Molecular Mechanism of traf6 like Gene in Innate Immunity of Procambarus clarkii
-
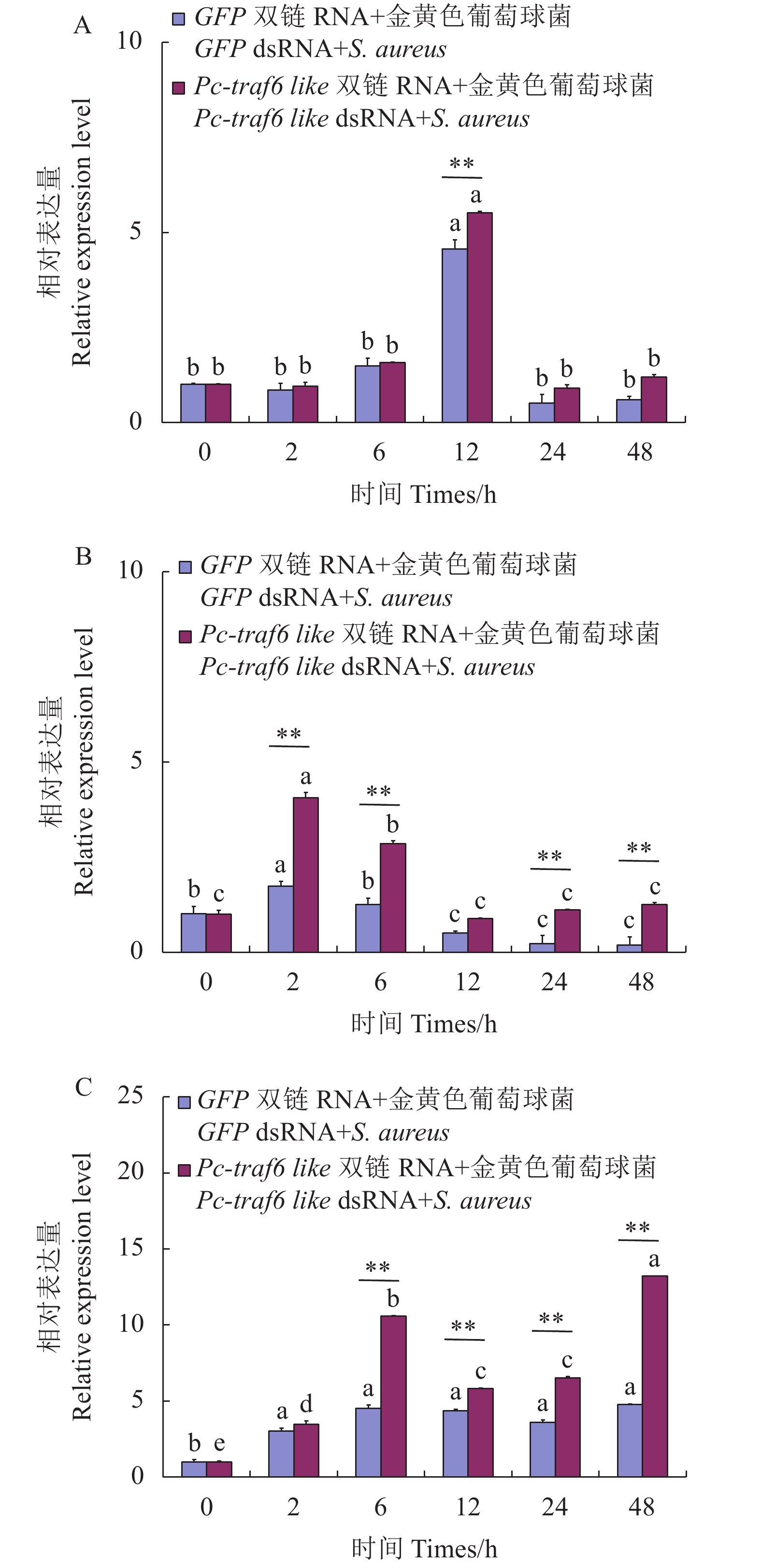
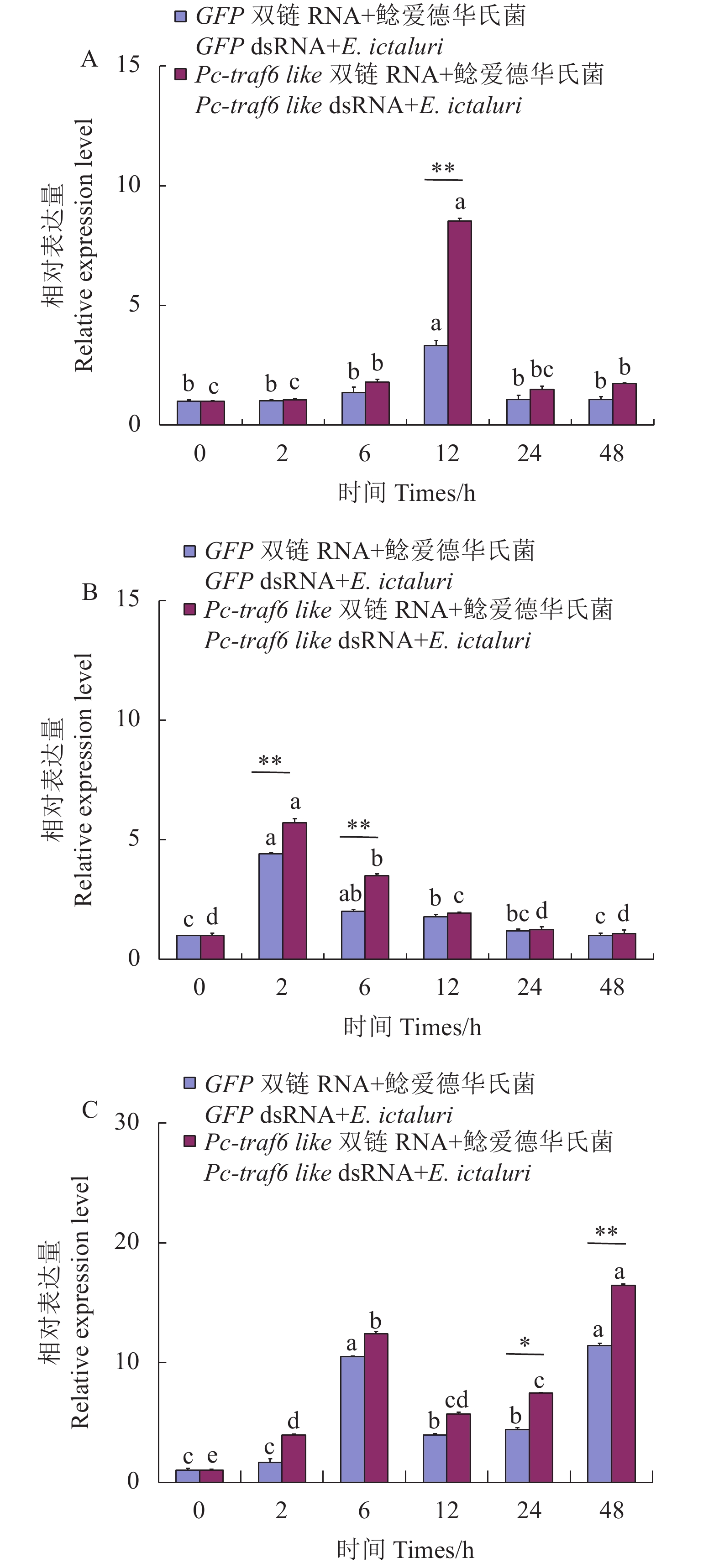
摘要:目的 深入研究克氏原螯虾(Procambarus clarkia)traf6 like基因参与先天免疫调节的功能。方法 以Pc-traf6 like基因为研究对象,利用RNAi技术干扰目的基因表达量之后,进行细菌模拟刺激,并且通过实时荧光定量PCR(qRT-PCR)检测细胞凋亡相关基因表达量的变化情况。结果 干扰Pc-traf6 like基因,通过干扰效果检测,显示48 h时干扰效果良好,可用于后续试验。在目的基因干扰后,进行金黄色葡萄球菌(Staphylococcus aureus)刺激,检测表明促凋亡基因Bax、抗凋亡基因Bcl 2、细胞凋亡关键基因Caspase 3不同程度上调表达;在目的基因干扰后,进行鲶爱德华氏菌(Edwardsiella ictaluri )刺激,检测表明促凋亡基因Bax、抗凋亡基因Bcl 2、细胞凋亡关键基因Caspase 3不同程度上调表达。结论 Pc-traf6 like基因被干扰,机体在受到金黄色葡萄球菌及鲶爱德华氏菌刺激后,Bax、Bcl 2和Caspase 3基因的相对表达量上调,推测Pc-traf6 like基因通过调控细胞凋亡参与了先天免疫反应。Abstract:Objective Role of traf6 like gene in innate immunity regulation of Procambarus clarkia(Pc-traf6 like) was investigated.Methods RNAi technology was employed to interfere the expression of Pc-traf6 like gene. Bacterial simulation was performed to determine the changes of apoptosis-related gene expression by real-time quantitative PCR (qRT-PCR).Result The interference on the gene was effective after 48 h for the subsequent experiments. The interference-induced pro-apoptotic gene Bax, anti-apoptotic gene Bcl 2, and apoptotic protease Caspase 3 were upregulated in varying degrees with the stimulation of Staphylococcus aureus or Edwardsiella ictaluri.Conclusion After the Pc-traf6 like gene was effectively interfered, the relative expressions of Bax, Bcl 2, and
Caspase 3 were upregulated after the P. clarkia was stimulated by either S. aureus or E. ictaluri indicating an involvement of Pc-traf6 like gene in the innate immune response by the regulating apoptosis. -
Keywords:
- Procambarus clarkii /
- RNA interference /
- apoptosis /
- innate immunity
-
0. 引言
【研究意义】小龙虾是一种淡水甲壳类无脊椎动物,学名克氏原螯虾(Procambarus clarkii),原产于墨西哥北部与美国南部。目前,它在我国已经成为了一种重要的经济水产养殖动物。养殖过程中,由于养殖密度的增加、病原菌引起的虾病频繁爆发,给小龙虾养殖业造成了严重损失。因此,研究小龙虾抗细菌先天免疫,对于虾病防治策略的制定具有重要意义。【前人研究进展】无脊椎动物为了保护机体免受外界病原侵染,进化出了一套先天免疫防御机制[1]。作为甲壳类模式动物,小龙虾主要依靠自身的先天免疫系统抵御病原微生物的入侵[2],该系统包括物理屏障、体液免疫与细胞免疫三部分[3]。对于体液免疫而言,主要的效应分子是抗菌肽,包括对虾素、溶菌酶、甲壳肽、抗脂多糖因子等,相关研究结果显示:此类分子对细菌、真菌具有广泛的抑菌活性,因而在分子生物学研究领域被广泛关注[4, 5]。近些年,在红螯虾(Pacifastacus leniusculus)、凡纳缤对虾(Litopenaeus vannamei)、中华绒螯虾(Eriocheir sinensis)、拟穴青蟹(Scylla paramamosain)的抗菌先天免疫相关研究中,相继发现了具有抗菌活性的甲壳肽分子[6-9]。在分子结构方面,抗菌肽分子的N末端极性氨基酸的残基促使其分子具有活化剂的活性性质[10]。在作用机理方面,抗菌肽分子能够与病原菌细胞壁表面的正负电荷进行结合,使其表面产生穿孔,内溶物释放,从而造成病原菌的死亡[11, 12],发挥抑菌活性。张财亮等利用LPS、Poly I:C刺激拟穴青蟹,并且通过对鳃组织中crustin基因进行抗细菌的研究[13]。【本研究的切入点】小龙虾在鲶爱德华氏菌刺激后组织甲壳肽基因表达模式有待深入研究。【拟解决的关键问题】本研究通过qRT-PCR技术分析小龙虾在鲶爱德华氏菌刺激后的血细胞、肝胰腺、鳃、肠组织基因相对表达量。通过对小龙虾crustin 6甲壳肽基因的研究以及初步解决后续基因重组表达、抗体制备、功能研究的技术问题,为深入无脊椎动物抗细菌先天免疫基础理论研究提供理论依据,同时也为水生生物养殖实践环节中免疫策略的制定提供技术支撑。
1. 材料与方法
1.1 材料及仪器
健康的小龙虾(15~20 g),购买自包头市友谊瑞福海鲜市场;PCR产物回收试剂盒、琼脂糖凝胶DNA回收试剂盒、T载体PCR产物克隆试剂盒,赛默飞世尔科技公司;动物总RNA提取试剂盒(TRIzol)、cDNA第一链合成试剂盒、荧光染料TB Green Premix,宝生物(大连)有限责任公司。
1.2 试验方法
1.2.1 总RNA提取
无菌条件下采集小龙虾的血细胞、肝胰腺、鳃、肠组织、肌肉50~100 mg置于玻璃匀浆器中,加入1 mL预冷的TRIzol试剂进行匀浆,使用动物总RNA提取试剂盒提取上述各组织的总RNA,利用NANO Drop2000仪进行浓度测定,利用1.0%琼脂糖凝胶电泳进行质量鉴定。
1.2.2 cDNA合成
提取的总RNA按照反转录试剂盒的使用说明进行cDNA合成,利用1%琼脂糖凝胶电泳进行质量验证并且−80 ℃保存备用。
1.2.3 基因序列的PCR扩增
根据前期转录组测序结果分析而获得的一段小龙虾甲壳肽基因的中心序列,设计目的基因序列扩增引物Pc-crustin-F(5′-GCT CCA GCG TAC ACG CAA-3′)与Pc-crustin-R(5′-ATG GCT CCC GGT GAT GGC-3′),以制备的小龙虾肝胰腺cDNA作为模板进行PCR反应,扩增目的基因序列片段。PCR反应条件:① 95 ℃,预变性3 min;② 95 ℃,变性30 s;③ 55 ℃,退火30 s;④ 72 ℃,延伸45 s(35个循环);⑤ 72 ℃,后延伸5 min。
1.2.4 重组载体的构建与序列测定
以制备的小龙虾肝胰腺cDNA为模板,以上述Pc-crustin-F、Pc-crustin-R为引物进行PCR扩增,利用琼脂糖凝胶DNA回收试剂盒分离、纯化目的基因扩增片段,根据T载体PCR产物克隆试剂盒的使用方法,将目的基因扩增片段与pUCm-T载体连接,构建重组载体并进行阳性重组子筛选,之后委托上海生工生物工程股份有限公司进行测序分析。
1.3 生物信息学分析
1.3.1 氨基酸序列比对
将测序获得的目的基因序列在NCBI在线网站的BLASTx模块中进行序列比对,选择相似度较高的crustin基因序列,利用DNAMAN软件进行氨基酸序列比对分析。
1.3.2 系统进化树分析
根据BLASTx序列比对结果,将物种亲缘关系较近、基因序列相似度较高的crustin基因核苷酸序列翻译为氨基酸序列,利用MEGA 7.0软件进行系统进化树分析。
1.4 多组织表达谱分析
在小龙虾第二腹节处注射鲶爱德华氏菌(2×107 CFU)进行刺激(鲶爱德华氏菌本实验室−80 ℃冰箱保存),对照组注射PBS,并在0、2、6、12、24、36、48 h解剖取样(血细胞、肝胰腺、鳃、肠),每个时间点平均取3只样,提总RNA,反转录成cDNA。然后利用实时荧光定量PCR技术检测小龙虾crustin基因mRNA的正常组织分布与鲶爱德华氏菌刺激后的基因表达模式。其中,目的基因特异性扩增引物为Pc-crustin-RT-F(5′-CAC TAT GGC TTC TAC GGTC-3′)与Pc-crustin-RT-R(5′-CTG GAG GCT GTG CAG GAA G-3′),18S RNA内参基因的扩增引物为18S RNA-RT-F(5′-TCT TCT TAG AGG GAT TAG CGG-3′)和18S RNA-RT-R(5′-AAG GGG ATT GAA CGG GTTA-3′)。PCR扩增程序如下:95 ℃,30 s循环1次;95 ℃,5 s,60 ℃,34 s循环40次。从刺激开始进行3次重复之后,采用2−ΔCT算法统计分析目的基因的正常组织分布,利用2−ΔΔCT算法统计分析鲶爱德华氏菌刺激后的基因表达模式。
2. 结果与分析
2.1 目的基因的PCR扩增结果
PCR扩增之后,通过琼脂糖凝胶电泳进行验证。结果显示:在DNA标准分子量250-500 bp之间有一条明亮的条带,与理论值465 bp相符合,表明PCR扩增结果正确(图1)。
2.2 序列分析结果
测序结果经过BLASTx比对,并且根据已有小龙虾crustin甲壳肽基因的同源序列数目,将其命名为Pc-crustin 6甲壳肽基因。序列分析结果显示:Pc-crustin 6
的cDNA序列全长为465 bp,开放阅读框(ORF)包括384 bp,编码127个氨基酸残基;其中,N末端25个氨基酸是信号肽序列,C末端的47个氨基酸形成了一个抗菌肽分子特有的WAP结构域,其中存在8个保守的Cys残基(图2)。 ![]() 图 2 Pc-crustin 6的cDNA序列以及编码的氨基酸序列注:下划线为信号肽序列,灰色底纹区域为WAP结构域,右侧数字分别代表核苷酸与氨基酸残基的数目。Figure 2. cDNA and encoded amino acids sequences of Pc-crustin 6Note: Signal peptide sequence is underlined; grey area represents WAP domain; numbers on the right represent nucleotide and corresponding amino acids sequences.
图 2 Pc-crustin 6的cDNA序列以及编码的氨基酸序列注:下划线为信号肽序列,灰色底纹区域为WAP结构域,右侧数字分别代表核苷酸与氨基酸残基的数目。Figure 2. cDNA and encoded amino acids sequences of Pc-crustin 6Note: Signal peptide sequence is underlined; grey area represents WAP domain; numbers on the right represent nucleotide and corresponding amino acids sequences.2.3 氨基酸序列比对结果
利用DNAMAN软件进行氨基酸序列比对,结果显示:小龙虾Pc-Crustin 6甲壳肽分子与巴西美对虾Fb-Crustin分子的同源性为28.49%,与圣保罗对虾Fp-Crustin分子的同源性为28.33%,与南美蓝对虾Ls-Crustin分子的同源性为28.81%,与日本对虾Pj-Crustin 3分子的同源性为26.53%,与小褐美对虾Fs-Crustin分子具有最高同源性,为29.19%(图3)。
2.4 系统进化树分析
利用MEGA 7.0软件进行系统进化树分析,结果显示:小龙虾Pc-Crustin 6分子与小褐美对虾Fs-Crustin分子、南美蓝对虾Ls-Crustin分子、巴西美对虾Fb-Crustin分子、圣保罗对虾Fp-Crustin分子、斑节对虾Pm-Crustin 1分子分布在进化树的同一分支(图4),表明它们之间的亲缘关系较近。
2.5 分子结构预测的结果
利用EXPASY软件预测目的蛋白质分子的初级结构,结果显示:该分子中包括一个完整的WAP结构域,是一个典型的Crustin甲壳肽分子。
2.6 目的基因的组织分布分析
利用qRT-PCR技术检测Pc-crustin 6在小龙虾5个组织中的表达水平,并且以18S RNA作为内参基因。图5结果显示:Pc-crustin 6在血细胞、肝胰腺、鳃、肠和肌肉中均有表达,并且,在鳃组织中的表达量最高,其次是血细胞与肠组织,其他组织中的表达量较低。
2.7 细菌刺激后Pc-crustin 6的表达模式
利用qRT-PCR技术检测Pc-crustin 6在鲶爱德华氏菌刺激后的表达模式,以18S RNA作为内参基因。结果显示:图6中A、B、C、D分别代表血细胞、肝胰腺、鳃和肠组织中Pc-crustin 6在鲶爱德华氏菌刺激后的表达模式,可以看出:细菌刺激后,Pc-crustin 6
在上述4个组织中的表达量均呈现出了明显的上调趋势,说明其与对抗细菌刺激有关。 ![]() 图 6 鲶爱德华氏菌刺激后Pc-crustin 6的表达模式注:①鲶爱德华氏菌刺激后Pc-crustin 6在四种组织中的相对表达模式,A血细胞的相对表达模式,B肝胰腺的相对表达模式,C鳃组织的相对表达模式,D肠组织的相对表达模式.②*表示显著差异(P<0.05),**表示极显著差异(P<0.01)。Figure 6. Pc-crustin 6 expressions after E. ictaluri stimulationNote: ①Relative expressions of Pc-Crustin 6 in tissues of P. clarkia after Edwardsiella cataphylosis; A: blood cells; B: hepatopancreas; C: gills; D: intestines.②* represents significant difference (P<0.05), ** represents extremely significant difference (P<0.01).
图 6 鲶爱德华氏菌刺激后Pc-crustin 6的表达模式注:①鲶爱德华氏菌刺激后Pc-crustin 6在四种组织中的相对表达模式,A血细胞的相对表达模式,B肝胰腺的相对表达模式,C鳃组织的相对表达模式,D肠组织的相对表达模式.②*表示显著差异(P<0.05),**表示极显著差异(P<0.01)。Figure 6. Pc-crustin 6 expressions after E. ictaluri stimulationNote: ①Relative expressions of Pc-Crustin 6 in tissues of P. clarkia after Edwardsiella cataphylosis; A: blood cells; B: hepatopancreas; C: gills; D: intestines.②* represents significant difference (P<0.05), ** represents extremely significant difference (P<0.01).3. 讨论
近几年的相关研究结果表明抗菌肽是甲壳类动物先天免疫系统中的重要效应分子。例如,贾文明对获得的Crustin 1-4甲壳肽分子的序列进行分析,发现其N端均具有一个信号肽序列[14],这是此类分子的典型特征之一。王一丽对日本沼虾中的Crustin 1-13甲壳肽分子进行序列分析,发现这13个甲壳肽分子也具有典型的Crustins家族的分子结构特征[15],在分子C末端存在至少8个保守的Cys残基。孙晨[16]对中国明对虾的Crustin 2与Crustin 3分子的研究发现WAP结构域是甲壳肽分子的功能结构域。王慧[17]从拟穴青蟹中克隆得到的Crustin 2分子的N端含有信号肽序列,C端具有Cys残基富集区形成的结构域,并且是典型的Ⅱ型甲壳肽分子。因此,N末端的信号肽序列与C末端的WAP结构域是Crustin家族分子的基本结构特征。
本研究克隆得到了克氏原螯虾一个新的crustin基因,根据目前其同源基因的发现顺序,将其命名为Pc-crustin 6基因。生物信息学分析结果显示Pc-Crustin 6分子具有甲壳肽家族分子的典型特征,包括N端的信号肽序列,C端的WAP结构域,并且与Smith等[18]关于Crustin分子结构特征的描述相一致。现有结果显示,crustin基因会在无脊椎动物的鳃组织中高表达,例如,孙保贞[19]通过实时荧光定量PCR发现日本对虾crustin-like基因在鳃组织中高表达;王慧[17]在拟穴青蟹中发现crustin 2
主要在鳃组织中表达。同样,本研究中的Pc-crustin 6基因在鳃组织中表达量最高,与以上结论一致,推测其可能与鳃组织的抗细菌作用相关。此外,SUN等[20]利用白斑病毒与弧菌分别刺激日本囊对虾,在血细胞中检测到crustin-like基因的上调表达,揭示了其在对虾先天免疫中的潜在免疫作用。同时,李朝政利用LPS和副溶血性弧菌以及白斑病毒分别对凡纳滨对虾进行刺激之后,发现crustin基因在血细胞中的相对表达量显著上调,说明Lv-Crustin在凡纳滨对虾的先天免疫中发挥着重要作用,可能作为一种抗菌效应分子在体内发挥作用[21]。本研究利用鲶爱德华氏菌刺激小龙虾之后,Pc-crustin 6的表达量在2 h呈现急剧上升趋势,表明鲶爱德华氏菌刺激后,crustin 6 表达发生改变,推测其在虾抗鲶爱德华氏菌过程中发挥了作用。在小龙虾鳃组织中,Pc-crustin 6的表达量在2 h后出现持续降低趋势,因为鳃组织是虾类重要的呼吸器官,起着过滤水体的作用,而本试验采用小龙虾第二腹节注射细菌的方式模拟细菌感染时的情况,并非在水体中掺入细菌,因此鳃组织受到的细菌刺激就相对弱一些,激发起的免疫反应随之较弱。根据细菌刺激后表达模式的分析结果可以得出:细菌刺激早期,血细胞、肝胰腺、鳃、肠组织中Pc-crustin 6表达上调;细菌刺激后期,鳃组织除外,其他组织中Pc-crustin 6又被高表达对细菌入侵作出应答。 4. 结论
在前期转录组测序的基础上,通过对目的基因的克隆与功能分析,发现了一个小龙虾新的crustin基因,命名为Pc-crustin 6,利用实时荧光定量PCR检测Pc-crustin 6在不同组织中的mRNA表达量,以及细菌刺激后的血细胞、肝胰腺、鳃和肠组织中的表达情况。为后续基因重组表达、抗体制备、功能研究提供一定的理论依据,对抗菌肽家族分子的进一步完善做出重要补充。近些年,针对小龙虾等甲壳类动物的抗细菌先天免疫的相关研究结果较为丰富,先天免疫的基础理论得到逐步完善;其中,甲壳肽作为重要的免疫效应分子在小龙虾中发挥着一系列抗菌作用,针对Pc-crustin 6基因的深入研究对无脊椎动物抗细菌先天免疫基础理论的进一步完善以及水生生物养殖实践环节免疫策略的制定都有重要意义。
-
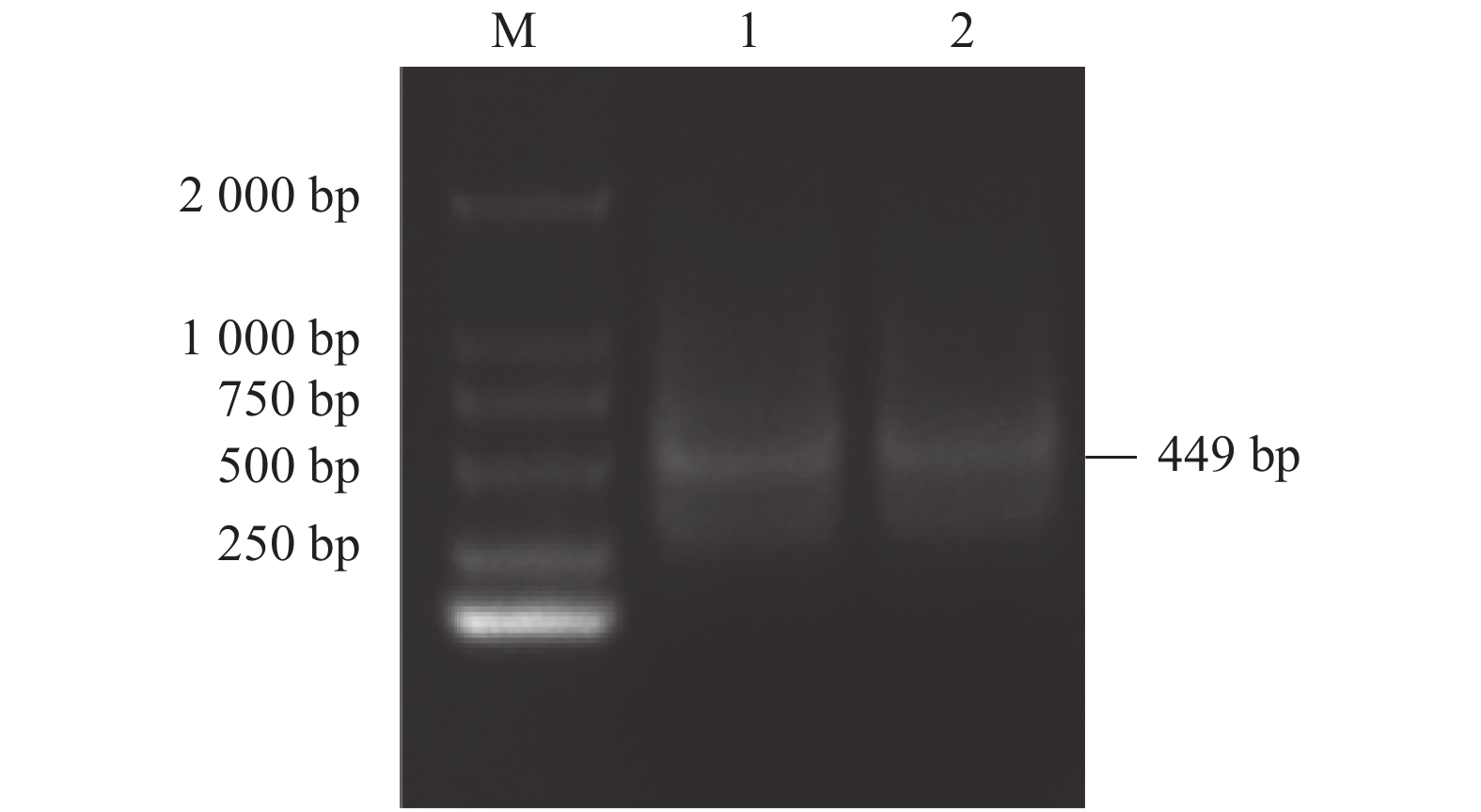
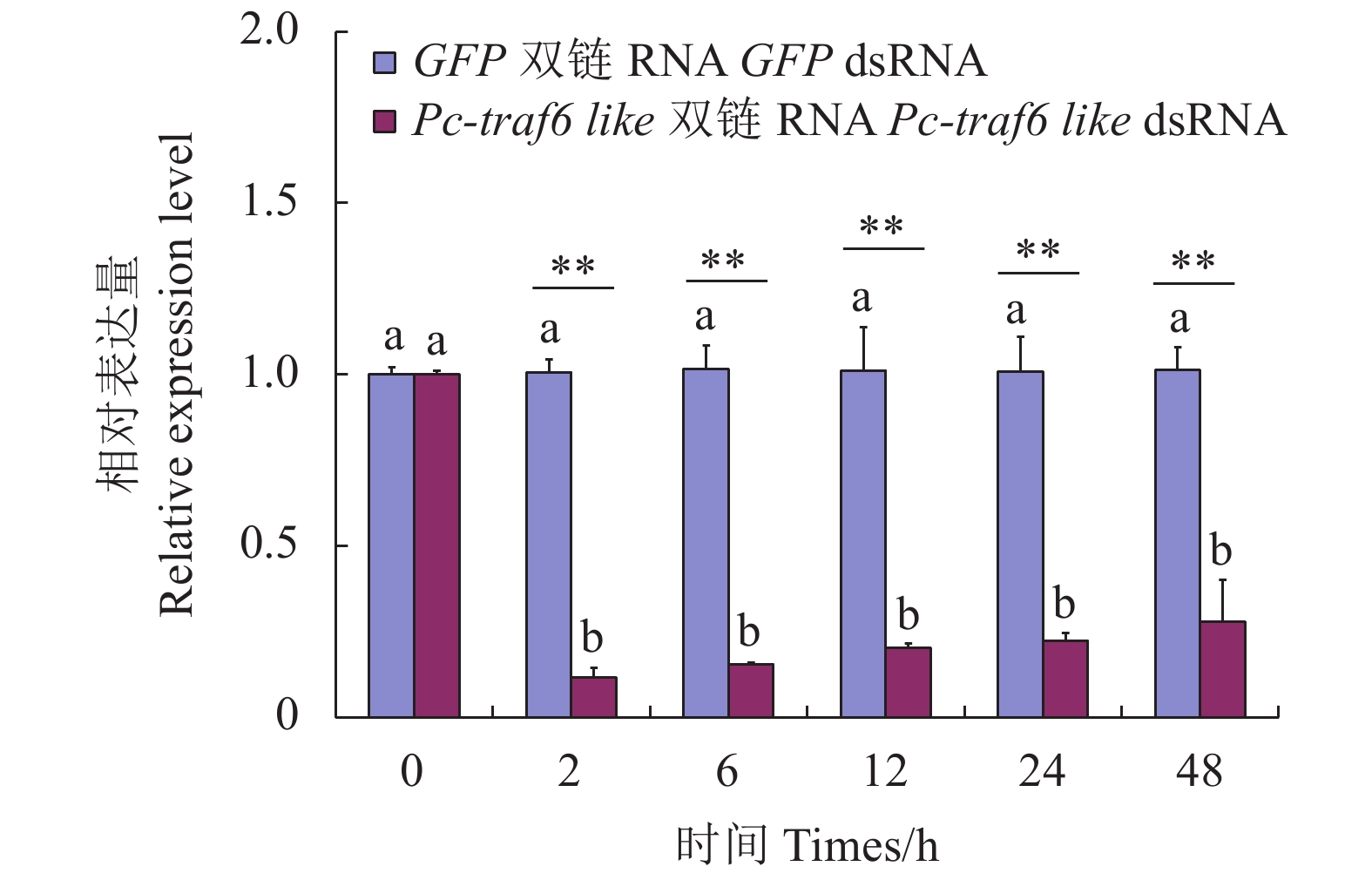
图 2 Pc-traf6 like基因双链RNA干扰效果检测
18S RNA作为内参对照。不同字母表示不同时间点同一处理组差异显著(P<0.05);*、**表示同一时间点不同处理组之间差异显著(P<0.05)或极显著(P<0.01)。图3、4同。
Figure 2. Detection of interference on double-stranded RNA of Pc-traf6 like gene
18S RNA was used as inner control; data with different letters indicate significant difference in same group at times (P<0.05); * or ** indicates significant difference between treatment groups at 0.05 or 0.01 level. Same for Figs. 3 and 4.
-
[1] WU Z Q, JIANG C, LING F, et al. Effects of dietary supplementation of intestinal autochthonous bacteria on the innate immunity and disease resistance of grass carp (Ctenopharyngodon idellus) [J]. Aquaculture, 2015, 438: 105−114. DOI: 10.1016/j.aquaculture.2014.12.041
[2] 刘文杰, 章跃陵. 无脊椎动物先天免疫分子研究概述 [J]. 生物学教学, 2017, 42(7):71−73. DOI: 10.3969/j.issn.1004-7549.2017.07.041 LIU W J, ZHANG Y L. Overview of molecular research on innate immunity of invertebrates [J]. Biology Teaching, 2017, 42(7): 71−73.(in Chinese) DOI: 10.3969/j.issn.1004-7549.2017.07.041
[3] CERENIUS L, JIRAVANICHPAISAL P, LIU H P, et al. Crustacean immunity [J]. Advances in Experimental Medicine and Biology, 2010, 708: 239−259.
[4] LI B, YANG B B, SHEN X L, et al. Molecular characterization and expression analysis of tumor necrosis factor receptor-associated factor 6 (traf6) like gene involved in antibacterial innate immune of fresh water crayfish, Procambarus clarkii [J]. Fish & Shellfish Immunology, 2020, 104: 517−526.
[5] WANG P H, GU Z H, WAN D H, et al. The shrimp NF-κB pathway is activated by white spot syndrome virus (WSSV) 449 to facilitate the expression of WSSV069 (ie1), WSSV303 and WSSV371 [J]. PLoS One, 2011, 6(9): e24773. DOI: 10.1371/journal.pone.0024773
[6] LIN Y, MAO F, ZHANG X Y, et al. TRAF6 suppresses the apoptosis of hemocytes by activating pellino in Crassostrea hongkongensis [J]. Developmental & Comparative Immunology, 2020, 103: 103501.
[7] KACZANOWSKI S. Apoptosis: Its origin, history, maintenance and the medical implications for cancer and aging [J]. Physical Biology, 2016, 13(3): 031001. DOI: 10.1088/1478-3975/13/3/031001
[8] KERR J F, WYLLIE A H, CURRIE A R. Apoptosis: A basic biological phenomenon with wide-ranging implications in tissue kinetics [J]. British Journal of Cancer, 1972, 26(4): 239−257. DOI: 10.1038/bjc.1972.33
[9] MARCHETTI P, CASTEDO M, SUSIN S A, et al. Mitochondrial permeability transition is a central coordinating event of apoptosis [J]. The Journal of Experimental Medicine, 1996, 184(3): 1155−1160. DOI: 10.1084/jem.184.3.1155
[10] 和四梅, 张丽莉, 王艺磊, 等. Caspase细胞凋亡通路及其在水生无脊椎动物的研究进展 [J]. 生物技术通报, 2013(9):54−61. HE S M, ZHANG L L, WANG Y L, et al. Caspase-apoptosis signal transduction pathway and its research advance in aquatic invertebrates [J]. Biotechnology Bulletin, 2013(9): 54−61.(in Chinese)
[11] WERNER A B, DE VRIES E, TAIT S W G, et al. Bcl-2 family member Bfl-1/A1 sequesters truncated bid to inhibit is collaboration with pro-apoptotic Bak or Bax [J]. The Journal of Biological Chemistry, 2002, 277(25): 22781−22788. DOI: 10.1074/jbc.M201469200
[12] HSU H, XIONG J, GOEDDEL D V. The TNF receptor 1-associated protein TRADD signals cell death and NF-κB activation [J]. Cell, 1995, 81(4): 495−504. DOI: 10.1016/0092-8674(95)90070-5
[13] MEDZHITOV R, PRESTON-HURLBURT P, KOPP E, et al. MyD88 is an adaptor protein in the hToll/IL-1 receptor family signaling pathways [J]. Molecular Cell, 1998, 2(2): 253−258. DOI: 10.1016/S1097-2765(00)80136-7
[14] WESCHE H, HENZEL W J, SHILLINGLAW W, et al. MyD88: An adapter that recruits IRAK to the IL-1 receptor complex [J]. Immunity, 1997, 7(6): 837−847. DOI: 10.1016/S1074-7613(00)80402-1
[15] QIU L M, SONG L S, YU Y D, et al. Identification and expression of TRAF6 (TNF receptor-associated factor 6) gene in Zhikong Scallop Chlamys farreri [J]. Fish & Shellfish Immunology, 2009, 26(3): 359−367.
[16] MAO F, LI J, ZHANG Y H, et al. Molecular cloning and functional analysis of tumor necrosis factor receptor-associated factor 6 (TRAF6) in Crossastrea gigas [J]. Fish & Shellfish Immunology, 2017, 68: 37−45.
[17] AYLLÓN N, VILLAR M, GALINDO R C, et al. Systems biology of tissue-specific response to Anaplasma phagocytophilum reveals differentiated apoptosis in the tick vector Ixodes scapularis [J]. PLoS Genetics, 2015, 11(3): e1005120. DOI: 10.1371/journal.pgen.1005120
[18] JIN P, HU J, QIAN J J, et al. Identification and characterization of a putative lipopolysaccharide-induced TNF-α factor (LITAF) gene from Amphioxus (Branchiostoma belcheri): An insight into the innate immunity of Amphioxus and the evolution of LITAF [J]. Fish & Shellfish Immunology, 2012, 32(6): 1223−1228.
[19] WIENS G D, GLENNEY G W. Origin and evolution of TNF and TNF receptor superfamilies [J]. Developmental & Comparative Immunology, 2011, 35(12): 1324−1335.
[20] CHANG S C, DING J L. Ubiquitination by SAG regulates macrophage survival/death and immune response during infection [J]. Cell Death and Differentiation, 2014, 21(9): 1388−1398. DOI: 10.1038/cdd.2014.54
[21] 曾高淳, 吴苗, 曾令基, 等. 青蒿琥酯调节BCL-2家族蛋白平衡诱发肌成纤维细胞凋亡 [J]. 实用医学杂志, 2021, 37(18):2332−2338. DOI: 10.3969/j.issn.1006-5725.2021.18.006 ZENG G C, WU M, ZENG L J, et al. Myofibroblasts apoptosis induced by artesunate via regulating balance of BCL-2 family [J]. The Journal of Practical Medicine, 2021, 37(18): 2332−2338.(in Chinese) DOI: 10.3969/j.issn.1006-5725.2021.18.006
-
期刊类型引用(1)
1. 张明达,李倩倩,张文硕,秦仕宇,沈秀丽,杜志强. 细菌刺激下克氏原螯虾prx4基因的免疫响应和抗氧化功能研究. 福建农业学报. 2023(10): 1185-1194 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载: