Bioinformatics and Expression of CaTPS9 in Chili Peppers
-
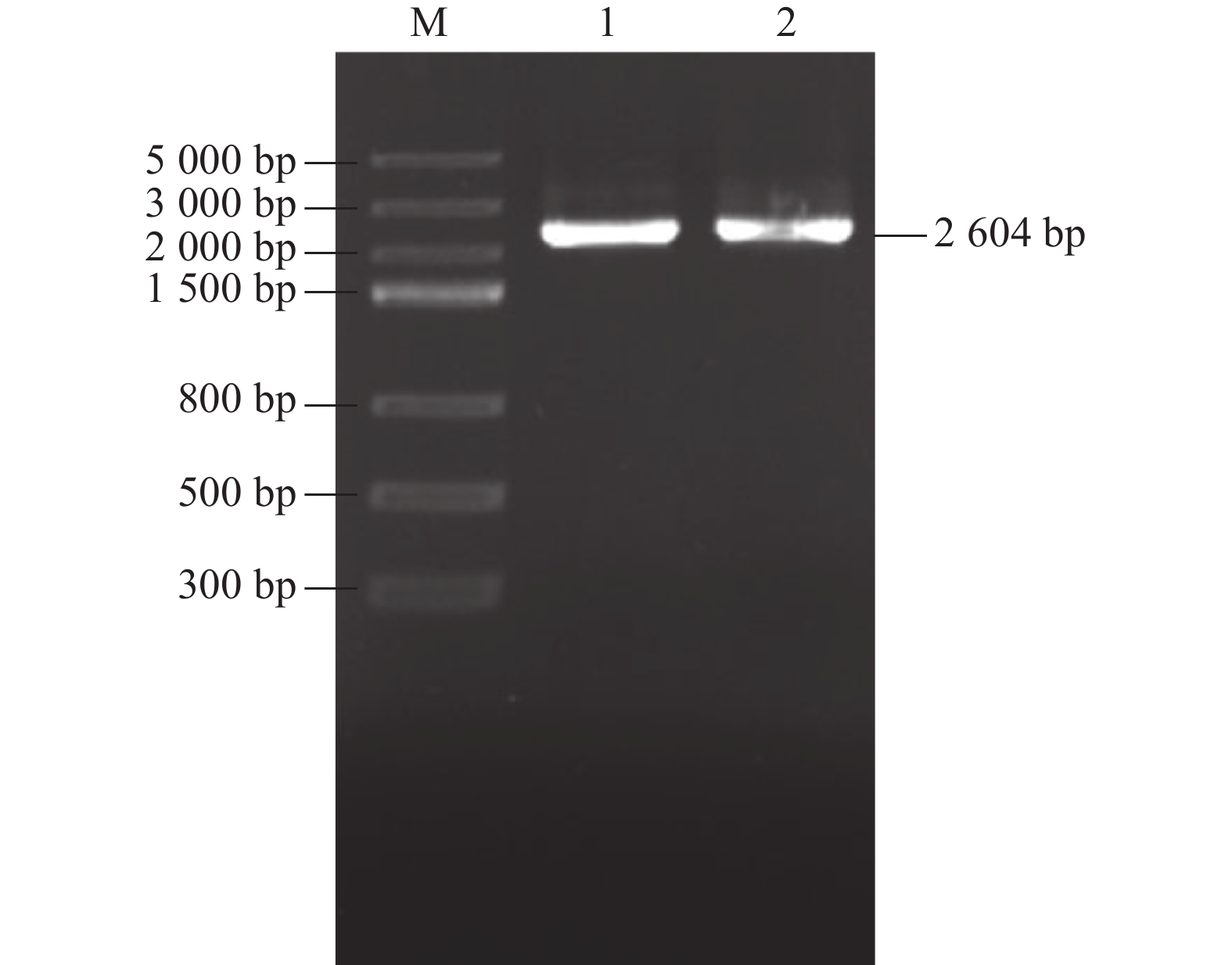
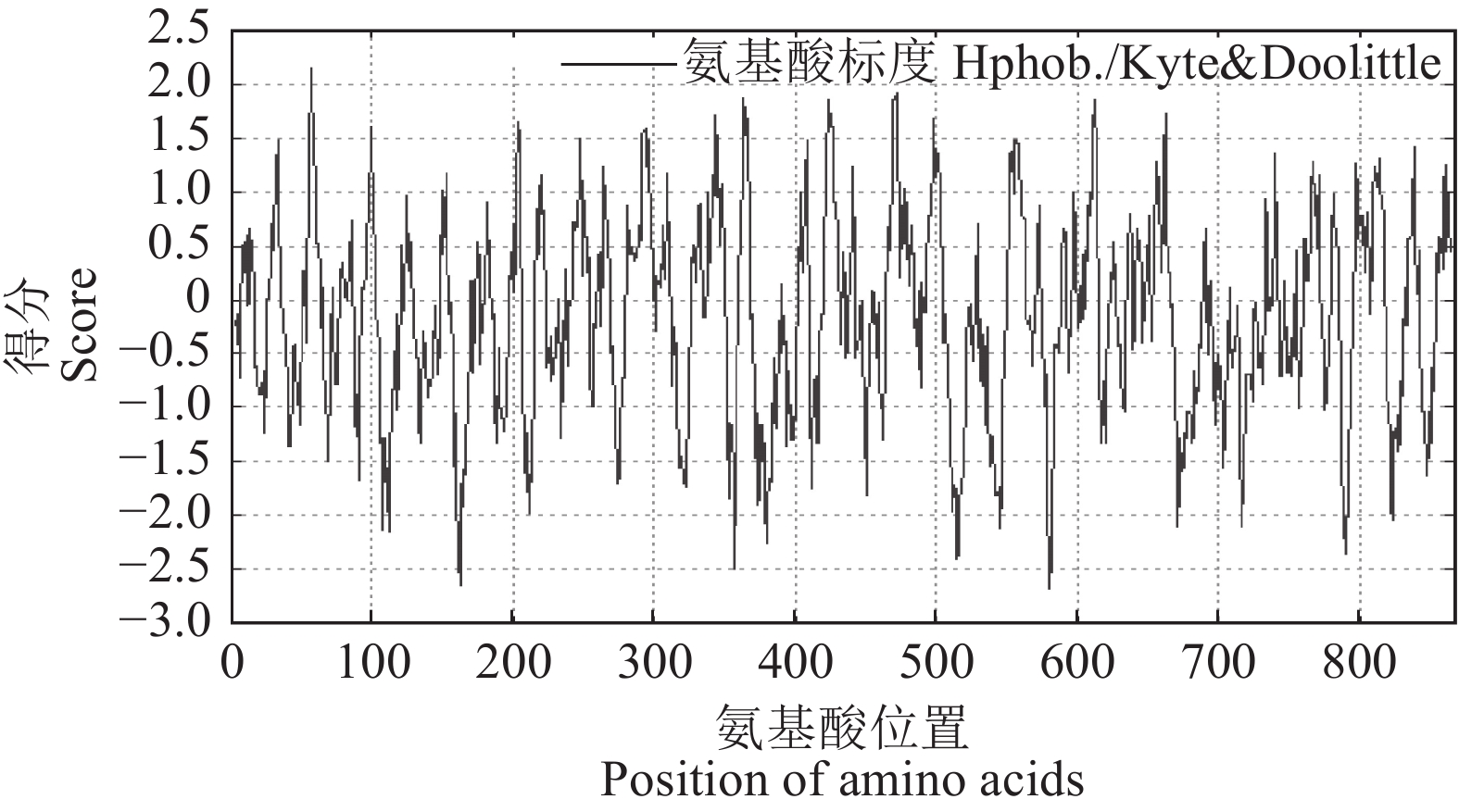
摘要:目的 明确辣椒中海藻糖-6-磷酸合酶(TPS)基因CaTPS9的表达特性和生物学功能,进一步了解TPS对辣椒生长中调控非生物胁迫的作用。方法 以辣椒品种强丰101为试验材料,克隆CaTPS9基因,并对辣椒CaTPS9的理化性质、蛋白结构、顺式作用元件、系统进化树等进行分析;通过qRT-PCR分析CaTPS9基因在不同组织(商品果果肉、幼果果肉、成熟果果肉、商品果胎座、幼果胎座、成熟果胎座、叶、根、茎、花)和胁迫处理(低温和植物生长调节剂处理)中的表达模式。结果 CaTPS9基因CDS序列全长2604 bp,编码867个氨基酸。CaTPS9蛋白包含Glyco_transf_20和Trehalose_PPase两个保守结构域,分子质量为97.60 kDa,不稳定指数为44.27,理论等电点为5.63,亚细胞定位预测CaTPS9蛋白位于细胞质中。生物信息学分析表明,CaTPS9蛋白属于亲水性蛋白,且不存在跨膜结构和信号肽序列,蛋白结构主要由α-螺旋和无规则卷曲组成。系统进化关系分析表明,CaTPS9与烟草(Nicotiana tabacum L.)、番茄(Solanum lycopersicum L.)和马铃薯(Solanum tuberosum L.)中的同源基因亲缘关系较近。启动子顺式作用元件分析表明,CaTPS9启动子区域含有与激素、胁迫及植物生长发育相关的顺式作用元件。此外,CaTPS9在叶片中表达量最高,在商品果胎座中表达量最低。在水杨酸(Salicylic acid,SA) 处理12 h后CaTPS9基因的表达量被显著提升,而低温、吲哚乙酸(3-indoleacetic acid,IAA)、脱落酸(Abscisic acid,ABA)、赤霉素(Gibberellin acid,GA3)和茉莉酸甲酯(Methyl jasmonate,MeJA)处理能够显著抑制CaTPS9基因表达量。结论 CaTPS9基因可能通过海藻糖生物合成途径响应逆境胁迫。
-
关键词:
- 辣椒 /
- 海藻糖-6-磷酸合酶 /
- 生物信息学 /
- 非生物胁迫 /
- 表达分析
Abstract:Objective Bioinformatics and expression of trehalose-6-phosphate synthase (TPS) gene in chili peppers,CaTPS9, were studied to understand its role in response to abiotic stress during the plant growth.Method CaTPS9 was cloned from Qiangfeng 101 to analyze the physicochemical properties, protein structure, cis-regulatory element, and phylogenetic tree. Expressions of the gene in the pericarp and placenta of a commercial pepper as well as the young pericarp, ripened pericarp, young placenta, ripened placenta, leaves, roots, stems, and flowers of chili pepper plants under varied stresses including low temperature, 3-indoleacetic acid(IAA), abscisic acid(ABA), salicylic acid(SA), gibberellin A3(GA3), and methyl jasmonate(MeJA) were determined using qRT PCR.Result The full-length cDNA sequence of CaTPS9 was 2604 bp encoded 867 amino acids. Located in the cytoplasm, the protein contained two conserved domains, Glyco_transf_20 and Trehalose_PPase, with a molecular weight of 97.60 kDa, an instability index of 44.27, and a theoretical isoelectric point of 5.63. It was a hydrophilic protein free of transmembrane structure and signal peptide sequence with a structure consisting mainly of alpha helixes and random coils. Phylogenetically, CaTPS9 was close to the homologous genes in Nicotiana tabacum, Solanum lycopersicum and Solanum tuberosum. It had hormones response, stress response, and plant growth and development cis−elements and was expressed most highly in the leaves, lowly in the placentas of a commercially available pepper, and significantly by 12 h SA induction. Stress, such as low temperature, IAA, ABA, GA3, and MeJA, significantly inhibited the expression.Conclusion It appeared that CaTPS9 might regulate the response of chili pepper plants to various abiotic stresses through the trehalose biosynthetic pathway.-
Keywords:
- Chili pepper /
- TPS /
- bioinformatics /
- abiotic stress /
- expression analysis
-
0. 引言
【研究意义】罗汉果Siraitia grosvenorii(swingle) C.Jeffrey是我国特有的经济、药用植物,也是广西桂北地区的传统特产,为药食两用植物。成熟罗汉果果实中富含罗汉果甜苷,平均甜度是蔗糖的250~340倍,且甜味纯正,是迄今发现最接近蔗糖风味的天然甜味剂[1]。罗汉果甜苷低能量、低热值,不直接参与体内糖代谢过程,能使体内血糖水平保持稳定,同时罗汉果中的主要药效成分罗汉果甜苷, 可以止咳、化痰、泻下、保肝, 而最近还发现它们具有防癌、降脂的功效[2-3]。近年来罗汉果甜苷作为一种高甜度、低卡路里的功能性天然甜味剂已广泛应用于食品、饮料及保健食品等行业。因此,罗汉果产业具有较好的发展前景。但是,由于传统种植的压蔓薯苗,品种混杂,在自然状态下易感染花叶病毒,导致病毒积累和种质严重退化[4],产量很低,严重制约了罗汉果扩大生产。近年罗汉果组织培养脱毒苗的应用,能使产量大幅度提高,罗汉果规模化、专业化生产成为可能,但其对环境条件和栽培技术要求远比压蔓薯苗严格,种植后易发生病害、死苗率高、上棚慢、结果迟、结果率低等问题十分普遍,成为组培苗种植发展的又一大障碍。因此,对其栽培条件和栽培技术进行深入研究是确保丰产稳产的关键。【前人研究进展】罗汉果对生态环境有独特的要求,早期罗汉果的多种植在海拔500 m以上的山区,随着罗汉果栽培技术发展将原产于山区林地的罗汉果引种到山下种植[5]。根据罗汉果生长的气象条件,科技人员努力进行罗汉果引种、组培苗培育及其相关栽培技术研究并取得进展,当前罗汉果生产已成为新的产业[6-7]。蒋水元等[8]利用正交试验等方法,研究了罗汉果组培苗不同生育期的植株氮、磷、钾三元素营养动态变化;潘丽梅等[9]研究了基质种类、瓶苗质量、温湿度及施肥浓度对组培苗移栽成活率和生长的影响。关于罗汉果栽培技术近年来有学者研究在栽培中使用特定肥料如硅肥,枯草芽孢杆菌肥对罗汉果的影响[10-11],马静等[12]也研究了微量元素对罗汉果生长发育的影响。【本研究切入点】目前对罗汉果组培苗生育周期、生长发育习性以及生态适应性的观察试验以及不同栽培方式对罗汉果枝蔓生长的研究也已有一些报道[13-15],但对于组培苗不同种植时间、不同栽培管理方式以及不同授粉时间对结果和果实生长的影响的相关研究鲜见报道。【拟解决的关键问题】本研究通过设置罗汉果组培苗在不同种植时间、不同移栽方式以及不同授粉时间等处理,研究罗汉果组培苗结果和果实生长,探明罗汉果组培苗高产栽培关键技术,为罗汉果组培苗推广发展提供参考。
1. 材料与方法
1.1 试验地等概况
试验于2016年在桂林市龙胜县泗水乡罗江山区林地的梯田进行。罗汉果组培苗种植株行距1.6 m×2.5 m,种植前每667 m2用生石灰100 kg均匀撒施后翻入土中,并挖定植穴,长50 cm、宽50 cm、深30 cm。每穴加入腐熟有机肥7~10 kg,磷肥250 g,复合肥100~150 g以及50%多菌灵可湿性粉剂2~3 g与土壤拌匀,然后再盖上5 cm厚的土壤, 避免幼根直接与肥土接触,防止烧根烧苗。移栽定植时将苗木放入定植穴,覆土压实,浇足定根水,其他栽培措施与常规管理一致。
1.2 试验材料
供试罗汉果组培苗品种佰林三号为优良青皮果薯块单株茎尖离体培养诱导筛选培育的罗汉果优良品种,种苗不带病毒, 具有抗病性、抗逆性强, 适应性广, 品质优良, 高产、稳产, 当年种植当年丰产等优良特性。罗汉果雌雄异株,雄株应选择开花早、花粉多、亲和力强、花期长的品种,雌雄株配置比例为100:2。
1.3 试验方法
1.3.1 不同种植时间对罗汉果组培苗生长和产量的影响
设置种植时间在3月中旬至6月下旬间,每隔20 d左右种植1次,共设置5个种植时间处理,即分别为3月中旬、4月上旬、4月下旬、5月中旬、6月上旬种植,每个处理3个重复,每重复种植15株。试验种植前先将罗汉果组培苗小苗由小营养钵转到大钵继续在温室大棚中培育1个月后再移栽大田定植,其后观察各处理植株上棚时间、开花时间以及果实成熟时间,并调查记录幼苗死苗率、平均株产以及裂果树。
1.3.2 不同移栽方式对罗汉果组培苗生长和产量的影响
试验设置4个处理,即T1:在3月中旬将小苗由小营养钵转到大钵继续在温室大棚中培育(控温25~30℃)至4月中旬气温相对较高时再移栽大田定植,期间每3 d淋施1次沤制的麸肥或1%硫酸钾复合肥液肥;T2:3月中旬小苗直接移栽大田定植后,用小拱膜覆盖,期间应根据天气变化适时开、盖膜;T3:3月中旬小苗直接移栽大田定植后,用黑膜覆盖厢面;T4:不经培育的小苗直接在4月中旬定植大田。各处理均设3个重复,每重复种植15株,随机排列。测量记录上棚前日均生长量、上棚时间、显蕾期、初花期以及盛花期,果实成熟后,记录株产以及果径大小。
1.3.3 不同授粉时间对罗汉果组培苗结果和果实生长的影响
在植株盛花期的前期进行,雄花开花后于早晨6:00~7:00采下,用保鲜膜包装置于5~8℃冰箱中保存,雌花开花后于当日8:00~18:00,每隔2 h进行授粉。每个处理3个重复,每重复授粉30朵,授粉后挂好相应标签牌,然后调查坐果率、成果率、测量果径。
1.3.4 雄花不同存贮方式及贮存时间授粉对坐果、成果和果径的影响
在植株盛花期的前期进行,雄花开花后于早晨6:00~7:00采下用保鲜膜包装好,贮存方式及贮存时间不同设置以下8个处理:B1(5~8℃冰箱中保存1 d后授粉)、B2(5~8℃冰箱中保存2 d后授粉)、B3(5~8℃冰箱中保存3 d后授粉)、B4(5~8℃冰箱中保存4 d后授粉);Y1(阴凉天气室内保存1 d后授粉)、Y2(阴凉天气室内保存2 d后授粉);G1(高温干燥天气室内保存1 d后授粉)、G2(高温干燥天气室内保存保存2 d后授粉)。每个处理3个重复,每重复授粉30朵,授粉后挂好相应标签牌,然后调查坐果率、成果率、测量果径等。
1.4 观测指标及方法
平均株产和裂果率:在收获期调查每处理小区内所有罗汉果个数、罗汉果株数得出以及罗汉果裂果数;果径:用游标卡尺测量,精确到0.01 cm;坐果率:在授粉后15 d调查授粉花的结果数量;成果率:在果实成熟期调查。
1.5 数据分析
采用Excel 2010对数据进行处理、分析;用SPSS 18.0进行方差分析。
2. 结果与分析
2.1 不同种植时间对罗汉果组培苗生长和产量的影响
由表 1可以看出,3月中旬种植植株幼苗死苗率最高,达11.63%,而5月中旬种植幼苗死苗率最低,仅2.12%,两者间差异显著。裂果率由大到小排列为:6月上旬>5月中旬>4月下旬>4月上旬>3月中旬,随着种植时间的延迟,罗汉果裂果率依次增加;其中6月上旬尤为严重,裂果率高达26.36%,与其他4个处理间存在显著差异,是其他处理的4.82~14.10倍。5月中旬、4月下旬、4月上旬种植的罗汉果平均株产相差不大,方差分析结果表明四者间差异不显著。5个处理中,4月下旬种植平均株产最高,而6月上旬种植的最低,二者间差异显著。
表 1 不同种植时间对植株生长和产量的影响Table 1. Effect of planting period on plant growth and yield种植时间
Planting time上棚时间
Sheding time
/(mm-dd)开花时间
Flowering time
/(mm-dd)果实成熟时间
Fruit ripening
time平均株产个数
Average number
of plants幼苗死苗率
Seedling mortality
/%裂果率
Dehiscent rate
/%3月中旬 In the middle of march 06-13 07-16 10月上旬 59±9.42b 11.63±2.27a 1.87±0.31b 4月上旬Early april 06-22 08-03 10月中旬 68±4.32ab 5.32±0.47b 2.02±0.15b 4月下旬In late april 06-28 08-10 10月下旬 73±5.89a 4.65±0.36bc 2.61±0.06b 5月中旬In middle may 07-14 08-15 10月下旬 66±8.64ab 2.12±0.23d 5.47±0.42b 6月上旬 In early june 07-23 08-21 11月下旬 57±4.97b 2.84±0.24cd 26.36±4.09a 注:同列数据后不同小写字母表示在0.05水平下差异显著。表 2~4同。
Note:Different lowercase letters in a same column represent significant difference at 5% level. The same as table 2-4.由此,结合各处理的上棚时间、开花和果实成熟时间说明提早种植能使植株提早上棚、开花和结果,随着种植时间的延长,气温开始升高,从种植至上棚、开花、结果的时间逐渐缩短,同时幼苗死苗率开始降低,裂果率逐渐增加。4月下旬种植罗汉果的平均株产最高,是罗汉果组培种植的适宜时间。
2.2 不同移栽方式对罗汉果组培苗生长和产量的影响
从表 2可以看出,T1处理罗汉果植株上棚、显蕾、初花和盛花期都最早。T2、T3、T4等3个处理的上棚时间基本一致,但4处理的显蕾时间、初花和盛花时间均比T2、T3处理晚1个月;而T2、T3处理各生长时期一致。从表 2还可知,各处理罗汉果平均株产由大到小排列为:T1>T2>T3>T4,而果径由大到小排列为:T1>T3>T2>T4;罗汉果平均株产、上棚前日均生长量与果径最大值均为T1处理,而最小值均为T4处理,两者间差异均显著。
表 2 不同移栽方式方式对植株生长和产量的影响Table 2. Effects of cultivation practice on plant growth and yield移栽方式
Management
style上棚前日均生长量
Average daily growth
before shed/cm上棚时间
Sheding
time显蕾时间
Flower
buds time初花时间
First flowering
time盛花期
Flowering
time平均株产个数
Average number
of plants果径
Fruit diameter
/cmT1 4.06±0.59a 5月上旬
Early May5月中下旬
Mid-to-tate May6月中旬
Mid-June6月下旬
Late June73±7.26a 5.47±0.50a T2 3.13±0.61b 6月上旬
Early June6月下旬
Late June7月中旬
Mid-July7月下旬
Late July68±6.48a 5.14±0.11ab T3 3.00±0.28b 6月上旬
Early June6月下旬
Late June7月中旬
Mid-July7月下旬
Late July66±2.16a 5.30±0.19a T4 1.89±0.25c 6月下旬
Late June7月下旬
Late July8月中旬
Mid-August8月下旬
Late August57±3.56b 4.79±0.11b 2.3 不同授粉时间对罗汉果组培苗结果和果实生长的影响
从表 3可以看出,雌花开花后选择不同的时间授粉对坐果率有影响,阴凉天气下,早晨8:00授粉的比傍晚18:00授粉的坐果率提高31.6个百分点,成果率提高23.8个百分点;高温干燥天气下,最大相差31.3%,最大相差20.9%。从果实横径来看,阴凉天气和上午授粉,果实略大些,其余的没有明显差异。其中,阴凉天气10:00授粉,其坐果率、成果率以及果径均最大;阴凉天气8:00、12:00、14:00以及高温干燥天气8:00、10:00次之,此4个授粉时间的坐果率均达80%、成果率均达70%、果径均达5.00 cm。方差分析结果表明,阴凉天气10:00、8:00、12:00、14:00以及高温干燥天气8:00、10:00授粉,其坐果率、成果率以及果径间无显著差异。除此之外其他各时间授粉,罗汉果的坐果率、成果率以及果径大小均不理想。
表 3 不同时间授粉对坐果、成果和果径的影响Table 3. Effects of pollinating time on fruit setting, fruiting and size不同授粉时间
Different
pollination time坐果率
Fruit-set
rate/%成果率
Fruit-result
rate/%果径
Fruit diameter
/cm阴凉天气 Cool weather 8:00 80.3±1.69a 74.1±1.35ab 5.43±0.18abc 10:00 82.0±2.16a 79.2±7.59a 5.71±0.11a 12:00 81.1±2.28a 76.3±4.46ab 5.53±0.21ab 14:00 80.5±1.95a 71.0±4.32bc 5.15±0.20cde 16:00 65.3±5.12c 66.3±4.61cd 4.86±0.10efg 18:00 58.2±6.09d 60.6±2.41de 5.07±0.13def 高温干燥天气 Hot dry weather 8:00 80.0±1.59a 70.3±1.43bc 5.29±0.23bcd 10:00 79.1±1.28a 71.2±1.30bc 4.96±0.21ef 12:00 72.1±4.41b 69.1±0.83bc 4.88±0.08efg 14:00 60.2±5.37cd 58.6±4.52e 4.77±0.15fgh 16:00 52.3±6.45e 50.4±3.15f 4.52±0.33h 18:00 48.7±3.51e 50.3±5.75f 4.61±0.07gh 综合各项指标,在罗汉果雌花开花后,在阴凉天气8:00~10:00进行授粉效果最佳。
2.4 雄花不同存贮方式及不同贮存时间授粉对坐果率、成果率和果径的影响
从表 4可见,雄花早晨采下后置于不同贮存环境贮存1 d后,其坐果率均达80%以上,而成果率均达75%以上;三者坐果率大小依次为:5~8℃冰箱贮存1 d、阴凉天气室内贮存1 d、高温干燥室内贮存1 d;而成果率大小依次为:阴凉天气室内贮存1 d、高温干燥室内贮存1 d、5~8℃冰箱贮存1 d;三者间差异不显著。从果实横径变化来看,随着花粉贮存时间延长,果实横径有变小的趋势,但无论在何种环境下贮存,只贮存了1 d的处理其果径均大于其他处理,但差异不显著。
表 4 雄花不同贮存方式及不同贮存时间授粉对坐果率、成果率和果径的影响Table 4. Effects of male flower storage and duration on pollination, fruit setting, fruiting and size不同存贮方式
Different storage
methods存贮天数
Storage
days/d坐果率
Fruit-set
rate/%成果率
Fruit-result
rate/%果径
Fruit diameter
/cm5~8℃冰箱
5~8℃ refrigerator1 82.6±1.84a 75.1±4.61a 5.47±0.13ab 2 78.5±1.06b 73.4±1.87a 5.01±0.14c 3 69.3±2.62c 62.1±2.12b 5.31±0.24b 4 27.4±2.05e 23.6±3.18d 4.66±0.28d 阴凉天气室内
Cool weather indoor1 81.8±0.85a 78.3±1.63a 5.63±0.09a 2 33.6±2.19d 28.7±3.32c 5.28±0.11b 3 0.0±0.00g - - 高温干燥天气室内
Hot dry weather indoor1 80.6±1.36ab 77.5±4.86a 5.30±0.16b 2 4.6±1.64f 4.6±1.22e 4.87±0.16cd 由表 4还可知,雄花早晨采下后置于5~8℃冰箱中贮存,第1 d后授粉坐果率达82.6%,而第4 d后授粉坐果率只有27.4%,期间授粉坐果率下降了55.2个百分点。在阴凉天气室内放置,坐果率从贮存1 d的81.8%急剧下降到贮存2 d的33.6%,且在第3 d完全丧失活力。在高温干燥环境下,第1 d后授粉坐果率达80.6%而,贮存2 d后授粉坐果率只有4.6%,说明贮存2 d后花粉便失去了活力。
3. 讨论与结论
罗汉果是桂北地区重要的特色产业,广西罗汉果产量占世界的90%以上,近年来,桂林地区开始大力发展罗汉果组培苗,有研究表明罗汉果组培苗存在诸多优势,相对于压蔓薯苗具植株生长势强、适应性广、产量高以及当年种植当年丰收等优势。陈继富等[16]在湘西地区通过对罗汉果组培苗农青2号进行大田种植观察发现,4月上、中旬气温回升后定植有利于植株恢复生长,既避过低温伤害又不会受到干旱的威胁,利于管理;定植时,若气温较低,可将罗汉果营养杯组培苗放在塑料大棚内培植,待气温回升后,选取晴天定植,定植成活率在95%左右,这与本试验研究结果基本一致。何金旺[17]通过在桂北高寒山区对5个罗汉果组培苗与2个农家品种进行品比试验,结果表明:组培苗单产及产值极显著优于对照农家品种。因此,罗汉果组培苗的推广应用被视为由传统生产模式向现代化、规模化发展的有力支撑[18-19],并且种苗不带病毒,藤蔓生长不受种源病毒的影晌,抗性较强[20]。
本试验研究结果表明:罗汉果组培苗在移栽大田之前,要将小苗转大钵在温棚中培育,因为温棚内气温相对较高,能促使植物快速生长,待移植到大田时具有发达的根系,移植后没有明显的缓苗期,从而可以提早上棚、显蕾、开花结果。
罗汉果组培苗应当选择4月上旬至5月中旬种植,此时气温已经升高且稳定,组培苗移植后能适应外界环境,正常生长,病害侵染少,方便管理,盛花期出现在高温干旱前期,对果实生长发育影响小,产量高,商品果多,是组培苗移栽大田最适宜的时期。
罗汉果对授粉时间和环境要求极高,综合各项因素,应当选择在阴凉天气8:00~10:00授粉,并且采集的花粉应当保存在5~8℃,可延长花粉的活力。
因此,在桂北地区发展种植罗汉果组培苗时,应当正确选择种植时间、种植方式、授粉时间和授粉方式,以保证罗汉果高产稳产。本研究通过对罗汉果组培苗开展高产栽培技术研究,确定适宜的种植时间、移栽方式、授粉时间以及花粉在不同条件下的有效活性时间。由于时间有限,本文仅仅对影响罗汉果高产栽培技术的4个方面进行了研究,特别是在对罗汉果花粉活力的研究方面没有涉及,对于罗汉果花粉活力对罗汉果果实以及品质的影响,还有待进一步探讨。
-
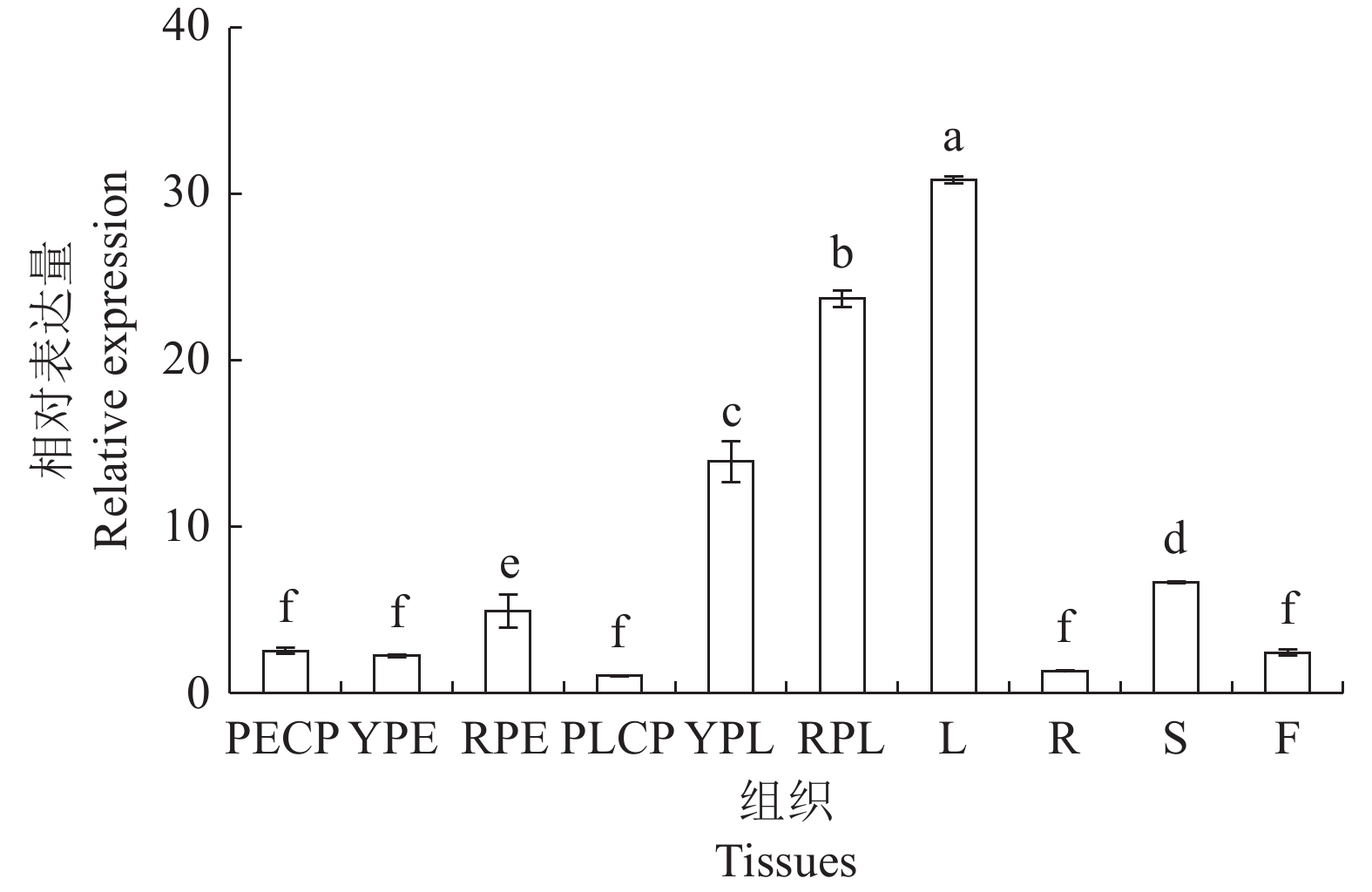
图 7 CaTPS9基因在辣椒不同组织的表达模式
PECP:商品果果肉;YPE:幼果果肉;RPE:成熟果果肉;PLCP:商品果胎座;YPL:幼果胎座;RPL:成熟果胎座;L:叶;R:根;S:茎;F:花;不同小写字母表示CaTPS9基因表达量在辣椒不同组织间差异显著(P<0.05)。图8同。
Figure 7. Expressions of CaTPS9 in different tissues of pepper plant
PECP: pericarp of commerical pepper; YPE: young pericarp; RPE: ripened pericarp; PLCP: placenta of commercial pepper; YPL: young placenta; RPL: ripened placenta ; L: leaf; R: root; S: stem; F: flower; those with different lowercase letters significantly different between different tissues of pepper at P<0.05. Same for Fig. 8.
表 1 CaTPS9基因引物信息及功能
Table 1 Information and function of CaTPS9 primer
引物名称
Primer name引物序列
Primer sequence(5′-3′)用途
PurposeCaTPS9-F ATGGCATCAAGATCTAGTGCA 基因扩增
Gene amplificationCaTPS9-R TTACCCACTCAAATTAACAGATGAG qCaTPS9-F GCATTGGAGATGACAGGTCGGATG 荧光定量PCR
qRT-PCRqCaTPS9-R ACTTGGCTTTGCTTGGCTTTTGC qActin-F AGAGATTCCGTTGCCCAGAGGTC 内参基因
Reference geneqActin-R AGCCACCACTGAGCACAATGTTAC 表 2 CaTPS9启动子顺式作用元件预测分析
Table 2 Putative cis−element analysis on promoter regions of CaTPS9
分类
Classification元件名称
Element name序列
Sequence功能预测
Function prediction激素响应元件
Hormone response element脱落酸响应元件
ABREACGTG 参与响应脱落酸的顺式作用元件
cis-acting element involved in abscisic acid responsiveness生长素响应元件
AuxRR-coreGGTCCAT 参与响应生长素的顺式作用元件
cis-acting regulatory element involved in auxin responsiveness赤霉素响应元件
TATC-boxTATCCCA 参与响应赤霉素的顺式作用元件
cis-acting element involved in gibberellin-responsiveness水杨酸响应元件
TCA-elementCCATCTTTTT 参与响应水杨酸的顺式作用元件
cis-acting element involved in salicylic acid responsiveness胁迫响应元件
Stress response element干旱诱导元件
MBSCAACTG 参与干旱诱导的MYB结合位点
MYB binding site involved in drought-inducibility厌氧诱导元件
AREAAACCA 参与厌氧诱导的顺式作用元件
cis-acting regulatory element essential for the anaerobic induction植物生长发育元件
Plant growth and development elements玉米蛋白代谢调节元件
O2-siteGATGA(C/T)
(A/G)TG(A/G)参与玉米蛋白代谢调节的顺式作用元件
cis-acting regulatory element involved in zein metabolism regulation种子特异调控元件
RY-elementCATGCATG 参与种子特异调控的顺式作用元件
cis-acting regulatory element involved in seed-specific regulation分生组织表达相关元件
CAT-boxGCCACT 与分生组织表达相关的顺式作用元件
cis-acting regulatory element related to meristem expression -
[1] 王立浩, 马艳青, 张宝玺. 我国辣椒品种市场需求与育种趋势 [J]. 中国蔬菜, 2019(8):1−4. DOI: 10.19928/j.cnki.1000-6346.2019.08.001 WANG L H, MA Y Q, ZHANG B X. Market demand and breeding trend of pepper varieties in China [J]. China Vegetables, 2019(8): 1−4.(in Chinese) DOI: 10.19928/j.cnki.1000-6346.2019.08.001
[2] ZHU F M, LI M Y, SUN M L, et al. Plant hormone signals regulate trehalose accumulation against osmotic stress in watermelon cells [J]. Protoplasma, 2022, 259(5): 1351−1369. DOI: 10.1007/s00709-021-01715-0
[3] GARG A K, KIM J K, OWENS T G, et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses [J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(25): 15898−15903.
[4] SINGER M A, LINDQUIST S. Multiple effects of trehalose on protein folding in vitro and in vivo [J]. Molecular Cell, 1998, 1(5): 639−648. DOI: 10.1016/S1097-2765(00)80064-7
[5] CHOWDARY T K, RAMAN B, RAMAKRISHNA T, et al. Interaction of mammalian Hsp22 with lipid membranes [J]. The Biochemical Journal, 2007, 401(2): 437−445. DOI: 10.1042/BJ20061046
[6] GARCIA A B, ENGLER J, IYER S, et al. Effects of osmoprotectants upon NaCl stress in rice [J]. Plant Physiology, 1997, 115(1): 159−169. DOI: 10.1104/pp.115.1.159
[7] TIAN L F, XIE Z J, LU C Q, et al. The trehalose-6-phosphate synthase TPS5 negatively regulates ABA signaling in Arabidopsis thaliana [J]. Plant Cell Reports, 2019, 38(8): 869−882. DOI: 10.1007/s00299-019-02408-y
[8] 周斌辉. 巴西橡胶树6-磷酸海藻糖合成酶家族基因的克隆、表达分析及其功能验证[D]. 海口: 海南大学, 2013. ZHOU B H. Cloning and functional characterization of the trehalose-6-phosphate synthase gene family in Hevea brasiliensis[D]. Haikou: Hainan University, 2013. (in Chinese)
[9] LI H W, ZANG B S, DENG X W, et al. Overexpression of the trehalose-6-phosphate synthase gene OsTPS1 enhances abiotic stress tolerance in rice [J]. Planta, 2011, 234(5): 1007−1018. DOI: 10.1007/s00425-011-1458-0
[10] WAHL V, PONNU J, SCHLERETH A, et al. Regulation of flowering by trehalose-6-phosphate signaling in Arabidopsis thaliana [J]. Science, 2013, 339(6120): 704−707. DOI: 10.1126/science.1230406
[11] VANDESTEENE L, RAMON M, LE ROY K, et al. A single active trehalose-6-P synthase (TPS) and a family of putative regulatory TPS-like proteins in Arabidopsis [J]. Molecular Plant, 2010, 3(2): 406−419. DOI: 10.1093/mp/ssp114
[12] ZANG B S, LI H W, LI W J, et al. Analysis of trehalose-6-phosphate synthase (TPS) gene family suggests the formation of TPS complexes in rice [J]. Plant Molecular Biology, 2011, 76(6): 507−522. DOI: 10.1007/s11103-011-9781-1
[13] 杨仕梅, 张天缘, 丘日光, 等. 番茄TPS基因家族鉴定与分析 [J]. 分子植物育种, 2019, 17(16):5215−5223. YANG S M, ZHANG T Y, QIU R G, et al. Identification and analysis of TPS gene family in tomato [J]. Molecular Plant Breeding, 2019, 17(16): 5215−5223.(in Chinese)
[14] 魏兵强, 王兰兰, 张茹, 等. 辣椒TPS家族成员的鉴定与CaTPS1的表达分析 [J]. 园艺学报, 2016, 43(8):1504−1512. WEI B Q, WANG L L, ZHANG R, et al. Identification of CaTPS gene family and expression analysis of CaTPS1 in hot pepper [J]. Acta Horticulturae Sinica, 2016, 43(8): 1504−1512.(in Chinese)
[15] 陈天池, 吴月燕, 沈乐意, 等. 葡萄TPS基因家族的鉴定与表达分析[J/OL]. 分子植物育种, 2021: 1-13. (2021-07-22). https://kns.cnki.net/kcms/detail/46.1068.S.20210722.1430.018.html. CHEN T C, WU Y Y, SHEN L Y, et al. Identification and expression analysis of TPS genes family in grape[J/OL]. Molecular Plant Breeding, 2021: 1-13. (2021-07-22). https://kns.cnki.net/kcms/detail/46.1068.S.20210722.1430.018.html.(in Chinese)
[16] 杜丽璞, 徐惠君, 叶兴国, 等. 小麦转TPS基因植株的获得及其初步功能鉴定 [J]. 麦类作物学报, 2007, 27(3):369−373. DU L P, XU H J, YE X G, et al. Transgenic wheat plants with trehalose-6-phosphate synthase (TPS) gene and identification of their function [J]. Journal of Triticeae Crops, 2007, 27(3): 369−373.(in Chinese)
[17] CORTINA C, CULIÁÑEZ-MACIÀ F A. Tomato abiotic stress enhanced tolerance by trehalose biosynthesis [J]. Plant Science, 2005, 169(1): 75−82. DOI: 10.1016/j.plantsci.2005.02.026
[18] 赵淑芳, 苟秉调, 魏敏, 等. 辣椒CaTPS8基因克隆与表达分析 [J]. 西北农业学报, 2022, 31(12):1568−1578. ZHAO S F, GOU B D, WEI M, et al. Cloning and expression analysis of CaTPS8 gene in Capsicum annuum [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2022, 31(12): 1568−1578.(in Chinese)
[19] LU S N, WANG J Y, CHITSAZ F, et al. CDD/SPARCLE: The conserved domain database in 2020 [J]. Nucleic Acids Research, 2020, 48(D1): D265−D268. DOI: 10.1093/nar/gkz991
[20] WILKINS M R, GASTEIGER E, BAIROCH A, et al. Protein identification and analysis tools in the ExPASy server [J]. Methods in Molecular Biology, 1999, 112: 531−552.
[21] CHOU K C, SHEN H B. A new method for predicting the subcellular localization of eukaryotic proteins with both single and multiple sites: Euk-mPLoc 2.0 [J]. PLoS One, 2010, 5(4): e9931. DOI: 10.1371/journal.pone.0009931
[22] JOHNSON M, ZARETSKAYA I, RAYTSELIS Y, et al. NCBI BLAST: A better web interface [J]. Nucleic Acids Research, 2008, 36(S2): W5−W9.
[23] LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. Clustal W and clustal X version 2.0 [J]. Bioinformatics, 2007, 23(21): 2947−2948. DOI: 10.1093/bioinformatics/btm404
[24] MÖLLER S, CRONING M D R, APWEILER R. Evaluation of methods for the prediction of membrane spanning regions [J]. Bioinformatics, 2001, 17(7): 646−653. DOI: 10.1093/bioinformatics/17.7.646
[25] ALMAGRO A J J, TSIRIGOS K D, SØNDERBY C K, et al. SignalP 5.0 improves signal peptide predictions using deep neural networks [J]. Nature Biotechnology, 2019, 37(4): 420−423. DOI: 10.1038/s41587-019-0036-z
[26] BLOM N, GAMMELTOFT S, BRUNAK S. Sequence and structure-based prediction of eukaryotic protein phosphorylation sites 1 [J]. Journal of Molecular Biology, 1999, 294(5): 1351−1362. DOI: 10.1006/jmbi.1999.3310
[27] GEOURJON C, DELÉAGE G. SOPMA: Significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments [J]. Bioinformatics, 1995, 11(6): 681−684. DOI: 10.1093/bioinformatics/11.6.681
[28] KIEFER F, ARNOLD K, KÜNZLI M, et al. The SWISS-MODEL Repository and associated resources[J]. Nucleic Acids Research, 2009, 37(Database issue): D387-D392.
[29] KUMAR S, STECHER G, LI M, et al. MEGA X: Molecular evolutionary genetics analysis across computing platforms [J]. Molecular Biology and Evolution, 2018, 35(6): 1547−1549. DOI: 10.1093/molbev/msy096
[30] ROMBAUTS S, DÉHAIS P, VAN MONTAGU M, et al. PlantCARE, a plant cis-acting regulatory element database [J]. Nucleic Acids Research, 1999, 27(1): 295−296. DOI: 10.1093/nar/27.1.295
[31] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method [J]. Methods, 2001, 25(4): 402−408. DOI: 10.1006/meth.2001.1262
[32] JIANG S Y, JIN J J, SAROJAM R, et al. A comprehensive survey on the terpene synthase gene family provides new insight into its evolutionary patterns [J]. Genome Biology and Evolution, 2019, 11(8): 2078−2098. DOI: 10.1093/gbe/evz142
[33] 于欢. 甘薯海藻糖-6-磷酸合成酶基因IbTPS1克隆与功能鉴定[D]. 太谷: 山西农业大学, 2019. YU H. Cloning and functional identification of trehalose-6-phosphate synthase gene IbTPS1 from Ipomoea batatas(L. ) lam[D]. Taigu: Shanxi Agricultural University, 2019. (in Chinese)
[34] 丁泽红, 付莉莉, 铁韦韦, 等. 木薯MeTPS9基因克隆及表达特性分析 [J]. 生物技术通报, 2017, 33(11):84−91. DOI: 10.13560/j.cnki.biotech.bull.1985.2017-0416 DING Z H, FU L L, TIE W W, et al. Clone and expression characteristics of MeTPS9 gene in cassava [J]. Biotechnology Bulletin, 2017, 33(11): 84−91.(in Chinese) DOI: 10.13560/j.cnki.biotech.bull.1985.2017-0416
[35] DING X D, WANG D, XIAO J L. Cloning of gs TPS9 gene from Glycine soja and study on its responses to stresses [J]. Journal of Northeast Agricultural University (English Edition), 2022, 29(1): 59−68.
[36] KHATUN K, ROBIN A H K, PARK J I, et al. Molecular characterization and expression profiling of tomato GRF transcription factor family genes in response to abiotic stresses and phytohormones [J]. International Journal of Molecular Sciences, 2017, 18(5): 1056. DOI: 10.3390/ijms18051056
[37] DOSSA K, DIOUF D, CISSÉ N. Genome-wide investigation of Hsf genes in sesame reveals their segmental duplication expansion and their active role in drought stress response [J]. Frontiers in Plant Science, 2016, 7: 1522.
[38] LIN T Y, ZHOU R, BI B, et al. Analysis of a radiation-induced dwarf mutant of a warm-season turf grass reveals potential mechanisms involved in the dwarfing mutant [J]. Scientific Reports, 2020, 10(1): 18913. DOI: 10.1038/s41598-020-75421-x
[39] SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Gene networks involved in drought stress response and tolerance [J]. Journal of Experimental Botany, 2007, 58(2): 221−227.
[40] SUGANO S, MAEDA S, HAYASHI N, et al. Tyrosine phosphorylation of a receptor-like cytoplasmic kinase, BSR1, plays a crucial role in resistance to multiple pathogens in rice [J]. The Plant Journal:for Cell and Molecular Biology, 2018, 96(6): 1137−1147. DOI: 10.1111/tpj.14093
[41] XU Y C, WANG Y J, MATTSON N, et al. Genome-wide analysis of the Solanum tuberosum (potato) trehalose-6-phosphate synthase (TPS) gene family: Evolution and differential expression during development and stress [J]. BMC Genomics, 2017, 18(1): 926. DOI: 10.1186/s12864-017-4298-x
[42] ZHOU M L, ZHANG Q, SUN Z M, et al. Trehalose metabolism-related genes in maize [J]. Journal of Plant Growth Regulation, 2014, 33(2): 256−271. DOI: 10.1007/s00344-013-9368-y
[43] 龙娅丽, 徐子健, 朱白婢, 等. 茉莉酸甲酯诱导西瓜ClTPS1基因的表达特性及其生物学信息分析 [J]. 分子植物育种, 2016, 14(12):3299−3307. LONG Y L, XU Z J, ZHU B B, et al. Sequence analysis of ClTPS1 gene in watermelon and its expression characteristic after treated with MeJA [J]. Molecular Plant Breeding, 2016, 14(12): 3299−3307.(in Chinese)
-
期刊类型引用(5)
1. 李冉,王张豪,阎燚刚,杨玉婷,杜冰,单体江. 罗汉果病虫害及其综合防治研究进展. 林业与环境科学. 2024(02): 150-160 .  百度学术
百度学术
2. 农代国. 蒲芦瑶族乡罗汉果优质高产栽培技术探讨. 农业技术与装备. 2023(05): 139-140+143 .  百度学术
百度学术
3. 秦凤琴. 桂林临桂区罗汉果优质高产栽培技术. 南方园艺. 2021(04): 41-43 .  百度学术
百度学术
4. 肖石明. 永福县罗汉果优质栽培技术探讨. 南方农业. 2021(20): 7-8 .  百度学术
百度学术
5. 甘金佳,毛玲莉,蒋水元,梁勇诗,李虹,向巧彦,黄夕洋. 不同授粉方式对罗汉果着果率和果实品质的影响. 中国南方果树. 2020(06): 71-74 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: