Microbe-mediated Phytoremediation on Low Concentration Oil Sludge
-
摘要:目的 探究4种新疆本土草本植物生物修复含油污泥的潜力,及其与微生物联合修复对低浓度含油污泥处理效果。方法 以狗牙根(Cynodondactylon)、高羊茅(Festuca elata)、黑麦草(Lolium Perenne)和苏丹草(Sorghum sudanense)与解脂假丝酵母(Candida lipolytica,菌A)、2株枯草芽孢杆菌[菌B( Bacillus subtilis PL-2)和菌C( Bacillus subtilis XJ-16)]、混菌D(A+B+C)为研究对象,采用盆栽试验,分别设置微生物组、植物组、植物-微生物组及对照4组处理,分析不同处理对石油烃残留量、微生物数量、草种生物量和叶绿素含量的影响。结果 120 d盆栽试验结表明,单独种植狗牙根、单独种植苏丹草、菌B、菌C处理对石油烃的降解效果较为相近,降解率分别为31.39%、34.19%、 33.71%与33.39%,显著高于对照组(P<0.05);草本植物与微生物联合修复中,狗牙根中添加菌A、菌B和菌C效果显著,石油烃的降解率可达43.02%、40.20%和42.54%,且在联合修复后土壤中可培养细菌与真菌数量显著增加,分别为1.50×105~2.59×105 cfu·g−1和4.32×104~5.53×104 cfu·g−1;此外,在添加降解菌后,狗牙根干重和叶绿素总含量均显著提高(P<0.05)。结论 综合石油烃残留量、微生物数量、生物量以及叶绿素含量指标得出,新疆本地植物狗牙根与菌A(解脂菌假丝酵母)、菌B和菌C(均为枯草芽孢杆菌)的联合,可为当地低浓度含油污泥处理提供可行的技术方案。
-
关键词:
- 植物-微生物联合修复 /
- 石油污染 /
- 降解率 /
- 微生物数量 /
- 生理特性
Abstract:Objective Potential of applying native Xinjiang plants in combination with microbes as a bioagent to treat low concentration oil sludge pollution was explored.Method Three treatments of microbes, plants, and plant-microbe combination that used plant including Cynodon dactylon, Festuca elata, Lolium Perenne, or Sorghum sudanense and the microbes including Candida lipolytica (Microbe A), Bacillus subtilis PL-2 (Bacterium B), and/or B. subtilis XJ-16 (Bacterium C) were conducted along with control in a pot experiment for 120 d. Effects of the treatments on petroleum hydrocarbon residues, and microbial population, as well as biomass and chlorophyll content of the plants, were determined.Result Under the single-factor treatments, C. dactylon, S. sudanense, Bacterium B, or Bacterium C provided relatively similar effect in degrading petroleum hydrocarbons with 31.39%, 34.19%, 33.71%, and 33.39% reductions, respectively, which were significantly higher than control (P<0.05). The plant-microbe combinations, on the other hand, showed significantly greater pollution remedying effect, such as achieved by incorporating C. dactylon with Bacterium A, B, and C that delivered the hydrocarbon removal rates of 43.02%, 40.20%, and 42.54%, respectively. Meanwhile, the culturable bacteria count increased significantly from 1.50×105 cfu·g−1 to 2.59×105 cfu·g−1 and fungi count from 4.32×104 cfu·g−1 to 5.53×104 cfu·g−1. In addition, the dry weight and total chlorophyll content of C. dactylon rose significantly in the presence of the microbes (P<0.05).Conclusion In view of petroleum hydrocarbon residue, microbial population, plant biomass, and leaf chlorophyll content, it appeared that the combined applications of Xinjiang native plant C. dactylon with yeast C. lipolytica and bacterium B. subtilis PL-2 or XJ-16 could be feasible for cleaning the environmental pollution caused by low concentration oil sludge in the area. -
0. 引言
【研究意义】含油污泥,简称油泥,是在石油钻井、运输、炼制过程中产生的含油固体废弃物[1]。油泥中有毒有害化合物达数百种,其中苯、多环芳烃等化合物具有“三致”效应,2008年被列入《国家危险废物名录》[2]。目前,我国每年产生500多万t的油泥,但实际处置率却在20%以下[3]。在新疆,油泥一般经过物理、化学、生物等处理后,含油率达到排放标准2%以下后,可以限定范围排放[4]。但是当堆置的油泥得不到有效处理,不仅会增加堆积体积,而且还会对周围环境产生巨大危害[5,6]。因此,对油泥的“三化”处置是当前研究的热点问题。【前人研究进展】油泥的处理技术包括植物修复、微生物降解以及植物-微生物联合处理[7]。其中,植物和微生物联合修复是目前最有发展潜力的一种生物技术[8]。郭鹏等[9]研究表明经生物降解后的油泥,再经1~2个生长周期的植物生长,可满足油田行业排放标准。史德青等[10]对胜利油田含油污泥进行120 d植物修复时发现,石油烃的降解率最高可达 34.09%。研究表明植物-微生物联合修复不仅对石油烃效果去除较好,且植物生物量、叶绿素含量均有增加[11]。种植玉米并联合菌株MN54和添加生物炭的情况下,多环芳烃化合物TPHs(Polycyclic aromatic hydrocarbons)的去除率进一步增强[12]。野生草本植物是一类人为与自然选择压力下产生的高度进化的植物类群,其生物量较大、生长速度较快,在污染胁迫下的抗逆性强,是生态恢复的先锋植物,在修复含油污泥方面具有巨大的应用潜力[13]。【本研究切入点】前人研究多针对原油生产与运输过程中,由井喷、渗漏及排放等造成的石油污染土壤;而含油污泥是生产作业时产生的含油的污泥,与其理化性质差异较大,目前对油泥的研究局限于物理、化学法,易造成二次污染,对植物-微生物联合修复技术的研究有待深入探讨。【拟解决的关键问题】本研究依据当地特有的干旱气候,选用4种该地区耐污染性强的草本植物与石油烃高效降解菌进行联合修复,检验植物-微生物联合修复对含油污泥的处理效果,通过检测污泥中石油烃降解率、植物生物量、叶绿素含量以及微生物数量等的变化,获得最佳处理组合,阐明可能的联合处理机制,为新疆当地低浓度含油污泥的生物修复提供科学依据及技术支撑。
1. 材料与方法
1.1 试验材料
1.1.1 菌种来源
3种菌株由中国科学院沈阳应用生态所微生物生态与技术实验室筛选所得,其中解脂假丝酵母菌(Candida lipolytica)筛选于某炼化厂污染土壤,编号为Y021,简写为A;两株枯草芽孢杆菌(Bacillus subtilis)筛选自新疆油田含油污泥中,编号分别为PL-2和XJ-16,简写为B和C,供试菌D为Y021、PL-2和XJ-16的混合(体积比为1∶1∶1)。
1.1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏5 g·L−1,蛋白胨10 g·L−1,NaCl 5 g·L−1 。酵母菌培养基:葡萄糖20 g·L−1,NaNO3 3 g·L−1,K2HPO4·3H2O 1 g·L−1,MgSO4·7H2O 0.5 g·L−1,KCl 0.5 g·L−1,FeSO4·7H2O 0.01 g·L−1 。营养液成分为:(NH4)2SO4 10 g·L−1,KCl 1.1 g·L−1,NaCl 1.1 g·L−1,KH2PO4 3.4 g·L−1,K2HPO4·3H2O 4.4 g·L−1,MgSO4·7H2O 0.5 g·L−1,酵母膏0.5 g·L−1,微量元素0.5 g·L−1 。微量元素组成为:ZnSO4 0.29 g·L−1,CaCl2 0.24 g·L−1,CuSO4 0.25 g·L−1,MnSO4 0.17 g·L−1,FeSO4·7H2O 0.56 g·L−1 。
1.1.3 供试植物
供试草本植物为本实验室前期考察的4种具有石油污染耐受性植物:狗牙根(Cynodon dactylon)、高羊茅(Festuca elata)、黑麦草(Lolium Perenne)和苏丹草(Sorghum sudanense)。其中狗牙根、高羊茅、黑麦草为禾本科多年生草本植物,分别简写为GYG、GYM、HMC,苏丹草为禾本科一年生草本植物,简写为SDC。
1.1.4 供试油泥
供试油泥为新疆油田含油污泥经过生物表面活性剂高温水洗后获得,总石油烃含量为6.23%,含油污泥基本性质:pH7.58,总氮2.06%,速效磷36.31 mg·kg−1,速效钾271.23 mg·kg−1。
1.2 试验方法
本研究在中科院沈阳应用与生态研究所温室内进行为期120 d的盆栽试验。为提高含油污泥的透气性,提高微生物的活性,油泥中添加10%的草炭作为盆栽基质,花盆宽16 cm,高17 cm。所添加的降解菌为培养至对数生长期的发酵液,发酵液中有效菌约为107 cfu·mL−1。试验共4组处理,分别为:微生物组、植物组、植物+微生物组及对照(CK)组(表1)。在植物组处理中,每盆放置2 kg的油泥,距表层 1.5 cm 左右深度进行播种 15~30粒种子,待出苗7 d后进行间苗,每盆间苗至10株;仅添加微生物的处理中,将菌液与油泥充分混匀后,放置于盆内,不种植植物,菌液添加量为2.5 mL·kg−1;在植物-微生物处理组中,菌液与油泥混匀后进行播种。所有处理试验温度为28 ℃。试验过程中每隔3 d对所有处理补充1次水分。分别在30 、60和120 d测定油泥中石油烃含量;在120 d测定根际土壤可培养微生物数量、植物生物量、叶绿素含量。每组设3个重复。
表 1 试验处理组Table 1. Experimental treatments处理 Treatment 处理代号 Code 备注 Notes 空白对照 Control CK 自然条件下含油污泥降解情况 微生物组 Microbial 解脂假丝酵母菌(A)、枯草芽孢杆菌(B)、枯草芽孢杆菌(C)、混菌D(A+B+C) 添加微生物对含油污泥的降解情况 植物组 Plant 狗牙根(GYG、GYG+YN)、高羊茅(GYM、GYM+YN)、黑麦草(HMC、HMC+YN)、苏丹草(SDC、SDC+YN) GYG、GYN、HMC、SDC为正常土壤条件下生长,GYG+YN、GYN+YN、HMC+YN、SDC+YN为污染土壤中生长。不同草本植物对含油污泥的降解情况。 植物-微生物组 Microbial and Plant GYG+A、GYG+B、GYG+C、GYG+D;GYM+A、GYM+B、GYM+C、GYM+D;HMC+A、HMC+B、HMC+C、HMC+D;SDC+A、SDC+B、SDC+C、SDC+D 植物微生物联合修复对石油烃降解效率 1.3 测定方法
植物生物量的测定是在培养结束后,将整株植物连根带土取出,抖掉大块土壤,用灭菌后的毛刷将根表面的土壤刷至无菌离心管中,作为根际土壤。植株清洗后称鲜重,于105 ℃下杀青20 min,然后于70 ℃烘干至恒重后,称其干重。总叶绿素含量采用分光光度法测定[14],根际土壤可培养细菌与真菌数量采用平板计数法[15]测定,石油烃含量测定采用重量法[16]测定。
1.4 数据分析
数据整理使用Excel 2016,并采用SPSS 17.0软件对所测数据进行统计分析,用平均值和标准误表示测定结果,分别对各组中的石油烃残留量、生物量、微生物数量和叶绿素含量指标进行比较,从而综合反应联合处理效果,并进行单因素方差分析,再使用 Duncan法对各测定数据进行多重比较,在95%水平上分析其差异显著性,采用Origin 2021制图进行可视化分析。
2. 结果与分析
2.1 不同处理下石油烃残留量与降解率
各处理组中石油烃的残留量与降解率见表2 。在植物组中,120 d时,SDC+YN组的石油烃残留量最低,显著低于CK组(P<0.05),其次为GYG+YN,显著低于CK组(P<0.05)。从60 d的阶段性修复效果看,苏丹草和狗牙根的降解作用主要集中在前60 d,期间修复效率也是相对较高的,60 d后去除作用逐渐减弱。而高羊茅和黑麦草60 d后也保持着一定的去除作用,石油烃残留量比对照组低10.86%和11.24%(P<0.05)。植物组中,修复效果由大到小顺序依次为:苏丹草>狗牙根>黑麦草>高羊茅。
表 2 处理组中石油烃的残留量与降解率Table 2. Residues and degradation of petroleum hydrocarbons by each treatment处理组
Group处理
Treatment30 d 60 d 120 d 残留量
Residual amount/g降解率
Degradation rate/%残留量
Residual amount/g降解率
Degradation rate/%残留量
Residual amount/g降解率
Degradation rate/%对照组
Control groupCK 5.71±0.09 ab 8.13±1.62 h 5.20±0.15 a 16.53±2.41 f 4.85±0.05 a 22.15±0.80 k 植物组
Plant groupGYG+YN 5.38±0.23 bcdef 13.72±3.62 efgh 4.33±0.30 efj 30.57±6.02 ab 4.27±0.13 bcdefgh 31.39±2.01 defghi GYM+YN 5.35±0.45 bcdef 13.86±3.62 efgh 4.52±0.13 defg 27.37±2.01 abc 4.45±0.15 bcde 28.57±2.41 ghij HMC+YN 5.30±0.10 bcdefg 14.93±1.61 defgh 4.50±0.05 defg 27.77±0.80 abc 4.35±0.15 cdefg 30.18±2.41 e SDC+YN 4.70±0.05 ghij 24.56±0.80 abc 4.20±0.18 fg 32.58±1.61 a 4.10±0.05 ghi 34.19±0.80 cde 微生物
Microbial groupA 5.25±0.30 bcdefgh 15.73±4.82 defgh 4.63±0.03 cdef 25.75±0.40 abcd 4.27±0.03 ghi 31.39±0.40 defghi B 5.15±0.20 bcdefghi 17.34±3.21 cedfg 4.53±0.03 defg 25.38±3.08 abc 4.10±0.05 ghi 33.71±1.05 cdef C 4.67±0.48 hij 24.97±7.62 abc 4.87±0.28 abcd 21.76±4.41 cdef 4.15±0.20 efghi 33.39±3.21 cdefg D 5.65±0.45 abc 9.31±7.22 gh 4.97±0.08 abc 20.15±0.41 def 4.67±0.28 ab 25.01±5.67 jk 植物—微生物
Microbial and PlantGYG+A 5.40±0.10 bcde 13.32±1.61 efgh 4.22±0.08 fg 32.19±1.21 a 3.55±0.05 k 43.02±0.80 a GYG+B 4.90±0.25 efghij 21.62±4.42 bcde 4.33±0.03 efg 30.57±0.40 ab 3.73±0.08 jk 40.20±1.21 ab GYG+C 5.00±0.30 defghi 19.74±4.82 bcdef 4.35±0.10 efg 30.18±1.61 ab 3.58±0.35 k 42.54±5.22 a GYG+D 4.92±0.28 defghij 20.96±4.42 bcde 5.10±0.15 ab 18.41±2.02 ef 3.95±0.35 ij 36.60±5.62 bc GYM+A 4.75±0.39 defghi 19.32±4.42 bcdef 4.60±0.18 cdef 26.16±3.21 abcd 4.25±0.10 defghi 32.05±2.02 cdefgh GYM+B 4.33±0.13 j 30.57±2.01 a 4.37±0.03 efg 29.78±0.41 ab 4.45±0.10 bcde 28.57±1.61 ghij GYM+C 4.59±0.53 fghij 23.15±3.27 abcd 4.40±0.10 efg 29.78±13.65 ab 4.43±0.16 cdefg 28.96±2.81 fghig GYM+D 5.52±0.10 abcd 11.33±5.70 fgh 5.12±0.08 ab 17.74±1.21ef 4.43±0.08 cdefg 28.97±1.21 fghig HMC+A 5.40±0.33 a 13.37±5.70 efgh 4.33±0.08 efg 30.57±1.21ab 4.20±0.10 defghi 32.58±1.61 cdefgh HMC+B 4.88±0.03 efghij 21.74±0.400 bcde 4.33±0.08 g 29.89±0.54 ab 3.77±0.35 efghi 32.99±0.40 cdefgh HMC+C 4.80±0.15 fghij 23.33±0.41 abcd 4.72±0.28 bcde 24.16±4.42 bcde 4.55±0.10 bc 26.97±1.61 ij HMC+D 5.26±0.73 bcdef 15.69±12.04 defgh 4.52±0.13 defg 27.37±2.01 abc 4.48±0.03 bcd 28.16±0.40 hij SDC +A 5.35±0.50 bcdef 14.13±0.81 edfgh 4.52±0.18 defg 27.38±2.81 abc 3.97±0.03 hij 36.20±0.41 bcd SDC +B 4.33±0.08 j 30.57±1.21 a 4.27±0.03 fg 31.39±0.40 a 4.13±0.08 fghi 33.94±0.98 cde SDC +C 5.10±0.05 cdefghi 18.14±0.80 cedf 4.98±0.18 abc 20.14±2.81 def 4.03±0.18 hi 35.38±2.81 cd SDC +D 4.55±0.15 ig 26.97±2.41 ab 4.55±0.05 defg 26.97±0.81 abcd 4.18±0.03 defghi 32.98±0.41 cdefgh 不同小写字母表示不同处理间差异显著(P<0.05)。表3同。
Different lowercase letters represent significant difference among groups (P<0.05). Same for Table 3.在微生物处理组中,添加菌B和菌C的处理石油烃残留量最低,显著低于CK组(P<0.05),二者差异不显著。其次为添加菌A的处理,显著低于CK组(P<0.05),残留量最高的为D组,仅低于CK组3.75%(P>0.05)。可见两类降解菌发生了强烈的拮抗作用,导致混合降解效果低于单一降解效果的现象。微生物组中,修复效果由大到小顺序依次为:菌B>菌C>菌A>菌D。
在植物与微生物联合修复 120 d时,狗牙根与分别添加菌A、B、C、D的处理石油烃残留量显著低于CK组20.87%、18.03%、15.25%和14.45%(P<0.05);狗牙根与A、B、C降解菌联合处理后,石油烃降解率比GYG+YN组分别提高了14.45%、11.61%、8.83%,比单独添加降解菌修复分别提高11.61%、5.99%、4.01%。HMC+B处理石油烃残留量低于CK组10.86%(P<0.05)。修复效率最低的为GYM+B和HMC+D的处理,仅低于CK组6.42%和5.99%(P<0.05)。在短期修复(60 d)中,种植狗牙根添加菌A与苏丹草添加菌B修复效果较好;在120 d中,种植狗牙根分别添加菌A、菌B、菌C修复效果较好。
2.2 不同处理对根际土壤微生物数量的影响
120 d测定各处理土壤中可培养细菌和真菌的数量,结果见表3。在仅种植植物土壤中,可培养细菌与真菌数量较CK均显著增加(P<0.05),分别是CK组的5.69~15.66倍与3.01~5.35倍,表明种植草本植物可提高根际可培养微生物的数量;在仅添加微生物处理组中,土壤中可培养细菌与真菌数量显著提高(P<0.05),其中添加降解菌A后,其可培养细菌与真菌数量均为最高,为CK组的13.99倍、6.14倍,表明解脂假丝酵母与油泥中土著细菌有较好共生性;而添加混合菌D的可培养细菌和真菌数量最低,显示这两类降解菌有相互抑制作用,这也是导致其降解率最低的关键因素。在单项修复中,土壤中可培养细菌表现为植物组占优势,可培养真菌以微生物组占优势。
表 3 不同处理土壤中微生物数量Table 3. Microbial loads in sludge by treatments处理组
Group处理
Treatment细菌
Bacteria/
(×105 cfu·g−1)真菌
Fungus
(×104 cfu·g−1)对照组 Control group CK 0.08±0.01 i 0.67±0.06 i 植物组 Plant group GYG+YN 1.33±0.10 ef 3.58±0.38 efg GYM+YN 1.09±0.02 g 0.33±0.39 fgh HMC+YN 1.12±0.13 g 0.35±0.20 efg SDC+YN 0.48±0.04 h 2.02±0.28 k 微生物 Microbial group A 1.19±0.04 fg 4.78±0.39 b B 0.96±0.07 g 3.43±0.21 efgh C 1.02±0.07 g 4.13±0.24 bcde D 0.65±0.06 g 2.95±0.38 ghi 植物-微生物
Microbial and plantGYG+A 1.79±0.06 b 5.53±0.58 a GYG+B 1.50±0.07 cde 4.32±0.55 bcd GYG+C 2.59±0.12 a 4.40±0.36 bc GYG+D 1.91±0.08 b 2.00±0.41 k GYM+A 1.45±0.09 cde 4.03±0.43 cde GYM+B 1.39±0.20 de 3.53±0.43 efg GYM+C 1.33±0.09 ef 3.07±0.49 fgh GYM+D 1.32±0.11 ef 3.25±0.03 fgh HMC+A 1.47±0.13 cde 3.67±0.33 def HMC+B 1.61±0.09 c 4.08±0.19 cde HMC+C 1.12±0.27 g 2.75±0.48 hig HMC+D 1.56±0.13 cd 2.30±0.33 igk SDC+A 1.51±0.09 cde 3.15±0.40 fgh SDC+B 1.32±0.10 ef 2.80±0.35 hig SDC+C 1.37±0.07 def 3.50±0.23 efg SDC+D 1.12±0.08 g 2.15±0.26 jk 在联合修复中,GYG+C可培养细菌数量显著增加(P<0.05),是CK组的30.47倍,其次为添加菌A、B、D的处理,分别是CK组的21.06倍、17.62倍、22.46倍(P<0.05);在真菌中,GYG+A的处理真菌数量显著增加,是CK组的8.26倍(P<0.05),其次是GYG+B和GYG+C的处理,为CK组的6.44倍、6.57倍(P<0.05),真菌数量增加较少的为GYG+D处理,仅是CK组的2.99倍(P<0.05)。高羊茅添加4种菌株后可培养细菌与真菌数量显著增加(P<0.05)。HMC+A、HMC+B、HMC+C与HMC+D组可培养细菌数量增加显著(P<0.05),是CK组的17.02倍、18.92倍、13.19倍、18.32倍(P<0.05);在真菌中,HMC+A、HMC+B组增加效果较好,为CK组的5.47倍与6.09倍(P<0.05),HMC+C、HMC+D的处理真菌数量也显著增加(P<0.05),为CK组4.10倍和3.43倍。SDC+A组可培养细菌增加效果显著(P<0.05),是CK组的17.79倍,其余3组分别为CK组的15.50倍、16.08倍、13.21倍(P0.05);而在真菌中,SDC+C组真菌数量是CK组的5.22倍(P<0.05),其余3组处理是CK组的4.70倍、4.18倍、3.21倍(P<0.05)。综合表明联合修复后微生物数量显著提高,其中以狗牙根与菌A、菌B、菌 C的组合效果较好。
2.3 不同处理对植物生物量的影响
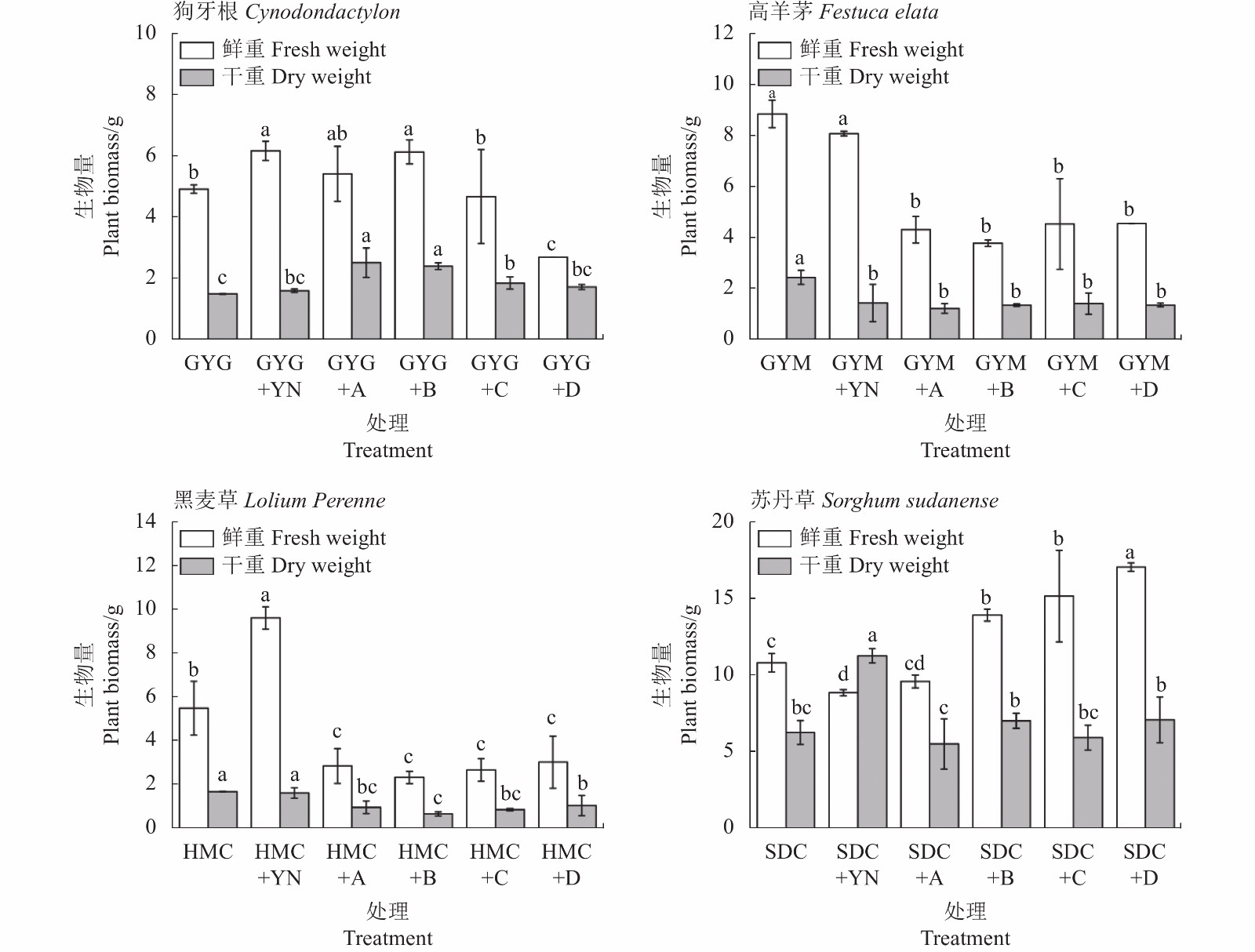
经过120 d盆栽试验后,不同处理组植物生物量见图1。GYG+YN与GYG+B联合处理时,狗牙根鲜重较GYG显著提高了25.36%和24.61%(P<0.05);在干重中,GYG+YN和GYG+A、GYG+B、GYG+C联合处理时,狗牙根干重比GYG提高了6.42%、40.48%(P<0.05)、37.71%(P<0.05)和19.06%(P<0.05)。高羊茅与4种降解菌联合处理后鲜重比GYM显著降低了51.25%、57.22%、48.71和48.60%(P<0.05);在干重中,GYM+YN和高羊茅添加4种降解菌处理时,高羊茅干重分别显著降低了41.16%、49.89%、44.52%、42.06%和44.46%(P<0.05)。HMC+YN鲜重比HMC显著提高了42.99%(P<0.05);在干重中,黑麦草与4种降解菌联合处理后干重比HMC组显著降低了43.46%、61.45%、49.74%和38.73%(P<0.05)。苏丹草分别添加菌B、菌C和菌D后鲜重比SDC组显著提高了22.39%、28.75%和36.71%(P<0.05);SDC+YN和SDC+B、SDC+D联合处理后,苏丹草干重比SDC组显著提高44.51%、10.89%和11.59%,其中仅SDC+YN表现为显著差异(P<0.05)。结果显示,不同草本植物的生物量对添加降解菌的反应不同,其中以狗牙根和苏丹草鲜重表现为促进作用。
2.4 不同处理对植物叶绿素含量的影响
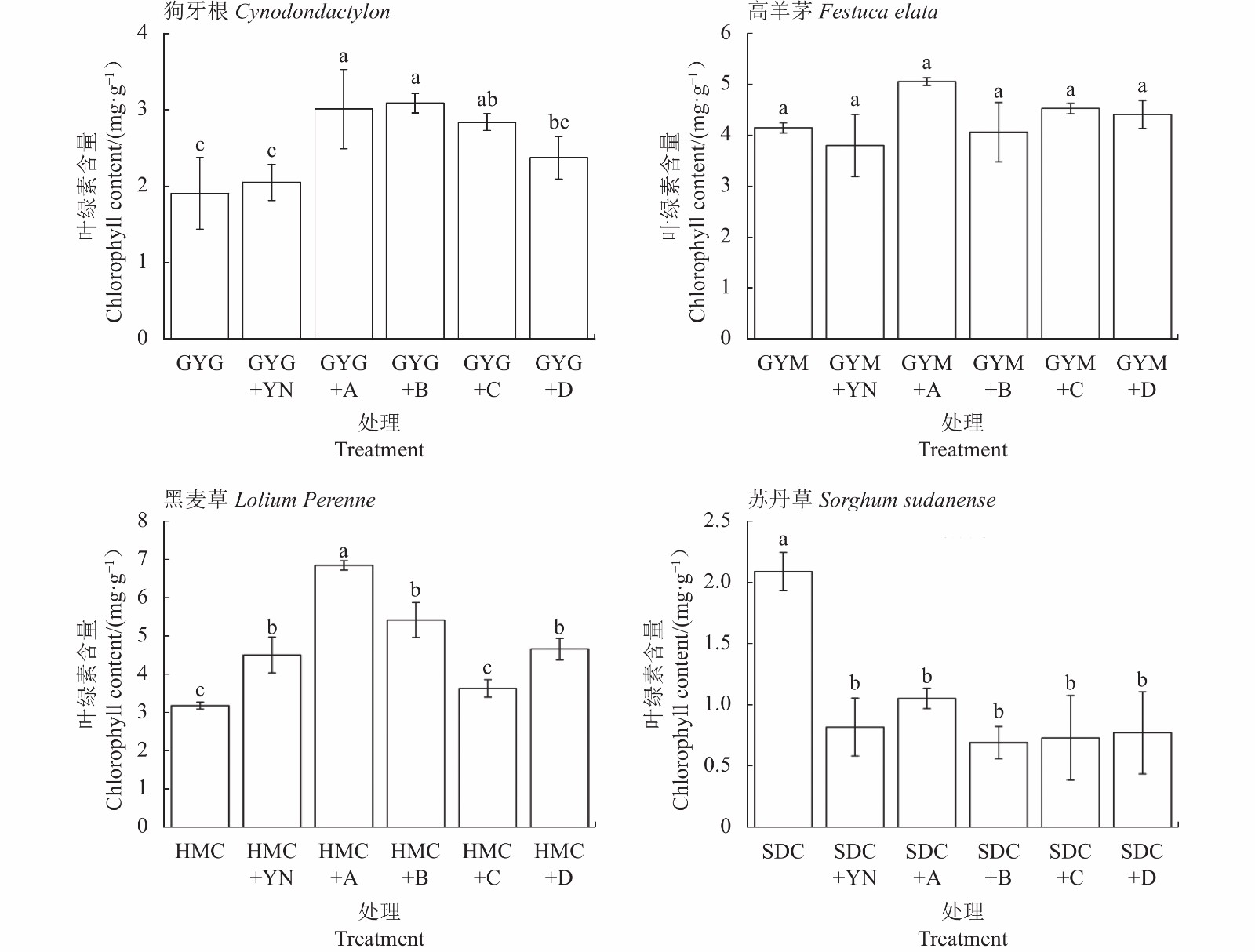
120 d盆栽试验结束后,不同处理中草本植物的叶绿素含量差别较大(图2)。在狗牙根处理组中,狗牙根分别接种菌A、B 和C后,叶绿素含量较GYG组显著提高62.10%、60.90%和44.66%(P<0.05),表明添加这3种降解菌可提高植物光合作用强度,促进植物生物量的积累,与植物生物量变化基本一致;仅种植狗牙根和狗牙根添加菌D的处理中,虽然叶绿素含量有所提高,但无显著差异(P>0.05)。在高羊茅处理组中,高羊茅分别与菌A、菌C和菌D结合后,叶绿素含量较GYM组提高21.82%、9.08%和6.30%,差异不显著(P>0.05);而GYM+YN和GYM+B处理组的叶绿素含量低于无油泥组12.33%和3.02%,差异不显著(P>0.05)。黑麦草在接种A菌株后叶绿素含量最高,显著高于HMC组114.96%(P<0.05),其次HMC+YN、HMC+B、HMC+D处理显著高于HMC组,分别提高41.49%、70.15%、46.43%(P<0.05);HMC+C组虽然叶绿素高于HMC组14.09%,但无显著差异(P>0.05)。在苏丹草的处理组中,无论是仅种植苏丹草的处理组还是与微生物联合的处理组,叶绿素含量均显著低于SDC组(P<0.05),分别降低60.75%、46.90%、67.22%、64.07%、59.40%。结果显示,不同降解菌对植物叶绿素含量的影响不同,其中以狗牙根、高羊茅和黑麦草促进效果明显。
3. 讨论
植物-微生物联合修复是石油污染绿色修复的关注热点[17]。刘永军等[18]利用黑麦草在接种不动杆菌(Acinetobacter sp.)后,石油烃降解率可达53.08%。欧阳威等[19]利用高羊茅接种Rhoder菌剂,降解率可达75.49%。本研究表明在120 d的草本植物生长周期内,狗牙根分别与菌A、B、C协同后石油烃降解率达到43.02%、40.20%和42.54%,相比其他几种草本植物优势明显。在单项修复方面,分别是苏丹草、菌B的降解率最高,达34.19%和33.71%;单项利用狗牙根修复的降解率虽仅有31.39%,但其与降解菌联合后降解效率提升最高。这是因为植物在不同微生物刺激下反应不同,而在协同效应作用下植物为微生物生长提供良好的条件,将污染物中的氮分解为植物所能利用氮源,同时根系分泌物可为微生物生长提供适宜的环境与所需的物质[20,21]。一些微生物通过分泌酶来分解污染物,将其转化为氨基环丙烷羧酸盐脱氮酶,经植物吸收后可提高植物乙烯含量,且植物还可通过本身的积累和吸收微生物产生的酶,再次将污染物分解[22]。
植物-微生物联合修复中,降解菌对污染物的降解能力起着重要的影响,但因养分、代谢物能与原有的微生物产生一定的竞争或协同关系,导致微生物的数量变化,从而直接影响对污染物的降解效果。本研究表明,狗牙根分别接种菌A、B和C后,根际微生物数量显著提高,其中可培养细菌与真菌最高可达2.59×105 cfu·g−1和5.53×104 cfu·g−1,石油烃降解率也显著提高。王京秀等[23]利用柳枝稷与菌剂修复时,微生物数量可达2.00×106 cfu·g−1,降解率最高为73.47%。王洪[24]利用不同植物与菌剂联合后微生物数量(达8.60×108 cfu·g−1和9.70×104 cfu·g−1)与降解率也均显著提高。已有的研究[25]表明降解菌数量与降解率呈正相关。这是因为在联合修复中根际是个活跃的微观系统,可为微生物生长提供表面积,改善环境,利于微生物的生长;同时根在生长过程中,可产生一些根系分泌物[26],包括黏胶状物质、酶和裂解物[27,28],根系对环境释放有机碳,其中部分碳源在分泌作用下进入土壤[29],形成独有的根际系统,为微生物提供营养物质促进其生长发育繁殖,从而提高降解速率[30]。
一般认为用于修复的植物体内会通过一些渗透物质来防御胁迫引起的影响[31]。以往的研究表明添加细菌或丛枝菌根真菌AMF可以增强胁迫下植物的生长力和抗性。高乃媛等[32]研究表明联合修复前2个月内叶绿素含量显著提高,第3个月开始下降。豆胜才[33]研究表明苜蓿与KB1菌株进行修复时,叶绿素含量最高达2.5 mmoL·g−1。本研究通过添加降解菌后,狗牙根、高羊茅、黑麦草和苏丹草叶片叶绿素含量均有不同程度的增加,最高可达6.72 mg·g−1。在本研究中发现,高羊茅和黑麦草的大部分处理组鲜重被抑制,包括单独植物处理及添加菌处理,可能是不同植物长期受石油污染后,植物摄取的养分不足从而导致植物生物量下降。而在植物干重中,狗牙根及狗牙根添加4种菌株、苏丹草和苏丹草接种降解菌B、菌D促进积累,其余均表现抑制干重积累,该结果同雒晓芳等[34]研究结果基本一致。整体来看,植物与微生物联合修复后叶绿素含量明显提高,生物量呈不同下降,这与岳冰冰等[35]研究当含油量为5000 mg·kg−1时,叶绿素含量呈现上升,植物生物量呈现下降趋势结果相符。推测可能是不同修复植物对含油污泥污染土壤表现不同的抗性,但是当菌株分解石油烃时会分泌植物所需的营养物质,间接增强光合作用致使叶绿素含量上升[35]。当降解菌达到一定数量时,能与植物根部产生互惠作用促进微生物的繁衍[36,37],而根际微生物的生长会增强植物对污染物的降解能力,从污染物中获得植物所需养分,增加自身生物量[38-40]。
新疆属于干旱区且石油资源丰富,开采中的污染风险无法避免。本研究中狗牙根是多年生草本植物,具有耐干旱、耐污染性强的特性,接种降解菌后对石油烃降解可以得到较好的结果,可为新疆油田低浓度含油污泥处理提供可行的技术方案。
4. 结论
(1) 在4种新疆本土耐污染草本植物中,仅种植狗牙根与苏丹草对石油烃具有较好去除作用,降解率为31.39%和34.19%。
(2) 草本植物与降解菌联合后,可显著提高降解效率。其中降解率较高的是狗牙根与解脂假丝酵母菌(A)和两株枯草芽孢杆菌(B、C)的联合,降解率可达43.02%、40.20%和42.54%,高于单独种植狗牙根11.81%、8.81%和11.15%。
(3) 高效降解微生物的添加,使得狗牙根、苏丹草生物量以及狗牙根、黑麦草光合作用显著提高;降解率较高的组合,植物通过提高叶绿素含量来减轻污染胁迫对自身的伤害,促进植物生物量积累,同时增加土壤中可培养细菌和真菌的数量,从而提高了降解效果。
-
表 1 试验处理组
Table 1 Experimental treatments
处理 Treatment 处理代号 Code 备注 Notes 空白对照 Control CK 自然条件下含油污泥降解情况 微生物组 Microbial 解脂假丝酵母菌(A)、枯草芽孢杆菌(B)、枯草芽孢杆菌(C)、混菌D(A+B+C) 添加微生物对含油污泥的降解情况 植物组 Plant 狗牙根(GYG、GYG+YN)、高羊茅(GYM、GYM+YN)、黑麦草(HMC、HMC+YN)、苏丹草(SDC、SDC+YN) GYG、GYN、HMC、SDC为正常土壤条件下生长,GYG+YN、GYN+YN、HMC+YN、SDC+YN为污染土壤中生长。不同草本植物对含油污泥的降解情况。 植物-微生物组 Microbial and Plant GYG+A、GYG+B、GYG+C、GYG+D;GYM+A、GYM+B、GYM+C、GYM+D;HMC+A、HMC+B、HMC+C、HMC+D;SDC+A、SDC+B、SDC+C、SDC+D 植物微生物联合修复对石油烃降解效率 表 2 处理组中石油烃的残留量与降解率
Table 2 Residues and degradation of petroleum hydrocarbons by each treatment
处理组
Group处理
Treatment30 d 60 d 120 d 残留量
Residual amount/g降解率
Degradation rate/%残留量
Residual amount/g降解率
Degradation rate/%残留量
Residual amount/g降解率
Degradation rate/%对照组
Control groupCK 5.71±0.09 ab 8.13±1.62 h 5.20±0.15 a 16.53±2.41 f 4.85±0.05 a 22.15±0.80 k 植物组
Plant groupGYG+YN 5.38±0.23 bcdef 13.72±3.62 efgh 4.33±0.30 efj 30.57±6.02 ab 4.27±0.13 bcdefgh 31.39±2.01 defghi GYM+YN 5.35±0.45 bcdef 13.86±3.62 efgh 4.52±0.13 defg 27.37±2.01 abc 4.45±0.15 bcde 28.57±2.41 ghij HMC+YN 5.30±0.10 bcdefg 14.93±1.61 defgh 4.50±0.05 defg 27.77±0.80 abc 4.35±0.15 cdefg 30.18±2.41 e SDC+YN 4.70±0.05 ghij 24.56±0.80 abc 4.20±0.18 fg 32.58±1.61 a 4.10±0.05 ghi 34.19±0.80 cde 微生物
Microbial groupA 5.25±0.30 bcdefgh 15.73±4.82 defgh 4.63±0.03 cdef 25.75±0.40 abcd 4.27±0.03 ghi 31.39±0.40 defghi B 5.15±0.20 bcdefghi 17.34±3.21 cedfg 4.53±0.03 defg 25.38±3.08 abc 4.10±0.05 ghi 33.71±1.05 cdef C 4.67±0.48 hij 24.97±7.62 abc 4.87±0.28 abcd 21.76±4.41 cdef 4.15±0.20 efghi 33.39±3.21 cdefg D 5.65±0.45 abc 9.31±7.22 gh 4.97±0.08 abc 20.15±0.41 def 4.67±0.28 ab 25.01±5.67 jk 植物—微生物
Microbial and PlantGYG+A 5.40±0.10 bcde 13.32±1.61 efgh 4.22±0.08 fg 32.19±1.21 a 3.55±0.05 k 43.02±0.80 a GYG+B 4.90±0.25 efghij 21.62±4.42 bcde 4.33±0.03 efg 30.57±0.40 ab 3.73±0.08 jk 40.20±1.21 ab GYG+C 5.00±0.30 defghi 19.74±4.82 bcdef 4.35±0.10 efg 30.18±1.61 ab 3.58±0.35 k 42.54±5.22 a GYG+D 4.92±0.28 defghij 20.96±4.42 bcde 5.10±0.15 ab 18.41±2.02 ef 3.95±0.35 ij 36.60±5.62 bc GYM+A 4.75±0.39 defghi 19.32±4.42 bcdef 4.60±0.18 cdef 26.16±3.21 abcd 4.25±0.10 defghi 32.05±2.02 cdefgh GYM+B 4.33±0.13 j 30.57±2.01 a 4.37±0.03 efg 29.78±0.41 ab 4.45±0.10 bcde 28.57±1.61 ghij GYM+C 4.59±0.53 fghij 23.15±3.27 abcd 4.40±0.10 efg 29.78±13.65 ab 4.43±0.16 cdefg 28.96±2.81 fghig GYM+D 5.52±0.10 abcd 11.33±5.70 fgh 5.12±0.08 ab 17.74±1.21ef 4.43±0.08 cdefg 28.97±1.21 fghig HMC+A 5.40±0.33 a 13.37±5.70 efgh 4.33±0.08 efg 30.57±1.21ab 4.20±0.10 defghi 32.58±1.61 cdefgh HMC+B 4.88±0.03 efghij 21.74±0.400 bcde 4.33±0.08 g 29.89±0.54 ab 3.77±0.35 efghi 32.99±0.40 cdefgh HMC+C 4.80±0.15 fghij 23.33±0.41 abcd 4.72±0.28 bcde 24.16±4.42 bcde 4.55±0.10 bc 26.97±1.61 ij HMC+D 5.26±0.73 bcdef 15.69±12.04 defgh 4.52±0.13 defg 27.37±2.01 abc 4.48±0.03 bcd 28.16±0.40 hij SDC +A 5.35±0.50 bcdef 14.13±0.81 edfgh 4.52±0.18 defg 27.38±2.81 abc 3.97±0.03 hij 36.20±0.41 bcd SDC +B 4.33±0.08 j 30.57±1.21 a 4.27±0.03 fg 31.39±0.40 a 4.13±0.08 fghi 33.94±0.98 cde SDC +C 5.10±0.05 cdefghi 18.14±0.80 cedf 4.98±0.18 abc 20.14±2.81 def 4.03±0.18 hi 35.38±2.81 cd SDC +D 4.55±0.15 ig 26.97±2.41 ab 4.55±0.05 defg 26.97±0.81 abcd 4.18±0.03 defghi 32.98±0.41 cdefgh 不同小写字母表示不同处理间差异显著(P<0.05)。表3同。
Different lowercase letters represent significant difference among groups (P<0.05). Same for Table 3.表 3 不同处理土壤中微生物数量
Table 3 Microbial loads in sludge by treatments
处理组
Group处理
Treatment细菌
Bacteria/
(×105 cfu·g−1)真菌
Fungus
(×104 cfu·g−1)对照组 Control group CK 0.08±0.01 i 0.67±0.06 i 植物组 Plant group GYG+YN 1.33±0.10 ef 3.58±0.38 efg GYM+YN 1.09±0.02 g 0.33±0.39 fgh HMC+YN 1.12±0.13 g 0.35±0.20 efg SDC+YN 0.48±0.04 h 2.02±0.28 k 微生物 Microbial group A 1.19±0.04 fg 4.78±0.39 b B 0.96±0.07 g 3.43±0.21 efgh C 1.02±0.07 g 4.13±0.24 bcde D 0.65±0.06 g 2.95±0.38 ghi 植物-微生物
Microbial and plantGYG+A 1.79±0.06 b 5.53±0.58 a GYG+B 1.50±0.07 cde 4.32±0.55 bcd GYG+C 2.59±0.12 a 4.40±0.36 bc GYG+D 1.91±0.08 b 2.00±0.41 k GYM+A 1.45±0.09 cde 4.03±0.43 cde GYM+B 1.39±0.20 de 3.53±0.43 efg GYM+C 1.33±0.09 ef 3.07±0.49 fgh GYM+D 1.32±0.11 ef 3.25±0.03 fgh HMC+A 1.47±0.13 cde 3.67±0.33 def HMC+B 1.61±0.09 c 4.08±0.19 cde HMC+C 1.12±0.27 g 2.75±0.48 hig HMC+D 1.56±0.13 cd 2.30±0.33 igk SDC+A 1.51±0.09 cde 3.15±0.40 fgh SDC+B 1.32±0.10 ef 2.80±0.35 hig SDC+C 1.37±0.07 def 3.50±0.23 efg SDC+D 1.12±0.08 g 2.15±0.26 jk -
[1] 包清华, 黄立信, 修建龙, 等. 油气田含油污泥生物处理技术研究进展 [J]. 化工进展, 2021, 40(5):2762−2773. DOI: 10.16085/j.issn.1000-6613.2020-1299 BAO Q H, HUANG L X, XIU J L, et al. Development in the biological treatment of oily sludge in oil and gas fields [J]. Chemical Industry and Engineering Progress, 2021, 40(5): 2762−2773.(in Chinese) DOI: 10.16085/j.issn.1000-6613.2020-1299
[2] 郭盼, 刘正宁, 李阳, 等. 浅析含油污泥处理技术 [J]. 东方电气评论, 2019, 33(3):6−9. DOI: 10.3969/j.issn.1001-9006.2019.03.002 GUO P, LIU Z N, LI Y, et al. Analysis on oily sludge treatment technology [J]. Dongfang Electric Review, 2019, 33(3): 6−9.(in Chinese) DOI: 10.3969/j.issn.1001-9006.2019.03.002
[3] 梁宏宝, 张全娟, 陈洪涛, 等. 含油污泥联合处理技术的应用现状与展望 [J]. 环境工程技术学报, 2020, 10(1):118−125. DOI: 10.12153/j.issn.1674-991X.20190065 LIANG H B, ZHANG Q J, CHEN H T, et al. Application status and prospect of combined treatment technology for oily sludge [J]. Journal of Environmental Engineering Technology, 2020, 10(1): 118−125.(in Chinese) DOI: 10.12153/j.issn.1674-991X.20190065
[4] 新疆维吾尔自治区质量监督局. 新疆油气田含油污泥及钻井固体废物处理处置技术规范: DB 65/T 3999 -2017[S]. 新疆: 2017. [5] HU G J, LI J B, ZENG G M. Recent development in the treatment of oily sludge from petroleum industry: A review [J]. Journal of Hazardous Materials, 2013, 261: 470−490. DOI: 10.1016/j.jhazmat.2013.07.069
[6] 李俊生, 肖能文. 陆地石油开采生态风险评估的技术研究[M]. 北京: 中国环境出版社, 2013. [7] 马强, 张旭红, 林爱军, 等. 土壤石油烃污染的植物毒性及植物-微生物联合降解 [J]. 环境工程学报, 2009, 3(3):544−548. MA Q, ZHANG X H, LIN A J, et al. Phytoxicity and biodegradation of petroleum hydrocarbon contamination in soil [J]. Chinese Journal of Environmental Engineering, 2009, 3(3): 544−548.(in Chinese)
[8] 王丽萍, 朱新萍, 董双快, 等. 苏丹草与紫花苜蓿对新疆原油污染土壤的响应 [J]. 环境工程, 2016, 34(11):145−149. WANG L P, ZHU X P, DONG S K, et al. Response of sorghum sudanense and Medicago sativa growing on soil contaminated with crude oil in Xinjiang [J]. Environmental Engineering, 2016, 34(11): 145−149.(in Chinese)
[9] 郭鹏, 李汉周, 刘松林, 等. 油田含油污泥土壤降解与修复试验研究 [J]. 石油与天然气化工, 2019, 48(6):105−110. DOI: 10.3969/j.issn.1007-3426.2019.06.021 GUO P, LI H Z, LIU S L, et al. Study on degradation and rehabilitation of oily sludge soil in oil field [J]. Chemical Engineering of Oil & Gas, 2019, 48(6): 105−110.(in Chinese) DOI: 10.3969/j.issn.1007-3426.2019.06.021
[10] 史德青, 张建, 祝威, 等. 胜利油田含油污泥的植物修复研究 [J]. 环境污染与防治, 2008, 30(8):52−55. DOI: 10.3969/j.issn.1001-3865.2008.08.014 SHI D Q, ZHANG J, ZHU W, et al. Phytoremediation of oily sludge of shengli oilfield [J]. Environmental Pollution & Control, 2008, 30(8): 52−55.(in Chinese) DOI: 10.3969/j.issn.1001-3865.2008.08.014
[11] 李文娆, 李小利, 张晓, 等. 甜高粱/紫花苜蓿对石油污染土壤的光合适应性研究 [J]. 河南大学学报(自然科学版), 2015, 45(3):327−333. LI W R, LI X L, ZHANG X, et al. Photosynthetic adaptability of sweet Sorghum and alfalfa to crude oil-polluted soils [J]. Journal of Henan University (Natural Science), 2015, 45(3): 327−333.(in Chinese)
[12] ALI M H, KHAN M I, BASHIR S, et al. Biochar and Bacillus sp. MN54 assisted phytoremediation of diesel and plant growth promotion of maize in hydrocarbons contaminated soil [J]. Agronomy, 2021, 11(9): 1795. DOI: 10.3390/agronomy11091795
[13] ZHOU Q X, CAI Z, ZHANG Z N, et al. Ecological remediation of hydrocarbon contaminated soils with weed plant [J]. Journal of Resources and Ecology, 2011, 2(2): 97−105.
[14] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. [15] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007. [16] 王如刚, 王敏, 牛晓伟, 等. 超声-索氏萃取-重量法测定土壤中总石油烃含量 [J]. 分析化学, 2010, 38(3):417−420. WANG R G, WANG M, NIU X W, et al. Determination of total petroleum hydrocarbons content in soil by ultrasonic-soxhlet extraction-gravimetric analysis [J]. Chinese Journal of Analytical Chemistry, 2010, 38(3): 417−420.(in Chinese)
[17] 赵媛媛, 张万坤, 马慧, 等. 降解菌ZQ5与紫茉莉对芘污染土壤的联合修复 [J]. 环境工程学报, 2013, 7(7):2752−2756. ZHAO Y Y, ZHANG W K, MA H, et al. Microbial-phytoremediation of pyrene contaminated soil using pyrene-degrading strain ZQ5 with Mirabilis Jalapa [J]. Chinese Journal of Environmental Engineering, 2013, 7(7): 2752−2756.(in Chinese)
[18] 刘永军, 曹中利, 贾海燕, 等. 黑麦草-不动杆菌组合体系对石油污染土壤的生物强化修复 [J]. 化工环保, 2018, 38(1):101−105. DOI: 10.3969/j.issn.1006-1878.2018.01.018 LIU Y J, CAO Z L, JIA H Y, et al. Enhanced bioremediation of petroleum-contaminated soil using ryegrass-acinetobacter combination system [J]. Environmental Protection of Chemical Industry, 2018, 38(1): 101−105.(in Chinese) DOI: 10.3969/j.issn.1006-1878.2018.01.018
[19] 欧阳威, 刘红, 于勇勇, 等. 高羊茅对微生物强化修复石油污染土壤影响的研究 [J]. 环境污染治理技术与设备, 2006(1):94−97. OUYANG W, LIU H, YU Y Y, et al. The combined effects of tall fescue(Festuca arundinace) phyto-remediation and bio-augmentation on treatment of oil-contaminated soil [J]. Techniques and Equipment for Environmental Pollution Control, 2006(1): 94−97.(in Chinese)
[20] HOU J Y, LIU W X, WANG B B, et al. PGPR enhanced phytoremediation of petroleum contaminated soil and rhizosphere microbial community response [J]. Chemosphere, 2015, 138: 592−598. DOI: 10.1016/j.chemosphere.2015.07.025
[21] GLICK B R. Using soil bacteria to facilitate phytoremediation [J]. Biotechnology Advances, 2010, 28(3): 367−374. DOI: 10.1016/j.biotechadv.2010.02.001
[22] 胥九兵, 迟建国, 邱维忠, 等. 石油降解菌剂的研制及其在石油污染土壤修复中的应用 [J]. 生物加工过程, 2009, 7(6):21−24. DOI: 10.3969/j.issn.1762-3678.2009.06.004 XU J B, CHI J G, QIU W Z, et al. Application of bacterial agent capable of degrading petroleum for remediation of oil-contaminated soil [J]. Chinese Journal of Bioprocess Engineering, 2009, 7(6): 21−24.(in Chinese) DOI: 10.3969/j.issn.1762-3678.2009.06.004
[23] 王京秀, 张志勇, 万云洋, 等. 植物-微生物联合修复石油污染土壤的实验研究 [J]. 环境工程学报, 2014, 8(8):3454−3460. WANG J X, ZHANG Z Y, WAN Y Y, et al. Experimental study on plant-microbial remediation of oil-contaminated soil [J]. Chinese Journal of Environmental Engineering, 2014, 8(8): 3454−3460.(in Chinese)
[24] 王洪. 多环芳烃污染农田土壤原位生物修复技术研究[D]. 沈阳: 东北大学, 2011. WANG H. Research on In-situ bioremediation for farm soil contaminated with polycyclic aromatic hydrocarbons[D]. Shenyang: Northeastern University, 2011. (in Chinese)
[25] 刘魏魏, 尹睿, 林先贵, 等. 生物表面活性剂-微生物强化紫花苜蓿修复多环芳烃污染土壤 [J]. 环境科学, 2010, 31(4):1079−1084. LIU W W, YIN R, LIN X G, et al. Interaction of biosurfactant-microorganism to enhance phytoremediation of aged polycyclic aromatic hydrocarbons (PAHs) contaminated soils with alfalfa (Medicago sativa L. ) [J]. Environmental Science, 2010, 31(4): 1079−1084.(in Chinese)
[26] 旷远文, 温达志, 钟传文, 等. 根系分泌物及其在植物修复中的作用 [J]. 植物生态学报, 2003, 27(5):709−717. DOI: 10.3321/j.issn:1005-264X.2003.05.020 KUANG Y W, WEN D Z, ZHONG C W, et al. Root exudates and their roles in phytoremediation [J]. Acta Phytoecologica Sinica, 2003, 27(5): 709−717.(in Chinese) DOI: 10.3321/j.issn:1005-264X.2003.05.020
[27] JONES D L, DARRAH P R. Role of root derived organic acids in the mobilization of nutrients from the rhizosphere [J]. Plant and Soil, 1994, 166(2): 247−257. DOI: 10.1007/BF00008338
[28] MARSCHNER H, ROMHELD V, CAKMAK I. Root-induced changes of nutrient availability in the rhizosphere [J]. Journal of Plant Nutrition, 1987, 10(9): 1175−1184. DOI: 10.1080/01904168709363645
[29] LYNCH J M, WHIPPS J M. Substrate flow in the rhizosphere [J]. Plant and Soil, 1990, 129(1): 1−10. DOI: 10.1007/BF00011685
[30] YANG C H, CROWLEY D E. Rhizosphere microbial community structure in relation to root location and plant iron nutritional status [J]. Applied and Environmental Microbiology, 2000, 66(1): 345−351. DOI: 10.1128/AEM.66.1.345-351.2000
[31] 王丽丽, 杨谦. 接种枯草芽孢杆菌和丛枝菌根真菌促进红三叶修复石油污染土壤 [J]. 江苏农业科学, 2016, 44(5):526−529. WANG L L, YANG Q. Inoculating Bacillus subtilis and arbuscular mycorrhizal fungi to promote remediation of oil contaminated soil by Trifolium repens [J]. Jiangsu Agricultural Sciences, 2016, 44(5): 526−529.(in Chinese)
[32] 高乃媛, 刘宪斌, 赵兴茹. 石油烃对翅碱蓬生理特性的影响及植物-微生物联合降解 [J]. 环境工程学报, 2013, 7(4):1578−1582. GAO N Y, LIU X B, ZHAO X R. Influence of oil in soil on growth and physiological indexes of Suaeda heteroptera and plant-microbial remediation [J]. Chinese Journal of Environmental Engineering, 2013, 7(4): 1578−1582.(in Chinese)
[33] 豆胜才. 红平红球菌KB1协同苜蓿降解石油烃的生态学效应[D]. 兰州: 兰州理工大学, 2020. DOU S C. Ecological effect of Rhodococcus erythropolis Kb1 on alfalfa degradation of petroleum hydrocarbons[D]. Lanzhou: Lanzhou University of Technology, 2020. (in Chinese)
[34] 雒晓芳, 陈丽华, 王冬梅, 等. 不同石油浓度对两种作物生理生化的影响 [J]. 生物技术通报, 2016, 32(10):135−140. LUO X F, CHEN L H, WANG D M, et al. The influence for two corps physiological index by the different petroleum density [J]. Biotechnology Bulletin, 2016, 32(10): 135−140.(in Chinese)
[35] 岳冰冰, 李鑫, 任芳菲, 等. 石油污染对紫花苜蓿部分生理指标的影响 [J]. 草业科学, 2011, 28(2):236−240. DOI: 10.3969/j.issn.1001-0629.2011.02.013 YUE B B, LI X, REN F F, et al. Effects of petroleum contamination on some of physiological indexes of alfalfa [J]. Pratacultural Science, 2011, 28(2): 236−240.(in Chinese) DOI: 10.3969/j.issn.1001-0629.2011.02.013
[36] HO C H, BANKS M K. Degradation of polycyclic aromatic hydrocarbons in the rhizosphere of Festuca arundinacea and associated microbial community changes [J]. Bioremediation Journal, 2006, 10(3): 93−104. DOI: 10.1080/10889860600939609
[37] BINET P, PORTAL J M, LEYVAL C. Dissipation of 3-6-ring polycyclic aromatic hydrocarbons in the rhizosphere of ryegrass [J]. Soil Biology and Biochemistry, 2000, 32(14): 2011−2017. DOI: 10.1016/S0038-0717(00)00100-0
[38] ASLANTAŞ R, ÇAKMAKÇI R, ŞAHIN F. Effect of plant growth promoting rhizobacteria on young apple tree growth and fruit yield under orchard conditions [J]. Scientia Horticulturae, 2007, 111(4): 371−377. DOI: 10.1016/j.scienta.2006.12.016
[39] RYU C M, HU C H, LOCY R D, et al. Study of mechanisms for plant growth promotion elicited by rhizobacteria in Arabidopsis thaliana [J]. Plant and Soil, 2005, 268(1): 285−292. DOI: 10.1007/s11104-004-0301-9
[40] BELIMOV A A, DODD I C, HONTZEAS N, et al. Rhizosphere bacteria containing 1-aminocyclopropane-1-carboxylate deaminase increase yield of plants grown in drying soil via both local and systemic hormone signalling [J]. New Phytologist, 2009, 181(2): 413−423. DOI: 10.1111/j.1469-8137.2008.02657.x
-
期刊类型引用(0)
其他类型引用(2)




 下载:
下载: