Optimization of Bacillus velezensis FJ17-4 Fermentation
-
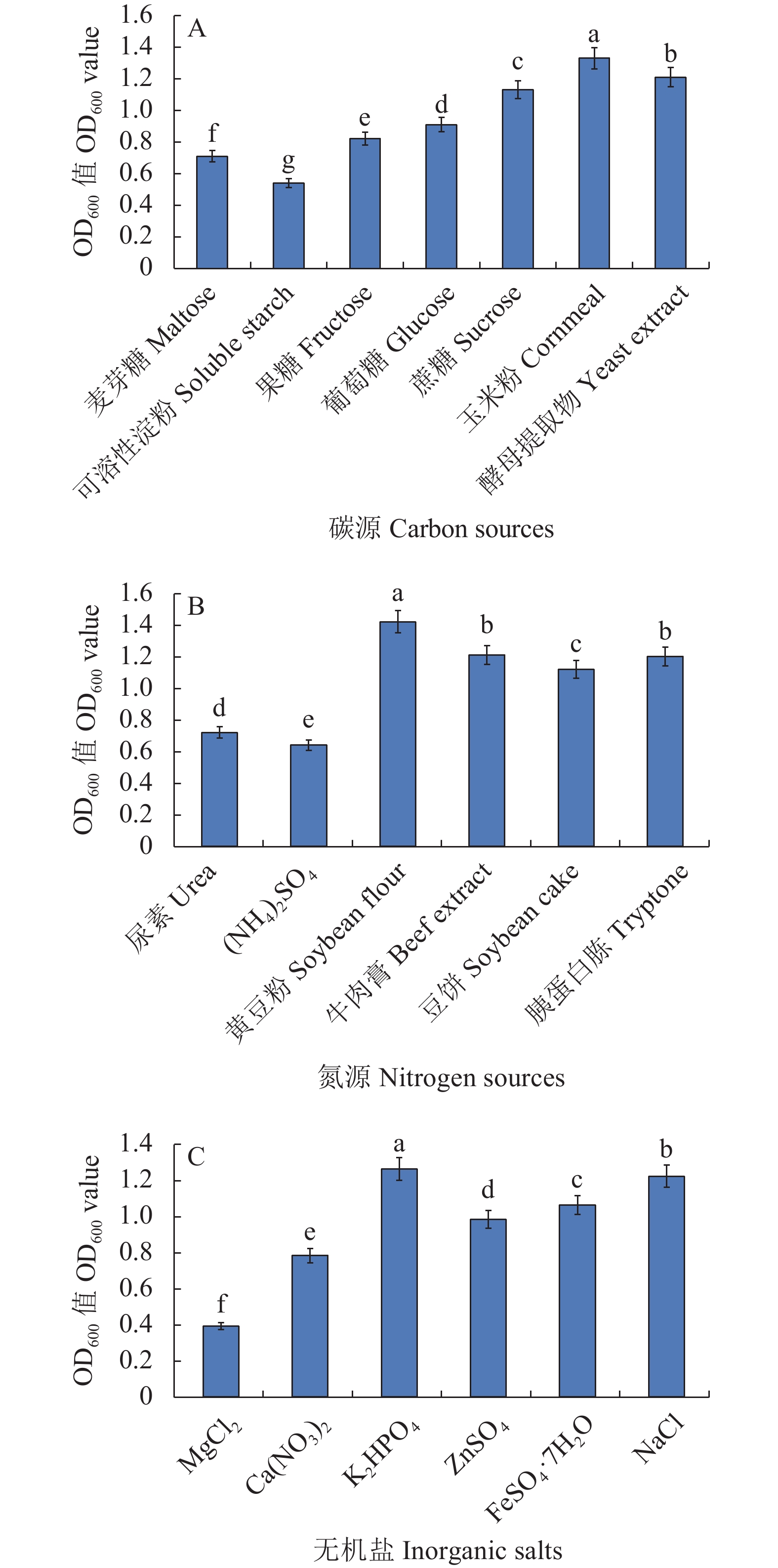
摘要:目的 贝莱斯芽孢杆菌FJ17-4对许多病原菌具有较强的抑制作用,为提高其生防作用,开展FJ17-4发酵技术研究。方法 以发酵液的OD600值为评估指标,采用单因素和正交试验方法对发酵培养基和发酵条件进行筛选和优化,获得最佳发酵培养基和发酵条件后,进一步对优化后发酵液的菌体数、病原菌抑制率和室内盆栽防治效果进行测定和分析。结果 菌株FJ17-4的最佳培养基配方为黄豆粉12.5 g·L−1、玉米粉5.0 g·L−1、K2HPO4 12.5 g·L−1,最佳发酵条件为:初始pH 7.0,培养温度30 ℃,装液量20% (50 mL/250 mL),接种量12.5%,转速180 r·min−1,发酵培养时间40 h。优化后发酵液的OD600值和菌体数量分别为1.52×1010、1.03×1010 cfu·mL−1,比优化前分别提高了25.62%和21.95%。50倍优化发酵液对病原菌菌丝生长抑制率和室内盆栽防治效果分别为42.35%和 72.14%,比优化前分别提高了56.38%和13.46%。结论 优化后发酵培养基和发酵条件有效提高菌株FJ17-4的发酵效果,降低了发酵成本,研究结果为贝莱斯芽孢杆菌FJ17-4的开发和工业化生产及应用提供了理论依据。Abstract:Objective Fermentation of Bacillus velezensis FJ17-4 known with a high inhibitory activity against several pathogens was optimized for potential application as a biocontrol agent.Methods Spectrometric measurement at OD600 of the fermentation broth was used as the index for evaluation. Culture medium and conditions were optimized by single factor and orthogonal experiments. Bacterial quantity, pathogenic inhibition, and indoor potted control effect of the optimized fermentation product were determined.Results The optimized FJ17-4 fermentation used a medium that consisted of 12.5 g·L−1 soybean meal, 5.0 g·L−1 corn flour, and 12.5 g·L−1 potassium dihydrogen phosphate at an initial pH of 7.0 to ferment a liquid loading (medium volume) of 50 mL with an inoculum size of 12.5% for 40 h at 30 ℃ in a 250 mL flask that rotated at a constant speed of 180 r·min−1. The OD600 of the optimized fermentation broth was 1.52 representing a cell load of 1.03×1010 cfu·mL−1, which were 25.62% and 21.95%, respectively, higher than those prior to the optimization. The inhibition rate on the mycelial growth of Fusarium oxysporum f. sp. cucumerinum and the indoor potted control on cucumber fusarium wilt of the 50× optimized fermentation broth were 42.35% and 72.14%, representing 56.38% and 13.46% increases, respectively, over the original.Conclusion The FJ17-4 fermentation was significantly improved by the optimization. An operational cost reduction was also achieved.
-
Keywords:
- Bacillus velezensis /
- culture medium /
- fermentation conditions /
- optimization
-
0. 引言
【研究意义】茶树[Camallia sinensis (L.) O. Kuntze]是世界上最重要的经济树种之一,广泛种植在我国热带和亚热带的酸性土壤中[1]。然而,茶树长期单一栽培和管理不当,产量大幅下降,土壤退化,对土壤微生物多样性和有益微生物产生负面影响[2-4]。土壤微生物是茶园土壤生态系统的重要组成部分和最为活跃的生物因子,直接参与凋落物分解、养分循环及吸收等土壤生态过程,对茶树的健康生长、茶叶品质,以及维持土壤生态系统功能稳定具有重要的影响[5-6]。套种大豆已成为茶园管理的一种重要复合栽培技术,明确大豆不同部位处理对茶园土壤微生物群落结构的影响,对改善茶园土壤微生物环境具有指导意义。【前人研究进展】茶园套种大豆能增加茶叶产量、改善茶叶品质,提高土壤pH值,提高土壤肥力,有效改善茶园小气候[7-9];还可以丰富土壤有益微生物群落[10]。研究表明在茶园间作大豆,土壤中真菌、细菌及放线菌的数量显著高于单作茶园,微生物种群多样性更加丰富;根际土壤酸性磷酸酶、脲酶和过氧化氢酶的活性也显著提高,主要因为间作作物根系之间相互作用,使根系分泌物增加,有机物分解和转化速度加快,从而改善茶园土壤生态环境[11]。【本研究切入点】套种大豆是因为地上部枝叶腐解增加土壤有机质含量而丰富土壤微生物,还是因为大豆地下部根瘤固氮菌释放而改变土壤微生物群落结构,目前尚不明确;大豆不同部位处理对茶园土壤微生物群落结构的影响鲜有报道。课题组前期研究发现:大豆地上部位和整株植物连续3次处理酸化茶园土壤后,土壤pH值显著增加,土壤细菌的ACE指数和Chao1指数、真菌的ACE指数显著增加[12],但是土壤中微生物的群落结构变化尚不明确。【拟解决的关键问题】本研究利用茶园土壤盆栽大豆,分别将大豆不同部位处理茶园土壤,分析茶树土壤细菌和真菌群落组成和结构差异,剖析大豆不同部位处理对茶园土壤微生物群落结构的影响,进一步为茶园间作和可持续高产提供微生物学依据。
1. 材料与方法
1.1 试验材料
供试土样采自福建省安溪县参内乡岩前茶叶基地连续种植15年茶树的茶园土壤(E25°04′28.7″,N118°15′27.4″,海拔196 m),去除表面前茬物质之后,在茶行间取0~30 cm的茶树根际土壤,充分混匀后,每个大塑料盆(27 cm×33 cm)中放入18 kg土壤作为研究对象。参照《土壤农化分析》方法[13]测定供试土壤性质:质地为红壤土,pH 4.36,有机碳1.16%,全氮0.56 g·kg−1,全磷0.27 g·kg−1,全钾5.8 g·kg−1,水解氮167.47 mg·kg−1,速效磷11.89 mg·kg−1,速效钾140.5 mg·kg−1。供试大豆品种为华夏一号,由福建农林大学根系生物学研究中心提供。
1.2 试验设计
于2017年4月1日、2017年7月1日、2018年5月7日在盆栽土壤连续3次种植大豆,在大豆灌浆初期,设置3个处理:USB(种植大豆,移除大豆地上部枝叶、只保留根系于土壤中)、ASB(未种植大豆,将USB处理的大豆地上部割下覆盖到土壤表面)、WSB(种植大豆,保留大豆根系并将大豆上部割下就地覆盖土壤表面),每个处理6盆重复;设置无种植大豆的空白对照(CK),3盆重复。前2次种植时,所有试验样品均施用42.5 g钙镁磷复合肥作为基肥(P2O5含量15%,CaO含量45%,SiO2含量20%,MgO含量12%,其他含量8%),置于福建省安溪县福建农林大学安溪茶学院(E25°04′57″,N118°13′40″,海拔65 m)室外培养,每隔5 d用自来水浇灌1次,于2018年12月31日采集土壤样品,去除表面的前茬物质,垂直采取0~15 cm深的土壤,每盆随机取5个点混匀后,装入无菌密封塑料袋中,贴上标签,立即带回实验室,用于提取土壤微生物DNA。
1.3 土壤基因组MiSeq 测序和生物信息学分析
利用试剂盒提取基因组DNA(Powersoil® DNA isolation kit)。对16S rDNA和真菌ITS区进行测序,由北京百迈客科技有限公司完成,使用Illumina(MiSeq)平台进行测序。在0.97相似度下利用QIIME (v1.8.0)软件将其聚类为用于物种分类的OTU(Operational Taxonomic Units),统计各样品OTU中的丰度信息。并计算香农指数(Shannon index),Chao1指数,谱系多样性和观察种数等多样性分析和群落结构分析。
1.4 数据处理
丰富度指数(Chao1、Ace)和α-多样性指数(Shannon、Simpson)的计算利用Mothur 1.30.1软件完成。通过RDP Classifier鉴定OTU代表性序列的微生物分类地位。不同处理的分类比较柱形图和盒型图是根据QIIME(v1.8.0)软件计算的结果用R(v3.1.1)软件绘制。采用SSPS 17.0软件进行单因素方差分析。
2. 结果与分析
2.1 不同处理后对茶园土壤微生物多样性分析
16S rDNA和ITS序列测序分析不同的大豆处理组与对照细菌和真菌样品稀释曲线均趋于平缓,表明测序趋于饱和,测序数据量渐进合理,能够相对真实地反映出土壤样品中细菌和真菌的群落组成,取样基本合理。最终得到的序列长度集中细菌在413~418 bp、真菌在248~258 bp。在97%的相似度水平下,细菌聚类得到986~1 248个OTU、真菌得到171~241个OUT,ASB、USB和WSB等3个处理组细菌的OTU数量显著高于CK组,而ASB和WSB组中真菌的OTU数量显著高于CK组。对指示群落多样性4个指数:ACE、Chao1、Simpson和Shannon指数进行组间差异性分析(表1)。结果显示,ASB、USB和WSB等3个处理组细菌和真菌的ACE指数显著高于CK组(P<0.05);同时,3个处理组细菌的Chao1指数显著高于CK组,而真菌的Chao1指数无显著性差异。处理组与对照组的细菌和真菌的Simpson指数和Shannon指数均无显著性差异。
表 1 不同处理后茶园土壤微生物Alpha多样性指数Table 1. Indices of alpha microbial diversities of tea plantation soils with different treatments on soybean plants类别
Category处理
TreatmentOTU数量
OTU countsACE指数
ACE indexChao1指数
Chao1 index辛普森多样性指数
Simpson index香农多样性指数
Shannon index细菌 Bacterium CK 985.67±132.90 b 1042.00±97.63 b 1055.43±95.03 b 0.01±0.00 a 5.71±0.18 a ASB 1247.50±21.36 a 1296.88±11.65 a 1305.34±14.97 a 0.02±0.01 a 5.58±0.23 a USB 1178.50±47.18 a 1231.65±39.31 a 1242.85±39.17 a 0.11±0.10 a 5.02±0.66 a WSB 1233.67±22.00 a 1322.35±14.42 a 1326.90±14.39 a 0.02±0.00 a 5.50±0.12 a 真菌 Fungus CK 170.67±32.52 c 185.41±40.11 b 176.25±35.13 a 0.07±0.04 a 3.61±0.43 a ASB 221.33±14.94 ab 279.63±13.94 a 251.77±13.57 a 0.06±0.01 a 3.77±0.12 a USB 180.83±10.70 bc 281.73±29.52 a 256.58±37.65 a 0.09±0.02 a 3.41±0.18 a WSB 241.33±10.56 a 263.26±9.65 a 262.41±11.21 a 0.10±0.03 a 3.40±0.18 a 数据表示重复组的平均值±标准误差。不同字母表示组间差异显著(P <0.05).
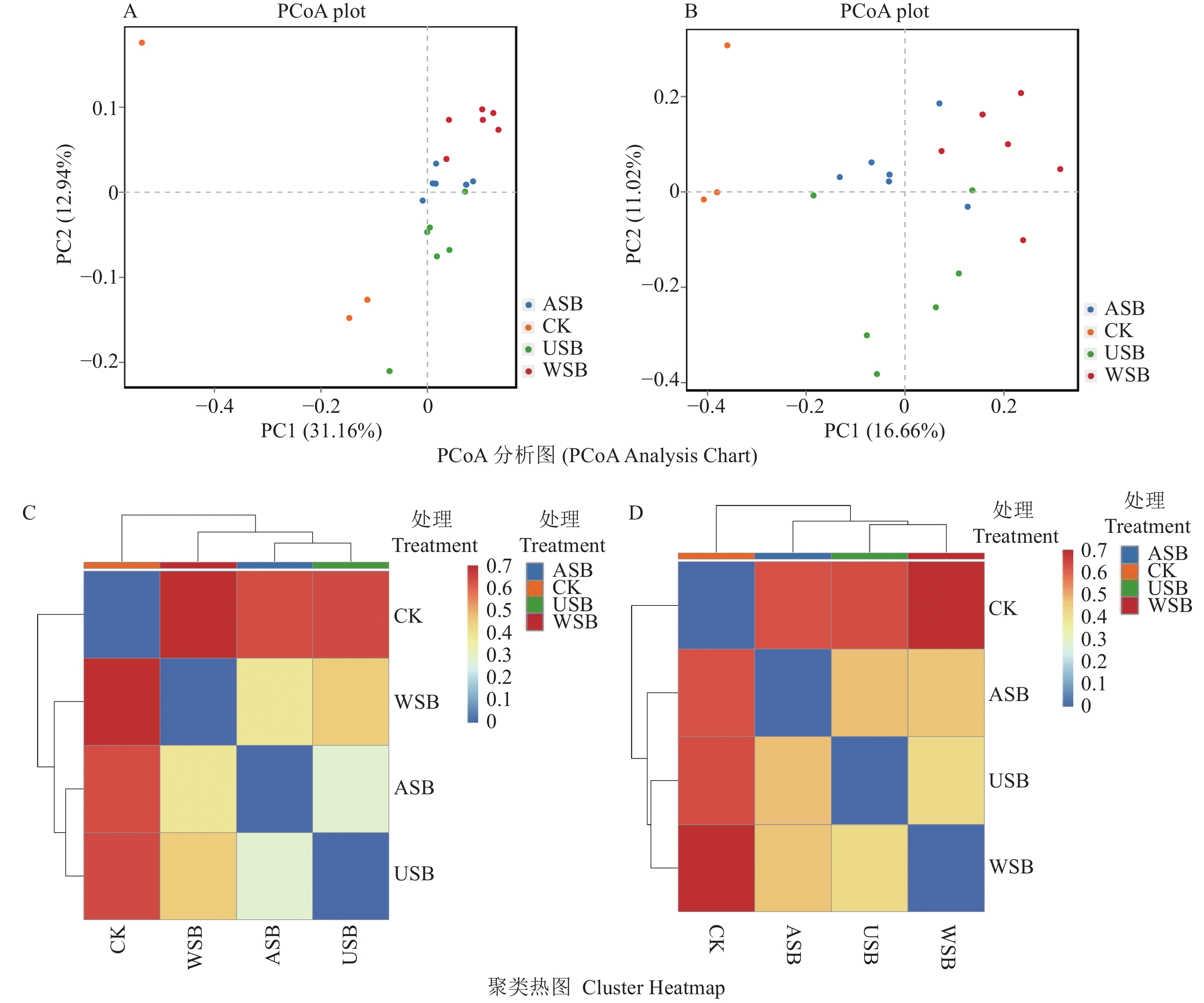
Data represent mean ± standard error of replicates. Different letters indicate significant difference between the treatments (P< 0.05).通过对Bray结果的聚类分析,可以观察样品的聚集、离散程度,样品分布点越近,说明这些样品中所含的物质组成和浓度越接近。结果显示(图1),观察样品的聚集、离散程度,其分布点越近,他们所含的物质组成和浓度越接近。2个主成分(PC1 、 PC2)表明4组的生物学重复之间具备较好的一致性(图1-A、B);经过大豆不同部位处理后,茶园土壤细菌和真菌的聚类具有相似之处,ASB、USB和WSB都聚类在一起(图1-C、D),反映茶园土壤细菌和真菌菌群的相似性高。但是细菌和真菌具有差异,其中细菌ASB和USB聚类在同一树蔟上,而真菌是以USB和WSB聚类在一起,表明细菌和真菌对于大豆处理后,茶园土壤细菌和真菌结构变化具有一定差异。
2.2 不同处理后对茶园土壤微生物物种组成分析
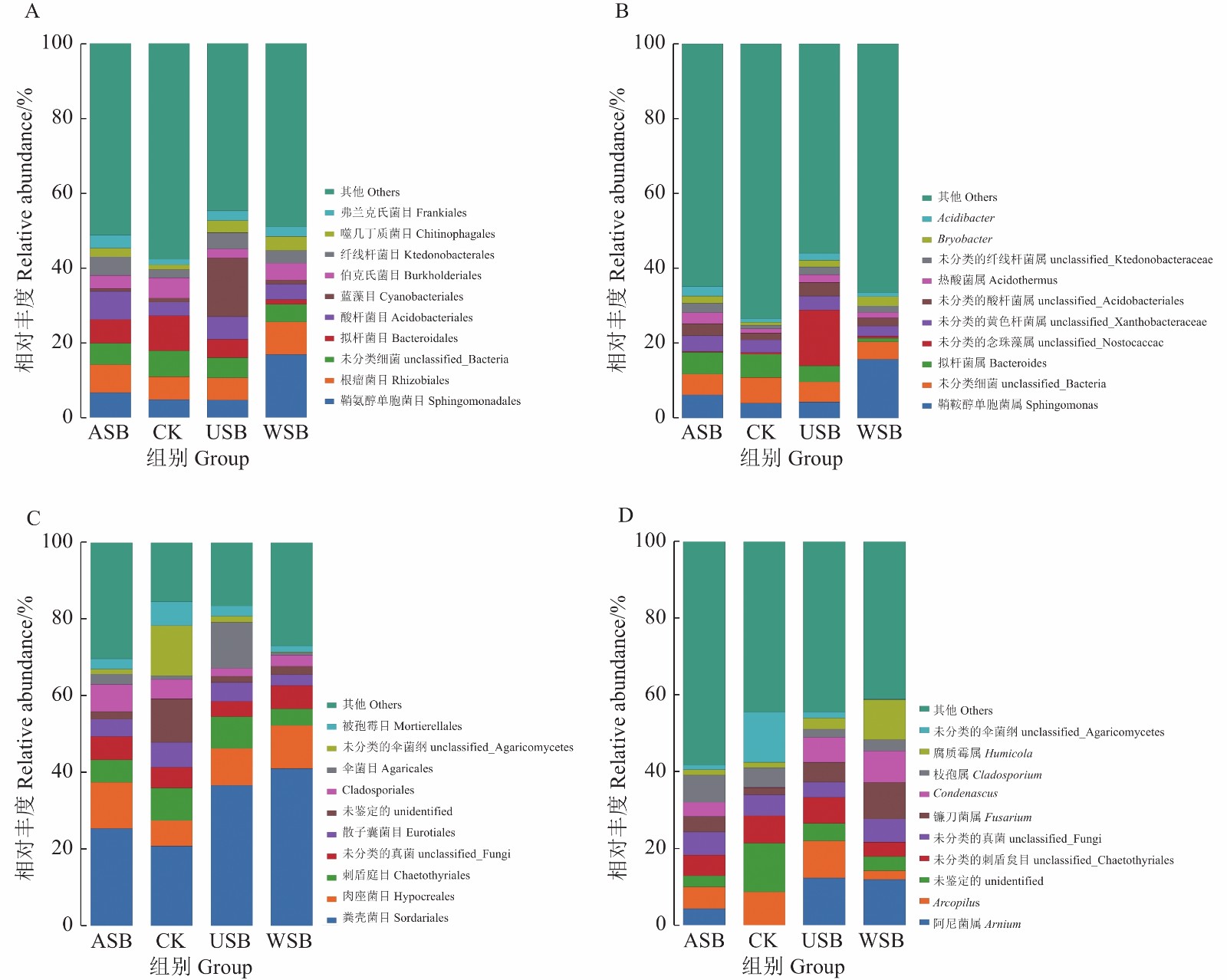
物种组成分析反映样品在不同分类学水平上的群落结构,图2分别展示目(order)水平和属(genus)水平的微生物群落结构和分类比较结果。已鉴定出细菌平均相对丰度大于2.5%的有9个目,分别为鞘氨醇单胞菌目(Sphingomonadales,8.32%)、根瘤菌目(Rhizobiales,7.06%)、拟杆菌目(Bacteroidales,5.49%)、酸杆菌目(Acidobacteriales,5.32%)、蓝藻目(Cyanobacteriales,4.62%)、伯克氏菌目(Burkholderiales,3.98%)、纤线杆菌目(Ktedonobacterales,3.77%)、噬几丁质菌目(Chitinophagales,3.77%)和弗兰克氏菌目(Frankiales,2.59%)等(图2-A)。在属水平上相对丰度大于1.5%的有5个属,其中鞘鞍醇单胞菌属(Sphingomonas,7.53%)相对含量最多、其次是拟杆菌属(Bacteroides,4.30%)、热酸菌属(Acidothermus,1.94%)、Bryobacter(1.76%)和 Acidibacter(1.60%)(图2-B)。大豆不同部位处理后的茶园土样中细菌菌群群落结构较为相似;但是其细菌的相对丰度有明显的差异,其中USB组中蓝藻目(Cyanobacteriales)相对丰度为15.65%、而WSB组中鞘氨醇单胞菌目(Sphingomonadales)相对丰度为15.69%,明显高于其他三组。
已鉴定出真菌平均相对丰度大于2.5%的有8个目,分别为粪壳菌目(Sordariales,31.06%)、肉座菌目(Hypocreales,9.87%)、刺盾炱目(Chaetothyriales,6.74%)、散子囊菌目(Eurotiales,4.67%)、Cladosporiales(4.27%)、伞菌目(Agaricales,4.09%)、 被孢霉目(Mortierellales,3.33%)和 假球壳目(Pleosporales,3.22%)(图2-C)。在属水平上相对丰度大于4.0%的有6个属,其中阿尼菌属 (Arnium, 7.21%)相对含量最多、其次是Arcopilus(6.58%)、镰刀菌属(Fusarium,5.15%)、Condenascus(4.61%)、枝孢属(Cladosporium,4.27%)、和腐质霉属 (Humicola,4.04%) (图2-D)。大豆不同部位处理后的茶园土样中真菌群落相对丰度产生明显的差异,其中阿尼菌属 (Arnium)只存在于ASB、USB和WSB组,CK处理组未发现该真菌;同时,Condenascus的相对丰度在ASB、USB和WSB组明显提高。
2.3 不同处理后组间菌种差异分析
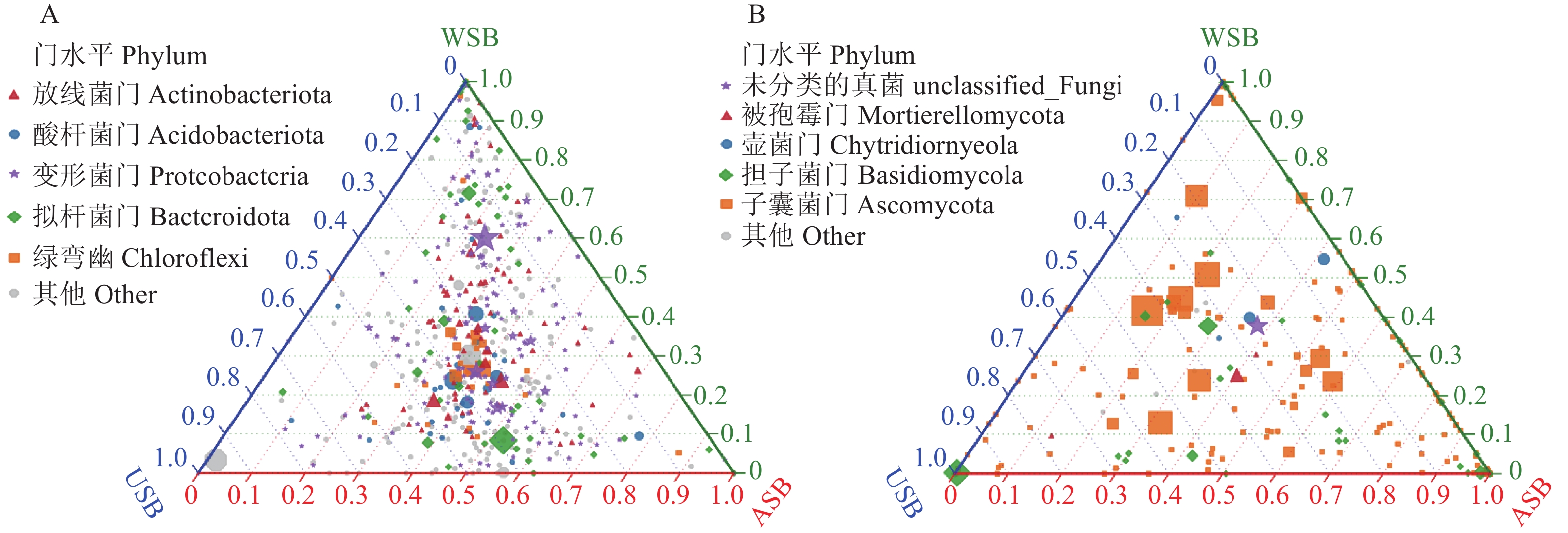
在ASB、USB和WSB三组茶园土壤中鉴定出细菌5个门、真菌4个门,在不同处理组织间微生物具备差异性。其中细菌主要集中在变形菌门(Protcobacteria)、放线菌门(Actinobacteriota)、酸杆菌门 (Acidobacteriota)、拟杆菌门(Bacteroidota)和绿弯菌门(Chloroflexi);根据三元相位图显示各个门水平下的细菌分布比较集中,主要分布在三元相位图的中间区域(图3-A),表明经3个大豆处理组处理后,对茶园土壤中细菌结构和相对丰度影响不大。同时,真菌主要集中在被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)和子囊菌门(Ascomycota),且子囊菌门(Ascomycota)相对丰度明显高于其他菌种;同时,根据三元相位图显示各个门水平下的真菌分布比较分散,各组之间的各类门水平下的真菌群落结构差异性较大(图3-B)。
![]() 图 3 3个不同处理的OTU和门水平微生物分布的三元图①A:组间的细菌菌种差异;B: 组间的真菌菌种差异;②三角形的3个角分别代表3个样品,3个样品分别用3个颜色表示,三条边用于度量相应颜色的样品的物种丰度,三角图中的圆圈代表某一门水平下包含的所有种水平的物种分类,圆圈大小代表物种的平均相对丰度。Figure 3. Ternary plot of OTU and phylum-level microbial distribution in soils under treatments①A: different bacterial strains among groups; B: different fungal strains among groups; ②3 corners in a triangle represent 3 different samples in different colors, and 3 sides signify species abundance in samples of corresponding color. Circle inside a triangle represents species classification of all species at a specified level, and size of circle signifies average relative abundance of species.
图 3 3个不同处理的OTU和门水平微生物分布的三元图①A:组间的细菌菌种差异;B: 组间的真菌菌种差异;②三角形的3个角分别代表3个样品,3个样品分别用3个颜色表示,三条边用于度量相应颜色的样品的物种丰度,三角图中的圆圈代表某一门水平下包含的所有种水平的物种分类,圆圈大小代表物种的平均相对丰度。Figure 3. Ternary plot of OTU and phylum-level microbial distribution in soils under treatments①A: different bacterial strains among groups; B: different fungal strains among groups; ②3 corners in a triangle represent 3 different samples in different colors, and 3 sides signify species abundance in samples of corresponding color. Circle inside a triangle represents species classification of all species at a specified level, and size of circle signifies average relative abundance of species.2.4 不同处理后土壤微生物菌种相关性分析
为展示不同微生物菌种之间的相关性,利用python分别构建了细菌和真菌的相关性最高的前50个属。细菌筛选出44个菌属具有一定的相关性,其中优势菌种的鞘鞍醇单胞菌属(Sphingomonas)作为相对丰度最高的菌种,其与Bryobacter菌属互为唯一的正相关性(图4-A)。同时,真菌筛选出49个菌属具有一定的相关性,其中优势菌种阿尼菌属 (Arnium)与青霉菌属(Penicillium)和unclassified_Saccharomycetales呈现出负相关性(图4-B)。
![]() 图 4 不同处理后对微生物的属水平相关性分析A:细菌属水平相关性;B: 真菌属水平相关性;圆圈代表物种,圆圈大小代表物种平均丰度大小;线条代表两物种间相关,线的粗细代表相关性的强弱;线的颜色:橙色代表正相关,绿色代表负相关。Figure 4. Correlation among microbes in soil at genus level after treatments.A: among bacteria; B: among fungi;Circle represents species and its size average abundance; line, correlation between two species and its thickness strength of correlation; orange-colored line, positive correlation; and green-colored line, negative correlation.
图 4 不同处理后对微生物的属水平相关性分析A:细菌属水平相关性;B: 真菌属水平相关性;圆圈代表物种,圆圈大小代表物种平均丰度大小;线条代表两物种间相关,线的粗细代表相关性的强弱;线的颜色:橙色代表正相关,绿色代表负相关。Figure 4. Correlation among microbes in soil at genus level after treatments.A: among bacteria; B: among fungi;Circle represents species and its size average abundance; line, correlation between two species and its thickness strength of correlation; orange-colored line, positive correlation; and green-colored line, negative correlation.3. 讨论与结论
土壤微生物在农业生态系统中发挥着至关重要的作用,在土壤营养元素循环、有机物质的形成和分解、土壤肥力的保持和提高、植物的生长发育和作物病虫害防治等方面扮演着非常重要的角色[14-15]。利用Illumina MiSeq检测微生物核酸碱基序列,分析土壤微生物OTU数量、多样性指数、均匀度指数、丰富度指数和优势度等常用来反映微生物群落的多样性,可以揭示土壤微生物种类和功能的差异[16]。在本研究中,不同大豆处理组显著提高了茶园土壤细菌的OTU数量、ACE指数和Chao1指数,分别提高了20%~26%、18%~27%、18%~26%;而ASB和WSB组中真菌的OTU数量和ACE指数显著提高,分别提高了30%~41%、42%~51%。同时,不同大豆部位处理组中土壤细菌和真菌的群落结构相似性高;但对真菌的群落相对丰度影响较大,其中子囊菌门、担子菌门、被孢霉门和壶菌门相对丰度差异明显。研究表明大豆间作可以增加土壤中的腐殖质,提高土壤有机质含量[17-18],改善土壤质量和结构,为土壤提供丰富的碳源[19],促进土壤微生物的大量繁殖,从而增加土壤微生物群落多样性、优势度及其丰富度[20]。
合理的间套作可以增加土壤细菌、放线菌等微生物数量,提高土壤微生物群落多样性和功能多样性,改善微生物群落结构茶园间作植物,如大豆、花生和板栗等,其有利于改善茶园土壤养分、茶叶品质和土壤微生态环境[21-22];特别是土壤细菌和真菌参与土壤有机质分解、营养元素形态转换以及病害防治等重要环节[23]。本研究表明,茶园土壤中有鞘氨醇单胞菌目(Sphingomonadales)、根瘤菌目(Rhizobiales)、拟杆菌目(Bacteroidales)等9个优势的细菌菌目类;粪壳菌目(Sordariales)、肉座菌目(Hypocreales)等8个真菌菌目类,大豆不同部位处理后没有显著改变茶园土壤微生物优势菌目类,这与前人研究结果相似[24-25]。茶园土壤种的优势细菌菌种为鞘鞍醇单胞菌属(Sphingomonas),有促进植物生长、降解有机质以及修复植物重金属污染的作用[26-27];其在大豆处理后相对含量均提高,且在WSB组中相对丰度为15.69%,是对照组CK相对丰度的3.63倍。同时,粪壳菌目、肉座菌目为各组土壤真菌优势菌目,其中在WSB处理组种粪壳菌目总菌群41.14%,显著高于CK组的20.90%;已有研究表明粪壳菌目、肉座菌目同时也具有降解腐烂有机质,降解纤维素的作用[28]。
本研究发现优势真菌阿尼菌属 (Arnium)只存在于大豆不同部位处理组中,在未经大豆处理的土壤中没有发现该真菌属。已有研究表明,阿尼菌属参与了水稻根系同化土壤中外源碳源作用[29],因此,通过大豆不同部位处理后,可以显著提高茶园土壤中促进土壤碳代谢有关的微生物富集,从而提高茶树土壤有机质含量。同时,对茶园土壤具有耐酸、提高茶树抗病性的镰刀菌属和青霉菌属在大豆处理后也具有较高的相对丰度[30-32]。然而发现阿尼菌属与青霉菌属呈现负相关性,这可能是由于施用大豆处理后,促进了以阿尼菌属为主的碳同化真菌的活性,从而抑制了青霉菌属真菌活性,已有研究利用13C稳定同位素标记试验证实了施用生物碳促进了关键物真菌菌种(如青霉属)与其他微生物之间的竞争作用,导致负激发效应研究具有相似之处[33]。由此可见,大豆不同部位处理改变了茶园土壤微生物优势群落结构,同时微生物群落结构的改变进一步提高了土壤的外源碳同化效应。
综上所述, 种植大豆,移除大豆地上部枝叶、只保留根系于土壤中(USB);未种植大豆,将USB处理的大豆地上部割下覆盖到土壤表面(ASB);种植大豆,保留大豆根系并将大豆上部割下就地覆盖土壤表面(WSB)处理方式对茶园土壤微生物群落结构影响不显著;3种大豆处理方式均可以显著提高土壤微生物群落多样性、丰富度,并提高茶园土壤中具有加速降解有机质、促进土壤碳代谢的微生物富集,特别是种植大豆,保留大豆根系并将大豆上部割下就地覆盖土壤表面(WSB)处理微生物富集作用更为显著,从而进一步提高茶树土壤有机质含量。
-
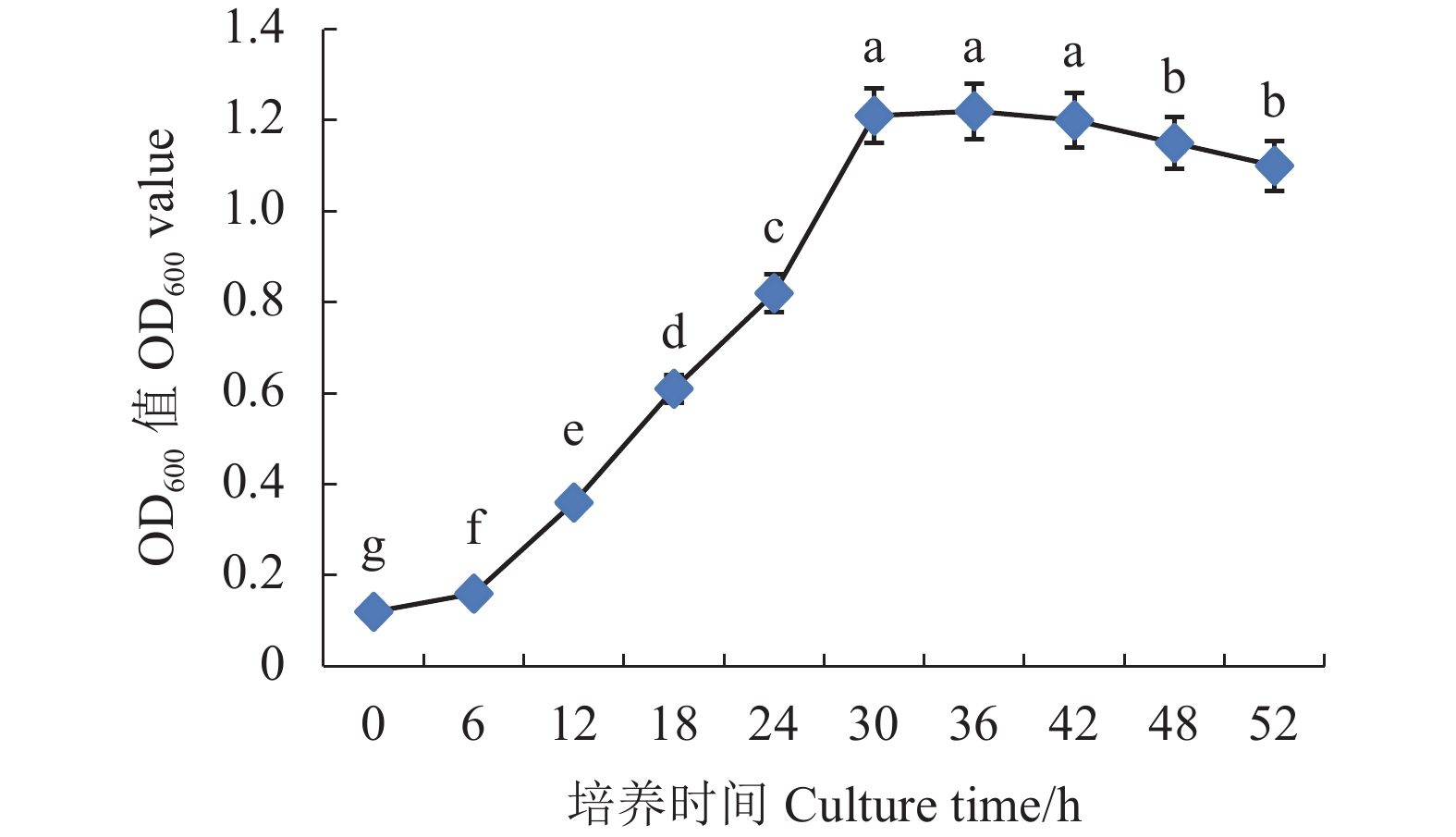
图 3 不同初始pH值、温度、接种量、装液量、转速和培养时间对菌株FJ17-4发酵的影响
A:初始pH,B:温度,C:接种量,D:装液量,E:转速,F:培养时间。
Figure 3. Effects of initial pH, temperature, inoculum concentration, liquid loading, rotating speed, and culture time on FJ17-4 fermentation
A: initial pH; B: temperature; C: inoculum size; D: liquid loading; E: rotating speed; F: culture time.
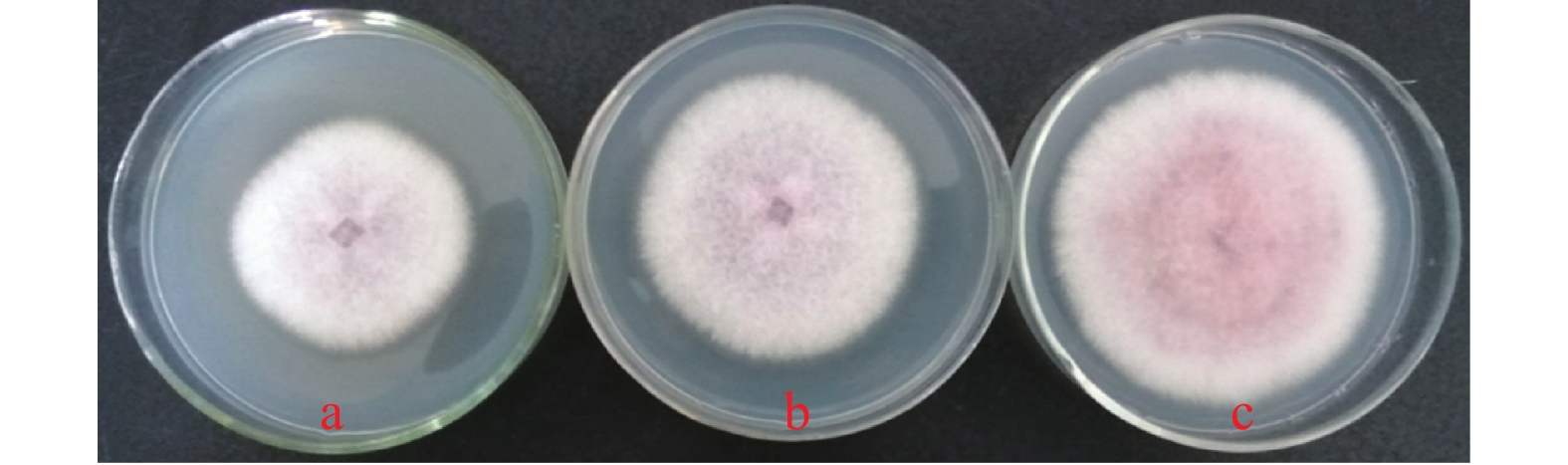
图 5 发酵液对黄瓜枯萎病的防治效果
A: 50倍优化发酵液;B:10倍优化发酵液;C:2000倍98%噁霉灵可溶粉剂;D:无菌水;E: 50倍基础培养基发酵液。
Figure 5. Control effects of fermentation broth on cucumber fusarium wilt
A: 50× optimized fermentation broth; B: 10× optimized fermentation broth; C: 2000×98% hymexazol soluble powder; D: sterile water; F: 50× original fermentation broth.
表 1 培养基组分的正交试验因素与水平
Table 1 Factors and levels of orthogonal test for culture medium formulation
水平
Level各因素含量
Content of each factor /(g·L−1)A:玉米粉
CornmealB:黄豆粉
Soybean flourC:K2HPO4 1 5.0 10.0 10.0 2 7.5 12.5 12.5 3 10.0 15.0 15.0 表 2 培养基各组分比优化的正交试验
Table 2 Orthogonal test on all factors of medium
处理
TreatmentsA:玉米粉
A: Cornmeal
/(g·L−1)B:黄豆粉
B: Soybean
flour /(g·L−1)C:K2HPO4
C: K2HPO4
/(g·L−1)OD600值
OD600
Value1 5.0 10.0 10.0 0.98±0.01 2 5.0 12.5 12.5 1.02±0.02 3 5.0 15.0 15.0 1.12±0.00 4 7.5 10.0 12.5 1.28±0.01 5 7.5 12.5 15.0 0.86±0.01 6 7.5 15.0 10.0 0.96±0.02 7 10.0 10.0 15.0 1.03±0.01 8 10.0 12.5 10.0 0.95±0.01 9 10.0 15.0 12.5 1.06±0.02 K1 3.12 3.36 2.98 K2 3.16 3.12 3.12 K3 2.86 2.99 3.05 R 0.30 0.37 0.14 重要性顺序
Order of importanceB>A>C 优水平
Optimal levelsA2 B1 C2 优组合
Optimal combinationA2 B1 C2 表 3 FJ17-4无菌滤液对黄瓜枯萎病菌菌丝生长的抑制效果
Table 3 Inhibitory effect of FJ17-4 cell-free fermentation filtrate on mycelial growth of Fusarium oxysporum f. sp. cucumerinum
处理
Treatments菌落直径
Colony
diameter/cm抑制效果
Inhibition
effect/%差异显著性
Difference significance
(P<0.05)10倍优化后无菌发酵滤液 10 times optimized sterile fermentation filtrate 4.90±0.38 42.35±2.13 a 10倍基础培养基(LB)无菌滤液 10 times sterile fermentation filtrate of basic medium (LB) 6.2±0.29 27.08±1.45 b 无菌水对照 Sterile water 8.50±0.46 / / 表 4 FJ17-4无菌滤液对黄瓜枯萎病菌分生孢子萌发的抑制效果
Table 4 Inhibitory effect of FJ17-4 cell-free fermentation filtrate on conidial germination of F. oxysporum f. sp. cucumerinum
处理
Treatments孢子萌发率
Spore germination
rate /%抑制效果
Inhibition
effect /%)差异显著性
Difference significance
(P<0.05)50倍优化后无菌发酵滤液 50 times optimized sterile fermentation filtrate 13.13±0.76 85.32±0.35 a 50倍基础培养基(LB)无菌滤液 50 times sterile fermentation filtrate of basic medium (LB) 14.82±1.03 83.43±1.44 a 100倍优化后无菌发酵滤液 100 times optimized sterile fermentation filtrate 22.14±1.41 75.26±0.24 b 100倍基础培养基(LB)无菌滤液 100 times sterile fermentation filtrate of basic medium (LB) 24.93±1.22 72.12±0.36 c 无菌水对照 Sterile water 89.42±2.43 / / 表 5 FJ17-4发酵液对黄瓜枯萎病的室内盆栽防治效果
Table 5 Control effect of FJ17-4 fermentation broth on cucumber fusarium wilt in potted experiment
处理
Treatments发病率
Incidence rate/%防治效果
Control effect /%差异显著性
Difference significance (P<0.05)10倍优化发酵液 10 times optimized fermentation broth 24.02±0.86 73.68±0.52 a 50倍优化发酵液 50 times optimized fermentation broth 24.51±1.12 72.14±0.36 b 50倍基础培养基发酵液 50 times basic medium fermentation broth 33.24±2.13 63.58±1.23 d 2000倍98%噁霉灵可溶粉剂 2000 times 98% hymexazol soluble powder 27.62±1.79 69.73±0.54 c 无菌水对照 Sterile water 91.26±3.26 / / -
[1] 黄曦, 许兰兰, 黄荣韶, 等. 枯草芽孢杆菌在抑制植物病原菌中的研究进展 [J]. 生物技术通报, 2010(1):24−29. DOI: 10.13560/j.cnki.biotech.bull.1985.2010.01.026 HUANG X, XU L L, HUANG R S, et al. Research advance in controlling plant disease by Bacillus subtilis [J]. Biotechnology Bulletin, 2010(1): 24−29.(in Chinese) DOI: 10.13560/j.cnki.biotech.bull.1985.2010.01.026
[2] KHALIL M S, HAIKAL N Z, HAFEZ E. Biological controls of cucumber wilt disease caused by Fusarium oxysporum [J]. Research Journal of Pharmaceutical Biological and Chemical Sciences, 2017, 8(6): 413−422.
[3] RUIZ-GARCÌA C, BÉJAR V, MARTINEZ-CHECA F, et al. Bacillus velezensis sp. nov. a surfactant-producing bacterium isolated from the river Vélez in Málaga, souther Spain [J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 191−195. DOI: 10.1099/ijs.0.63310-0
[4] 刘洋, 刘晓昆, 陈文浩. 贝莱斯芽孢杆菌(Bacillus velezensis)物种名称的“前世今生” [J]. 生物技术通报, 2019(7):230−232. LIU Y, LIU X K, CHEN W H. “past and present” species name of Bacillus velezensis [J]. Biotechnology Bulletin, 2019(7): 230−232.(in Chinese)
[5] 沙月霞, 隋书婷, 曾庆超, 等. 贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力 [J]. 中国农业科学, 2019(11):1908−1917. DOI: 10.3864/j.issn.0578-1752.2019.11.006 SHA Y X, SUI S T, ZENG Q C, et al. Biocontrol potential of Bacillus velezensis strain E69 against rice blast and other fungal diseases [J]. Scientia Agricultura Sinica, 2019(11): 1908−1917.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2019.11.006
[6] LUO W J, LIU L D, QI G F, et al. Embedding Bacillus velezensis NH-1 in microcapsules for biocontrol of cucumber Fusarium wilt [J]. Applied and Environmental Microbiology, 2019, 85(9): e03128−e03118.
[7] YE M, TANG X, YANG R, et al. Characteristics and application of a novel species of Bacillus: Bacillus velezensis [J]. ACS Chemical Biology, 2018, 13(3): 500−505. DOI: 10.1021/acschembio.7b00874
[8] 刘芳, 廖先清, 周荣华, 等. 响应面法优化贝莱斯芽孢杆菌CY30发酵培养基的研究 [J]. 湖北农业科学, 2019(23):91−94. DOI: 10.14088/j.cnki.issn0439-8114.2019.23.021 LIU F, LIAO X Q, ZHOU R H, et al. Study on optimization of fermentation medium of Bacillus velezensis CY30 by using response-surface method [J]. Hubei Agricultural Sciences, 2019(23): 91−94.(in Chinese) DOI: 10.14088/j.cnki.issn0439-8114.2019.23.021
[9] 杨可, 司文, 林海, 等. 利用响应面分析法优化贝莱斯芽孢杆菌TCS001的发酵条件 [J]. 农药学学报, 2019, 21(4):444−452. DOI: 10.16801/j.issn.1008-7303.2019.0066 YANG K, SI W, LIN H, et al. Fermentation condition optimization of Bacillus velezensis TCS001 using response surface methodology [J]. Chinese Journal of Pesticide Science, 2019, 21(4): 444−452.(in Chinese) DOI: 10.16801/j.issn.1008-7303.2019.0066
[10] 黎燕珊, 崔文艳, 张陈芳, 等. 抗金银花白粉病菌贝莱斯芽孢杆菌HC-8菌株培养基及发酵条件优化 [J]. 南方农业学报, 2021, 52(8):2148−2157. DOI: 10.3969/j.issn.2095-1191.2021.08.013 LI Y S, CUI W Y, ZHANG C F, et al. Optimization of culture medium and fermentation parameters of Bacillus velezensis HC-8 antagonistic to Erysiphe lonicerae [J]. Journal of Southern Agriculture, 2021, 52(8): 2148−2157.(in Chinese) DOI: 10.3969/j.issn.2095-1191.2021.08.013
[11] 张晓, 张艳军, 陈雨, 等. 嘧菌酯对番茄早疫病菌的抑制作用 [J]. 农药学学报, 2008, 10(1):41−46. DOI: 10.3321/j.issn:1008-7303.2008.01.007 ZHANG X, ZHANG Y J, CHEN Y, et al. Inhibitory effect of azoxystrobin on Alternaria solani [J]. Chinese Journal of Pesticide Science, 2008, 10(1): 41−46.(in Chinese) DOI: 10.3321/j.issn:1008-7303.2008.01.007
[12] 韦巧婕, 郑新艳, 邓开英, 等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效 [J]. 南京农业大学学报, 2013, 36(1):40−46. DOI: 10.7685/j.issn.1000-2030.2013.01.008 WEI Q J, ZHENG X Y, DENG K Y, et al. Screening and identification of antagonistic Bacillus vallismoritis B against cucumber Fusarium wilt and its biological effect [J]. Journal of Nanjing Agricultural University, 2013, 36(1): 40−46.(in Chinese) DOI: 10.7685/j.issn.1000-2030.2013.01.008
[13] 王朝恩, 刘婉慧, 陆蓝翔, 等. 短小芽孢杆菌HR10产孢培养基及发酵条件优化 [J]. 微生物学杂志, 2021, 41(2):37−45. WANG C E, LIU W H, LU L X, et al. Optimization of sporulation medium and fermentation conditions for Bacillus pumilus HR10 [J]. Journal of Microbiology, 2021, 41(2): 37−45.(in Chinese)
[14] 赵鹏鹏, 雷淑珍, 徐晓光, 等. 培养基组成对贝莱斯芽孢杆菌产抑真菌成分的影响 [J]. 食品与发酵工业, 2020, 46(5):147−151. DOI: 10.13995/j.cnki.11-1802/ts.022174 ZHAO P P, LEI S Z, XU X G, et al. Effect of medium compositions on the production of antifungalcomponents by Bacillus velezensis [J]. Food and Fermentation Industries, 2020, 46(5): 147−151.(in Chinese) DOI: 10.13995/j.cnki.11-1802/ts.022174
[15] 吴志美, 兰明先, 高熹, 等. 除草活性成团泛菌ZLSY20菌株发酵条件的优化 [J]. 南方农业学报, 2019, 50(9):1990−1997. WU Z M, LAN M X, GAO X, et al. Screening of fermentation conditions for herbicidal activity of Pantoea agglomerans strain ZLSY20 [J]. Journal of Southern Agriculture, 2019, 50(9): 1990−1997.(in Chinese)
[16] 李姝江, 王淋敏, 谯天敏, 等. 利用响应面法优化贝莱斯芽孢杆菌ZJ20发酵参数 [J]. 西北农林科技大学学报(自然科学版), 2019, 47(2):88−96. DOI: 10.13207/j.cnki.jnwafu.2019.02.011 LI S J, WANG L M, QIAO T M, et al. Optimization of Bacillus velezensis ZJ20 fermentation parameters by response surface methodology [J]. Journal of Northwest A & F University (Natural Science Edition), 2019, 47(2): 88−96.(in Chinese) DOI: 10.13207/j.cnki.jnwafu.2019.02.011
[17] YUAN Q P, WANG J D, ZHANG H, et al. Effect of temperature shift on production of xylanase by Aspergillus niger [J]. Process Biochemistry, 2005, 40(10): 3255−3257. DOI: 10.1016/j.procbio.2005.03.020
[18] 周洋子, 邱慧珍, 董莉, 等. 马铃薯疮痂病高效生防芽孢杆菌的筛选及发酵条件优化 [J]. 干旱地区农业研究, 2020, 38(5):259−267. DOI: 10.7606/j.issn.1000-7601.2020.05.36 ZHOU Y Z, QIU H Z, DONG L, et al. Screening of highly effective biocontrol Bacillus strains for potato scab and optimization of its fermentation conditions [J]. Agricultural Research in the Arid Areas, 2020, 38(5): 259−267.(in Chinese) DOI: 10.7606/j.issn.1000-7601.2020.05.36
[19] 徐世荣, 陈骧, 吴云鹏. 细菌芽孢形成机制在微生态制剂生产中的应用 [J]. 食品与生物技术学报, 2007, 26(4):121−126. DOI: 10.3321/j.issn:1673-1689.2007.04.025 XU S R, CHEN X, WU Y P. Application of the mechanism of sporulation in production of pharmaceutical probiotics [J]. Journal of Food Science and Biotechnology, 2007, 26(4): 121−126.(in Chinese) DOI: 10.3321/j.issn:1673-1689.2007.04.025
[20] CHEN F, WANG M, ZHENG Y, et al. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt by Bacillus subtilis B579 [J]. World Journal of Microbiology and Biotechnology, 2010, 26(4): 675−684. DOI: 10.1007/s11274-009-0222-0
[21] CAO Y, XU Z H, LING N, et al. Isolation and identification of lipopeptides produced by B. subtilis SQR9 for suppressing fusarium wilt of cucumber [J]. Scientia Horticulturae, 2012, 135: 32−39. DOI: 10.1016/j.scienta.2011.12.002
[22] 郑爱萍, 闫敏, 李平, 等. 黄瓜枯萎病新型抑制蛋白L37的研究 [J]. 园艺学报, 2005, 32(6):1102−1104. DOI: 10.3321/j.issn:0513-353X.2005.06.029 ZHENG A P, YAN M, LI P, et al. Research on new antagonistic protein L37 against Fusarium oxysporum [J]. Acta Horticulturae Sinica, 2005, 32(6): 1102−1104.(in Chinese) DOI: 10.3321/j.issn:0513-353X.2005.06.029
[23] 张美君, 吴庆, 尹翠, 等. 尖镰孢黄瓜专化型枯萎病菌拮抗菌的筛选、鉴定及培养条件优化 [J]. 生物技术通报, 2020, 36(9):125−136. DOI: 10.13560/j.cnki.biotech.bull.1985.2020-0578 ZHENG M J, W Q, YIN C, et al. Screening and identification of an antagonistic strain against Fusarium oxysporum f. sp. cucumerinum and optimization of culture conditions [J]. Biotechnology Bulletin, 2020, 36(9): 125−136.(in Chinese) DOI: 10.13560/j.cnki.biotech.bull.1985.2020-0578
-
期刊类型引用(0)
其他类型引用(3)




 下载:
下载: