Pathogen Identification and Biological Characterization of Camellia Petal Blight Disease
-
摘要:目的 明确山茶花腐病的致病菌及其生物学特性,提升山茶花期品质和观赏价值。方法 采用组织分离法对云南省昆明市昆明植物园山茶的花腐病进行病原菌分离,通过致病性测定、形态学和分子生物学鉴定确定病原菌,并进行生物学特性的研究。结果 从病组织中分离得到1株菌株,将其回接于健康花瓣上,接种后划破的花瓣病症较为明显,花朵失色变黄褐,严重时能使花瓣干腐或湿腐,并且长菌丝体,与田间的症状一致,符合柯赫氏法则的致病性测定。PDA培养基上菌丝偏黄,培养后期长黑色的孢子,子囊孢子柠檬状,经合并多基因(ITS、LSU、EF1)系统发育分析,其与假螺卷毛壳菌(Chaetomium pseudocochliodes)聚集在同一分支。对假螺卷毛壳菌(C. pseudocochliodes)的生物学特性研究结果显示,该病原菌的最适培养温度为25 ℃,对光照条件没有特殊要求,最适培养基为LB和OMA培养基,以牛肉膏作为氮源和以果糖作为碳源的利用率最高,致死温度为55 ℃/10 min。结论 假螺卷毛壳菌(C. pseudocochliodes)是山茶花腐病的病原菌,该病原菌的适宜温度为25 ℃,不受光照影响,培养基为LB和OMA培养基,以牛肉膏作为氮源和以果糖作为碳源的利用率最高,致死温度为55 ℃/10 min。Abstract:Objective The pathogen and its biological characteristics of camellia petal blight disease were investigated for improving the quality and protecting the ornamental value of the floral plant.Method A pathogen was isolated from of diseased Camellia japonica at the Botanical Garden in Kunming City by tissue separation method and confirmed by pathogenicity assay as well as morphological and molecular biological identifications. Biological characteristics of the isolate were studied.Result A suspected microbe was isolated from the diseased tissue and inoculated onto healthy camellia flower petals. With the appearance of yellowing and browning petals with dry or wet rots and fungal mycelial growth, the similar symptoms shown on the infected plants in the field, the isolate was studied further for a confirmed identification. On a PDA medium, the fungal colonies displayed yellow mycelia and produced black spores and lemon-like ascospores at late stage. The phylogenetic analysis of multiple genes of ITS, LSU, and EF1 clustered the isolate with Chaetomium pseudocochliodes clade. Subsequently, the optimal conditions for the growth of the isolated fungus were found to be at 25 ℃ on LB and OMA culture medium,without special requirement of light,beef paste as a nitrogen source and fructose as a carbon source have the highest utilization rates, and the lethality at 55 ℃ in 10 min.Conclusion C. pseudocochliodes was identified as the pathogen that caused floral petal blight disease on C. japonica. The pathogen grew optimally at 25 ℃ on LB and OMA culture medium ,without a specific light requirement, beef paste as a nitrogen source and fructose as a carbon source have the highest utilization rates, and it was killed by exposure to 55 ℃ for 10 min.
-
0. 引言
【研究意义】山茶花(Camellia.),常绿灌木或小乔木,为世界著名观赏花木,是中国传统名花,树形优美,花大而美丽,品种繁多,早花品种11月开花,晚花品种开花可至次年4月,观花期较长,可营造观赏专类园或在庭园绿化中起点景作用 [1-3]。山茶常见的病害有枝枯病、花腐病、炭疽病、花叶病、媒污病等[4-9],而山茶花花腐病肆虐,是全世界茶花观赏的一大难题[10],成为目前亟待解决的问题。【前人研究进展】有研究认为山茶花腐病是由山茶叶杯菌(Ciborinia camelliae)侵染所致[11-12],也有研究认为山茶花腐病是由子囊菌亚门(Ascomycotina)盘菌纲(Pezizomycetes)柔膜菌目(Helotiales)核盘菌科(Sclerotiniaceae)核盘菌属(Sclerotinia)的山茶核盘菌(Sclerotinia camelliae)和子囊菌门( Ascomycotina )锤舌菌纲(Leotiomycetes)柔膜菌目( Helotiales )核盘菌科( Sclerotiniaceae )孢盘菌属(Botryotinia)灰葡萄孢(Botrytis cinerea)侵染所致[13]。【本研究切入点】通过对昆明市主要山茶花的栽培专类园调查发现,山茶花腐病的发病情况较为严重,该病害的病原种类及其生物学特性有待深入研究。【拟解决的关键问题】采集感病山茶花,通过组织分离、柯赫氏法则验证、病原菌形态学和分子生物学,鉴定该病害的病原种类,探讨病原菌的生物学特性,为山茶花腐病的病原学研究提供依据。
1. 材料与方法
1.1 供试材料
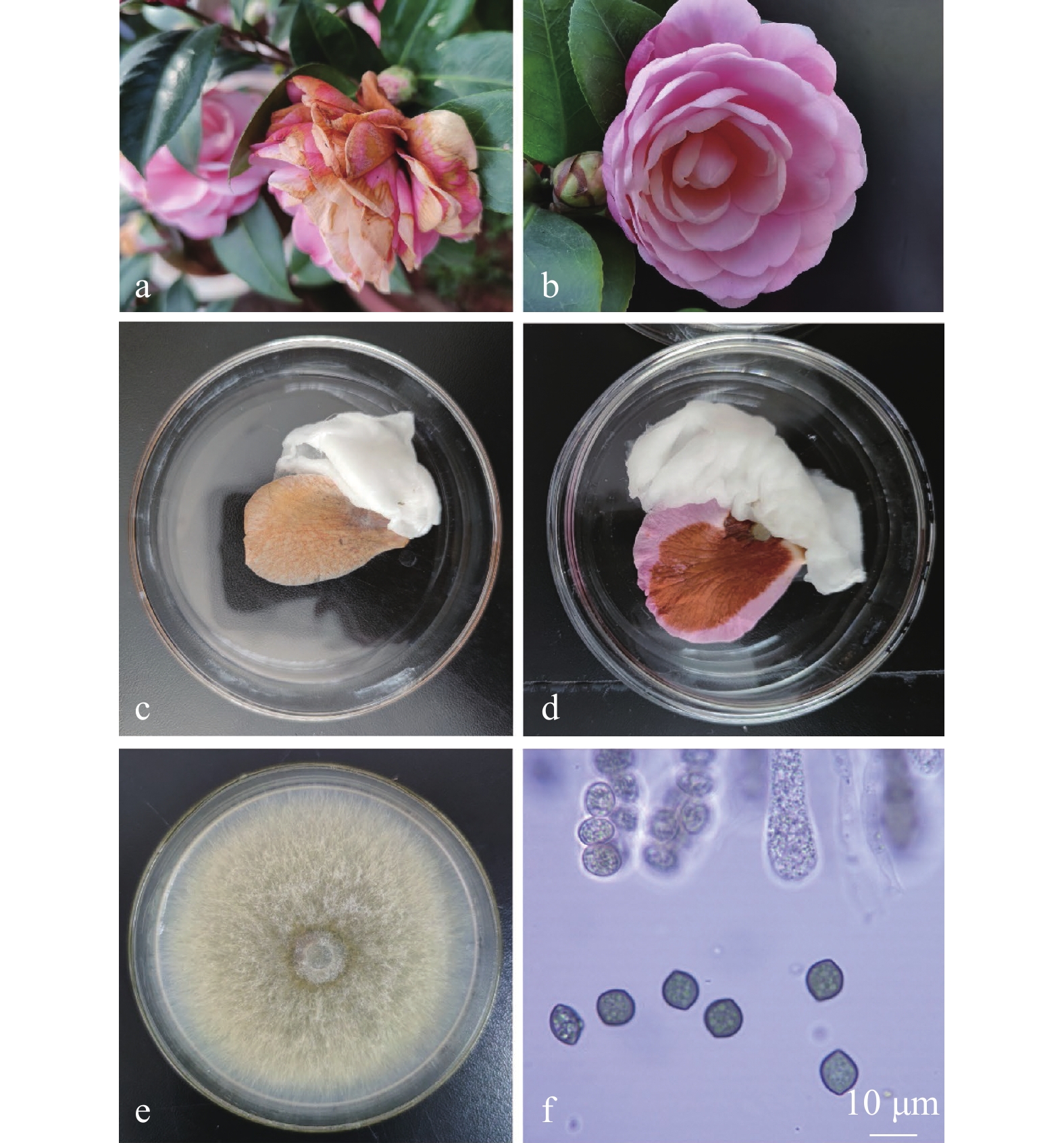
植物材料:感病的山茶品种水仙(Camellia Water Lily)于2020年12月22日采自云南省昆明植物山茶园(25°8′27.10″N, 102°45′9.59″E),病株表现为花瓣上出现不规则的小棕色斑点,在良好的温度和湿度条件下,病变迅速扩大并合并成大斑点,使整个花瓣变成棕色,甚至长出菌丝体,直至整朵花都染病并掉落(图1-a、b)。
![]() 图 1 山茶花腐病田间和接种后症状及病原菌在PDA培养基上的形态学特征a. 田间感病病花症状;b. 田间健康花;c、d. 室内离体接种后花腐症状;e. 菌落形态;f. 子囊孢子。Figure 1. Symptoms of petal blight disease on field and inoculated C. japonica and morphology of pathogen on PDAa: symptoms on field flower; b: healthy flower; c and d: symptoms on inoculated camellia flower;e: colony morphology; f: ascospores.
图 1 山茶花腐病田间和接种后症状及病原菌在PDA培养基上的形态学特征a. 田间感病病花症状;b. 田间健康花;c、d. 室内离体接种后花腐症状;e. 菌落形态;f. 子囊孢子。Figure 1. Symptoms of petal blight disease on field and inoculated C. japonica and morphology of pathogen on PDAa: symptoms on field flower; b: healthy flower; c and d: symptoms on inoculated camellia flower;e: colony morphology; f: ascospores.供试培养基:①马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂17 g,加水定容至1 000 mL;②Luria-Bertani培养基: 胰蛋白胨10 g,氯化钠5 g,酵母浸粉10 g,琼脂20 g, 加水定容至1 000 mL;③燕麦片琼脂(OMA)培养基:燕麦片30 g,琼脂17 g,加水定容至1 000 mL[14];④玉米粉琼脂(CMA)培养基:玉米粉300 g,琼脂17 g,加水定容至1 000 mL[14];⑤Czapek 培养基:硝酸钠2.0 g,磷酸氢二钾1.0 g,氯化钾0.5 g,硫酸镁(MgSO4·7H2O)0.5 g,硫酸铁(FeSO4)0.01 g,蔗糖30.0 g,琼脂17 g,加水定容至1 000 mL[14]。
1.2 病原菌的分离纯化
采用组织分离法[14],将花瓣放入75%的酒精30 s,用无菌水漂洗,再放入1%的次氯酸钠30 s,再用无菌水漂洗3次,放在灭菌滤纸上晾干,剪除花瓣上彻底病死的部分,剪取花瓣的病健交界处(5 mm × 5 mm),置于PDA表面,及时封口,并做标记。平行对照至少3组。倒置装入自封袋,再置于25 ℃的恒温培养箱中培养3~7 d,每天观察是否长出菌丝,是否污染,并拍照作好记录,待长出真菌菌丝后,进行分离纯化。
1.3 病原菌的致病性测定
在真菌菌落边缘,用5 mm打孔器打取菌饼。用无菌接种针划破山茶花瓣,在伤口上放置菌饼(气生菌丝面向伤口),以无菌PDA做空白对照,设置平行对照至少3组。接种后用沾无菌水的棉花保湿培养诱导发病。每日拍照并记录描述花朵状态[15]。
1.4 病原菌的形态学鉴定
将纯化后得到的菌株转接到PDA培养基上,于25 ℃的培养箱中培养7 d,记录菌落特征(正反面颜色、形状、质地等)。待产生孢子后,显微镜下观察产孢结构及分生孢子形状和大小,并拍照记录[16]。
1.5 病原菌的分子生物学鉴定
采用真菌基因组DNA快速抽提试剂盒进行DNA提取,利用引物ITS1和ITS4、NL1和NL4、EF1-983F和EF1-2218R(表1)进行PCR反应,分别获取内部转录间隔区(ITS)区间、核糖体大亚基(LSU)区间、延伸因子1-α(EF1)区间的DNA序列。
表 1 引物序列表Table 1. Primer sequencesPCR反应为25 μL体系,包括PCR MIX 12.5 μL,ddH2O 9.5 μL,上下游引物各1 μL,DNA模板1 μL。
扩增条件如下。ITS区间:95 ℃预变性5 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸50 s,共35个循环;最终72 ℃延伸10 min[17]。LSU区间:94 ℃预变性3 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min,共35个循环;最终72 ℃延伸10 min[18]。EF1区间:94 ℃预变性3 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸1 min,共39个循环;最终72 ℃延伸10 min[19]。
采用1.0%琼脂糖电泳检测PCR产物,并进行测序,结果进行BLAST来比对确定致病菌的种属类别。利用MEGA 6.0软件邻接法(Neighbor-joining,NJ)多基因合并构建系统发育树,确定病原菌的种类。
1.6 病原菌生物学特性的研究
1.6.1 不同温度对病原菌生长的影响
设置10、15、20、25、30、35 、40 ℃共7个不同温度处理 [20-22]。
1.6.2 不同光照对病原菌生长的影响
设置4种光照条件:光照24 h、12 h光暗交替、黑暗24 h、正常光照 [23]。
1.6.3 不同培养基对病原菌生长的影响
将菌株分别培养于马铃薯葡萄糖琼胶培养基、燕麦片琼胶培养基、玉米粉琼胶培养基和Luria-Bertani培养基上。
1.6.4 不同氮源对病原菌生长的影响
以Czapek 培养基为基础培养基,将培养基中的硝酸钠替换成等量的蛋白胨、牛肉膏、酵母膏、硝酸钾和甘氨酸,制成不同氮源的培养基,以缺氮培养基为对照(CK) [24]。
1.6.5 不同碳源对病原菌生长的影响
以Czapek 培养基为基础培养基,将培养基中的蔗糖分别替换成等量的葡萄糖、木糖、麦芽糖、阿拉伯树胶糖、果糖,制成不同碳源的培养基,以缺碳培养基为对照(CK) [24]。
1.6.6 病原菌致死温度测定
将直径5 mm的病原菌菌块放置于装有1 mL无菌水的灭菌离心管中,分别置于35~65 ℃(设置梯度5 ℃)的恒温水浴中处理10 min(先预热1 min)后取出迅速冷却 [25]。
1.6.7 数据分析
以上条件除了温度条件的梯度变化外,培养条件均为恒温恒湿25 ℃,连续观察7 d后十字交叉法测定菌落直径,各条件试验均设3个重复。利用Excel整理数据,利用SPSS 22.0软件在P = 0.05的情况下,采用Duncan’s 新复极差法进行单因素方差分析,检验数据差异显著性[26-27]。
2. 结果与分析
2.1 病原菌的致病性测定
将从昆明植物园采集的山茶品种水仙(Camellia Water Lily)样品上分离得到的3株疑似病原菌(SX-1、SX-2、SX-3)回接到健康的山茶品种八重姬(Camellia japonica Yae-hime)、明镜(C. japonica William Bartlett)、水仙,健康的云南山茶品种早桃红(C. reticulata Zaotaohong)、菊瓣(C. reticulata Juban)、妍荷(C. reticulata Yanhe)、大理茶(C. reticulata Dali Cha)的健康花瓣上,接种后3~5 d,接种SX-3的山茶品种水仙和云南山茶品种妍荷回接花瓣上均呈现病症,花瓣开始褐化,尤其是划破的花瓣病症更为明显,从伤口处向外扩展,与所采集的病症一致,分离株也与SX-3菌落形态一致,分别编为SX Ⅰ和YH Ⅰ(图1-c、d)。
2.2 病原菌的形态学鉴定
(25±1) ℃培养7 d,菌落直径为(9±1) cm,菌丝黄色,后期长黑色的孢子。子囊体表面具小孔,子囊体毛椭圆形、卵形或近球形,长270~425 μm,直径190~370 μm,在反射光下呈柠檬绿到柠檬黄。子囊孢子成熟时为橄榄褐色或褐色,柠檬状,双尖,两端稍具脐状突起,两侧扁平;对12个子囊孢子进行测量,平均长度为10.25 cm,平均宽度8 cm,顶端有胚芽孔。无性形态缺失[28](图1-e、f)。
2.3 病原菌的分子生物学鉴定
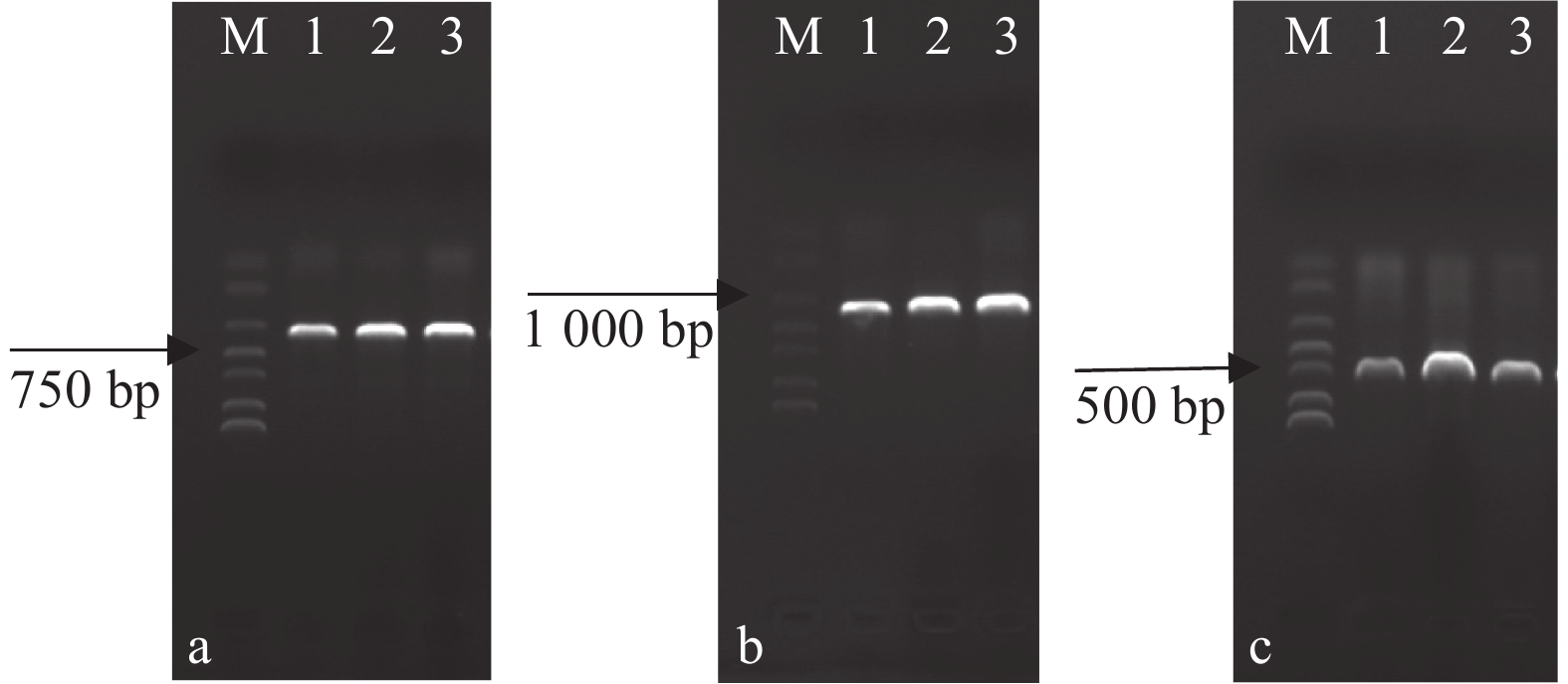
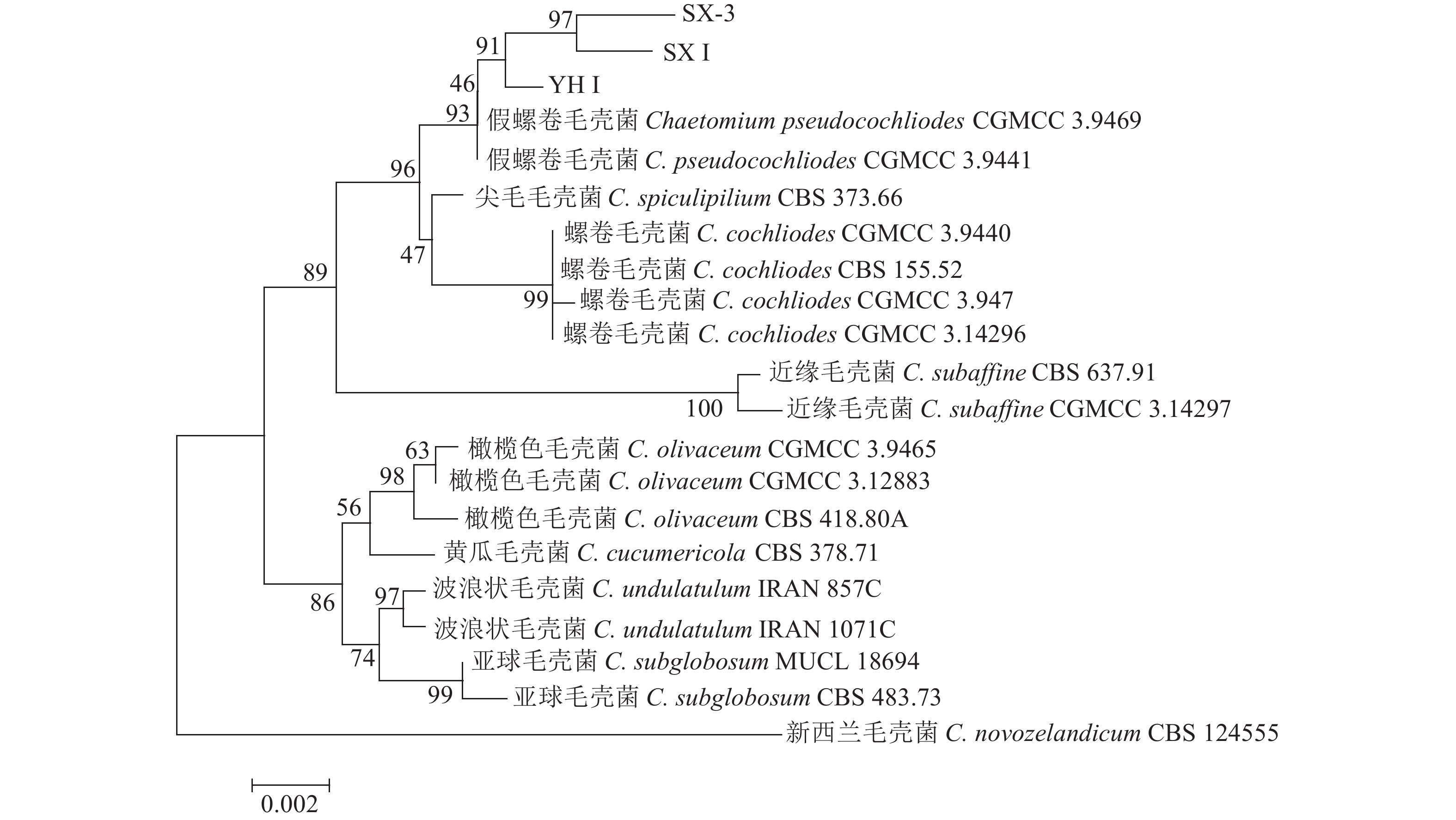
用真菌ITS、LSU、EF1扩增对分离菌进行r DNA-ITS区间、LSU区间、EF1区间序列测定,1.0%琼脂糖电泳成像检测(图2),条带出现在500~1 000 bp,并在NCBI的GenBank进行Blast比对,分离得到的病原菌与已知模式属的最大相似性在98%以上,说明新分离内生菌的科学分类地位比较明确,且获得序列登录号MZ817064、MZ817065、MZ817066(ITS);MZ817069、MZ817070、MZ817071 (LSU);MZ820164、MZ820165、MZ820166(EF1)。利用MEGA 6.0软件构建基于邻接法的多基因系统发育树(图3)。病原菌与假螺卷毛壳菌(Chaetomium pseudocochliodes)聚集在同一分支上,多基因系统学分析结果进一步证实了云南省昆明市昆明植物园山茶花腐病的病原菌为假螺卷毛壳菌(C. pseudocochliodes)。
2.4 病原菌生物学特性的研究
2.4.1 不同温度对病原菌生长的影响
由表2所示,菌株SX-3的菌丝正常生长范围为10 ~35 ℃,温度40 ℃时,菌丝生长受限,菌落直径较小且稀疏。25 ℃条件下病原菌平均直径最大,与其他处理差异显著,10 ℃条件下直径较小。结果表明,病原菌最适生长温度条件为25 ℃。
表 2 温度对菌株SX-3菌丝生长的影响Table 2. Effect of temperature on mycelial growth of SX-3温度
Temperature/℃菌落直径
Colony diameter/cm温度
Temperature/℃菌落直径
Colony diameter/cm10 3.967±0.0577 d 30 7.833±0.2887 b 15 5.500±0.5000 c 35 6.267±0.0577 c 20 7.733±1.1676 b 40 1.033±0.0577 e 25 8.833±0.2887 a 不同小写字母表示各处理菌落直径差异显著(P<0.05),下同。 The different lowercase alphabet shows that the factor to the diameter of the colony has significantly difference (P<0.05), The same applies below. 2.4.2 不同光照对病原菌生长的影响
由表3所示,菌株SX-3在不同光照条件下均可以正常生长,菌落直径均可达8 cm以上,培养第7天,菌株在24 h光照、12 h光暗交替和正常光照条件下均可产孢。结果表明,菌株在24 h光照、12 h光暗交替和正常光照条件均较合适生长和产孢,对光照没有特殊的要求。
表 3 光照对菌株SX-3菌丝生长的影响Table 3. Effect of illumination on mycelial growth of SX-3光照情况
Lighting
condition菌落直径
Colony diameter/
cm光照情况
Lighting
condition菌落直径
Colony diameter/
cm24 h光照
24 h lighting8.800±0.1732 a 24 h黑暗
24 h darkness8.600±0.6928 a 12 h交替
12 h alternation8.500±0.0000 a 正常光照
Normal lighting8.667±0.0577 a 2.4.3 不同培养基对病原菌生长的影响
由表4所示,菌株SX-3在4种培养基上均能正常生长,但在LB上菌丝生长最快,菌落直径最大,而在PDA上菌落直径较小。在培养第7天时,OMA培养基和PDA培养基均长孢子。结果表明,最适培养基为LB和OMA培养基。
表 4 培养基对菌株SX-3菌丝生长的影响Table 4. Effect of culture medium on mycelial growth of SX-3培养基
Culture
medium菌落直径
colony diameter/
cm培养基
Culture
medium菌落直径
Colony diameter/
cmOMA 8.500±0.0000 b PDA 8.167±0.2887 c CMA 8.500±0.0000 b LB 9.000±0.0000 a 2.4.4 不同氮源对病原菌生长的影响
由表5所示,菌株SX-3在6种氮源上均可正常生长,菌落生长直径均在8 cm以上,但硝酸钠、蛋白胨、硝酸钾、甘氨酸氮源培养基菌落较为稀疏,菌丝长势较差,而以牛肉膏为氮源的培养基菌株长势最好,且均未观察到孢子的产生。结果表明各类氮源对菌落直径的生长影响较小,而对菌丝的长势产生极大的影响,长势均较差,对牛肉膏的利用率最高。
表 5 氮源对菌株SX-3菌丝生长的影响Table 5. Effect of nitrogen sources on mycelial growth of SX-3氮源
Nitrogen source菌落直径
Colony diameter/cm氮源
Nitrogen source菌落直径
Colony diameter/cm硝酸钠
Sodium nitrate8.500±0.0000 a 硝酸钾
Potassium nitrate8.333±0.2887 a 蛋白胨
Peptone8.500±0.0000 a 甘氨酸
Glycine8.667±0.2887 a 牛肉膏
Beef extract8.500±0.0000 a 缺氮
Nitrogen deficiency7.200±0.1000 c 酵母膏
Yeast cream7.967±0.2517 b 2.4.5 不同碳源对病原菌生长的影响
由表6所示, 菌株SX-3在6种碳源上均可正常生长。病原菌在以果糖作为碳源时,菌落直径最大,而在以阿拉伯树胶糖为碳源时,菌落直径最小,各类碳源也无明显的产孢现象。结果表明病原菌对果糖的利用率最高,对阿拉伯树胶糖的利用率最低。
表 6 碳源对菌株SX-3菌丝生长的影响Table 6. Effect of carbon sources on mycelial growth of SX-3碳源
Carbon source菌落直径
Colony diameter/cm碳源
Carbon source菌落直径
Colony diameter/cm蔗糖
Sucrose7.967±0.4509 b 阿拉伯树胶糖
Gum Arabic sugar3.567±0.3055 c 葡萄糖
Glucose8.433±0.0577 a 果糖
Fructose8.500±0.0000 a 木糖
Xylose8.467±0.0577 a 缺碳
Carbon deficiency7.500±0.0000 b 麦芽糖
Maltose8.333±0.1155 ab 2.4.6 病原菌致死温度的测定
由表7所示,菌株SX-3在温度35~50 ℃经10 min处理的菌丝在PDA培养基上均能正常生长,在55~65 ℃条件下处理10 min不再生长,但在35 ℃和40 ℃处理10 min的条件下菌落直径随温度增高呈负相关,表明该菌菌丝具有一定的耐热性,且致死温度为55 ℃/10 min。
表 7 菌株SX-3致死温度测定Table 7. Lethal temperature of SX-3致死温度
Lethal
temperature/ ℃菌落直径
Colony
diameter/cm致死温度
Lethal
temperature/ ℃菌落直径
Colony
diameter/cm35 7.633±0.3215 b 55 0.000±0.0000 d 40 8.367±0.1528 a 60 0.000±0.0000 d 45 7.133±0.9074 b 65 0.000±0.0000 d 50 2.467±0.1528 c 3. 讨论与结论
假螺卷毛壳菌(C. pseudocochliodes)广泛分布于空气、土壤等多种自然环境中,也是植物最常见的内生真菌之一[29]。毛壳菌对一些植物病原菌有拮抗作用,是良好的生物防治材料。其代谢产物在农业、医药领域和饲料业也有较高的应用价值[30]。Tveit[31]报道螺卷毛壳(C. cochliodes)对一些植物病原真菌有拮抗作用,并发现螺卷毛壳能有效防治一些植物种传病害。该属中应用最为广泛的是球毛壳菌(C.globosum),研究发现球毛壳菌是某些植物的内生真菌,对棉花枯萎病菌、油菜白斑病菌、小麦赤霉病菌[32-33]、三七根腐病[34]、辣椒枯萎病[35]、人参黑斑病[36]都有抑制作用。但是也可以作为杭白菊叶枯病[37]、早小洋菊叶枯病[38]、石榴叶斑病[39]、红果臭椿苗期病害[40]、橡胶籽苗黑根病[41]的病原菌。杨丽芬等[39]研究了球毛壳菌(C.globosum)菌丝的生长温度在26~34 ℃,适宜温度26~32 ℃,最适温度28 ℃;光照能促进菌丝生长;不同碳源、氮源对球毛壳菌菌丝生长的影响均较明显;麦芽糖和蛋白胨对菌丝生长有显著的促进作用。蒋桂芝等[41]认为球毛壳菌(C.globosum)生长适应能力强,在10~35 ℃菌丝和子囊孢子能生长和萌发,全光照能减缓菌丝的生长,糖类营养物质有利于子囊孢子萌发,子囊孢子较耐高温,48 ℃持续20 min,50 ℃持续15 min,52 ℃持续10 min,以及54 ℃持续5 min时才能导致病原子囊孢子失活、死亡。假螺卷毛壳菌(C. pseudocochliodes)的首次提取是从云南文山的三七根中获得的[28],近些年关于该菌的报道甚少,也未发现其作为致病菌或生防菌来报道。
本研究首次发现假螺卷毛壳菌(C. pseudocochliodes)为山茶花花腐病病原菌,在发生规律和防治方面还需进行进一步的研究。生物学特性研究结果表明,该病原菌的最适培养温度为25 ℃,对光照条件没有特殊的要求,最适培养基为LB和OMA培养基,以牛肉膏作为氮源和以果糖作为碳源的利用率最高,其致死温度为55 ℃/10 min。本研究为山茶花腐病病害的防治提供了新依据,对云南山茶培育的栽培管理和城市园林绿化景观设计具有重要的意义。
-
图 1 山茶花腐病田间和接种后症状及病原菌在PDA培养基上的形态学特征
a. 田间感病病花症状;b. 田间健康花;c、d. 室内离体接种后花腐症状;e. 菌落形态;f. 子囊孢子。
Figure 1. Symptoms of petal blight disease on field and inoculated C. japonica and morphology of pathogen on PDA
a: symptoms on field flower; b: healthy flower; c and d: symptoms on inoculated camellia flower;e: colony morphology; f: ascospores.
表 1 引物序列表
Table 1 Primer sequences
表 2 温度对菌株SX-3菌丝生长的影响
Table 2 Effect of temperature on mycelial growth of SX-3
温度
Temperature/℃菌落直径
Colony diameter/cm温度
Temperature/℃菌落直径
Colony diameter/cm10 3.967±0.0577 d 30 7.833±0.2887 b 15 5.500±0.5000 c 35 6.267±0.0577 c 20 7.733±1.1676 b 40 1.033±0.0577 e 25 8.833±0.2887 a 不同小写字母表示各处理菌落直径差异显著(P<0.05),下同。 The different lowercase alphabet shows that the factor to the diameter of the colony has significantly difference (P<0.05), The same applies below. 表 3 光照对菌株SX-3菌丝生长的影响
Table 3 Effect of illumination on mycelial growth of SX-3
光照情况
Lighting
condition菌落直径
Colony diameter/
cm光照情况
Lighting
condition菌落直径
Colony diameter/
cm24 h光照
24 h lighting8.800±0.1732 a 24 h黑暗
24 h darkness8.600±0.6928 a 12 h交替
12 h alternation8.500±0.0000 a 正常光照
Normal lighting8.667±0.0577 a 表 4 培养基对菌株SX-3菌丝生长的影响
Table 4 Effect of culture medium on mycelial growth of SX-3
培养基
Culture
medium菌落直径
colony diameter/
cm培养基
Culture
medium菌落直径
Colony diameter/
cmOMA 8.500±0.0000 b PDA 8.167±0.2887 c CMA 8.500±0.0000 b LB 9.000±0.0000 a 表 5 氮源对菌株SX-3菌丝生长的影响
Table 5 Effect of nitrogen sources on mycelial growth of SX-3
氮源
Nitrogen source菌落直径
Colony diameter/cm氮源
Nitrogen source菌落直径
Colony diameter/cm硝酸钠
Sodium nitrate8.500±0.0000 a 硝酸钾
Potassium nitrate8.333±0.2887 a 蛋白胨
Peptone8.500±0.0000 a 甘氨酸
Glycine8.667±0.2887 a 牛肉膏
Beef extract8.500±0.0000 a 缺氮
Nitrogen deficiency7.200±0.1000 c 酵母膏
Yeast cream7.967±0.2517 b 表 6 碳源对菌株SX-3菌丝生长的影响
Table 6 Effect of carbon sources on mycelial growth of SX-3
碳源
Carbon source菌落直径
Colony diameter/cm碳源
Carbon source菌落直径
Colony diameter/cm蔗糖
Sucrose7.967±0.4509 b 阿拉伯树胶糖
Gum Arabic sugar3.567±0.3055 c 葡萄糖
Glucose8.433±0.0577 a 果糖
Fructose8.500±0.0000 a 木糖
Xylose8.467±0.0577 a 缺碳
Carbon deficiency7.500±0.0000 b 麦芽糖
Maltose8.333±0.1155 ab 表 7 菌株SX-3致死温度测定
Table 7 Lethal temperature of SX-3
致死温度
Lethal
temperature/ ℃菌落直径
Colony
diameter/cm致死温度
Lethal
temperature/ ℃菌落直径
Colony
diameter/cm35 7.633±0.3215 b 55 0.000±0.0000 d 40 8.367±0.1528 a 60 0.000±0.0000 d 45 7.133±0.9074 b 65 0.000±0.0000 d 50 2.467±0.1528 c -
[1] 卓丽环, 陈龙清. 园林树木学[M]. 北京: 中国农业出版社, 2004. [2] 李峻红, 陆俊, 单蓓, 等. 保鲜剂对山茶花切花保鲜效果的研究 [J]. 农村实用技术, 2021(9):59−60. LI J H, LU J, SHAN B, et al. Study on the effect of preservatives on fresh-keeping of cut camellia flowers [J]. Rural Practical Technology, 2021(9): 59−60.(in Chinese)
[3] WANG Y, ZHUANG H, SHEN Y, et al. The Dataset of Camellia Cultivars Names in the World[J]. Biodiversity Data Journal, 2021, 9(12). DOI: 10.3897/BDJ.9.e61646
[4] 杨英. 山茶花常见病虫害及其防治对策 [J]. 农业科技与信息, 2016, 13(10):101−101,103. DOI: 10.3969/j.issn.1003-6997.2016.10.070 YANG Y. Common diseases and insect pests of Camellia and their control countermeasures [J]. Agricultural Technology and Information, 2016, 13(10): 101−101,103.(in Chinese) DOI: 10.3969/j.issn.1003-6997.2016.10.070
[5] 张齐发, 胡一民(摄). 中国十大名花之山茶花常见主要病虫害的识别与防治(上) [J]. 花木盆景(上半月), 2006(11):24−26. ZHANG Q F, HU Y M. Identification and Control of Common Main Diseases and Insects of Camellia, the Top Ten Famous Flowers in China (Part 1) [J]. Bonsai (Flowers and Horticulture), 2006(11): 24−26.(in Chinese)
[6] 刘国信. 山茶花常见病虫害防治 [J]. 植物医生, 2009(1):28−29. DOI: 10.3969/j.issn.1007-1067.2009.01.018 LIU G X. Prevention and control of camellia pests and diseases [J]. Plant Doctor, 2009(1): 28−29.(in Chinese) DOI: 10.3969/j.issn.1007-1067.2009.01.018
[7] 罗会生. 山茶病虫害防治 [J]. 中国花卉园艺, 2016(4):32−35. DOI: 10.3969/j.issn.1009-8496.2016.04.013 LUO H S. Prevention and control of camellia pests and diseases [J]. China Flower and Horticulture, 2016(4): 32−35.(in Chinese) DOI: 10.3969/j.issn.1009-8496.2016.04.013
[8] 王建伟, 钱显明, 张炳欣. 浙江省山茶花病害 [J]. 植物病理学报, 1990(2):89−92. WANG J W, QIAN X M, ZHANG B X. The diseases of Camellia in Zhejiang Province [J]. Acta Phytopathologica Sinica, 1990(2): 89−92.(in Chinese)
[9] 何美仙. 山茶花主要病害的发生及防治 [J]. 内蒙古林业科技, 2005(1):51−52. DOI: 10.3969/j.issn.1007-4066.2005.01.020 HE M X. Occurrence and control of main disease for Camellia japomica [J]. Inner Mongolia Forestry Science & Technology, 2005(1): 51−52.(in Chinese) DOI: 10.3969/j.issn.1007-4066.2005.01.020
[10] RAABE R D, MCCAIN A H, PAULUS A O. Diseases and pests[M]//Feathers D L, Brown M H. The camellia its history culture genetics and a look into its future development. Columbia South Carolina, USA: Southern Californian Camellia Society Inc, 1978: 279-285.
[11] RON VAN TOOR. Development of Biocontrol Methods for Camellia Flower Blight Caused by Ciborinia camelliae [J]. American Camellia Yearbook, 2003: 29−33.
[12] KONDRATEV N, DENTON-GILES M, BRADSHAW R E, et al. Camellia plant resistance and susceptibility to petal blight disease are defined by the timing of defense responses [J]. Mol Plant Microbe Interact, 2020, 33(7): 982−995. DOI: 10.1094/MPMI-10-19-0304-R
[13] 陈秀虹, 伍建榕. 观赏植物病害诊断与治理[M]. 北京: 中国建筑工业出版社, 2009. [14] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998. [15] 任纬恒. 高山杜鹃病害的病原菌分离鉴定与防治基础研究[D]. 贵阳: 贵州师范大学, 2019. REN W H. Basic research on isolation, identification and control of pathogen of Rhododendron lapponicum disease [D]. Gui yang: Guizhou Normal University, 2019. (in Chinese)
[16] 朱轶慧, 刘玉军, 毕飞虎, 等. 红叶石楠叶斑病病原鉴定及其生物学特性研究 [J]. 植物保护, 2021(5):210−215, 235. ZHU Y H, LIU Y J, BI F H, et al. Identification and biological characteristics of the pathogen causing leaf spot disease on Photinia × fraseri [J]. Plant Protection, 2021(5): 210−215, 235.(in Chinese)
[17] HENSON J M, FRENCH R. The polymerase chain reaction and plant disease diagnosis [J]. Annual Review of Phytopathology, 1993, 31: 81−109. DOI: 10.1146/annurev.py.31.090193.000501
[18] 刘彬, 张祥林, 王羽中, 等. 向日葵白锈病菌巢式PCR检测方法的研究 [J]. 新疆农业科学, 2011(5):859−863. DOI: 10.6048/j.issn.1001-4330.2011.05.013 LIU B, ZHANG X L, WANG Y Z, et al. Study on the nest-PCR to detect the Albugo tragopogi (persoon) schruter var helianthi novotlenova [J]. Xinjiang Agricultural Sciences, 2011(5): 859−863.(in Chinese) DOI: 10.6048/j.issn.1001-4330.2011.05.013
[19] 谭秀梅, 阿地力·沙塔尔, 朴春根, 等. 无柄灵芝遗传多样性的SRAP、ITS、TEF1-α和LSU分析 [J]. 微生物学通报, 2016, 43(12):2667−2677. TAN X M, ADIL S, PIAO C G. Genetic diversity of Ganoderma resinaceum by SRAP, ITS, TEF1-α and LSU markers [J]. Microbiology China, 2016, 43(12): 2667−2677.(in Chinese)
[20] 李雪玲, 谢美华, 杨海艳, 等. 高山榕叶枯病病原菌分离鉴定和生物学特性的初步研究 [J]. 西南农业学报, 2015(6):2558−2562. LI X L, XIE M H, YANG H Y, et al. Pathogen identification and biological characterstics of leaf blight of Ficus altissima [J]. Southwest China Journal of Agricultural Sciences, 2015(6): 2558−2562.(in Chinese)
[21] 黎肇家, 李汶晋, 毛跃彦, 等. 栾树枝枯病病原菌鉴定及其生物学特性研究 [J]. 西北农林科技大学学报(自然科学版), 2020(9):53−63. LI Z J, LI W J, MAO Y Y, et al. Identification and biological characteristics of branch withered disease causing pathogen to Koelreuteria paniculata Laxm [J]. Journal of Northwest A & F University (Natural Science Edition), 2020(9): 53−63.(in Chinese)
[22] 张凡, 冯婷, 韩正敏, 等. 落羽杉赤枯病病原菌的分离鉴定及生物学特性分析 [J]. 植物保护学报, 2018(4):900−907. ZHANG F, FENG T, HAN Z M, et al. Biological characteristics and molecular identification the pathogen of Taxodium red blight [J]. Journal of Plant Protection, 2018(4): 900−907.(in Chinese)
[23] 彭成彬, 王泽榕, 阮俊峰, 等. 柳叶蜡梅真菌病害分离鉴定及生物学特性 [J]. 福建农业学报, 2021(4):457−463. PENG C B, WANG Z R, RUAN J F, et al. Identification and biology of leaf spot pathogen on Chimonanthus salicifolius [J]. Fujian Journal of Agricultural Sciences, 2021(4): 457−463.(in Chinese)
[24] 姚锦爱, 黄鹏, 兰成忠, 等. 福建省铁皮石斛茎腐病病原菌鉴定及其生物学特性 [J]. 福建农业学报, 2021(12):1457−1463. YAO J A, HUANG P, LAN C Z, et al. Identification and biological characteristics of stem rot pathogen of Dendrobium officinale [J]. Fujian Journal of Agricultural Sciences, 2021(12): 1457−1463.(in Chinese)
[25] 李润根, 卢其能, 何咪, 等. 百合新病原菌假短孢弯孢生物学特性及其对杀菌剂的敏感性 [J]. 植物保护, 2020(6):41−46. LI R G, LU Q N, HE M, et al. The biological characteristics of Curvularia pseudobrachyspora, a new causal agent of lily leaf spot, and its sensitivity to fungicides [J]. Plant Protection, 2020(6): 41−46.(in Chinese)
[26] 杨迪, 杜婵娟, 叶云峰, 等. 广西香蕉煤污病病原菌的分离鉴定及其生物学特性 [J]. 植物病理学报, 2021(4):507−514. YANG D, DU C J, YE Y F, et al. Isolation, identification and characterization of the pathogen causing banana sooty blotch in Guangxi [J]. Acta Phytopathologica Sinica, 2021(4): 507−514.(in Chinese)
[27] 张建强, 吴康莉, 张晓梦, 等. 芹菜叶斑病病原菌的分离鉴定、生物学特性及其生防菌筛选 [J]. 西北农业学报, 2021(7):1089−1099. ZHANG J Q, WU K L, ZHANG X M, et al. Isolation, identification, biological characteristics and biocontrol bacteria screening of celery leaf spot pathogen [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2021(7): 1089−1099.(in Chinese)
[28] WANG X W, LOMBARD L, GROENEWALD J Z, et al. Phylogenetic reassessment of the Chaetomium globosum species complex [J]. Persoonia, 2016, 36: 83−133. DOI: 10.3767/003158516X689657
[29] 廖宏娟, 张志斌, 江玉梅, 等. 球毛壳菌对植物病原真菌和根结线虫的生物防治潜力 [J]. 天然产物研究与开发, 2022(6):1076−1089. DOI: 10.16333/j.1001-6880.2022.6.021 LIAO H J, ZHANG Z B, JIANG Y M, et al. Biocontrol potential of Chaetomium globosum against plant pathogenic fungi and root-knot Nematodes: A review [J]. Natural Product Research and Development, 2022(6): 1076−1089.(in Chinese) DOI: 10.16333/j.1001-6880.2022.6.021
[30] 谭悠久. 毛壳菌科(Chaetomiaceae)分类及分子系统发育研究[D]. 杨凌: 西北农林科技大学, 2005. TAN Y J. Taxonomy and molecular phylogeny of Chaetomiaceae [D]. Yangling: Northwest A&F University, 2005. (in Chinese )
[31] TVEIT M. Control of a seed-borne disease by Chaetomium cochlioides Pall., under natural conditions [J]. Nature, 1953, 172(4366): 39. DOI: 10.1038/172039a0
[32] 陈利军, 史洪中, 陈月华. 油菜内生球毛壳菌抑菌作用初步测定 [J]. 河南农业科学, 2005(7):54−56. DOI: 10.3969/j.issn.1004-3268.2005.07.018 CHEN L J, SHI H Z, CHEN Y H. Preliminary study on the anti-fungal action of Chaetomium globosum from endophytic fungi of rapeseed [J]. Journal of Henan Agricultural Sciences, 2005(7): 54−56.(in Chinese) DOI: 10.3969/j.issn.1004-3268.2005.07.018
[33] 兰楠, 祁高富, 喻子牛, 等. 油菜内生真菌的分离鉴定及抑菌作用 [J]. 华中农业大学学报, 2011(3):270−275. LAN N, QI G F, YU Z N, et al. Isolation, identification and anti-fungal action of endophytic fungi of rapeseed [J]. Journal of Huazhong Agricultural University, 2011(3): 270−275.(in Chinese)
[34] 赵林艳. 球毛壳菌对三七根腐病镰刀菌的生防潜力[D]. 昆明: 云南大学, 2018. ZHAO L Y. Biocontrol potential of Chaetomium globosum against Fusarium spp. —the pathogenic fungi of Panax notoginseng root rot diseases[D]. Kunming: Yunnan University, 2018. (in Chinese )
[35] 莫维弟, 卯婷婷. 辣椒枯萎病土壤拮抗真菌的筛选与鉴定 [J]. 贵州农业科学, 2019(8):66−70. DOI: 10.3969/j.issn.1001-3601.2019.08.015 MO W D, MAO T T. Screening and identification of antagonistic fungi in soil against Fusarium oxysporum in pepper [J]. Guizhou Agricultural Sciences, 2019(8): 66−70.(in Chinese) DOI: 10.3969/j.issn.1001-3601.2019.08.015
[36] 周春元, 朴向民, 闫梅霞, 等. 人参黑斑病菌生防内生真菌的分离筛选、鉴定及抑菌特性 [J]. 中国中药杂志, 2019(2):274−277. ZHOU C Y, PIAO X M, YAN M X, et al. Isolation, screening and identification of endophytic fungi and detection of its antifungal effects against Alternaria panax [J]. China Journal of Chinese Materia Medica, 2019(2): 274−277.(in Chinese)
[37] 马婉琴, 蔡苏, 钱永生, 等. 球毛壳菌引起杭白菊叶枯病的首次报道 [J]. 杭州师范大学学报(自然科学版), 2015(4):390−393. MA W Q, CAI S, QIAN Y S, et al. First report of leaf blight disease of Chrysanthemum morifolium caused by Chaetomium globosum [J]. Journal of Hangzhou Normal University (Natural Science Edition), 2015(4): 390−393.(in Chinese)
[38] 钱永生, 蔡苏, 吴剑丙, 等. 浙江省“浙八味”道地药材真菌病害调查及病原鉴定 [J]. 湖北农业科学, 2015(19):4740−4745,4748. QIAN Y S, CAI S, WU J B, et al. Investigation and identification of the pathogenic fungi in trueborn “Zhe-ba-Wei”Medicinal herbs in Zhejiang Province [J]. Hubei Agricultural Sciences, 2015(19): 4740−4745,4748.(in Chinese)
[39] 杨丽芬, 朱心, 周春香, 等. 石榴叶斑病球毛壳菌生长习性及杀菌剂筛选 [J]. 安徽农业大学学报, 2018(1):195−200. YANG L F, ZHU X, ZHOU C X, et al. Growth characteristics of mycelia of Chaetomium globusum causing pomegranate leaf spot disease and fungicides screening [J]. Journal of Anhui Agricultural University, 2018(1): 195−200.(in Chinese)
[40] 刘南南, 王桂清. 红果臭椿苗期病害致病菌的分离与鉴定 [J]. 北方园艺, 2019(17):89−94. DOI: 10.11937/bfyy.20184580 LIU N N, WANG G Q. Isolation and identification of pathogenic fungi from red fruit Ailanthus altissima seedling disease [J]. Northern Horticulture, 2019(17): 89−94.(in Chinese) DOI: 10.11937/bfyy.20184580
[41] 蒋桂芝, 田海, 朱国渊, 等. 橡胶籽苗黑根病病原鉴定及生物学特性研究 [J]. 植物保护, 2020(1):223−228. JIANG G Z, TIAN H, ZHU G Y, et al. Pathogen identification and biological characteristics of black root disease in rubber seedlings [J]. Plant Protection, 2020(1): 223−228.(in Chinese)
-
期刊类型引用(1)
1. 梁松,高媛,于新,徐文凤,邢芳芳,艾立山,李新柱,孟祥坤. 临沂地区草莓叶枯病病原菌的分离鉴定及其生物学特性研究. 安徽农业科学. 2024(05): 140-143 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: