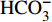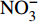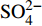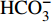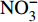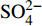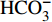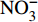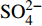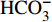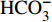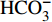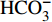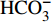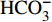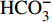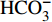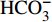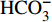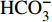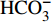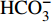TrnL-F and ISSR Primer-based Molecular Identification and Genetic Diversity Determination on Camellia impressinervis and Three Closely Related Species
-
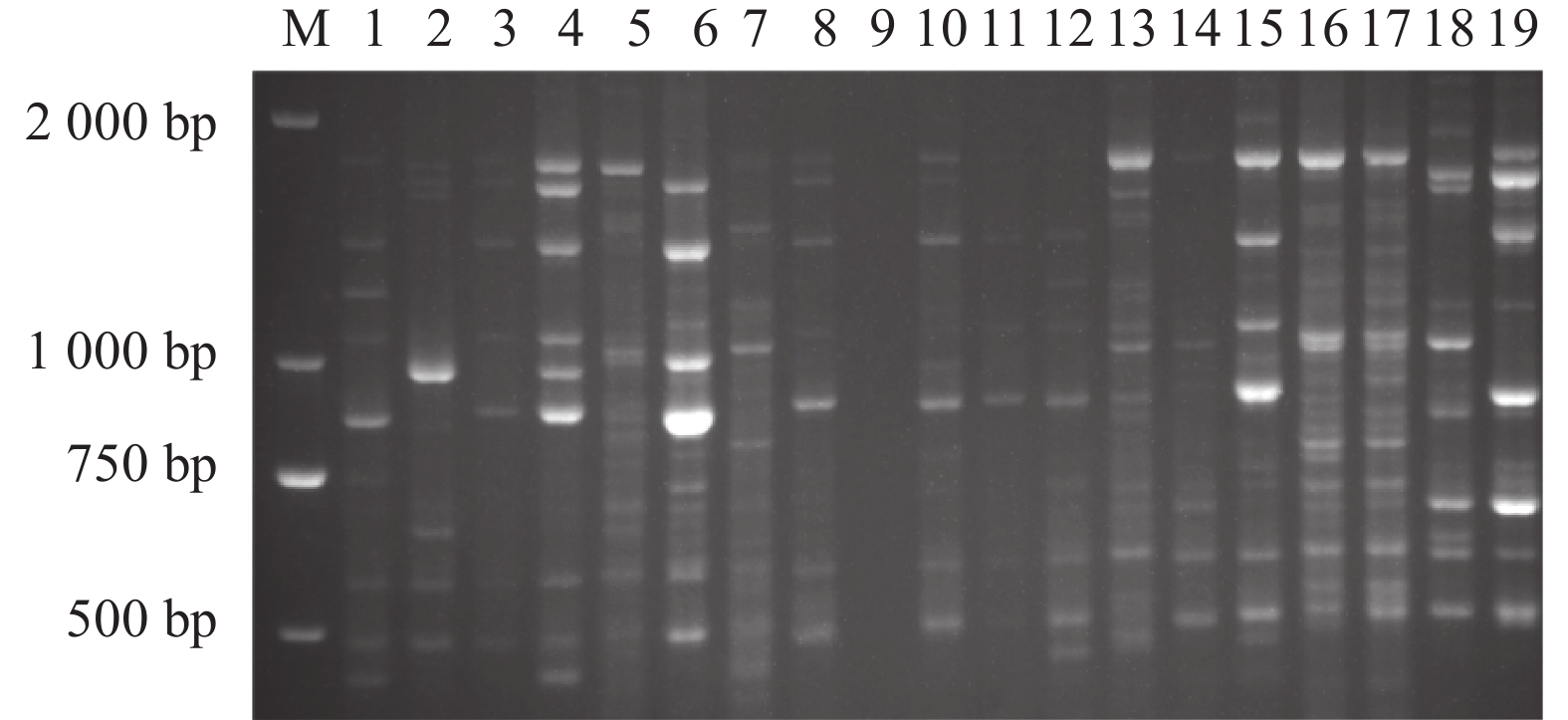
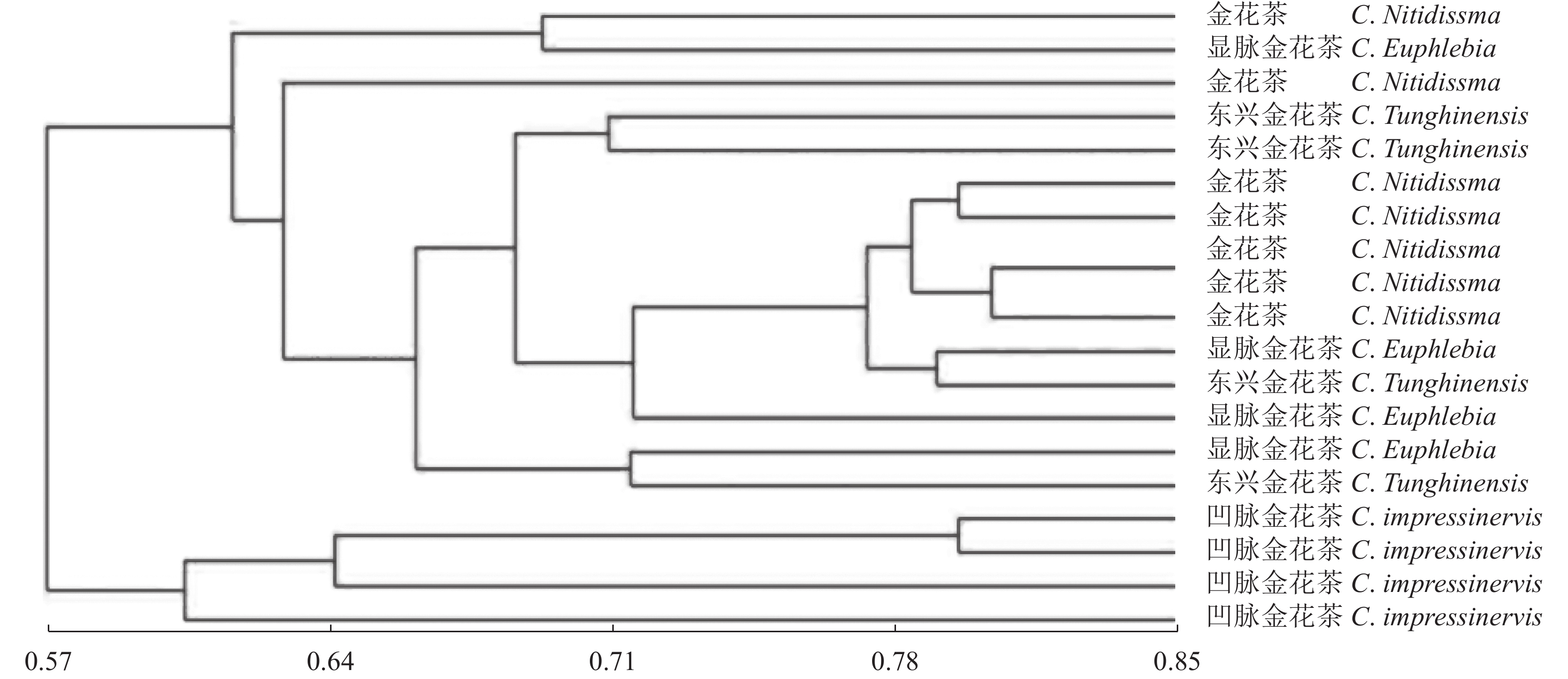
摘要:目的 凹脉金花茶是一种具有较高价值的观赏与药用两用植物,与其同属中的金花茶、显脉金花茶、东兴金花茶外形相似。通过分子指纹技术分析这4个近源种之间的遗传多样性,可为凹脉金花茶的鉴定及其种质资源保护和利用提供理论指导。方法 利用金花茶、凹脉金花茶、显脉金花茶、东兴金花茶的19个样品评估TrnL-F条形码在这4种山茶中鉴定凹脉金花茶的潜力,并利用简单序列间重复(ISSR)引物检测4个山茶组种的遗传多样性。结果 基于TrnL-F序列构建的进化树与检测到的单核苷酸多态性位点的差异相一致,所有凹脉金花茶样品单独聚为一类。ISSR分析显示,4个凹脉金花茶植物样本单独聚为一类,与其他3个山茶组物种的相似指数为0.57。结论 TrnL-F可有效鉴别凹脉金花茶与3种近缘种。本研究揭示了这4个近缘种的分子亲缘关系,从分子水平证实显凹脉金花茶具有异于其他3种山茶的遗传特性。Abstract:Objective Molecular identification and genetic diversity of Camellia impressinervis were studied to improve the preservation and utilization of the endangered species.Method A highly valuable ornamental and medicinal, but extremely endangered as classified by the International Union for the Conservation of Nature, C. impressinervis was compared with the closely related C. nitidissima, C. euphlebia, and C. tunghinensis. Using 19 specimens of the 4 species, validity of applying trnL-F barcode to confidently identify them was evaluated, and their genetic diversity examined based on the inter-simple sequence repeat (ISSR) primers.Result TrnL-F could accurately differentiate C. impressinervis from those closely related camellia cultivars and clustered all in a same group. The ISSR analysis grouped the 4 C. impressinervis specimens together and showed a similarity index of 0.57 with the other 3 camellia species.Conclusion The genetic fingerprint in terms of trnL-F barcode and ISSR primers successfully identified the close relationship of C. impressinervis with, but distinguishable from, C. nitidissima, C. euphlebia, and C. tunghinensis.
-
Keywords:
- Camellia /
- trnL-F /
- molecular identification /
- genetic diversity /
- ISSR
-
0. 引言
【研究意义】河流水化学特征的演化是一个极其复杂的过程,受到自然条件和人类活动等多种因素的共同影响。河流主要化学离子组成不仅可以反映流域自然环境,还可以反映岩石风化、大气降水及人类活动对流域水体环境的影响[1]。因此,分析河流水化学的时空分布特征对流域水化学类型、作用机制和溯源研究具有重要意义。【前人研究进展】当前,国外对河流水化学特征研究开展较早且对不同规模的水系研究较全面[2-5],国内水化学的研究近年来主要集中于较大规模的水系或较大尺度的流域范围,如长江[6]、黄河[7]、珠江[8]、赣江[9]、韩江[10]等。研究表明,地质和气候是影响流域水化学的重要因素[2],大气沉降和岩石风化是水化学的主要贡献源,但具体的岩性类型及其控制机制因不同流域特征而异。如长江水系的水化学物质来源以碳酸岩的风化作用为主[6];韩江流域则以蒸发岩风化作用更显优势;黄河流域中下游受蒸发岩和碳酸岩起决定性作用,并受人为活动影响[7];珠江流域除了岩石风化和气候影响,还受到水生光合作用等多重因素影响[8]。与此同时,对流域水化学的时间分布规律也有一定的研究,并发现了枯水期水化学主要离子浓度通常高于丰水期(如鄱阳湖[11]、喀斯特流域[12])。整体而言,对亚热带湿热季风区的中小型山区河流的水化学时空分布特征及作用机制的系统性报道较少,对其物质来源的量化贡献和影响规律研究不足[13]。【本研究切入点】武夷山国家公园处于亚热带湿热季风区,其不同水文期的水化学特征研究有待深入探讨。对该流域河流水化学时空分布特征展开研究,可以更好地揭示人为干扰较少的中小型山区河流主要化学离子组分的时空变化、形成机理及主要来源[14]。【拟解决的关键问题】以武夷山国家公园主要干流——九曲溪为研究对象,分析其不同水文期多个河流断面的水化学主要离子的时空分布特征,利用机理模型和主成因分析揭示其形成机制和定量贡献来源,为我国南方亚热带湿热季风区的山区小流域的水化学特征与作用机制研究提供理论参考。
1. 材料与方法
1.1 研究区域概况
武夷山国家公园位于武夷山脉北部(117°24′12″~117°59′19″ E,27°31′20″~27°55′49″ N) ,发育有古元古界变质岩,三叠-白垩系沉积岩、火山岩,第四系残积层、冲洪积层,并有志留纪-晚白垩世侵入岩(主要为志留纪二云母钾长花岗岩,其次为晚侏罗世黑云母钾长花岗岩、晚白垩世花岗斑岩)[15]。该地区属中亚热带季风气候,保存有世界同纬度带最完整、最典型、面积最大的中亚热带原生性森林生态系统,年均降水量为1 960 mm,年均气温为17~19 ℃[16]。其中,10月至翌年1月为枯水期,4~7月为丰水期,其他月份为平水期。
九曲溪是武夷山国家公园内主要水系干流,发源于武夷山自然保护区桐木关的西北角,自西向东流至武夷宫注入崇阳溪,全长62.80 km,年均径流量为7.36×108 m3[16-17]。九曲溪流域总面积为534.30 km2,主要包括了武夷山国家级自然保护区、国家级风景名胜区和九曲溪生态保护区。
1.2 样品采集与分析
1.2.1 样品采集
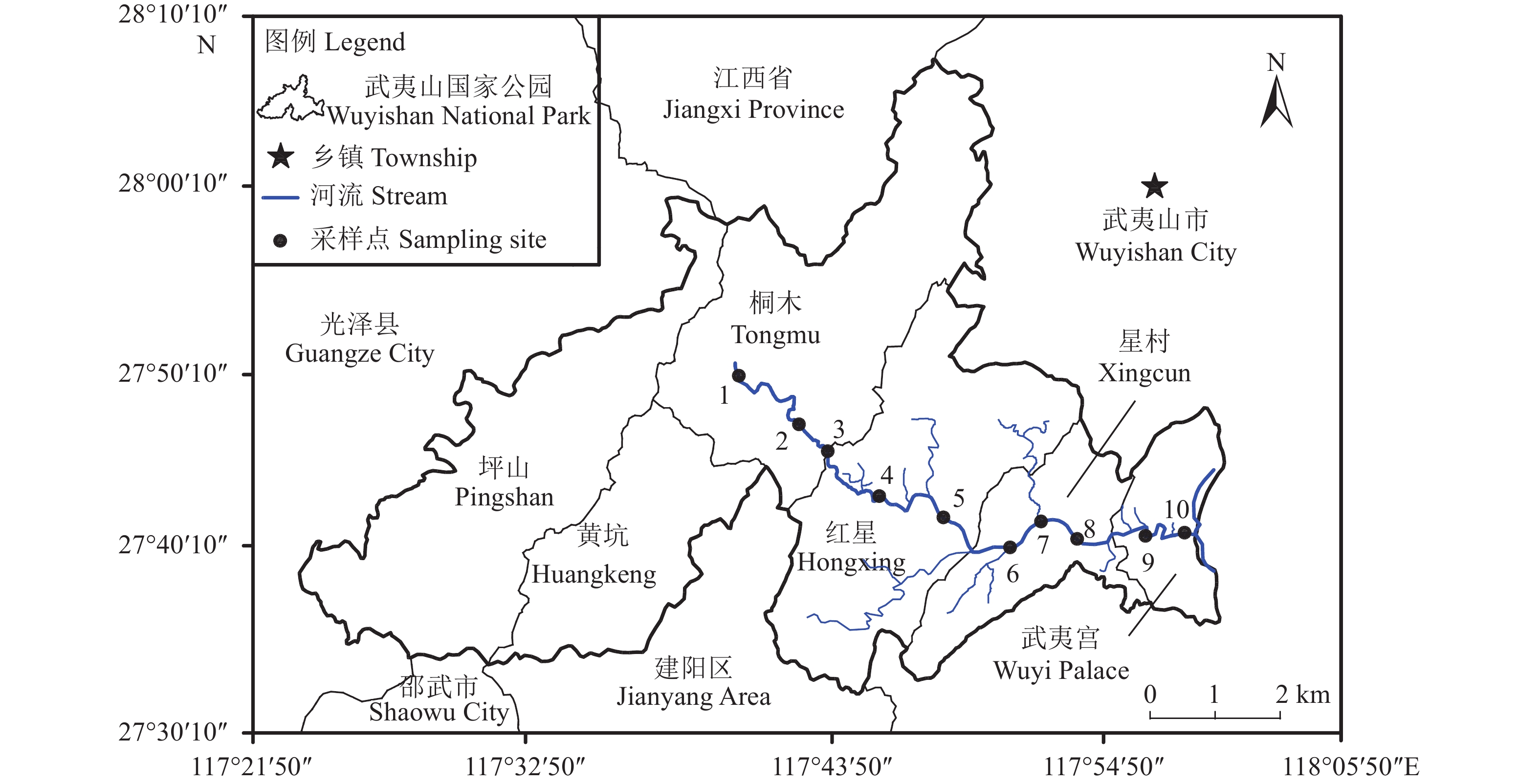
于2018年1月中旬(枯水期)、3月中旬(平水期)和6月中旬(丰水期)采集九曲溪水样各10个(图1)。其中,采样点1~3位于九曲溪的上游河段,属于武夷山国家级自然保护区,森林覆盖高且人为活动少;采样点4~7属于中游段,位于红星村及星村镇中心之间,是研究区的主要旅游中心和农业基地;采样点8~10为九曲溪的下游段,流经天游峰、玉女峰、武夷宫等核心旅游景点。水样采集时根据水流方向(自西向东),避免明显的污水排放源,按照基本等距采样的原则,并选择河流中平直的部位,于河中心的水面以下30 cm处采集水样,以2500 mL的带内塞螺口的聚乙烯塑料瓶盛装并编号。不同水文期合计采集水样30个。
1.2.2 样品测试
现场测定水体pH值,其他指标送往安徽省地质实验研究所(国土资源部合肥矿产资源监督检测中心)测试。其中,Ca2+、Mg2+、Na+、K+含量以电感耦合等离子体测试,
HCO−3 和NO−3 以离子选择电极法测试,Cl−和SO2−4 以离子色谱法,可溶性Si含量以分光光度法测试,并以GBW(E)080112国际标样及密码样把控测试结果的精确度[13]。1.2.3 数据分析
利用Excel 2003进行数据统计,以Origin2019绘制水化学时空分布图;通过Gibbs(吉布斯)模型判断水化学的主要作用机制,以三角图和端元图判断水化学的岩性控制类型,并以主成因分析、海盐校正和模型定量估算水化学物质的来源贡献率。
2. 结果与分析
2.1 水化学的分布特征和作用机制
2.1.1 水化学主要离子组成
由表1可知,九曲溪水体呈酸性(5.42~6.71),TDS含量变化范围为15.00~41.00 mg·L−1,平均值为25.30 mg·L−1,远低于世界河流的平均值(100.00 mg·L−1)[1]。其中,主要阳离子平均浓度值大小排序为Ca2+>Na+ >K+>Mg2+,分别为1.66、1.16、0.69、0.35 mg·L−1;主要阴离子的平均浓度值:
HCO−3 >Cl−>NO−3 >SO2−4 ,依次为13.41、1.93、1.89、1.29 mg·L−1。整体而言,九曲溪的水化学类型为HCO−3 -Ca2++Na+型,这与该地区侵入岩类基岩裂隙水及断裂(构造)脉状水的水化学类型一致,但整体的TDS含量要低于后者(46.70~91.00 mg·L−1,均值为59.88 mg·L−1)[15]。同时,主要阴、阳离子中Ca+、Mg2+、NO−3 和SO2−4 的变异系数较大,说明它们更容易受自然环境和人类活动的多因素影响。表 1 九曲溪水化学主要离子组成Table 1. Composition of major ions in Jiuquxi River water(单位:mg·L−1) 特征值
Characteristic valuepH TDS Ca2+ Mg2+ Na+ K+ HCO−3 NO−3 SO2−4 Cl− 最小值 Min. 5.42 15.00 0.70 0.08 0.45 0.37 6.10 0.71 0.60 1.26 平均值 Avg. 5.92 25.30 1.66 0.35 1.16 0.69 13.41 1.89 1.29 1.93 最大值 Max. 6.71 41.00 4.05 1.26 2.59 1.35 26.15 4.77 3.04 3.20 标准差 SD 0.34 7.23 0.89 0.29 0.46 0.27 4.66 0.95 0.55 0.54 变异系数 CV/% 5.72 28.57 53.90 82.28 39.24 39.01 34.76 50.14 42.39 27.97 2.1.2 水化学的时空分布特征
研究区水化学的时空分布特征如图2所示。从时间分布比较得出,九曲溪水化学特征随不同水文期呈现明显的变化规律:从枯水期、平水期到丰水期主要离子浓度逐渐减少,其TDS浓度分别为30.10、26.21、19.60 mg·L−1。其中,丰水期的大气降水集中且雨量大,河水流量大,流速快,与岩石接触时间短,水岩作用相对减弱,又进一步稀释了岩石溶出的溶解性物质,因此,丰水期受降雨、水体流量和流速等综合影响,水体TDS及主要离子浓度明显低于其他水文期。这与研究区不同水文期雨水中主要离子浓度变化规律相一致[18],说明大气降水是研究区水化学呈时间差异分布的主要原因。
从空间分布比较而言,水体主要离子浓度整体呈现出上游<中游<下游的趋势,TDS浓度依次为19.76、26.15、29.73 mg·L−1。其中,上游段河床坡度大、水体流速快,水岩作用相对弱,又位于武夷山国家级自然保护区内,人口数量少、活动强度弱,因此,上游的水化学离子含量最低。中游段河床坡度减小,水岩作用逐渐加强,同时属于星村镇的粮食主产区,枯、平水期条件下局部河流断面(采样点6)离子浓度特别高,受区域性的农业施肥和人类活动影响较大。下游段离子浓度整体较高,原因可能是下游段河道加宽、水流速度减缓,进一步增强了水岩作用,也可能与受下游人为旅游活动(核心旅游区)干扰影响有关,还可能与下游地势低,汇入水化学离子浓度更高的地下水(不同类型地下水的TDS浓度均值皆大于50 mg·L−1)有关[15]。
整体而言,研究区水化学具有明显的时空差异性,并可初步判断其受大气降水、水岩作用和人类活动的多因素影响。
2.1.3 水化学的主要控制机制
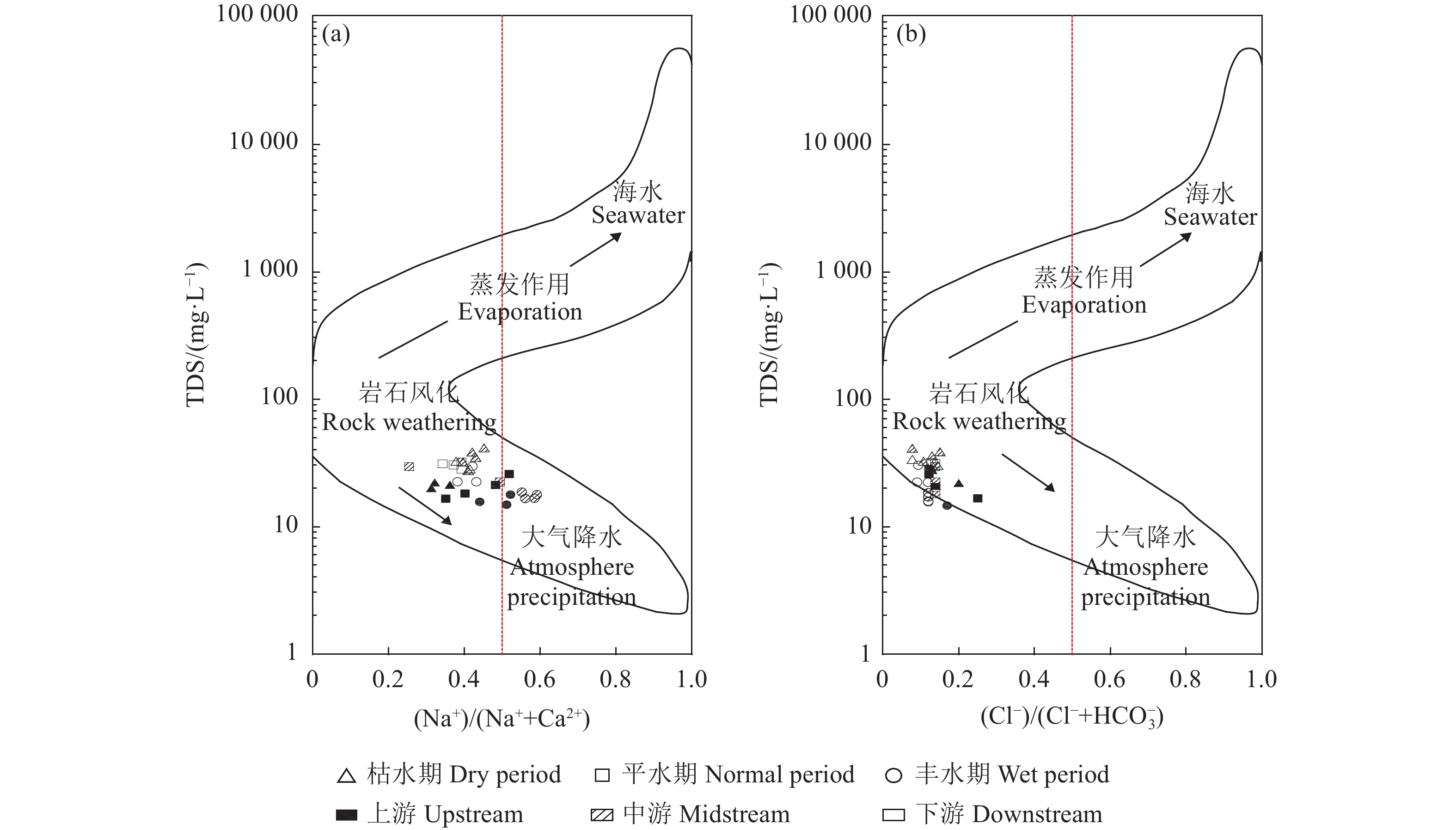
采用Gibbs模型图解法进一步研究九曲溪水化学的主要控制机制。该法直观反映了流域内水化学的起源机制:蒸发作用、岩石风化和大气降水3种自然作用机制[19-20]。其中,蒸发作用主导的水体TDS浓度较高且Na+/(Na++Ca2+)或Cl−/(Cl−+
HCO−3 )比值接近1,分布于Gibbs图的右上角[19,21];大气降水主导的水体TDS浓度低且离子比值高,位于图右下角;岩石风化主导的水体含有中等的矿化度且较低的离子比值(小于0.5),居于图的中部左侧。除了以上自然机制外,如果存在水体数值超出Gibbs图范围,说明水化学特征受到了人为活动的作用[22]。九曲溪水体样品基本分布在Gibbs图范围内,少数样品位于边界线外围(图3),说明研究区水化学特征以自然作用机制为主,并受到轻度的人为活动作用,包括局部区域的人为直接排放、人为污染物长距离传输及生物质燃烧的影响)[23]。与上述离子组成的分析相一致,整体水样的TDS浓度低(<41 mg·L−1)、Na+/(Na++Ca2+)或Cl−/(Cl−+
HCO−3 )比值基本小于0.5,证实了研究区水化学作用机制以岩石风化为主导,一定程度受大气降水(大气降水对世界河水溶解质的平均贡献率为3%[24])和人为活动的影响。该现象符合我国南方山区河流(如赣江上游[9]、闽江上游[25])的水化学岩性控制的主要作用机制,也与研究区对应地下水的水化学岩性主导作用机制一致(除第四系地下水受一定的蒸发作用机制影响)[15]。不同水文期对比可知,丰水期较其他水文期的样点更靠近Gibbs图的右下方,说明该水文期的大气降水(降雨)作用增强。不同河段对比得出,中下游样点较上游分布更离散(图3-a),甚至超出阴离子模型图的边界(图3-b),说明除了岩石风化的主导作用外,中下游受人为活动作用加强,同时大气降水直接导致了地下水水位增加而汇入中下游河段,引起TDS浓度的增加[15]。因此,多因素共同作用下呈现了九曲溪水化学离子组分的空间差异。
综上所述,研究区水化学的作用机制以岩石风化作用为主,并且受一定程度的大气降水和人为作用影响。其中,岩石风化对上游河段作用要小于中下游,大气降水在丰水期影响更明显,人为活动对枯水期中下游的水化学组成影响更加突出。
2.2 水化学岩性控制类型及贡献
2.2.1 水化学岩性控制的主要类型
三角图和端元图都是利用水体中阴、阳离子的相对含量判断水化学的物质来源,两者同时运用可以相互补充和验证水化学的岩性控制端元[20,26]。
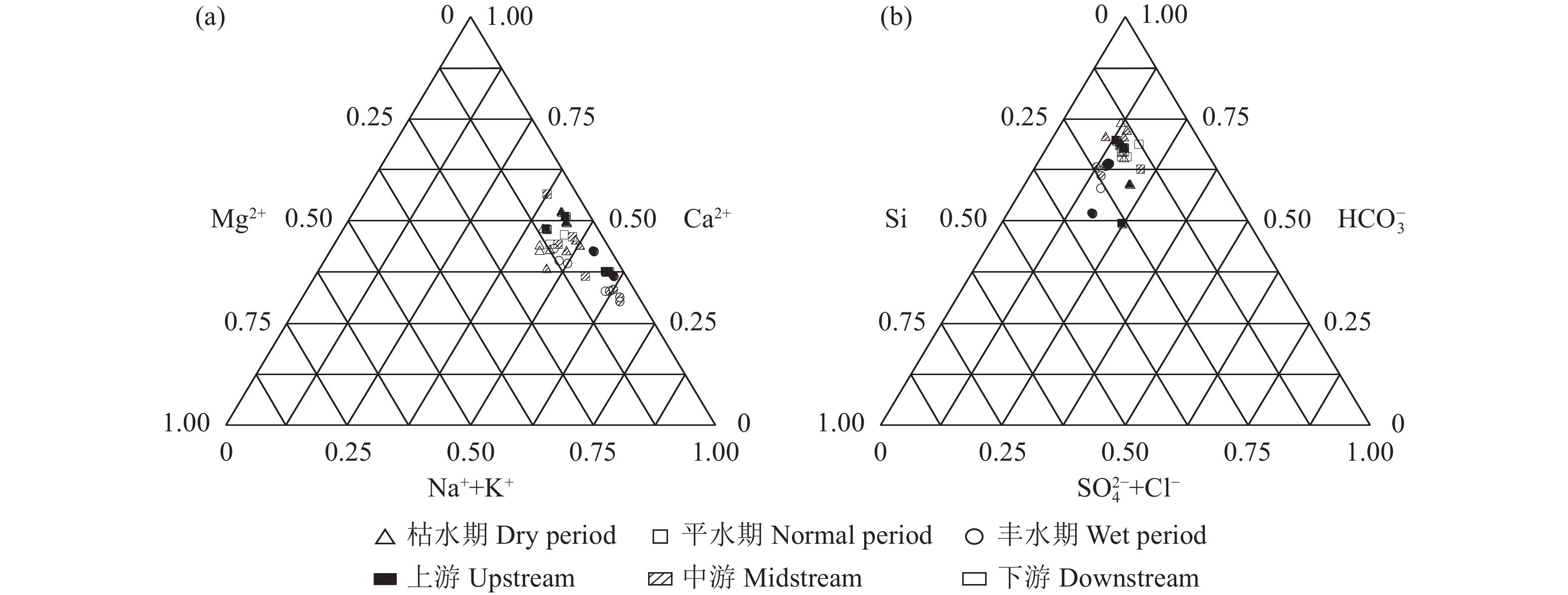
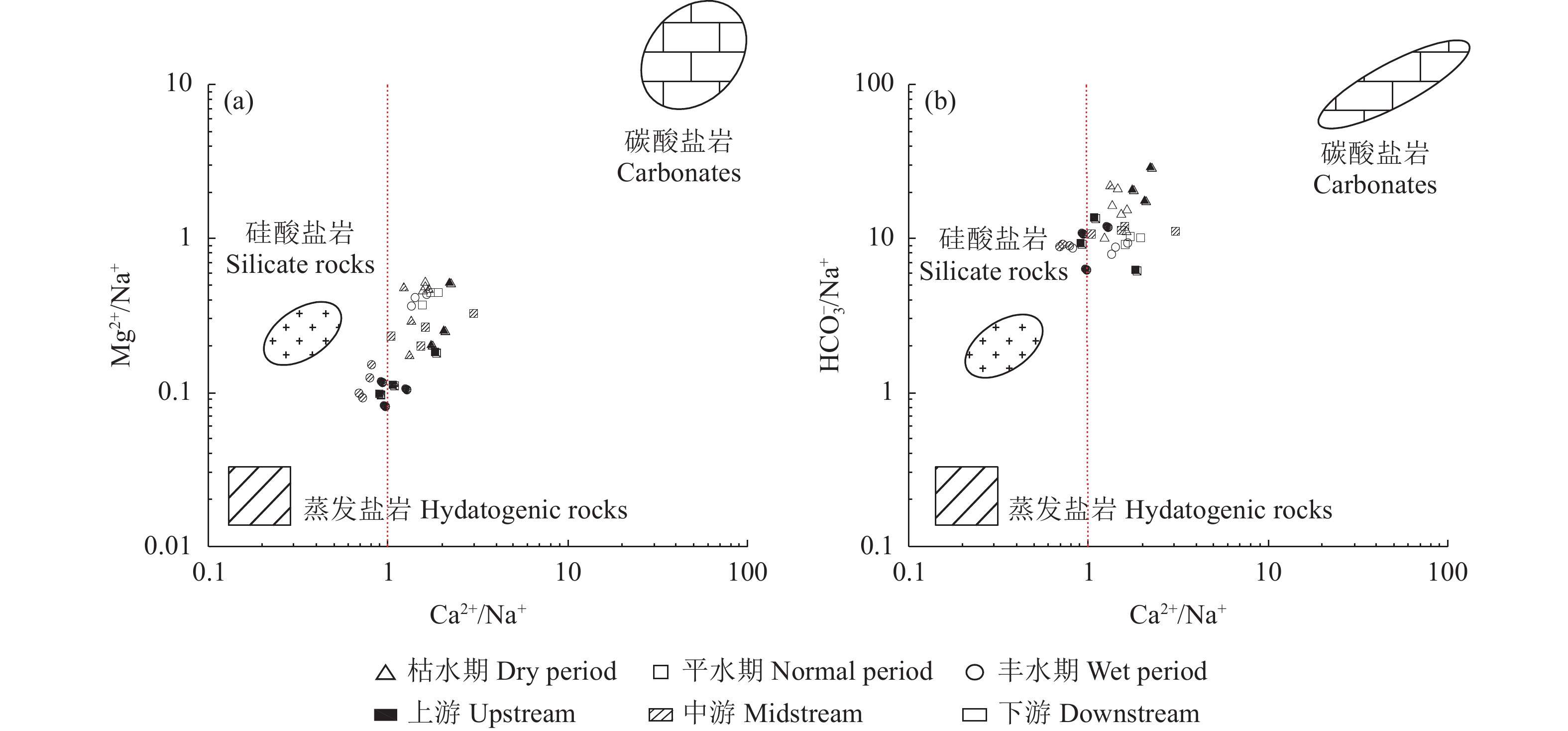
从水化学离子三角图(图4)可以看出,研究区水体样品集中于Mg2+-Ca2+线附近往Ca2+一端(图4-a)和Si-
HCO−3 线附近并侧重偏向HCO−3 峰值的一端(图4-b),可以初步判断研究区水化学物质来源中碳酸岩矿物[如方解石CaCO3和白云石CaMg(CO3)2]风化产物相对较多,硅酸岩矿物(如花岗岩中的石英SiO2和钠长石NaAlSi3O8)风化产物次之,蒸发岩矿物(如石膏和硬石膏岩CaSO4)风化产物最少。已有研究表明,河流水化学特征以硅酸盐岩性作用为主时,河水离子比值归一化数值Mg2+/Na+=0.24±0.12,Ca2+/Na+=0.35±0.15,
HCO−3 /Na+=2±1;碳酸盐控制区的比值数值高于硅酸盐岩区,而蒸发岩区则最低[24,27]。从水化学岩性端元图(图5)可以看出,水体主要阳离子中Ca2+/Na+比值基本大于1,采样点数值基本落在碳酸盐岩和硅酸盐岩之间,再次证实了碳酸岩与硅酸岩是研究区水化学岩性控制的主要物质来源,与三角图的岩性控制端元分析一致。实际上,不同岩性端元图的侧重点不同,反映了研究区水体Mg2+主要来源于硅酸岩和蒸发岩(Mg2+/Na+比值在0.08~0.53)(图5-a),HCO−3 主要来源于碳酸岩(HCO−3 /Na+比值在6.22~29.04)(图5-b)。虽然研究区广泛分布着大规模的花岗岩(以硅酸盐为主),但其抗风化能力强(化学风化速率只有碳酸盐岩的1/12、石膏的1/40、岩盐溶解的1/80[28-29]),因此,综合上文分析得出的研究区水化学类型为HCO−3 -Ca2++Na+型,可以进一步说明研究区水化学岩性控制整体以碳酸岩最占优势,硅酸岩次之,蒸发岩最少。结合三角图和端元图进一步分析研究区水化学时空分布差异的原因。从不同水文期比较看出,枯水期的样点更偏向
HCO−3 峰值的一端(图4-b)及碳酸岩端元(图5-b);丰水期的样点更偏向Na+ + K+一端(图4-a)及硅酸岩和蒸发岩端元(图5-a、b)。所以,可以推测降水很可能促进了研究区硅酸岩和蒸发岩的溶出或相应岩性类型地下水的汇入地表水[15]。从不同河段比较可知,九曲溪中下游的样点更偏向Na+ + K+一端(图4-a)及硅酸岩端元(图5)。因此,硅酸岩矿物风化对上游河段作用要小于中下游(碳酸岩风化作用相对增强)。2.2.2 水化学岩性控制的定量分析
为了定量分析岩石类型对流域水化学的贡献率,以SPSS统计分析软件对研究区水化学离子进行主成分分析和因子分析[20,30]。首先,对主要的水化学离子组分进行主成分分析,采用Varimax最大正交旋转法,使具有较大因子负载的变量个数减到最低限度[20],所得因子载荷见表2。其中,因子1主要与
HCO−3 、Cl−密切相关,可表征碳酸盐类来源;因子2中Si的荷载最高(0.923),可表征硅酸盐类来源[19];因子3主要与Ca2+、K+、Na+相关,可表征蒸发盐矿物(CaSO4)来源[19,31]。因此,因子1~3依次代表了碳酸盐岩、硅酸盐岩和蒸发盐岩3种主要岩性来源[20]。表 2 九曲溪水化学主成分分析的因子载荷Table 2. Component loadings of principal components Jiuquxi hydrochemistry变量
Variate因子1
Factor 1因子2
Factor 2因子3
Factor 3公共性方差
Publicity of varianceCa2+ 0.386 0.448 0.774 0.912 K+ 0.084 0.388 0.902 0.958 Mg2+ 0.312 0.776 0.423 0.847 Na+ 0.104 0.854 0.372 0.876 Si −0.191 0.923 0.126 0.854 HCO−3 0.852 0.407 0.100 0.897 Cl− 0.901 −0.144 0.242 0.883 NO−3 0.307 0.584 0.609 0.764 SO2−4 0.380 0.574 0.729 0.963 基于主成分的因子载荷结果(表2),将每个变量(主要离子)因子(分别对应因子1、2和3)载荷的平方除以其对应公共性方差,得到三种主要岩性(因子1、2和3对应的岩性类型)对各离子的相对方差贡献率[20],各离子的相对方差贡献率与其水体浓度乘积的总和除以 TDS 即为3种主要岩性的对应贡献率[13,32](表3)。
表 3 九曲溪与其他流域水化学物质来源的比较Table 3. Comparison on hydrochemistry of Jiuquxi River and rivers at other basins (单位:%)整体而言,研究区碳酸岩和硅酸岩矿物风化作用占主导地位,两者贡献率合计为58.82%,与三角图和端元图的岩性分析结果相符。其中,碳酸岩风化的贡献最大(32.07%),这与湿热地区碳酸盐类矿物风化较硅酸盐类的研究相符[33],但数值仍低于长江流域(碳酸盐岩作用更强)以及世界平均值[32]。研究区硅酸岩风化贡献率为26.75%,明显高于地理位置相近、岩性相似的赣南流域(硅酸盐岩风化贡献率仅6.60%)[20]。原因可能有:一方面,武夷山脉在中生代发生过强烈的地壳运动,导致大量的花岗岩入侵,使得研究区硅酸盐岩矿物含量较多,整体的风化贡献相对更高;另一方面,研究区森林覆盖率高达98.02% [34],且该地区常绿阔叶林生态系统林内雨和树干流的年均pH值约为5.5,明显低于林外雨的 pH 值(5.8)[18],酸化环境进一步促进了硅酸岩的风化作用[35]。由于硅酸岩风化是大气CO2的净碳汇,因此,武夷山国家公园区域内贡献较大的硅酸岩风化有利于提升其碳汇功能。此外,蒸发岩风化贡献率为14.85%,略高于世界平均值,并远低于韩江(拥有大量石膏易导致蒸发盐溶解贡献率增加)[10]。
从碳汇作用可知,碳酸岩矿物风化产生的
HCO−3 有一半为自身所含碳酸根提供,另一半由大气CO2参与形成;而硅酸岩风化产生的HCO−3 均来源于大气CO2;蒸发盐类风化过程中基本不消耗CO2[10,20]。因此,结合表2中HCO−3 的方差推算[20,31]和水化学离子浓度可以估算出大气CO2对研究区水化学物质来源贡献率为22.76%,低于世界河流的平均值[32],与赣南[20]、韩江[10]和长江[32]相近。此外,引入氯离子参考值Cl−ref[Cl−ref= F×Cl−rw,其中Cl−rw为大气降水Cl−浓度(μmol·L−1),F表示流域水分蒸发蒸腾损失量,F=P/(P-E),P表示流域的年均降水量(mm),E表示流域年均蒸发量(mm)]估算大气降水对河水溶质的贡献[32,36]。参考南平地区雨水Cl−浓度5.44 μmol·L−1[23],年平均降雨量和年平均蒸发量分别为1960 mm和1000 mm[13],得出研究区F=2.04,Cl−ref=11.10 μmol·L−1。在此基础上,结合运用海盐校正的方法[32,36]换算研究区不同水化学离子浓度,得出研究区大气降水对水化学物质贡献率为2.45%,略低于世界河流的平均值(3.00%)[24]。同时,假设其他因素(除了岩性和大气CO2来源之外)主要包括了大气降水(2.45%)和人为活动,可以推算出人为活动对研究区水化学物质贡献约为1.13%。综上所述,岩性分布、地壳活动和森林覆盖是决定岩性贡献大小的主要因素,而气候条件(气温、降水等)和人为活动也在一定程度影响着其化学风化速率的大小。
3. 讨论与结论
(1)研究区水化学主要离子总量范围为15.00~41.00 mg·L−1,水化学类型为
HCO−3 -Ca2++Na+型。主要离子含量变异的时间分布规律为:枯水期最高,平水期次之,丰水期最低,主要受降雨量的影响;空间分布整体表现为:下游>中游>上游,与不同河段的地形地貌及人为活动强度有关。(2)吉布斯模型显示研究区水化学的作用机制以岩石风化作用为主,并且受一定程度的大气降水和人为作用影响。其中,岩石风化对上游河段的水化学组成影响小于中下游;大气降水对丰水期的水化学组成影响大于其他水文期。
(3)三角图和端元图得出,研究区水化学岩性控制整体以碳酸岩最占优势,硅酸岩次之,蒸发岩最少。其中,硅酸盐和蒸发盐的控制作用在丰水期更突出,碳酸盐的控制作用则在枯水期更具优势;硅酸岩矿物风化对上游河段作用要小于中下游。
(4)主成分分析结果表明,研究区碳酸岩和硅酸岩矿物风化作用占主导地位,两者贡献率合计为58.82%,蒸发岩占比14.85%;同时,碳汇角度分析得出大气CO2对九曲溪水化学物质来源贡献率可达22.76%;此外,大气降水和人为活动影响分别为2.45%和1.13%。
-
表 1 ISSR扩增引物
Table 1 Amplified ISSR primers
引物
Primer引物序列(3′-5′)
Primer sequence(3′-5′)退火温度
Annealing
temperature/℃UBC811 GAGAGAGAGAGAGAGAC 51.2 UBC815 CTCTCTCTCTCTCTCTG 50.5 UBC825 ACACACACACACACACT 50.5 UBC834 AGAGAGAGAGAGAGAGYT 49 UBC835 AGAGAGAGAGAGAGAGYC 56 UBC836 AGAGAGAGAGAGAGAGYA 52 UBC840 GAGAGAGAGAGAGAGAYT 49 UBC841 GAGAGAGAGAGAGAGAYC 52 UBC844 CTCTCTCTCTCTCTCTRC 52 UBC845 CTCTCTCTCTCTCTCTRG 50.5 UBC846 CACACACACACACACART 51.2 UBC848 CACACACACACACACARG 55 UBC851 GTGTGTGTGTGTGTGTYG 52 UBC856 ACACACACACACACACYA 52 表 2 ISSR引物扩增产物的多态性
Table 2 Polymorphisms of ISSR primers amplified products
引物
Primer扩增条带总数
Total number of amplified bands/条多态性条带数
Polymorphic strips/条多态性条带占比
Percentage of polymorphic bands/%UBC811 20 20 100.0 UBC815 12 12 100.0 UBC825 18 16 88.9 UBC834 13 13 100.0 UBC835 15 15 100.0 UBC836 16 13 81.3 UBC840 12 12 100.0 UBC841 12 10 83.3 UBC844 15 15 100.0 UBC845 12 12 100.0 UBC846 16 16 100.0 UBC848 3 3 100.0 UBC851 9 8 88.9 UBC856 9 8 88.9 总数
Total182 173 95.1 -
[1] 王欣晨, 李文兰, 阎新佳, 等. 金花茶化学成分及药理活性研究 [J]. 哈尔滨商业大学学报(自然科学版), 2018, 34(5):522−527,563. WANG X C, LI W L, YAN X J, et al. Research on chemical constituents and pharmacological activities of flowers from Camellia chrysantha (Hu) Tuyama [J]. Journal of Harbin University of Commerce (Natural Sciences Edition), 2018, 34(5): 522−527,563.(in Chinese)
[2] 陈月圆, 黄永林, 文永新. 金花茶植物化学成分和药理作用研究进展 [J]. 广西热带农业, 2009(1):14−16. CHEN Y Y, HUANG Y L, WEN Y X. Advance in study on chemical constituents and pharmacological action of Camellia chrysantha [J]. Guangxi Tropical Agriculture, 2009(1): 14−16.(in Chinese)
[3] 宁恩创, 秦小明, 杨宏. 金花茶叶水提物的降脂功能试验研究 [J]. 广西大学学报(自然科学版), 2004, 29(4):350−352. NING E C, QIN X M, YANG H. The experimental study on regulating serum lipid of water soluble extractive from the leave of Camellia chrysantha (Hu) Tuyama [J]. Journal of Guangxi University (Natural Science Edition), 2004, 29(4): 350−352.(in Chinese)
[4] 王永奇, 彭晓, 唐前, 等. 金花茶组植物抗IgE介导Ⅰ型过敏反应的活性筛选 [J]. 中南药学, 2009, 7(10):721−724. WANG Y Q, PENG X, TANG Q, et al. Active fraction of IgE-mediated type I allergy from section chrysamtha changon [J]. Central South Pharmacy, 2009, 7(10): 721−724.(in Chinese)
[5] 马硕, 蒲志军, 张小玲, 等. 金花茶多酚对2型糖尿病大鼠胰腺的保护作用 [J]. 中国实验方剂学杂志, 2017, 23(18):89−93. MA S, PU Z J, ZHANG X L, et al. Protective effect of Camellia nitidissima polyphenols on pancreas in diabetic rats [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(18): 89−93.(in Chinese)
[6] 韦霄, 黄兴贤, 蒋运生, 等. 3种金花茶组植物提取物的抗氧化活性比较 [J]. 中国中药杂志, 2011, 36(5):639−641. WEI X, HUANG X X, JIANG Y S, et al. Comparison of antioxidant activities of extracts from three Camellia species [J]. China Journal of Chinese Materia Medica, 2011, 36(5): 639−641.(in Chinese)
[7] 李翠云, 段小娴, 苏建家, 等. 金花茶对二乙基亚硝胺致大鼠肝癌前病变及肝癌细胞株作用的影响 [J]. 广西医科大学学报, 2007, 24(5):660−663. DOI: 10.3969/j.issn.1005-930X.2007.05.002 LI C Y, DUAN X X, SU J J, et al. Impact of leaves and flowers of camellia chrysantha (hu) tuyama of different concentrations on diethylnitrosaminal-induced precancerous lision to liver of rat and hepatoma cells bel-7404 [J]. Journal of Guangxi Medical University, 2007, 24(5): 660−663.(in Chinese) DOI: 10.3969/j.issn.1005-930X.2007.05.002
[8] 张宏达. 华夏植物区系的金花茶组 [J]. 中山大学学报(自然科学版), 1979, 18(3):69−74. ZHANG H D. Chrysantha, A section of golden camellias from cathaysian flora [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni(National Science Edition), 1979, 18(3): 69−74.(in Chinese)
[9] 梁盛业. 世界金花茶植物名录 [J]. 广西林业科学, 2007, 36(4):221−223. LIANG S Y. The world list of Camellia [J]. Guangxi Forestry Science, 2007, 36(4): 221−223.(in Chinese)
[10] 赖彦池. 凹脉金花茶的保护遗传学研究[D]. 桂林: 广西师范大学, 2021. LAI Y C. Conservation genetic of Camellia impressinervis[D]. Guilin: Guangxi Normal University, 2021.
[11] HEBERT P D N, CYWINSKA A, BALL S L, et al. Biological identifications through DNA barcodes [J]. Proceedings Biological Sciences, 2003, 270(1512): 313−321. DOI: 10.1098/rspb.2002.2218
[12] CHASE M W, SALAMIN N, WILKINSON M, et al. Land plants and DNA barcodes: Short-term and long-term goals [J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2005, 360(1462): 1889−1895. DOI: 10.1098/rstb.2005.1720
[13] PATRICK O, JOHN M, DENNIS O, et al. Molecular footprint of Kenya's gene bank repositories based on the cp-genome signatures [J]. American Journal of Molecular Biology, 2018, 8(4): 215−244. DOI: 10.4236/ajmb.2018.84019
[14] LI J S, YANG M, LI Y N, et al. Chloroplast genomes of two Pueraria DC. species: Sequencing, comparative analysis and molecular marker development [J]. FEBS Open Bio, 2022, 12(2): 349−361. DOI: 10.1002/2211-5463.13335
[15] PARK I, SONG J H, YANG S, et al. Comparative analysis of Actaea chloroplast genomes and molecular marker development for the identification of authentic cimicifugae rhizoma [J]. Plants (Basel, Switzerland), 2020, 9(2): 157.
[16] ZHANG H, TANG S, SCHNABLE J C, et al. Genome-wide DNA polymorphism analysis and molecular marker development for the Setaria italica variety SSR41 and positional cloning of the Setaria white leaf sheath gene SiWLS1 [J]. Frontiers in Plant Science, 2021, 12: 743782. DOI: 10.3389/fpls.2021.743782
[17] PEI N C, CHEN B F, KRESS W J. Advances of community-level plant DNA barcoding in China [J]. Frontiers in Plant Science, 2017, 8: 225.
[18] KOCYAN A, SNIJMAN D A, FOREST F, et al. Molecular phylogenetics of Hypoxidaceae - Evidence from plastid DNA data and inferences on morphology and biogeography [J]. Molecular Phylogenetics and Evolution, 2011, 60(1): 122−136. DOI: 10.1016/j.ympev.2011.02.021
[19] 陈春梅, 马春雷, 马建强, 等. 茶树cpDNA测序及基于cpDNA序列的山茶属植物亲缘关系研究 [J]. 茶叶科学, 2014, 34(4):371−380. DOI: 10.3969/j.issn.1000-369X.2014.04.010 CHEN C M, MA C L, MA J Q, et al. Sequencing of chloroplast genome of Camellia sinensis and genetic relationship for Camellia plants based on chloroplast DNA sequences [J]. Journal of Tea Science, 2014, 34(4): 371−380.(in Chinese) DOI: 10.3969/j.issn.1000-369X.2014.04.010
[20] 方伟, 杨俊波, 杨世雄, 等. 基于叶绿体四个DNA片段联合分析探讨山茶属长柄山茶组、金花茶组和超长柄茶组的系统位置与亲缘关系 [J]. 云南植物研究, 2010, 32(1):1−13. DOI: 10.3724/SP.J.1143.2010.00001 FANG W, YANG J B, YANG S X, et al. Phylogeny of Camellia sects. Longipedicellata, chrysantha and longissima(Theaceae) based on sequence data of four chloroplast DNA loci [J]. Acta Botanica Yunnanica, 2010, 32(1): 1−13.(in Chinese) DOI: 10.3724/SP.J.1143.2010.00001
[21] 肖政, 李纪元, 李志辉, 等. 金花茶组物种遗传关系的ISSR分析 [J]. 林业科学研究, 2014, 27(1):71−76. XIAO Z, LI J Y, LI Z H, et al. Genetic relationships among species from Camellia sect. chrysantha Chang revealed by ISSR analysis [J]. Forest Research, 2014, 27(1): 71−76.(in Chinese)
[22] 张玥, 蓝增全, 吴田. 云南大围山金花茶种质资源的ISSR分析 [J]. 分子植物育种, 2018, 16(2):649−655. ZHANG Y, LAN Z Q, WU T. ISSR analysis of Camellia nitidissima germplasm resources from dawei mountain in Yunnan [J]. Molecular Plant Breeding, 2018, 16(2): 649−655.(in Chinese)
[23] 罗在柒, 陆俊, 李荣京, 等. 贵州金花茶种质资源ISSR分析及指纹图谱库构建 [J]. 乡村科技, 2020, 11(22):118−120. DOI: 10.3969/j.issn.1674-7909.2020.22.060 LUO Z Q, LU J, LI R J, et al. ISSR analysis and fingerprint database construction of Camellia chrysantha germplasm resources in Guizhou [J]. Countryside Technology, 2020, 11(22): 118−120.(in Chinese) DOI: 10.3969/j.issn.1674-7909.2020.22.060
[24] 覃小玲, 史艳财, 李承卓, 等. 基于FTIR技术金花茶组植物物种鉴定研究 [J]. 光谱学与光谱分析, 2012, 32(10):2685−2689. DOI: 10.3964/j.issn.1000-0593(2012)10-2685-05 QIN X L, SHI Y C, LI C Z, et al. Study on Camellia sect. chrysantha Chang species identification by FTIR technology [J]. Spectroscopy and Spectral Analysis, 2012, 32(10): 2685−2689.(in Chinese) DOI: 10.3964/j.issn.1000-0593(2012)10-2685-05
[25] 张晓丽, 代红军. 植物RNA提取方法的研究进展 [J]. 北方园艺, 2014(8):175−178. ZHANG X L, DAI H J. Research progress on extraction method of plant RNA [J]. Northern Horticulture, 2014(8): 175−178.(in Chinese)
[26] HEINRICH M, ANAGNOSTOU S. From pharmacognosia to DNA-based medicinal plant authentication - pharmacognosy through the centuries [J]. Planta Medica, 2017, 83(14/15): 1110−1116. DOI: 10.1055/s-0043-108999
[27] 刘红梅, 张存艳, 叶强, 等. 基于DNA条形码技术对喉红石斛的植物学分类研究 [J]. 中草药, 2021, 52(21):6656−6662. DOI: 10.7501/j.issn.0253-2670.2021.21.023 LIU H M, ZHANG C Y, YE Q, et al. Botanical Classification of Dendrobium christyanum based on DNA barcode technology [J]. Chinese Traditional and Herbal Drugs, 2021, 52(21): 6656−6662.(in Chinese) DOI: 10.7501/j.issn.0253-2670.2021.21.023
[28] NNEJI L M, ADEOLA A C, AYOOLA A O, et al. DNA barcoding and species delimitation of butterflies (Lepidoptera) from Nigeria [J]. Molecular Biology Reports, 2020, 47(12): 9441−9457. DOI: 10.1007/s11033-020-05984-5
[29] SARAVANAN M, MOHANAPRIYA G, LAHA R, et al. DNA barcoding detects floral origin of Indian honey samples [J]. Genome, 2019, 62(5): 341−348. DOI: 10.1139/gen-2018-0058
[30] DE VERE N, RICH T C G, TRINDER S A, et al. DNA barcoding for plants [J]. Methods in Molecular Biology (Clifton, N J), 2015, 1245: 101−118.
[31] TAN S L, LUO Y H, HOLLINGSWORTH P M, et al. DNA barcoding herbaceous and woody plant species at a subalpine forest dynamics plot in Southwest China [J]. Ecology and Evolution, 2018, 8(14): 7195−7205. DOI: 10.1002/ece3.4254
[32] GILL B A, MUSILI P M, KURUKURA S, et al. Plant DNA-barcode library and community phylogeny for a semi-arid East African savanna [J]. Molecular Ecology Resources, 2019, 19(4): 838−846. DOI: 10.1111/1755-0998.13001
[33] SUCHER N J, HENNELL J R, CARLES M C. DNA fingerprinting, DNA barcoding, and next generation sequencing technology in plants[M]//Methods in Molecular Biology. Totowa, NJ: Humana Press, 2012: 13-22.
[34] VIGLIANTE I, MANNINO G, MAFFEI M E. Chemical characterization and DNA fingerprinting of Griffonia simplicifolia baill [J]. Molecules (Basel, Switzerland), 2019, 24(6): 1032. DOI: 10.3390/molecules24061032
[35] BOBAN S B, MAURYA S, JHA Z. DNA fingerprinting: An overview on genetic diversity studies in the botanical taxa of Indian Bamboo [J]. Genetic Resources and Crop Evolution, 2022, 69(2): 469−498. DOI: 10.1007/s10722-021-01280-8
[36] ARSHAD H, SHADMA W, MOUSTAFA M. Pharmacognostic standardization and DNA fingerprinting of leaves of Datura stramonium, growing naturally in Asir region of Saudi Arabia [J]. Pakistan Journal of Pharmaceutical Sciences, 2020, 33(3): 1155−1161.
[37] 姚敏. 槭叶铁线莲亚组的遗传多样性和居群动态变化研究[D]. 北京: 北京林业大学, 2021. YAO M. Genetic diversity and population dynamics of Clematis subsect. acerifoliae[D]. Beijing: Beijing Forestry University, 2021. (in Chinese)
[38] 黄蕾, 邢晓成, 张雨曲, 等. 地理因素对箭竹复合体遗传多样性与遗传分化的影响 [J]. 西北植物学报, 2021, 41(5):872−879. DOI: 10.7606/j.issn.1000-4025.2021.05.0872 HUANG L, XING X C, ZHANG Y Q, et al. Effect of geographic factors on the genetic diversity and divergence of Fargesia spathacea complex [J]. Acta Botanica Boreali-Occidentalia Sinica, 2021, 41(5): 872−879.(in Chinese) DOI: 10.7606/j.issn.1000-4025.2021.05.0872
[39] 李爽, 刘上丽, 裴思玉, 等. 基于单拷贝核基因PAL研究贵州金花茶遗传多样性 [J]. 广西师范大学学报(自然科学版), 2021, 39(1):128−135. LI S, LIU S L, PEI S Y, et al. A study on genetic diversity of Camellia huana by single-copy nuclear gene PAL [J]. Journal of Guangxi Normal University (Natural Science Edition), 2021, 39(1): 128−135.(in Chinese)
[40] 骆亮, 张文春, 李龙, 等. 不同居群朱砂根(Ardisia crenata)的荧光ISSR遗传多样性分析 [J]. 分子植物育种, 2021, 19(18):6235−6247. LUO L, ZHANG W C, LI L, et al. Genetic diversity analysis of Ardisia crenata in different populations by fluorescence ISSR [J]. Molecular Plant Breeding, 2021, 19(18): 6235−6247.(in Chinese)
[41] 杨卓, 杨晓杰, 付学鹏. 扎龙湿地10个不同居群芦苇的ITS序列分析 [J]. 种子, 2021, 40(11):122−125. DOI: 10.16590/j.cnki.1001-4705.2021.11.122 YANG Z, YANG X J, FU X P. ITS sequence analysis of 10 different populations of Phragmites australis in Zhalong wetland [J]. Seed, 2021, 40(11): 122−125.(in Chinese) DOI: 10.16590/j.cnki.1001-4705.2021.11.122
[42] 马翠苹, 周先容, 尚进, 等. 四川花萼山不同海拔巴山榧树居群的遗传多样性 [J]. 分子植物育种, 2018, 16(19):6517−6524. DOI: 10.13271/j.mpb.016.006517 MA C P, ZHOU X R, SHANG J, et al. Genetic diversity of Torreya fargesii populations at different altitudes in Hua'eshan, Sichuan Province [J]. Molecular Plant Breeding, 2018, 16(19): 6517−6524.(in Chinese) DOI: 10.13271/j.mpb.016.006517
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载: