Effects of Planting Varieties of Arundo Grass on Soil Enzyme Activities and Microbial Community
-
摘要:目的 分析种植芦竹属菌草对土壤养分、酶活及微生物群落结构的影响,探讨种植芦竹属菌草对土壤的改良作用。方法 对种植芦竹属6个品种菌草前后土壤养分、酶活进行检测,采用Illumina-MiSeq高通量测序技术分析微生物多样性和群落结构。结果 芦竹属6个不同品种菌草种植后,与未种植芦竹的空白对照地相比,种植绿洲1号、绿洲9号土壤中速效磷(8.20 mg·kg−1、8.72 mg·kg−1)、速效氮(22.63 mg·kg−1、18.20 mg·kg−1)、有机碳(13.83 g·kg−1、10.48 g·kg−1)和总氮(0.84 g·kg−1、0.71 g·kg−1)的含量均显著高于对照组(2.54 mg·kg−1、14.47 mg·kg−1、5.27g·kg−1、0.38 g·kg−1)的含量(P<0.05);且种植芦竹属菌草后的土壤酶活性均有不同程度的升高,其中绿洲1号和绿洲9号土壤脲酶活性显著高于对照组(P<0.05)。Pearson相关性分析结果显示:脲酶活性与土壤速效磷、速效氮、有机碳和全氮等均有显著的相关性(P<0.01),蔗糖酶与几种土壤养分无显著的相关性。种植芦竹后,土壤细菌和真菌多样性评估指数均高于对照组,其中绿洲1号和绿洲3号的Ace指数、Chao指数和Shannon指数均显著高于对照组(P<0.05);Pearson相关性分析结果显示:微生物多样性细菌Ace指数和Chao指数与蔗糖酶活性、酸性磷酸酶活性呈极显著的正相关(P<0.01),微生物多样性真菌指数Shannon指数与ACP活性呈显著的正相关(P<0.05)。结论 在贫瘠的土壤条件下种植芦竹属菌草,能够起到改良土壤,提高土壤酶活性和土壤微生物多样性的积极作用,为种植芦竹属菌草(尤其是绿洲1号、绿洲3号和绿洲9号)的推广提供数据支撑和理论依据。Abstract:Objective Effects of planting different species of Arundo on the nutrients, enzyme activities, and microbial community of the soil were investigated.Method Nutrients and enzyme activities in the soil were analyzed before and after on which different varieties of arundo grass were planted. Pearson analysis was applied to corelate the factors. Diversity of microbial community in soil was determined by illumina miseq high-throughput sequencing.Results Six different Arundo species were planted in a pot experiment. In the soils that lvzhou 1 and lvzhou 9 were planted, the contents of available phosphorus (8.20 and 8.72 mg·kg−1, respectively), available nitrogen (22.63 and 8.20 mg·kg−1, respectively), organic carbon (13.83 and 10.48 g·kg−1, respectively), and total nitrogen (0.84 and 0.71 g·kg−1, respectively) were significantly higher than those in control (2.54 mg·kg−1, 14.47 mg·kg−1, 5.72 g·kg−1, and 0.38 g·kg−1, respectively) (P<0.05). The urease activity was significantly higher than that of control (P<0.05). The activities of urease significantly correlated with the available phosphorus, available nitrogen, organic carbon, and total nitrogen in the soil (P<0.01) but not on the invertase (P>0.05). The microbial diversity indices of the soil were higher after the grass planting than before, while the Ace, Chao, and Shannon indices of the soil planted with lvzhou 1 or lvzhou 3 significantly higher than those of control (P<0.05). The bacterial Ace and Chao indices all positively correlated with the invertase and ACP activities (P<0.01), the Shannon index on fungi showed with the ACP activity (P<0.05).Conclusion Planting arundo grasses, especially lvzhou 1 or lvzhou 3, on an infertile land could conceivably improve the soil quality due to the enrichments brought about through increased enzyme activity and microbial diversity.
-
Keywords:
- arundo grass /
- soil nutrient /
- soil enzyme activity /
- soil microbial community
-
0. 引言
【研究意义】芦竹(Arundo donax L.)属被子植物门的禾本科芦竹属,是一种多年生的草本植物,其植株高大,产量高,生长3年的芦竹生物量可达35 kg·m−2。芦竹综合利用价值高,可生产食用菌、板材、纸张,作为生物质能源发电、生产沼气,还可用于生态治理等。芦竹对土壤酶活及土壤微生物群落的影响的研究,可为芦竹的推广种植提供理论基础,促进芦竹的开发利用,为实现双碳目标贡献力量。【前人研究进展】土壤微生物作为陆地生态系统中的重要角色,参与土壤中有机质分解与转换、养分的循环与利用和土壤结构与形成等诸多主要生态学过程,能够促进土壤物质循环、稳定与保持土壤的生产力和健康,且作物的生长与病害、土壤环境及温室气体的排放等都与土壤微生物密切相关[1-5],而土壤微生物的多样性和分布与土壤肥力及其所处的环境亦密切相关[6]。Zimmerman等研究表明,土壤细菌、真菌和放线菌可决定土壤微生物总量的分布以及有机物的分解与转化[7];此外,土壤微生物还是土壤酶的主要来源,土壤酶几乎参与土壤中所有的生物化学反应,酶活性表征着土壤中物质代谢的旺盛程度,是土壤肥力的一个重要指标,同时土壤酶影响着土壤微生物数量和群落结构[8-9]。菌草是指所含营养适合食用菌、药用菌等微生物生长需要,并具有综合开发利用价值的草本植物[10-13],主要包括禾本科、里白科等共计20多个属46个种的植物[14-15],芦竹属菌草品种是菌草的重要组成部分。20世纪80年代,为了替代林木作为培养基栽培食(药)用菌,菌草概念应运而生,随之菌草栽培食药用菌、菌草生态治理、菌草菌物饲料等应用方面的研究相继开展[16],实现了在促进食用菌产业可持续发展的同时,经济、生态与社会三者效益的有机统一[12]。菌草的太阳能转化率为阔叶树的4~6倍,根量为一般农作物的3~5倍,维系土壤肥力比农作物高15倍。因此,它对土壤的防冲能力和吸附雨水能力要强于森林和农作物,故被称作为环境保护和修复的最好植物之一[17]。【本研究切入点】对于芦竹属菌草,在其综合利用方面有较多的研究,但在生态治理方面,有研究表明在荒漠化土壤种植Lz1可显著提高沙质土壤有机质含量,土壤中活性酶及微生物总量也显著增多[18],而对其他芦竹品种以及在黏质土的微生物种群情况,则有待深入研究。【拟解决的关键问题】通过对种植芦竹属6种不同菌草后的土壤开展研究,解析种植前后土壤酶活和土壤微生物群落结构的变化。采用Illumina-MiSeq高通量测序技术,对种植芦竹属6种不同菌草和未种植任何植物的土壤微生物进行测序,发现和挖掘芦竹属不同菌草的种植对土壤微生物群落多样性的影响,以及土壤微生物多样性与土壤养分、土壤酶活之间的关系,为做好菌草种植、推广以及菌草生态治理等提供参考和借鉴。
1. 材料与方法
1.1 研究区概况
位于福州市闽侯县福建农林大学旗山校区内,国家菌草工程技术研究中心菌草种质资源圃(N26.05°,E119.18°),该地区属于亚热带海洋性季风气候,气温适宜,温暖湿润,四季常青,阳光充足,雨量充沛,霜少无雪,夏长冬短,无霜期达326 d,年平均日照数为1 700~1 980 h;年平均降水量为900~2 100 mm;年平均气温为20~25 ℃,年相对湿度约77%。
1.2 试验方法
采样点为种植5年后的芦竹属(Arundo L.)6个菌草品种,由福建农林大学国家菌草工程技研究中心菌草种质资源圃提供,其中绿洲1号Lz1(H)、绿洲2号Lz2(I)、绿洲3号Lz3(J)、绿洲5号Lz5(K)、绿洲6号Lz6(L)和绿洲9号Lz9(M)分别来自莱索托、山东、福建、厄立特里亚、西藏和陕西,空白对照(CK)为中心菌草种质资源圃周围未种植任何植物的区域。每种菌草种植区30 m2,种植区内随机选取3处,根据5点取样法在每个采样点取样,去除表层残叶和浮土,取根系周围5 ~30 cm深度的土壤,每处采集的5点土样混匀为1个样品,每个试验区分别采集3个样品。采集样品后,去除植物根、动物残骸及其他杂质,混匀过2 mm筛,一部分保存在10 mL无菌离心管中,用干冰保存送往北京奥维森基因科技有限公司,对采集的土壤样品进行微生物多样性检测;另一部分将采集的土壤放入密封袋中,常温避光条件下风干、磨细和过筛,进行土壤样品分析,均随机采集3个生物学重复。
1.3 土壤养分和酶活性测定
土壤pH值采用pH计测定,土壤有机碳、速效磷、速效氮和全氮等养分采用《土壤农化分析》[19]的方法进行测定;土壤酶活性采用苏州科铭生物科技有限公司购买的试剂盒测定。
1.4 土壤微生物多样性测定分析方法
取土壤样品0.5 g,根据E.Z.N.A. Soil DNAKit试剂盒说明书操作流程提取土壤总DNA,然后对提取的土壤总DNA分别进行细菌16SrDNA和真菌ITS扩增。将真菌和细菌的扩增子构建Miseq文库,Illumina Miseq上机测序,利用Trimmomatic、Pear对原始数据进行质控、过滤、拼接得到有效数据,然后对测序结果进行个性化分析。
1.5 数据处理
采用 SPSS 23.0 和GraphPad Prism 8.3软件进行数据分析,采用SPSS单因素(one-way ANOVA)法进行方差分析和差异显著性比较,用Pearson法进行相关性分析。采用GraphPad Prism 8.3软件作图。图表中数据均为平均值±标准差。
2. 结果与分析
2.1 种植不同菌草对土壤养分及土壤酶活的影响
2.1.1 土壤基础养分
从表1看出,芦竹属不同菌草种植区域的土壤均偏酸性,其中Lz3的土壤pH值最低,为5.43;Lz6土壤pH值6.21,且与对照组、Lz1、Lz2、Lz3和Lz9之间存在显著差异(P<0.05)。种植菌草的土壤中速效磷(AP)含量均高于对照组未种植菌草的AP含量,其中Lz9和Lz1土壤速效磷含量最高,均大于8.00 mg·kg−1,差异显著(P<0.05)。土壤中的速效氮(AN)和全氮(TN)含量基本一致,均是Lz1含量最高,且显著高于未种植菌草的土壤速效氮和全氮含量(P<0.05)。土壤中有机碳(SOC)含量亦是Lz1最高,Lz9和Lz3次之,与未种植菌草对照组土壤有机碳含量有显著性差异(P<0.05)。
表 1 种植芦竹属不同菌草对土壤主要养分的影响Table 1. Nutrients in soil as affected by planting of different arundo grasses处理 Treatment pH 速效磷 AP/(mg·kg−1) 速效氮 AN/(mg·kg−1) 有机碳 SOC/(g·kg−1) 全氮 TN/(g·kg−1) CK 5.82±0.13 b 2.54±0.20 c 14.47±0.31 d 5.27±0.11 e 0.38±0.016 f Lz1 5.57±0.25 bc 8.20±0.76 a 22.63±0.64 a 13.83±0.44 a 0.84±0.0085 a Lz2 5.60±0.22 bc 4.63±0.44 b 15.52±0.53 cd 8.99±0.30 c 0.56±0.044 d Lz3 5.43±0.12 cd 3.59±0.12 bc 19.13±0.42 b 9.98±0.32 b 0.64±0.015 c Lz5 6.05±0.11 ab 3.82±0.10 bc 16.10±0.61 c 8.68±0.28 c 0.50±0.012 e Lz6 6.21±0.13 a 4.67±0.62 b 14.12±0.40 d 7.25±0.13 d 0.50±0.022 e Lz9 5.80±0.21 b 8.72±0.37 a 18.20±0.61 b 10.48±0.32 b 0.71±0.0098 b 同列数据后不同小写字母表示处理间的差异达显著水平(P<0.05)。
Data with different lowercase letters on same column indicate significant differences between treatments (P<0.05).2.1.2 土壤酶活
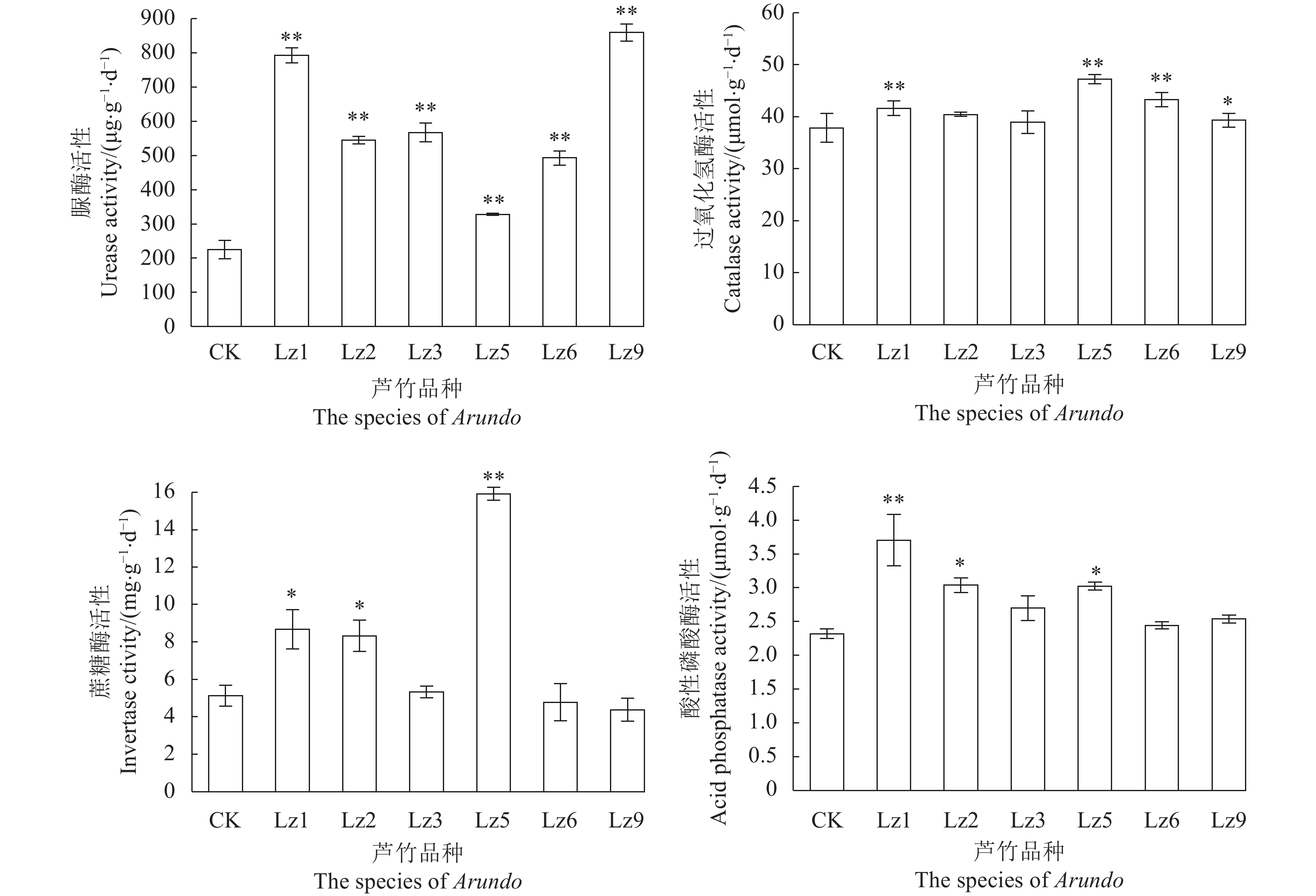
不同土壤样品的酶活性如图1所示,种植菌草的土壤脲酶(URE)活性均极显著高于对照组(P<0.01),其中Lz9脲酶活性最高(859.40 μg·g−1·d−1),Lz1次之(793.40 μg·g−1·d−1)。Lz5土壤中过氧化氢酶(CAT)活性最高(47.19 μmol·g−1·d−1),Lz6次之(43.26 μmol·g−1·d−1),均极显著高于未种植菌草的土壤酶活(P<0.01)。Lz5土壤中的蔗糖酶(INV)活性最高(15.91 mg·g−1·d−1),且极显著高于未种植菌草的土壤蔗糖酶酶活(P<0.01),Lz1的土壤酸性磷酸酶(ACP)活性极显著高于未种植菌草的ACP活性(P<0.01)。
2.1.3 土壤特性与土壤酶活相关性分析
由表2 Pearson相关性结果分析可知,土壤过氧化氢酶与土壤pH值有显著的正相关性(P<0.05)。土壤脲酶、蔗糖酶和酸性磷酸酶与pH值均无显著相关性。土壤脲酶与速效磷、速效氮、有机碳和全氮均有极显著的正相关性(P<0.01);相反,过氧化氢酶与速效磷、速效氮、有机碳和全氮均有极显著的负相关性(P<0.01)。而土壤蔗糖酶与速效磷、速效氮、有机碳和全氮相关性不显著(P>0.05),土壤酸性磷酸酶与速效氮、全氮均有显著的正相关性(P<0.05),与有机碳有极显著正相关性(P <0.01)。
表 2 土壤特性与土壤酶活的Pearson相关性Table 2. Pearson correlation between characteristics and enzyme activity of soil项目 Items pH 速效磷 AP 速效氮 AN 有机碳 SOC 全氮 TN 脲酶 URE −0.327 0.882** 0.690** 0.807** 0.910** 过氧化氢酶 CAT 0.426* −0.715** −0.622** −0.638** −0.784** 蔗糖酶 INV 0.064 −0.088 0.029 0.132 −0.070 酸性磷酸酶 ACP −0.181 0.197 0.464* 0.620** 0.506* *表示在0.05水平上差异显著,**表示在0.01水平上差异极显著。表4同。
* represents significant at the 0.05 probability level, ** represents significant at the 0.01 probability level. Same for Table 4.2.2 不同菌草种植对土壤微生物多样性及群落结构的影响
2.2.1 土壤微生物多样性
土壤微生物多样性的评估指数结果分析见表3,其中Chao指数代表群落丰富度,数值越大表明物种丰度越高;Shannon指数代表群落多样性,数值越大表明其群落多样性越高。由分析结果可知,种植几种菌草的土壤细菌Ace、Chao指数均显著高于对照组未种植菌草(P<0.05),Lz1、Lz2和Lz5细菌Shannon指数显著高于对照组(P<0.05),而Coverage指数和Simpson指数与对照组差异均不显著(P>0.05)。Lz1、Lz2和Lz3的土壤真菌Ace、Chao指数显著高于对照组(P<0.05),种植几种菌草的土壤真菌Shannon指数均显著高于对照组(P<0.05),而土壤Simpson指数只有Lz6显著低于对照组(P<0.05),Coverage指数与对照组差异均不显著(P>0.05)。分析结果表明7个样品的细菌文库覆盖率均达到96%、真菌文库覆盖率达99%,表明大部分微生物种群均能被检测出,可代表样本的真实情况。
表 3 不同土壤样品微生物丰度和多样性Table 3. Microbial abundance and diversity of soil samples评估指数
Assessment
indexCK Lz1 Lz2 Lz3 Lz5 Lz6 Lz9 细菌
BacteriaAce 3140.06±66.27 d 3680.22±78.84 ab 3686.17±46.09 a 3521.67±23.83 c 3814.67±33.64 a 3473.21±46.64 c 3526.08±41.77 b Shannon 9.36±0.13 b 9.77±0.072 a 9.72±0.028 a 9.58±0.060 ab 10.07±0.015 a 9.53±0.017 ab 9.56±0.061 ab Chao 3421.69±69.59 d 4139.99±57.67 a 4165.19±45.92 a 4062.60±49.83 ab 42225.80±24.29 a 3877.68±44.56 c 3937.11±63.52 bc Coverage 0.96 a 0.96 a 0.96 a 0.96 a 0.96 a 0.96 a 0.96 a Simpson 1.00 a 1.00 a 1.00 a 1.00 a 1.00 a 1.00 a 1.00 a 真菌
FungiAce 1066.61±36.88 cd 1423.82±80.32 ab 1268.97±21.65 b 1506.86±55.88 a 1201.24±66.81 c 1152.33±21.45 cd 1169.85±37.85 cd Shannon 4.50±0.0057 c 6.63±0.14 a 6.70±0.11 a 6.14±0.095 b 6.86±0.11 a 6.87±0.12 a 6.29±0.13 b Chao 1098.08±40.35 cd 1584.29±49.62 a 1454.06±51.65 ab 1619.30±60.94 a 1324.21±54.43 bc 1098.20±17.18 cd 1247.04±63.83 bc Coverage 0.99 a 0.99 a 0.99 a 0.99 a 0.98 a 0.99 a 0.99 a Simpson 0.96 a 0.97 a 0.98 a 0.95 a 0.97 a 0.75 b 0.96 a 同行数据后不同小写字母表示处理间显著性差异(P<0.05)。
Data with different lowercase letters on same row indicated significant differences between treatments (P<0.05).2.2.2 土壤微生物群落结构
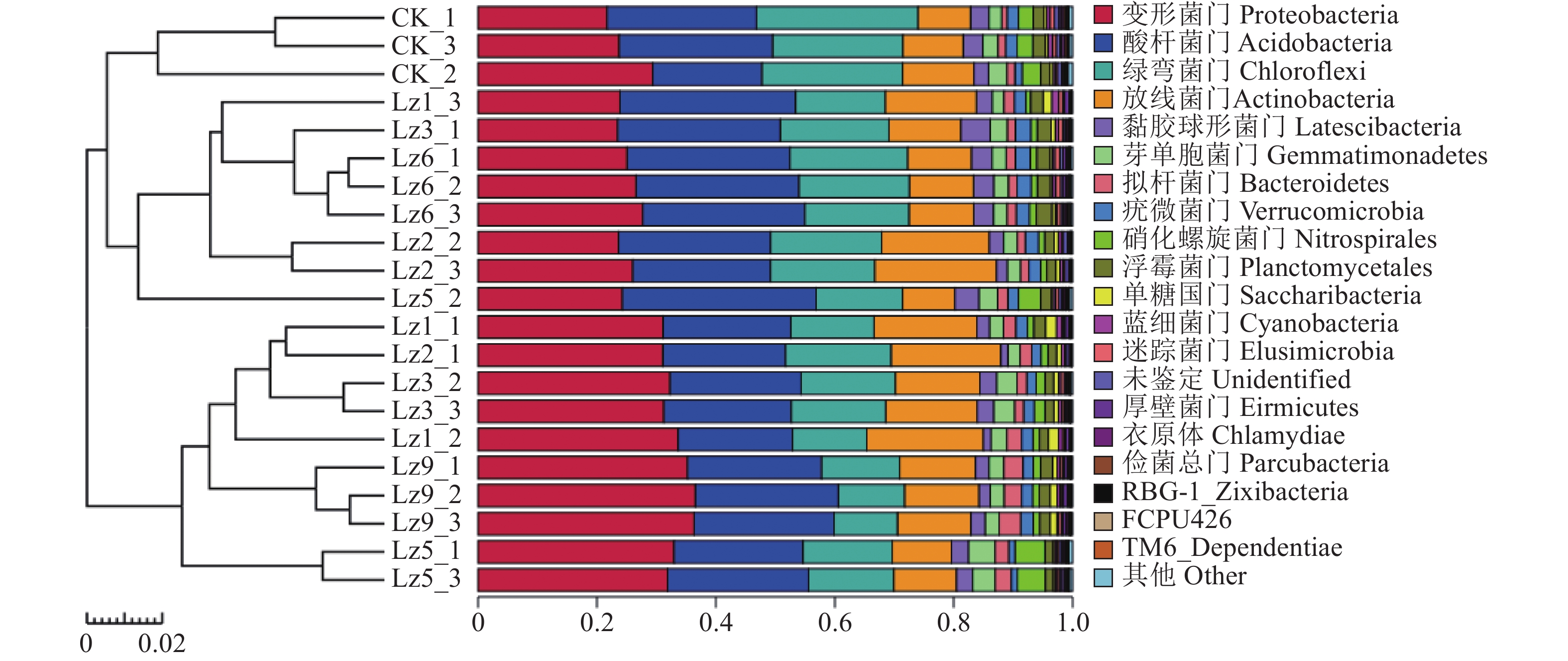
由图2可知,种植菌草的土壤样品中变形菌门(Proteobacteria)的相对丰度均高于对照组,Lz9最高,与对照组相比,提高了47.15%,Lz5和Lz1次之,与对照组相比较分别提高了21.1%、20.7%;酸杆菌门(Acidobacteria)的相对丰度大小顺序为:Lz6>Lz5>Lz3>Lz1>Lz9>对照组>Lz2,Lz6比对照组提高了17.3%;绿弯菌门(Chloroflexi)的相对丰度则是对照组最高;放线菌门(Actinobacteria)的相对丰度大小顺序为:Lz2>Lz1>Lz3>Lz9>Lz6>对照组>Lz5,其中与对照组相比,Lz2和Lz1分别提高了86.3%、68.6%。
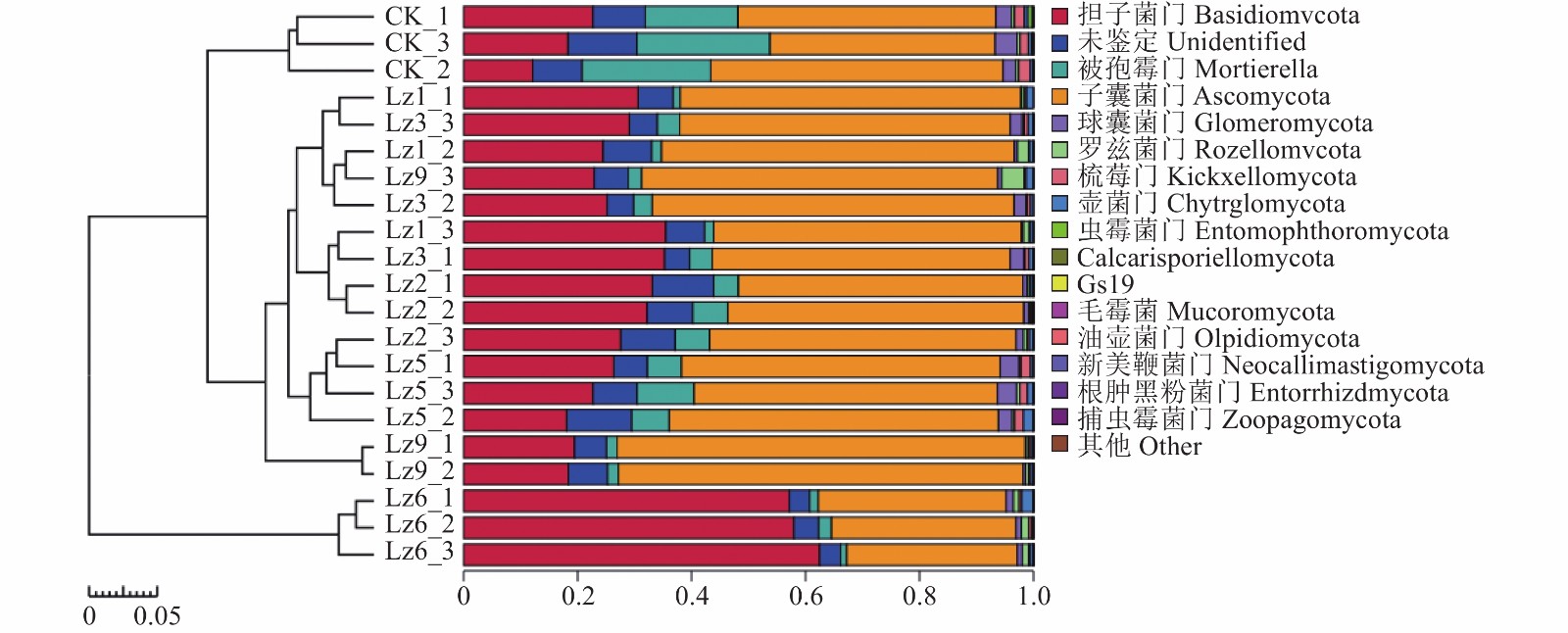
不同土壤样品门水平真菌最大丰度排名如图3所示,其中子囊菌门(Ascomycota)相对丰度大小顺序为:Lz9>Lz1>>Lz3>Lz5>Lz2>对照组>Lz6,Lz9和Lz1分别比对照组丰度提高了53.2%、32.9%;种植6种菌草的土壤样品中,担子菌门(Basidiomycota)相对丰度均高于对照组,其中Lz6的相对丰度最高;Lz1、Lz2和Lz3次之;种植六种菌草的被孢菌门(Mortierellomycota)的相对丰度均低于对照组。
2.3 土壤微生物多样性及群落结构与土壤酶活相关性分析
2.3.1 土壤微生物多样性指数与土壤酶活相关性分析
土壤微生物多样性由Ace指数、Shannon指数和Chao指数等来反映,由表4结果可知,蔗糖酶与细菌Ace指数、Shannon指数和Chao指数存在极显著的正相关关系(P<0.01),酸性磷酸酶与Shannon指数呈显著正相关关系(P<0.05),与细菌Ace指数、Chao指数存在极显著的正相关关系;而酸性磷酸酶与真菌的Ace指数存在极显著的正相关关系(P<0.01),与Shannon指数和Chao指数存在显著的正相关关系(P<0.05)。
表 4 微生物多样性指数与土壤酶活的相关关系Table 4. Correlation between microbial diversity index and enzyme activity of soil项目
Items评估指数
Assessment index脲酶
URE过氧化
氢酶
CAT蔗糖酶
INV酸性磷
酸酶
ACP细菌 Bacteria Ace 0.325 −0.193 0.641** 0.597** Shannon 0.026 0.080 0.869** 0.530* Chao 0.404 −0.314 0.554** 0.638** Coverage — — — — 真菌 Fungus Ace 0.376 −0.415 0.070 0.597** Shannon 0.421 −0.270 0.368 0.438* Chao 0.373 −0.401 0.119 0.632* Coverage −0.169 0.279 0.142 −0.194 2.3.2 土壤微生物群落结构与土壤酶活相关性分析
土壤微生物优势门类与4种土壤酶活之间的相关关系如表5 所示,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Saccharibacteria)、厚壁菌门(Firmicutes)等4个细菌菌门的相对丰度与URE活性呈极显著正相关关系(P<0.01),而绿弯菌门(Chloroflexi)和硝化螺旋菌门(Nitrospirae)与URE活性呈现极显著的负相关关系(P<0.01),芽单胞菌门(Gemmatimonadetes )与URE活性呈现负相关关系(P<0.05);绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)与CAT活性存在极显著的正相关关系(P<0.01),变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)与CAT活性存在负相关关系(P<0.05);硝化螺旋菌门(Nitrospirae)与INV活性呈极显著正相关( P <0.01),芽单胞菌门(Gemmatimonadetes )与INV活性呈现正相关(P<0.05),疣微菌门(Verrucomicrobia)与INV活性呈现显著负相关(P<0.05);放线菌门(Actinobacteria)与ACP活性呈现显著正相关(P<0.05)。
表 5 土壤微生物优势门类与土壤酶活之间的相关关系Table 5. Correlations among dominant microbial phyla, nutrients, and enzyme activity in soil项目
Items种类
PhylumURE CAT INV ACP 细菌 Bacteria 变形菌门 Proteobacteria 0.538** −0.500* 0.008 0.010 酸杆菌门 Acidobacteria −0.126 0.171 0.087 0.098 绿弯菌门 Chloroflexi −0.730** 0.585** −0.236 −0.408 放线菌门 Actinobacteria 0.507* −0.464* −0.069 0.456* 拟杆菌门 Bacteroidetes 0.614** −0.478* 0.101 0.174 黏胶球形菌 Latescibacteria −0.429 0.341 0.079 −0.258 疣微菌门 Verrucomicrobia 0.306 −0.239 −0.496* −0.132 芽单胞菌门 Gemmatimonadetes −0.449* 0.383 0.531* −0.041 浮霉菌门 Planctomycetes 0.109 −0.048 −0.333 −0.259 硝化螺旋菌门 Nitrospirae −0.692** 0.680** 0.679** −0.045 梭杆菌门 Saccharibacteria 0.811** −0.668** −0.174 0.430 蓝细菌门 Cyanobacteria 0.374 −0.195 0.041 0.449* 迷踪菌门 Elusimicrobia −0.329 0.315 −0.259 −0.239 俭菌总门 Parcubacteria −0.432 0.382 −0.309 −0.603** 厚壁菌门 Firmicutes 0.715** −0.494* −0.243 0.291 真菌
Fungus子囊菌门 Ascomycota 0.555** −0.696** 0.185 0.396 担子菌门 Basidiomycota 0.066 0.009 −0.206 −0.088 未鉴定 unidentified 0.265 −0.300 0.145 0.165 被孢 霉门Mortierellomycota −0.755** 0.667** −0.014 −0.310 球囊菌门 Glomeromycota −0.836** 0.717** 0.334 −0.211 壶菌门 Chytridiomycota −0.030 0.095 0.103 −0.067 梳霉门 Kickxellomycota −0.833** 0.738** 0.338 −0.313 罗兹菌门 Rozellomycota 0.353 −0.186 −0.285 0.057 Calcarisporiellomycota −0.682** 0.602** −0.098 −0.394 真菌的优势菌门中,子囊菌门(Ascomycota)与URE活性呈极显著正相关关系(P<0.01),被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、Kickxellomycota和Calcarisporiellomycota与URE活性呈极显著负相关关系(P<0.01);被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、Kickxellomycota和Calcarisporiellomycota与CAT活性呈极显著正相关关系(P<0.01),子囊菌门(Ascomycota)与CAT活性呈极显著负相关关系(P<0.01)。
3. 讨论与结论
土壤养分是衡量土壤肥力状况的指标之一,福建农林大学旗山校区国家菌草工程技术研究中心菌草种质资源圃建在用黏土及石块填方的土地,土壤肥力差。芦竹属菌草抗性强,耐贫瘠,种植5年来,在该土地上不仅正常生长,而且长势旺盛。本研究选用的是种质资源圃种植芦竹属菌草5年后的土壤与未种植区域土壤进行比较,结果表明:所测区域土壤均属于酸性土壤(5.4~6.2),其中Lz6所种植区域土壤pH值最高,Lz3土壤pH值最低;Lz1、Lz9、Lz3的土壤有机碳、AN、TN含量等均显著高于未种植土壤的各养分含量。由结果可知,种植5年的芦竹属菌草,可增加土壤养分的含量,提高土壤肥力,但由于芦竹属不同菌草品种的生长特性存在一定差异,因此不同菌草种植区的土壤养分亦存在一定的差异。
土壤酶活性是微生物功能的表现,参与了土壤中许多重要的生物化学过程,与土壤养分有着密切的关系[20],土壤pH值、土壤有机质、AP、AN、TN含量等土壤理化性质都会对土壤酶活产生显著的影响。土壤酶活性结果显示,种植芦竹属6种菌草的土壤脲酶活性均极显著高于未种植菌草的对照组,其中Lz1和Lz9的脲酶活性最高,这与Lz1和Lz9土壤有机质含量高的结果一致,且Pearson相关分析亦表明脲酶活性与土壤有机质含量呈显著正相关(P<0.01)。诸多研究结果亦表明,土壤中有机质含量高,土壤脲酶活性也会相应提高[21-23]。土壤过氧化氢酶活性与土壤呼吸强度和土壤微生物活动相关,是重要的土壤微生态环境指示因子[24-25],能有效防止过氧化氢的毒害,而过氧化氢酶和蔗糖酶活性则是种植Lz5的土壤酶活性最高,均显著高于对照组,酸性磷酸酶活性则是种植Lz1的土壤最高,显著高于对照组。影响土壤酶活性的因子较多,在不同的研究中所得结论也不尽相同[26]。本研究相关性结果分析发现,供试4种土壤酶中,脲酶活性与土壤速效磷、速效氮、有机碳和全氮呈极显著的相关关系(P<0.01),蔗糖酶与几种土壤养分无显著的相关性,亦说明土壤酶活性受多因子协同作用影响。
土壤微生物群落多样性和群落结构,受土壤理化性质、不同土壤条件和环境的差异影响,在不同土壤条件和环境中,土壤微生物群落存在很大差别[27]。基于高通量测序的分析结果表明,芦竹属不同菌草土壤微生物的多样性指数和丰富度指数存在一定差异,种植菌草土壤微生物中细菌和真菌的Ace指数、Shannon指数、Chao指数均高于对照组,亦说明了种植菌草以后土壤微生物的多样性和丰度总体高于未种植。而不同种植区域微生物优势菌门大致相似,其中Lz1土壤微生物中变形菌门、酸杆菌门、放线菌门等相对丰度均大于对照组。
土壤中有机碳是土壤微生物群落的能量和微生物细胞组成成分的主要来源,还是土壤微生物新陈代谢的主要产物[28]。由本研究土壤微生物优势门类与土壤酶活的相关性结果可知,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Saccharibacteria)、厚壁菌门(Firmicutes)等细菌的相对丰度均与土壤中URE活性呈极显著正相关(P<0.01)。同样,研究结果表明优势菌门与土壤酶活性的相关性存在差异,相关性并不是呈现出一致的趋势。植物-土壤-微生物之间的关系非常复杂,相互作用、相互影响[29-31],但不同芦竹种植的土壤微生物多样性和群落结构存在一定差异,且与土壤养分和土壤酶活的具有一定的相关性。
综上所述,种植芦竹属6种不同菌草后,土壤养分、土壤酶活、土壤微生物多样性和群落结构存在一定的差异,但与未种植芦竹属菌草的空白对照地相比,种植lz1、Lz9土壤中速效磷、速效氮、有机碳和总氮的含量以及土壤脲酶活性显著升高。土壤微生物丰度和多样性指数结果亦表明,种植芦竹后,土壤微生物丰度和多样性高于对照组。结合之前研究结果,种植芦竹属菌草Lz1有望在贫瘠的土壤条件下,起到改良土壤,提高土壤酶活性和土壤微生物多样性的积极作用,为绿洲1号(Lz1)的推广奠定理论基础。
-
表 1 种植芦竹属不同菌草对土壤主要养分的影响
Table 1 Nutrients in soil as affected by planting of different arundo grasses
处理 Treatment pH 速效磷 AP/(mg·kg−1) 速效氮 AN/(mg·kg−1) 有机碳 SOC/(g·kg−1) 全氮 TN/(g·kg−1) CK 5.82±0.13 b 2.54±0.20 c 14.47±0.31 d 5.27±0.11 e 0.38±0.016 f Lz1 5.57±0.25 bc 8.20±0.76 a 22.63±0.64 a 13.83±0.44 a 0.84±0.0085 a Lz2 5.60±0.22 bc 4.63±0.44 b 15.52±0.53 cd 8.99±0.30 c 0.56±0.044 d Lz3 5.43±0.12 cd 3.59±0.12 bc 19.13±0.42 b 9.98±0.32 b 0.64±0.015 c Lz5 6.05±0.11 ab 3.82±0.10 bc 16.10±0.61 c 8.68±0.28 c 0.50±0.012 e Lz6 6.21±0.13 a 4.67±0.62 b 14.12±0.40 d 7.25±0.13 d 0.50±0.022 e Lz9 5.80±0.21 b 8.72±0.37 a 18.20±0.61 b 10.48±0.32 b 0.71±0.0098 b 同列数据后不同小写字母表示处理间的差异达显著水平(P<0.05)。
Data with different lowercase letters on same column indicate significant differences between treatments (P<0.05).表 2 土壤特性与土壤酶活的Pearson相关性
Table 2 Pearson correlation between characteristics and enzyme activity of soil
项目 Items pH 速效磷 AP 速效氮 AN 有机碳 SOC 全氮 TN 脲酶 URE −0.327 0.882** 0.690** 0.807** 0.910** 过氧化氢酶 CAT 0.426* −0.715** −0.622** −0.638** −0.784** 蔗糖酶 INV 0.064 −0.088 0.029 0.132 −0.070 酸性磷酸酶 ACP −0.181 0.197 0.464* 0.620** 0.506* *表示在0.05水平上差异显著,**表示在0.01水平上差异极显著。表4同。
* represents significant at the 0.05 probability level, ** represents significant at the 0.01 probability level. Same for Table 4.表 3 不同土壤样品微生物丰度和多样性
Table 3 Microbial abundance and diversity of soil samples
评估指数
Assessment
indexCK Lz1 Lz2 Lz3 Lz5 Lz6 Lz9 细菌
BacteriaAce 3140.06±66.27 d 3680.22±78.84 ab 3686.17±46.09 a 3521.67±23.83 c 3814.67±33.64 a 3473.21±46.64 c 3526.08±41.77 b Shannon 9.36±0.13 b 9.77±0.072 a 9.72±0.028 a 9.58±0.060 ab 10.07±0.015 a 9.53±0.017 ab 9.56±0.061 ab Chao 3421.69±69.59 d 4139.99±57.67 a 4165.19±45.92 a 4062.60±49.83 ab 42225.80±24.29 a 3877.68±44.56 c 3937.11±63.52 bc Coverage 0.96 a 0.96 a 0.96 a 0.96 a 0.96 a 0.96 a 0.96 a Simpson 1.00 a 1.00 a 1.00 a 1.00 a 1.00 a 1.00 a 1.00 a 真菌
FungiAce 1066.61±36.88 cd 1423.82±80.32 ab 1268.97±21.65 b 1506.86±55.88 a 1201.24±66.81 c 1152.33±21.45 cd 1169.85±37.85 cd Shannon 4.50±0.0057 c 6.63±0.14 a 6.70±0.11 a 6.14±0.095 b 6.86±0.11 a 6.87±0.12 a 6.29±0.13 b Chao 1098.08±40.35 cd 1584.29±49.62 a 1454.06±51.65 ab 1619.30±60.94 a 1324.21±54.43 bc 1098.20±17.18 cd 1247.04±63.83 bc Coverage 0.99 a 0.99 a 0.99 a 0.99 a 0.98 a 0.99 a 0.99 a Simpson 0.96 a 0.97 a 0.98 a 0.95 a 0.97 a 0.75 b 0.96 a 同行数据后不同小写字母表示处理间显著性差异(P<0.05)。
Data with different lowercase letters on same row indicated significant differences between treatments (P<0.05).表 4 微生物多样性指数与土壤酶活的相关关系
Table 4 Correlation between microbial diversity index and enzyme activity of soil
项目
Items评估指数
Assessment index脲酶
URE过氧化
氢酶
CAT蔗糖酶
INV酸性磷
酸酶
ACP细菌 Bacteria Ace 0.325 −0.193 0.641** 0.597** Shannon 0.026 0.080 0.869** 0.530* Chao 0.404 −0.314 0.554** 0.638** Coverage — — — — 真菌 Fungus Ace 0.376 −0.415 0.070 0.597** Shannon 0.421 −0.270 0.368 0.438* Chao 0.373 −0.401 0.119 0.632* Coverage −0.169 0.279 0.142 −0.194 表 5 土壤微生物优势门类与土壤酶活之间的相关关系
Table 5 Correlations among dominant microbial phyla, nutrients, and enzyme activity in soil
项目
Items种类
PhylumURE CAT INV ACP 细菌 Bacteria 变形菌门 Proteobacteria 0.538** −0.500* 0.008 0.010 酸杆菌门 Acidobacteria −0.126 0.171 0.087 0.098 绿弯菌门 Chloroflexi −0.730** 0.585** −0.236 −0.408 放线菌门 Actinobacteria 0.507* −0.464* −0.069 0.456* 拟杆菌门 Bacteroidetes 0.614** −0.478* 0.101 0.174 黏胶球形菌 Latescibacteria −0.429 0.341 0.079 −0.258 疣微菌门 Verrucomicrobia 0.306 −0.239 −0.496* −0.132 芽单胞菌门 Gemmatimonadetes −0.449* 0.383 0.531* −0.041 浮霉菌门 Planctomycetes 0.109 −0.048 −0.333 −0.259 硝化螺旋菌门 Nitrospirae −0.692** 0.680** 0.679** −0.045 梭杆菌门 Saccharibacteria 0.811** −0.668** −0.174 0.430 蓝细菌门 Cyanobacteria 0.374 −0.195 0.041 0.449* 迷踪菌门 Elusimicrobia −0.329 0.315 −0.259 −0.239 俭菌总门 Parcubacteria −0.432 0.382 −0.309 −0.603** 厚壁菌门 Firmicutes 0.715** −0.494* −0.243 0.291 真菌
Fungus子囊菌门 Ascomycota 0.555** −0.696** 0.185 0.396 担子菌门 Basidiomycota 0.066 0.009 −0.206 −0.088 未鉴定 unidentified 0.265 −0.300 0.145 0.165 被孢 霉门Mortierellomycota −0.755** 0.667** −0.014 −0.310 球囊菌门 Glomeromycota −0.836** 0.717** 0.334 −0.211 壶菌门 Chytridiomycota −0.030 0.095 0.103 −0.067 梳霉门 Kickxellomycota −0.833** 0.738** 0.338 −0.313 罗兹菌门 Rozellomycota 0.353 −0.186 −0.285 0.057 Calcarisporiellomycota −0.682** 0.602** −0.098 −0.394 -
[1] GYANESHWAR P, KUMAR G N, PAREKH L J, et al. Role of soil microorganisms in improving P nutrition of plants [J]. Plant and Soil, 2002, 245(1): 133−143.
[2] LYNCH J M, BENEDETTI A, INSAM H, et al. Microbial diversity in soil: Ecological theories, the contribution of molecular techniques and the impact of transgenic plants and transgenic microorganisms [J]. Biology and Fertility of Soils, 2004, 40(6): 363−385. DOI: 10.1007/s00374-004-0784-9
[3] WELBAUM G E, STURZ A V, DONG Z M, et al. Managing soil microorganisms to improve productivity of agro-ecosystems [J]. Critical Reviews in Plant Sciences, 2004, 23(2): 175−193. DOI: 10.1080/07352680490433295
[4] 罗安程, T-B-SUBEDI, 章永松, 等. 有机肥对水稻根际土壤中微生物和酶活性的影响 [J]. 植物营养与肥料学报, 1999, 5(4):321−327. DOI: 10.3321/j.issn:1008-505X.1999.04.005 LUO A C, SUBEDI T B, ZHANG Y S, et al. Effect of organic manure on the numbers of microbes and enzyme activity in rice rhizosphere [J]. Plant Natrition and Fertilizen Science, 1999, 5(4): 321−327.(in Chinese) DOI: 10.3321/j.issn:1008-505X.1999.04.005
[5] 刘素慧, 刘世琦, 张自坤, 等. 大蒜连作对其根际土壤微生物和酶活性的影响 [J]. 中国农业科学, 2010, 43(5):1000−1006. DOI: 10.3864/j.issn.0578-1752.2010.05.015 LIU S H, LIU S Q, ZHANG Z K, et al. Influence of garlic continuous cropping on rhizosphere soil microorganisms and enzyme activities [J]. Scientia Agricultura Sinica, 2010, 43(5): 1000−1006.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2010.05.015
[6] BLAGODATSKAYA E, KUZYAKOV Y. Active microorganisms in soil: Critical review of estimation criteria and approaches [J]. Soil Biology and Biochemistry, 2013, 67: 192−211. DOI: 10.1016/j.soilbio.2013.08.024
[7] ZIMMERMAN A R. Abiotic and microbial oxidation of laboratory-produced black carbon (biochar) [J]. Environmental Science & Technology, 2010, 44(4): 1295−1301.
[8] LEHMANN J, RILLIG M C, THIES J, et al. Biochar effects on soil biota–A review [J]. Soil Biology and Biochemistry, 2011, 43(9): 1812−1836. DOI: 10.1016/j.soilbio.2011.04.022
[9] 李小清. 华西雨屏区天然次生林及其人工更新后不同植被类型土壤微生物和酶活性研究[D]. 雅安: 四川农业大学, 2014. LI X Q. The study of natural secondary forest and its artificial regeneration forests on soil microbial and enzyme activity in rainy area of west china[D]. Yaan: Sichuan Agricultural University, 2014. (in Chinese)
[10] 林兴生, 林占熺, 林冬梅, 等. 5种菌草苗期抗盐性的评价 [J]. 福建农林大学学报(自然科学版), 2013, 42(2):195−201. LIN X S, LIN Z X, LIN D M, et al. Assessment on salt resistance at seedling stage of 5 species of Juncao under NaCl stress [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2013, 42(2): 195−201.(in Chinese)
[11] 林兴生, 林占熺, 林冬梅, 等. 低温胁迫5种菌草的抗寒性评价 [J]. 草业学报, 2013, 22(2):227−234. DOI: 10.11686/cyxb20130229 LIN X S, LIN Z X, LIN D M, et al. Cold-tolerance of 5 species of juncao under low temperature stress [J]. Acta Prataculturae Sinica, 2013, 22(2): 227−234.(in Chinese) DOI: 10.11686/cyxb20130229
[12] 林占熺. 菌草学[M]. 北京: 国家行政学院出版社, 2013. [13] 林占熺. 菌草生态环境产业[M]. 北京: 国家行政学院出版社, 2013. [14] 李波, 刘朋虎, 王义祥, 等. 以草代料栽培食用菌的相关技术与主要物质转化机制研究进展 [J]. 福建农业学报, 2015, 30(1):90−97. DOI: 10.3969/j.issn.1008-0384.2015.01.016 LI B, LIU P H, WANG Y X, et al. Utilization of herbage for and material transformation in edible fungi cultivation [J]. Fujian Journal of Agricultural Sciences, 2015, 30(1): 90−97.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2015.01.016
[15] 林雄杰, 范国成, 林冬梅, 等. 6份狼尾草属菌草的ITS和叶绿体matK序列分析 [J]. 福建农林大学学报(自然科学版), 2015, 44(2):174−180. LIN X J, FAN G C, LIN D M, et al. Sequence analysis on ITS and chloroplast mat K gene of six Pennisetum juncao [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(2): 174−180.(in Chinese)
[16] 林兴生, 林占熺, 林冬梅, 等. 不同种植年限的巨菌草对植物和昆虫多样性的影响 [J]. 应用生态学报, 2012, 23(10):2849−2854. LIN X S, LIN Z X, LIN D M, et al. Effects of different years of planting Pennisetum sp. on the plant-and insect diversity in Pennisetum sp. communities [J]. Chinese Journal of Applied Ecology, 2012, 23(10): 2849−2854.(in Chinese)
[17] 郑金英, 陈丽凤, 林占熺. 菌草产业成长及其多功能性探析 [J]. 中国农学通报, 2011, 27(1):304−308. ZHENG J Y, CHEN L F, LIN Z X. The analysis of juncao industrial growth and its versatility [J]. Chinese Agricultural Science Bulletin, 2011, 27(1): 304−308.(in Chinese)
[18] 林冬梅, 林占熺, 苏德伟, 等. 种植菌草对沙质荒漠化土壤养分、酶活性及微生物的影响 [J]. 河南农业科学, 2017, 46(5):61−65. LIN D M, LIN Z X, SU D W, et al. Effect of planting Juncao on nutrients, enzyme activities and microorganisms of desertified soils [J]. Journal of Henan Agricultural Sciences, 2017, 46(5): 61−65.(in Chinese)
[19] 鲍士旦. 土壤农化分析 [M]. 第3版. 北京: 中国农业出版社, 2013 [20] O'DONNELL A G, SEASMAN M, MACRAE A, et al. Plants and fertilisers as drivers of change in microbial community structure and function in soils [J]. Plant and Soil, 2001, 232(1/2): 135−145. DOI: 10.1023/A:1010394221729
[21] OZLUE, SANDHUSS, KUMARS, et al. Soil health indicators impacted by long-term cattle manure and inorganic fertilizer application in acorn-soy bean rotation of South Dakota [J]. Scientific reports, 2019, 9(1): 11776. DOI: 10.1038/s41598-019-48207-z
[22] AZEEM M, HAYAT R, HUSSAIN Q, et al. Effects of biochar and NPK on soil microbial biomass and enzyme activity during 2 years of application in the arid region [J]. Arabian Journal of Geosciences, 2019, 12(10): 1−13.
[23] 刘爽, 王艳宇, 杨焕民, 等. 玉-鹅种养模式下土壤养分及土壤细菌群落功能多样性研究 [J]. 干旱地区农业研究, 2021, 39(2):1−9. DOI: 10.7606/j.issn.1000-7601.2021.02.01 LIU S, WANG Y Y, YANG H M, et al. The soil nutrients and functional diversity of soil bacterial community under the co-cultivation mode of breeding goose in cornfield [J]. Agricultural Research in the Arid Areas, 2021, 39(2): 1−9.(in Chinese) DOI: 10.7606/j.issn.1000-7601.2021.02.01
[24] 马云华, 王秀峰, 魏珉, 等. 黄瓜连作土壤酚酸类物质积累对土壤微生物和酶活性的影响 [J]. 应用生态学报, 2005, 16(11):2149−2153. DOI: 10.3321/j.issn:1001-9332.2005.11.028 MA Y H, WANG X F, WEI M, et al. Accumulation of phenolic acids in continuously cropped cucumber soil and their effects on soil microbes and enzyme activities [J]. Chinese Journal of Applied Ecology, 2005, 16(11): 2149−2153.(in Chinese) DOI: 10.3321/j.issn:1001-9332.2005.11.028
[25] WOESE C R. Bacterial evolution [J]. Microbiol Rev, 1987, 51: 221−271. DOI: 10.1128/mr.51.2.221-271.1987
[26] 冯慧琳, 徐辰生, 何欢辉, 等. 生物炭对土壤酶活和细菌群落的影响及其作用机制 [J]. 环境科学, 2021, 42(1):422−432. FENG H L, XU C S, HE H H, et al. Effect of biochar on soil enzyme activity & the bacterial community and its mechanism [J]. Environmental Science, 2021, 42(1): 422−432.(in Chinese)
[27] 李岩, 何学敏, 杨晓东, 等. 不同生境黑果枸杞根际与非根际土壤微生物群落多样性 [J]. 生态学报, 2018, 38(17):5983−5995. LI Y, HE X M, YANG X D, et al. The microbial community diversity of the rhizosphere and bulk soils of Lycium ruthenicum in different habitats [J]. Acta Ecologica Sinica, 2018, 38(17): 5983−5995.(in Chinese)
[28] 杨继松, 刘景双. 小叶章湿地土壤微生物生物量碳和可溶性有机碳的分布特征 [J]. 生态学杂志, 2009, 28(8):1544−1549. YANG J S, LIU J S. Distribution characteristics of microbial biomass carbon and dissolved organic carbon in Deyeuxia angustifolia marsh soils [J]. Chinese Journal of Ecology, 2009, 28(8): 1544−1549.(in Chinese)
[29] 杨荣仲, 周会, 桂意云, 等. 甘蔗低氮胁迫性状变化与蔗茎含氮量的研究 [J]. 安徽农业科学, 2013, 41(2):481−484. YANG R Z, ZHOU H, GUI Y Y, et al. Response to low nitrogen stress and stalk nitrogen content of sugarcane germplasm [J]. Journal of Anhui Agricultural Sciences, 2013, 41(2): 481−484.(in Chinese)
[30] NICOLAS G, GALLOWAY J N. An Earth-system perspective of the global nitrogen cycle [J]. Nature, 2008, 451(7176): 293−296. DOI: 10.1038/nature06592
[31] FALKOWSKI P G, FENCHEL T, DELONG E F. The microbial engines that drive earth's biogeochemical cycles [J]. Science, 2008, 320(5879): 1034−1039. DOI: 10.1126/science.1153213
-
期刊类型引用(2)
1. 林辉,罗海凌,张双双,陈晓斌,苏德伟,林占熺,林冬梅. 芦竹属菌草品种农艺性状、光合特性及碳氮比. 福建农林大学学报(自然科学版). 2023(01): 21-25 .  百度学术
百度学术
2. 万家明,陈伟祥,陈重成,郑书河. 基于ANSYS Workbench/Ls-Dyna的锤片—菌草粉碎系统的功耗模型分析. 福建农林大学学报(自然科学版). 2023(01): 127-134 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载: