Cloning and Expression of Nitrite Reductase Gene HcNiR in Kenaf
-
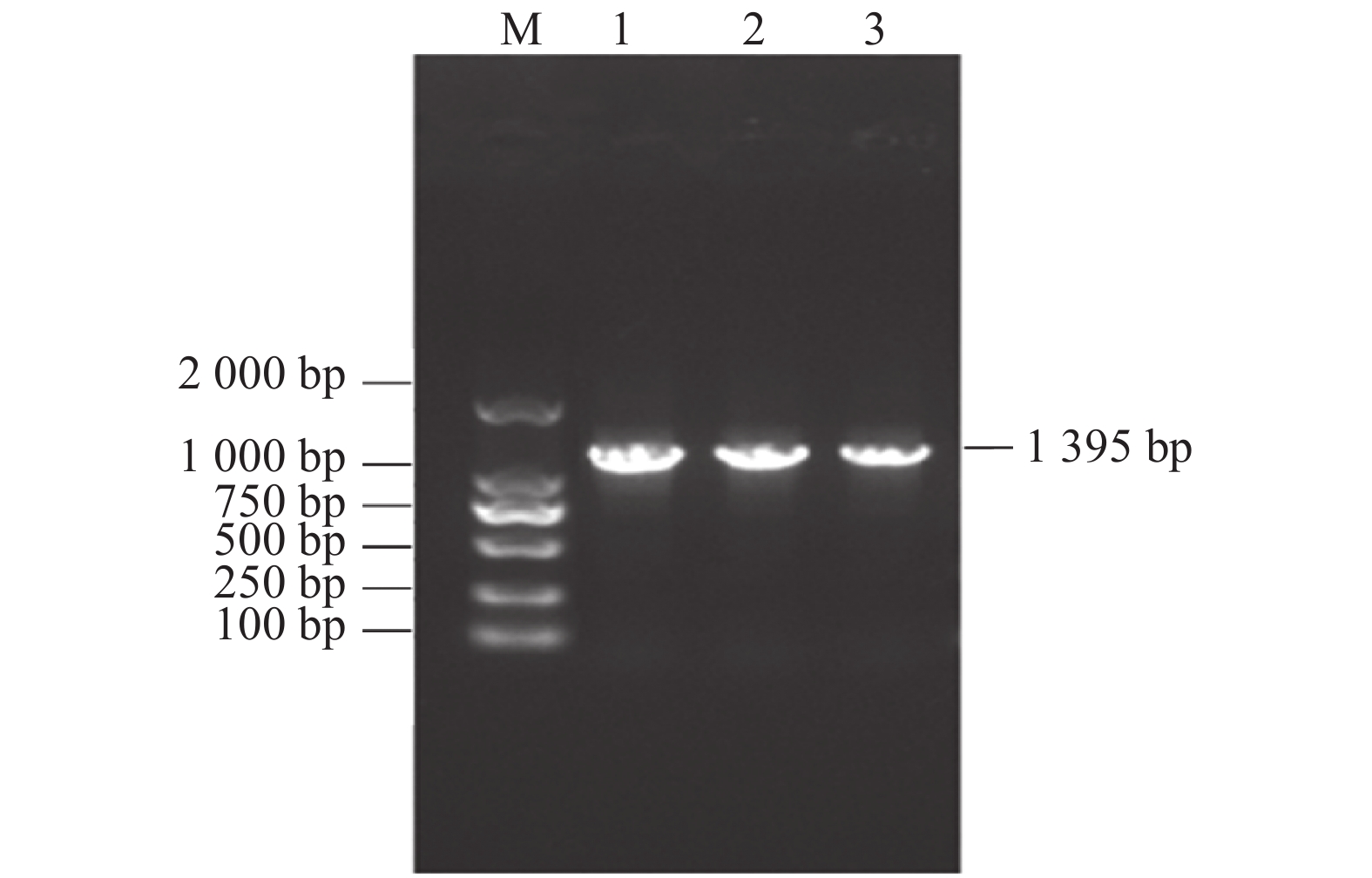
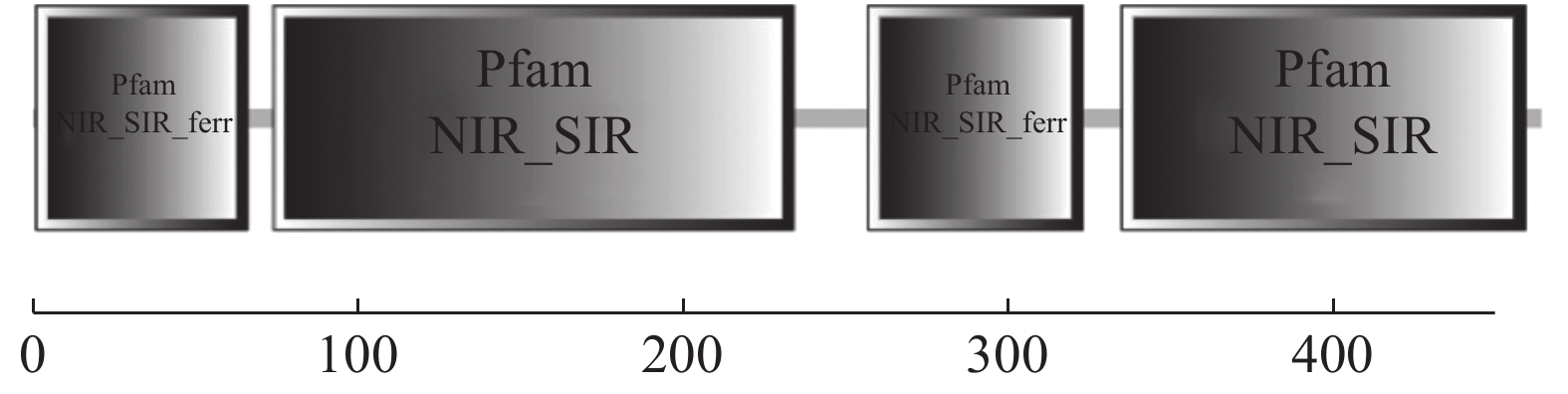
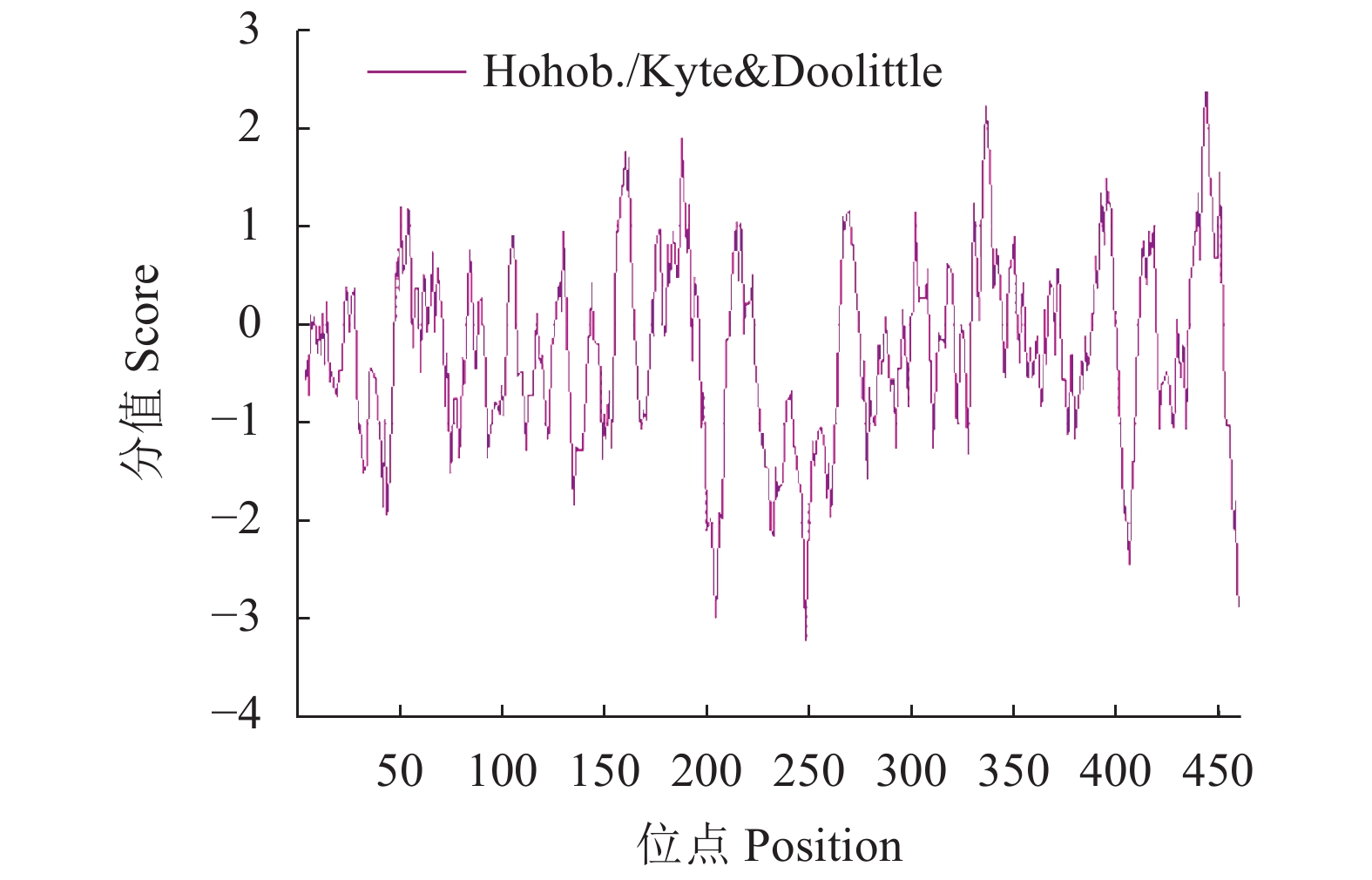
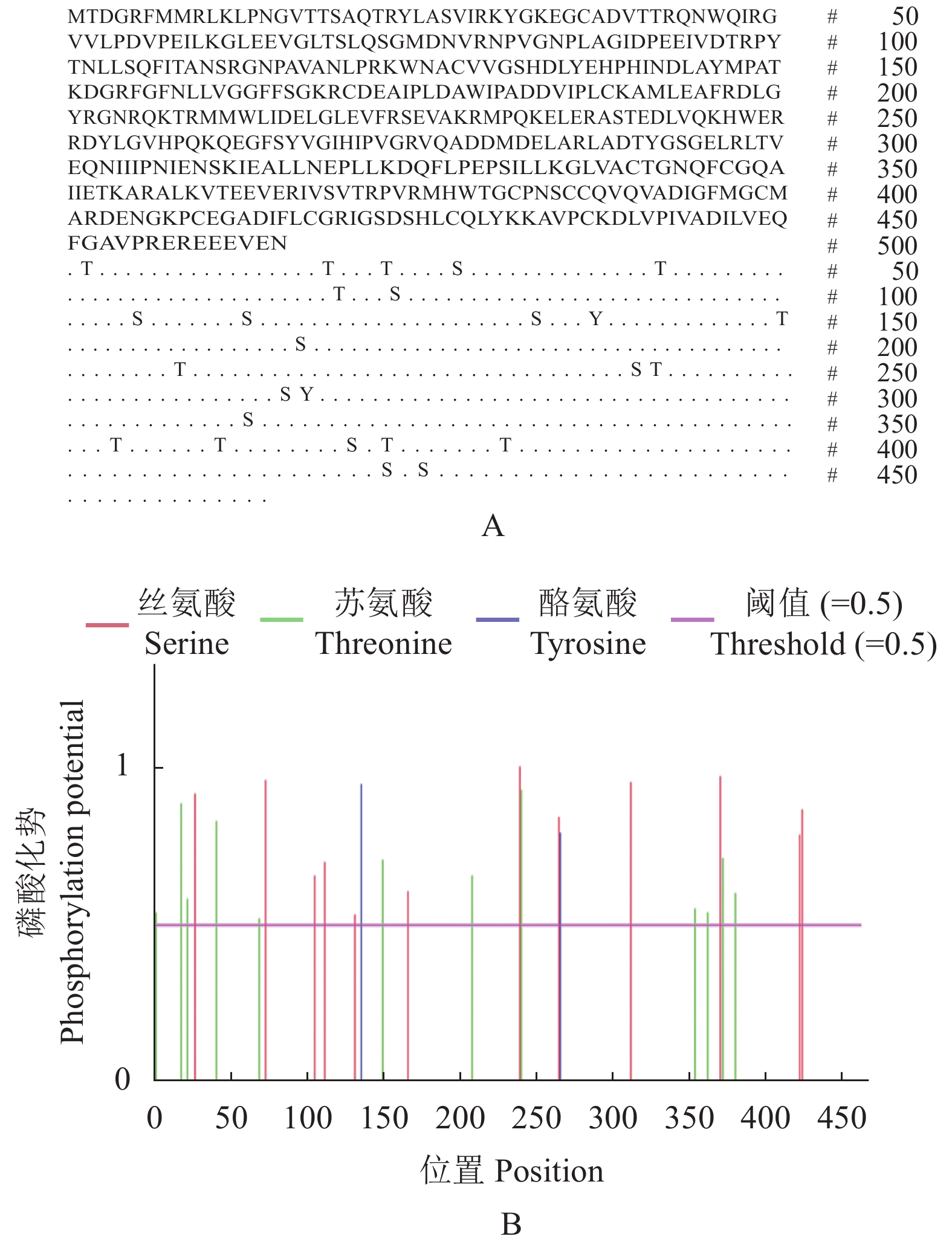
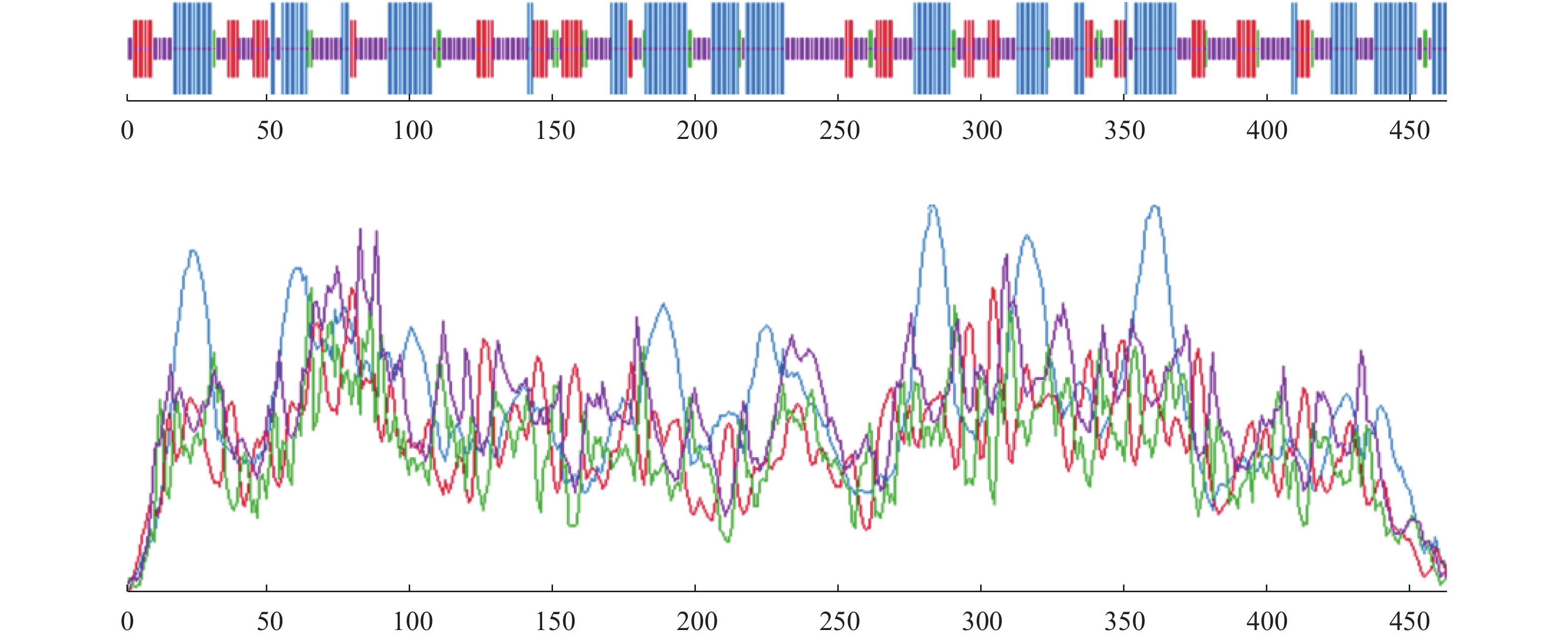
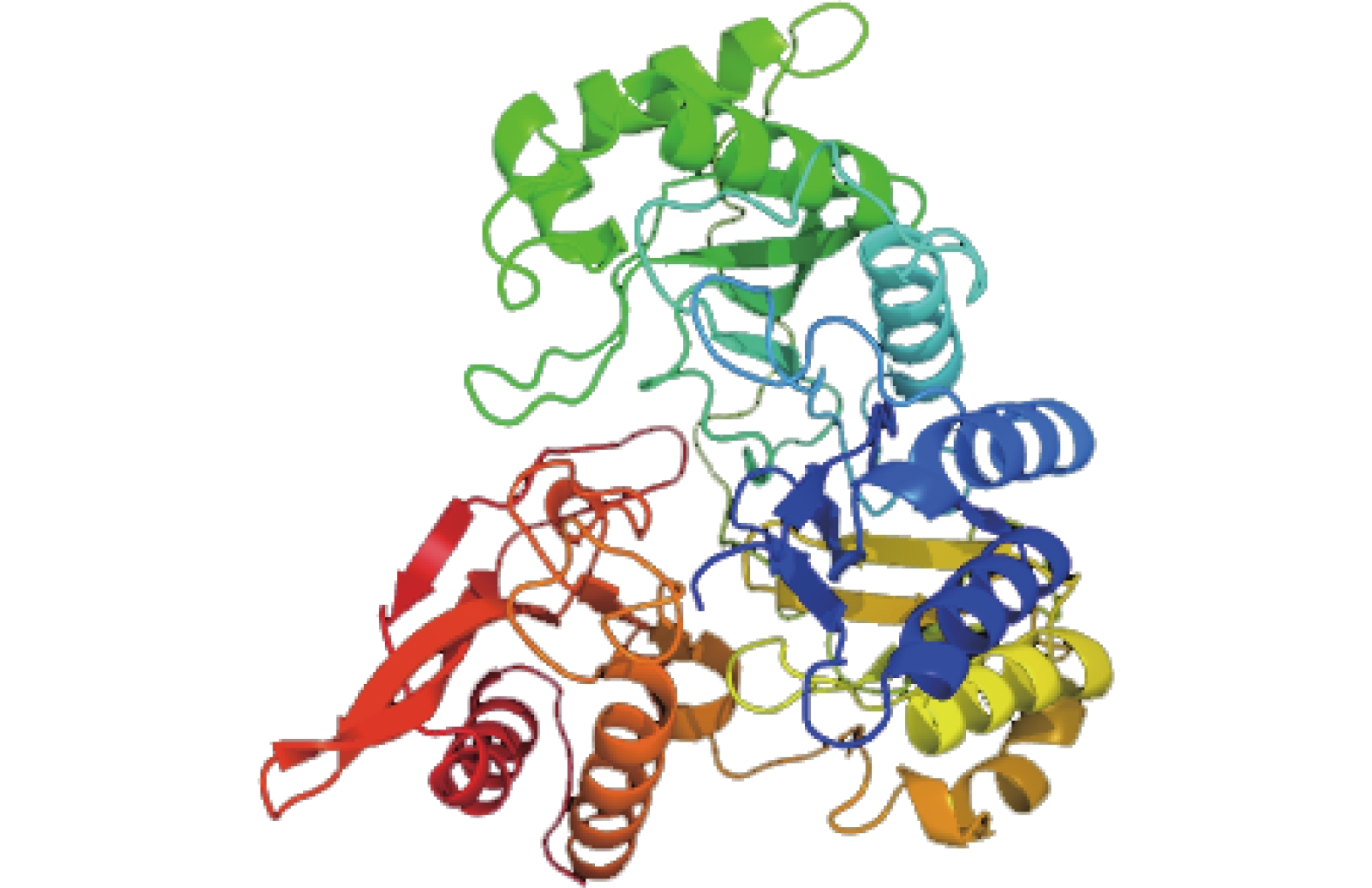
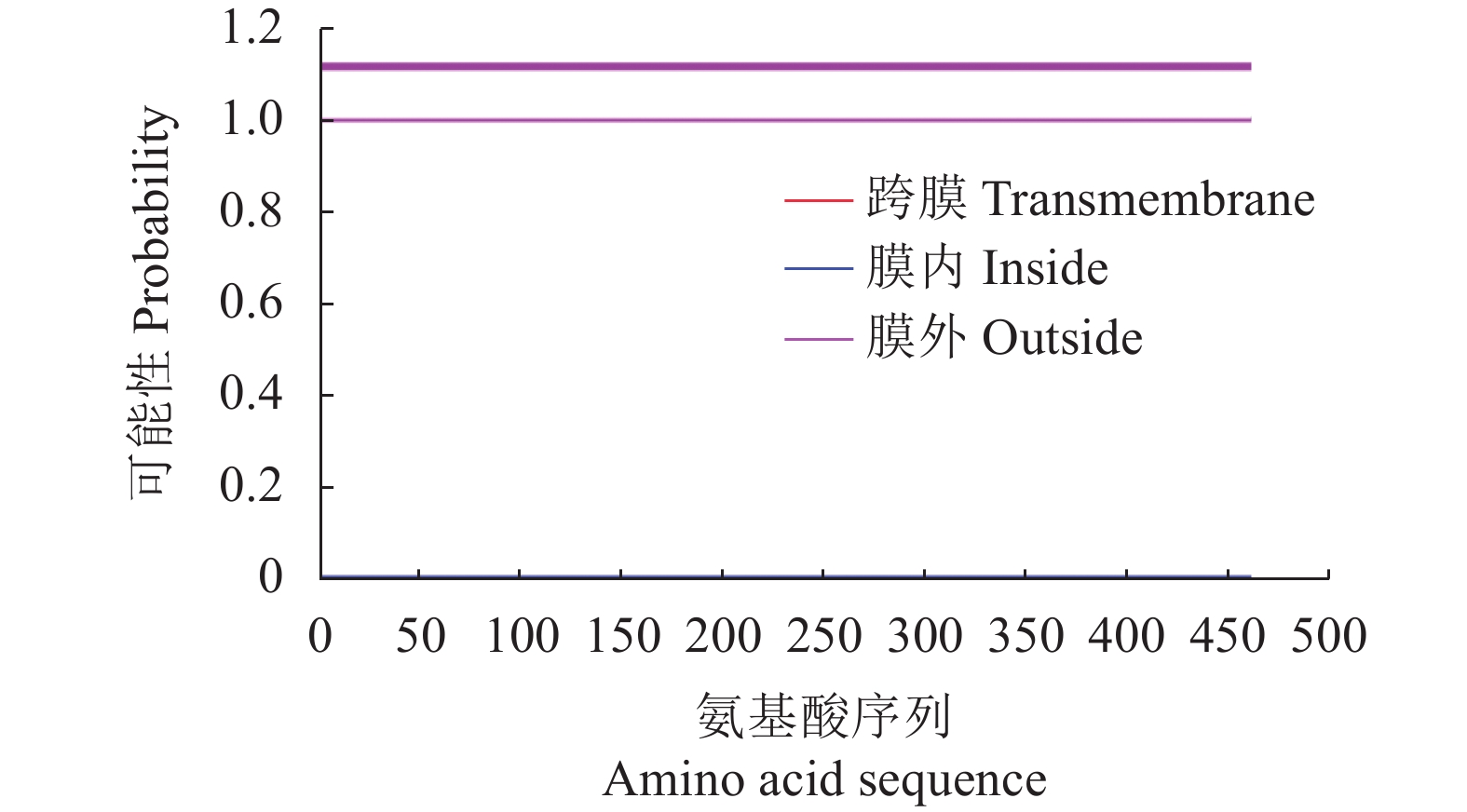
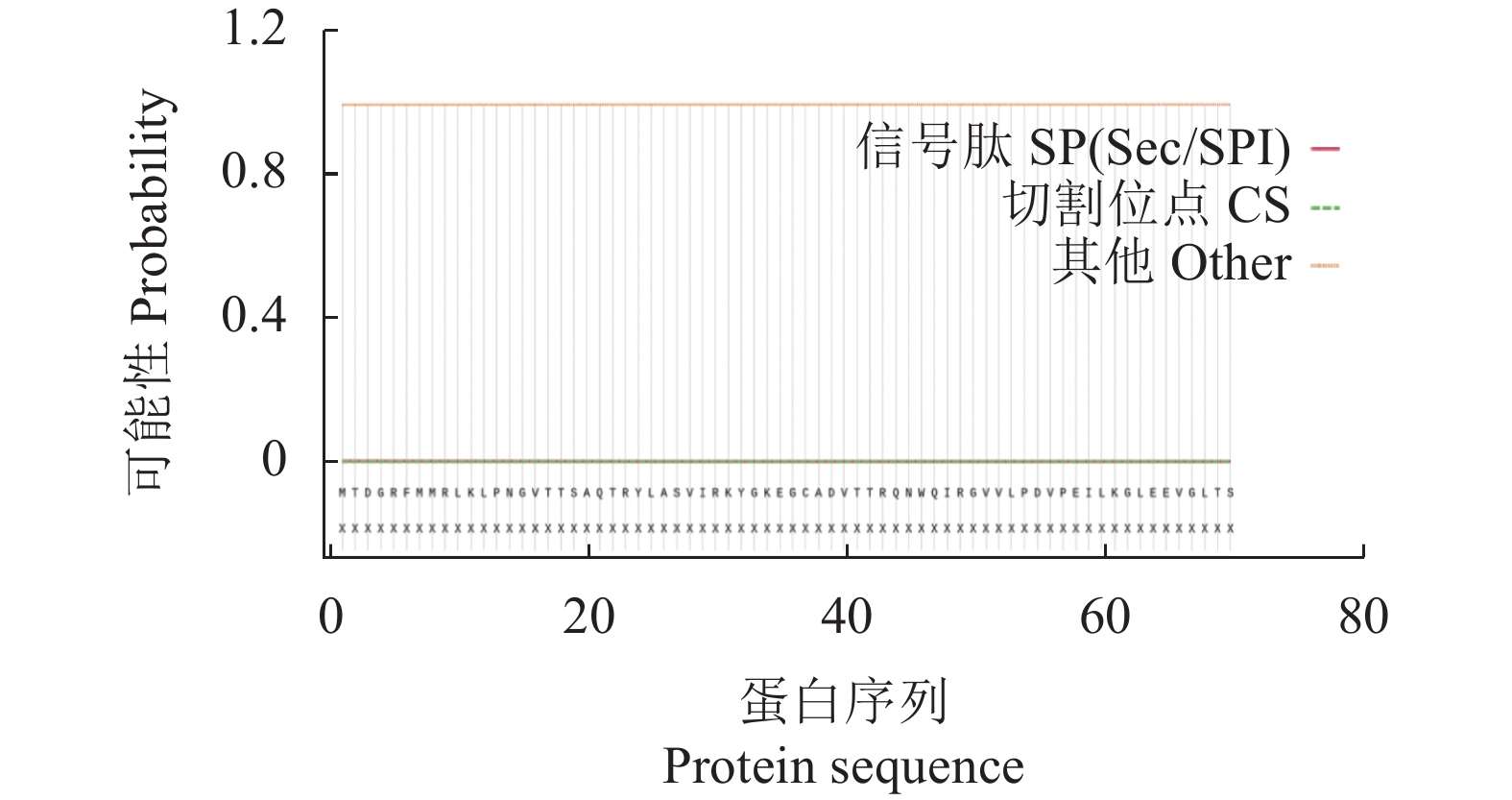
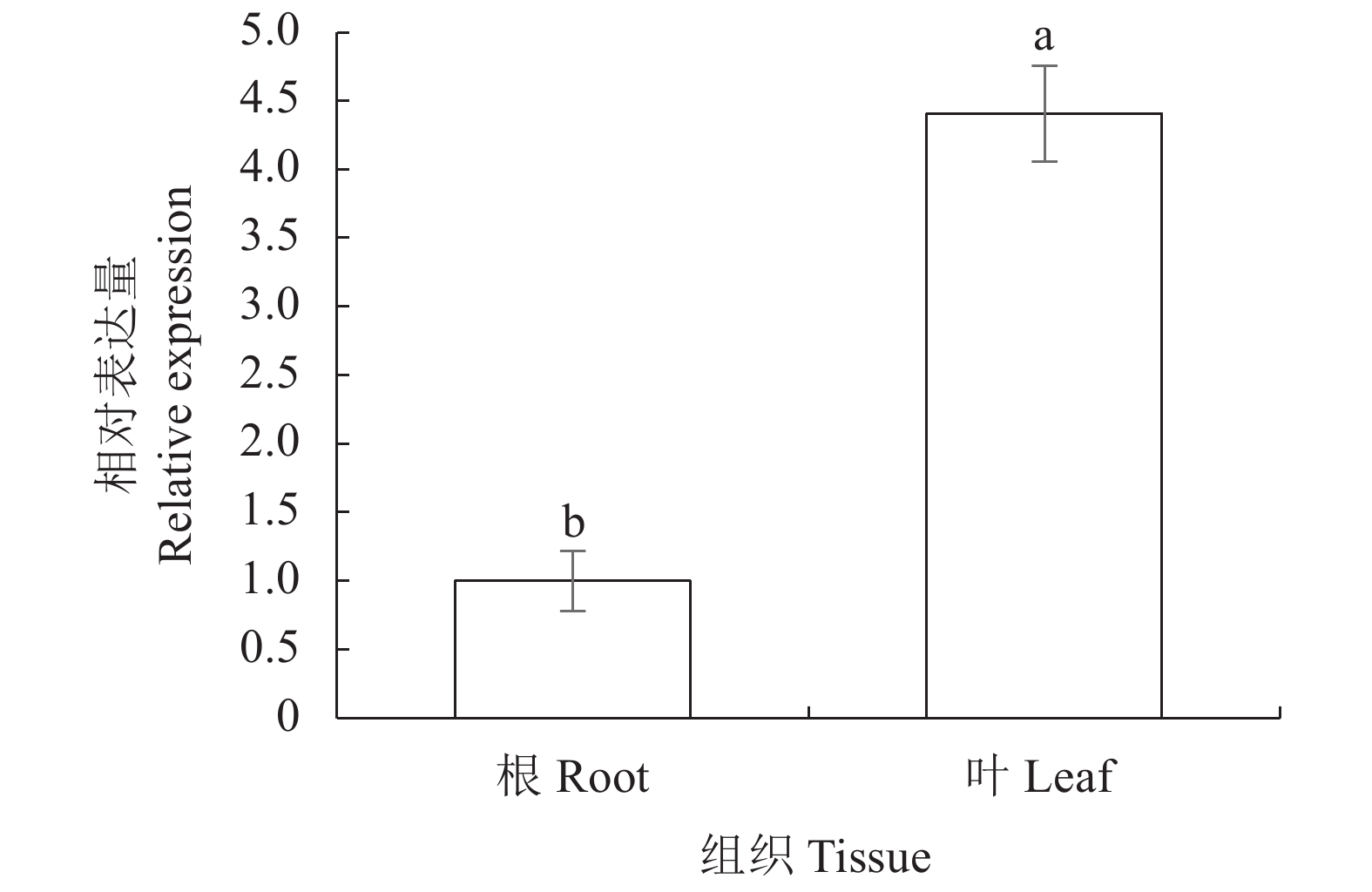
摘要:目的 了解红麻亚硝酸还原酶基因HcNiR生物信息学特性及组织表达特异性,为培育红麻氮高效利用品种提供理论依据。方法 以红麻材料349叶片的cDNA为模板,利用PCR扩增HcNiR基因的CDS序列,采用生物信息学方法分析HcNiR的氨基酸组成、蛋白质跨膜结构、信号肽、高级结构以及蛋白的同源进化树;采用实时荧光定量PCR检测HcNiR基因在红麻不同组织的表达情况。结果 HcNiR基因cDNA全长1395 bp,编码蛋白含有464个氨基酸,包含2个保守的亚硝酸和亚硫酸还原酶4Fe-4S结构域及铁氧蛋白部分结构域。HcNiR蛋白是一个不含跨膜转运结构与信号肽的亲水稳定性蛋白质,该蛋白质等电点是5.49,分子量51.68 kDa;具有26处潜在磷酸化位点。在其蛋白二级结构中,α-螺旋和无规则卷曲所占比例超过70%。通过氨基酸序列同源性分析发现,红麻HcNiR氨基酸序列与木槿HsNiR氨基酸序列相似性较高,达到97.37%,都含有铁-硫/铁血红素结合位点。进化树分析结果表明,红麻HcNiR基因与木槿HsNiR基因亲缘关系较近。组织特异性表达结果显示,红麻HcNiR基因在叶中的表达量高于根。结论 HcNiR基因编码蛋白含亚硝酸和亚硫酸还原酶4Fe-4S结构域及铁氧蛋白部分结构域;HcNiR基因具有组织表达特异性,在红麻叶片中表达较高,推测其主要在初级氮的同化过程中发挥重要调控作用。Abstract:Objective Bioinformatics and expressions of the nitrate reductase gene of kenaf(Hibiscus cannabinus) were studied for breeding varieties highly efficient in nitrogen utilization.Method From the leaf of kenaf 349, the coding sequences (CDS) of HcNiR was amplified by PCR. Bioinformatics method was applied to analyze the amino acid sequences, protein transmembrane structure, protein signal peptide, high-level structures, and homologous evolutionary tree associated with the gene, while the expression in various tissues detected by qRT-PCR.Result The full length of HcNiR cDNA was 1395 bp encoded 464 amino acids. The amino acid sequence contained two conserved nitrite and sulfite reductase 4Fe-4S domains and two conserved nitrite/sulfite reductase ferredoxin-like half domains. The predicted stable, hydrophilic HcNiR protein with an isoelectric point of 5.49 and molecular weight of 51.68 kDa had no transmembrane domain or signal peptide. It contained 26 potential phosphorylation sites in a secondary structure that consisted of more than 70% in the forms of alpha helix and irregular coils. The amino acid sequence of HcNiR was 97.37% homologous with that of H. syriacus, and both included nitrite and sulfite reductases iron-sulfur/siroheme-binding sites. The phylogenetic tree on HcNiR showed it closely related to HsNiR. The HcNiR expression was higher in the leaves than in the roots of a kenaf plant.Conclusion HcNiR contained two conserved nitrite and sulfite reductase 4Fe-4S domains and two conserved nitrite/sulfite reductase ferredoxin-like half domains. The gene was abundantly expressed in the kenaf leaves and speculated to be mainly involved in the process of primary nitrogen assimilation.
-
Keywords:
- kenaf /
- nitrate reductase /
- HcNiR /
- gene cloning /
- expression analysis
-
0. 引言
【研究意义】罗汉果Siraitia grosvenorii(swingle) C.Jeffrey是我国特有的经济、药用植物,也是广西桂北地区的传统特产,为药食两用植物。成熟罗汉果果实中富含罗汉果甜苷,平均甜度是蔗糖的250~340倍,且甜味纯正,是迄今发现最接近蔗糖风味的天然甜味剂[1]。罗汉果甜苷低能量、低热值,不直接参与体内糖代谢过程,能使体内血糖水平保持稳定,同时罗汉果中的主要药效成分罗汉果甜苷, 可以止咳、化痰、泻下、保肝, 而最近还发现它们具有防癌、降脂的功效[2-3]。近年来罗汉果甜苷作为一种高甜度、低卡路里的功能性天然甜味剂已广泛应用于食品、饮料及保健食品等行业。因此,罗汉果产业具有较好的发展前景。但是,由于传统种植的压蔓薯苗,品种混杂,在自然状态下易感染花叶病毒,导致病毒积累和种质严重退化[4],产量很低,严重制约了罗汉果扩大生产。近年罗汉果组织培养脱毒苗的应用,能使产量大幅度提高,罗汉果规模化、专业化生产成为可能,但其对环境条件和栽培技术要求远比压蔓薯苗严格,种植后易发生病害、死苗率高、上棚慢、结果迟、结果率低等问题十分普遍,成为组培苗种植发展的又一大障碍。因此,对其栽培条件和栽培技术进行深入研究是确保丰产稳产的关键。【前人研究进展】罗汉果对生态环境有独特的要求,早期罗汉果的多种植在海拔500 m以上的山区,随着罗汉果栽培技术发展将原产于山区林地的罗汉果引种到山下种植[5]。根据罗汉果生长的气象条件,科技人员努力进行罗汉果引种、组培苗培育及其相关栽培技术研究并取得进展,当前罗汉果生产已成为新的产业[6-7]。蒋水元等[8]利用正交试验等方法,研究了罗汉果组培苗不同生育期的植株氮、磷、钾三元素营养动态变化;潘丽梅等[9]研究了基质种类、瓶苗质量、温湿度及施肥浓度对组培苗移栽成活率和生长的影响。关于罗汉果栽培技术近年来有学者研究在栽培中使用特定肥料如硅肥,枯草芽孢杆菌肥对罗汉果的影响[10-11],马静等[12]也研究了微量元素对罗汉果生长发育的影响。【本研究切入点】目前对罗汉果组培苗生育周期、生长发育习性以及生态适应性的观察试验以及不同栽培方式对罗汉果枝蔓生长的研究也已有一些报道[13-15],但对于组培苗不同种植时间、不同栽培管理方式以及不同授粉时间对结果和果实生长的影响的相关研究鲜见报道。【拟解决的关键问题】本研究通过设置罗汉果组培苗在不同种植时间、不同移栽方式以及不同授粉时间等处理,研究罗汉果组培苗结果和果实生长,探明罗汉果组培苗高产栽培关键技术,为罗汉果组培苗推广发展提供参考。
1. 材料与方法
1.1 试验地等概况
试验于2016年在桂林市龙胜县泗水乡罗江山区林地的梯田进行。罗汉果组培苗种植株行距1.6 m×2.5 m,种植前每667 m2用生石灰100 kg均匀撒施后翻入土中,并挖定植穴,长50 cm、宽50 cm、深30 cm。每穴加入腐熟有机肥7~10 kg,磷肥250 g,复合肥100~150 g以及50%多菌灵可湿性粉剂2~3 g与土壤拌匀,然后再盖上5 cm厚的土壤, 避免幼根直接与肥土接触,防止烧根烧苗。移栽定植时将苗木放入定植穴,覆土压实,浇足定根水,其他栽培措施与常规管理一致。
1.2 试验材料
供试罗汉果组培苗品种佰林三号为优良青皮果薯块单株茎尖离体培养诱导筛选培育的罗汉果优良品种,种苗不带病毒, 具有抗病性、抗逆性强, 适应性广, 品质优良, 高产、稳产, 当年种植当年丰产等优良特性。罗汉果雌雄异株,雄株应选择开花早、花粉多、亲和力强、花期长的品种,雌雄株配置比例为100:2。
1.3 试验方法
1.3.1 不同种植时间对罗汉果组培苗生长和产量的影响
设置种植时间在3月中旬至6月下旬间,每隔20 d左右种植1次,共设置5个种植时间处理,即分别为3月中旬、4月上旬、4月下旬、5月中旬、6月上旬种植,每个处理3个重复,每重复种植15株。试验种植前先将罗汉果组培苗小苗由小营养钵转到大钵继续在温室大棚中培育1个月后再移栽大田定植,其后观察各处理植株上棚时间、开花时间以及果实成熟时间,并调查记录幼苗死苗率、平均株产以及裂果树。
1.3.2 不同移栽方式对罗汉果组培苗生长和产量的影响
试验设置4个处理,即T1:在3月中旬将小苗由小营养钵转到大钵继续在温室大棚中培育(控温25~30℃)至4月中旬气温相对较高时再移栽大田定植,期间每3 d淋施1次沤制的麸肥或1%硫酸钾复合肥液肥;T2:3月中旬小苗直接移栽大田定植后,用小拱膜覆盖,期间应根据天气变化适时开、盖膜;T3:3月中旬小苗直接移栽大田定植后,用黑膜覆盖厢面;T4:不经培育的小苗直接在4月中旬定植大田。各处理均设3个重复,每重复种植15株,随机排列。测量记录上棚前日均生长量、上棚时间、显蕾期、初花期以及盛花期,果实成熟后,记录株产以及果径大小。
1.3.3 不同授粉时间对罗汉果组培苗结果和果实生长的影响
在植株盛花期的前期进行,雄花开花后于早晨6:00~7:00采下,用保鲜膜包装置于5~8℃冰箱中保存,雌花开花后于当日8:00~18:00,每隔2 h进行授粉。每个处理3个重复,每重复授粉30朵,授粉后挂好相应标签牌,然后调查坐果率、成果率、测量果径。
1.3.4 雄花不同存贮方式及贮存时间授粉对坐果、成果和果径的影响
在植株盛花期的前期进行,雄花开花后于早晨6:00~7:00采下用保鲜膜包装好,贮存方式及贮存时间不同设置以下8个处理:B1(5~8℃冰箱中保存1 d后授粉)、B2(5~8℃冰箱中保存2 d后授粉)、B3(5~8℃冰箱中保存3 d后授粉)、B4(5~8℃冰箱中保存4 d后授粉);Y1(阴凉天气室内保存1 d后授粉)、Y2(阴凉天气室内保存2 d后授粉);G1(高温干燥天气室内保存1 d后授粉)、G2(高温干燥天气室内保存保存2 d后授粉)。每个处理3个重复,每重复授粉30朵,授粉后挂好相应标签牌,然后调查坐果率、成果率、测量果径等。
1.4 观测指标及方法
平均株产和裂果率:在收获期调查每处理小区内所有罗汉果个数、罗汉果株数得出以及罗汉果裂果数;果径:用游标卡尺测量,精确到0.01 cm;坐果率:在授粉后15 d调查授粉花的结果数量;成果率:在果实成熟期调查。
1.5 数据分析
采用Excel 2010对数据进行处理、分析;用SPSS 18.0进行方差分析。
2. 结果与分析
2.1 不同种植时间对罗汉果组培苗生长和产量的影响
由表 1可以看出,3月中旬种植植株幼苗死苗率最高,达11.63%,而5月中旬种植幼苗死苗率最低,仅2.12%,两者间差异显著。裂果率由大到小排列为:6月上旬>5月中旬>4月下旬>4月上旬>3月中旬,随着种植时间的延迟,罗汉果裂果率依次增加;其中6月上旬尤为严重,裂果率高达26.36%,与其他4个处理间存在显著差异,是其他处理的4.82~14.10倍。5月中旬、4月下旬、4月上旬种植的罗汉果平均株产相差不大,方差分析结果表明四者间差异不显著。5个处理中,4月下旬种植平均株产最高,而6月上旬种植的最低,二者间差异显著。
表 1 不同种植时间对植株生长和产量的影响Table 1. Effect of planting period on plant growth and yield种植时间
Planting time上棚时间
Sheding time
/(mm-dd)开花时间
Flowering time
/(mm-dd)果实成熟时间
Fruit ripening
time平均株产个数
Average number
of plants幼苗死苗率
Seedling mortality
/%裂果率
Dehiscent rate
/%3月中旬 In the middle of march 06-13 07-16 10月上旬 59±9.42b 11.63±2.27a 1.87±0.31b 4月上旬Early april 06-22 08-03 10月中旬 68±4.32ab 5.32±0.47b 2.02±0.15b 4月下旬In late april 06-28 08-10 10月下旬 73±5.89a 4.65±0.36bc 2.61±0.06b 5月中旬In middle may 07-14 08-15 10月下旬 66±8.64ab 2.12±0.23d 5.47±0.42b 6月上旬 In early june 07-23 08-21 11月下旬 57±4.97b 2.84±0.24cd 26.36±4.09a 注:同列数据后不同小写字母表示在0.05水平下差异显著。表 2~4同。
Note:Different lowercase letters in a same column represent significant difference at 5% level. The same as table 2-4.由此,结合各处理的上棚时间、开花和果实成熟时间说明提早种植能使植株提早上棚、开花和结果,随着种植时间的延长,气温开始升高,从种植至上棚、开花、结果的时间逐渐缩短,同时幼苗死苗率开始降低,裂果率逐渐增加。4月下旬种植罗汉果的平均株产最高,是罗汉果组培种植的适宜时间。
2.2 不同移栽方式对罗汉果组培苗生长和产量的影响
从表 2可以看出,T1处理罗汉果植株上棚、显蕾、初花和盛花期都最早。T2、T3、T4等3个处理的上棚时间基本一致,但4处理的显蕾时间、初花和盛花时间均比T2、T3处理晚1个月;而T2、T3处理各生长时期一致。从表 2还可知,各处理罗汉果平均株产由大到小排列为:T1>T2>T3>T4,而果径由大到小排列为:T1>T3>T2>T4;罗汉果平均株产、上棚前日均生长量与果径最大值均为T1处理,而最小值均为T4处理,两者间差异均显著。
表 2 不同移栽方式方式对植株生长和产量的影响Table 2. Effects of cultivation practice on plant growth and yield移栽方式
Management
style上棚前日均生长量
Average daily growth
before shed/cm上棚时间
Sheding
time显蕾时间
Flower
buds time初花时间
First flowering
time盛花期
Flowering
time平均株产个数
Average number
of plants果径
Fruit diameter
/cmT1 4.06±0.59a 5月上旬
Early May5月中下旬
Mid-to-tate May6月中旬
Mid-June6月下旬
Late June73±7.26a 5.47±0.50a T2 3.13±0.61b 6月上旬
Early June6月下旬
Late June7月中旬
Mid-July7月下旬
Late July68±6.48a 5.14±0.11ab T3 3.00±0.28b 6月上旬
Early June6月下旬
Late June7月中旬
Mid-July7月下旬
Late July66±2.16a 5.30±0.19a T4 1.89±0.25c 6月下旬
Late June7月下旬
Late July8月中旬
Mid-August8月下旬
Late August57±3.56b 4.79±0.11b 2.3 不同授粉时间对罗汉果组培苗结果和果实生长的影响
从表 3可以看出,雌花开花后选择不同的时间授粉对坐果率有影响,阴凉天气下,早晨8:00授粉的比傍晚18:00授粉的坐果率提高31.6个百分点,成果率提高23.8个百分点;高温干燥天气下,最大相差31.3%,最大相差20.9%。从果实横径来看,阴凉天气和上午授粉,果实略大些,其余的没有明显差异。其中,阴凉天气10:00授粉,其坐果率、成果率以及果径均最大;阴凉天气8:00、12:00、14:00以及高温干燥天气8:00、10:00次之,此4个授粉时间的坐果率均达80%、成果率均达70%、果径均达5.00 cm。方差分析结果表明,阴凉天气10:00、8:00、12:00、14:00以及高温干燥天气8:00、10:00授粉,其坐果率、成果率以及果径间无显著差异。除此之外其他各时间授粉,罗汉果的坐果率、成果率以及果径大小均不理想。
表 3 不同时间授粉对坐果、成果和果径的影响Table 3. Effects of pollinating time on fruit setting, fruiting and size不同授粉时间
Different
pollination time坐果率
Fruit-set
rate/%成果率
Fruit-result
rate/%果径
Fruit diameter
/cm阴凉天气 Cool weather 8:00 80.3±1.69a 74.1±1.35ab 5.43±0.18abc 10:00 82.0±2.16a 79.2±7.59a 5.71±0.11a 12:00 81.1±2.28a 76.3±4.46ab 5.53±0.21ab 14:00 80.5±1.95a 71.0±4.32bc 5.15±0.20cde 16:00 65.3±5.12c 66.3±4.61cd 4.86±0.10efg 18:00 58.2±6.09d 60.6±2.41de 5.07±0.13def 高温干燥天气 Hot dry weather 8:00 80.0±1.59a 70.3±1.43bc 5.29±0.23bcd 10:00 79.1±1.28a 71.2±1.30bc 4.96±0.21ef 12:00 72.1±4.41b 69.1±0.83bc 4.88±0.08efg 14:00 60.2±5.37cd 58.6±4.52e 4.77±0.15fgh 16:00 52.3±6.45e 50.4±3.15f 4.52±0.33h 18:00 48.7±3.51e 50.3±5.75f 4.61±0.07gh 综合各项指标,在罗汉果雌花开花后,在阴凉天气8:00~10:00进行授粉效果最佳。
2.4 雄花不同存贮方式及不同贮存时间授粉对坐果率、成果率和果径的影响
从表 4可见,雄花早晨采下后置于不同贮存环境贮存1 d后,其坐果率均达80%以上,而成果率均达75%以上;三者坐果率大小依次为:5~8℃冰箱贮存1 d、阴凉天气室内贮存1 d、高温干燥室内贮存1 d;而成果率大小依次为:阴凉天气室内贮存1 d、高温干燥室内贮存1 d、5~8℃冰箱贮存1 d;三者间差异不显著。从果实横径变化来看,随着花粉贮存时间延长,果实横径有变小的趋势,但无论在何种环境下贮存,只贮存了1 d的处理其果径均大于其他处理,但差异不显著。
表 4 雄花不同贮存方式及不同贮存时间授粉对坐果率、成果率和果径的影响Table 4. Effects of male flower storage and duration on pollination, fruit setting, fruiting and size不同存贮方式
Different storage
methods存贮天数
Storage
days/d坐果率
Fruit-set
rate/%成果率
Fruit-result
rate/%果径
Fruit diameter
/cm5~8℃冰箱
5~8℃ refrigerator1 82.6±1.84a 75.1±4.61a 5.47±0.13ab 2 78.5±1.06b 73.4±1.87a 5.01±0.14c 3 69.3±2.62c 62.1±2.12b 5.31±0.24b 4 27.4±2.05e 23.6±3.18d 4.66±0.28d 阴凉天气室内
Cool weather indoor1 81.8±0.85a 78.3±1.63a 5.63±0.09a 2 33.6±2.19d 28.7±3.32c 5.28±0.11b 3 0.0±0.00g - - 高温干燥天气室内
Hot dry weather indoor1 80.6±1.36ab 77.5±4.86a 5.30±0.16b 2 4.6±1.64f 4.6±1.22e 4.87±0.16cd 由表 4还可知,雄花早晨采下后置于5~8℃冰箱中贮存,第1 d后授粉坐果率达82.6%,而第4 d后授粉坐果率只有27.4%,期间授粉坐果率下降了55.2个百分点。在阴凉天气室内放置,坐果率从贮存1 d的81.8%急剧下降到贮存2 d的33.6%,且在第3 d完全丧失活力。在高温干燥环境下,第1 d后授粉坐果率达80.6%而,贮存2 d后授粉坐果率只有4.6%,说明贮存2 d后花粉便失去了活力。
3. 讨论与结论
罗汉果是桂北地区重要的特色产业,广西罗汉果产量占世界的90%以上,近年来,桂林地区开始大力发展罗汉果组培苗,有研究表明罗汉果组培苗存在诸多优势,相对于压蔓薯苗具植株生长势强、适应性广、产量高以及当年种植当年丰收等优势。陈继富等[16]在湘西地区通过对罗汉果组培苗农青2号进行大田种植观察发现,4月上、中旬气温回升后定植有利于植株恢复生长,既避过低温伤害又不会受到干旱的威胁,利于管理;定植时,若气温较低,可将罗汉果营养杯组培苗放在塑料大棚内培植,待气温回升后,选取晴天定植,定植成活率在95%左右,这与本试验研究结果基本一致。何金旺[17]通过在桂北高寒山区对5个罗汉果组培苗与2个农家品种进行品比试验,结果表明:组培苗单产及产值极显著优于对照农家品种。因此,罗汉果组培苗的推广应用被视为由传统生产模式向现代化、规模化发展的有力支撑[18-19],并且种苗不带病毒,藤蔓生长不受种源病毒的影晌,抗性较强[20]。
本试验研究结果表明:罗汉果组培苗在移栽大田之前,要将小苗转大钵在温棚中培育,因为温棚内气温相对较高,能促使植物快速生长,待移植到大田时具有发达的根系,移植后没有明显的缓苗期,从而可以提早上棚、显蕾、开花结果。
罗汉果组培苗应当选择4月上旬至5月中旬种植,此时气温已经升高且稳定,组培苗移植后能适应外界环境,正常生长,病害侵染少,方便管理,盛花期出现在高温干旱前期,对果实生长发育影响小,产量高,商品果多,是组培苗移栽大田最适宜的时期。
罗汉果对授粉时间和环境要求极高,综合各项因素,应当选择在阴凉天气8:00~10:00授粉,并且采集的花粉应当保存在5~8℃,可延长花粉的活力。
因此,在桂北地区发展种植罗汉果组培苗时,应当正确选择种植时间、种植方式、授粉时间和授粉方式,以保证罗汉果高产稳产。本研究通过对罗汉果组培苗开展高产栽培技术研究,确定适宜的种植时间、移栽方式、授粉时间以及花粉在不同条件下的有效活性时间。由于时间有限,本文仅仅对影响罗汉果高产栽培技术的4个方面进行了研究,特别是在对罗汉果花粉活力的研究方面没有涉及,对于罗汉果花粉活力对罗汉果果实以及品质的影响,还有待进一步探讨。
-
图 9 HcNiR的氨基酸序列对比
HcNiR:红麻;HsNiR:木槿(XP_039006864.1);TcNiR:可可树(XP_007042430.2);GhNiR:陆地棉(ADJ68001.1);GrNiR:雷蒙德氏棉(XP_012463711.1)。
Figure 9. Amino acid sequences of HcNiR
HcNiR: H. cannabinus; HsNiR: H. syriacus (XP_039006864.1); TcNiR: Theobroma cacao (XP_007042430.2); GhNiR: Gossypium hirsutum (ADJ68001.1); GrNiR: Gossypium raimondii (XP_012463711.1).
表 1 引物序列
Table 1 Primer sequence
引物名称
Primer names引物序列(5′-3′)
Primer sequence(5′-3′)HcNiR-F ATGACAGATGGGAGATTTATGATG HcNiR-R GCATTTTCCACTTCTTCTTCCC HcNiR-qPCR-F TCTTGGTTACAGGGGCAATAGAC HcNiR-qPCR-R TGGACACCAAGATAGTCTCTCCT beta-actin-F ATCCTCCGTCTTGACCTTG beta-actin-R TGTCCGTCAGGCAACTCAT 表 2 HcNiR基因编码蛋白质产物一级结构预测分析
Table 2 Primary structure of HcNiR encoded protein
一级结构特征
Characteristics of
primary structure氨基酸数量
Number of
amino acids等电点
pI相对分子质量
Relative molecular
mass/Da分子式
Molecular
formula正电荷
残基
Arg+Lys负电荷
残基
Asp+Glu平均疏水性
Average
hydrophobicity脂肪系数(AI)
Fatty
coefficient不稳定系数(Ⅱ)
Instability
coefficient (Ⅱ)半衰期
Estimated
half-life/h预测结果
Prediction result464 5.490 51683.220 C2276H3632N644O681S24 54 64 −0.289 89.480 37.930 30 -
[1] ZHANG L W, XU Y, ZHANG X T, et al. The genome of kenaf (Hibiscus cannabinus L. ) provides insights into bast fibre and leaf shape biogenesis [J]. Plant Biotechnology Journal, 2020, 18(8): 1796−1809. DOI: 10.1111/pbi.13341
[2] AYADI R, HANANA M, MZID R, et al. Hibiscus cannabinus L.- kenaf: A review paper [J]. Journal of Natural Fibers, 2017, 14(4): 466−484.
[3] 陶爱芬, 张晓琛, 祁建民. 红麻综合利用研究进展与产业化前景 [J]. 中国麻业科学, 2007, 29(1):1−5. DOI: 10.3969/j.issn.1671-3532.2007.01.001 TAO A F, ZHANG X C, QI J M. Research progress and industrialization prospect of comprehensive utilization on kenaf [J]. Plant Fiber Sciences in China, 2007, 29(1): 1−5.(in Chinese) DOI: 10.3969/j.issn.1671-3532.2007.01.001
[4] SWINGLE R S, URIAS A R, DOYLE J C, et al. Chemical composition of kenaf forage and its digestibility by lambs and in vitro [J]. Journal of Animal Science, 1978, 46(5): 1346−1350. DOI: 10.2527/jas1978.4651346x
[5] 李超显. 饲料产业的环保问题及解决对策 [J]. 中国饲料, 2019(18):114−117. LI C X. Environmental protection problems and solutions in feed industry [J]. China Feed, 2019(18): 114−117.(in Chinese)
[6] SEITH B, SCHUSTER C, MOHR H. Coaction of light, nitrate and a plastidic factor in controlling nitrite-reductase gene expression in spinach [J]. Planta, 1991, 184(1): 74−80.
[7] ZHANG J, LV J, XIE J M, et al. Nitrogen source affects the composition of metabolites in pepper (Capsicum annuum L. ) and regulates the synthesis of capsaicinoids through the GOGAT-GS pathway [J]. Foods (Basel, Switzerland), 2020, 9(2): 150.
[8] KYAING M, 顾立江, 程红梅. 植物中硝酸还原酶和亚硝酸还原酶的作用 [J]. 生物技术进展, 2011, 1(3):159−164. KYAING M, GU L J, CHENG H M. The role of nitrate reductase and nitrite reductase in plant [J]. Current Biotechnology, 2011, 1(3): 159−164.(in Chinese)
[9] LAHNERS K, KRAMER V, BACK E, et al. Molecular cloning of complementary DNA encoding maize nitrite Reductase: Molecular analysis and nitrate induction [J]. Plant Physiology, 1988, 88(3): 741−746. DOI: 10.1104/pp.88.3.741
[10] WANG R C, XING X J, CRAWFORD N. Nitrite acts as a transcriptome signal at micromolar concentrations in Arabidopsis roots [J]. Plant Physiology, 2007, 145(4): 1735−1745. DOI: 10.1104/pp.107.108944
[11] TAKAHASHI M, SASAKI Y, IDA S, et al. Nitrite reductase gene enrichment improves assimilation of NO2 in Arabidopsis [J]. Plant Physiology, 2001, 126(2): 731−741. DOI: 10.1104/pp.126.2.731
[12] KATO C, TAKAHASHI M, SAKAMOTO A, et al. Differential expression of the nitrite reductase gene family in tobacco as revealed by quantitative competitive RT-PCR [J]. Journal of Experimental Botany, 2004, 55(403): 1761−1763. DOI: 10.1093/jxb/erh182
[13] OZAWA K, KAWAHIGASHI H. Positional cloning of the nitrite reductase gene associated with good growth and regeneration ability of calli and establishment of a new selection system for Agrobacterium-mediated transformation in rice (Oryza sativa L. ) [J]. Plant Science, 2006, 170(2): 384−393. DOI: 10.1016/j.plantsci.2005.09.015
[14] 夏磊, 王团团, 段莉莉, 等. 黄瓜亚硝酸还原酶基因(CsNiR)的克隆及对外植体分化的影响 [J]. 南京农业大学学报, 2020, 43(2):231−237. DOI: 10.7685/jnau.201906021 XIA L, WANG T T, DUAN L L, et al. Cloning of nitrite reductase gene(CsNiR)in cucumber and its effect on explant differentiation [J]. Journal of Nanjing Agricultural University, 2020, 43(2): 231−237.(in Chinese) DOI: 10.7685/jnau.201906021
[15] 张超, 黄思齐, 邓勇, 等. 高蛋白饲用红麻品种筛选及饲用品质研究 [J]. 中国麻业科学, 2021, 43(6):287−293. DOI: 10.3969/j.issn.1671-3532.2021.06.002 ZHANG C, HUANG S Q, DENG Y, et al. Selection of high protein forage kenaf varieties and study on their feed quality [J]. Plant Fiber Sciences in China, 2021, 43(6): 287−293.(in Chinese) DOI: 10.3969/j.issn.1671-3532.2021.06.002
[16] 邓勇. 硫化氢缓解红麻重金属镉胁迫功能分析[D]. 北京: 中国农业科学院, 2019. DENG Y. Function analysis of hydrogen sulfide-mediated alleviation of cadmium stress in kenaf(Hibiscus cannabinus L.) seedlings[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese)
[17] 张超, 张勇, 满百膺, 等. 大豆GmPID基因生物信息学分析及克隆 [J]. 东北农业大学学报, 2020, 51(1):13−22. DOI: 10.3969/j.issn.1005-9369.2020.01.002 ZHANG C, ZHANG Y, MAN B Y, et al. Bioinformatic analysis and cloning of gene GmPID in soybean [J]. Journal of Northeast Agricultural University, 2020, 51(1): 13−22.(in Chinese) DOI: 10.3969/j.issn.1005-9369.2020.01.002
[18] 田华, 段美洋, 王兰. 植物硝酸还原酶功能的研究进展 [J]. 中国农学通报, 2009, 25(10):96−99. TIAN H, DUAN M Y, WANG L. Research progress on nitrate reductase functions in plants [J]. Chinese Agricultural Science Bulletin, 2009, 25(10): 96−99.(in Chinese)
[19] NAVARRO F J, PERDOMO G, TEJERA P, et al. The role of nitrate reductase in the regulation of the nitrate assimilation pathway in the yeast Hansenula polymorpha [J]. FEMS Yeast Research, 2003, 4(2): 149−155. DOI: 10.1016/S1567-1356(03)00163-6
[20] 佘茂云, 陈朵朵, 冯晨, 等. 小麦亚硝酸还原酶基因及调控序列克隆、定位和表达分析 [J]. 作物学报, 2011, 37(1):28−39. DOI: 10.3724/SP.J.1006.2011.00028 SHE M Y, CHEN D D, FENG C, et al. Isolation, chromosome assignment, and expression assay of nitrite reductase gene and regulatory sequence in wheat [J]. Acta Agronomica Sinica, 2011, 37(1): 28−39.(in Chinese) DOI: 10.3724/SP.J.1006.2011.00028
[21] 曾彦达, 石晓艳, 马凤鸣. 甜菜亚硝酸还原酶(NiR)基因的克隆与分析 [J]. 东北农业大学学报, 2012, 43(1):77−82. DOI: 10.3969/j.issn.1005-9369.2012.01.013 ZENG Y D, SHI X Y, MA F M. Cloning and analysis of NiR gene in sugar beet [J]. Journal of Northeast Agricultural University, 2012, 43(1): 77−82.(in Chinese) DOI: 10.3969/j.issn.1005-9369.2012.01.013
[22] HIRASAWA M, FUKUSHIMA K, TAMURA G, et al. Immunochemical characterization of nitrite reductases from spinach leaves, spinach roots and other higher plants [J]. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology, 1984, 791(2): 145−154. DOI: 10.1016/0167-4838(84)90004-9
[23] 张芬, 王丽鸳, 成浩, 等. 茶树亚硝酸还原酶基因CsNiR的克隆及表达分析 [J]. 园艺学报, 2016, 43(7):1348−1356. ZHANG F, WANG L Y, CHENG H, et al. Molecular cloning and expression analysis of nitrite reductase gene CsNiR in tea plant [J]. Acta Horticulturae Sinica, 2016, 43(7): 1348−1356.(in Chinese)
[24] 孙菲菲, 蒋芳玲, 侯喜林, 等. 白菜亚硝酸还原酶基因BcNiR的克隆及表达分析 [J]. 园艺学报, 2009, 36(10):1511−1518. DOI: 10.3321/j.issn:0513-353X.2009.10.017 SUN F F, JIANG F L, HOU X L, et al. Molecular cloning and characterization of nitrite reductase gene BcNiR from non-heading Chinese cabbage [J]. Acta Horticulturae Sinica, 2009, 36(10): 1511−1518.(in Chinese) DOI: 10.3321/j.issn:0513-353X.2009.10.017
[25] 石晓艳, 曾彦达, 李世龙, 等. 甜菜亚硝酸还原酶(NiR)基因的克隆与表达分析 [J]. 作物学报, 2011, 37(8):1406−1414. DOI: 10.3724/SP.J.1006.2011.01406 SHI X Y, ZENG Y D, LI S L, et al. Molecular cloning and characterization of nitrite reductase gene from sugarbeet [J]. Acta Agronomica Sinica, 2011, 37(8): 1406−1414.(in Chinese) DOI: 10.3724/SP.J.1006.2011.01406
[26] 陈何, 王乐, 赵春丽, 等. 氮素和红蓝复合光配比对苋菜幼苗亚硝酸还原酶活性及其基因表达的影响 [J]. 中国农业大学学报, 2021, 26(8):61−71. DOI: 10.11841/j.issn.1007-4333.2021.08.07 CHEN H, WANG L, ZHAO C L, et al. Effects of nitrogen and red and blue light on NiR enzyme activity and gene expression in Amaranthus tricolor L. seedlings [J]. Journal of China Agricultural University, 2021, 26(8): 61−71.(in Chinese) DOI: 10.11841/j.issn.1007-4333.2021.08.07
-
期刊类型引用(5)
1. 李冉,王张豪,阎燚刚,杨玉婷,杜冰,单体江. 罗汉果病虫害及其综合防治研究进展. 林业与环境科学. 2024(02): 150-160 .  百度学术
百度学术
2. 农代国. 蒲芦瑶族乡罗汉果优质高产栽培技术探讨. 农业技术与装备. 2023(05): 139-140+143 .  百度学术
百度学术
3. 秦凤琴. 桂林临桂区罗汉果优质高产栽培技术. 南方园艺. 2021(04): 41-43 .  百度学术
百度学术
4. 肖石明. 永福县罗汉果优质栽培技术探讨. 南方农业. 2021(20): 7-8 .  百度学术
百度学术
5. 甘金佳,毛玲莉,蒋水元,梁勇诗,李虹,向巧彦,黄夕洋. 不同授粉方式对罗汉果着果率和果实品质的影响. 中国南方果树. 2020(06): 71-74 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: