Expression and Distribution of Nucleic Acid-sensing TLRs in Porcine Sperm
-
摘要:目的 Toll样受体(Toll like receptors, TLRs)作为天然免疫系统中重要的模式识别受体,在抵御病原微生物感染方面发挥着重要作用。研究猪精子核酸识别TLR的表达和分布情况,为精子TLR信号通路相关功能和抗微生物特性的研究奠定基础。方法 采用RT-PCR技术检测公猪精子TLR3、7、8和9 mRNA的表达情况,利用免疫荧光方法检测了TLR3蛋白在猪精子上的分布。结果 RT-PCR结果显示,TLR3、7、8和9 mRNA在猪精子均有表达;免疫荧光试验结果显示TLR3主要分布在精子头部的后部和中段。结论 猪精子上核酸识别TLRs的存在以及TLR3分布的区域化提示猪精子可能对病毒及其衍生物感染做出应答,为进一步研究精子TLR信号通路提供依据。Abstract:Objective Expression and distribution of the toll-like receptor (TLR) in porcine sperm were analyzed to facilitate the study on the related signaling pathway and antimicrobial properties.Method The mRNA expressions of TLR3, 7, 8, and 9 in pig sperm were detected by RT-PCR, and the distribution of TLR3 by immunofluorescence.Result The mRNA of TLR3, 7, 8, and 9 were all expressed in the sperm, and TLR3 mainly found in the posterior head and midpiece.Conclusion The expression of nucleic acid-sensing TLRs and the localizations of TLR3 in the porcine sperm revealed in this study gave clues of how the sperm might respond to attacks by virus and derivatives. The information paved the way for further investigation on the sperm TLR signaling pathway and pathogen recognition function.
-
Keywords:
- Nucleic acid-sensing TLRs /
- porcine sperm /
- mRNA expression /
- immunofluorescence
-
0. 引言
【研究意义】Toll样受体(TLR)是天然免疫系统重要的模式识别受体之一,能够识别细菌脂多糖(LPS)、肽聚糖、未甲基化病原体的CpG DNA和病毒RNA等病原体衍生物并通过髓样分化蛋白88、β-干扰素TLR结构域衔接蛋白介导多种信号通路,继而引发特异性的免疫应答[1, 2]。Toll样受体家族因其重要的免疫调控作用,已成为近些年研究的热点。精液可作为细菌和病毒向雌性动物生殖道传播的载体,进而传递给胎儿[3]。研究精子的天然免疫相关蛋白,有助于了解精液和精子的抗微生物特性,对畜禽的抗病育种研究具有重要科学意义和应用前景。【前人研究进展】哺乳动物中已经发现13种TLRs,其中TLR 1-9在人和鼠身上有功能表达,TLR10仅仅在人体内起作用;猪上也已克隆出TLR1-10基因[1]。根据细胞定位和病原相关模式分子(PAMPs)的类型,TLRs大体上分为两大类:第一类为TLR1、TLR2、TLR4、TLR5、TLR6和TLR10,主要识别来自细菌、真菌和原生动物的PAMPs;第二类为TLR3、TLR7、TLR8和TLR9,识别病毒和细菌的核酸衍生物。TLRs首次被报道存在于雄性大鼠附睾上皮及精子中[4]。鼠精原细胞和精母细胞TLR3,被激活后可启动生精细胞抗病毒的天然免疫反应,并可以诱导生精细胞凋亡[5, 6]。人和鼠精子的TLR2和TLR4可识别病原组分脂多糖和肽聚糖引起精子运动减慢和精子凋亡[7, 8]。小鼠精子TLR9激活也可导致精子活力及受精能力下降[9]。目前对精子中TLRs的研究多集中人和鼠,针对其他动物的研究报道较少[7, 8, 10]。【本研究切入点】TLRs在生殖系统的微生物广谱识别和清除中发挥重要作用。虽然猪雄性和雌性生殖器官已检测到TLRs的表达[11],但在猪精子上关于识别核苷酸衍生物的TLRs尚待进一步研究。【拟解决的关键问题】本研究测定了猪精子TLR3、7、8、9基因的表达及TLR3蛋白在精子上的分布情况,为猪精子的抗微生物特性研究和TLR信号相关功能的研究奠定基础。
1. 材料与方法
1.1 试验动物与样品采集
分别采集3只长白公猪精液样本,经16层纱布过滤,检测精子活力和活率,精液与CXM按 1∶2稀释后,45°倾斜置于37 ℃ CO2培养箱1 h,取上层3/4部分2 500 r·min−1离心5 min,弃上清。PBS清洗2次,12 000 r·min−1离心1 min,收集精子立即用液氮速冻后置于−80 ℃冻存备用。另一部分经过洗涤后制作精子涂片。
1.2 总RNA提取和反转录
采用Trizol法提取组织总RNA,超微量紫外分光光度计(Thermo Scientific,美国)检测RNA含量、纯度及质量,并调整总RNA含量至1 μg·μL−1;利用Super Script™ III First-Strand Synthesis Super反转试剂盒(Invitrogen,美国)将其反转录成cDNA,置于−80 ℃保存备用。
1.3 RT-PCR检测
根据Gen Bank已公布TLR3、7、8和9基因序列,应用Primer Premier 6.0和Beacon designer 7.8软件设计引物(表1),生工生物工程(上海)股份有限公司合成。以GAPDH基因为内参,Applied Biosystems Veriti PCR仪(Applied Biosystems Ltd.,美国)检测猪精子、脾脏和肺脏mRNA表达情况。反应体系(50 μL):Platinum® PCR Super Mix,High Fidelity 45 μL(Invitrogen,美国)、1 μg·μL−1 cDNA 2.0 μL、10 μmol·L−1 PCR-F 1 μL、10 μmol·L−1 PCR-R 1 μL和ddH2O 1.0 μL。反应条件:94 ℃ 2 min,94 ℃ 30 s、X ℃ (溶解温度,见表1)30 s、68 ℃ 30 s 38个循环。
表 1 RT-PCR引物序列Table 1. RT-PCR primers and conditions基因名称
Gene基因序列号
Genbank Accession引物序列(5′→3′)
Primer Sequences(5′→3′)扩增长度
Size/bp溶解温度
Annealing/℃Pig TLR3 NM_001097444.1 F: GGCTCTGGAAACACGCAAACC
R: GAGACCATGATATTGAGGTGGAGTA428 62 Pig TLR7 NM_001097434.1 F: CACCAGAAGGCAGCAGATTAA
R: ACTTGCGGTTGACTGAGGTTAT423 58 Pig TLR8 NM_214187.1 F: GGCAAAAGAATGGAGATAGACCC
R: CAGCTCACTGAAAGCAGCGTC347 60 Pig TLR9 NM_213958.1 F: ACTGGAGCAGCCTGACCCT
R: AGCAGCGAGATGCCAAAAC466 62 Pig GAPDH NM_001206359.1 F: CATCACTGCCACCCAGAAGA
R: ATTGTCGTACCAGGAAATGAGC409 60 1.4 免疫荧光试验
精子涂片自然风干后,经4%的多聚甲醛固定10 min,PBS洗涤(0.02 mol·L−1, pH 7.2),5%BSA封闭,小鼠TLR3单克隆抗体(1∶250;Abcam,美国)4 ℃孵育过夜;精子涂片PBS漂洗后,用FITC标记的免抗鼠IgG荧光二抗(1∶100;北京博奥森,中国)37 ℃ 孵育1 h,PBS漂洗,甘油封片。阴性对照用PBS替代一抗孵育。封片后快速在荧光显微镜(尼康,日本)下观察,并进行数据和图像采集。
2. 结果与分析
2.1 猪精子TLRs mRNA的表达水平
以脾脏和肺脏为阳性对照,利用RT-PCR检测了TLR3、7、8、9 mRNA在猪精子中的表达情况,如图1所示。结果显示:在理论大小处各组织均有单一清晰的条带,这一结果提示,TLR3、7、8、9 mRNA在猪精子、脾脏和肺脏中均有表达。
2.2 TLR3在猪精子上的分布情况
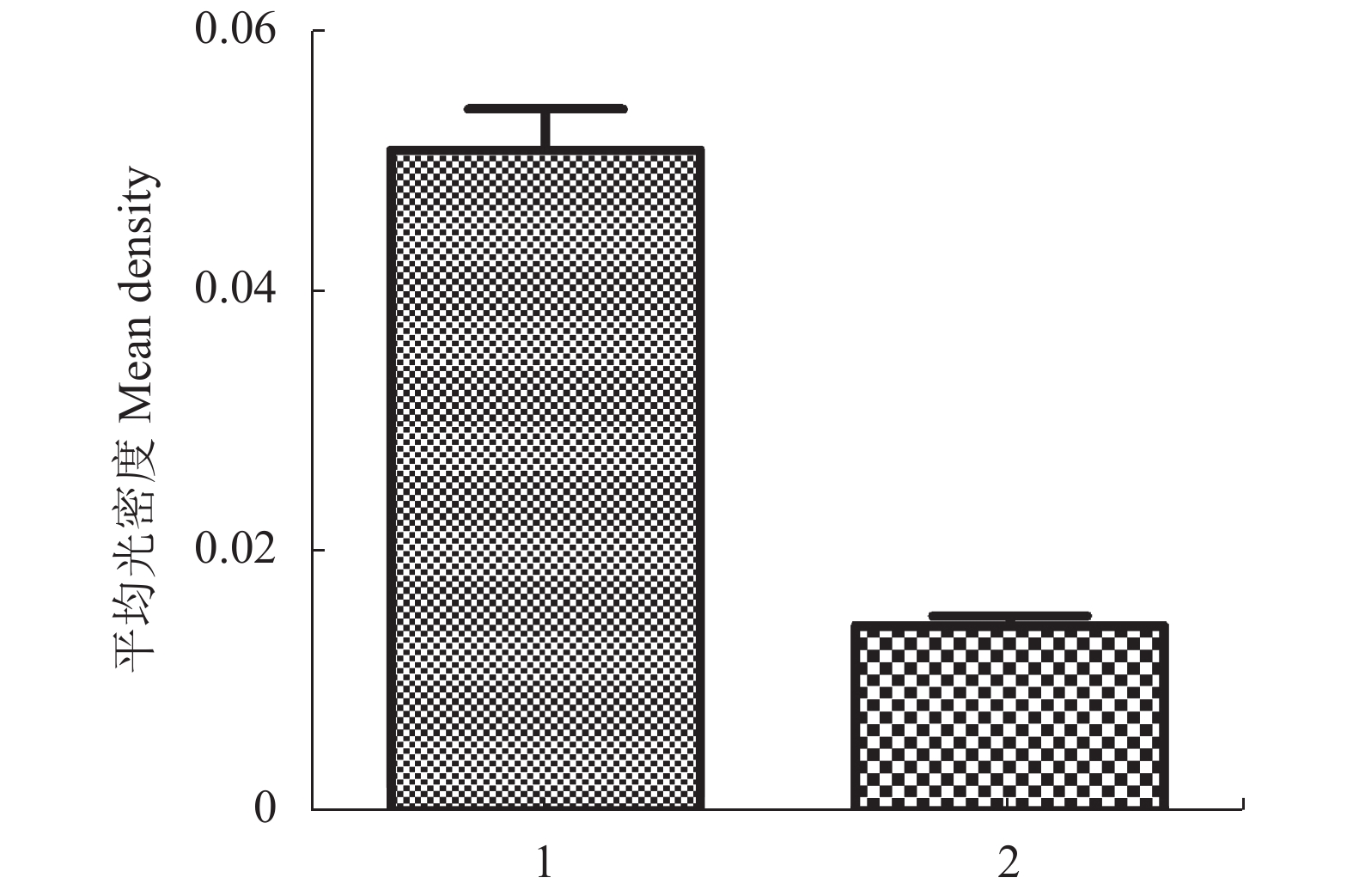
本研究选取mRNA表达量相对较高TLR3,通过免疫荧光的方法观察TLR3在猪精子上的分布情况,如图2、3所示。结果显示:TLR3定位于猪精子的头部后部对应核后帽区及中段。利用IPP6软件对荧光强度进行分析,显示核后帽区荧光强度强于中段(图4),而阴性对照中检测不到荧光信号。
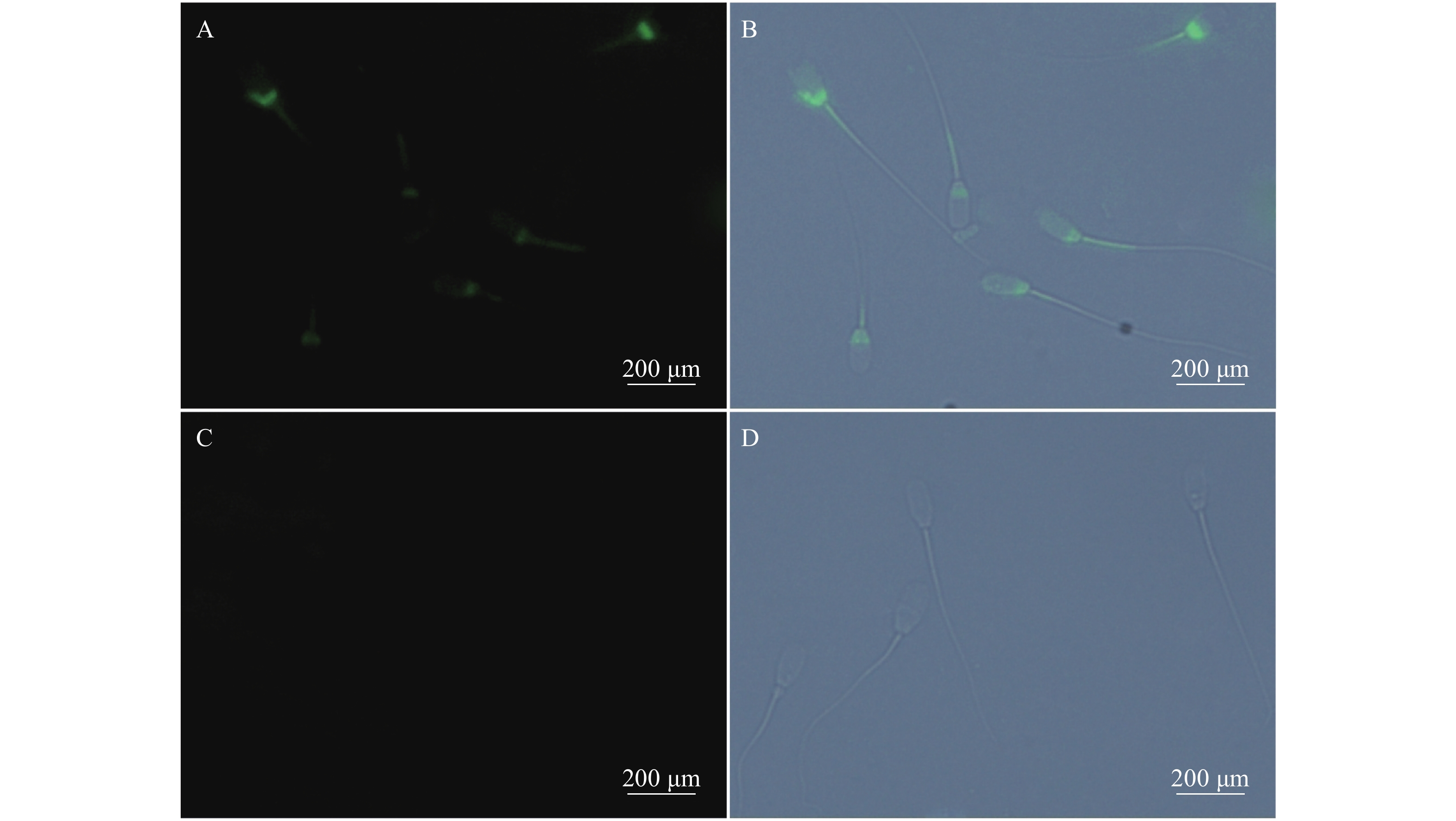
![]() 图 2 免疫荧光染色显示TLR3在猪精子的分布情况注:A:特异性免疫荧光染色后,TLR3阳性表达处呈绿色荧光;B:荧光与明场叠加图;C:阴性对照;D:C与明场叠加图Figure 2. Immunofluorescence of TLR3 in porcine spermNote: A: TLR3 stained by green fluorescence; B: image of green fluorescence on bright background; C: negative controls for TLR3; D: image of C on bright background.
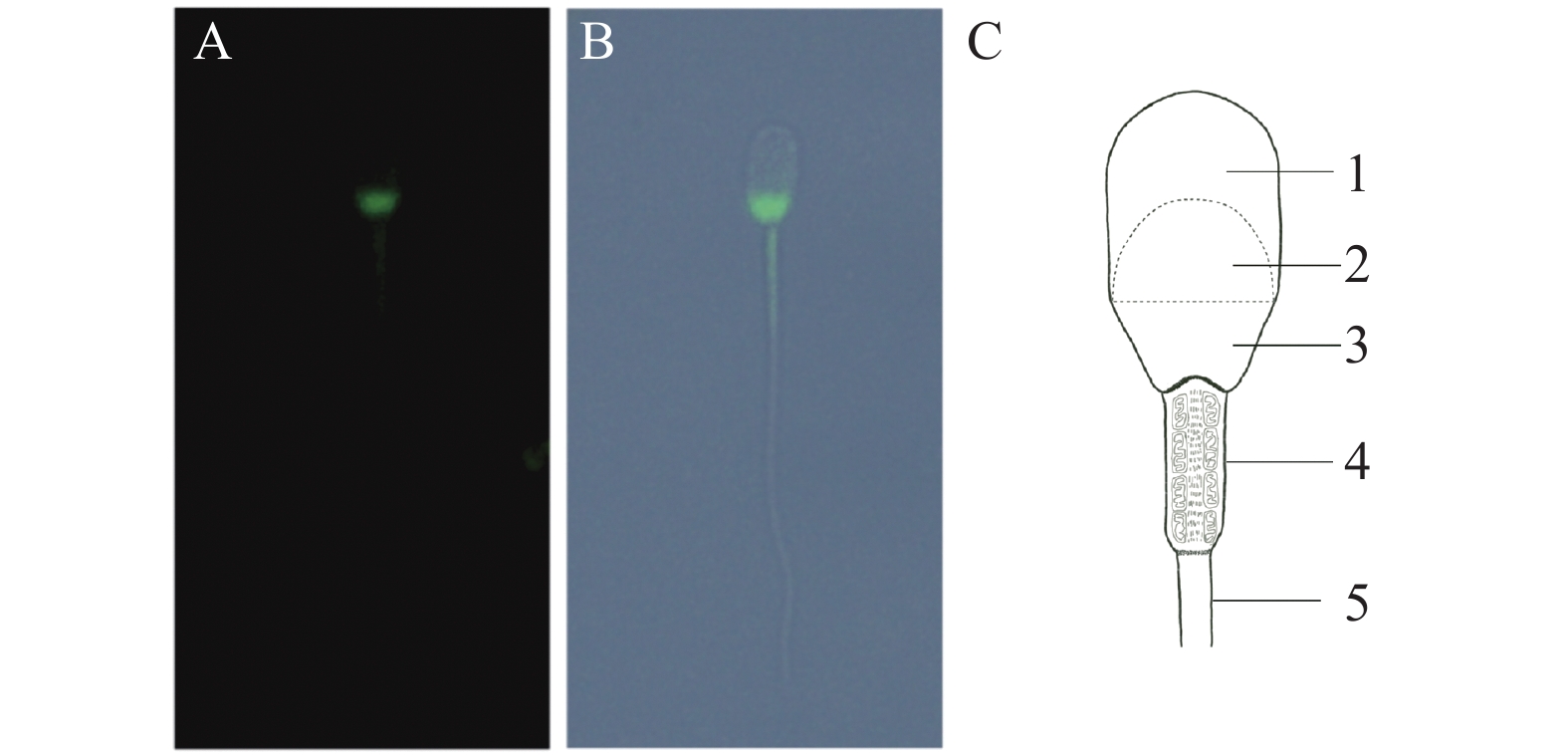
图 2 免疫荧光染色显示TLR3在猪精子的分布情况注:A:特异性免疫荧光染色后,TLR3阳性表达处呈绿色荧光;B:荧光与明场叠加图;C:阴性对照;D:C与明场叠加图Figure 2. Immunofluorescence of TLR3 in porcine spermNote: A: TLR3 stained by green fluorescence; B: image of green fluorescence on bright background; C: negative controls for TLR3; D: image of C on bright background.![]() 图 3 TLR3在猪精子的分布注:A、B:免疫荧光显示TLR3在猪精子头部的后部和中段表达;C:精子结构示意图;1:顶体区;2:赤道区;3:核后帽区;4:中片;5尾部Figure 3. Localization of TLR3 in porcine spermNote: A-B: TLR3 expressed in midpiece and posterior head of sperm; C: schematic diagram of sperm structure; 1: acrosome; 2: equatorial segment; 3: post nuclear cap; 4: midpiece; 5: tail
图 3 TLR3在猪精子的分布注:A、B:免疫荧光显示TLR3在猪精子头部的后部和中段表达;C:精子结构示意图;1:顶体区;2:赤道区;3:核后帽区;4:中片;5尾部Figure 3. Localization of TLR3 in porcine spermNote: A-B: TLR3 expressed in midpiece and posterior head of sperm; C: schematic diagram of sperm structure; 1: acrosome; 2: equatorial segment; 3: post nuclear cap; 4: midpiece; 5: tail3. 讨论
精子从形成到与卵子结合过程中都有可能受微生物入侵[12]。因此有效的感应和抵抗微生物感染对维持动物生殖健康至关重要。猪精液中已检测到多种病原如口蹄疫病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病毒和猪瘟病毒,并可导致公猪精子受精能力下降,甚至种公猪生精障碍[13, 14],提示猪精子可能存在相关受体对病毒感染做出反应。免疫系统和生殖系统可能看似截然不同,实则这两个系统之间存在复杂的联系。在输卵管、颗粒细胞、附睾等非免疫细胞都发现TLR家族成员,其不但具有天然防御的作用,还参与正常的生殖生理,影响精子的发生和成熟[15]。
本研究显示猪精子中表达 TLR3、TLR7、TLR8和TLR9 mRNA。人、鼠和鸡等精子中都发现TLR3、TLR7、TLR8和TLR9 mRNA[9, 10, 16]。一些研究发现哺乳动物精子在雌性生殖道中可发生蛋白质合成[17]。精子中观察到的TLRs mRNA应该在精子核凝结之前产生,这些TLRs mRNA可能也在生殖道中翻译成蛋白并发挥识别病毒感染等功能。动物细胞TLR3、TLR7、TLR8和TLR9信号转导主要通过MyD88和TRIF两个途径介导天然免疫反应,它们通过核转录因子NF-κB、AP-1、IRF3和IRF7的激活,诱导多种细胞因子和IFNs的释放,以发挥抗炎症反应和抗病毒状态效应。除此之外,在精子上,Toshihiro等[9]研究表明小鼠TLR9被未甲基化的 CpG DNA激活后,精子活力和受精能力降低,并影响精子顶体状态,抑制牛血清白蛋白(BSA)诱导的精子获能。Takashi Umehara发现小鼠TLR7/8被配体激活后可选择性地抑制了携带X染色体精子(X-精子)的活力,而不改变Y-精子活力或顶体的形成[18]。在体外应用TLR7/8配体(R848)处理小鼠精子成功分离X精子和Y精子[19]。由此推测,猪精子上表达TLR7/8,也可能作为猪性别选择的工具,有待于进一步验证。
TLRs细胞定位的不同以及自身结构的差异,导致识别的病原PAMPs具有特异性。TLR3、TLR7、TLR8和TLR9位于细胞质内小泡上,如内质网(ER)、内质体、溶酶体和内质体[20]。Megan等[21]研究发现TLR3在肠上皮细胞的不对称分布,使肠上皮细胞免疫反应出现极化现象。不同动物精子TLRs受体的分布存在差异。大鼠精子中TLR1~3、5、7~9分布于整个精子,无特异的分布模式[4]。小鼠精子TLR7和TLR8分别位于精子尾部和中段,TLR9位于顶体区域和中段[9, 18],且都可影响精子活力。本研究中TLR3定位于猪精子的头部后部及中段。头部核后部由单层膜构成的核后帽覆盖,该部位是精子最后与卵母细胞膜融合位点[8]。而中段是精子细胞器的主要分布区域,包含线粒体壳、致密纤维和轴丝,可为精子的代谢和活动提供能量。Zhu等[8]研究显小鼠TLR信号可通过影响线粒体膜电位的方式间接消耗ATP从而影响精子运动。猪精子TLR3分布于头部后部及中段,可能会对精子运动产生调控作用,从而降低微生物感染胎儿的概率。
4. 结论
TLR3、7、8和9 mRNA在猪精子中均有表达;TLR3蛋白主要分布在精子头部的后部和中段,提示猪精子可能对病毒及其衍生物感染做出应答,TLR3激活后可能会对精子运动产生影响。
-
图 2 免疫荧光染色显示TLR3在猪精子的分布情况
注:A:特异性免疫荧光染色后,TLR3阳性表达处呈绿色荧光;B:荧光与明场叠加图;C:阴性对照;D:C与明场叠加图
Figure 2. Immunofluorescence of TLR3 in porcine sperm
Note: A: TLR3 stained by green fluorescence; B: image of green fluorescence on bright background; C: negative controls for TLR3; D: image of C on bright background.
图 3 TLR3在猪精子的分布
注:A、B:免疫荧光显示TLR3在猪精子头部的后部和中段表达;C:精子结构示意图;1:顶体区;2:赤道区;3:核后帽区;4:中片;5尾部
Figure 3. Localization of TLR3 in porcine sperm
Note: A-B: TLR3 expressed in midpiece and posterior head of sperm; C: schematic diagram of sperm structure; 1: acrosome; 2: equatorial segment; 3: post nuclear cap; 4: midpiece; 5: tail
表 1 RT-PCR引物序列
Table 1 RT-PCR primers and conditions
基因名称
Gene基因序列号
Genbank Accession引物序列(5′→3′)
Primer Sequences(5′→3′)扩增长度
Size/bp溶解温度
Annealing/℃Pig TLR3 NM_001097444.1 F: GGCTCTGGAAACACGCAAACC
R: GAGACCATGATATTGAGGTGGAGTA428 62 Pig TLR7 NM_001097434.1 F: CACCAGAAGGCAGCAGATTAA
R: ACTTGCGGTTGACTGAGGTTAT423 58 Pig TLR8 NM_214187.1 F: GGCAAAAGAATGGAGATAGACCC
R: CAGCTCACTGAAAGCAGCGTC347 60 Pig TLR9 NM_213958.1 F: ACTGGAGCAGCCTGACCCT
R: AGCAGCGAGATGCCAAAAC466 62 Pig GAPDH NM_001206359.1 F: CATCACTGCCACCCAGAAGA
R: ATTGTCGTACCAGGAAATGAGC409 60 -
[1] 戴超辉, 冯海悦, 吴圣龙, 等. 猪源Toll样受体家族(TLRs)及其在抗病育种中的应用 [J]. 浙江农业学报, 2018, 30(3):507−520. DOI: 10.3969/j.issn.1004-1524.2018.03.21 DAI C H, FENG H Y, WU S L, et al. Advances in porcine Toll-like receptor family (TLRs) and its application in resistance breeding [J]. Acta Agriculturae Zhejiangensis, 2018, 30(3): 507−520.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2018.03.21
[2] JANEWAY C A, MEDZHITOV R. Innate immune recognition [J]. Annual Review of Immunology, 2002, 20: 197−216. DOI: 10.1146/annurev.immunol.20.083001.084359
[3] REIBER M, MCINROY J, CONNER D. Enumeration and identification of bacteria in chicken semen [J]. Poultry Science, 1995, 74(5): 795−799. DOI: 10.3382/ps.0740795
[4] PALLADINO M A, SAVARESE M A, CHAPMAN J L, et al. Localization of Toll-like receptors on epididymal epithelial cells and spermatozoa [J]. American Journal of Reproductive Immunology, 2008, 60(6): 541−555. DOI: 10.1111/j.1600-0897.2008.00654.x
[5] HEDGER M P. Toll-like receptors and signalling in spermatogenesis and testicular responses to inflammation: A perspective [J]. Journal of Reproductive Immunology, 2011, 88(2): 130−141. DOI: 10.1016/j.jri.2011.01.010
[6] WANG T, ZHANG X Y, CHEN Q Y, et al. Toll-like receptor 3-initiated antiviral responses in mouse male germ cells in vitro [J]. Biology of Reproduction, 2012, 86(4): 106, 1−10.
[7] FUJITA Y, MIHARA T, OKAZAKI T, et al. Toll-like receptors (TLR) 2 and 4 on human sperm recognize bacterial endotoxins and mediate apoptosis [J]. Human Reproduction, 2011, 26(10): 2799−2806. DOI: 10.1093/humrep/der234
[8] ZHU X X, SHI D Y, LI X Q, et al. TLR signalling affects sperm mitochondrial function and motility via phosphatidylinositol 3-kinase and glycogen synthase kinase-3α [J]. Cellular Signalling, 2016, 28(3): 148−156. DOI: 10.1016/j.cellsig.2015.12.002
[9] MIHARA T, FUKUMOTO K, OKAZAKI T, et al. Murine sperm expresses Toll-like receptor (TLR) family that responds to the pathogens released from virus, and decreases fertilization ability by the stimuli [J]. Journal of Mammalian Ova Research, 2010, 27(3): 136−143. DOI: 10.1274/jmor.27.136
[10] SAEIDI S, SHAPOURI F, AMIRCHAGHMAGHI E, et al. Sperm protection in the male reproductive tract by Toll-like receptors [J]. Andrologia, 2014, 46(7): 784−790. DOI: 10.1111/and.12149
[11] MARANTIDIS A, LALIOTIS G P, MICHAILIDIS G, et al. Study of toll-like receptor and B-defensins genes expression pattern in porcine reproductive organs [J]. Animal Biotechnology, 2015, 26(3): 188−193. DOI: 10.1080/10495398.2014.902849
[12] ELEY A, PACEY A A, GALDIERO M, et al. Can Chlamydia trachomatis directly damage your sperm? [J]. The Lancet Infectious Diseases, 2005, 5(1): 53−57. DOI: 10.1016/S1473-3099(04)01254-X
[13] 田克恭. 公猪精液传播的疫病及其控制 [J]. 中国猪业, 2012, 7(8):6−8. TIAN K G. Diseases transmitted by boar semen and its control [J]. China Swine Industry, 2012, 7(8): 6−8.(in Chinese)
[14] GUÉRIN B, POZZI N. Viruses in boar semen: Detection and clinical as well as epidemiological consequences regarding disease transmission by artificial insemination [J]. Theriogenology, 2005, 63(2): 556−572. DOI: 10.1016/j.theriogenology.2004.09.030
[15] GIRLING J E, HEDGER M P. Toll-like receptors in the gonads and reproductive tract: emerging roles in reproductive physiology and pathology [J]. Immunology and Cell Biology, 2007, 85(6): 481−489. DOI: 10.1038/sj.icb.7100086
[16] DAS S, ISOBE N, Yoshimura Y. Expression of toll-like receptors and avian β-defensins and their changes in response to bacterial components in chicken sperm [J]. Poultry Science, 2011, 90(2): 417−425. DOI: 10.3382/ps.2010-00850
[17] GUR Y, BREITBART H. Mammalian sperm translate nuclear-encoded proteins by mitochondrial-type ribosomes [J]. Genes & Development, 2006, 20(4): 411−416.
[18] UMEHARA T, TSUJITA N, Shimada M. Activation of Toll-like receptor 7/8 encoded by the X chromosome alters sperm motility and provides a novel simple technology for sexing sperm [J]. PLoS Biology, 2019, 17(8): e3000398. DOI: 10.1371/journal.pbio.3000398
[19] UMEHARA T, TSUJITA N, ZHU Z D, et al. A simple sperm-sexing method that activates TLR7/8 on X sperm for the efficient production of sexed mouse or cattle embryos [J]. Nature Protocols, 2020, 15(8): 2645−2667. DOI: 10.1038/s41596-020-0348-y
[20] BLASIUS A L, BEUTLER B. Intracellular toll-like receptors [J]. Immunity, 2010, 32(3): 305−315. DOI: 10.1016/j.immuni.2010.03.012
[21] STANIFER M L, MUKENHIRN M, MUENCHAU S, et al. Asymmetric distribution of TLR3 leads to a polarized immune response in human intestinal epithelial cells [J]. Nature Microbiology, 2020, 5(1): 181−191. DOI: 10.1038/s41564-019-0594-3




 下载:
下载: