Expression of α-Cyclodextrin Glycosyltransferase Gene of Gebacillius sp. CHB1 in Bacillus subtilis
-
摘要:目的 构建分泌表达α-环糊精葡萄糖基转移酶(α-CGTase)的重组枯草芽胞杆菌,实现α-CGTase的安全高效表达。方法 通过PCR法扩增嗜热地芽胞杆菌α-CGTase基因,运用EcoR Ⅰ/Xho Ⅰ分别对α-CGTase基因及pBES进行双酶切,然后将该基因片段插入到大肠杆菌-枯草芽胞杆菌穿梭载体pBES中,再电转化法转化枯草芽胞杆菌RIK1285;对重组枯草芽胞杆菌B.subtilis RIK1285/pBE-CGT发酵条件进行探索。结果 (1)利用发酵培养基分泌表达α-CGTase,重组枯草芽胞杆菌工程菌B.subtilis RIK1285/pBE-CGT发酵上清液产酶达到2.9 U·mL-1。(2)TB为最适发酵培养基(配方:甘油0.5%,蛋白胨1.2%,酵母粉2.4%,K2HPO4 1.64%,KH2PO4 0.23%);在初始pH 6.5,温度为37℃下,摇瓶发酵培养24 h后,α-环糊精酶的环化活性达到5.3 U·mL-1,是野生菌株嗜热地芽胞杆菌(0.66 U·mL-1)的8倍。结论 成功构建了枯草芽胞杆菌B.subtilis RIK1285/pBE-CGT工程菌,并确定其最适发酵培养基和培养条件。
-
关键词:
- 枯草杆菌工程菌 /
- α-环糊精葡萄糖基转移酶 /
- 表达 /
- 优化
Abstract:Objective To construct a vector for expressing α-cyclodextrin glycosyltransferase (α-CGTase) gene in Bacillus subtilis.Method The α-CGTase gene from Gebacillius sp. CHB1 was amplified by PCR. The EcoR Ⅰ-digested pBES and Xho Ⅰ-digested α-CGT gene were connected and transformed into B. subtilis RIK1285. Subsequently, fermentation of the recombinant B. subtilis RIK1285/pBE-CGT was optimized.Result (1) The α-CGTase gene was expressed in a fermentation medium to show an enzymatic activity of 2.9 U·mL-1 by B. subtilis RIK1285/pBE-CGT. (2) Medium TB with the formula of 0.5% glycerol, 1.2% peptone, 2.4% yeast extract, 1.64% K2HPO4, and 0.23% KH2PO4 was found to be optimal for the fermentation. After fermentation in TB at 37℃ for 24h, the α-CGTase activity reached 5.3 U·mL-1, which was 8-fold of what the wild Gebacillius sp. CHB1 could generate.Conclusion The engineered B. subtilis RIK1285/pBE-CGT was successfully obtained and the fermentation process optimized. -
0. 引言
【研究意义】环糊精是生物酶催化淀粉等相关基质经环化形成的环状寡聚糖,由6个以上葡萄糖通过α-1,4-糖苷键联结而成,通常由6、7、8个D-吡喃葡萄糖单元构成,称为α-、β-、γ-环糊精。由于环糊精分子具有特殊的外表亲水、内里疏水的中空圆筒结构,能与许多客体分子形成包络物,进而改变客体分子的溶解度、稳定性等物理化学性质,在农药、食品、医药、化妆品和环保等领域具有广泛的应用[1]。环糊精糖基转移酶(cyclodextrin glycosyltransferase, 简称CGTase)是生产环糊精的重要工业用酶,鉴于环糊精的巨大应用价值,生产环糊精所必需的CGTase的制备成为了当今研究的热点。环糊精酶催化产物通常包含α-、β-、γ-环糊精3种环糊精,根据主要产物的不同,将环糊精酶分类为α-、β-、γ-环糊精酶。总结现有的报道,环糊精酶的获取方式大致归纳为3种:从自然界中筛选野生菌株;根据基因文库进行克隆表达;对已知目的基因片段进行蛋白质工程改良。其中野生菌株筛选不仅最为直接有效,而且也是后两种方式的基础[2]。有关CGT酶的研究已经跨越了一个世纪,人们对环糊精酶也逐步提出了更高的要求:更高的产物专一性、更高的热稳定性、更稳定的耐碱性,甚至更强的抗有机试剂性能。【前人研究进展】为了降低环糊精生产成本,提高CGTase的产量和催化特性, 将CGTase基因采用基因工程方法进行异源表达被认为是最有效的途径之一。目前常见的基因表达系统主要有大肠杆菌、芽胞杆菌及酵母表达系统。其中大肠杆菌表达环糊精酶多有报道[3-5],酵母表达系统报道较少[6-7],并且效果不甚理想。而枯草芽胞杆菌表达系统,与其他表达系统相比具有明显的优势:首先,相对于大肠杆菌表达系统:枯草芽胞杆菌为非致病性、细胞壁组成简单、重组表达的蛋白内毒素低、较低密码子偏爱性、表达蛋白可溶性高、生物活性好[8-9]。其次,相对于真核表达系统,其表达周期短,成本低,表达量较高。【本研究切入点】本课题组在前期工作中从Gebacillius sp.CHB1中分离获得了1种α-环糊精酶,该酶最适反应温度达到65℃,有较好的热稳定性,应用潜力巨大,并且该CGT基因在大肠杆菌 E. coli及毕赤酵母中成功克隆表达[10-12]。大肠杆菌表达量虽高,但易形成包涵体,对环糊精酶的分离造成困难,而毕赤酵母表达量较低。【拟解决的关键问题】本研究尝试选用枯草芽胞杆菌分泌表达系统表达嗜热芽胞杆菌CHB1 α-CGTase,以期实现α-CGTase的安全高效表达,并对该工程菌的发酵温度、pH和培养基等进行优化,为环糊精酶工程菌株的规模化生产奠定基础。
1. 材料与方法
1.1 菌种和质粒
嗜热芽孢杆菌Gebacillius sp.CHB1(含新型环糊精酶基因)、大肠杆菌Escherichia coli JM109为福建省农业科学院土壤肥料研究所保存;枯草芽胞杆菌B. subtilis strain RIK1285、大肠杆菌E. coli穿梭载体pBE-S DNA购自大连宝生物工程(TaKaRa)公司。
1.2 试剂与仪器
限制性内切酶、Taq DNA聚合酶、DNA Mark、T4DNA连接酶及B. subtilis strain RIK1285感受态细胞购自TaKaRa公司;DNA切胶回收试剂盒、PCR引物及质粒快速提取试剂盒购自上海生工生物工程股份有限公司,其余试剂均为国产或进口分析纯。3-18K超高速冷冻离心机购自Sigma公司,PCR仪购自基因有限公司,Multiskan FC酶标仪购自美国Thermo公司。
1.3 培养基
LB培养基,Amp终浓度100 μg·mL-1。TSB(胰蛋白胨大豆肉汤培养基):胰蛋白胨1.5%,大豆蛋白胨0.5%,氯化钠0.5%。M9:葡萄糖1%,维生素B1(单独灭菌) 1 μg·mL-1,Na2HPO4 1.28%,KH2PO4 0.3%, NaCl 0.05%,NH4Cl 0.5%。TB:甘油0.5%,蛋白胨1.2%,酵母粉2.4%,K2HPO4 1.64%,KH2PO4 0.23%。
1.4 α-环糊精酶基因引物设计与扩增
提取嗜热芽胞杆菌Gebacillius sp. CHB1基因组DNA, 并以此为模板,在α-环糊精酶基因上下游分别添加限制性酶切位点(Xho Ⅰ和EcoR Ⅰ),设计上下游引物如下:
CGT-F:5′-CCG CTC GAGA ATA AGG TAA ATT TTA CAT CG-3′(下划线为Xho Ⅰ限制性酶切位点);CGT-R:5′-CCG GAA TTC GTT TTG CCA ATT CAC TAT AAT-3′(下划线为EcoR Ⅰ限制性酶切位点);用PCR扩增试剂盒进行α-CGT酶基因扩增。PCR反应条件:94℃ 4 min;94℃ 60 s,58℃ 45 s,72℃ 2 min,循环30次;72℃ 10 min。DNA切胶回收试剂盒进行CGT片段回收,备用。
1.5 重组表达质粒pBE-CGT的构建及鉴定
用限制性内切酶EcoR Ⅰ和Xho Ⅰ分别对pBE载体及CGT片段进行双酶切,胶回收CGT基因片段及pBE线性载体;参照TaKaRa公司T4 DNA连接酶使用说明书,将CGT基因片段与pBES线性载体混合,进行连接反应,连接产物转化感受态细胞JM109,经100 μg·mL-1氨苄青霉素抗性LB平板及菌落PCR鉴定,构建重组枯草芽胞-大肠杆菌穿梭表达质粒pBE-CGT;同时提取相应质粒送至上海生工生物工程有限公司测序验证。
1.6 重组芽胞杆菌的构建及筛选
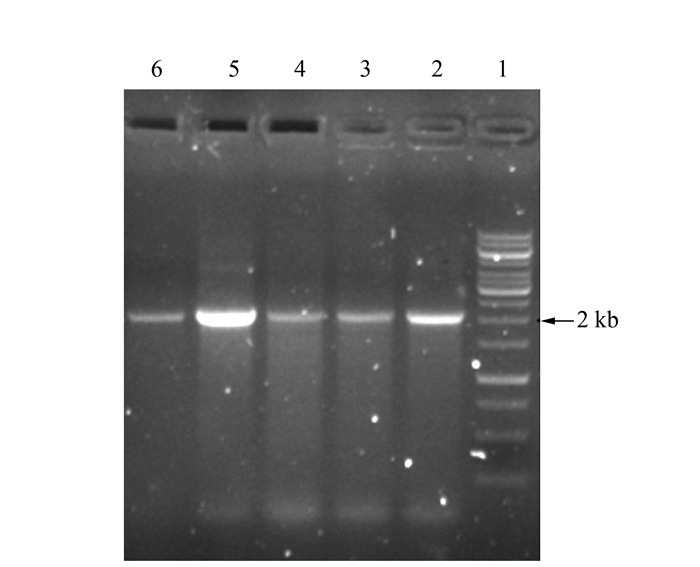
采用电转化方法,冰浴融化感受态细胞枯草芽胞杆菌B. subtilis strain RIK1285,与3 μL重组表达质粒pBE-CGT混匀,设置电转化参数(电击参数1 500 V、25 μF、200 Ω),将pBE-CGT载体导入感受态B. subtilis strain RIK1285中,于100 μg·mL-1氨苄青霉素抗性LB平板培养至转化子出现(24~48 h),挑取若干克隆子进行PCR验证,获得重组枯草芽胞杆菌重组B. subtilis RIK1285/pBE-CGT。
1.7 枯草芽胞杆菌的发酵培养
种子液培养:挑取重组枯草芽胞杆菌B. subtilis单克隆于LB培养基生长18 h;
发酵培养:按1%接种量将种子发酵液接种至50 mL发酵培养基,在37℃摇床培养36 h,每隔一段时间取样,将发酵液于12 000 r·min-1离心2 min除菌体,收集上清液,测定α-环糊精酶活性。
1.8 重组枯草杆菌表达外源蛋白条件优化
1.8.1 培养时间对产酶的影响
为考察重组枯草芽胞杆菌发酵不同阶段α-环糊精酶活性变化,在温度37℃、pH7.0条件下,进行工程菌产酶培养,每隔4 h进行取样测定OD600和环糊精酶活力,发酵持续32 h。
1.8.2 培养温度对产酶的影响
为考察不同温度对重组枯草芽胞杆菌产环糊精酶能力的影响,在pH7.0条件下分别采用25℃、30℃、37℃、40℃培养,24 h后测定OD600和环糊精酶活力。
1.8.3 初始pH对产酶的影响
为考察不同初始pH对重组枯草芽胞杆菌产环糊精酶能力的影响,在温度37℃下,调整初始发酵pH分别为5.5、6.0、6.5、7.0、7.5、8.0,经过发酵24 h后,测定OD600和环糊精酶活力,考察初始pH对环糊精酶表达量的影响。
1.8.4 初始培养基对产酶的影响
为考察不同初始培养基对重组枯草芽胞杆菌重组B. subtilis RIK1285/pBE-CGT产环糊精酶能力的影响,在温度37℃、pH6.5条件下,分别对常用芽胞杆菌培养基(LB,TSB,M9,TB),进行发酵培养24 h,筛选最适培养基。
1.9 CGTase酶活性测定
测定α-环糊精葡萄糖基转移酶活力的方法参照甲基橙褪色法[13],具体操作如下:取0.9 mL预先用50 mmol·L-1磷酸钠缓冲液(pH6.0)配制的3%(w/v)可溶性淀粉溶液于试管中,置于60℃水浴锅内预热2 min,然后加入粗酶液或适当稀释的纯酶液0.1 mL,反应10 min,立即加入1.0 mL 1 mol·L-1的盐酸终止反应,再加入1.0 mL(pH6.0)的0.1 mmol·L-1的甲基橙溶液,混匀后于16℃下保温20 min,用酶标仪测定波长505 nm处的吸光度并根据空白计算褪色程度(ΔA),最后根据α-环糊精标准曲线计算出α-环糊精的浓度。酶活性单位定义为:60℃,pH6.0下,每分钟催化产生1 μmol α-环糊精所需的酶量即为一个酶活力单位(U)。
2. 结果与分析
2.1 CGTase表达质粒的构建
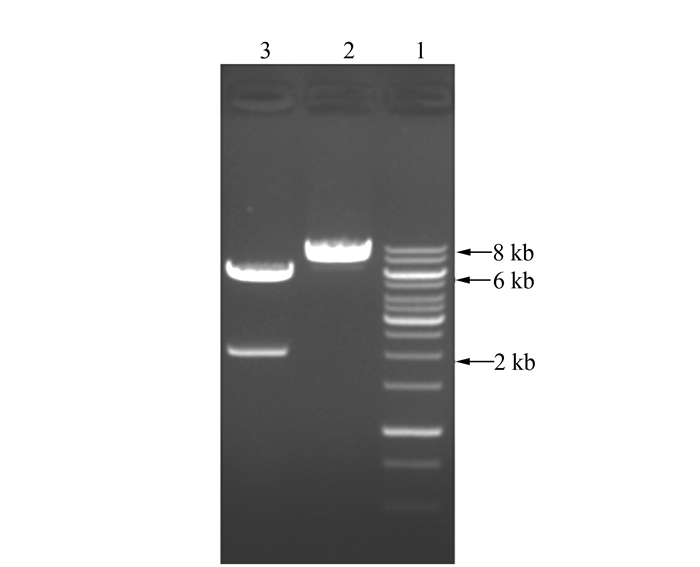
以EcoR Ⅰ和Xho Ⅰ为双酶切体系,分别对载体pBE载体及CGT片段进行双酶切,回收2 000 bp(CGT)及6 000 bp线性载体pBE。转化大肠杆菌JM109,筛选阳性克隆子,提质粒进行单/双酶切验证,电泳结果如图 1所示,在2、6及8 kb附近出现2条预期大小的DNA亮带,说明大肠杆菌/芽胞杆菌穿梭表达质粒pBE-CGT成功构建。进一步通过电转化法将梭表达质粒pBE-CGT导入B. subtilis RIK1285感受态细胞,筛选克隆子菌落进行PCR验证(引物CGT-F/CGT-R)(图 2),在2 kb左右出现预期大小条带;同时将质粒送上海生工进行测序验证,由测序结果可知,环糊精酶重组枯草芽胞杆菌工程菌B. subtilis RIK1285/pBE-CGT构建完成。
2.2 重组枯草芽胞杆菌产环糊精酶
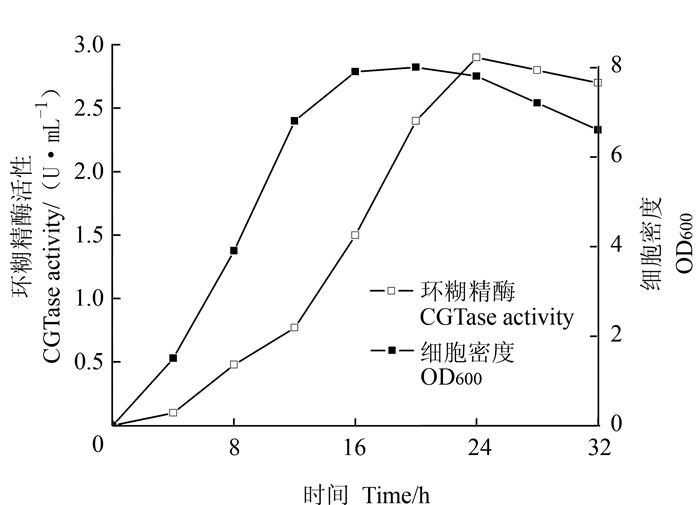
以基础培养基LB为发酵培养基,对工程枯草芽胞杆菌菌B. subtilis RIK1285/pBE-CGT进行产酶培养,每隔4 h测定芽胞杆菌生长情况及产酶量,结果如图 3所示。随着发酵时间延长,细胞密度及酶活力均出现逐步上升的趋势,发酵16 h细胞量趋于稳定,菌体生长进入稳定期,当发酵24 h后,菌体浓度开始下降,此时α-环糊精酶酶活力达到最大值2.9 U·mL-1,之后伴随菌体进入衰亡期,酶活力略微下降。因此,发酵24 h为该工程菌的最适发酵时间。
2.3 重组枯草杆菌发酵环糊精酶条件优化
2.3.1 培养温度对产环糊精酶的影响
温度对微生物生长及生物酶活性具有重要影响;温度的改变,影响着微生物的代谢活动,过低的温度可能使微生物生长停滞,过高的温度可能导致微生物致死,因此本试验考察了4个温度下,工程菌经24 h发酵后的产酶情况,结果如表 1所示。随着温度的升高,菌体逐渐升高,生长旺盛;然而环糊精酶活性随温度的升高,呈先上升后下降的趋势,在37℃下酶活性达到最大值,为最适表达温度。分析原因,可能由于温度过低,菌体生长缓慢酶表达量低;随温度升高,菌体产酶速度加快,过高导致酶活降低,可能高温产生更多的蛋白酶对环糊精酶产生降解。
表 1 不同温度对菌体生长和产酶的影响Table 1. Effects of temperature on growth and enzyme production of bacteria温度
Temperature/℃细胞密度
OD600环糊精酶活性
CGTase activity/(U·mL-1)25 6.9 1.6±0.11a 30 7.3 2.1±0.16b 37 8.3 2.9±0.14c 40 9.5 1.9±0.15b 注:同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。表 2~3同。
Note:Values are the means±SD(n=3).Means with different letters within the same column are signi cantly different (P<0.05).The same as Table 2-3.表 2 不同pH对菌体生长和产酶的影响Table 2. Effects of pH on growth and enzyme production of bacteria酸碱度
pH细胞密度
OD600环糊精酶活性
CGTase activity/(U·mL-1)5.5 7.3 1.9±0.13a 6.0 7.9 2.7±0.17b 6.5 8.1 3.3±0.19c 7.0 8.3 3.0±0.15c 7.5 8.4 2.7±0.15b 8.0 8.1 2.1±0.12a 表 3 不同培养基对产环糊精酶的影响Table 3. Effects of culture medium on growth and enzyme production of bacteria初始培养基
Initial medium细胞密度
OD600环糊精酶活性
CGTase activity/(U·mL-1)LB 8.3 2.9±0.17a TSB 9.2 3.5±0.16b M9 10.5 4.1±0.13c TB 12.3 5.3±0.21d 2.3.2 pH对产环糊精酶的影响
pH是影响微生物生长及工程菌发酵过程中各种酶活性的一个重要因素,因此,本研究分析了不同pH下,工程菌经24 h发酵后的产酶情况,结果如表 2所示。当控制初始pH在6.0-8.0时菌体生长旺盛,pH7.5时菌体量最高;而在pH 6.5时酶活力达到最高,说明中性偏碱性有利于菌体生长,而中性偏酸性环境有利于外源环糊精酶基因的表达。因此,虽然初始pH在7.5时更有利于菌体生长,但工程菌最适表达pH为6.5。
2.3.3 不同培养基对产环糊精酶的影响
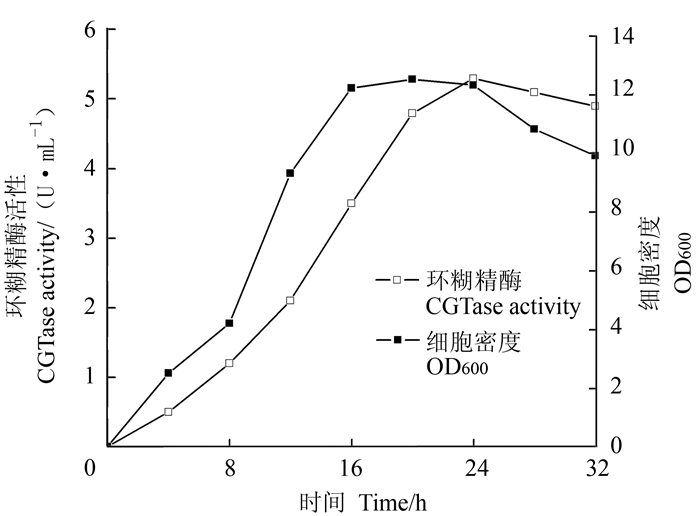
为了选择适合工程菌表达α-CGT酶并可用于下步优化的出发培养基, 将工程菌置于4种常见的枯草芽胞杆菌培养基中培养24 h,测定细胞密度及相应环糊精酶活力(表 3)。由表 3可知,经TB培养基发酵后,工程菌的细胞密度及环糊精酶活力均最高,明显高于其他3种培养基,究其原因:相对LB、TSB培养基而言,TB培养基有相对较高的pH缓冲能力,稳定的pH环境更有利于菌体生长,表达更多蛋白。相对M9而言,TB含丰富的营养成分(蛋白胨、甘油等)更适合菌体生长,因此有更多的菌体生产重组环糊精酶,更有利于α-CGT酶的表达。因此最终确定TB为最优发酵培养基。在pH6.5、37℃下,进行工程菌B. subtilis RIK1285/pBE-CGT产α-环糊精酶培养,其菌体生长及产酶曲线如图 4所示,在发酵24 h胞外酶活达到最高,为5.3 U·mL-1,细胞密度达到(OD600)12.3。
3. 讨论与结论
环糊精分子因其特殊的环状中空结构,具有的很强包络能力,应用广泛。随着人类生活品质的提高,对环糊精的需求量日益增长。环糊精的工业化生产主要是有环糊精酶催化合成。因此环糊精酶的产量及活性对环糊精的生产至关重要。随着现代分子生物学的飞速发展,运用基因工程手段,实现CGTase基因的异源超量表达,成为国内外研究的热点。本课题组前期已经实现了环糊精酶在大肠杆菌与酵母中的表达,取得一定进展。
为进一步提高环糊精酶表达量,探索环糊精酶最适表达系统,本研究选择枯草芽胞杆菌表达系统,成功构建了枯草芽胞杆菌B. subtilis RIK1285/pBE-CGT工程菌,并对工程菌发酵培养基种类及基础发酵条件进行了初步探索,最终确定TB为该工程菌的最适发酵培养基,在初始pH 6.5、37℃下,持续发酵24 h后,细胞密度达到12.3(OD600),此时测得发酵上清液α-环糊精酶环化活力同时达到最大值5.3 U·mL-1,是野生菌Gebacillius sp.CHB1产α-环糊精酶(0.66 U·mL-1)的8倍[14]。目前有关α-环糊精酶的异源表达,主要集中在大肠杆菌表达系统,而枯草芽胞杆菌表达系统鲜见报道,张佳瑜等[7]研究来源于软化芽孢杆菌的α-环糊精葡萄糖基转移酶在枯草杆菌中的表达,表达量是野生菌株软化芽孢杆菌表达量的9.8倍,α-环糊精酶活力为4.9 U·mL-1。本研究结果虽最终提高倍数略低于前者,但最终酶活力更高。另外,虽然本研究枯草芽胞杆菌α-环糊精酶表达量低于其在大肠杆菌中的表达量,但相对大肠杆菌表达系统而言,枯草芽胞杆菌遗传背景清晰,属于公认的食品工业安全菌,不含内毒素,具有良好的遗传稳定性,且分离纯化工艺简单,是环糊精酶乃至其他酶蛋白高效表达、最终实现规模化生产的重要途径。后期深入研究,将考虑通过信号肽、表达载体等的优化以及对酶分子的氨基酸序列进行定点突变,最大限度提高环糊精酶在枯草芽胞杆菌中的表达量,为其规模化生产提供技术支持。
-
表 1 不同温度对菌体生长和产酶的影响
Table 1 Effects of temperature on growth and enzyme production of bacteria
温度
Temperature/℃细胞密度
OD600环糊精酶活性
CGTase activity/(U·mL-1)25 6.9 1.6±0.11a 30 7.3 2.1±0.16b 37 8.3 2.9±0.14c 40 9.5 1.9±0.15b 注:同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。表 2~3同。
Note:Values are the means±SD(n=3).Means with different letters within the same column are signi cantly different (P<0.05).The same as Table 2-3.表 2 不同pH对菌体生长和产酶的影响
Table 2 Effects of pH on growth and enzyme production of bacteria
酸碱度
pH细胞密度
OD600环糊精酶活性
CGTase activity/(U·mL-1)5.5 7.3 1.9±0.13a 6.0 7.9 2.7±0.17b 6.5 8.1 3.3±0.19c 7.0 8.3 3.0±0.15c 7.5 8.4 2.7±0.15b 8.0 8.1 2.1±0.12a 表 3 不同培养基对产环糊精酶的影响
Table 3 Effects of culture medium on growth and enzyme production of bacteria
初始培养基
Initial medium细胞密度
OD600环糊精酶活性
CGTase activity/(U·mL-1)LB 8.3 2.9±0.17a TSB 9.2 3.5±0.16b M9 10.5 4.1±0.13c TB 12.3 5.3±0.21d -
[1] CHEN J, WU J, LI Z F, et al. Gamma-cyclodextrin:a review on enzymatic production and applications[J]. Appl Microbiol Biotechnol, 2007, 77(2):245-255. DOI: 10.1007/s00253-007-1166-7
[2] 金征宇, 柏玉香, 王金鹏.环糊精葡萄糖基转移酶的筛选及其定向改造[J].食品与生物技术学报, 2012, 31(2):113-123. DOI: 10.3969/j.issn.1673-1689.2012.02.001 JIN Z Y, BAI Y X, WANG J P. Screen and Modification of Cyclodextrin Glycosyltransferase[J].Journal of Food Science and Biotechnology, 2012, 31(2):113-123. (in Chinese) DOI: 10.3969/j.issn.1673-1689.2012.02.001
[3] JARUNEE K, WANIDA P, VICHIEN R, et al. Expression and characterization of a fusion protein-containing cyclodextrin glycosyltransferase from Paenibacillus sp. A11[J]. Journal of Basic Microbiology, 2010, 50(5):427-435 http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=302988a94cb9b9a3185b21ebe80ea8d2
[4] PENKA P, ALEXANDRA T, KALOYAN P. Sequence analysis, cloning and extracellular expression of cyclodextrin glucanotransferase gene from the alkaliphilic Bacillus pseudalcaliphilus 8SB in Escherichia coli[J]. Process Biochemistry, 2012, 47(12):2139-2145. DOI: 10.1016/j.procbio.2012.08.001
[5] LIU H, LI J H, DU G C, et al. Enhanced production of α-cyclodextrin glycosyltransferase in Escherichia coli by systematic codon usage optimization[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(12):1841-1849. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=22b60651c0202af0ce77cb4e46a682a2
[6] NAM S W, PARK H Y, KIM J H, et al. Expression of Bacillus macerans cyclodextrin glucanotransferase gene in Sacchoromyces cerevisiae[J]. Biotechnol Lett, 2001, 23(9):727-730. DOI: 10.1023/A:1010303019603
[7] 张佳瑜, 吴丹, 李兆丰, 等.来源于软化芽孢杆菌的环糊精葡萄糖基转移酶在毕赤酵母和枯草杆菌中的表达[J].生物工程学报, 2009, 25(12):1948-1954. DOI: 10.3321/j.issn:1000-3061.2009.12.026 ZHANG J Y, WU D, LI Z F, et al. Expression of Paenibacillus macerans cyclodextrin glycosyltransferase in Pichia pastoris and Bacillus subtilis[J]. Chinese Journal of Biotechnology, 2009, 25(12):1948-1954. (in Chinese) DOI: 10.3321/j.issn:1000-3061.2009.12.026
[8] WONG S L. Advances in the use of Bacillus subtilis for the expression and secretion of heterologous proteins[J]. Curr Opin Biotechnol, 1995, 6(5):517-522. DOI: 10.1016/0958-1669(95)80085-9
[9] LIDIA W, HELGA W, WIM J Q. Bacillus subtilis as cell factory for pharmaceutical proteins:a biotechnological approach to optimize the host organism[J]. Biochim Biophys Acta, 2004, 1694(1-3):299-310. DOI: 10.1016/j.bbamcr.2004.02.011
[10] 陈龙军, 陈济琛, 林晓栩, 等.嗜热芽孢杆菌CHB1环糊精酶基因优化及其在毕赤酵母中的表达[J].食品与生物技术学报, 2018, 37(9):994-999. DOI: 10.3969/j.issn.1673-1689.2018.09.014 CHEN L J, CHEN J C, LIN X X, et al. Codon Optimization And Expression Of Cyclodextrin Glycosyltransferase From Gebacillius sp.CHB1 In Pichia pastoris.[J]. Journal of Food Science and Biotechnology, 2018, 37(9):994-999. (in Chinese) DOI: 10.3969/j.issn.1673-1689.2018.09.014
[11] 陈龙军, 陈济琛, 林新坚, 等.环糊精酶基因在毕赤酵母中的组成型表达[J].福建农业学报, 2017, 32(1):82-86. DOI: 10.19303/j.issn.1008-0384.2017.01.017 CHEN L J, CHEN J C, LIN X J, et al. Constitutive Expression of Cyclodextrin Glycosyltransferase in Pichia pastoris[J].Fujian Journal of Agricultural Sciences, 2017, 32(1):82-86. (in Chinese) DOI: 10.19303/j.issn.1008-0384.2017.01.017
[12] 蔡海松, 林晓栩, 郭永华, 等.信号肽及化学通透剂对环糊精葡萄糖基转移酶胞外分泌的影响[J].微生物学通报, 2017(3):601-610. http://d.old.wanfangdata.com.cn/Periodical/wswxtb201703011 CAI H S, LIN X X, GUO Y H, et al. Effects of different signal peptides and chemical penetrators on extracellular production of recombinant cyclodextrin glycosyltransferase[J]. Microbiology China, 2017(3):601-610. (in Chinese) http://d.old.wanfangdata.com.cn/Periodical/wswxtb201703011
[13] LEJEUNE A, SAKAPUCHI K, IMANAKA T. A Spectrophotometric Assay for the Cyclization Activity of Cyclomaltohexaose (α-Cyclodextrin) Glucanotransferase[J]. Analytical Biochemistry, 1989, 181:6-11. DOI: 10.1016/0003-2697(89)90385-0
[14] 叶学军.地芽孢杆菌CHB1产CGTase的分离纯化及基因的克隆表达[D].福州: 福州大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10386-1015349318.htm YE X J. Purification And Expression Of Cyclodextrin Glycosyltransferase From Gebacillius sp.CHB1[D]. Fuzhou: Fuzhou University, 2014. (in Chinese)[1] CHEN J, WU J, LI Z F, et al. Gamma-cyclodextrin: a review on enzymatic production and applications[J]. Appl Microbiol Biotechnol, 2007, 77(2): 245-255. http://cdmd.cnki.com.cn/Article/CDMD-10386-1015349318.htm
-
期刊类型引用(5)
1. 陶大炜,张颖琦,赵赛赛. 产环糊精葡萄糖基转移酶的菌株选育及酶分子改造研究进展. 食品与发酵工业. 2024(15): 359-371 .  百度学术
百度学术
2. 张悦,许庭娇,李雪妮,田长城. β-环糊精葡萄糖基转移酶的固定化及其酶学性质. 广州化工. 2023(05): 39-42 .  百度学术
百度学术
3. 陶志杰,杨静文,王清晨,吴元元,胡雪芹,张洪斌. γ-环糊精葡萄糖基转移酶的酶学性质及其产物特异性. 食品与发酵工业. 2022(13): 25-32 .  百度学术
百度学术
4. 陶大炜,宁喜斌. 产α-环糊精葡萄糖基转移酶的菌株筛选、鉴定与酶学性质的初步研究. 食品与发酵工业. 2021(06): 145-151 .  百度学术
百度学术
5. 陶大炜,张小丹,宁喜斌,孙梦洁. 复合诱变选育高产α-环糊精葡萄糖基转移酶的菌株及产酶条件优化. 食品与发酵工业. 2021(19): 63-70 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: