Evaluation of Soil Solarization for Controlling Root-knot Nematodes on Tropical Peppers in Open-fields
-
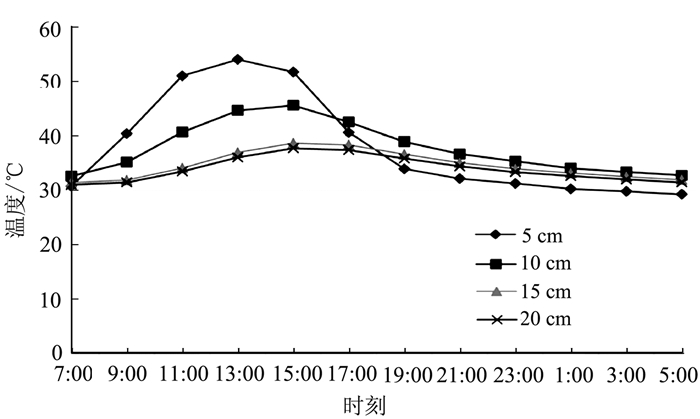
摘要: 辣椒根结线虫病在海南全省普遍发生,本研究通过对土壤覆盖透明塑料地膜,探讨阳光消毒对海南冬季露地辣椒根结线虫病的防治效果。结果表明,覆膜期间5、10、15、20 cm土层最高温分别可达73、57.8、45.1、43.9℃。覆膜处理30~60 d,土壤中根结线虫二龄幼虫数量减少54.8%~57.5%,辣椒移栽2个月后的防治效果可达65.9%~70.3%,移栽5个月后仍具有55.9%~59.1%的防治效果。不同覆膜时间处理间防治效果无显著性差异。海南拥有丰富的阳光资源,采用覆盖透明塑料地膜的方法对根结线虫具有良好的防治效果,可减少化学杀线剂的使用量,提高经济效益。Abstract: Chili peppers cultivated in open-fields in Hainan province are commonly infested by root-knot nematodes (RKN). This study focused on the effect of disinfection by using solar energy to control the pepper RKN disease. Transparent plastic mulch film was used to cover the soil for evaluation. The highest temperatures of the solarized soil layers at 5 cm, 10 cm, 15 cm and 20 cm were found to be 73℃, 57.8℃, 45.1℃ and 43.9℃, respectively. After 30-60d mulching, the population of the second-stage RKN juveniles was reduced by 54.8%-57.5%. Two months after the plants were transplanted, the control efficacy was 65.9%-70.3% and remained at 55.9%-59.1% level 5 months after the transplantation. Duration of mulching did not show any significant difference on the efficacy. The abundant sunshine in Hainan would render the solarization a method feasible and cost effective for controlling RKN while minimizing the dependency on chemical nematicides.
-
Keywords:
- chili pepper /
- solarization /
- transparent film /
- root-knot nematode /
- dazomet
-
在分析功能基因的表达水平时,为了消除不同样品在RNA的提取质量和得率及在RNA反转录成cDNA的效率上存在的差异,通常选用适当的内参基因进行校正,以确定目的基因的相对表达量。理想的内参基因要求表达量适中,表达水平稳定,不受内源性(如生长周期或不同器官)或外界条件(如实验措施或环境因素)的影响。
植物肌动蛋白(Actin)是一类古老的、由单一多肽构成的球状蛋白质[1],构成细胞的微丝系统,参与细胞分裂和形态控制、信号传导、细胞器运动等细胞生理活动[2-3];3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehyrogenase, GAPDH)是糖酵解过程中的关键酶,氧化3-磷酸甘油醛形成1, 3-二磷酸甘油酸[4],与生命活动紧密相关;微管蛋白(tubulin)不仅是细胞骨架的组成部分,而且与胞内物质运输、信号识别、细胞运动等关系密切,主要由α、β两种微管蛋白以二聚体的形式聚合而成[5]。Actin、GAPDH和tubulin表达相对稳定,常作为内参基因用于基因表达分析[6-9]。但是,已有研究发现,持家基因的表达水平也存在不稳定性[10-11],应根据不同试验目的筛选合适的内参基因。
金线莲Anoectochilusroxburghii (Wall.) Lindl是兰科Orchidaceae开唇兰属Anoectochilus植物,又称金线兰、金草,具有保肝、降血糖、抗肿瘤、提高免疫力等作用[12-13],主要分布在我国的亚热带地区,福建和台湾是主产地[14],因野生资源匮乏,主要靠种植组培苗满足市场的需求。金线莲富含黄酮、生物碱、皂苷、甾体化合物、三萜类等活性成分[15-17],而组培苗的种植时间会影响金线莲活性成分含量[18]。姜福星等[19]对台湾金线莲进行转录组测序,分析发现与黄酮类、生物碱和萜类物质代谢相关的Unigenes分别有130、114和441条,而有关金线莲活性成分合成功能基因的研究还处于起步阶段。研究金线莲药用成分合成调控关键酶基因的功能,分析关键酶基因表达模式,必须选择理想的内参基因,而目前有关金线莲内参基因的研究还鲜有报道。本研究从金线莲转录组测序数据中选择GAPDH、Actin和α-tubulin等3个Unigenes,根据序列信息设计引物,应用半定量RT-PCR技术分析不同生长期和不同温度处理条件下3个基因在金线莲茎、叶的表达水平,以期为金线莲药用活性成分合成关键酶基因的研究选择合适的内参基因。
1. 材料与方法
1.1 试验材料
金线莲(采自福建省龙岩市梅花山)生根瓶苗为本课题组培养。pMD19-T连接试剂盒、Ex Taq DNA Polymerase、PrimeScriptTM Reverse Transcriptase、RNAiso Plus购自宝生物公司。UNIQ-10柱式DNA胶回收试剂盒购自上海生工生物工程有限公司,引物合成、克隆测序委托上海生工。
1.2 金线莲温度处理
将光照培养箱的温度设置为5℃(T5)、15℃(T15)、25℃(T25)、35℃(T35),光照强度4 000 lx,待温度稳定后放入可以移栽的组培生根瓶苗,培养10 d,随机剪取15株金线莲的茎、叶,用铝箔分开包装,液氮速冻后置超低温冰箱保存。
1.3 金线莲不同生长阶段处理
2017年11月3日种植,将金线莲组培生根苗从瓶子取出,洗净根部的培养基后种植于育苗盘,每盘30株,光照强度在3 000~5 000 lx,栽培基质为泥炭土,栽培过程根据基质的干湿情况及时补水。2017年12月至2018年5月,每月取样1次(分别用P1~P6表示),随机剪取15株金线莲的茎、叶,用铝箔分开包装,液氮速冻后置超低温冰箱保存。
1.4 总RNA的提取和cDNA合成
利用RNAiso Plus提取金线莲茎、叶总RNA,经电泳检测后,用超微量紫外可见光分光光度计(ND-1000)测定RNA纯度并定量为500 ng·μL-1。
cDNA合成:在200 μL PCR管中顺序加入DEPC水3 μL,总RNA 2 μL,随机引物(50 μmol·L-1)1 μL,dNTP Mixture(各2.5 mmol·L-1)4 μL,65℃保温5 min后,迅速在冰上急冷5 min,离心数秒后加入预先混合好的5×PrimeScriptTM Buffer 4 μL,RNase inhibitor (40 U·μL-1)0.5 μL,PrimeScriptTM Reverse 0.5 μL,DEPC水5 μL,混匀后放入PCR仪,PCR仪反应程序为:30℃ 10 min,42℃ 60 min,70℃ 15 min,4℃结束反应。反应结束后利用超微量紫外可见光分光光度计(ND-1000)测定吸光值并定量为200 ng·μL-1。
1.5 引物设计及扩增特异性分析
根据金线莲转录组测序数据中的Actin、GAPDH和α-tubulin等3个Unigenes序列信息,利用primer 5.0软件设计扩增引物(表 1)。以茎、叶混合的cDNA为模板PCR扩增,验证引物特异性。扩增体系20 μL:模板1 μL,引物(10 μmol·L-1)各1 μL,10×Buffer 2 μL,Ex Taq DNA聚合酶(5 U·μL-1) 0.1 μL,dNTP Mixture(各2.5 mmol·L-1) 1.6 μL,ddH2O 13.3 μL。反应程序为:94℃预变性5 min,94℃变性30 s,退火(Actin 50℃、GAPDH 55℃、α-tubulin 55℃)30 s,72℃延伸20 s,30个循环,最后72℃延伸10 min。胶回收目的片段,与克隆载体pMD19-T连接后转化大肠杆菌DH5α感受态细胞,经验证后送上海生工测序。
表 1 PCR引物及其序列Table 1. PCR primers and sequences靶基因 引物名称 引物序列(5′-3′) 产物长度/bp Actin ArACT-F AGATGAGGCACAGTCCAAGA 228 ArACT-R GCTGGAACATTGAAGGTCTC GAPDH ArGAPDH-F CCCTTTGGACCTGTGCTACC 162 ArGAPDH-R GATTTGAACTGTGCCCGTCTC α-tubulin ArATUB-F GCTGTTGGAGGTGGGACTG 162 ArATUB-R AGAGTGTGTGGACAGGACGC 1.6 循环参数优化与表达分析
以不同处理样品总RNA反转录获得的cDNA为模板进行PCR,优化循环参数。扩增体系40 μL:模板2 μL,引物(10 μmol·L-1)各2 μL,10×Buffer 4 μL,Ex Taq DNA聚合酶(5 U·μL-1) 0.2 μL,dNTP Mixture(各2.5 mmol·L-1) 3.2 μL,ddH2O 26.6 μL。反应程序为:94℃预变性5 min,94℃变性30 s,退火30 s,72℃延伸20 s,20个循环开始取样5 μL,3个循环取样1次,取样5次,确定循环数。以优化的循环再进行PCR,重复3次,分析3个基因的表达。
2. 结果与分析
2.1 引物扩增特异性分析
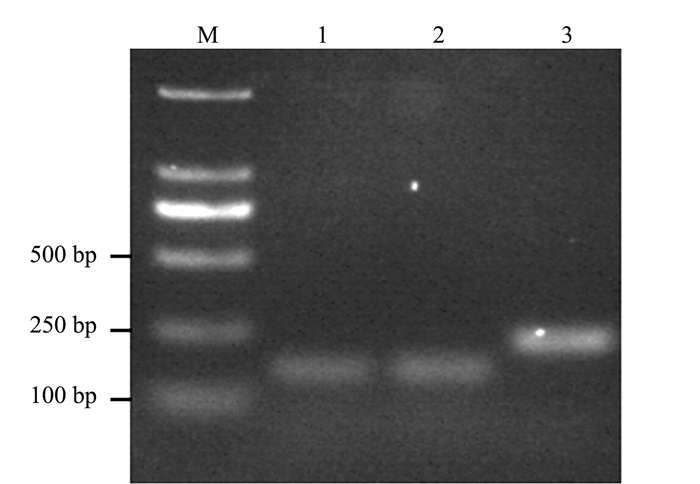
为了验证设计引物扩增的特异性,以合成的引物ArACT-F和ArACT-R、ArGAPDH-F和ArGAPDH-R、ArATUB-F和ArATUB-R进行PCR扩增,从图 1可以看出,3对引物均能扩增特异性条带,无非特异性扩增,目的条带的测序结果经DNAMAN V6.0比对后确认均是目的片段,可作进一步分析。
2.2 Actin在不同处理温度和不同生长期的表达分析
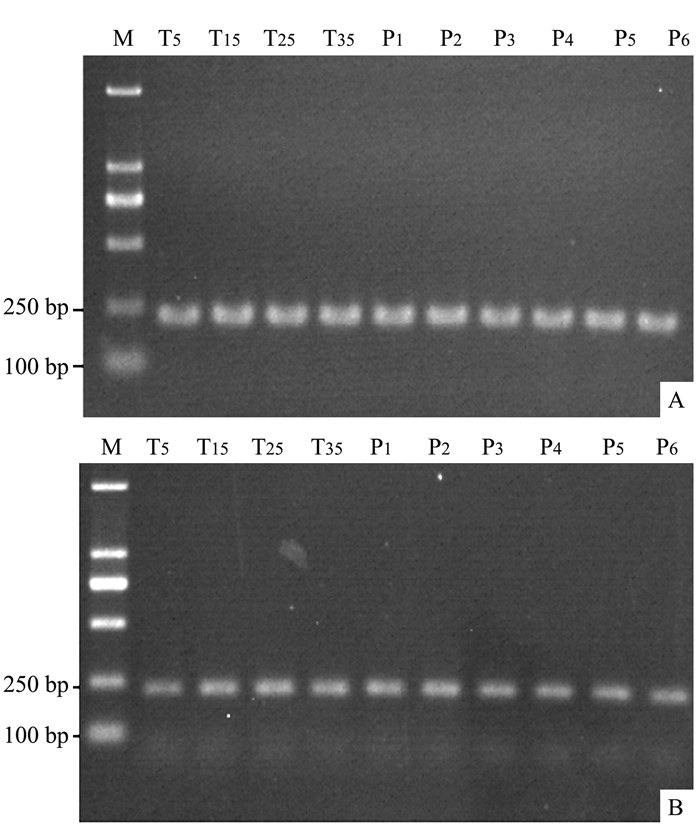
以不同处理温度和不同生长期的金线莲茎、叶提取的总RNA反转录的cDNA为模板,优化PCR扩增循环参数,确定Actin扩增循环数为26。以优化的循环数进行PCR扩增,分析Actin在金线莲茎、叶中的表达情况。从图 2可以看出,不同温度处理和不同生长期,Actin在茎、叶中的表达量基本一致,表达稳定,可作为温度处理和生长期金线莲功能基因表达分析的内参基因。
2.3 GAPDH在不同处理温度和不同生长期的表达分析
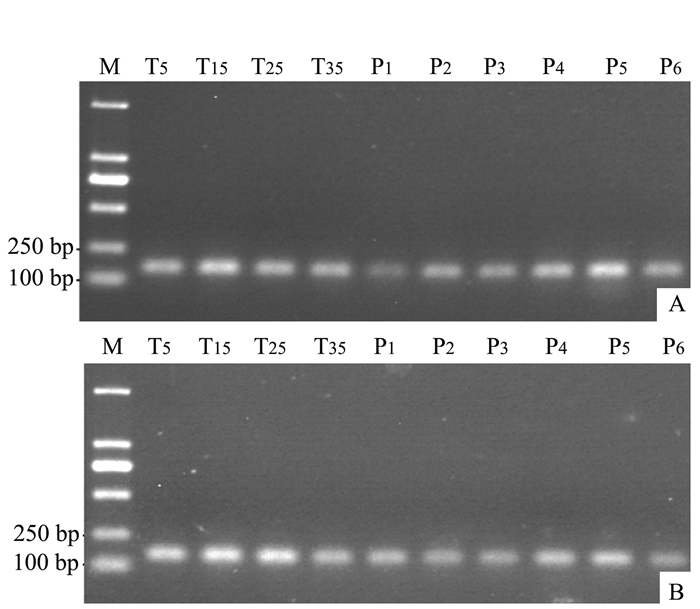
以各种处理金线莲茎、叶提取的总RNA反转录的cDNA为模板,经过PCR扩增循环参数优化,确定GAPDH扩增循环数为27。以优化的循环数进行PCR扩增,分析GAPDH在金线莲茎、叶中的表达情况。从图 3可以看出,不同温度处理GAPDH表达存在明显差异,随着温度的降低,GAPDH在茎、叶中的表达量越来越高,5℃的表达量最高,说明低温能上调GAPDH的表达。不同生长期GAPDH的表达量也存在差异,随着种植时间的延长,GAPDH在茎、叶中的表达量越来越高,种植4~5个月表达量最高,种植6个月的表达量下降。
2.4 α-tubulin在不同处理温度和不同生长期的表达分析
以金线莲茎、叶各种样品提取的总RNA反转录的cDNA为模板,经优化α-tubulin扩增循环数确定为28。以优化的循环数进行PCR扩增,分析α-tubulin基因在金线莲茎、叶中的表达情况。从图 4可以看出,金线莲茎15℃处理的表达量较高,其他3个温度基本一致,叶中15℃和25℃表达量比5℃和35℃稍高。随着种植时间的延长,α-tubulin在茎、叶中的表达也越来越高,种植5个月的表达量均最高,种植6个月的表达量下降。
3. 讨论
持家基因不仅参与细胞的代谢过程,还具有其他的生理功能,不同样品、不同试验因素的内参基因不同,要根据试验目的不同,分析选择适宜的持家基因做内参,提高研究的可能性和准确性。
梁云等[20]克隆发现百合lilyActin在花蕾、叶片和鳞片中表达稳定。黄连香等[21]克隆发现三叶青肌动蛋白基因ThAct1和ThAct2在茎、普通根和块根中都稳定表达,但ThAct1比ThAct2表达量高;叶与茎、根的表达量存在差异,且叶中ThAct2的表达量稍高,而ThAct1表达量较低。亓希武等[22]克隆了金银花LjActin在幼蕾期、绿蕾期、白蕾期、银花期和金花期等5个发育阶段的花中稳定表达。敖特根白音等[23]克隆了蒙古冰草MwACT2,在高盐、干旱、低温等逆境胁迫下表达稳定。本研究中金线莲肌动蛋白基因在不同温度处理和不同生长期均能稳定表达,是研究金线莲在温度胁迫或不同生长期基因表达分析的理想内参基因。
已有研究发现植物GAPDH表达并不稳定,可被高温、低温和盐胁迫等诱导。如卜娇迪等[24]克隆了金丝小枣的ZjGAPDH,定量分析发现该基因在果实不同发育阶段表达量存在差异,全红期表达量最高,半红期最低。张霞等[25]研究发现盐穗木GAPDH受盐胁迫和ABA上调表达,盐胁迫6 h、ABA处理12 h时达到最高值。本研究也发现低温上调金线莲GAPDH的表达,不同生长期GAPDH在茎、叶中的表达量也不一致,不适宜在分析温度处理和生育期金线莲功能基因表达时作为内参基因。
Jian等[26]分析了大豆不同发育时期10个内参基因,发现α-tubulin表达稳定性最好。然而,本研究中发现金线莲α-tubulin在不同的温度和生长期的表达并不稳定,不适宜在分析温度处理和生育期金线莲功能基因表达时作为内参基因。
本研究选择金线莲的GAPDH、Actin和α-tubulin等3个持家基因,应用半定量RT-PCR技术分析了不同生长期和不同温度处理条件下3个基因在茎、叶的表达水平,没有进行准确的表达定量分析,其他环境条件下金线莲持家基因的表达稳定性也有待进一步研究。
-
表 1 覆膜处理前后土壤中线虫的数量
Table 1 RKN population before and after film mulching under the sun
表 2 不同处理对辣椒株高的影响
Table 2 Height of pepper plants under different treatments
处理 株高/cm 株高增长率/% 覆膜30 d 40.4±2.7 -0.7 a 覆膜50 d 39.2±1.3 -0.4 a 覆膜60 d 41.2±2.2 1.2 a 棉隆 39.5±1.9 -0.3 a 未覆膜CK 40.7±2.0 - 表 3 不同处理对辣椒根结线虫的防治效果
Table 3 Efficacy of treatments on controlling pepper RKN disease
处理 辣椒移栽2个月/% 辣椒移栽5个月/% 病情指数 防治效果 病情指数 防治效果 覆膜30 d 14.8 65.9b 39.0 55.9b 覆膜40 d 14.3 67.0b 37.6 57.5b 覆膜50 d 15.2 64.8b 36.7 58.6b 覆膜60 d 12.9 70.3ab 36.2 59.1b 棉隆 5.7 86.8a 17.6 80.1a 未覆膜CK 43.3 - 88.6 - -
[1] 刘子记, 贺滉, 杨衍, 等.海南省冬季瓜菜播种面积变化趋势分析[J].中国蔬菜, 2016 (4): 6-8. DOI: 10.3969/j.issn.1000-6346.2016.04.004 [2] 陈绵才, 谢圣华, 肖彤斌, 等.海南岛冬季蔬菜根结线虫病的发生及其防治研究[J].沈阳农业大学学报, 2001, 32(3):186-188. DOI: 10.3969/j.issn.1000-1700.2001.03.007 [3] KATAN J, GREENBERGER A, ALON H, et al. Solar heating by polyethylene mulching for the control of diseases caused by soilborne pathogens[J]. Phytopathology, 1976, 66:683-689. DOI: 10.1094/Phyto-66-683
[4] CANDIDO V, ADDABBO T D, BASILE M, et al. Greenhouse soil solarization: effect on weeds, nematodes and yield of tomato and melon[J]. Agronomy for Sustainable Development, 2008, 28(2): 221-230. DOI: 10.1051/agro:2007053
[5] SAGAR B V, RAO V K, PRASAD K S V, et al. Krishna1, Soil Solarization for Control of Rhizoctonia solani and Meloidogyne incognita Complex and Weeds in Tomato[J]. Indian Journal of Nematology, 2012, 42(2): 146-149. http://indianjournals.com/ijor.aspx?target=ijor:ijn&volume=42&issue=2&article=010
[6] 黄文坤, 张桂娟, 张超, 等.生物熏蒸结合阳光消毒治理温室根结线虫技术[J].植物保护, 2010, 36(1):139-142. DOI: 10.3969/j.issn.0529-1542.2010.01.032 [7] 彭德良.蔬菜线虫病害的发生和防治[J].中国蔬菜, 1998 (4):57-58. http://d.old.wanfangdata.com.cn/Periodical/ahny201001152 [8] 李林, 齐军山, 李长松.氰氨化钙-太阳能消毒土壤防治蔬菜根结线虫病研究[J].莱阳农学院学报, 2004, 21(20):122-124. http://d.old.wanfangdata.com.cn/Periodical/lynxyxb200402013 [9] 廖月华, 陈须文, 黄文生, 等.蔬菜根结线虫病发生规律研究.[J].江西农业大学学报, 1996, 18(1):101-105. http://d.old.wanfangdata.com.cn/Periodical/ahny201611107 [10] STAPLETON J J, De VAY J E, LEAR B. In vitro effect of ammonium phosphate fertilizer and soil heating on root galling of tomato(Lycopersicon esculentum cv. Early pak 7)by Meloidogyne incognita[J]. Nematol, 1989 (12): 589.
[11] SEIZO H. Soil solarization in Japan[M]. Soil solarization CRC, Boca Raton, FL, USA, 1991: 215-226.
[12] 陈志杰, 张锋, 张淑莲, 等.太阳能消毒对温室土壤环境效应及防治黄瓜根结线虫病效果[J].生态学报, 2009, 29 (12): 6664-6671. DOI: 10.3321/j.issn:1000-0933.2009.12.043 [13] 李世东, 李明社, 缪作清, 等.生物熏蒸用于治理蔬菜根结线虫病的研究[J].植物保护, 2007, 33(4): 68-71. DOI: 10.3969/j.issn.0529-1542.2007.04.018 -
期刊类型引用(6)
1. 林江波,邹晖,黄惠明,李和平,戴艺民. 金线莲ArCRC基因的克隆、亚细胞定位和表达分析. 热带亚热带植物学报. 2025(01): 42-48 .  百度学术
百度学术
2. 林江波,黄惠明,邹晖,李和平,戴艺民. 金线莲ArLBD1基因克隆、亚细胞定位及表达分析. 北方园艺. 2024(01): 100-106 .  百度学术
百度学术
3. 张闻婷,梅瑜,王继华. 珍稀药用植物金线莲研究现状与展望. 中国农学通报. 2024(05): 16-26 .  百度学术
百度学术
4. 李和平,林江波,黄惠明,邹晖,戴艺民. 金线莲甘露糖-1-磷酸尿苷转移酶基因的克隆与表达分析. 福建农业学报. 2023(05): 537-544 .  本站查看
本站查看
5. 李和平,林江波,黄惠明,邹晖,戴艺民. 金线莲磷酸甘露糖变位酶基因的克隆与表达分析. 农业生物技术学报. 2023(11): 2284-2293 .  百度学术
百度学术
6. 林江波,王伟英,邹晖,戴艺民. 金线莲呋甾皂苷26-O-β-葡萄糖苷酶基因克隆与表达分析. 福建农业学报. 2020(04): 422-428 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载: