Optimization of Astaxanthin-producing Fermentation by Phaffia rhodozyma using Okara as Nitrogen Source
-
摘要:目的
研究以豆渣为氮源进行红法夫酵母产虾青素的可行性,并进行发酵工艺优化,为替代传统的红法夫酵母生产虾青素过程中通常使用的蛋白胨和酵母粉等高成本氮源、降低虾青素生产成本提供参考。
方法以豆渣为有机氮源,分析碳源、前体物质、其他氮源、维生素和无机盐等对虾青素产量的影响,选取(NH4)2SO4、维生素E、葡萄糖、蔗糖4个影响因子进行发酵工艺的响应面优化。
结果以湿豆渣为氮源时,葡萄糖是红法夫酵母产虾青素的最佳碳源,葡萄糖与蔗糖混合可促进虾青素增产,KCl、KNO3、K2HPO4等钾盐物质,(NH4)2SO4、VB2、VE、玉米黄素等均可显著提高虾青素的产量。对增产最优的4个因素(葡萄糖、蔗糖、K2SO4 和维生素E)进行响应面优化,获得产虾青素的最佳培养基配方为:湿豆渣 10%、K2SO4 0.22%、维生素E 0.6%、葡萄糖 1.08%、蔗糖1.50%,虾青素产量实测值为32.46 mg·L−1,是YM培养基产量的2.23倍。
结论豆渣可作为唯一氮源进行红法夫酵母发酵产虾青素,经响应面试验进行工艺优化,红法夫酵母生产虾青素效率明显提升。研究可为虾青素生产中氮源成本控制及虾青素产量提升提供参考。
Abstract:ObjectiveAn astaxanthin-producing fermentation by Phaffia rhodozyma using okara for nitrogen was optimized.
MethodsOn the conventional fermentation by P. rhodozyma to make astaxanthin, okara was used to replace the commonly applied peptone and yeast extract as the organic nitrogen source for cost reduction. Effects of carbon sources, precursor substances, other nitrogen supply, vitamins, and inorganic salts on yield of astaxanthin were analyzed with the amounts of (NH4)2SO4, vitamin E, glucose, and sucrose optimized by response surface methodology.
ResultsWhen okara was used as a raw ingredient for the fermentation, glucose became the optimal carbon source. The yield of astaxanthin by the P. rhodozyma fermentation could be significantly increased by applying both glucose and sucrose, potassium salts such as KCl, KNO3, and K2HPO4 as well as (NH4)2SO4, VB2, VE, and zeaxanthin. Hence, the medium was optimized by response surface method on the 4 key ingredients of glucose, sucrose, K2SO4, and VE to arrive at a formulation consisting of 10% okara, 0.22% K2SO4, 0.6% VE, 1.08% glucose, and 1.50% sucrose to reach a yield of astaxanthin at 32.46 mg·L−1, which was 2.23 folds higher than what obtained by using the YM medium.
ConclusionOkara could amply be used to replace peptone and yeast extract as the nitrogen source for the astaxanthin production by P. rhodozyma fermentation.
-
Keywords:
- Phaffia rhodozyma /
- astaxanthin /
- okara /
- impact factor /
- response surface
-
0. 引言
【研究意义】虾青素是一种类胡萝卜素[1],具有强抗氧化、抗癌、抗炎、增强免疫力等多种生物学活性功能[2],可提高鱼类和甲壳类动物的应激耐受性、疾病抵抗力、生长性能、生存率[3, 4],显著改善肉质和蛋黄色泽品质,在水产养殖和畜禽养殖业中被广泛应用。虾青素可通过甲壳动物废物提取法、化学合成和生物代谢3种途径获得,由于提取原料效率低、化学合成难吸收等问题,使用微生物代谢虾青素成为重要生产途径[5]。红法夫酵母(Phaffia rhodozyma)作为虾青素生产的主要微生物种类,因其生产的虾青素为容易被吸收的右旋构型游离态[6],且生长周期短、可高密度养殖、发酵工艺易控制、易提取等优势备受青睐。目前红法夫酵母生产虾青素除了需要用到大量的糖源物质,还涉及到昂贵的蛋白胨和酵母膏等氮源,且由于虾青素的产量普遍较低,导致其生产成本和市场价格居高不下,限制了产业升级发展[7]。因此,从原料上着手进行红法夫酵母产虾青素的成本控制研究,并对发酵工艺进行优化以提升产量,对虾青素产业的发展具有重要意义。【前人研究进展】红法夫酵母生产虾青素常规培养基的主要成分为蛋白胨、酵母粉、麦芽提取物和葡萄糖等作为碳源或氮源。在碳源替代方面,目前已经有较多的替代技术研究,包括使用糖蜜、甘蔗汁和玉米浆等替代麦芽提取物和葡萄糖用于虾青素的生产和产量提升[2, 4]。在氮源方面,主要集中在常规氮源的优化中,如林嘉祺等 [8]分析了氯化铵、硫酸铵、硝酸钾、酵母粉、蛋白胨、牛肉膏等氮源对红法夫酵母RP-306产虾青素的影响,结果表明加入2.0 g·L−1酵母粉和5.0 g·L−1硫酸铵组合可使虾青素产量达17.04 mg·L−1;潘雪珊等[9]分析了红法夫酵母发酵过程中加入硫酸铵和谷氨酸对生物量和虾青素的影响,发现在发酵24 h补充0.368 g·L−1谷氨酸可显著提高虾青素的产量;而在氮源完全替代上,仅见安君[10]使用牛血清白蛋白为唯一氮源碳源,制备出的氮掺杂碳点添加到钝顶螺旋藻培养体系中提高了螺旋藻中藻胆蛋白、玉米黄素和β-胡萝卜素的积累,再用钝顶螺旋藻粉部分替代葡萄糖和全部酵母浸粉,以提高红法夫酵母的生物量和虾青素的积累研究。在发酵工艺优化上,主要以常规培养基为发酵基础,进行虾青素前体物质、维生素和无机盐等促进因子的筛选研究,如江文涛等[11]在发酵的YM培养基中添加番茄红素等提升虾青素的产量;王宝贝等[1]在基础培养基中添加生物素、泛酸钙、肌醇、维生素B1以提高红法夫酵母的生物量和虾青素的产量;张晶等[12]在YM培养基中加入了各种金属离子、活性氧发生剂,发现0.5 g·L−1 CaCl2和500~
1500 mg·L−1的TiO2可显著提升虾青素的产量。【本研究切入点】豆渣富含高质量蛋白质,干豆渣的蛋白质含量在18%左右,此外还含有丰富的碳水化合物、脂肪、矿物质和维生素等[13],可为微生物的生长提供充足的氮源和较为全面的营养支持。作为豆制品加工副产物,豆渣作为氮源在成本上具有明显优势,目前以廉价豆渣为氮源的虾青素生产替代技术研究较少,同时亦缺乏以豆渣为氮源的发酵工艺技术优化研究。【拟解决的关键问题】本研究以湿豆渣为氮源,分析碳源、前体物质、其他氮源、维生素、无机盐等对红法夫酵母生物量和产虾青素的影响,并获得以豆渣为唯一氮源的虾青素生产发酵工艺优化技术,为解决传统红法夫酵母产虾青素过程中氮源物质成本过高和产量过低的问题提供原料替代方案和技术参考。1. 材料与方法
1.1 材料与试剂
豆渣(含水率79.88%)购自福建省龙岩市昌泰食品有限公司;红法夫酵母ATCC 74220(GDMCC编号2.218)购自北纳创联生物技术有限公司;虾青素标准品(HPLC,≥98.0%,y=
9.1254 x+0.0288 ,R2=0.9998 ,其中y为虾青素含量,x为492 nm处吸光值)购自上海阿拉丁生化科技股份有限公司;二甲基亚砜、丙酮(分析纯)购自国药集团化学试剂有限公司。YM培养基:蛋白胨5 g·L−1、葡萄糖10 g·L−1、酵母粉3 g·L−1、麦芽提取物3 g·L−1,蒸馏水补至1 L,pH 6.2。
CK豆渣基础培养基:湿豆渣100 g·L−1、葡萄糖25 g·L−1,蒸馏水补至1 L,pH6.0。
1.2 仪器与设备
CLARIO Star多功能酶标仪,德国BMG Labtech公司;Neofuge 15R台式高速冷冻离心机,力康发展有限公司;生化培养箱SPX-150DS-Ⅱ,上海新苗医疗器械制造有限公司;恒温摇床NS-2102C,上海皓庄仪器有限公司;SW-CJ-IFD超净工作台,苏州净化设备有限公司。
1.3 试验方法
1.3.1 红法夫酵母发酵母液及培养方法
取−80 ℃保存的红法夫酵母ATCC 74220接种于YM培养基中,22 ℃、200 r·min−1摇床培养4 d至培养基变为红色,即为红法夫酵母发酵种子液。
1.3.2 红法夫酵母基础培养基单因素优化
分析2.5%不同碳源(葡萄糖、蔗糖、果糖和海藻糖)、不同豆渣用量(5%、10%、15%、20%、25%和30%)对红法夫酵母生物量和虾青素含量的影响,获得培养红法夫酵母产虾青素的基础培养基CK。其中培养基按照100 mL每三角瓶(250 mL)分装,红法夫酵母接种量1%(V/V), 22 ℃、 200 r·min−1摇床培养,每处理3次重复。
1.3.3 不同因素对红法夫酵母活菌数及虾青素产量的影响
在前期获得CK培养基的基础上,分析0.5%不同氮源(蛋白胨、牛肉粉和酵母粉),2.5%混合糖(葡萄糖与蔗糖、果糖和海藻糖比例均为1∶1的混合物),0.5%不同前体物质[乙醇(ethanol, E)、乙酸(acetic acid, Ace)、乳酸(lactic acid, Lac)、磺基水杨酸(sulfosalicylic acid, Sul)、玉米黄素(zeaxanthin, Ze)、番茄(tomato, Tom)]、0.5%不同维生素(VA、VB1、VB2、VC、VE),0.5%不同无机盐[NH4Cl、(NH4)2SO4、NH4H2PO4、KCl、K2SO4、K2HPO4、KH2PO4、CH3COOK、KNO3、Na2SO4、Na2HPO4、MgCl2、CaCl2]对红法夫酵母活菌数和虾青素产量的影响。
1.3.4 主要影响因子用量确定
分析主要影响因子K2SO4(0.2%、0.4%、0.6%、0.8%、1.0%和1.2%)、VE(0.4%、0.6%、0.8%和1.0%)、葡萄糖(0.5%、1.0%、1.5%、2.0%、2.5%和30%)、混合糖(葡萄糖∶蔗糖=1∶1)(0.5%、1.0%、1.5%、2.0%、2.5%和3.0%)加入量对红法夫酵母生物量和虾青素产量的影响。
1.3.5 响应面优化试验
为进一步筛选出最优影响因子,基于上述结果,以虾青素产量为响应指标,选取因子K2SO4、VE、葡萄糖和蔗糖,根据软件Design-Expert中的Box-Behnken进行四因素三水平的响应面设计分析[14],因素水平编码见表1,设计获得29个处理组,将各处理组合因子加入含有10%的湿豆渣纯净水配制的培养基,检测各处理组虾青素的产量,并进行多元二次响应面回归、三维响应曲面图分析、最佳因素和最大响应面值预测分析。
表 1 响应面优化设计因素及水平编码表Table 1. Factors and codes applied in response surface experiment促进因子
Promoter factor编码
Code水平 level −1 0 1 硫酸钾 K2SO4/% A 0.2 0.4 0.6 维生素E Vitamin E/% B 0.6 0.8 1.0 葡萄糖 Glucose/% C 1.00 1.25 1.50 蔗糖 Sucrose/% D 1.00 1.25 1.50 1.3.6 活菌计数与虾青素检测方法
红法夫酵母计数采用平板计数法进行。虾青素含量检测采用DMSO法进行[15]。取1 mL发酵液至15 mL离心管,
4500 r·min−1离心5 min,去上清液,加入5 mL[V(二甲基亚砜): V(丙酮)=5∶1]溶解液振荡悬浮,超声30 min,4500 r·min−1离心10 min,取200 μL测定492 nm处吸光值,代入上述标准曲线方程计算样品中虾青素的含量。1.4 数据统计
数据统计采用Excel软件进行,显著性方差分析采用IBM SPSS Statistics(SPSS Inc., Chicago,USA)中的单因素ANOVA 进行(P≤0.01)。
2. 结果与分析
2.1 红法夫酵母基础培养基单因素优化
分析以豆渣为氮源的红法夫酵母产虾青素的单因素条件和最适豆渣加入量。由图1A可知,糖作为速效碳源对酵母的生长和虾青素的积累具有决定性的作用,未加糖的豆渣水培养基(C处理)无法满足红法夫酵母生长的基本需求[活菌数仅为7.36 lg (CFU·mL−1)],虾青素产量仅为1.25 mg·L−1,加入2.5%的葡萄糖后虾青素产量最高(19.70 mg·L−1),显著高于使用YM培养基获得的虾青素含量14.58 mg·L−1,对应活菌数为8.07 lg (CFU·mL−1),说明在以豆渣为原料时,糖是红法夫酵母菌体生长和虾青素积累的必需基础物质[11]。分析不同湿豆渣加入量对红法夫酵母生长的影响,由图1B可知,湿豆渣加入量为10%~20%时,其生长处于最佳水平,活菌数为8.01~8.06 lg(CFU·mL−1),虾青素产量为19.51~21.62 mg·L−1,显著高于其他组,方差分析显示10%~20%的加入量无显著差异,为了控制生产成本,选择湿豆渣加入量10%进行后续试验分析。
![]() 图 1 红法夫酵母生长及虾青素积累基础培养条件分析A:YM、C、Glc、Suc、Fru和Tre分别代表YM培养基、未加糖豆渣培养基、2.5%葡萄糖、2.5%蔗糖、2.5%果糖、2.5%海藻糖。不同字母代表样品间显著差异(P<0.01),下同。Figure 1. Required ingredients for P. rhodozyma growth and astaxanthin productionA: YM, C, Glc, Suc, Fru, and Tre represent YM medium, unsugar-added okara medium, 2.5% glucose, 2.5% sucrose, 2.5% fructose, and 2.5% trehalose treatment, respectively. Data with different letters represent significant differences between samples at P<0.01. Same for below.
图 1 红法夫酵母生长及虾青素积累基础培养条件分析A:YM、C、Glc、Suc、Fru和Tre分别代表YM培养基、未加糖豆渣培养基、2.5%葡萄糖、2.5%蔗糖、2.5%果糖、2.5%海藻糖。不同字母代表样品间显著差异(P<0.01),下同。Figure 1. Required ingredients for P. rhodozyma growth and astaxanthin productionA: YM, C, Glc, Suc, Fru, and Tre represent YM medium, unsugar-added okara medium, 2.5% glucose, 2.5% sucrose, 2.5% fructose, and 2.5% trehalose treatment, respectively. Data with different letters represent significant differences between samples at P<0.01. Same for below.综上,确定豆渣基础发酵培养基(CK)为葡萄糖2.5%、湿豆渣10%、纯净水88%。
2.2 红法夫酵母产虾青素影响因子筛选分析
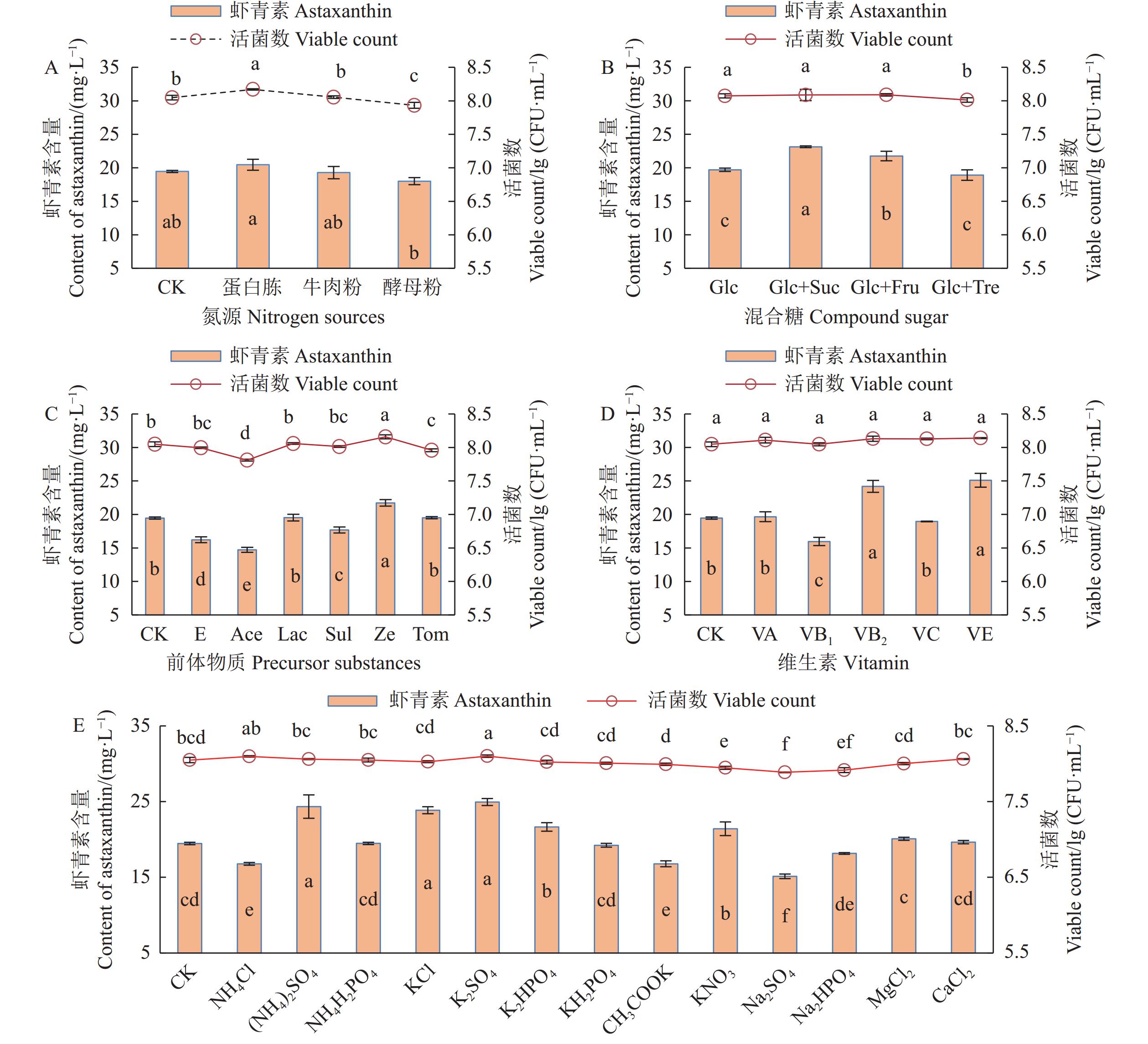
分析不同影响因子对红法夫酵母生物量和产虾青素的影响(图2)。由图2A可知,在上述基础培养基(CK)中,额外加入蛋白胨可显著提高红法夫酵母的活菌数[8.17 lg(CFU·mL−1)],但虾青素产量为20.46 mg·L−1,未达到显著差异水平;而酵母粉的加入使得活菌数和虾青素产量出现降低现象,说明使用10%的湿豆渣能够满足红法夫酵母的生长和虾青素的积累所需的氮源,即豆渣可作为唯一氮源用于红法夫酵母发酵生产虾青素,无需额外加入氮源物质。分析混合糖对生物量和虾青素积累的影响(图2B),可知加入2.5%的混合糖(葡萄糖与蔗糖混合)可显著提高虾青素产量至23.14 mg·L−1,但活菌数未见显著差异,表明等量葡萄糖与蔗糖混合添加可促进红法夫酵母的虾青素积累,因此,选择使用葡萄糖和蔗糖混合作为虾青素生产的碳源物质。分析前体物质对虾青素积累的影响(图2C),发现玉米黄素(虾青素含量为21.73 mg·L−1)可促进虾青素产量的增加,其余前体物质在以豆渣为氮源时对虾青素的产量无显著促进作用。分析维生素对虾青素产量的影响(图2D),发现维生素E和维生素B2可显著促进虾青素积累,加入维生素E的虾青素的量最高(25.10 mg·L−1),故选择维生素E作为红法夫酵母培养基成分之一。系统分析0.5%的各种无机盐对红法夫酵母产虾青素的影响(图2E),发现(NH4)2SO4、KCl、K2SO4、KNO3、K2HPO4均能显著促进虾青素含量的提升,对应虾青素含量分别为24.34、23.85、24.93、21.41、21.65 mg·L−1,其中K2SO4 处理组中活菌数显著增加至8.11 lg(CFU·mL−1),对虾青素有促进作用的无机盐中,K+和SO42−出现的频次极高,固选择效果最好的K2SO4作为促进影响因子之一。综上,确定葡萄糖、蔗糖、维生素E和K2SO4为虾青素生产的影响因子进行下一步优化研究。
![]() 图 2 不同因子对红法夫酵母生物量及产虾青素含量的影响。A:向对照组(CK组)中分别加入0.5%的蛋白胨、牛肉粉和酵母粉;B:Glc、Suc、Fru和Tre分别代表葡萄糖、蔗糖、果糖和海藻糖,+表示2种糖的等量混合物;C中,E:乙醇,Ace:乙酸,Lac:乳酸, Sul:磺基水杨酸,Ze:玉米黄素,Tom:番茄。D中,VA:维生素A,VB1:维生素B1,VB2:维生素B2,VC:维生素C, VE:维生素E。Figure 2. Viable count and astaxanthin yield of P. rhodozyma under various treatmentsA: 0.5% peptone, beef powder, and yeast powder added to CK; B: Glc, Suc, Fru, and Tre represent glucose, sucrose, fructose, and trehalose, respectively; "+" denotes an equal mixture of two sugars; C: in CK, 0.5% ethanol (E), acetic acid (Ace), lactic acid (Lac), sulfosalicylic acid (Sul), zeaxanthin (Ze), and tomato (Tom) were added; D: 0.5% vitamin A (VA), vitamin B1 (VB1), vitamin B2 (VB2), vitamin C (VC), and vitamin E (VE) were added.
图 2 不同因子对红法夫酵母生物量及产虾青素含量的影响。A:向对照组(CK组)中分别加入0.5%的蛋白胨、牛肉粉和酵母粉;B:Glc、Suc、Fru和Tre分别代表葡萄糖、蔗糖、果糖和海藻糖,+表示2种糖的等量混合物;C中,E:乙醇,Ace:乙酸,Lac:乳酸, Sul:磺基水杨酸,Ze:玉米黄素,Tom:番茄。D中,VA:维生素A,VB1:维生素B1,VB2:维生素B2,VC:维生素C, VE:维生素E。Figure 2. Viable count and astaxanthin yield of P. rhodozyma under various treatmentsA: 0.5% peptone, beef powder, and yeast powder added to CK; B: Glc, Suc, Fru, and Tre represent glucose, sucrose, fructose, and trehalose, respectively; "+" denotes an equal mixture of two sugars; C: in CK, 0.5% ethanol (E), acetic acid (Ace), lactic acid (Lac), sulfosalicylic acid (Sul), zeaxanthin (Ze), and tomato (Tom) were added; D: 0.5% vitamin A (VA), vitamin B1 (VB1), vitamin B2 (VB2), vitamin C (VC), and vitamin E (VE) were added.2.3 影响因子用量优化
分析不同用量葡萄糖、蔗糖、维生素E和K2SO4对红法夫酵母生物量和虾青素产量的影响(图3)。K2SO4加入比例为0.4%时,活菌数和虾青素均为最高值,分别为8.08 lg(CFU·mL−1)和 25.83 mg·L−1(图3A);维生素E的加入量为0.8 %时,虾青素含量最高为26.24 mg·L−1(图3B);活菌数在葡萄糖加入量2.0%~3.0%处于最高值,但葡萄糖加入量为2.0%~2.5%时虾青素含量最高,当加入量为3.0%时,虾青素的产量显著下降(图3C);葡萄糖与蔗糖1∶1混合加入量为2.5%时,虾青素含量最高,达23.32 mg·L−1,活菌数在混合糖加入量大于1.5%后即达到最高值(图3D);加入2.5%混合糖的虾青素含量最高,表明使用复合糖可减少因葡萄糖含量过高导致的虾青素产量阻遏问题。综上,选择K2SO4(0.2%~0.6%)、维生素E(0.4%~0.8%),由于葡萄糖与蔗糖同为碳源,按照复合糖一半浓度设计进一步的响应面试验,即葡萄糖(1.0%~1.5%)和蔗糖(1.0%~1.5%)进行下一步响应面优化。
2.4 响应面优化红法夫酵母产虾青素工艺
2.4.1 Box-Behnken 响应面试验设计与结果
根据4个因素浓度梯度分析结果,运用Box-Benhnken的中心组合试验设计原理,响应面分析K2SO4(A)、维生素E(B)、葡萄糖(C)和蔗糖(D)对红法夫酵母虾青素产量的影响。响应面优化设计及结果见表2。拟合二次回归模型为:虾青素含量/(mg·L−1)=
50.98948 +18.92021 A+19.59842 B+2.31248 C+4.96615 D+19.94863 AB−0.66753 AC−1.39294 AD+0.13158 BC−1.64477 BD-0.086234 CD−11.64922 A2−5.66453 B2−0.045559 C2−0.077337 D2。回归模型的方差分析显示(表3),模型显著性检验(P <0.05),表明该模型具有统计学意义,二次项AB 、AD、BD、CD、A2和D2显著(P<0.01),失拟项用来表示所用模型与试验拟合程度,即二者差异的程度。本研究失拟项P =0.1055 >0.05,无失拟因素存在,表明可用该回归方程代替试验真实点对试验结果进行分析。R2=0.9002 和校正决定系数Radj2 =0.8003 ,均大于0.8000 ,变异系数(CV)为5.44%,说明该模型只有5.44%的变异,进一步说明模型拟合优度较好,可用来对4种因子的对虾青素产量进行分析预测。表 2 响应面优化试验结果Table 2. Response surface optimization results试验号
No.影响因子加入量
Dosage of influence factors/%虾青素含量
Content of
Astaxanthin/
(mg·L−1)试验号
No.影响因子加入量
Dosage of influence factors/%虾青素含量
Content of
Astaxanthin/
(mg·L−1)K2SO4 维生素E
Vitamin E葡萄糖
Glucose蔗糖
SucroseK2SO4 维生素E
Vitamins E葡萄糖
Glucose蔗糖
Sucrose1 0.4 0.6 1.5 1.25 24.14±0.94 16 0.4 0.6 1.25 1 20.92±1.68 2 0.4 0.8 1.25 1.25 29.13±0.32 17 0.6 0.8 1.25 1.5 20.90±1.58 3 0.4 0.6 1 1.25 27.38±0.48 18 0.4 0.8 1 1 20.14±1.03 4 0.2 1 1.25 1.25 22.27±0.94 19 0.2 0.8 1.25 1 19.28±2.90 5 0.6 0.6 1.25 1.25 20.42±0.77 20 0.2 0.6 1.25 1.25 24.02±0.06 6 0.4 0.8 1.5 1.5 22.43±1.16 21 0.4 1 1.5 1.25 23.27±0.68 7 0.4 0.8 1.25 1.25 27.19±0.23 22 0.6 0.8 1 1.25 26.60±0.94 8 0.4 0.8 1.5 1 25.51±1.26 23 0.2 0.8 1 1.25 24.25±2.00 9 0.4 1 1.25 1.5 20.83±0.19 24 0.4 0.8 1.25 1.25 28.63±0.19 10 0.4 0.8 1 1.5 26.65±0.10 25 0.6 0.8 1.5 1.25 21.42±0.39 11 0.4 0.6 1.25 1.5 28.01±0.35 26 0.4 0.8 1.25 1.25 27.60±1.65 12 0.6 1 1.25 1.25 28.13±1.48 27 0.6 0.8 1.25 1 24.55±1.32 13 0.4 1 1.25 1 26.94±0.45 28 0.2 0.8 1.25 1.5 27.99±1.23 14 0.2 0.8 1.5 1.25 24.57±0.32 29 0.4 1 1 1.25 25.51±1.06 15 0.4 0.8 1.25 1.25 28.27±2.26 表 3 回归模型的方差分析Table 3. ANOVA of quadratic model方差来源
Source平方和
Sum of
Squares自由
度
df均方差
Mean
SquareF值
F valueP值
P value显著性
Significance模型
Model228.71 14 16.34 9.02 < 0.0001 ** A-K2SO4 0.011 1 0.011 6.13×10−3 0.9387 B-VE 0.35 1 0.35 1.90×10−1 0.6664 C-葡萄糖
C-Glucose7.04 1 7.04 3.89 0.0687 D-蔗糖
D-Sucrose7.47 1 7.47 4.12 0.0617 AB 22.41 1 22.41 12.37 0.0034 ** AC 7.56 1 7.56 4.17 0.0604 AD 38.22 1 38.22 21.1 0.0004 ** BC 0.25 1 0.25 0.14 0.7148 BD 43.62 1 43.62 24.08 0.0002 ** CD 22.95 1 22.95 12.67 0.0031 ** A2 41.79 1 41.79 23.07 0.0003 ** B2 16.78 1 16.78 9.26 0.0088 C2 16.72 1 16.72 9.23 0.0089 D2 42.83 1 42.83 23.64 0.0003 ** 残差
Residual25.36 14 1.81 失拟项
Lack of Fit22.94 10 2.29 3.79 0.1055 ns 纯误差
Pure error2.42 4 0.61 总离差
Cor total254.07 28 R2 0.9002 Radj2 0.8003 CV/% 5.44 *表示 P <0. 05, 差异显著;**表示 P <0. 01;差异极显著;ns表示P≥0.05,差异不显著。
*: significant difference at P<0.05; **: extremely significant difference at P<0.01; ns: no significant difference at P≥0.05.2.4.2 各因素交互作用等高线与三维响应曲面
根据模型绘制等高线与三维响应面曲面,分析因素间交互作用对红法夫酵母产虾青素的影响(图4)。K2SO4、维生素E、葡萄糖和蔗糖含量的变化均能引起曲面斜率的变化,其中蔗糖对应的响应面坡度最为显著,图3a、b和d响应面图各因素开口均向下,证明K2SO4、维生素E、葡萄糖在设计的浓度范围内均有最大虾青素产量值,图3c、e和f响应面图中,虾青素含量与蔗糖含量有正相关趋势,预示蔗糖的浓度还可进一步提高;除了等高线图4b和4d,其余图接近椭圆形,结合回归模型的方差分析结果,表明AB、AD、BD和CD因素间存在极显著差异(P <0. 01),BC(维生素E与葡萄糖)交互作用不显著(P =
0.7148 ),而AC(P =0.0604 )虽有交互差异,但未达到显著水平,但其余因素间交互作用均呈现显著性。通过软件预测最终获得使用豆渣为基础氮源的生产虾青素促进因子最佳配方为:K2SO4 0.22%、 维生素E 0.60%、葡萄糖 1.08%、蔗糖1.50%,预测虾青素产量为31.53 mg·L−1。2.5 响应面优化试验验证
按照响应面分析结果,在含有10%湿豆渣的水中,加入0.22%的K2SO4、0.60%的维生素E、1.08%的葡萄糖、1.50%的蔗糖,组经过优化后,获得虾青素的实际含量为32.46 mg·L−1,与预测值拟合,说明模型能较好地预测红法夫酵母实际发酵虾青素的情况。
3. 讨论与结论
氮源是红法夫酵母生长的必需营养物质,氮源缺乏会影响生物量和虾青素的合成速度,而过多的氮源会遏制虾青素的积累[9]。本研究发现在湿豆渣加入量10%~20%时,红法夫酵母的生物量和虾青素的产量处于最佳水平,过低的豆渣含量不利于生物量的积累,而豆渣含量超过20%时,虾青素的积累受到抑制,在含10%湿豆渣培养基中额外加入蛋白胨、牛肉粉和酵母膏后,未发现虾青素显著提高,且酵母粉的加入降低了虾青素的产量,进一步说明适量的豆渣作为氮源足够满足红法夫酵母的生长和虾青素的积累,并证实过多的氮源加入会对虾青素的分泌产生遏制现象。
碳源是红法夫酵母生长的必需物质,也是虾青素积累的主要原料来源[16],糖作为碳源的一部分对红法夫酵母的生长和虾青素的积累有决定性作用。现有研究表明过高的葡萄糖会抑制胡萝卜素合成途径中番茄红素-β-胡萝卜素-虾青素的生产路径,抑制类胡萝卜素合成基因crtE、pbs和ast的表达,进而降低虾青素的产量[17],而使用复合糖不仅可以克服葡萄糖浓度过高导致的系列问题,还有利于降低成本,降低糖消耗速度,为发酵后期虾青素的转化提供足够原料物质[2]。本研究在以豆渣为唯一氮源的条件下,同样发现葡萄糖是虾青素生产最适碳源物质,过多的葡萄糖加入会遏制虾青素的产量,因此推测过高葡萄糖用量可能限制了虾青素及前体物质的积累,而葡萄糖和蔗糖的混合使用则可在一定程度上缓解高浓度葡萄糖产生的阻遏现象,进而进一步提高虾青素的产能并降低糖的使用成本。
一些农业原料物质含有虾青素合成的前体物质,如玉米黄素,通过氧化可转化成虾青素[18],番茄中含有的番茄红素也是虾青素合成的前体物质[11];此外乙醇被报道可作为碳源应用于红法夫酵母的生长[19],并可显著提高虾青素的产量[20];乙酸、乳酸和磺基水杨酸等物质亦被报道是虾青素合成的前体物质,有助于促进虾青素的合成[2]。基于此,本研究分析了上述物质对虾青素的积累作用,未发现虾青素有显著增加,这可能与研究的红法夫酵母的菌株特征或与豆渣复配有关。维生素是细胞生长的重要营养元素,参与了酶反应和细胞生长代谢全过程。本研究发现维生素E对虾青素的增产有显著促进作用,这可能与其良好的抗氧化能力和脂溶性特征有关[17],维生素E或通过捕捉自由基,保护虾青素不被氧化降解,进而提高虾青素的产量。无机盐不仅能维持细胞正常生长繁殖所需的渗透压,而且还是细胞骨架组成和代谢物质形成的重要元件,微生物常规需求的无机盐包括钾、钙、磷、钠和镁等[21]。已有研究发现硝酸钾、磷酸二氢钾等对红法夫酵母或雨生红球藻产虾青素有促进作用[22, 23],SO42-也证实对虾青素有促进作用[2],本研究分析同样发现含有K+和SO42-的无机盐对虾青素产量有显著促进作用,与现有报道一致。
通过响应面坡度分析,获得K2SO4与VE、K2SO4与蔗糖、VE与蔗糖、葡萄糖与蔗糖两两间存在极显著差异。结果表明,以价格低廉豆腐加工副产物湿豆渣为氮源,替代传统蛋白原料进行红法夫酵母生产工艺技术研究,可以完全替代传统YM培养基中的氮源物质进行虾青素的生产。在以湿豆渣为氮源的培养基中,糖是红法夫酵母产虾青素的必需物质,葡萄糖依旧是红法夫酵母产虾青素的最佳碳源,使用蔗糖与葡萄糖混合可显著提高虾青素的产量。影响因子筛选分析发现KCl、K2SO4、KNO3、K2HPO4等钾盐物质,(NH4)2SO4、VB2、维生素E、玉米黄素等均可显著促进虾青素产量。对促进效果最优的K2SO4、维生素E、葡萄糖和蔗糖进行响应面优化分析,获得红法夫酵母产虾青素的最佳培养基配方为:湿豆渣10%,K2SO4 0.22%、维生素E 0.6%、葡萄糖 1.08%、蔗糖1.50%、其余纯净水,预测虾青素产量为31.53 mg·L−1,实测虾青素产量为32.46 mg·L−1,是使用YM培养产量(14.58 mg·L−1)的2.23倍。虾青素的产量与菌种有关,现有文献报道的红法夫酵母的虾青素产量通常低于20 mg·L−1,使用条件优化后对虾青素产量的提升鲜见大于2倍[1,2,8,9,12],如林嘉祺等通过培养条件优化,将红法夫酵母RP-306的虾青素的产量从13.46 mg·L−1提高到17.04 mg·L−1,比优化前提高了26.61%[8]。本研究采用豆渣完全替代传统培养基中的氮源,通过加入筛选的促进因子可使虾青素的原始产量提高2倍以上,表明豆渣作为氮源替代原料在虾青素的生产中具有良好的市场应用前景。
-
图 1 红法夫酵母生长及虾青素积累基础培养条件分析
A:YM、C、Glc、Suc、Fru和Tre分别代表YM培养基、未加糖豆渣培养基、2.5%葡萄糖、2.5%蔗糖、2.5%果糖、2.5%海藻糖。不同字母代表样品间显著差异(P<0.01),下同。
Figure 1. Required ingredients for P. rhodozyma growth and astaxanthin production
A: YM, C, Glc, Suc, Fru, and Tre represent YM medium, unsugar-added okara medium, 2.5% glucose, 2.5% sucrose, 2.5% fructose, and 2.5% trehalose treatment, respectively. Data with different letters represent significant differences between samples at P<0.01. Same for below.
图 2 不同因子对红法夫酵母生物量及产虾青素含量的影响。
A:向对照组(CK组)中分别加入0.5%的蛋白胨、牛肉粉和酵母粉;B:Glc、Suc、Fru和Tre分别代表葡萄糖、蔗糖、果糖和海藻糖,+表示2种糖的等量混合物;C中,E:乙醇,Ace:乙酸,Lac:乳酸, Sul:磺基水杨酸,Ze:玉米黄素,Tom:番茄。D中,VA:维生素A,VB1:维生素B1,VB2:维生素B2,VC:维生素C, VE:维生素E。
Figure 2. Viable count and astaxanthin yield of P. rhodozyma under various treatments
A: 0.5% peptone, beef powder, and yeast powder added to CK; B: Glc, Suc, Fru, and Tre represent glucose, sucrose, fructose, and trehalose, respectively; "+" denotes an equal mixture of two sugars; C: in CK, 0.5% ethanol (E), acetic acid (Ace), lactic acid (Lac), sulfosalicylic acid (Sul), zeaxanthin (Ze), and tomato (Tom) were added; D: 0.5% vitamin A (VA), vitamin B1 (VB1), vitamin B2 (VB2), vitamin C (VC), and vitamin E (VE) were added.
表 1 响应面优化设计因素及水平编码表
Table 1 Factors and codes applied in response surface experiment
促进因子
Promoter factor编码
Code水平 level −1 0 1 硫酸钾 K2SO4/% A 0.2 0.4 0.6 维生素E Vitamin E/% B 0.6 0.8 1.0 葡萄糖 Glucose/% C 1.00 1.25 1.50 蔗糖 Sucrose/% D 1.00 1.25 1.50 表 2 响应面优化试验结果
Table 2 Response surface optimization results
试验号
No.影响因子加入量
Dosage of influence factors/%虾青素含量
Content of
Astaxanthin/
(mg·L−1)试验号
No.影响因子加入量
Dosage of influence factors/%虾青素含量
Content of
Astaxanthin/
(mg·L−1)K2SO4 维生素E
Vitamin E葡萄糖
Glucose蔗糖
SucroseK2SO4 维生素E
Vitamins E葡萄糖
Glucose蔗糖
Sucrose1 0.4 0.6 1.5 1.25 24.14±0.94 16 0.4 0.6 1.25 1 20.92±1.68 2 0.4 0.8 1.25 1.25 29.13±0.32 17 0.6 0.8 1.25 1.5 20.90±1.58 3 0.4 0.6 1 1.25 27.38±0.48 18 0.4 0.8 1 1 20.14±1.03 4 0.2 1 1.25 1.25 22.27±0.94 19 0.2 0.8 1.25 1 19.28±2.90 5 0.6 0.6 1.25 1.25 20.42±0.77 20 0.2 0.6 1.25 1.25 24.02±0.06 6 0.4 0.8 1.5 1.5 22.43±1.16 21 0.4 1 1.5 1.25 23.27±0.68 7 0.4 0.8 1.25 1.25 27.19±0.23 22 0.6 0.8 1 1.25 26.60±0.94 8 0.4 0.8 1.5 1 25.51±1.26 23 0.2 0.8 1 1.25 24.25±2.00 9 0.4 1 1.25 1.5 20.83±0.19 24 0.4 0.8 1.25 1.25 28.63±0.19 10 0.4 0.8 1 1.5 26.65±0.10 25 0.6 0.8 1.5 1.25 21.42±0.39 11 0.4 0.6 1.25 1.5 28.01±0.35 26 0.4 0.8 1.25 1.25 27.60±1.65 12 0.6 1 1.25 1.25 28.13±1.48 27 0.6 0.8 1.25 1 24.55±1.32 13 0.4 1 1.25 1 26.94±0.45 28 0.2 0.8 1.25 1.5 27.99±1.23 14 0.2 0.8 1.5 1.25 24.57±0.32 29 0.4 1 1 1.25 25.51±1.06 15 0.4 0.8 1.25 1.25 28.27±2.26 表 3 回归模型的方差分析
Table 3 ANOVA of quadratic model
方差来源
Source平方和
Sum of
Squares自由
度
df均方差
Mean
SquareF值
F valueP值
P value显著性
Significance模型
Model228.71 14 16.34 9.02 < 0.0001 ** A-K2SO4 0.011 1 0.011 6.13×10−3 0.9387 B-VE 0.35 1 0.35 1.90×10−1 0.6664 C-葡萄糖
C-Glucose7.04 1 7.04 3.89 0.0687 D-蔗糖
D-Sucrose7.47 1 7.47 4.12 0.0617 AB 22.41 1 22.41 12.37 0.0034 ** AC 7.56 1 7.56 4.17 0.0604 AD 38.22 1 38.22 21.1 0.0004 ** BC 0.25 1 0.25 0.14 0.7148 BD 43.62 1 43.62 24.08 0.0002 ** CD 22.95 1 22.95 12.67 0.0031 ** A2 41.79 1 41.79 23.07 0.0003 ** B2 16.78 1 16.78 9.26 0.0088 C2 16.72 1 16.72 9.23 0.0089 D2 42.83 1 42.83 23.64 0.0003 ** 残差
Residual25.36 14 1.81 失拟项
Lack of Fit22.94 10 2.29 3.79 0.1055 ns 纯误差
Pure error2.42 4 0.61 总离差
Cor total254.07 28 R2 0.9002 Radj2 0.8003 CV/% 5.44 *表示 P <0. 05, 差异显著;**表示 P <0. 01;差异极显著;ns表示P≥0.05,差异不显著。
*: significant difference at P<0.05; **: extremely significant difference at P<0.01; ns: no significant difference at P≥0.05. -
[1] 王宝贝, 凌雪萍, 郑宗宇, 等. 维生素对红法夫酵母产虾青素的影响 [J]. 厦门大学学报(自然科学版), 2011, 50(1):111−116. WANG B B, LING X P, ZHENG Z Y, et al. Effect of vitamins on astaxanthin production of Phaffia rhodozyma [J]. Journal of Xiamen University (Natural Science), 2011, 50(1): 111−116. (in Chinese)
[2] 周桂雄, 王闻, 谭雪松, 等. 利用农业废弃物碳源的红法夫酵母生产虾青素研究进展 [J]. 农业工程学报, 2016, 32(15):308−314. DOI: 10.11975/j.issn.1002-6819.2016.15.043 ZHOU G X, WANG W, TAN X S, et al. Review on astaxanthin production from agricultural wastes by Phaffia rhodozyma [J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(15): 308−314. (in Chinese) DOI: 10.11975/j.issn.1002-6819.2016.15.043
[3] LAI J X, LIU W P, BU J, et al. Enhancement of astaxanthin production from food waste by Phaffia rhodozyma screened by flow cytometry and feed application potential [J]. Biotechnology and Applied Biochemistry, 2023, 70(6): 1817−1829. DOI: 10.1002/bab.2484
[4] 张辰, 徐慧, 朱坤福, 等. 微生物法生产虾青素的研究进展 [J]. 中国酿造, 2021, 40(10):29−35. DOI: 10.11882/j.issn.0254-5071.2021.10.005 ZHANG C, XU H, ZHU K F, et al. Research progress in the production of astaxanthin by microbial method [J]. China Brewing, 2021, 40(10): 29−35. (in Chinese) DOI: 10.11882/j.issn.0254-5071.2021.10.005
[5] HIGUERA-CIAPARA I, FÉLIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin: A review of its chemistry and applications [J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185−196. DOI: 10.1080/10408690590957188
[6] ELBAHNASWY S, ELSHOPAKEY G E. Recent progress in practical applications of a potential carotenoid astaxanthin in aquaculture industry: A review [J]. Fish Physiology and Biochemistry, 2024, 50(1): 97−126. DOI: 10.1007/s10695-022-01167-0
[7] NAIR A, AHIRWAR A, SINGH S, et al. Astaxanthin as a king of ketocarotenoids: Structure, synthesis, accumulation, bioavailability and antioxidant properties [J]. Marine Drugs, 2023, 21(3): 176. DOI: 10.3390/md21030176
[8] 林嘉祺, 庄岩, 刘骁, 等. 一株海洋红法夫酵母Phaffia rhodozyma RP-306产虾青素的发酵条件优化 [J]. 海洋科学, 2024, 48(2):69−78. LIN J Q, ZHUANG Y, LIU X, et al. Optimization of fermentation conditions for astaxanthin production by marine Phaffia rhodozyma RP-306 [J]. Marine Sciences, 2024, 48(2): 69−78. (in Chinese)
[9] 潘雪珊, 凌雪萍, 叶驰名, 等. 红发夫酵母生产虾青素的氮源补加策略 [J]. 厦门大学学报(自然科学版), 2013, 52(4):545−552. PAN X S, LING X P, YE C M, et al. Nitrogen feeding strategies on astaxanthin production by Xanthophyllomyces dendrorhous [J]. Journal of Xiamen University (Natural Science), 2013, 52(4): 545−552. (in Chinese)
[10] 安君. 红法夫酵母发酵钝顶螺旋藻合成虾青素及载虾青素微粒功能性质研究[D]. 北京: 北京林业大学, 2020. AN J. Study on synthesis of astaxanthin from Spirulina platensis by Phaffia rhodozyma and functional properties of astaxanthin-loaded particles[D]. Beijing: Beijing Forestry University, 2020. (in Chinese)
[11] 江文涛, 彭立影, 马加军, 等. 产虾青素红法夫酵母的发酵工艺优化 [J]. 饲料博览, 2021(12):13−18. DOI: 10.3969/j.issn.1001-0084.2021.12.003 JIANG W T, PENG L Y, MA J J, et al. Optimization of fermentation process of astaxanthin producing Phaffia rhodozyma [J]. Feed Review, 2021(12): 13−18. (in Chinese) DOI: 10.3969/j.issn.1001-0084.2021.12.003
[12] 张晶. 红法夫酵母菌株筛选及TiO2胁迫提高其虾青素产量的作用机制[D]. 长春: 吉林农业大学, 2022. ZHANG J. Screening of Phaffia rhodozyma strain and the mechanism of Increasing Its astaxanthin production under TiO2 stress[D]. Changchun: Jilin Agricultural University, 2022. (in Chinese)
[13] 祝义伟, 龙勃, 龙勇, 等. 豆渣中营养成分的检测及其含量声称 [J]. 食品研究与开发, 2017, 38(8):117−120. DOI: 10.3969/j.issn.1005-6521.2017.08.027 ZHU Y W, LONG B, LONG Y, et al. Determination and content claim of nutrients in okara [J]. Food Research and Development, 2017, 38(8): 117−120. (in Chinese) DOI: 10.3969/j.issn.1005-6521.2017.08.027
[14] 韩扬, 何聪芬, 董银卯, 等. 响应面法优化超声波辅助酶法制备燕麦ACE抑制肽的工艺研究 [J]. 食品科学, 2009, 30(22):44−49. DOI: 10.3321/j.issn:1002-6630.2009.22.006 HAN Y, HE C F, DONG Y M, et al. Response surface optimization of ultrasonic-assisted enzymatic preparation of ACE inhibitory peptides from oat [J]. Food Science, 2009, 30(22): 44−49. (in Chinese) DOI: 10.3321/j.issn:1002-6630.2009.22.006
[15] 倪辉, 何国庆, 杨远帆, 等. 法夫酵母虾青素提取工艺的优化研究 [J]. 农业工程学报, 2004, 20(2):204−208. DOI: 10.3321/j.issn:1002-6819.2004.02.049 NI H, HE G Q, YANG Y F, et al. Optimization of condition for extracting astaxanthin from Phaffia rhodozyma [J]. Transactions of the Chinese Society of Agricultural Engineering, 2004, 20(2): 204−208. (in Chinese) DOI: 10.3321/j.issn:1002-6819.2004.02.049
[16] STOKLOSA R J, JOHNSTON D B, NGHIEM N P. Phaffia rhodozyma cultivation on structural and non-structural sugars from sweet Sorghum for astaxanthin generation [J]. Process Biochemistry, 2019, 83: 9−17. DOI: 10.1016/j.procbio.2019.04.005
[17] MIAO L L, CHI S, WU M R, et al. Deregulation of phytoene-β-carotene synthase results in derepression of astaxanthin synthesis at high glucose concentration in Phaffia rhodozyma astaxanthin-overproducing strain MK19 [J]. BMC Microbiology, 2019, 19(1): 133. DOI: 10.1186/s12866-019-1507-6
[18] 王严飞, 刘燕青, 陶正国, 等. 玉米黄素转化为虾青素的工艺参数研究 [J]. 天然产物研究与开发, 2014, 26(2):278−282. WANG Y F, LIU Y Q, TAO Z G, et al. Study on technical parameters of converting Zeaxanthin into astaxanthin [J]. Natural Product Research and Development, 2014, 26(2): 278−282. (in Chinese)
[19] 刘春利, 沈宁燕, 倪辉, 等. 乙醇对法夫酵母发酵合成虾青素的影响 [J]. 食品与发酵工业, 2018, 44(3):1−7. LIU C L, SHEN N Y, NI H, et al. Effect of ethanol on synthesis of astaxanthin by Phaffia rhodozyma [J]. Food and Fermentation Industries, 2018, 44(3): 1−7. (in Chinese)
[20] YAMANE Y, HIGASHIDA K, NAKASHIMADA Y, et al. Astaxanthin production by Phaffia rhodozyma enhanced in fed-batch culture with glucose and ethanol feeding [J]. Biotechnology Letters, 1997, 19(11): 1109−1111. DOI: 10.1023/A:1018492611011
[21] 黎丽, 窦光鹏, 霍文严, 等. 高产虾青素红法夫酵母的选育和工艺优化 [J]. 中国食品添加剂, 2014, 25(9):140−146. DOI: 10.3969/j.issn.1006-2513.2014.09.014 LI L, DOU G P, HUO W Y, et al. Screening and optimization of a high-yield astaxanthin-producing Phaffia rhodozyma [J]. China Food Additives, 2014, 25(9): 140−146. (in Chinese) DOI: 10.3969/j.issn.1006-2513.2014.09.014
[22] 王雪, 孙美娟, 刘军贤, 等. 激光镊子拉曼光谱法优化红法夫酵母合成虾青素条件 [J]. 光散射学报, 2013, 25(2):152−157. DOI: 10.3969/j.issn.1004-5929.2013.02.009 WANG X, SUN M J, LIU J X, et al. Condition optimization of astaxanthin production in Phaffia rhodozyma using laser tweezers Raman spectroscopy [J]. The Journal of Light Scattering, 2013, 25(2): 152−157. (in Chinese) DOI: 10.3969/j.issn.1004-5929.2013.02.009
[23] 徐建春, 孙翰, 张睿钦, 等. 响应面分析法优化雨生红球藻产虾青素培养基 [J]. 中国酿造, 2014, 33(12):72−75. DOI: 10.11882/j.issn.0254-5071.2014.12.014 XU J C, SUN H, ZHANG R Q, et al. Optimization of Haematococcus Pluvialis medium producing astaxanthin by response surface methodology [J]. China Brewing, 2014, 33(12): 72−75. (in Chinese) DOI: 10.11882/j.issn.0254-5071.2014.12.014




 下载:
下载: