Isolation, Identification, and Antibacterial Activity of Endophytic Fungi from Paris qiliangiana
-
摘要:目的 从药用植物啟良重楼中分离鉴定内生真菌,研究其对常见病原细菌的抑菌活性,并分析其次级代谢产物,为利用传统药用植物内生菌开发新型抗生素药物提供新的思路。方法 采用平板分离法分离纯化啟良重楼内生真菌,提取其基因组DNA,PCR扩增ITS序列并测序,鉴定内生真菌的种类;采用滤纸片法研究其次级代谢产物对12种供试菌的抑菌活性;采用GC-MS技术分析次级代谢产物的种类。结果 从啟良重楼中分离了2株内生真菌,分别鉴定为Setophoma caverna CLZ1和Psilocybe sp.CLZ2;S. caverna CLZ1对肺炎克雷伯菌(Klebsiella pneumonia ATCC 13883)、藤黄微球菌(Micrococcus luteus ATCC 4698)、苏云金芽孢杆菌(Bacillus thuringiensis ATCC 10792)、多耐铜绿假单胞菌(Pseudomonas aeruginosa ATCC 9027)和耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus ATCC 43300,MRSA)等5种供试菌有中度敏感抑制作用,其最小抑菌浓度(MIC)为0.78~3.13 mg·mL−1;Psilocybe sp.CLZ2对MRSA有中度敏感抑制作用,其MIC值为3.13 mg·mL−1。运用GC-MS从S. caverna CLZ1提取物中鉴定出36个化合物,包括吡啶(0.91%)、烟酰胺(0.61%)、邻苯二甲酸二丁酯(1.42%)、油酸甲酯(2.28%)和硬脂酸甲酯(0.83%)等5个抑菌活性化合物;从Psilocybe sp. CLZ2提取物中鉴定出44个化合物,包括吡啶(0.106%)和苯乙醇(0.073%)等2个抑菌活性化合物。结论 从啟良重楼根茎中分离出内生真菌S. caverna CLZ1和Psilocybe sp.CLZ2,发现S. caverna CLZ1的次级代谢产物具有广抑菌谱,并从中鉴定出5个可能具有抑菌活性的次生代谢产物。Abstract:Objective Endophytes from the medicinal Paris qiliangiana plants were isolated to identify effective antipathogenic metabolites secreted.The in vitro activity of their secondary metabolites might lead to the development of new antibiotics for disease control on plants.Method Endophytic fungi of P. qiliangiana plants were isolated in a disc diffusion method and identified by ITS gene sequencing. The secondary metabolites from each isolate were obtained by filter paper separation and tested for antibacterial activity against 12 pathogens. Active components were analyzed by GC-MS.Results Setophoma caverna CLZ1 and Psilocybe sp. CLZ2 were the two functional endophytic fungi identified. The former showed a broad spectrum against the tested gram-negative and gram-positive bacteria including Klebsiella pneumonia ATCC 13883, Micrococcus luteus ATCC 4698, Bacillus thuringiensis ATCC 10792, Pseudomonas aeruginosa ATCC 9027, and Staphylococcus aureus ATCC 43300. Their intermediate degree of bacteriostatic activities on the pathogens had the MICs ranging from 0.78 to 3.13 mg·mL−1. The latter exhibited a similar degree of inhibition against S. aureus at an MIC of 3.13 mg·mL−1. The GC–MS analysis identified 36 chemicals in the S. caverna CLZ1 culture filtrate that included pyridine, nicotinamide, dibutyl phthalate, 9-octadecenoic acid (Z)-, and methyl ester methyl stearate. In the Psilocybe sp. CLZ2 filtrate, 44 compounds, including antibiotic pyridine and phenylethanols, were found.Conclusion The endophytic fungi, S. caverna CLZ1 and Psilocybe sp. CLZ2, isolated from the roots of the new variety of P. qiliangiana displayed significant antibacterial property.
-
Keywords:
- Paris qiliangiana /
- endophytic fungi /
- bacteriostatic activity /
- GC-MS
-
0. 引言
【研究意义】致病细菌引起的严重感染及其对抗生素的耐药性,已成为制药和医学界面临的最大医疗威胁之一,全世界每年约有70万人死于耐药菌感染。虽然抗生素耐药性的产生是一种自然进化现象,但在人类预防和对抗疾病的过程中,抗生素的滥用加剧了耐药性的产生。鉴于这一严重的全球威胁,世卫组织发出警告,如果不采取行动,任由致病菌耐药性的持续增加,到2050年耐药性细菌导致的感染死亡人数可能会膨胀到每年1000万人[1]。因此,寻找新型抗生素已成为当前迫切需要解决的问题。【前人研究进展】植物内生真菌为开发新型抗生素提供了新资源,它们在生命周期的某些或所有阶段生活在植物组织中参与保护宿主免受病原体的侵害[2]。研究表明,药用植物内生真菌产生独特的次生代谢物,如阿尼度喹诺酮(Aniduquinolone)、细胞松弛素衍生物(Cytochrysin)、丁香酚衍生物(Eutyscoparol)、顶吡喃酮(Acropyrone),对各种耐药性细菌病原体屎肠球菌(Enterococcus faecium)、耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus ATCC 43300)、多耐铜绿假单胞菌(Pseudomonas aeruginosa ATCC 9027)等都具有显著的抑菌活性[3-7]。此外,药用植物内生真菌能产生与宿主相同或相似的抗肿瘤[8]、抗氧化[9]的次生代谢产物,有成为稀有药材替代物的巨大潜力[10]。啟良重楼(Paris qiliangiana H.Li, J.Yang & Y.H.Wang)是百合科、重楼属的名贵药用植物,是中国科学院昆明植物研究所专家组2017年在湖北省竹溪县境内发现的重楼属新种[1, 9]。重楼具有消肿止痛、清热解毒、凉肝定惊之功效[11],现代药理学研究表明,甾体皂苷类、黄酮类、三萜类和脂肪酸类等化合物是其主要活性成分,具有抗菌[12]、抗病毒[13]、止血[14]、镇痛抗炎[15]、抗肿瘤[16]和免疫调节[17]等重要药理作用,为我国重要的名贵中药材。【本研究切入点】然而啟良重楼内生真菌及其代谢产物的研究还有待深入探讨,从啟良重楼中分离鉴定具有抑菌活性的内生菌真菌,有利于开发新的抗菌药物,对缓解当前抗生素耐药性的问题具有重要意义。【拟解决的关键问题】对药用植物啟良根茎内生真菌进行分离鉴定,研究重楼真菌次级代谢产物对12种病原细菌的抑制作用,同时对次级代谢产物进行鉴定,为啟良重楼内生真菌资源开发和新型抗生素药物研发提供科学依据。
1. 材料与方法
1.1 材料与仪器
1.1.1 供试菌及培养基
啟良重楼样品采集于恩施市新塘乡的华中药用植物园(30°10′30.94″ N,109°45′0.88″E),由湖北省农业科学院中药材研究所何美军博士鉴定。12株供试菌包括肺炎克雷伯菌(Klebsiella pneumonia ATCC 13883)、金黄色葡萄球菌(Staphylococcus aureus ATCC 29213)、枯草芽孢杆菌(Bacillus subtilis ATCC 19659)、藤黄微球菌(Micrococcus luteus ATCC 4698)、苏云金芽孢杆菌(Bacillus thuringiensis ATCC 10792)、粪链球菌(Enterococcus faecalis ATCC 29212)、耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus ATCC 43300,MRSA)、多耐铜绿假单胞菌(Pseudomonas aeruginosa ATCC 9027)、大肠杆菌(Enterococcus coli ATCC 25922)、耐甲氧西林表皮葡萄球菌(Staphylococcus epidermidis ATCC 12228,MRSE)、溶藻弧菌(Vibrio alginolyticus XSBZ14)和鲍曼不动杆菌(Acinetobacter bammannii ATCC 19606),由中国科学院热带海洋生物资源与生态重点实验室提供。PDA培养基:马铃薯200 g,葡萄糖20 g ,蒸馏水1000 mL,琼脂20 g,pH 7.2~7.4,121 ℃灭菌30 min。
1.1.2 试剂及仪器
葡萄糖、卡那霉素(Kanamycin,Kan)、酵母提取物、琼脂,均购自生工生物工程(上海)股份有限公司。无水乙醇、乙酸乙酯、二甲基亚砜、氯化钠、次氯酸钠溶液,均为国产分析纯。HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm,安捷伦科技有限公司)、酶标仪(北京华安麦科生物技术有限公司)、CR-80CO2培养箱(广州市康恒仪器有限公司)、德国SIGMA离心机(希格玛实验室离心机公司)、BC-R208型旋转蒸发仪(上海贝凯生物化工设备有限公司)、电子天平(上海佑科仪器仪表有限公司)、Q5200DE型数控超声波清洗器(昆山市超声仪器有限公司)、THZ-B气浴恒温振荡器(常州杰博森仪器有限公司)、HDL超净工作台(北京东联哈尔仪器制造有限公司)、立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂)、真空干燥箱(上海一恒科学仪器有限公司)等。
1.2 内生真菌的分离与鉴定
内生菌分离鉴定采用YU等[7]的方法并稍做调整,选取5年生的啟良重楼根茎洗净,消毒并用无菌水冲洗干净。选取约1 g处理好的根茎于2 mL无菌水中研磨成悬浮液,涂布PDA平板,(28±2) ℃培养7 d 。根据菌落形态颜色等特征,用灭菌竹签挑取单菌落接种于PDA 培养基上,28 ℃恒温培养纯化,直至分离纯化出形态相同的单一菌落[18]。挑取单克隆菌落接入液体PDA培养基,28 ℃、180 r·min−1培养24~48 h,用CTAB法提取全基因组DNA,在37 ℃下TE缓冲液溶解DNA样品,并于−20 ℃下保存。用基因组DNA为模板,ITS 1、ITS 4为引物进行ITS PCR扩增。扩增产物送上海生工生物工程有限公司测序,将测序结果在GenBank(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中BLSAT分析, 选择相似度>90% 的序列进行分子系统发育关系分析,运用MEGA-X 10.2.2软件(https://www.megasoftware.net/),选用邻接法(Neighbour-Joining)构建系统发育树。
1.3 真菌次级代谢产物的活性评价
1.3.1 内生真菌次级代谢产物制备
将PDA固体培养基上培养7 d的真菌菌丝体用灭菌竹签刮到液体PDA培养基中(接种量:50 mL接种一个固体平板),28 ℃、200 r·min−1发酵14 d;发酵后的菌体和发酵液加等体积乙酸乙酯90 W条件下超声萃取30 min,萃取3次;40 ℃、0.8 MPa减压浓缩至浸膏,获得真菌次级代谢产物。真菌次级代谢产物0.5 g加5 mL的DMSO配制成100 mg·mL−1的母液,置于4 ℃冰箱备用。
1.3.2 抑菌活性试验
采用侯敏娜等[19] 的方法(稍做调整)测试啟良重楼内生真菌抑菌活性。试验组100 mg·mL−1啟良重楼内生真菌提取物,阳性对照卡那霉素(25 mg·mL−1)、阴性对照DMSO,分别取10 μL滴加于滤纸片(直径为8.00 mm)上,倒置在37 ℃培养箱中,12 h后测量每个平板的抑菌圈直径,拍照并记录。抗生素药敏标准如下:高敏(抑菌圈直径≥20 mm)、中敏(10~20 mm)、轻敏或耐药(≤10 mm)。采用微量肉汤稀释法在96孔板中制备成等比梯度的样品稀释液,除空白对照小孔外,每个小孔再加100 μL菌液,混匀后测定吸光值,37 ℃培养16 h后再次测定吸光值 ,参照美国临床和实验室标准化协会(CLSI)M07-A10[20]的方法进行,并根据CLSI M100-S25[21]标准,计算最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimal bactericide concentration,MBC)。
1.3.3 啟良重楼内生真菌代谢产物GC-MS分析
GC条件:HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序为初始温度80 ℃,以3 ℃·min−1升至280 ℃,保持40 min;进样口温度250 ℃;柱流量为1.0 mL·min−1;柱前压100 kPa;分流比20∶1;进样量2.0 μL;载气为高纯氦气。MS条件:电离方式EI;电子能量70;离子源温度230 ℃;传输线温度250 ℃;四极杆温度150 ℃;质量扫描范围为m/z 35~500;采用NIST11和wiley7n.l标准谱库检索鉴定挥发性成分,采用面积归一化法对挥发油成分进行定量分析。样品处理:抑菌活性次级代谢产物乙酸乙酯充分溶解,13 000 r·min−1离心10 min,进样分析,并以溶剂乙酸乙酯作为对照。
1.4 数据分析
所有试验数据用SPSS 19.0 软件进行统计分析,试验数据以“平均值±标准偏差”表示。P<0.05,表明具有显著性差异,P<0.01,表明具有极显著性差异。
2. 结果与分析
2.1 内生菌形态学与分子生物学鉴定
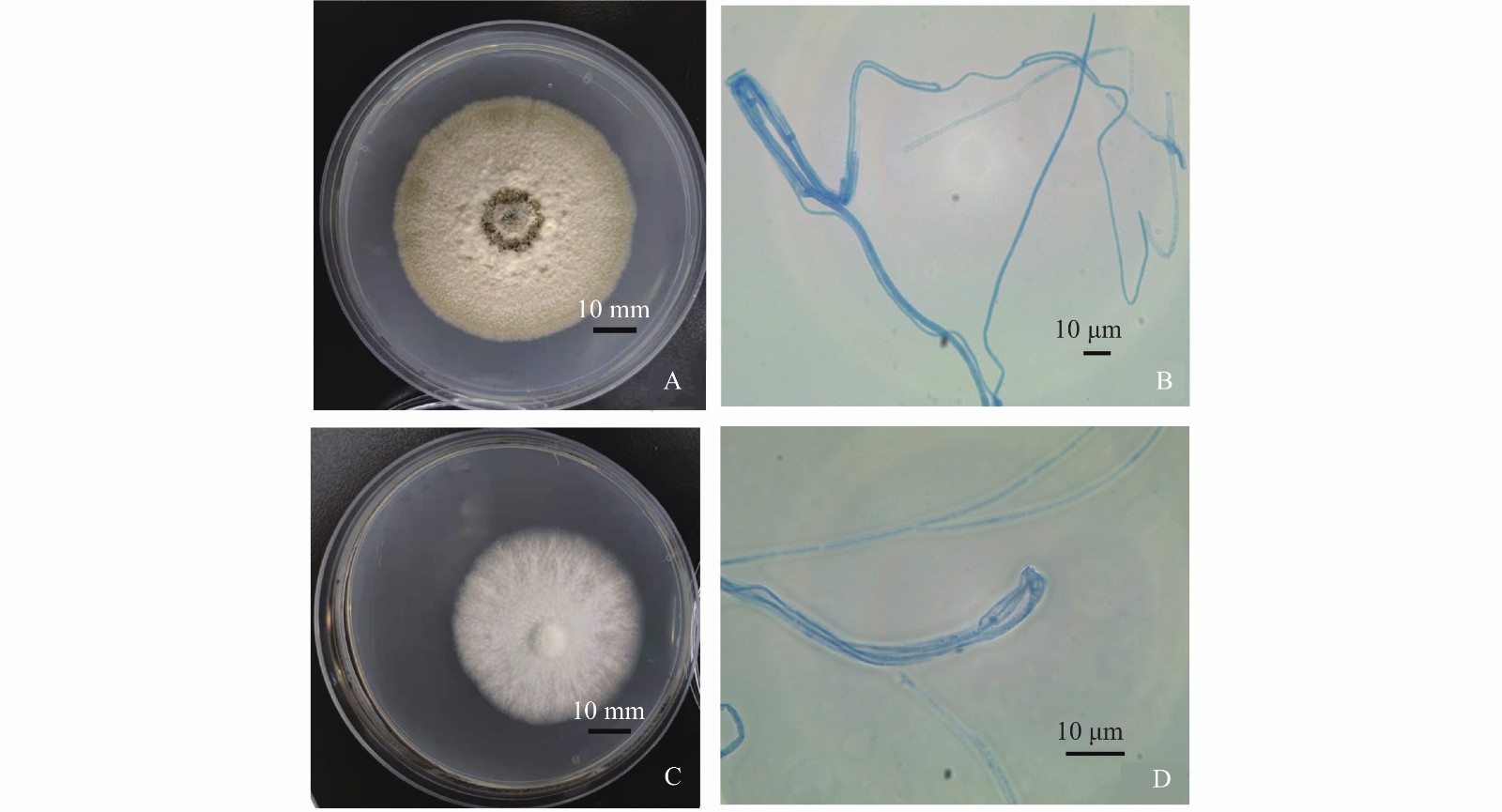
从啟良重楼中分离到2株内生菌。CLZ1的菌落为规则的圆形,边缘清晰;菌落由里向外为米黄色、棕褐色、米黄色的交替环形;菌丝呈质地均匀的细绒毛状,生长速度为3.27 mm·d−1 (图1-A),在100× 油镜下,菌丝隔膜不明显,排列无规则,弯曲度高,呈现丝带舞动形状(图1-B),与Setophoma属真菌的菌落形态学特征基本一致[22]。CLZ2的菌落为规则的圆形,边缘呈雪白色毛絮状,质地由内向外逐渐疏松,生长速度为3.75 mm·d−1(图1-C)。在100×油镜下,菌丝隔膜不明显,菌丝较粗,分支少,弯曲度较低,呈笤帚状(图1-D)。与Psilocybe属真菌的菌落形态学特征基本一致[23]。
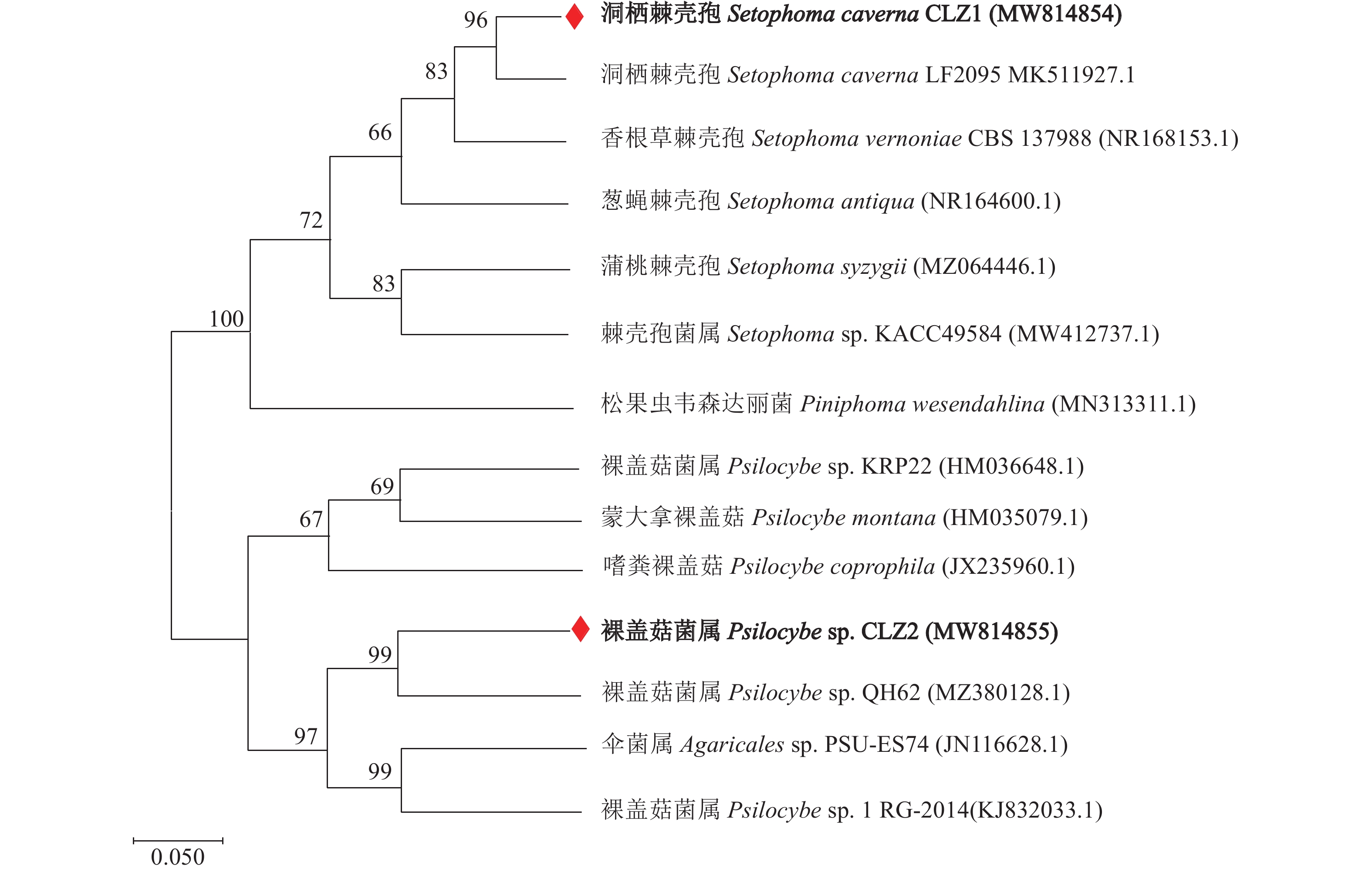
提取啟良重楼2个内生真菌的基因组DNA,PCR扩增其ITS并测序,将2个ITS的序列上传至GenBank(https://submit.ncbi.nlm.nih.gov/),获得基因序列ID分别为MW814854(CLZ1)和MW814855(CLZ2)。应用MEGA-x 10.2.2软件,选择邻接法,利用极大似估计法构建内生菌系统发育树(进行1000次自展检测,Bootstrap值≥60%)基因组的遗传变异度为0.5(图2)。ITS序列进化树分析显示,与NCBI数据库筛选到的6个同源菌种相比,CLZ1与Setophoma caverna isolate LF2095(MK511927.1)在系统发育树上属同一分支,序列相似性达99.61%,结合其形态特征鉴定为刚毛藻属真菌Setophoma caverna CLZ1;与NCBI数据库筛选到的6个同源菌种相比,CLZ2与Psilocybe sp. QH62(MZ380128.1)在系统发育树上聚为一支,且同源性达到100%,结合其形态特征鉴定为裸盖伞属Psilocybe sp.CLZ2。
2.2 内生菌次级代谢产物抑菌活性分析
2种内生真菌对12种供试菌有不同的抑菌活性,其中S. caverna CLZ1提取物有更广的抑菌谱,对藤黄微球菌、肺炎克雷伯菌、苏云金芽孢杆菌、多耐铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌等5种供试菌有中度敏感抑制作用;2种内生真菌提取物对耐甲氧西林金黄色葡萄球菌有中度敏感抑制作用(抑菌圈直径≥11.82 mm),显著优于抗生素Kan(无抑菌圈形成);但是抗生素Kan对其他11种供试菌的抑制作用显著强于2种内生真菌提取物(表1)。
表 1 内生真菌的抑菌圈直径Table 1. Diameter of inhibition zone of endophytic fungi ( n = 3)供试菌
Strains抑菌圈直径 Diameter of inhibition zone/mm 卡那霉素 Kan 洞栖棘壳孢CLZ1
S.caverna.CLZ1裸盖菇菌属CLZ2
Psilocybe sp.CLZ2肺炎克雷伯菌 K.pneumonia 23.81±0.18 a 11.84±0.08 b 8.62±0.04 c 金黄色葡萄球菌 S.aureus 17.06±0.08 a — — 粪链球菌 E. faecalis 29.21±0.02 a — — 枯草芽孢杆菌 B. subtilis 25.74±0.70 a 8.54±0.08 b — 藤黄微球菌 M. luteus 26.49±0.15 a 11.79±0.30 b — 苏云金芽孢杆菌B. thuringiensis 27.14±0.01 a 11.56±0.29 b 9.26±0.13 c 耐甲氧西林金黄色葡萄球菌 MRSA — 12.15±0.30 a 11.82±0.42 a 多耐铜绿假单胞菌 P.aeruginosa 26.06±0.20 a 11.36±0.02 b 9.80±0.04 c 大肠杆菌 E. coli 15.95±0.30 a — — 耐甲氧西林表皮葡萄球菌 MRSE 29.06±0.19 a — 8.70±0.02 b 溶藻弧菌 I.alginolyticus 21.78±0.03 a 8.33±0.16 b 8.48±0.02 b 鲍曼不动杆菌 C.bammannii 24.30±0.15 a 8.27±0.19 b — 同行数据后不同小写字母表示差异显著(P<0.05)。
Data with different lowercase letters in the same line mean significant difference at 0.05 level.S. caverna CLZ1对肺炎克雷伯菌、藤黄微球菌、耐甲氧西林金黄色葡萄球菌、多耐铜绿假单胞菌、苏云金芽孢杆菌、鲍曼不动杆菌、枯草芽孢杆菌和溶藻弧菌8种供试菌有抑制效果,MIC值分别为0.78、1.56、1.56、1.56 、3.13、3.13、6.25和6.25 mg·mL−1;Psilocybe sp.CLZ2对苏云金芽孢杆菌、肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌、多耐铜绿假单胞菌、耐甲氧西林表皮葡萄球菌和溶藻弧菌6种供试菌有抑制效果,MIC值为1.56、3.13、3.13、6.25、12.5和12.5 mg·mL−1。2种真菌对耐甲氧西林金黄色葡萄球菌均有中度敏感的抑制作用,其MIC分别为1.56 、3.13 mg·mL−1,而Kan对该菌无抑制作用(表2)。
表 2 内生真菌的MIC和MBCTable 2. MICs and MBCs of endophytic fungi供试菌
Strains最低抑菌质量浓度 MIC/(mg·mL−1) 最低杀菌质量浓度 MBC/(mg·mL−1) 洞栖棘壳孢
CLZ1 S. caverna.
CLZ1裸盖菇菌属
CLZ2 Psilocybe sp.
CLZ2卡那霉素
Kan洞栖棘壳孢
CLZ1 S. caverna.
CLZ1裸盖菇菌属
CLZ2 Psilocybe sp.
CLZ2卡那霉素
Kan肺炎克雷伯菌 Klebsiella pneumonia 0.78 3.13 0.031 1.56 6.25 0.063 金黄色葡萄球菌 Staphylococcus aureus — — — — — — 粪链球菌 Enterococcus faecalis — — — — — — 枯草芽孢杆菌 Bacillus subtilis 6.25 — 0.016 12.50 — 0.031 藤黄微球菌 Micrococcus luteus 1.56 — 0.002 3.13 — 0.002 苏云金芽孢杆菌 Bacillus thuringiensis 3.13 1.56 0.063 6.25 6.25 0.125 耐甲氧西林金黄色葡萄球菌 Staphylococcus aureus 1.56 3.13 — 3.13 3.13 — 多耐铜绿假单胞菌 Pseudomonas aeruginosa 1.56 6.25 0.063 6.25 6.25 0.063 大肠杆菌 Enterococcus coli — — 0.031 — — 0.031 耐甲氧西林表皮葡萄球菌 staphylococcus epidermidis — 12.50 0.008 — 12.50 0.008 溶藻弧菌 ibrio alginolyticus 6.25 12.50 0.016 12.50 12.50 0.016 鲍曼不动杆菌 cinetobacter bammannii 3.13 — 0.008 6.25 — 0.016 2.3 重楼内生真菌代谢产物GC-MS分析
通过GC-MS技术从啟良重楼内生真菌Setophoma caverna.CLZ1和 Psilocybe sp.CLZ2提取物中共鉴定出68个挥发性成分(匹配度≥85%)。啟良重楼内生真菌S. caverna CLZ1中鉴定出12个酯类化合物,11个烃类化合物,3个醇类化合物,6个醛类化合物和1个酚类化合物,占其相对百分含量分别为32.73%、16.11%、11.08%、7.52%和4.53%(表3),通过查阅文献发现吡啶(0.91%)、烟酰胺(0.61%)、邻苯二甲酸二丁酯(1.42%)、9-十八烯酸甲酯(2.28%)和硬脂酸甲酯(0.83%)是具有抑菌活性的化合物[24-28]。啟良重楼内生真菌Psilocybe sp.CLZ2中鉴定出8个烃类化合物,13个酯类化合物,6个酸类化合物,8个醛类化合物,2个醇类化合物和1个酮类化合物,其相对百分含量分别为19.045%、8.932%、3.51%、1.19%、0.32%和0.16%(表3),通过查阅文献发现吡啶(0.106%)和苯乙醇(0.073%)是具有抑菌活性的化合物[24, 29]。
表 3 啟良重楼内生真菌活性成分GC-MS鉴定Table 3. GC-MS identification on active metabolites of endophytes isolated from P. polyphylla类别
Category出峰时间
The peak
time/min名称
Name含量 Content/% 匹配度
Match/%药理活性
Pharma-
cological
activity参考文献
ReferenceCLZ1 CLZ2 酯类
Esters
(24)2.912 丙酸乙酯 Propanoic acid, ethyl ester 6.37 3.052 96.4 2.944 乙酸正丙酯 n-Propyl acetate — 2.618 95.2 3.079 甲酸丁酯 Formic acid, butyl ester — 0.088 90.7 3.089 丙酮酸甲酯 Propanoic acid, 2-oxo-, methyl ester 4.83 — 86.5 4.825 乙酸丁酯 Acetic acid,butyl ester — 0.091 90.5 5.803 1,2-乙二醇单乙酸酯 1,2-Ethanediol, monoacetate — 0.300 85.7 13.287 泛内酯 Pantolactone 0.42 0.173 90.9 16.151 甘油单乙酸酯 1,2,3-Propanetriol, 1-acetate 1.16 — 92.3 28.961 3-氯-丙酸,4-甲酰基苯酯
Propanoic acid, 3-chloro-, 4-formylphenyl ester— 0.076 91.8 30.671 癸酸乙酯 Decanoic acid, ethyl ester — 0.071 90.5 33.230 避蚊酯 Dimethyl phthalate 0.42 — 91.3 36.189 月桂酸甲酯 Dodecanoic acid, methyl ester — 0.163 86.8 39.063 月桂酸乙酯 Dodecanoic acid, ethyl ester — 0.179 88.2 43.407 2,4-二羟基-3,6-二甲基苯甲酸甲酯
Benzoic acid, 2,4-dihydroxy-3,6-dimethyl-, methyl ester6.01 — 96.7 49.326 邻苯二甲酸二异丁酯
1,2-Benzenedicarboxylic acid, bis(2-methylpropyl) ester2.08 0.404 91.5 51.276 棕榈酸甲酯
Hexadecanoic acid, methyl ester— 0.881 92.2 51.286 14-甲基十五烷酸甲酯
Pentadecanoic acid, 14-methyl-, methyl ester4.71 — 97.8 52.526 邻苯二甲酸二丁酯 Dibutyl phthalate 1.42 — 95.3 抑菌 [30-31] 53.584 十六酸乙酯 Hexadecanoic acid, ethyl ester — 0.836 89.4 56.805 亚油酸甲酯
9,12-Octadecadienoic acid, methyl ester1.06 — 98.6 57.003 油酸甲酯
9-Octadecenoic acid (Z)-, methyl ester2.28 — 96.7 抑菌 [27] 57.831 硬脂酸甲酯 Methyl stearate 0.83 — 98.2 抑菌 [28] 66.629 4,5-二羧基-γ-十五内酯 Spiculesporic acid — 0.292 87.4 68.820 2-棕榈酰甘油
Hexadecanoic acid, 2-hydroxy-1-(hydroxymethyl)ethyl ester2.31 — 89.7 醛类
Aldehyde
(13)4.451 正己醛 Hexanal — 0.385 87.5 7.640 2-甲基-2-己烯醛 2-Hexenal, 2-methyl- — 0.043 87.6 9.761 (Z)-2-庚烯醛 (Z)-2-Heptenal 3.41 0.405 96.4 13.757 苯乙醛 Benzeneacetaldehyde — 0.118 92 14.500 (E)-2-辛烯醛 (E)-2-Octenal 0.90 85.0 16.792 壬醛 Nonanal 0.38 0.075 86.9 18.875 2-壬烯醛,(E)- 2-Nonenal, (E)- 0.011 86.7 21.765 癸醛 Decanal 0.217 87.5 22.727 5-羟甲基糠醛
5-Hydroxymethylfurfural0.264 89.5 24.442 2-癸烯醛,(Z) 2-Decenal, (Z)- 5.77 95.0 26.600 十一醛 Undecanal 0.44 0.078 94.2 26.995 (E,E) -2,4-癸二烯醛 (E,E)- 2,4-Decadienal 1.85 0.307 91.1 31.216 十二醛 Dodecanal 0.54 92.8 烃类
Hydrocarbons
(17)3.18 1,1-二乙氧基乙烷 1,1-diethoxy-Ethane 0.09 0.098 90.2 3.789 甲苯 Toluene 0.073 89.6 4.376 正辛烷 Octane 3.84 — 94.9 6.166 乙苯 Ethylbenzene — 0.877 89.8 11.877 八甲基环四硅氧烷 Cyclotetrasiloxane, octamethyl- — 0.089 92.9 30.815 十四烷 Tetradecane 0.36 — 90.6 34.977 十二烷 Dodecane — 0.503 91.6 35.666 2,4-二(1,1-二甲基乙基)-苯酚
2,4-bis(1,1-dimethylethyl)-Phenol4.53 — 93.6 36.852 正十九烷 Nonadecane 0.32 — 85.6 38.946 十六烯 Cetene 1.57 — 91.9 39.234 1-十六烷 Hexadecane 0.68 — 91.2 43.535 正十七烷 Heptadecane 2.47 0.673 90.6 46.585 十八烯1-Octadecene 1.75 0.669 94.8 60.037 二十二烷 Docosane 1.53 3.399 94.3 63.045 正二十三烷 Tricosane — 6.288 96.7 65.846 二十四烷 Tetracosane 1.83 7.326 98.6 68.585 二十烷 Eicosane 1.67 — 91.3 醇类
Alcohols
(4个)3.981 2,3-丁二醇 2,3-Butanediol — 0.247 92.3 16.685 3-吡啶醇 3-Pyridinol 0.54 — 85.2 17.128 苯乙醇 Phenylethyl Alcohol — 0.073 85.5 抑菌 [29] 31.696 2,5-二甲基-1,4-苯二醇
2,5-dimethyl-1,4-Benzenediol9.38 — 92.8 酸类
Acids
(5)24.944 壬酸 Nonanoic acid — 0.082 85.5 29.704 正癸酸 n-Decanoic acid — 0.108 92.9 33.727 十一烷酸 Undecanoic acid — 0.113 87.9 37.872 十二烷酸 Dodecanoic acid — 0.226 89.1 45.987 十四烷酸 Tetradecanoic acid — 2.686 99.1 其他
Others
(4)3.393 吡啶 Pyridine 0.91 0.106 92.3 抑菌 [24] 11.359 2-戊基呋喃 Furan, 2-pentyl- — 0.061 90.9 14.831 苯乙酮 Acetophenone — 0.160 86.4 30.340 烟酰胺 Niacinamide 0.61 — 87.8 抑菌 [25] 3. 讨论与结论
从药用植物中筛选内生菌用于生产具有药用价值的生物活性化合物,已成为新药开发的重要来源之一[32]。国内外对重楼属内生菌已有了系列的研究,程媛媛等[33]从华重楼根状茎中分离出1株华重楼内生菌PCE45,发现其生产的抗菌肽PCP-1对玉米弯孢病菌、稻瘟病菌、松赤枯病菌、镰刀霉菌和玉米纹枯病菌显示强的抗菌活性;施蕊等[34]从滇重楼块茎中分离得到8株对立枯丝核菌、尖孢镰刀菌、烟草黑胫病菌等植物病原菌有抑制作用的内生真菌;Hu等[35]从云南重楼中分离得到了产二苯醚化合物的内生真菌,对耐甲氧西林金黄色葡萄球菌有抑菌效果,抑菌圈直径为(10.8±2.0)mm。
本研究首次从啟良重楼中分离鉴定了S. caverna CLZ1和Psilocybe sp.CLZ2两种内生真菌,发现S. caverna CLZ1提取物对藤黄微球菌、苏云金芽孢杆菌、肺炎克雷伯菌、枯草芽孢杆菌、耐甲氧西林金黄色葡萄球菌、溶藻弧菌、多耐铜绿假单胞菌和鲍曼不动杆菌等8种致病菌有抑菌活性;Psilocybe sp. CLZ2提取物对肺炎克雷伯菌、苏云金芽孢杆菌、耐甲氧西林金黄色葡萄球菌、多耐铜绿假单胞菌、耐甲氧西林表皮葡萄球菌和溶藻弧菌等6种致病菌有抑菌活性。其中,2株内生真菌对耐甲氧西林表皮葡萄球菌都具有中度抑菌活性,其抑菌圈直径分别为(12.15±0.30)、(11.82±0.42) mm。
通过GC/MS分析在S. caverna CLZ1的乙酸乙酯提取物中发现了吡啶、烟酰胺、邻苯二甲酸二丁酯、油酸甲酯和硬脂酸甲酯等36种化合物;在Psilocybe sp.CLZ2提取物中发现了吡啶和苯乙醇等44种化合物。已有研究表明,检测出的部分化合物具有抑菌活性:蔡丽华等[24]发现吡啶对大肠杆菌有抑制活性;张志斌等[26]发现邻苯二甲酸二丁酯对小麦赤霉菌、水稻纹枯病菌、油菜菌核菌等7种农作物常见致病菌以及金黄色葡萄球菌有抑制活性;普特等[25]发现烟酰胺对番茄疮痂病菌、烟草青枯病菌和丁香假单胞杆菌有抑制活性;方静凡等[29]发现苯乙醇对苹果青霉病、苹果灰霉病、柑橘绿霉病、柑橘炭疽病、柑橘酸腐病、柑橘黑腐病、芒果炭疽病、芒果蒂腐病、番茄早疫病、番茄根霉腐烂病、葡萄灰霉病、葡萄根霉腐烂病均具有良好的防治效果。因此推测S. caverna CLZ1和Psilocybe sp.CLZ2提取物中被鉴定的如上抑菌活性化合物可能对12株供试菌的生长起主要抑制作用,同时S. caverna CLZ1中被鉴定的抑菌化合物种类比Psilocybe sp. CLZ2更为丰富,含量也较后者更高,该鉴定结果与该真菌拥有更强的抑菌效果相一致。本研究结果对解决耐药菌株的问题具有重要现实意义,为进一步开发重楼属药用植物资源,尤其是开发替代抗生素的抗菌药物具有指导意义。
-
表 1 内生真菌的抑菌圈直径
Table 1 Diameter of inhibition zone of endophytic fungi ( n = 3)
供试菌
Strains抑菌圈直径 Diameter of inhibition zone/mm 卡那霉素 Kan 洞栖棘壳孢CLZ1
S.caverna.CLZ1裸盖菇菌属CLZ2
Psilocybe sp.CLZ2肺炎克雷伯菌 K.pneumonia 23.81±0.18 a 11.84±0.08 b 8.62±0.04 c 金黄色葡萄球菌 S.aureus 17.06±0.08 a — — 粪链球菌 E. faecalis 29.21±0.02 a — — 枯草芽孢杆菌 B. subtilis 25.74±0.70 a 8.54±0.08 b — 藤黄微球菌 M. luteus 26.49±0.15 a 11.79±0.30 b — 苏云金芽孢杆菌B. thuringiensis 27.14±0.01 a 11.56±0.29 b 9.26±0.13 c 耐甲氧西林金黄色葡萄球菌 MRSA — 12.15±0.30 a 11.82±0.42 a 多耐铜绿假单胞菌 P.aeruginosa 26.06±0.20 a 11.36±0.02 b 9.80±0.04 c 大肠杆菌 E. coli 15.95±0.30 a — — 耐甲氧西林表皮葡萄球菌 MRSE 29.06±0.19 a — 8.70±0.02 b 溶藻弧菌 I.alginolyticus 21.78±0.03 a 8.33±0.16 b 8.48±0.02 b 鲍曼不动杆菌 C.bammannii 24.30±0.15 a 8.27±0.19 b — 同行数据后不同小写字母表示差异显著(P<0.05)。
Data with different lowercase letters in the same line mean significant difference at 0.05 level.表 2 内生真菌的MIC和MBC
Table 2 MICs and MBCs of endophytic fungi
供试菌
Strains最低抑菌质量浓度 MIC/(mg·mL−1) 最低杀菌质量浓度 MBC/(mg·mL−1) 洞栖棘壳孢
CLZ1 S. caverna.
CLZ1裸盖菇菌属
CLZ2 Psilocybe sp.
CLZ2卡那霉素
Kan洞栖棘壳孢
CLZ1 S. caverna.
CLZ1裸盖菇菌属
CLZ2 Psilocybe sp.
CLZ2卡那霉素
Kan肺炎克雷伯菌 Klebsiella pneumonia 0.78 3.13 0.031 1.56 6.25 0.063 金黄色葡萄球菌 Staphylococcus aureus — — — — — — 粪链球菌 Enterococcus faecalis — — — — — — 枯草芽孢杆菌 Bacillus subtilis 6.25 — 0.016 12.50 — 0.031 藤黄微球菌 Micrococcus luteus 1.56 — 0.002 3.13 — 0.002 苏云金芽孢杆菌 Bacillus thuringiensis 3.13 1.56 0.063 6.25 6.25 0.125 耐甲氧西林金黄色葡萄球菌 Staphylococcus aureus 1.56 3.13 — 3.13 3.13 — 多耐铜绿假单胞菌 Pseudomonas aeruginosa 1.56 6.25 0.063 6.25 6.25 0.063 大肠杆菌 Enterococcus coli — — 0.031 — — 0.031 耐甲氧西林表皮葡萄球菌 staphylococcus epidermidis — 12.50 0.008 — 12.50 0.008 溶藻弧菌 ibrio alginolyticus 6.25 12.50 0.016 12.50 12.50 0.016 鲍曼不动杆菌 cinetobacter bammannii 3.13 — 0.008 6.25 — 0.016 表 3 啟良重楼内生真菌活性成分GC-MS鉴定
Table 3 GC-MS identification on active metabolites of endophytes isolated from P. polyphylla
类别
Category出峰时间
The peak
time/min名称
Name含量 Content/% 匹配度
Match/%药理活性
Pharma-
cological
activity参考文献
ReferenceCLZ1 CLZ2 酯类
Esters
(24)2.912 丙酸乙酯 Propanoic acid, ethyl ester 6.37 3.052 96.4 2.944 乙酸正丙酯 n-Propyl acetate — 2.618 95.2 3.079 甲酸丁酯 Formic acid, butyl ester — 0.088 90.7 3.089 丙酮酸甲酯 Propanoic acid, 2-oxo-, methyl ester 4.83 — 86.5 4.825 乙酸丁酯 Acetic acid,butyl ester — 0.091 90.5 5.803 1,2-乙二醇单乙酸酯 1,2-Ethanediol, monoacetate — 0.300 85.7 13.287 泛内酯 Pantolactone 0.42 0.173 90.9 16.151 甘油单乙酸酯 1,2,3-Propanetriol, 1-acetate 1.16 — 92.3 28.961 3-氯-丙酸,4-甲酰基苯酯
Propanoic acid, 3-chloro-, 4-formylphenyl ester— 0.076 91.8 30.671 癸酸乙酯 Decanoic acid, ethyl ester — 0.071 90.5 33.230 避蚊酯 Dimethyl phthalate 0.42 — 91.3 36.189 月桂酸甲酯 Dodecanoic acid, methyl ester — 0.163 86.8 39.063 月桂酸乙酯 Dodecanoic acid, ethyl ester — 0.179 88.2 43.407 2,4-二羟基-3,6-二甲基苯甲酸甲酯
Benzoic acid, 2,4-dihydroxy-3,6-dimethyl-, methyl ester6.01 — 96.7 49.326 邻苯二甲酸二异丁酯
1,2-Benzenedicarboxylic acid, bis(2-methylpropyl) ester2.08 0.404 91.5 51.276 棕榈酸甲酯
Hexadecanoic acid, methyl ester— 0.881 92.2 51.286 14-甲基十五烷酸甲酯
Pentadecanoic acid, 14-methyl-, methyl ester4.71 — 97.8 52.526 邻苯二甲酸二丁酯 Dibutyl phthalate 1.42 — 95.3 抑菌 [30-31] 53.584 十六酸乙酯 Hexadecanoic acid, ethyl ester — 0.836 89.4 56.805 亚油酸甲酯
9,12-Octadecadienoic acid, methyl ester1.06 — 98.6 57.003 油酸甲酯
9-Octadecenoic acid (Z)-, methyl ester2.28 — 96.7 抑菌 [27] 57.831 硬脂酸甲酯 Methyl stearate 0.83 — 98.2 抑菌 [28] 66.629 4,5-二羧基-γ-十五内酯 Spiculesporic acid — 0.292 87.4 68.820 2-棕榈酰甘油
Hexadecanoic acid, 2-hydroxy-1-(hydroxymethyl)ethyl ester2.31 — 89.7 醛类
Aldehyde
(13)4.451 正己醛 Hexanal — 0.385 87.5 7.640 2-甲基-2-己烯醛 2-Hexenal, 2-methyl- — 0.043 87.6 9.761 (Z)-2-庚烯醛 (Z)-2-Heptenal 3.41 0.405 96.4 13.757 苯乙醛 Benzeneacetaldehyde — 0.118 92 14.500 (E)-2-辛烯醛 (E)-2-Octenal 0.90 85.0 16.792 壬醛 Nonanal 0.38 0.075 86.9 18.875 2-壬烯醛,(E)- 2-Nonenal, (E)- 0.011 86.7 21.765 癸醛 Decanal 0.217 87.5 22.727 5-羟甲基糠醛
5-Hydroxymethylfurfural0.264 89.5 24.442 2-癸烯醛,(Z) 2-Decenal, (Z)- 5.77 95.0 26.600 十一醛 Undecanal 0.44 0.078 94.2 26.995 (E,E) -2,4-癸二烯醛 (E,E)- 2,4-Decadienal 1.85 0.307 91.1 31.216 十二醛 Dodecanal 0.54 92.8 烃类
Hydrocarbons
(17)3.18 1,1-二乙氧基乙烷 1,1-diethoxy-Ethane 0.09 0.098 90.2 3.789 甲苯 Toluene 0.073 89.6 4.376 正辛烷 Octane 3.84 — 94.9 6.166 乙苯 Ethylbenzene — 0.877 89.8 11.877 八甲基环四硅氧烷 Cyclotetrasiloxane, octamethyl- — 0.089 92.9 30.815 十四烷 Tetradecane 0.36 — 90.6 34.977 十二烷 Dodecane — 0.503 91.6 35.666 2,4-二(1,1-二甲基乙基)-苯酚
2,4-bis(1,1-dimethylethyl)-Phenol4.53 — 93.6 36.852 正十九烷 Nonadecane 0.32 — 85.6 38.946 十六烯 Cetene 1.57 — 91.9 39.234 1-十六烷 Hexadecane 0.68 — 91.2 43.535 正十七烷 Heptadecane 2.47 0.673 90.6 46.585 十八烯1-Octadecene 1.75 0.669 94.8 60.037 二十二烷 Docosane 1.53 3.399 94.3 63.045 正二十三烷 Tricosane — 6.288 96.7 65.846 二十四烷 Tetracosane 1.83 7.326 98.6 68.585 二十烷 Eicosane 1.67 — 91.3 醇类
Alcohols
(4个)3.981 2,3-丁二醇 2,3-Butanediol — 0.247 92.3 16.685 3-吡啶醇 3-Pyridinol 0.54 — 85.2 17.128 苯乙醇 Phenylethyl Alcohol — 0.073 85.5 抑菌 [29] 31.696 2,5-二甲基-1,4-苯二醇
2,5-dimethyl-1,4-Benzenediol9.38 — 92.8 酸类
Acids
(5)24.944 壬酸 Nonanoic acid — 0.082 85.5 29.704 正癸酸 n-Decanoic acid — 0.108 92.9 33.727 十一烷酸 Undecanoic acid — 0.113 87.9 37.872 十二烷酸 Dodecanoic acid — 0.226 89.1 45.987 十四烷酸 Tetradecanoic acid — 2.686 99.1 其他
Others
(4)3.393 吡啶 Pyridine 0.91 0.106 92.3 抑菌 [24] 11.359 2-戊基呋喃 Furan, 2-pentyl- — 0.061 90.9 14.831 苯乙酮 Acetophenone — 0.160 86.4 30.340 烟酰胺 Niacinamide 0.61 — 87.8 抑菌 [25] -
[1] YU L, PACHAIYAPPAN S K, JIAO Q, et al. Production of bioactive compounds from callus of Pueraria thomsonii Benth with promising cytotoxic and antibacterial activities [J]. Arabian Journal of Chemistry, 2022, 15(6): 1−11. DOI: 10.1016/j.arabjc.2022.103854
[2] LINH T M, MAI N C, HOE P T, et al. Development of a Cell Suspension Culture System for Promoting Alkaloid and Vinca Alkaloid Biosynthesis Using Endophytic Fungi Isolated from Local Catharanthus roseus [J]. Plants, 2021, 10(4): 1−12. DOI: 10.3390/plants10040672
[3] QLM A, SXY C, TX A, et al. New cytochalasan alkaloids and cyclobutane dimer from an endophytic fungus Cytospora chrysosperma in Hippophae rhamnoides and their antimicrobial activities [J]. Tetrahedron Letters, 2021, 87(1): 1−5. DOI: 10.1016/j.tetlet.2021.153207
[4] WZA D, XLA D, HWA B, et al. Antibacterial secondary metabolites from the endophytic fungus Eutypella scoparia SCBG-8 [J]. Tetrahedron Letters, 2021, 79(1): 1−4. DOI: 10.1016/j.tetlet.2021.153314
[5] ALI W, PENG L, XUPING Z, et al. Two New Anisic Acid Derivatives from Endophytic Fungus Rhizopycnis vagum Nitaf22 and Their Antibacterial Activity [J]. Molecules, 2018, 23(3): 1−6. DOI: 10.3390/molecules23030591
[6] XU Z Y, WU X, LI G, et al. Pestalotiopisorin B, a new isocoumarin derivative from the mangrove endophytic fungus Pestalotiopsis sp. HHL101 [J]. Natural Product Research, 2020, 34(7): 1002−1007. DOI: 10.1080/14786419.2018.1539980
[7] YU L, SARAVANA K P, QUANSHENG T, et al. Diversity and chemical fingerprinting of endo-metabolomes from endophytes associated with Ampelopsis grossedentata (Hand.-Mazz. ) W. T. Wang possessing antibacterial activity against multidrug resistant bacterial pathogens. [J]. Journal of infection and public health, 2021, 14(12): 1917−1926. DOI: 10.1016/j.jiph.2021.10.019
[8] 胡晓峰, 柴海全, 贾林川, 等. 一株太子参内生真菌Aspergillus terreus TZS-201607中抗肿瘤活性代谢产物研究 [J]. 天然产物研究与开发, 2021, 33(7):1156−1164. DOI: 10.16333/j.1001-6880.2021.7.010 HU X F, CHAI H Q, JIA L C, et al. Antitumor secondary metabolites of an endophytic fungus Aspergillus terreus TZS-201607 from Pseudostellaria heterophylla [J]. Natural Product Research and Development, 2021, 33(7): 1156−1164.(in Chinese) DOI: 10.16333/j.1001-6880.2021.7.010
[9] 陈金阳, 陆儒涵, 王玲, 等. 药用植物内生菌抗氧化活性研究进展 [J]. 中草药, 2016, 47(20):3720−3727. DOI: 10.7501/j.issn.0253-2670.2016.20.027 CHEN J Y, LU R H, WANG L, et al. Recent progress in study on anti-oxidant activity of endophytes in medicinal plants [J]. Chinese Traditional and Herbal Drugs, 2016, 47(20): 3720−3727.(in Chinese) DOI: 10.7501/j.issn.0253-2670.2016.20.027
[10] 朱晓松, 陈文慧, 何朋伦, 等. 从微生物转化的方向解决重楼资源不足的展望 [J]. 时珍国医国药, 2017, 28(11):2744−2746. DOI: CNKI:SUN:SZGY.0.2017-11-064 ZHU X S, CHEN W H, HE P L, et al. Prospect of solving the shortage of Paris polyphylla resources from the direction of microbial transformation [J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(11): 2744−2746.(in Chinese) DOI: CNKI:SUN:SZGY.0.2017-11-064
[11] 牛素芳. 重楼的栽培与管理 [J]. 中医研究, 2021, 34(8):51−54. DOI: 10.3969/j.issn.1001-6910.2021.08.16 NIU S F. Cultivation and management of Paris polyphylla [J]. Traditional Chinese Medicinal Research, 2021, 34(8): 51−54.(in Chinese) DOI: 10.3969/j.issn.1001-6910.2021.08.16
[12] 孟婷婷, 李君, 李露露, 等. 重楼抑菌效果的研究 [J]. 科技风, 2018(11):166. DOI: 10.19392/j.cnki.1671-7341.201811150 MENG T T, LI J, LI L L, et al. Study on antibacterial effect of Paris polyphylla [J]. Technology Trend, 2018(11): 166.(in Chinese) DOI: 10.19392/j.cnki.1671-7341.201811150
[13] 卢伟, 牟雄军, 杨光义, 等. 中药重楼药理活性研究进展 [J]. 中国药师, 2017, 20(5):896−899. DOI: 10.3969/j.issn.1008-049X.2017.05.036 LU W, MOU X J, YANG G Y, et al. Research advances in pharmacological activities of Paris polyphylla [J]. China Pharmacist, 2017, 20(5): 896−899.(in Chinese) DOI: 10.3969/j.issn.1008-049X.2017.05.036
[14] 尹鸿翔, 文飞燕, 张浩. 彝药“麻补”止血活性物质基础及机理研究 [J]. 世界科学技术-中医药现代化, 2014, 16(1):177−180. DOI: 10.11842/wst.2014.01.033 YIN H X, WEN F Y, ZHANG H. Research on material basis and mechanism for hemostatic activity of yi medicine "ma-bu" [J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2014, 16(1): 177−180.(in Chinese) DOI: 10.11842/wst.2014.01.033
[15] 张媛, 唐大轩, 张莉, 等. 重楼皂苷Ⅰ. Ⅵ及总皂苷镇痛抗炎作用研究 [J]. 四川中医, 2020, 38(5):68−70. DOI: CNKI:SUN:SCZY.0.2020-05-024 ZHANG Y, TANG D X, ZHANG L, et al. Study on analgesic and anti-inflammatory effects of Paris polyphylla saponins Ⅰ, ⅵ and total saponins [J]. Journal of Sichuan of Traditional Chinese Medicine, 2020, 38(5): 68−70.(in Chinese) DOI: CNKI:SUN:SCZY.0.2020-05-024
[16] 张勇, 骆亮生, 储华健, 等. 重楼在抗肿瘤等方面的研究进展 [J]. 全科口腔医学电子杂志, 2019, 6(9):38−39. DOI: CNKI:SUN:QKKQ.0.2019-09-020 ZHANG Y, LUO L S, CHU H J, et al. Research progress of Paris polyphylla in anti-tumor [J]. Electronic Journal of General Stomatology, 2019, 6(9): 38−39.(in Chinese) DOI: CNKI:SUN:QKKQ.0.2019-09-020
[17] 刘功成. 重楼多糖对衰老模型小鼠免疫功能和抗氧化能力的影响[D]. 雅安: 四川农业大学, 2015. LIU G C. The effects of polysaccharides Paris polyphylla on immune function and antioxidant capacities of mice in aging mouse model [D]. Yaan: Sichuan Agricultural University, 2015. (in Chinese)
[18] 许小蓉, 黄之镨, 许玉潇, 等. 昆明西山森林公园天然虫生真菌及其内生真菌的分离鉴定及多样性分析 [J]. 微生物学通报, 2023, 50(1):64−77. DOI: 10.13344/j.microbiol.china.220433 XU X R, HUANG Z P, XU Y X, et al. Isolation, identification, and diversity analysis of natural entomogenous fungi and endophytic fungi in Xishan Forest Park of Kunming [J]. Microbiology China, 2023, 50(1): 64−77.(in Chinese) DOI: 10.13344/j.microbiol.china.220433
[19] 侯敏娜, 成昕玥, 赵明光, 等. 浙贝母挥发油提取工艺优选及抑菌活性实验研究 [J]. 西部林业科学, 2019, 48(1):87−92. DOI: 10.16473/j.cnki.xblykx1972.2019.01.015 HOU M N, CHENG X Y, ZHAO M G, et al. Optimized extraction process of volatile oil from Fritillaria thunbergii miq. and its antibacterial activity [J]. Journal of West China Forestry Science, 2019, 48(1): 87−92.(in Chinese) DOI: 10.16473/j.cnki.xblykx1972.2019.01.015
[20] Clinical and Laboratory Standards Institute. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-Tenth EditionThis document addresses reference methods for the determination of minimal inhibitory concentrations (MICs) of aerobic bacteria by broth macrodilution, broth microdilution, and agar dilution: M07-A10[S]. America: American National Standards Institute, 2015.
[21] Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twenty Fifth Informational Supplement: M100-S25-2015 [S]. America: American National Standards Institute, 2015.
[22] MARIN Y, HERNÁNDEZ-RESTREPO M, GONZÁLEZ I I, et al. Genera of phytopathogenic fungi: GOPHY 3 [J]. Studies in Mycology, 2019, 94(1): 1−124. DOI: 10.1016/j.simyco.2019.05.001
[23] DHANASEKARAN D, LATHA S, SUGANYA P, et al. Taxonomic identification and bioactive compounds characterization of Psilocybe cubensis DPT1 to probe its antibacterial and mosquito larvicidal competency [J]. Microbial Pathogenesis, 2020, 143(1): 1−10. DOI: 10.1016/j.micpath.2020.104138
[24] 蔡丽华, 张立侠. 几种含吡啶双酰胺基双Schiff碱对大肠杆菌的抑菌活性研究 [J]. 化学研究与应用, 2014, 26(3):436−440. DOI: 10.3969/j.issn.1004-1656.2014.03.022 CAI L H, ZHANG L X. Study of antibacterial activity of double Schiff base containing pyridine ring and diamide on E. coli [J]. Chemical Research and Application, 2014, 26(3): 436−440.(in Chinese) DOI: 10.3969/j.issn.1004-1656.2014.03.022
[25] 普特, 杨云海, 王凯博, 等. MTT比色法测定烟酰胺类化合物对植物病原细菌的抑菌活性 [J]. 云南农业大学学报: 自然科学版, 2019, 34(1):15−21. DOI: CNKI:SUN:YNDX.0.2019-01-004 PU T, YANG Y H, WANG K B, et al. Determination of the Nicotinamide Compounds by Using MTTColorimetric Assay against Pathogenic Bacteria [J]. Journal of YunnanAgricultural University (Natural Science), 2019, 34(1): 15−21.(in Chinese) DOI: CNKI:SUN:YNDX.0.2019-01-004
[26] 张志斌, 敖武, 熊瑶瑶, 等. 内生拮抗放线菌FR02的鉴定及抑菌活性物质的分离 [J]. 微生物学通报, 2014, 41(8):1574−1581. DOI: 10.13344/j.microbiol.china.130672 ZHANG Z B, AO W, XIONG Y Y, et al. Identification of antagonistic endophytic actinomycete FRo2 and isolation of its antimicrobial composition [J]. Microbiology China, 2014, 41(8): 1574−1581.(in Chinese) DOI: 10.13344/j.microbiol.china.130672
[27] 张慧芸, 孔保华, 李鑫玲. 桂皮提取物成分分析及抗菌活性的研究 [J]. 食品研究与开发, 2010, 31(3):147−150. DOI: 10.3969/j.issn.1005-6521.2010.03.044 ZHANG H Y, KONG B H, LI X L. Study on volatile components of ethanol extract from Cassia bark and its antimicrobial activities [J]. Food Research and Development, 2010, 31(3): 147−150.(in Chinese) DOI: 10.3969/j.issn.1005-6521.2010.03.044
[28] 薛珺一. 了哥王细胞毒性和抗病毒活性成分研究[D]. 广州: 暨南大学, 2007. XUE J Y. Studies on the cytotoxic and antiviral constituents of Wikstroemia indica (L.)C. A. Mey. [D]. Guangzhou: Jinan University, 2007. (in Chinese)
[29] 方静凡. 苯乙醇对柑橘青霉及生防菌34-9的作用研究[D]. 武汉: 华中农业大学, 2013. FANG J F. Effect of 2-phenylethanol(PEA) on citrus blue mold and biocontrol yeast 34-9[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[30] 杨立宾, 宋瑞清, 邓勋, 等. 哈茨木霉T28发酵液提取物对致病疫霉的抑菌作用及有效成分 [J]. 林业科学, 2013, 49(7):118−122. DOI: 10.11707/j.1001-7488.20130717 YANG L B, SONG R Q, DENG X, et al. Active components of extracts from the fermentation liquid of Trichoderma harzianum strain T28 and their inhibiting activities to Phytophthora infestans [J]. Scientia Silvae Sinicae, 2013, 49(7): 118−122.(in Chinese) DOI: 10.11707/j.1001-7488.20130717
[31] 张丽娟, 李君, 范雪云, 等. 双酚A和邻苯二甲酸二丁酯对人乳腺癌细胞株MCF-7细胞增殖的影响 [J]. 环境与健康杂志, 2005, 22(2):111−113. DOI: 10.3969/j.issn.1001-5914.2005.02.011 ZHANG L J, LI J, FAN X Y, et al. The effect of bisphenol A and dibutyphthlate treated with rat liver S9 on proliferation of MCF-7 cells [J]. Journal of Environment and Health, 2005, 22(2): 111−113.(in Chinese) DOI: 10.3969/j.issn.1001-5914.2005.02.011
[32] 吕彩云, 夏娟, 林永翔, 等. 一株具有拮抗作用黄精内生菌HJ-3的鉴定及抗菌活性研究 [J]. 天然产物研究与开发, 2022, 34(3):399−406. DOI: 10.16333/j.1001-6880.2022.3.006 LYU C Y, XIA J, LIN Y X, et al. Identification and antimicrobial activity of an antagonistic endophytic strain HJ-3 from Polygonatum cyrtonema [J]. Natural Product Research and Development, 2022, 34(3): 399−406.(in Chinese) DOI: 10.16333/j.1001-6880.2022.3.006
[33] 程媛媛, 雍彬, 张超, 等. 华重楼内生菌抗菌肽的分离纯化及其特性 [J]. 微生物学报, 2009, 49(4):498−503. DOI: 10.3321/j.issn:0001-6209.2009.04.014 CHENG Y Y, YONG B, ZHANG C, et al. Purification and characterization of an antimicrobial peptide from Paris polyphylla var. chinensis [J]. Acta Microbiologica Sinica, 2009, 49(4): 498−503.(in Chinese) DOI: 10.3321/j.issn:0001-6209.2009.04.014
[34] 施蕊, 王娟, 叶敏, 等. 滇重楼内生菌分离及其发酵液抑菌活性 [J]. 江苏农业科学, 2017, 45(6):86−88. DOI: 10.15889/j.issn.1002-1302.2017.06.021 SHI R, WANG J, YE M, et al. Isolation of endophytic bacteria from Paris polyphylla var. yunnanensis and antibacterial activity of its fermentation broth [J]. Jiangsu Agricultural Sciences, 2017, 45(6): 86−88.(in Chinese) DOI: 10.15889/j.issn.1002-1302.2017.06.021
[35] HU S S, LIANG M J, MI Q L, et al. Two New Diphenyl Ether Derivatives from the Fermentation Products of an Endophytic Fungus Phomopsis fukushii [J]. Chemistry of Natural Compounds, 2019, 55(3): 428−431. DOI: 10.1007/s10600-019-02706-7




 下载:
下载: