Ovarian Proteomics of Yaks in Pregnancy and Postpartum Anestrus
-
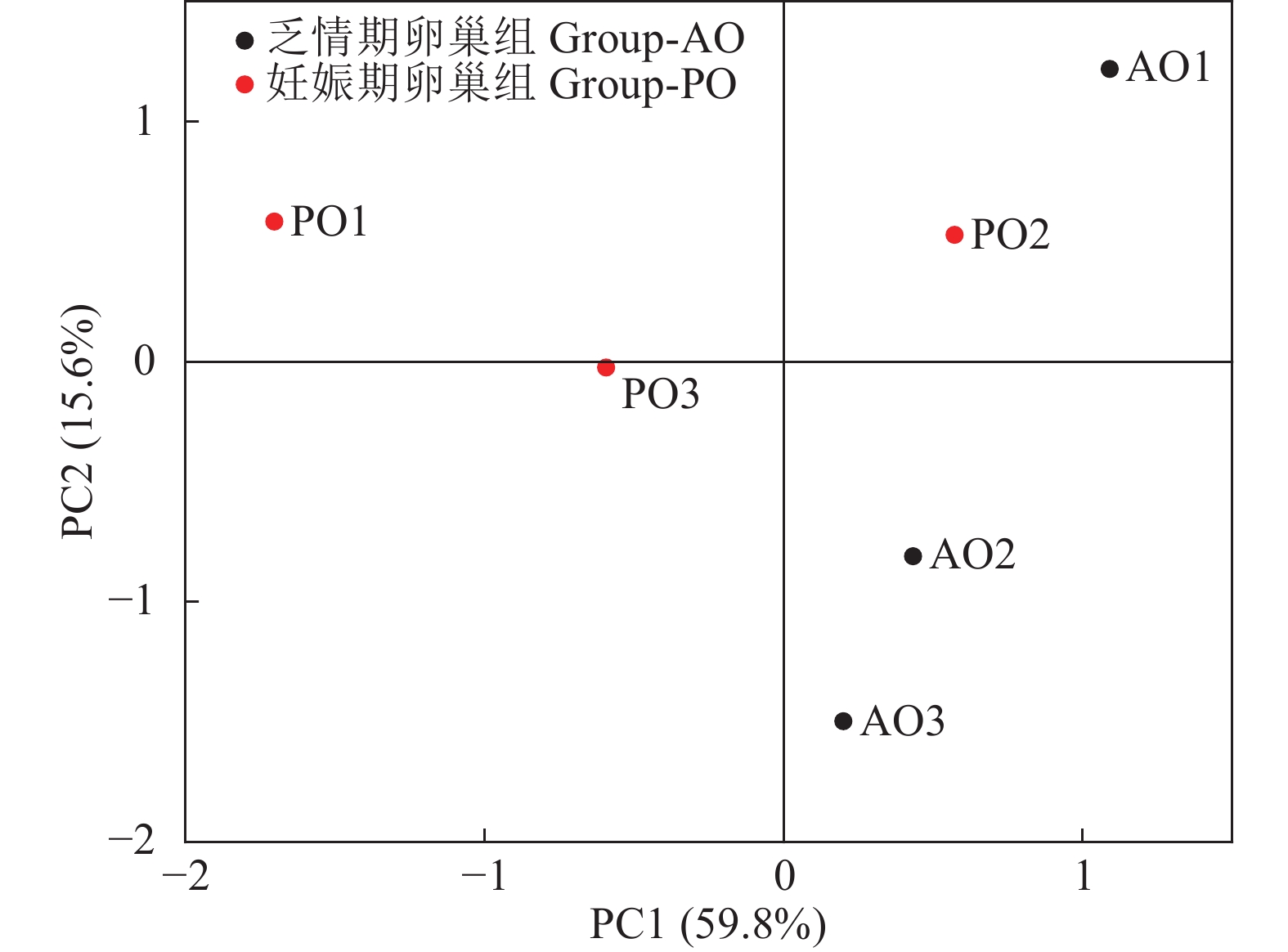
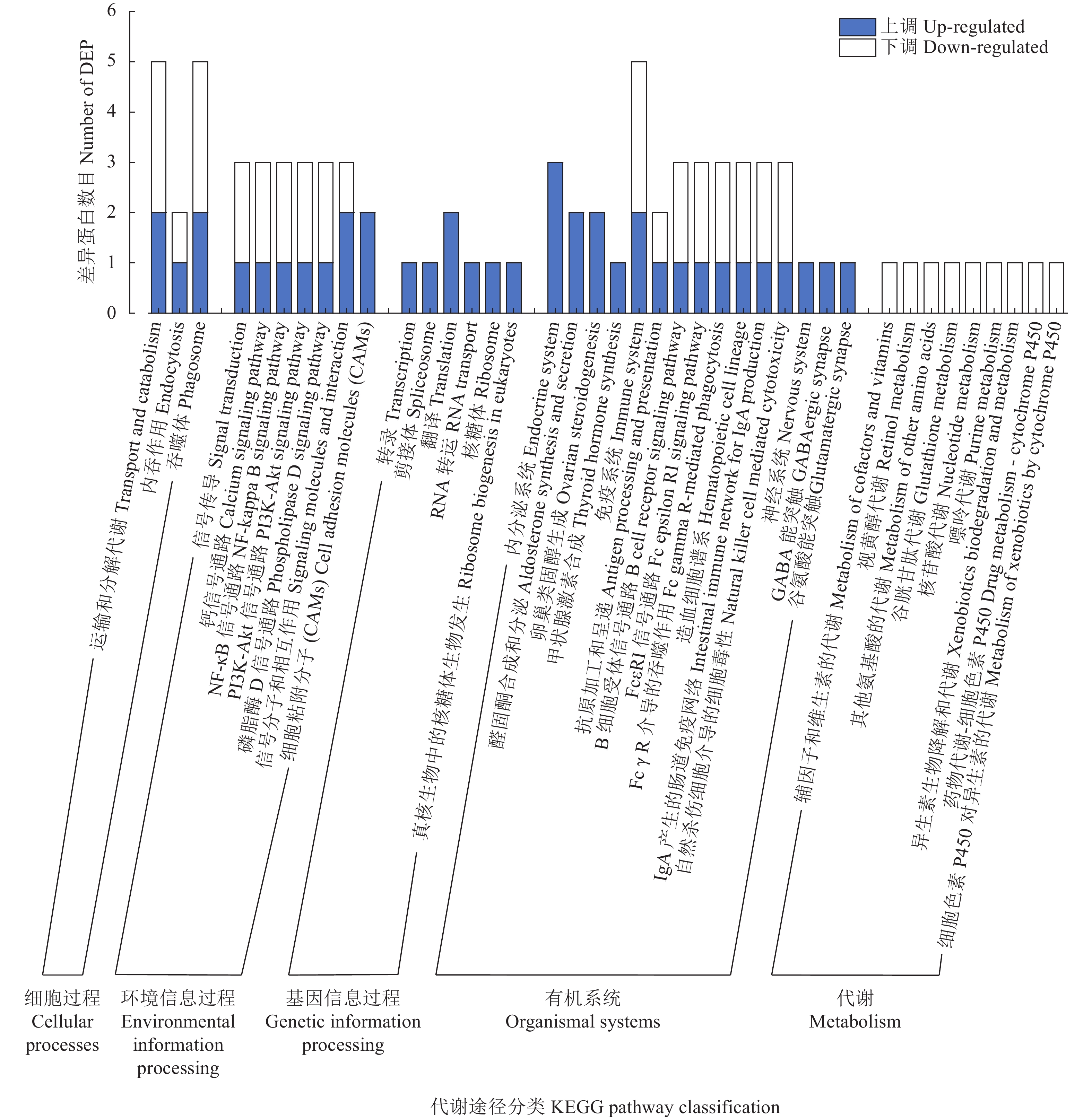
摘要:目的 研究牦牛产后乏情期和妊娠期卵巢中差异蛋白的表达情况。方法 选择青海省湟源县一户牧民自然放牧牛群中处于妊娠期和产后乏情期牦牛各3头为研究对象,采集卵巢组织,利用TMT定量蛋白质组学技术发掘不同时期卵巢差异表达蛋白。结果 妊娠期和产后乏情期卵巢组织中差异表达蛋白有57个,其中乏情期卵巢组织中上调蛋白38个,下调蛋白19个;COG分析发现,差异表达蛋白功能集中于能量的生产与转化、蛋白质周转、氨基酸转运与代谢等过程;GO分析发现,差异表达蛋白集中于代谢、繁殖等生物过程,涉及细胞器成分等细胞组分,参与转运活性等分子功能;KEGG分析发现,差异表达蛋白共参与27条信号通路,其中,缓激肽(BK)、胆固醇侧链裂解酶(P450scc)参与卵巢类固醇激素生成通路,谷胱甘肽过氧化物酶1(GSH-P1)、谷胱甘肽S转移酶A2(GSTA2)、谷胱甘肽转移酶(GST)和天冬氨酸转氨酶(AST)参与氨基酸转运与蛋白质代谢通路,磷脂酰肌醇-3-激酶蛋白(PI3K)参与PI3K-Akt细胞凋亡信号通路。结论 BK、P450scc、GSH-P1、GSTA2、GST、AST和PI3K与牦牛乏情的产生密切相关。Abstract:Objective Differentially expressed proteins (DEPs) in ovaries of yak s in pregnancy and postpartum anestrus were identified.Method Ovarian tissues of 3 randomly selected yaks each in pregnancy or postpartum anestrus from a natural grazing herd in Huangyuan County, Qinghai Province were sampled for DEP identification by the TMT method.Result Thirty-eight upregulated and 19 downregulated DEPs were found in the yaks. The COG analysis indicated the major functions of the proteins related to the production and transformation of energy, protein turnover, and amino acid transport and metabolism. The Go analysis showed that they were mainly annotated in the biological processes of metabolism and reproduction, associated with the cellular component including organelle cell components, and participated in molecular function including the molecular transport activity. Whereas KEGG revealed their involvements in 27 signaling pathways that included BK and P450scc in the ovarian steroid hormone production, GSH-P1, GSTA2, GST, and AST in the amino acid transport and protein metabolism, and PI3K in the PI3K-Akt apoptosis signaling.Conclusion The current study identified specific DEPs in yak ovary, i.e., BK, P450scc, GSH-P1, GSTA2, GST, AST, and PI3K, that were closely related to the onset of anestrus in the animal.
-
Keywords:
- Pregnancy /
- postpartum anestrus /
- proteomics /
- ovary /
- yak
-
0. 引言
【研究意义】杨梅Myrica rubra Sieb. et Zucc.为杨梅科杨梅属植物,是我国南方特有的亚热带果树,果实酸甜适口,富含多种功能性抗氧化类物质[1],深受消费者喜爱。果实表面颜色是杨梅的重要经济性状之一,根据果实充分成熟时表面颜色可分为乌梅类、红梅类、粉红梅类等着色品种和白梅类[2]。其中水晶种为白杨梅中品质最佳者,于6月中下旬成熟,果实扁圆球形,果面乳白色或微带粉色[3],风味佳。但生产上对其果实生长发育规律的了解较少,且从外观上难以确定采收标准,鲜果常出现因成熟度未达标而造成果实品质差的现象。因此,分析水晶种果实发育过程中品质的变化规律和品质间的相关性,有助于发现果实成熟的特征指标,为果实的适时采收提供参考依据。【前人研究进展】在对着色品种的研究中,随着果实的发育,果实表面L*、a*、b*值呈相应变化[4],果实生长呈“快-慢-快”的变化趋势,酸含量变化呈“低-高-低”的趋势,糖含量逐渐上升[5-6]。其中杨梅中含有的糖类[7]、有机酸[8]等风味相关物质是衡量果实内在品质优劣的重要指标,同时决定着果实的风味品质及是否达到采收标准。在蓝莓[9]、火龙果[10]等研究中证实了色差与品质之间有较密切的相关性,可以作为果实成熟的参考指标。【本研究切入点】目前对杨梅果实发育规律的研究主要集中在对着色品种的营养成分分析及糖酸积累规律上[11-12],白梅类水晶种的生长发育规律研究尚无报道。【拟解决的关键问题】本试验通过测定水晶种果实发育过程中果实色差参数、单果质量、纵横径等外观品质和可溶性固形物(The soluble solids,TSS)、可溶性糖、有机酸含量等内在品质指标的动态变化,并分析各品质间的相互关系,以期得到水晶种杨梅果实生长过程中各生理生化指标变化规律,找到反映果实成熟的特征指标,为白杨梅采收期的确定提供参考依据。
1. 材料与方法
1.1 试验材料
以绍兴市上虞区二都村白杨梅种植区——张家岙杨梅基地的3株典型的水晶种白杨梅(SJZ-1、SJZ-2、SJZ-3)为试材。采样树树势中庸,生长基本一致,树龄均为10年。果实从幼果期(2017年5月10日)开始采样,每隔8 d采样1次,转白期(5月26日)后缩短采样间隔时间,每隔2 d采样1次,直至果实完熟(6月25日)时结束采样,共计采样18次。每次在试验树的东西南北各个方向采集大小、成熟度一致的健康果实各10个,放入冰盒保鲜,立即带回实验室进行色差及品质测定。
1.2 试验方法
采用CR-400便携式色差仪测定杨梅果实色差,记录明度L*、红绿值a*、蓝绿值b*[13],并计算色泽比a*/b*。每个时期随机测定10个果实,下同。用YP502N电子天平随机称取10个不同果实的质量,并计算得出单果质量;用电子数显游标卡尺测定其果实的纵径和横径;果形指数=纵径/横径。
TSS的测定依据GB/T 8210-1987《出口柑橘鲜果检验方法》进行测定;葡萄糖、蔗糖和果糖含量依据GB/T 18932.22-2003《蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的测定方法》进行测定,高效液相色谱(Waters e2695型),示差折光检测器2414 RI Detector,流动相为85%乙腈+15%水,流速1.0 mL·min-1,色谱柱为Agilent Zorbax NH2(5 μm,4.6 mm×150.0 mm),柱温30℃,进样量20 μL。柠檬酸、苹果酸和草酸含量利用离子色谱法进行分离测定[14]。离子色谱仪(DIONEX ICS-3000型),分离柱Dionex IonPac AS11-HC 4×250 mm,保护柱Dionex IonPac AG11-HC 4×50 mm,柱温30℃,进样量20 μL,流动相为氢氧化钾溶液,流速1.0 mL·min-1。
1.3 数据处理
采用Excel和SPSS 21软件进行数据统计与分析,Microsoft Excel 2012进行作图。
2. 结果与分析
2.1 水晶种果实发育过程中色差变化规律
通过对果实发育过程中色差值的测定发现(图 1),3株水晶种的色差变化的趋势基本一致,明度L*随着杨梅果实的发育先增大后减小。水晶种的红绿值a*随着果实的发育波动上升,6月15日起3株水晶种的a*值均呈上升趋势,且无显著性差异(图 1-B)。黄蓝值b*从负值先变小,后由负值迅速上升为接近于0的正值后继续增大;5月26日过后b*又逐渐减小直至稳定,此时b*仍大于0。色泽比a*/b*一直呈缓慢上升趋势,5月26日过后由负值转变为接近于0的正值后继续上升(图 1-D),果实完熟时a*/b*值最高可达0.38。
2.2 水晶种果实发育过程中质量相关性状的变化
图 2可知,随着果实的发育,3株水晶种的质量相关性状变化趋势一致,单果质量、纵径和横径均呈不断增大的趋势,单果质量从5月26日后开始快速增加,至6月25日3株水晶种的单果质量范围为9.36~10.48 g。横径的增长速度略快于纵径。果形指数整体呈下降趋势,从大于1变为小于1。
2.3 水晶种果实发育过程中TSS与可溶性糖含量的变化
可溶性固形物指杨梅汁液中的溶质,主要由可溶性糖和有机酸等营养成分组成,其中蔗糖、葡萄糖、果糖是杨梅果实糖的主要成分。图 3可知,随着果实的发育,3株水晶种的TSS和可溶性糖含量均逐渐升高。在果实发育后期蔗糖含量最高,成熟期蔗糖含量占3种主要可溶性糖总含量40%以上,而果糖和葡萄糖的含量相当,且均小于30%。其中TSS、果糖和葡萄糖含量均在果实发育后期迅速积累并达到最大值,而蔗糖含量在6月19日时积累达到最大值后下降。
2.4 水晶种果实发育过程中有机酸含量的变化
柠檬酸、苹果酸和草酸是杨梅果实有机酸的主要成分,其中柠檬酸含量占3种有机酸总含量的90%以上,为主要的有机酸成分。在果实发育过程中苹果酸含量整体是先上升后下降再上升,呈“M”形变化趋势,在6月3日前后达到最高值(图 4-A)。柠檬酸含量先缓慢上升后快速下降,呈“倒V”型变化趋势,在6月3日达到最高值(图 4-B)。草酸含量则随着果实发育整体呈现下降趋势,于果实完熟期含量降至最低值(图 4-C)。
2.5 果实品质指标的相关性分析
对15个品质指标原始数据采用隶属函数归一化后进行相关性分析,结果见表 1。在果实发育过程中,L*、a*/b*等色差参数和单果质量、纵横径等质量相关性状与糖、酸含量等内在品质的关系密切,其中L*与TSS和蔗糖含量之间呈显著性正相关,与草酸之间呈极显著负相关;a*/b*与TSS、果糖、葡萄糖、蔗糖之间呈极显著正相关,与草酸之间呈极显著负相关。果实单果质量、纵径、横径与TSS、果糖、葡萄糖、蔗糖之间呈极显著正相关,与柠檬酸、草酸之间呈极显著负相关。果形指数与TSS、果糖、葡萄糖、蔗糖之间呈极显著负相关,与柠檬酸、草酸之间呈极显著正相关。
表 1 水晶种果实品质指标的相关性分析Table 1. Correlation analysis on quality indicators性状Characters L* a* b* a*/b* 单果质量Single fruit weight 纵径Lengthwise diameter 横径Broadwise diameter 果形指数Fruit shape index TSS ω(果糖) Fructose content ω(葡萄糖) Glucose content ω(蔗糖) Sucrose content ω(苹果酸) Malic acid content ω(草酸) Oxalic acid content ω(柠檬酸) Citric acid content L* 1 a* 0.419 1 b* 0.573* 0.527* 1 a*/b* 0.836** 0.616** 0.569* 1 单果质量 0.536* 0.470* 0.177 0.850** 1 纵径 0.642** 0.532* 0.277 0.914** 0.987** 1 横径 0.634** 0.476* 0.244 0.901** 0.990** 0.996** 1 果形指数 -0.678** -0.321 -0.190 -0.854** -0.924** -0.930** -0.957** 1 TSS 0.548* 0.408 0.183 0.840** 0.985** 0.974** 0.982** -0.937** 1 ω(果糖) 0.397 0.445 0.077 0.766** 0.983** 0.948** 0.951** -0.864** 0.958** 1 ω(葡萄糖) 0.366 0.463 0.056 0.743** 0.976** 0.937** 0.938** -0.844** 0.948** 0.997** 1 ω(蔗糖) 0.577* 0.257 0.123 0.799** 0.935** 0.921** 0.946** -0.958** 0.948** 0.907** 0.884** 1 ω(苹果酸) 0.189 0.110 0.349 0.015 -0.257 -0.183 -0.230 0.310 -0.293 -0.288 -0.294 -0.382 1 ω(草酸) -0.882** -0.512* -0.534* -0.959** -0.834** -0.897** -0.892** 0.881** -0.844** -0.732** -0.713** -0.812** -0.009 1 ω(柠檬酸) -0.097 -0.137 0.232 -0.448 -0.827** -0.739** -0.771** 0.748** -0.820** -0.880** -0.884** -0.842** 0.621** 0.461 1 注:**表示在0.01水平的显著相关;*表示在0.05水平的显著相关。
Note:** stands for the significant level P < 0.01; *stands for the significant level P < 0.05.3. 讨论与结论
本试验结果显示3株水晶种的发育规律具有一致性,且不同成熟度的果实色差和品质变化差异显著。对色差参数的测定发现,在果实成熟过程中色差参数总体趋于果实特征色泽变化,随着果实发育,水晶种的果肉由绿转白,亮度变亮;在果实成熟后期阶段,果实颜色从黄白色逐渐过渡到白色或微带粉色,亮度下降,表现为明度L*先上升后下降,a*整体呈上升趋势。梁森苗等[4]研究中发现早佳和荸荠种两个着色品种的L*在果实发育后期快速下降,a*呈现倒V型,与本研究不同,表明了水晶种杨梅与着色品种在颜色发育规律上存在明显差异。同时水晶种黄蓝值b*由负值转变为正值,表明了水晶种果实黄蓝色差是由蓝向黄转变的过程。色泽比a*/b*是综合色度指标,值为负值时表示绿色,正值表示黄白色或橙红色[15]。有研究表明色差值的变化可作为贡柑、芒果、枇杷[16-18]等果实发育进程的参考指标,其中a*/b*更能反映果实的发育[19]。3株水晶种的a*/b*均先由负值上升为接近于0的正值,果实颜色先由绿变白,此时果实发育经历了幼果期、硬核期和转白期。果实发育后期a*/b*持续小幅度上升,果实继续变白或微带粉色。实际生产中水晶种杨梅于6月20日前后开始采收至6月25日结束,此时0.3 < a*/b* < 0.4。
随着果实的发育,水晶种的单果质量、纵径、横径、TSS、果糖和葡萄糖含量均在果实发育后期迅速积累并达到最大值,同时柠檬酸和草酸含量降低,这与着色品种的品质变化规律相似[20],说明部分品质相关性状的发育规律在不同颜色类型的杨梅中具有统一性。同着色品种相比,水晶种成熟时的TSS和可溶性糖含量均较低[21],而有机酸的含量同着色品种相近[22],因此表现为不同于着色品种的酸甜风味。蔗糖含量在6月19日积累达到最大,此时TSS含量也处于较高水平,而柠檬酸和草酸含量较低,水晶种杨梅果实具有较好的风味,适宜采收。随后蔗糖有一段下降的过程,且蔗糖含量的下降阶段与葡萄糖和果糖含量的上升阶段有部分重合,可能是随着果实进一步的成熟,杨梅果实的可溶性糖作为呼吸底物被消耗而呈下降趋势[23],同时说明了蔗糖同葡萄糖和果糖之间存在相互转化过程[24]。若果实采摘时间过晚,尽管TSS含量在持续上升,3种主要可溶性糖的总含量会下降,从而改变糖酸比,影响果实的风味和口感。因此,本试验中水晶种杨梅的最佳开始采收日期为6月19日前后,与生产上的采收日期接近。
果实品质间的相关性分析结果表明,L*、a*/b*等色差参数和单果质量、纵径、横径等质量相关性状与糖、酸含量等果实内在品质变化关系密切,其中a*/b*与TSS、果糖、葡萄糖、蔗糖之间均呈极显著正相关。因此a*/b*可作为预测果实成熟的特征指标,且当a*/b*的值为0.3~0.4时可判断水晶种杨梅成熟,为水晶种的适时采收提供参考依据。具体量化数据还需进一步分析。
-
表 1 差异表达蛋白信息统计
Table 1 Statistical information on DEPs
序号
Number标识
ID蛋白名称
Protein names调节
Regulated1 Q4U0F3 热休克 70 kDa 蛋白 1B (HSP70.2) Heat shock 70 kDa protein 1B (HSP70.2) 下调 Down 2 D4QBF3 血红蛋白β Hemoglobin beta 上调 Up 3 L8I5Y3 胶原结合蛋白 Collagen-binding protein 上调 Up 4 A0A5A9Q697 未知 Deleted 上调 Up 5 A0A5A9QF16 未知 Deleted 下调 Down 6 A0A5A9PW39 未知 Deleted 上调 Up 7 L8J5R1 谷胱甘肽 S-转移酶 A2(片段) Glutathione S-transferase A2 (Fragment) 上调 Up 8 A0A5A9PVT1 未知 Deleted 上调 Up 9 L8HPR0 缓激肽 Bradykinin 下调 Down 10 A0A5A9QYU8 未知 Deleted 下调 Down 11 L8ICZ3 天冬氨酸氨基转移酶 (EC 2.6.1.1) Aspartate aminotransferase (EC 2.6.1.1) 上调 Up 12 A0A5A9Q9K0 未知 Deleted 下调 Down 13 A0A5A9QIY6 未知 Deleted 上调 Up 14 L8HXR0 胆固醇侧链裂解酶,线粒体(EC 1.14.15.6)
Cholesterol side-chain cleavage enzyme, mitochondrial (EC 1.14.15.6)上调 Up 15 L8HVE1 EPM2A相互作用蛋1 EPM2A-interacting protein 1 上调 Up 16 L8INV1 肽基脯氨酰顺反异构酶 (EC 5.2.1.8) Peptidyl-prolyl cis-trans isomerase (EC 5.2.1.8) 上调 Up 17 A0A5A9R284 未知 Deleted 上调 Up 18 A0A5A9QP43 未知 Deleted 上调 Up 19 A0A5A9Q6B8 未知 Deleted 上调 Up 20 A0A5A9QVH4 未知 Deleted 下调 Down 21 L8IKU4 D-3-磷酸甘油酸脱氢酶 (EC1.1.1.95) D-3-phosphoglycerate dehydrogenase (EC 1.1.1.95) 上调 Up 22 P00435 谷胱甘肽过氧化物酶 1 (GPx-1) (EC 1.11.1.9) Glutathione peroxidase 1 (GPx-1) (EC 1.11.1.9) 上调 Up 23 L8HR71 视网膜脱氢酶2 Retinal dehydrogenase 2 下调 Down 24 L8IBL3 氨基肽酶 (EC 3.4.11.-)(片段) Aminopeptidase (EC 3.4.11.-) (Fragment) 上调 Up 25 A0A5A9QJL1 未知 Deleted 上调 Up 26 A0A5A9Q7A9 未知 Deleted 上调 Up 27 A0A5A9Q4N6 未知 Deleted 下调 Down 28 L8HS12 未鉴定的蛋白质(片段) Uncharacterized protein (Fragment) 上调 Up 29 L8IZP3 肾上腺素,线粒体(片段) Adrenodoxin, mitochondrial (Fragment) 上调 Up 30 L8I6P6 非综合征性听力障碍蛋白5样蛋白 Non-syndromic hearing impairment protein 5-like protein 上调 Up 31 L8IL81 α-2-巨球蛋白受体相关蛋白 Alpha-2-macroglobulin receptor-associated protein 上调 Up 32 L8HM51 胰蛋白酶抑制剂(片段) Pancreatic trypsin inhibitor (Fragment) 上调 Up 33 L8HXY3 含有 Ig 样结构域的蛋白质(片段) Ig-like domain-containing protein (Fragment) 上调 Up 34 L8HVF6 硒蛋白 M Selenoprotein M 上调 Up 35 L8HX05 神经元特异性钙结合蛋白海马钙素 Neuron-specific calcium-binding protein hippocalcin 下调 Down 36 A0A5A9QIW4 未知 Deleted 下调 Down 37 L8HVH6 中性粒细胞明胶酶相关脂质运载蛋白 Neutrophil gelatinase-associated lipocalin 上调 Up 38 A0A5A9QMW0 未知 Deleted 上调 Up 39 L8IS41 E3 UFM1-蛋白连接酶 1 E3 UFM1-protein ligase 1 下调 Down 40 L8HY99 含三部分基序的蛋白质 3(片段) Tripartite motif-containing protein 3 (Fragment) 下调 Down 41 Q860K0 MHC I 类抗原(片段) MHC class I antigen (Fragment) 下调 Down 42 A0A5A9QEA2 未知 Deleted 上调 Up 43 L8HU38 含有 Ig 样结构域的蛋白质(片段) Ig-like domain-containing protein (Fragment) 下调 Down 44 L8I6S3 谷胱甘肽转移酶(EC 2.5.1.18)(片段) Glutathione transferase (EC 2.5.1.18) (Fragment) 下调 Down 45 A0A5A9QAJ2 未知 Deleted 上调 Up 46 L8HUU8 SRA 茎环相互作用 RNA 结合蛋白,线粒体
SRA stem-loop-interacting RNA-binding protein, mitochondrial上调 Up 47 L8I2B7 碱性磷酸酶 (EC 3.1.3.1)(片段) Alkaline phosphatase (EC 3.1.3.1) (Fragment) 上调 Up 48 A0A5A9QZ00 未知 Deleted 下调 Down 49 A0A5A9Q3H5 未知 Deleted 下调 Down 50 A0A5A9R1T6 未知 Deleted 上调 Up 51 L8HU32 含有 Ig 样结构域的蛋白质(片段) Ig-like domain-containing protein (Fragment) 下调 Down 52 A0A5A9Q609 未知 Deleted 上调 Up 53 A0A5A9QMW5 未知 Deleted 上调 Up 54 L8IIL6 醌氧化还原酶 PIG3(片段) Quinone oxidoreductase PIG3 (Fragment) 上调 Up 55 L8IUD0 含有 EGF 样模块的粘蛋白样激素受体样 1(片段)
EGF-like module-containing mucin-like hormone receptor-like 1 (Fragment)上调 Up 56 L8IC02 ER 腔蛋白保留受体(片段) ER lumen protein-retaining receptor (Fragment) 上调 Up 57 L8HUM8 磷脂酰肌醇-4,5-二磷酸 3-激酶 (EC 2.7.1.153) Phosphatidylinositol-4,5-bisphosphate 3-kinase (EC 2.7.1.153) 下调 Down -
[1] 刘敏清, 何翃闳, 潘阳阳, 等. HSP27基因在牦牛卵母细胞和体外早期胚胎中的表达 [J]. 核农学报, 2021, 35(12):2716−2723. DOI: 10.11869/j.issn.100-8551.2021.12.2716 LIU M Q, HE H H, PAN Y Y, et al. Expression of HSP27 gene in yak oocytes and early embryos in vitro [J]. Journal of Nuclear Agricultural Sciences, 2021, 35(12): 2716−2723.(in Chinese) DOI: 10.11869/j.issn.100-8551.2021.12.2716
[2] 赵寿保, 武甫德, 裴杰, 等. 牦牛提前发情调控技术的研究 [J]. 中国牛业科学, 2018, 44(3):34−36. DOI: 10.3969/j.issn.1001-9111.2018.03.009 ZHAO S B, WU F D, PEI J, et al. Study on technology of early Oestrus control in yak [J]. China Cattle Science, 2018, 44(3): 34−36.(in Chinese) DOI: 10.3969/j.issn.1001-9111.2018.03.009
[3] NASCIMENTO T, SOARES LOPES E Jr, DE SOUZA MIRANDA M, et al. Factors affecting postpartum ovarian activity of goats in tropical semi-arid region [J]. Revista De La Facultad De Ciencias Agrarias UNCuyo, 2021, 53(1): 330−345. DOI: 10.48162/rev.39.032
[4] 季美超, 付斌, 张养军. 基于质谱的蛋白质组学方法新进展 [J]. 质谱学报, 2021, 42(5):862−877. JI M C, FU B, ZHANG Y J. Recent progress of analytical methods of proteomics based on mass spectrometry [J]. Journal of Chinese Mass Spectrometry Society, 2021, 42(5): 862−877.(in Chinese)
[5] 付莉霞, 程子倩, 王洪, 等. 基于质谱的血液蛋白质组学: 血液学研究的新焦点 [J]. 中国细胞生物学学报, 2022, 44(1):204−213. FU L X, CHENG Z Q, WANG H, et al. MS-based blood proteomics: Emerging research focus in hematology [J]. Chinese Journal of Cell Biology, 2022, 44(1): 204−213.(in Chinese)
[6] BHATTACHARYA T. Controlling mixing and segregation in time periodic granular flows[D]. Pittsburgh: University of Pittsburgh, 2011
[7] 海超. 褪黑素对牛冷冻保存精子的蛋白质组学研究[D]. 呼和浩特: 内蒙古大学, 2020. HAI C. Proteomics study on the role of melatonin in frozen bovine sperm[D]. Hohhot: Inner Mongolia University, 2020. (in Chinese)
[8] 赵国顺. 天祝白牦牛和双峰驼卵泡发育过程中卵泡液差异蛋白质组学研究[D]. 兰州: 甘肃农业大学, 2013. ZHAO G S. Comparative proteomics studies of follicular fluid during the different periods of follicular development in Tianzhu white yak and Bactrian camel[D]. Lanzhou: Gansu Agricultural University, 2013. (in Chinese)
[9] 阮崇美. 不同发育期白牦牛睾丸蛋白质组学分析及生殖相关候选基因HSP60生物学研究[D]. 兰州: 甘肃农业大学, 2017. RUAN C M. Proteomic analysis of white yak testis in different developmental stages and reproductive candidate gene HSP60 biology research[D]. Lanzhou: Gansu Agricultural University, 2017. (in Chinese)
[10] PEI J, SONG R D, BAO P J, et al. Differential proteomic analysis demonstrates follicle fluid participate immune reaction and protein translation in yak [J]. BMC Veterinary Research, 2022, 18(1): 34. DOI: 10.1186/s12917-021-03097-0
[11] ZHAO X X. A proteomics study of Tianzhu white yak ovary during estrus and pregnancy [J]. Pakistan Veterinary Journal, 2014, 34(1): 87−91.
[12] HUO S D, CHEN Z, LI S Y, et al. A comparative transcriptome and proteomics study of post-partum ovarian cycle arrest in yaks (Bos grunniens) [J]. Reproduction in Domestic Animals, 2022, 57(3): 292−303. DOI: 10.1111/rda.14059
[13] 张寿, 王应安, 贾荣莉, 等. 高原牦牛卵巢及卵泡的形态观测 [J]. 中国兽医科技, 2001, 31(6):32−33. DOI: 10.3969/j.issn.1673-4696.2001.06.016 ZHANG S, WANG Y A, JIA R L, et al. Morphological observation of ovary and follicle in plateau yak [J]. Chinese Journal of Veterinary Science and Technology, 2001, 31(6): 32−33.(in Chinese) DOI: 10.3969/j.issn.1673-4696.2001.06.016
[14] 李晨雷, 齐昆龙, 刘蓥珂, 等. 大白母猪发情期前后唾液蛋白组学分析 [J]. 中国农业大学学报, 2022, 27(2):98−109. DOI: 10.11841/j.issn.1007-4333.2022.02.10 LI C L, QI K L, LIU Y K, et al. Salivary proteomics analysis of large white sows before and after estrus [J]. Journal of China Agricultural University, 2022, 27(2): 98−109.(in Chinese) DOI: 10.11841/j.issn.1007-4333.2022.02.10
[15] 纪万里, 王婷婷, 安叡, 等. 基于定量蛋白质组学技术探究半夏泻心汤对慢性胃炎大鼠影响的作用机制 [J]. 中国实验方剂学杂志, 2021, 27(9):1−8. JI W L, WANG T T, AN R, et al. Mechanism of Banxia Xiexintang on rats with chronic gastritis based on quantitative proteomics [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(9): 1−8.(in Chinese)
[16] EFIMOVA V S, ISAEVA L V, OREKHOV P S, et al. Using a viral 2A peptide-based strategy to reconstruct the bovine P450scc steroidogenic system in S. cerevisiae: Bovine P450scc system expression using 2A peptides [J]. Journal of Biotechnology, 2021, 325: 186−195. DOI: 10.1016/j.jbiotec.2020.10.028
[17] ZHU H B, REN Q L, YAN Z Y, et al. Human HAND1 inhibits the conversion of cholesterol to steroids in trophoblasts[J]. Journal of Genetics and Genomics, 2021.
[18] ONO K, YANO A, ISHIMURA K. Effect of peripherally derived steroid hormones on the expression of steroidogenic enzymes in the rat choroid plexus [J]. The Journal of Medical Investigation:JMI, 2021, 68(3.4): 238−243. DOI: 10.2152/jmi.68.238
[19] 邹鹏达. LH诱导山羊卵泡膜细胞Akt磷酸化及对雄激素生成的影响[D]. 杨凌: 西北农林科技大学, 2016. ZOU P D. Luteinizing hormone-induced Akt phosphorylation and its effect on androgen production in goat theca cells[D]. Yangling: Northwest A & F University, 2016. (in Chinese)
[20] 美日阿依·买合买提, 朱梦婷, 牟健, 等. 舍饲哈萨克母羊在乏情期补饲精料对其诱导发情效果及相关生殖激素变化规律的研究 [J]. 石河子大学学报(自然科学版), 2020, 38(6):686−690. MEHRAY·MAIHEMAITI, ZHU M T, MU J, et al. Study on the effects of supplementary feeding of feed during non-estrus period induces estrus and reproductive hormone changes in Kazak sheep [J]. Journal of Shihezi University (Natural Science), 2020, 38(6): 686−690.(in Chinese)
[21] 王洋洋. FSH对牛体外有腔卵泡膜细胞和颗粒细胞类固醇激素合成相关基因表达的影响[D]. 北京: 中国农业科学院, 2019. WANG Y Y. Effects of FSH on gene expression related to steroidogenesis in bovine follicles cultured in vitro[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese)
[22] 孙金莉, 颜晓红, 林莉, 等. 体外受精长方案晚卵泡期不同浓度孕酮干预对妊娠结局的影响 [J]. 中华生殖与避孕杂志, 2019, 39(10):803−809. SUN J L, YAN X H, LIN L, et al. Influence of the different concentration of progesterone intervention on pregnancy outcomes in late follicular phase of gonadotropin-releasing hormone agonist cycles of in vitro fertilization [J]. Chinese Journal of Reproduction and Contraception, 2019, 39(10): 803−809.(in Chinese)
[23] GREISEN S, LEDET T, OVESEN P. Effects of androstenedione, insulin and luteinizing hormone on steroidogenesis in human granulosa luteal cells [J]. Human Reproduction, 2001, 16(10): 2061−2065. DOI: 10.1093/humrep/16.10.2061
[24] RYTELEWSKA E, KIEZUN M, KISIELEWSKA K, et al. Chemerin as a modulator of ovarian steroidogenesis in pigs: An in vitro study [J]. Theriogenology, 2021, 160: 95−101. DOI: 10.1016/j.theriogenology.2020.10.040
[25] 段宇, 夏成, 吴凌, 等. 产后乏情奶牛血浆生化参数的变化 [J]. 中国兽医杂志, 2014, 50(4):26−28. DOI: 10.3969/j.issn.0529-6005.2014.04.009 DUAN Y, XIA C, WU L, et al. Alterations of plasma metabolites and hormones in postpartum anestrus cows [J]. Chinese Journal of Veterinary Medicine, 2014, 50(4): 26−28.(in Chinese) DOI: 10.3969/j.issn.0529-6005.2014.04.009
[26] CONNOLLY L, BRIGGS E. Acquired pyroglutamic acidaemia in a critically ill patient with chronic paracetamol use: A case report[J]. SAGE Open Medical Case Reports, 2022, 10: 2050313X211068561.
[27] 彭影琦. L-茶氨酸对肠道吸收与转运氨基酸的调节作用及机制[D]. 长沙: 湖南农业大学, 2019. PENG Y Q. Regulation and mechanism of L-theanine on intestinal absorption and transport of amino acids[D]. Changsha: Hunan Agricultural University, 2019. (in Chinese)
[28] ZHANG J, WANG G, ZHAO C, et al. 1H NMR plasma metabolomic profiling of ovarian quiescence in energy balanced postpartum dairy cows [J]. Veterinary Quarterly, 2018, 38(1): 47−52. DOI: 10.1080/01652176.2018.1473660
[29] UDDIN A M, ATIKUZZAMAN M, HOSSAIN M K. Postpartum cyclicity of Holstein-Friesian crossbred cows shows relation with serum biochemical profiles during 45-60 days postpartum [J]. Pakistan Veterinary Journal, 2019, 40(2): 257−260.
[30] GO N. Regulation of primordial follicle formation, dormancy, and activation in mice [J]. The Journal of Reproduction and Development, 2021, 67(3): 189−195. DOI: 10.1262/jrd.2021-040
[31] 姜凤丽, 王晓滨, 宗婧, 等. PI3K-Akt/m TOR信号通路对卵巢早衰相关性研究进展 [J]. 黑龙江科学, 2019, 10(2):50−51. DOI: 10.3969/j.issn.1674-8646.2019.02.016 JIANG F L, WANG X B, ZONG J, et al. Research progress on the correlation between PI3K-Akt/mTOR signaling pathway and premature ovarian failure [J]. Heilongjiang Science, 2019, 10(2): 50−51.(in Chinese) DOI: 10.3969/j.issn.1674-8646.2019.02.016
[32] 胡小靖. Mfn2在PCOS大鼠卵巢的表达及其对大鼠卵泡发育的影响与机制的初步探讨[D]. 重庆: 重庆医科大学, 2014. HU X J. Expression of Mitofusin2in pcos rat and its mechanism of effect on rat follicle development[D]. Chongqing: Chongqing Medical University, 2014. (in Chinese)
[33] 李德保, 周莉, 孙祖越. 早发性卵巢功能不全相关信号通路研究进展 [J]. 中国比较医学杂志, 2020, 30(2):121−127. DOI: 10.3969/j.issn.1671-7856.2020.02.019 LI D B, ZHOU L, SUN Z Y. Research advances of premature ovarian insufficiency-related signaling pathways [J]. Chinese Journal of Comparative Medicine, 2020, 30(2): 121−127.(in Chinese) DOI: 10.3969/j.issn.1671-7856.2020.02.019
[34] SANTOS J M S, LINS T L B G, BARBERINO R S, et al. Kaempferol promotes primordial follicle activation through the phosphatidylinositol 3-kinase/protein kinase B signaling pathway and reduces DNA fragmentation of sheep preantral follicles cultured in vitro [J]. Molecular Reproduction and Development, 2019, 86(3): 319−329. DOI: 10.1002/mrd.23107
[35] ZHANG T, HE M, ZHAO L, et al. HDAC6 regulates primordial follicle activation through mTOR signaling pathway [J]. Cell Death & Disease, 2021, 12: 559.
[36] 张焱, 张华. 哺乳动物卵巢卵泡发育调控机制研究进展 [J]. 生理学报, 2020, 72(1):63−74. ZHANG Y, ZHANG H. Research advances in regulating mechanisms of mammalian ovarian folliculogenesis [J]. Acta Physiologica Sinica, 2020, 72(1): 63−74.(in Chinese)
[37] 梁菁媛, 邓彦飞, 赵易敏, 等. 哺乳动物原始卵泡体外培养与激活调控研究进展 [J]. 中国畜牧杂志, 2019, 55(7):5−9. LIANG J Y, DENG Y F, ZHAO Y M, et al. Research progress on in vitro culture and activation regulation of mammalian primordial follicles retraction [J]. Chinese Journal of Animal Science, 2019, 55(7): 5−9.(in Chinese)
[38] WATANABE R, SASAKI S, KIMURA N. Activation of autophagy in early neonatal mice increases primordial follicle number and improves lifelong fertility [J]. Biology of Reproduction, 2019, 102(2): 399−411.
[39] CORDEIRO C N, CHRISTIANSON M S, SELTER J H, et al. In vitro activation: A possible new frontier for treatment of primary ovarian insufficiency [J]. Reproductive Sciences (Thousand Oaks, Calif ), 2016, 23(4): 429−438. DOI: 10.1177/1933719115625842





 下载:
下载: