Rapid PCR Differentiation Between Lobelia chinensis and Mazus pumilus
-
摘要: 市场流通中半边莲容易与通泉草相互混淆,拟基于rbcL序列建立半边莲与通泉草的分子鉴别方法。采集不同产地的半边莲样品9份,通泉草样品7份,所有受试样品提取总DNA。对其叶绿体DNA中rbcL片段进行扩增、测序,用ClustalX 2.1软件进行多重序列比对后,应用Meg 5.0软件构建NJ系统聚类树进行聚类分析,根据二组样品间的SNP位点设计相互鉴别的特异性引物,建立特异PCR鉴别方法,并应用SYBR Green I染料法建立对2种中草药进行快速检测的方法。本研究建立了对半边莲与通泉草2种中草药进行分子鉴别的方法,并建立了荧光快速检测方法。Abstract: Molecular identifications of Lobelia chinensis and Mazus pumilus, as well as a specific PCR rapid method based on the SNP in rbcL sequence to differentiate between the two rather similar Chinese medicinal material were establish in this study. Commercial samples of 9 L. chinensis and 7 M. pumilus from different origins were collected to extract total DNA for rbcL gene sequencing. SNPs in the rbcL sequences of the samples were isolated using the ClustulX 2.1 program. The primers for identifying the two material were designed based on the SNP site. A specific PCR method was subsequently developed to rapidly and effectively detect the markers by the addition of SYBR Green I dye.
-
Keywords:
- Lobelia chinensis /
- Mazus pumilus /
- SNP /
- molecular identification
-
半边莲Lobelia chinensisLour.为桔梗科多年生小草本植物,全草入药,是常用中药之一。《本草纲目》载:“生阴湿塍堑边,就地细梗引蔓,节节而生细叶,秋开小花,淡红紫色,止有半边,如莲花状。”故称为“半边莲”,分布较广,主产于福建、江苏、浙江、安徽、江西、广东与广西等省区。具有清热解毒,利水消肿等功效,主治毒蛇咬伤,烧伤,扁桃体炎,阑尾炎,痈肿疗疮,肝硬化腹水及多种癌症等[1]。全草含有生物碱类,黄酮类与多炔类等成分[2],现代药理实验证实具有镇痛消炎、抗肿瘤、抑制α-葡萄糖苷酶、调节内皮细胞与抗心肌缺血再灌注等方面作用,已被广泛应用于各种临床实践中,且取得了良好的治疗效果[1, 3]。
玄参科植物通泉草Mazuspumilus同为矮生草本,生态位宽度较大,在中国分布广泛,适应性强,资源较丰富,由于与半边莲生长环境相似,且两者全草有具有相似的形态特征等原因,市场上有以通泉草的干燥全草冒充半边莲的现象。伪品通泉草与半边莲的主治功效不一样,不能代替半边莲药用,药材在市场流通时需要准确相互辨别[4]。目前,对半边莲的鉴定主要通过性状鉴别、显微鉴别与理化鉴别等传统生药鉴定方法,而传统生药鉴定方法比较依赖个人经验,不利于推广。随着分子生物学的快速发展,DNA条形码(DNA barcoding)鉴别技术成为中药鉴定有效新工具。其具有通用性强,稳定性和重复性高,不受被检测对象形态特征的影响,有统一易于掌握的操作流程和标准,方便推广等优点[5-6]。长期以来,植物DNA条形码多选用叶绿体上的DNA序列片段,其中,rbcL进化速度相对较慢,遗传变异主要存在种以上水平,而在物种水平的遗传变异很小,这是因为rbcL在光呼吸及光合作用中起关键性作用这一重要功能的限制。rbcL片段序列全长约1 300 bp,具有引物易比对、易扩增、通用性强等特点,在PCR分子鉴定中可以提供长度差异较明显的扩增片段进行辨别,因为物种鉴别方便,实际研究中常选取其作为分子鉴定的DNA条形码[7-8]。本研究拟对来源于不同居群的半边莲与通泉草的rbcL序列进行聚类分析,并基于利用rbcL区的SNP位点设计引物,分别利用该引物建立特异扩增2种植物的PCR体系,通过在PCR产物中加SYBR Green I染料,对真伪结果进行快速检测。配合DNA快速提取技术,大大提高检测的效率,建立半边莲和通泉草药材快速便捷的鉴定方法。
1. 材料与方法
1.1 仪器与材料
凝胶成像分析仪(BIO-RAD ChemiDoc XRS),微量移液器(Eppendorf),PCR仪(Eppendorf,型号5332),手持式紫外灯,低温冷冻离心机(Eppendorf,型号5810R),电泳系统(北京市六一仪器厂,型号DYY-12)。
DNA Taq聚合酶(Takara公司),TAE缓冲液,Goldview(北京索莱宝科技有限公司),CTAB提取液,1000* SYBR Green I染料(Invitrogen公司),琼脂糖(Promega公司),异丙醇、无水乙醇、三氯甲烷均为国产分析纯。
研究供试样品由福建中医药大学鉴定和收集,采自不同产地的半边莲Lobelia chinensis Lour.9份,通泉草Mazus pumilus 7份(表 1)。
表 1 供试材料Table 1. Basic information on material tested编号 物种 原产地 1 Lobelia chinensis 福建安溪 2 Lobelia chinensis 福建安溪 3 Lobelia chinensis 福建安溪 4 Lobelia chinensis 福建永春 5 Lobelia chinensis 福建永春 6 Lobelia chinensis 福建永春 7 Lobelia chinensis 福建永春 8 Lobelia chinensis 福建德化 9 Lobelia chinensis 福建德化 10 Mazus pumilus 福建安溪 11 Mazus pumilus 福建安溪 12 Mazus pumilus 福建安溪 13 Mazus pumilus 福建安溪 14 Mazus pumilus 福建永春 15 Mazus pumilus 福建永春 16 Mazus pumilus 福建永春 1.2 方法
1.2.1 样品基因组DNA提取
各干燥样品基因组DNA的提取采用的是本课题组优化的CTAB法,所提DNA经稀释后作为后续试验检测的PCR模版。
1.2.2 扩增受试样品的rbcL序列
利用通用引物rbcLR与rbcLF扩增rbcL序列[5]:总体积20 μL,其中包括引物各0.2 μmol·L-1,Taq酶1 U,dNTP 20 nmol·L-1,10×buffer缓冲液2.0 μL,ddH2O补足体积至20 μL。PCR反应程序:95℃预变性4 min,94℃变性30 s,55℃退火60 s,72℃延伸90 s,35个循环后72℃延伸8 min。PCR产物用1.2%的琼脂糖凝胶进行电泳,以Goldview染色观察。
1.2.3 聚类分析
对16个受试样品的rbcL序列进行测序,获得16条rbcL序列,用ClustalX 2.1软件进行多重序列比对,利用MEGA5.0进行邻接(NJ)系统聚类树分析。
经测序,获得半边莲与通泉草所有受试样品rbcL序列,用ClustalX 2.1软件对所获得的序列进行多重序列比对,进一步应用Meg 5.0软件构建NJ系统聚类树分析所有受试样品rbcL序列,分析其相互进化关系(图 1)。NJ系统聚类树结果显示9个不同来源的半边莲样品单独聚为一类,与7个不同来源的通泉草样品没有交叉,表明rbcL序列适用于半边莲与通泉草之间的相互鉴别,可应用rbcL序列建立半边莲与通泉草的分子鉴别方法。
1.2.4 引物设计
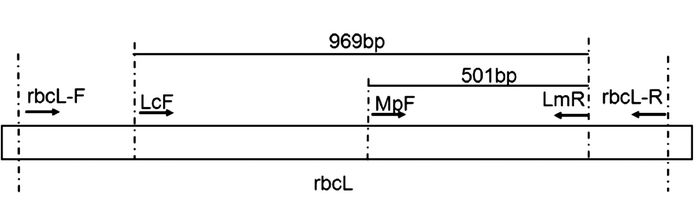
所得受试样品rbcL序列用ClustalX 2.1软件对进行多重序列比对,筛选获得半边莲与通泉草的SNP位点,筛选二者之间的特异鉴别位点,设计半边莲的鉴别引物LcF,通泉草的鉴别引物MpF,两者均能够与共同反向引物LmR分别构建特异PCR,所构建的PCR鉴别体系中,半边莲样品则可产生969 bp的PCR扩增片段,而通泉草样品则可产生501 bp的PCR扩增片段。根据PCR扩增片段的大小则可进行样品的鉴别,引物设计位置及引物序列见图 2及表 2。
表 2 供试引物Table 2. Primers applied名称 序列(5′-3′) rbcLF ATGTCACCACAAACAGARACTAAAGC rbcLR GTATCCATTGCGGCAAACTC LcF CCGGAGAAGAAAATCAATTTATTGC MpF GCGAAGAAATGATGAAAAGAGGTAT LmR CATTTCCCCACGGATGTCCTAA 1.2.5 特异性PCR鉴别受试半边莲与通泉草样品
利用所设计的可鉴别半边莲与通泉草的特异性引物LcF、MpF分别与共用反向引物LmR构建2个PCR体系,反应体系同上,通过梯度退火温度试验(50.0、50.5、51.6、53.2、55.1、56.7、57.6、58.0℃),以考查不同的退火温度对PCR扩增体系的扩增效果影响。加2 μL SYBR Green I染料到20 μL的PCR产物中,365 nm紫外波长检测荧光,以此建立简便快速鉴别方法。
2. 结果与分析
2.1 特异性PCR快速鉴别受试半边莲与通泉草样品
利用半边莲与通泉草的共同的反向引物LmR分别与两植物的特异性鉴别引物LcF、MpF构建PCR反应体系,通过退火温度梯度的设计,综合不同退火温度的PCR扩增效果,结果表明,在退火温度51.6~58.0℃条件下,这2个反应体系均能扩增出半边莲969 bp的特征鉴别条带,通泉草601 bp的特征鉴别条带。
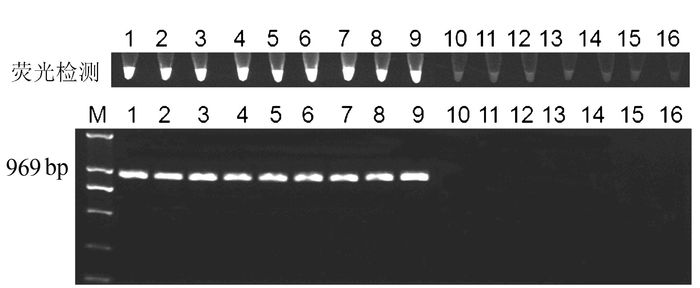
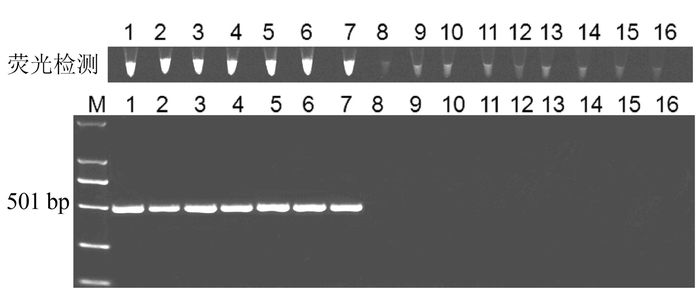
以退火53℃,应用以上建立的PCR反应体系,分别对受试所有半边莲与通泉草样品进行检测,受试9个半边莲样品,7个通泉草样品相应特征阳性条带都能够检测到(图 3、4),但没有扩增到相对应的阴性样品条带。结果表明该PCR体系具备特异性,能够用于半边莲与通泉草的鉴别。
![]() 图 3 特异性PCR鉴别半边莲与通泉草凝胶电泳与荧光检测注:① M为DL2000 DNA maker,1~9为来源不同产地的半边莲样品,10~16为不同产地的通泉草样品;
图 3 特异性PCR鉴别半边莲与通泉草凝胶电泳与荧光检测注:① M为DL2000 DNA maker,1~9为来源不同产地的半边莲样品,10~16为不同产地的通泉草样品;
② 电泳图上方为荧光检测图,图 4同。Figure 3. Gel electrophoresis and florescence diagrams on PCR amplified markers of L.chinensis and M.pumilus2.2 特异性PCR快速鉴别的快捷检测方法
为了建立更加快捷简便的检测方法,在20 μL PCR产物中加入2 μL SYBR Green I染料,365 nm紫外波长检测荧光,结果显示所建立的2个PCR鉴别体系,受试样品均能检测到荧光,而阴性样品均不能检测到荧光(图 3、4)。表明该方法可用于快捷鉴别受试样品。
3. 讨论与结论
DNA条形码是近年来生物分类和鉴定的研究热点,其通过一段通用DNA片段的比较,对物种进行准确、快速的识别鉴定。在中药鉴定领域,DNA分子标记可以弥补和克服传统鉴定方法的一些问题与缺点,为中药鉴定提供了一个强大的工具,应用该方法鉴定中药原植物及其药材和饮片,取得了快速发展,大大加快了中药鉴定标准化的进程。在中药基源的鉴定中引入条形码SNP位点的特异性PCR方法,能够为解决药材识别提供快速有效的分子手段,有利于解决日益扩大的中药材国内与国际贸易中需要准确快速鉴定药用植物及其混伪品的问题[5, 9]。因此,本研究基于已有的研究已经充分表明rbcL在种水平具有显著的分子鉴定能力[7-8],及具有引物通用性强、易扩增、易比对等特点,选择其作为鉴别DNA条形码。本研究重点在于建立半边莲与通泉草样品相互鉴别的PCR快速鉴别方法,可在市场流通中快速对其相应的干品进行初步的分子鉴别。
该方法的关键在于特异鉴别引物的设计,其难易程度在于可用于鉴别的SNP位点的多寡,本课题组在研究中发现应用连续2~3个SNP位点用于特异鉴别,可提高特异鉴别PCR的稳定性与重复性[10-11]。另外,由于特定样品中叶绿体DNA比核DNA具有更多的拷贝数,基于核DNA的分子鉴别方法比较容易受到DNA降解的影响,应用来源于叶绿体DNA的条形码进行分子鉴别更适于干燥的中药材的分子鉴别[10]。经典PCR检测方法,需经制胶,凝胶,电泳与成像等多个步骤才能完成检测,比较繁琐,最近文献报道崔占虎、蒋超与陈康等在PCR产物中加入SYBR Green I染料法进行快速荧光检测,能够快速识别样品的阳性和阴性结果,大大提高了检测速度,该方法为本研究建立快速简便的检测体系提供了借鉴[12-14]。在本课题组的研究中,20 μL PCR体系中20 ng模板DNA就能够检测到阳性条带,表明特异性PCR方法检测灵敏高,而且实验重复性好[15-16],可用于半边莲与通泉草植物及其药材快速简便鉴别,为今后有关这两种药材的相互鉴别提供思路。由于半边莲与通泉草功效和主治均不同,本技术也能为防止药材混用误用提供依据,具有实际应用价值。
-
图 3 特异性PCR鉴别半边莲与通泉草凝胶电泳与荧光检测
注:① M为DL2000 DNA maker,1~9为来源不同产地的半边莲样品,10~16为不同产地的通泉草样品;
② 电泳图上方为荧光检测图,图 4同。Figure 3. Gel electrophoresis and florescence diagrams on PCR amplified markers of L.chinensis and M.pumilus
表 1 供试材料
Table 1 Basic information on material tested
编号 物种 原产地 1 Lobelia chinensis 福建安溪 2 Lobelia chinensis 福建安溪 3 Lobelia chinensis 福建安溪 4 Lobelia chinensis 福建永春 5 Lobelia chinensis 福建永春 6 Lobelia chinensis 福建永春 7 Lobelia chinensis 福建永春 8 Lobelia chinensis 福建德化 9 Lobelia chinensis 福建德化 10 Mazus pumilus 福建安溪 11 Mazus pumilus 福建安溪 12 Mazus pumilus 福建安溪 13 Mazus pumilus 福建安溪 14 Mazus pumilus 福建永春 15 Mazus pumilus 福建永春 16 Mazus pumilus 福建永春 表 2 供试引物
Table 2 Primers applied
名称 序列(5′-3′) rbcLF ATGTCACCACAAACAGARACTAAAGC rbcLR GTATCCATTGCGGCAAACTC LcF CCGGAGAAGAAAATCAATTTATTGC MpF GCGAAGAAATGATGAAAAGAGGTAT LmR CATTTCCCCACGGATGTCCTAA -
[1] 张玉杰, 李明春, 张华, 等.半边莲药理作用及机制的研究进展[J].中国药师, 2015, 18(8):1376-1378. http://www.cnki.com.cn/Article/CJFDTOTAL-ZYSG201508043.htm [2] 王培培, 罗俊, 杨鸣华, 等.半边莲的化学成分研究[J].中草药, 2013, 44(7):794-797. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZHZY201407002037.htm [3] 周斌, 崔小弟, 程丹, 等.半边莲的化学成分和药理作用研究进展[J].中药材, 2013, 36(4):679-681. http://www.cnki.com.cn/Article/CJFDTOTAL-ZYCA201304054.htm [4] 田宏, 鲁国栋.半边莲混淆品——通泉草的鉴别[J].中药通报, 1987, 33(4):12-13. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY198704006.htm [5] 陈士林, 姚辉, 韩建萍, 等.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志, 2013, 38(2):141-148. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201302000.htm [6] 辛天怡, 雷美艳, 宋经元.中药材DNA条形码鉴定研究进展[J].中国现代中药, 2015, 17(2):170-176. http://www.cnki.com.cn/Article/CJFDTOTAL-YJXX201502022.htm [7] ZHAO D, WANG H M, SHENG Y W, et al. Morphological observation and rbcL gene sequences studies of two new species, GrateloupiadalianensisH.W.Wang et D.Zhao, sp.nov.andG.yinggehaiensisH.W.WangetR.X.Luan, sp.nov.(Halymeniaceae, Rhodophyta) from China[J]. Acta Oceanologica Sinica, 2012, 25(2):109-120.
[8] 王艇, 苏应娟, 朱建明.叶绿体rbcL基因序列在植物系统学研究中的应用[J].武汉植物学研究, 1999, 17(S1):8-14. http://www.cnki.com.cn/Article/CJFDTOTAL-WZXY1999S1001.htm [9] 陈士林, 庞晓慧, 姚辉, 等.中药DNA条形码鉴定体系及研究方向[J].世界科学技术:中医药现代化, 2011, 13(5):747-754. http://www.cnki.com.cn/Article/CJFDTOTAL-SJKX201105002.htm [10] WEI Y, CHEN Y, HUANG Y, et al. Molecular authen-tication and quantitative analysis of Sarcandraglabra and adulterated chloranthus products using SNP markers[J]. Mitochondrial DNA A DNA MappSeq Anal, 2016, 27(5):3618-3625.
[11] 魏艺聪, 陈莹, 罗林泉, 等.草珊瑚与金粟兰叶片双位点特异性PCR鉴别方法研究[J].中国中药杂志, 2014, 39(17):3259-3262. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201417010.htm [12] 崔占虎, 袁媛, 张景景, 等.基于快速PCR方法的人参属药用植物鉴别研究[J].中药材, 2015, 38(8):1634-1638. http://www.cnki.com.cn/Article/CJFDTOTAL-ZYCA201508017.htm [13] 蒋超, 侯静怡, 黄璐琦, 等.快速PCR方法在金银花真伪鉴别中的应用[J].中国中药杂志, 2014, 39(19):3668-3672. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201419003.htm [14] 陈康, 蒋超, 袁媛, 等.快速PCR方法在蛇类药材真伪鉴别中的应用[J].中国中药杂志, 2014, 39(19):3673-3677. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY201419004.htm [15] 魏艺聪, 陈建雄, 黄泽豪, 等. PCR方法快速鉴别绞股蓝与乌蔹莓[J].福建农业学报, 2016, 31(3):265-267. http://www.fjnyxb.cn/CN/abstract/abstract2888.shtml [16] 魏艺聪, 袁媛, 陈建雄, 等.快速PCR法鉴别鱼腥草与百部还魂的方法研究[J].中草药, 2016, 47(12):2163-2166. DOI: 10.7501/j.issn.0253-2670.2016.12.025




 下载:
下载: