Physiological Functions of SecD in Aeromonas hydrophila
-
摘要:目的 系统研究嗜水气单胞菌Sec分泌系统亚基SecD(Protein-export membrane protein,SecD)的生理功能。方法 利用pRE112自杀载体,通过同源重组的方法,构建secD基因缺失株(标记为∆secD)。以嗜水气单胞菌野生型菌株为对照组,分别采用绵羊血、牛奶固体培养基测定∆secD 的溶血性和胞外蛋白酶活性;结晶紫染色法结合多功能酶标仪测定生物被膜形成能力;利用全自动生长曲线仪进行细菌酸碱及高渗透压耐受性分析;采用二倍稀释法系统评估细菌抗生素耐药性。结果 与嗜水气单胞菌野生型菌株相比,发现∆secD生物被膜形成能力降低,溶血性、胞外蛋白酶活性显著增强,碱性和高渗透压环境胁迫的耐受性增强,对盐酸土霉素、四环素、依诺沙星和美罗培南的MIC提高4倍,对环丙沙星和诺氟沙星的MIC提高2倍,而对红霉素和头孢噻肟钠的MIC分别降低了2倍和4倍。结论 发现Sec分泌系统的亚基SecD参与嗜水气单胞菌毒力因子、抗生素耐药蛋白等的跨膜转运,对以Sec分泌系统的亚单位为靶标开发新一代抗菌药物提供理论依据,对预防和控制嗜水气单胞菌引起疾病的发生和传播可能具有重要的科学意义。Abstract:Objective Physiological functions of the Sec pathway subunit secD of Aeromonas hydrophila were studied.Method An secD-knockout A.hydrophila was constructed by homologous recombination with pRE112 suicide vector. Effects of the genetic deletion on the physiological phenotypes including hemolytic and extracellular protease activities were determined on sheep’s blood and skim milk agar plates; on the biofilm formation, by crystal violet staining combined with SpectraMax® i3; on the bacterial acid-base and hyperosmolarity tolerance, according to the growth curve; and on the minimal inhibitory concentration (MIC) of antibiotics, using the broth microdilution method.Result Compared to wild-type, the constructed ∆secD A.hydrophila showed no significant differences in growth and tolerance to pH 5, 6, 7, and 8. The activities of hemolytic and extracellular protease, as well as the resistance to high osmotic pressure or pH 9 were enhanced. The biofilm forming ability significantly declined. And the resistance to antibiotics varied, as the MIC increased 4 times on oxytetracycline, tetracycline, enoxacin, or meropenem and two times on ciprofloxacin and norfloxacin, but decreased 2 times on erythromycin and 4 times on cefotaxime.Conclusion The Sec pathway subunit secD was confirmed to be involved in the transport of virulence factors and resistance to antibiotics in A.hydrophila. It could be a key element in studies for developing antimicrobial applications and prevention of disease infected by the pathogen.
-
Keywords:
- Aeromonas hydrophila /
- secD /
- Sec pathway /
- physiological functions
-
0. 引言
【研究意义】嗜水气单胞菌(Aeromonas hydrophila)是水产养殖业中重要病原菌之一,广泛分布于自然界,可感染各种蛙、蟹、鱼类和贝壳类等重要水产品,引发细菌性流行病,最终导致鱼类大面积死亡,从而造成巨额的经济损失[1-4]。随着青霉素等抗生素的相继问世,各种细菌性传染病得到有效治疗,然而抗生素的滥用引发的细菌耐药现象普遍存在。例如2015年Stratev等[5]通过调查发现嗜水气单胞菌抗生素耐药现象普遍,该病原菌对阿米卡星(Amikacin)、阿莫西林(Amoxicillin)、氨苄(Ampicillin)和先锋霉素等抗生素的耐药性高达100%;2017年Lee等[6]从红色杂交罗非鱼种中分离出的嗜水气单胞菌对磺酰胺类(Sulfamide)、磺胺甲恶唑(Sulfamethoxazole)、土霉素(Oxytetracycline)、强力霉素(Doxycycline)等抗生素的耐药性超过70%。可见嗜水气单胞菌抗生素耐药日益严峻,这给该病原菌的防控带来极大的挑战。此外,抗生素的过度使用还会导致细菌的多重耐药,据报道该菌的多重耐药菌已在养殖业甚至临床上检出,并造成一定危害[7]。因此,寻求有效的预防和控制该菌的靶点迫在眉睫。【前人研究进展】蛋白分泌是细菌生长和繁殖、致病菌分泌毒力因子和毒素的重要途径。其中,Sec途径是细菌蛋白质主要的跨膜转运机制,该分泌系统是一种质膜蛋白复合体,由运输通道及其附属蛋白组成,具体包括SecA、SecB、SecDF、SecYEG和SecG等亚基,可参与毒力因子、蛋白酶、黏附素等的分泌[8,9]。因此Sec组成蛋白抑制剂有望成为候选抗菌剂,成为目前研究热点。近年来,国内外学者对SecA的小分子抑制剂的化学合成、功效和抑菌效果进行了评价,SecA已被广泛认为是一种有效的药物靶点[10-12]。SecD是Sec途径重要组成蛋白,横跨细胞质膜,可编码细胞质膜的合成和细菌黏附素的分泌[13,14]。据报道,SecD属于多药外排的抗瘤细胞分裂(Resistance nodulation and cell division,RND)家族蛋白,参与β-内酰胺类抗生素的靶标β-内酰胺酶的转运[15,16]。课题组前期利用定量蛋白质组学技术研究发现嗜水气单胞菌抗生素耐药性与SecD表达量变化密切相关[17]。【本研究切入点】在嗜水气单胞菌中,secD基因编码的蛋白由716个氨基酸组成,其是否参与调节该病原菌生理表型尚未报道。【拟解决的关键问题】本研究利用自杀载体pRE112和同源重组技术在嗜水气单胞菌中成功构建secD基因缺失株(标记为ΔsecD),通过生长速率、生物被膜形成、溶血性、胞外蛋白酶活性、酸碱及高渗透压耐受性和抗生素耐药性等一系列生理表型的测定,探索secD在嗜水气单胞菌毒力因子、抗生素耐药蛋白等的跨膜转运中的功能,为SecD蛋白在嗜水气单胞菌生理功能中的研究提供理论依据,并为防控嗜水气单胞菌提供一个有效靶点,从而达到预防和控制该菌引起的细菌疾病。
1. 材料与方法
1.1 试验材料
1.1.1 菌株和质粒
嗜水气单胞菌ATCC 7966(A. hydrophila),自杀载体pRE112,大肠杆菌E. coli S17-λpir和E. coli MC1061-λpir,以上菌株和质粒均来源于本实验室保存。
1.1.2 试验用鱼
试验用斑马鱼购自福州花鸟市场,选取30日龄左右、长度为(3.0 ± 1.0) cm、重量为(0.3 ± 0.1) g的健康斑马鱼,试验前饲养7 d,待斑马鱼生长稳定后再进行攻毒,期间每天24 h供氧,每天喂养1次,水温保持在25 ℃。
1.1.3 主要试剂
本研究所用胶回收、质粒提取试剂盒购自Omega公司;细菌总DNA提取试剂盒购自Takara公司;多片段一步法克隆试剂盒C113购自南京诺唯赞生物科技有限公司;配置LB培养基所用的胰蛋白胨、酵母、NaCl均购于广州赛国生物科技有限公司;涉及的40种抗生素均购自上海翊圣生物科技有限公司。
1.1.4 主要仪器
单人单面净化工作台(SW-CJ-1FD型,苏州净化设备有限公司)、电子天平[AR224CN,奥豪斯仪器(常州)有限公司]、恒温培养摇床(ZQZY-BST,知楚仪器公司)、恒温培养箱(SPX-60BSH-Ⅱ,上海精宏实验设备有限公司)、多功能酶标仪(SpectraMax® i3,Molecular Devices)、移液器等。
1.2 试验方法
1.2.1 sec基因缺失菌株的构建
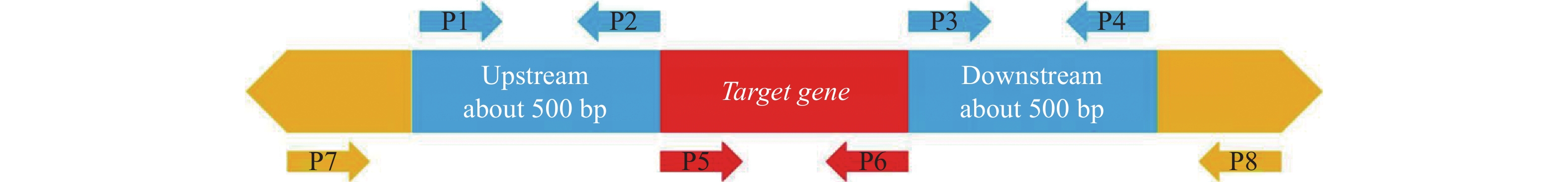
secD基因的敲除方法参照前期研究[18]。首先,从NCBI数据库下载嗜水气单胞菌ATCC 7966基因组序列,导入SnapGene软件,截取目的基因上下游500 bp左右长度的片段作为同源臂。利用引物设计软件CE Design V1.03将选取的上下游同源臂的基因序列和pRE112载体的基因序列导入其中,即可生成上下游引物(图1),并将其送至擎科生物技术有限公司合成(表1)。其次,提取嗜水气单胞菌ATCC 7966的全基因组作为模板,选取上下游同源臂两端的引物P1、P2和P3、P4扩增secD上下游片段并回收,而后利用多片段无缝连接试剂盒(ClonExpressR Multis one step Cloning Kit,Vazyme),把secD的上下游片段连接至经Sac I和Xba I双酶切后的pRE112上,获得重组质粒pRE-ΔsecD。将重组质粒转入MC1061-λpir,翌日挑取CmR单克隆进行验证,正确的CmR单克隆提取质粒再次转化至S17-λpir;选取正确的S17-λpir-pRE-ΔsecD作为供体菌与野生型Ah按照体积比4∶1进行第一次同源重组,利用氨苄青霉素(Amp,100 μg·mL−1)和氯霉素(Cm,30 μg·mL−1)双重抗性LB平板筛选出正确的单克隆。最后,在含20%的蔗糖平板上进行第二次同源重组,利用引物P5P6和P7P8进行PCR验证,筛选出secD敲除菌株ΔsecD。ΔsecD菌株在LB平板上稳定传代10代后,用于后续试验。
表 1 secD基因敲除引物序列Table 1. Primers for secD knockout编号
No.寡核苷酸序列(5′-3′)
Oligonucleotide sequence (5′-3′)描述
DiscriptionP1 catgaattcccgggagagctcGGGACGCGATCGAGCAGG 左臂上游引物 P2 aacatgtctcttccGCTGTGCTCCTCGGGAGATT 左臂下游引物 P3 cacagcGGAAGAGACATGTTTCAGATTCTACATT 右臂上游引物 P4 cgatcccaagcttcttctagaGGCCAGACGCCATTCGAA 右臂下游引物 P5 GTGTTAAATCGCTATCCGCTGTGGA 目的基因上游引物 P6 TTAGATCGGCAGCTTGTCGAGG 目的基因下游引物 P7 CGATTGCTACACCTGCAAGAACTACA 左臂外侧验证上游引物 P8 GATGTACTCGGTATCCCCCTTGC 右臂外侧验证下游引物 1.2.2 生长速率的测定
挑取野生菌和缺失菌的单克隆转接到LB液体培养基,30 ℃ 200 r·min−1培养16 h后按照体积比1∶100转接到生长曲线微孔板,利用全自动生长曲线分析仪(Bioscreen)测定生长速率。每个样品设置3个复孔,3次生物学重复。
1.2.3 生物被膜的测定
利用结晶紫染色法检测缺失菌生物被膜形成的能力[19]。首先按1%的比例转接过夜菌,30 ℃ 200 r·min−1培养至OD600 nm为1.0,再按5%的比例转接至新鲜的LB配置成细菌悬液备用;接着往96孔板的每个上样孔中加入200 μL配制的菌悬液,每个样品设置8组重复,新鲜LB为阴性对照组,于30 ℃培养箱中静置培养24 h;翌日弃去菌液,生成的生物被膜依次用甲醇溶液固定和0.1%(m/V)结晶紫溶液染色,最后溶于95%(V/V)的乙醇溶液,混匀后用SpectraMax® i3多功能酶标仪检测其OD595 nm波长下的吸光值,每个样品设置8个复孔,3次生物学重复。
1.2.4 溶血性和胞外蛋白酶活性的测定
利用绵羊血和脱脂牛奶的方法来测定细菌溶血性和胞外蛋白酶活性[20,21]。首先制备绵羊血和牛奶平板,具体方法如下:(1)配制含0.8%(m/V)琼脂的LB固体培养基,121 ℃高压灭菌20 min,待冷却至40 ℃左右加入8 mL绵羊血,混匀后将培养基倒至培养皿吹干备用;(2)配制含1.0%(m/V)琼脂的LB固体培养基,同时称取1 g脱脂奶粉于15 mL离心管中加入10 mL蒸馏水混匀,115 ℃高压灭菌30 min,稍作冷却后将牛奶倒入固体培养基混匀后倒至培养皿吹干备用。接着,转接过夜菌,30 ℃ 200 r·min−1培养至OD600 nm为1.0,然后取5 μL的菌液至已打好孔的绵羊血和牛奶LB平板上,吹干并静置于30 ℃恒温培养箱,16 h后观察、测量、记录溶血圈和水解圈的直径,进行3次生物学重复。
1.2.5 斑马鱼攻毒
饲养7 d稳定后的斑马鱼被随机分为3组,每组20尾,采用腹腔注射的方法进行攻毒。转接过夜菌至新鲜的LB液体培养基中,30 ℃ 200 r·min−1培养至OD600 nm=1.0,利用1×PBS无菌溶液稀释菌株含量至1×107 CFU·mL−1,试验组斑马鱼分别注射10 µL该浓度的野生型和secD基因缺失突变型菌株进行攻毒;对照组斑马鱼每尾注射10 µL无菌1×PBS溶液,观察统计不同时间段(1、2、3、4、5、6、7 d)斑马鱼的死亡数,设置3次重复。
1.2.6 对高渗透压和酸碱耐受性的测定
参照文献[22]配置4% NaCl和pH=5、6、7、8、9的液体LB,以不做任何处理的LB液体培养基中细菌的生长量为对照试验组。分别按照体积比1:100转接过夜菌(野生菌和敲除菌)至以上液体LB中,然后转接到生长曲线微孔板,利用全自动生长曲线分析仪(Bioscreen)测定,每个样品设置3个重复孔,3次生物学重复。
1.2.7 抗生素耐药性的测定
采用二倍稀释法测定抗生素对嗜水气单胞菌的最低抑菌浓度(Minimum inhibitory concentration,MIC)[18]。按照体积比1:100转接过夜菌至新鲜LB液体培养基,培养至OD600 nm值为1.0,转接至含有系列梯度浓度的抗生素LB液体培养基中;最后,将96孔板用封口膜封好静置于30 ℃培养16 h后观察并记录试验结果。
1.3 数据处理
数据导入GrapPad Prism 8.0 版本软件进行处理,利用t检验进行显著性分析。
2. 结果与分析
2.1 secD缺失株的验证
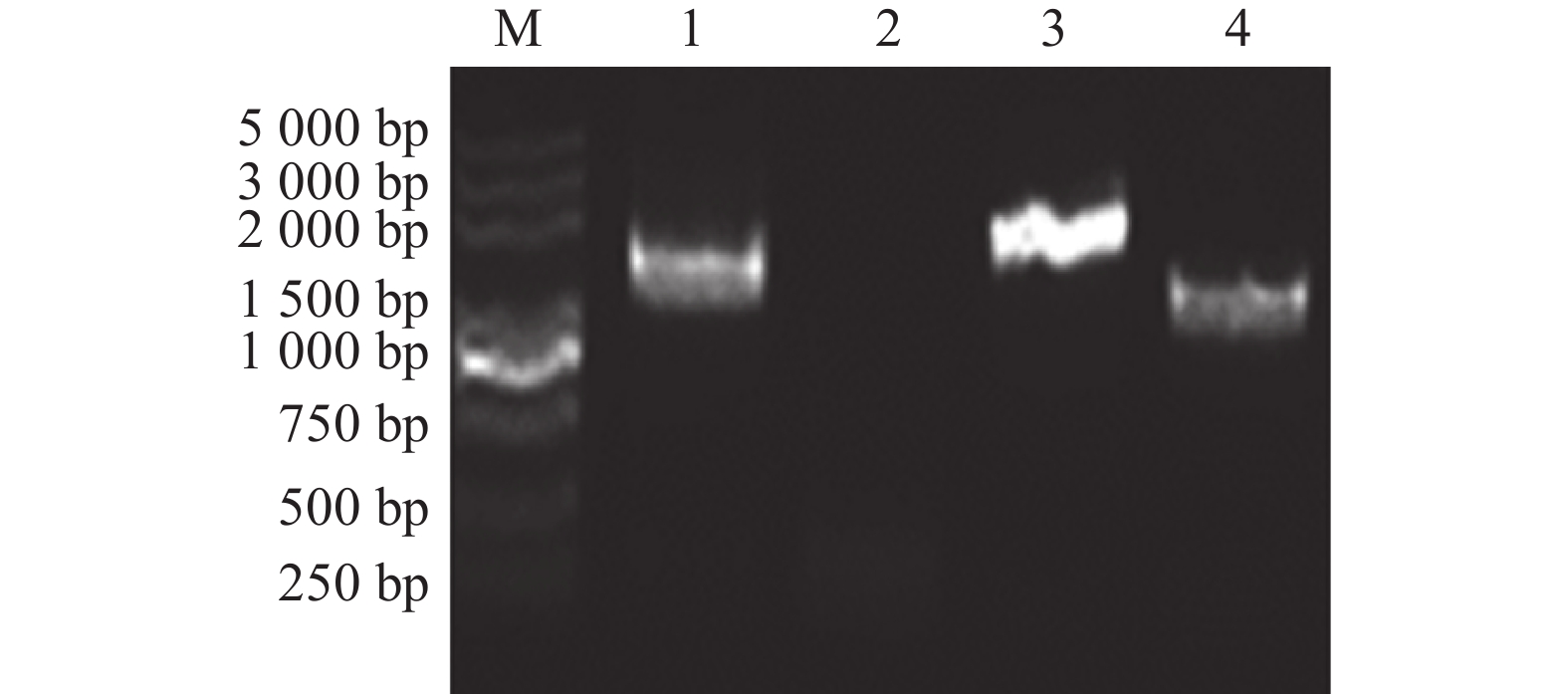
两次同源重组获得的敲除株,以嗜水气单胞菌野生型为阳性对照,分别选用P5、P6和P7、P8两对引物进行验证,结果如图2所示,目的基因验证引物P5、P6在∆secD模板中1854 bp位置没有条带,而P7、P8引物扩增的条带大小相差2000 bp左右,与预计值相符;进一步将P7、P8在ΔsecD模板扩增的产物送至测序公司测序,测序结果导入SnapGene软件与嗜水气单胞菌ATCC7966的全基因组进行比对,证实敲除菌构建成功。以上结果说明secD基因在嗜水气单胞菌中被成功敲除。
![]() 图 2 ΔsecD缺失株的验证M:5000 Marker;1:以嗜水气单胞菌为模板,P5、P6为引物的扩增产物;2:以敲除菌为模板,P5、P6为引物的扩增产物;3:以嗜水气单胞菌为模板,P7、P8为引物的扩增产物;4:以敲除菌为模板,P7、P8为引物的扩增产物。Figure 2. Verification of ΔsecD strainM: 5000 Marker; 1: PCR products by P5 and P6 primers with A.hydrophila template; 2: PCR products by P5 and P6 primers with ΔsecD template; 3: PCR products by P7 and P8 primers with A.hydrophila template; 4: PCR products by P7 and P8 primers with ΔsecD template.
图 2 ΔsecD缺失株的验证M:5000 Marker;1:以嗜水气单胞菌为模板,P5、P6为引物的扩增产物;2:以敲除菌为模板,P5、P6为引物的扩增产物;3:以嗜水气单胞菌为模板,P7、P8为引物的扩增产物;4:以敲除菌为模板,P7、P8为引物的扩增产物。Figure 2. Verification of ΔsecD strainM: 5000 Marker; 1: PCR products by P5 and P6 primers with A.hydrophila template; 2: PCR products by P5 and P6 primers with ΔsecD template; 3: PCR products by P7 and P8 primers with A.hydrophila template; 4: PCR products by P7 and P8 primers with ΔsecD template.2.2 ΔsecD生理表型测定结果
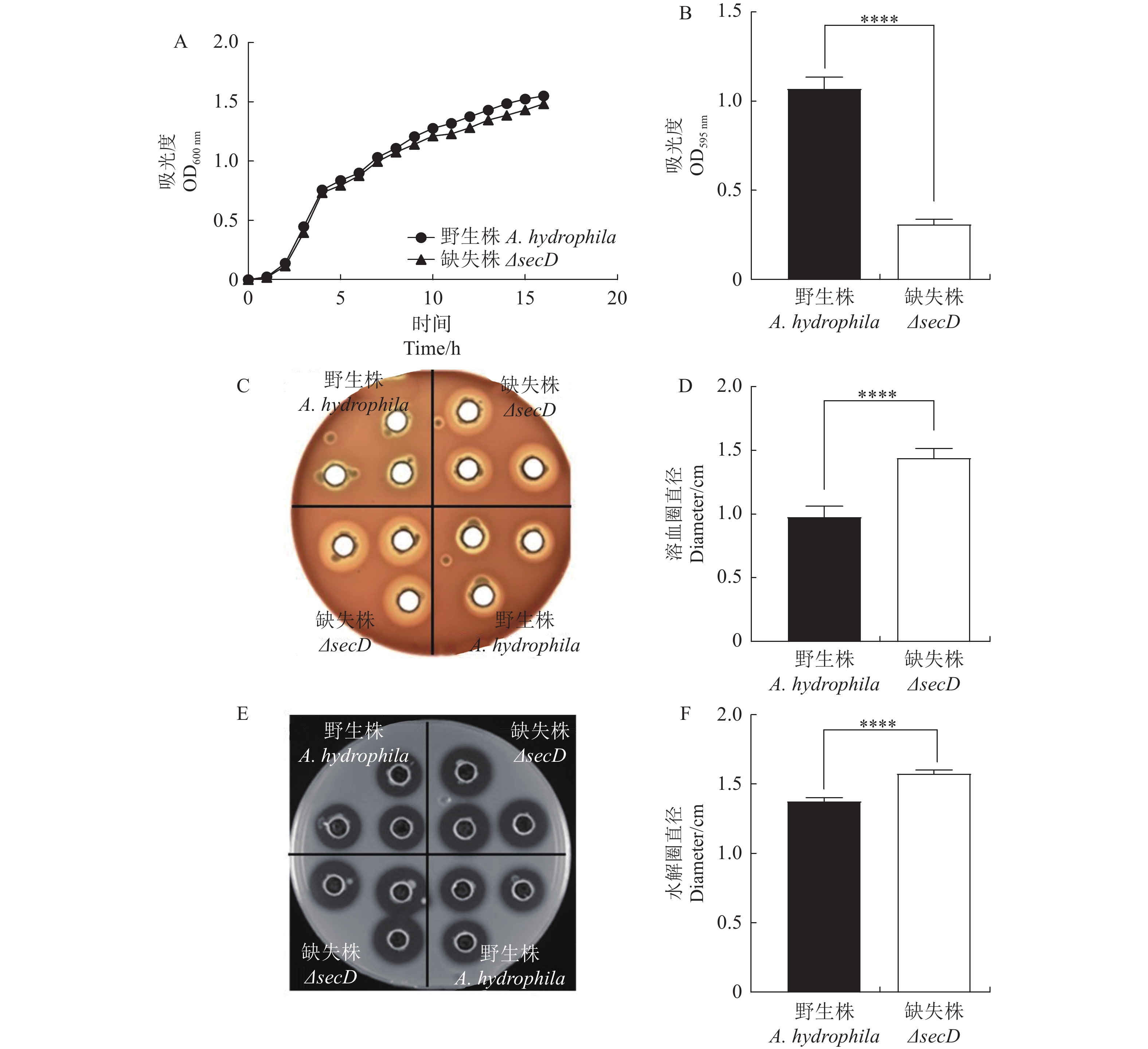
为全面评估secD基因的生物学功能,测定野生株及secD缺失株生长曲线、生物被膜形成能力、溶血性、胞外蛋白酶活性等。结果表明,当secD基因缺失后,细菌的生长趋势不变(图3-A),说明该基因不是嗜水气单胞菌生长所必需的;利用结晶紫染色法比较野生型和ΔsecD生物被膜形成能力,发现secD缺失后,其生物被膜形成能力显著降低(图3-B)。溶血性试验发现ΔsecD的溶血圈明显大于野生型(图3-C),说明secD缺失后细菌溶血性增强。同样的,酪蛋白酶水解法检测细菌胞外蛋白酶活性,结果发现ΔsecD水解圈也显著大于野生型(图3-D),说明secD缺失后细菌的胞外蛋白酶活性增强。
2.3 斑马鱼攻毒存活率
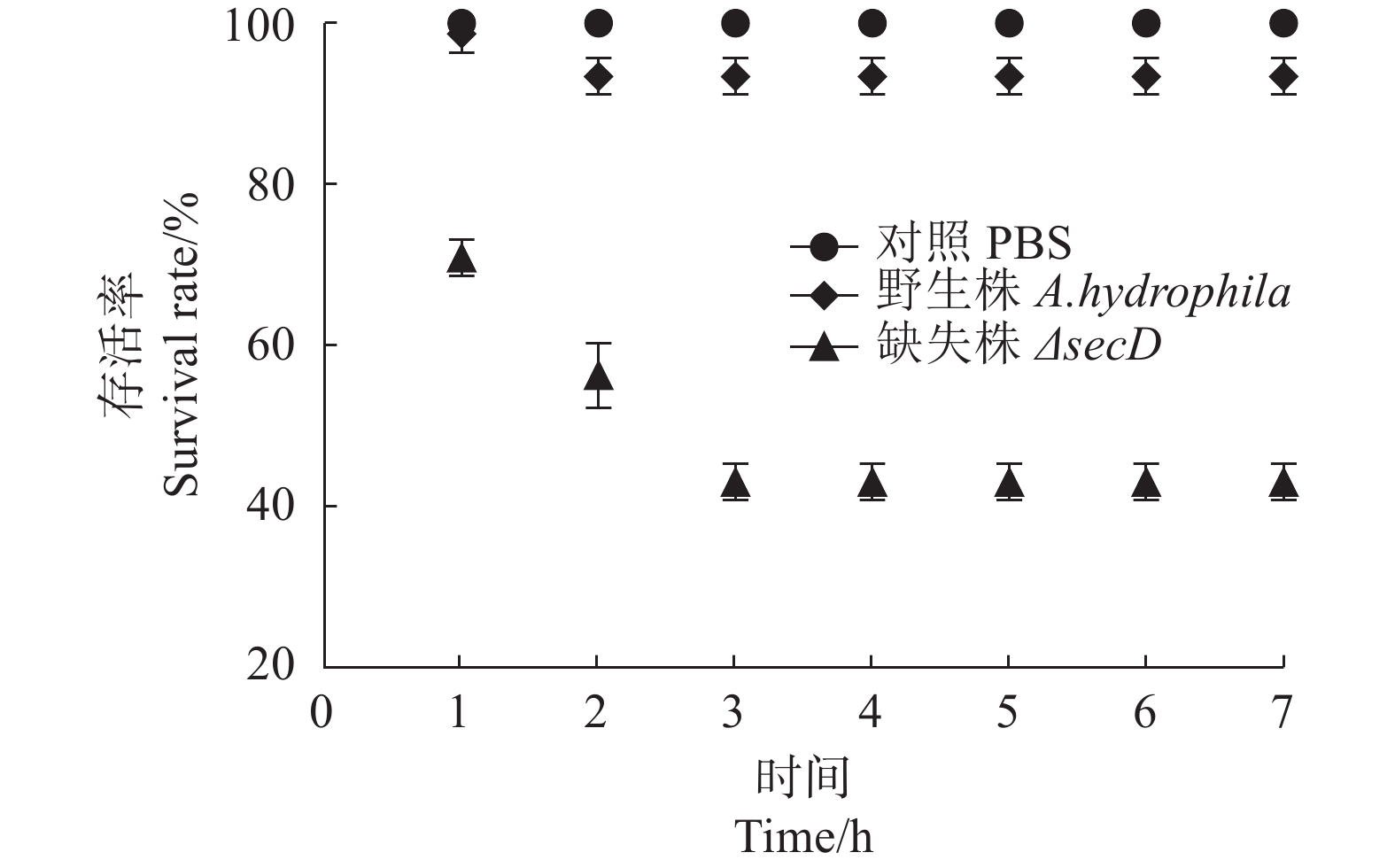
本研究通过野生型和secD基因缺失突变株进行斑马鱼攻毒,进一步研究该基因对嗜水气单胞菌毒性的影响。结果如图4所示,在整个试验周期内只注射PBS的对照组,斑马鱼存活率为100%,说明适量体积的PBS注射到斑马鱼体内不会影响其正常生长,因此可以用于稀释菌体用于斑马鱼的攻毒;第2天起,A.hydrophila攻毒的试验组斑马鱼的存活率为91.67%并保持至试验结束;ΔsecD 攻毒24 h后斑马鱼存活率为63.33%,48 h后下降至45%,72 h后存活率仅为28.33%并稳定至试验结束。以上结果表明,secD参与嗜水气单胞菌毒力因子的负向调控。
2.4 ΔsecD对酸碱度和高渗透压的耐受性
利用全自动生长曲线分析仪测定菌株在碱性和高渗透压环境下的生长趋势,从而评估细菌对酸碱度及高渗透压的耐受性,结果如图5所示。与嗜水气单胞菌相比,ΔsecD在pH为5、6、7、8的 LB处理下生长速率几乎没有差异,而当培养基的pH为9时,进入对数生长期后ΔsecD长势较好,即对碱的耐受性更强(图5-E)。同样的,ΔsecD对高渗透压的耐受性更强,生长状况明显好于野生型(图5-F)。
2.5 ΔsecD对抗生素耐药性的影响
为了系统研究secD基因对细菌抗生素耐药性的影响,测定secD基因缺失后对40种抗生素MIC的影响。测定结果如表2所示,相较于野生型菌株,ΔsecD对盐酸金霉素、多西霉素、培氟沙星等32种抗生素的敏感性几乎不变,对红霉素和头孢噻肟钠的MIC分别降低了2倍和4倍,提示ΔsecD可能对大环内酯类和头孢菌素类抗生素的敏感性增加;secD缺失后细菌对盐酸土霉素、四环素、依诺沙星、环丙沙星、诺氟沙星和美罗培南的耐受性增强,其中对盐酸土霉素、四环素、依诺沙星和美罗培南的MIC提高4倍,对环丙沙星和诺氟沙星的MIC提高2倍,提示secD可能参与四环素类、碳青霉烯类和喹诺酮类抗生素的负调控。综上,secD基因在嗜水气单胞菌抗生素耐药性的调控中发挥至关重要的作用,其中对四环素类、碳青霉烯类和头孢菌素类的多种抗生素MIC变化高达4倍,因此认为该基因对这3类抗生素的效果较为显著。
表 2 ΔsecD抗生素耐药性检测结果Table 2. Antibiotic resistance of A.hydrophila and ΔsecD strain分类
Category名称
Name最低抑菌质量浓度
MIC/(μg·mL−1)分类
Category名称
Name最低抑菌质量浓度
MIC/(μg·mL−1)野生株
A.hydrophila缺失株
ΔsecD野生株
A.hydrophila缺失株
ΔsecD四环素类
Tetracyclines盐酸土霉素
Oxytetracycline
hydrochloride2.5 10 氨基糖苷类
Aminoglycosides链霉素
Streptomycin20 20 四环素
Tetracycline2.5 10 硫酸新霉素
Neomycin sulfate6.25 6.25 盐酸金霉素
Chlortetracycline
hydrochloride20 20 卡那霉素
Kanamycin12.5 12.5 多西霉素
Doxycycline10 10 硫酸安普霉素
Apramycin Sulfate25 25 强力霉素
Doxycycline10 10 庆大霉素
Gentamicin1.25 1.25 大环内酯类
Macrolides红霉素
Erythromycin32 16 硫酸巴龙霉素
Paromomycin sulfate10 10 罗红霉素
Roxithromycin32 32 妥布霉素
Tobramycin1.25 1.25 阿奇霉
Azithromycin0.5 0.5 壮观霉素
Spectinomycin32 32 那他霉素
Natamycin10 10 阿米卡星
Amikacin12.8 12.8 乙酰螺旋霉素
Acetylspiramycin512 512 利福霉素类
Rifamycins利福平
Rifampicin6.4 6.4 奎诺酮类
Quinolones恩诺沙星
Enrofloxacin0.125 0.125 头孢菌素类
Cephalosporins头孢美唑钠
Cefmetazole8 8 依诺沙星
Enoxacin0.0125 0.0500 头孢米诺
Cefminox64 64 培氟沙星
Pefloxacin0.125 0.125 头孢唑啉钠
Cefazolin256 256 环丙沙星
Ciprofloxacin0.00625 0.01250 头孢噻肟钠
Cefotaxime1.2500 0.3125 巴洛沙星
Balofloxacin0.625 0.625 头孢他啶
Ceftazidime128 128 萘啶酸
Nalidixic acid0.5 0.5 头孢曲松钠
Ceftriaxone0.25 0.25 左氧氟沙星
Levofloxacin0.015625 0.015625 多肽类
Polypeptides硫酸粘菌素
Colistin5 5 氧氟沙星
Ofloxacin0.025 0.025 硫酸多粘菌素
B Polymyxin B6.25 6.25 诺氟沙星
Norfloxacin0.02 0.04 碳青霉烯类
Carbapenems美罗培南
Meropenem0.0625 0.2500 莫西沙星
Moxifloxacin0.0625 0.0625 亚胺培南
Imipenem128 128 3. 讨论与结论
中国是水产大国,水产品产量自1989年起连续28年稳居世界首位,充分保障了中国食物产量。但是近年来由于嗜水气单胞菌等病原菌诱发的鱼类病害频繁发生,给水产养殖业带来了严重的经济损失。抗生素的大量使用虽然有效防止了鱼类细菌性疾病,但随之而来的细菌耐药问题不容忽视。研究表明,渔业中嗜水气单胞菌耐药形势日益严峻,该菌对四环素、头孢克肟等抗生素的耐药率已超过70% [23]。此外每年全球由于耐药细菌感染死亡人数高达70万人左右,预计到2050年,仅亚洲地区将有470多万人死于耐药细菌的感染[24]。因此寻找嗜水气单胞菌新靶点,能够有效预防该病原菌引起的细菌性疾病,进一步缓解细菌耐药性问题。
细菌在细胞内合成蛋白质需分泌到胞内特定的位置或者细胞外行使特定的生物学功能,对于致病菌而言,蛋白转运途径也是病原菌释放毒力因子感染宿主的主要通道。Sec途径作为革兰氏阴性菌一种重要的蛋白分泌途径,参与细菌毒力因子、鞭毛、黏附素等蛋白的转运,对于细菌致病性、信息传递、生存和生长都起到至关重要的作用[25]。SecD是Sec途径的重要组成蛋白,位于细胞内膜,与SecF形成SecDF蛋白复合物协助蛋白的转运。在嗜水气单胞菌中secD基因编码的蛋白由716个氨基酸组成,以往的研究更多关注的是SecD蛋白结构,其生理功能较少研究。因此本研究利用自杀载体pRE112和同源重组技术构建了基因缺失株ΔsecD,通过生理表型测定,发现与A.hydrophila相比ΔsecD生物被膜形成能力降低,而溶血性、胞外蛋白酶活性显著增强,耐受强碱性和高渗透压胁迫;斑马鱼攻毒试验进一步证实secD负调控该病原菌毒力因子的分泌。Guo等[14]报道溶藻弧菌中的SecD蛋白可参与细菌对酸碱度和高渗透压的调控,提出在酸性条件下secD下调表达,在高渗透压生长环境下则上调表达。而本研究中secD缺失后嗜水气单胞菌对酸度变化不敏感,而对强碱性和高渗透压的耐受性显著增强,这与文献报道结果相反,提示SecD参与嗜水气单胞菌酸碱度以及高渗透压的调控方式与溶藻弧菌不同。Sec分泌系统的蛋白质转位酶亚基SecDF(Protein translocase subunit,SecDF)是影响细胞外蛋白质转运的一个重要组分,结合分子生物学技术和定量蛋白质组学方法研究发现,敲除secDF后金黄色葡萄球菌毒力因子表达量发生显著性差异,从而影响细菌毒性,提示secD可能影响嗜水气单胞菌细胞外毒力因子的分泌[26]。
本研究通过8大类常见抗生素最低抑菌浓度的测定,发现secD基因缺失后嗜水气单胞菌对红霉素和头孢噻肟钠更加敏感,而对盐酸土霉素、四环素、美罗培南、依诺沙星、环丙沙星和诺氟沙星更加耐药。课题组前期利用定量蛋白质组学技术研究发现嗜水气单胞菌抗生素耐药性与SecD表达量变化密切相关,这与本研究的结果相符[17]。不仅如此,在其他病原菌中SecD已被证实调控细菌抗生素耐药,例如在大肠杆菌中SecD(同源性高达99%)属于多药外排的抗瘤细胞分裂家族蛋白,参与β-内酰胺类抗生素的靶标β-内酰胺酶的转运[15]。金黄色葡萄球菌Sec分泌系统的SecD亚基(同源性为63%)已被找到适合作为开发抗菌药物的靶点[27]。
综上,SecD与嗜水气单胞菌耐药性的调节密切相关。Sec分泌系统的SecD亚基在嗜水气单胞菌毒力因子的分泌和抗生素耐药的调控中发挥重要作用,设计特异性的嗜水气单胞菌Sec分泌途径SecD亚基为靶点的抑制剂,能够有效防治致病菌并缓解其耐药性。本研究对嗜水气单胞菌SecD蛋白生理功能的研究,为研发新一代抗菌药物提供新的候选靶点。
-
图 2 ΔsecD缺失株的验证
M:5000 Marker;1:以嗜水气单胞菌为模板,P5、P6为引物的扩增产物;2:以敲除菌为模板,P5、P6为引物的扩增产物;3:以嗜水气单胞菌为模板,P7、P8为引物的扩增产物;4:以敲除菌为模板,P7、P8为引物的扩增产物。
Figure 2. Verification of ΔsecD strain
M: 5000 Marker; 1: PCR products by P5 and P6 primers with A.hydrophila template; 2: PCR products by P5 and P6 primers with ΔsecD template; 3: PCR products by P7 and P8 primers with A.hydrophila template; 4: PCR products by P7 and P8 primers with ΔsecD template.
表 1 secD基因敲除引物序列
Table 1 Primers for secD knockout
编号
No.寡核苷酸序列(5′-3′)
Oligonucleotide sequence (5′-3′)描述
DiscriptionP1 catgaattcccgggagagctcGGGACGCGATCGAGCAGG 左臂上游引物 P2 aacatgtctcttccGCTGTGCTCCTCGGGAGATT 左臂下游引物 P3 cacagcGGAAGAGACATGTTTCAGATTCTACATT 右臂上游引物 P4 cgatcccaagcttcttctagaGGCCAGACGCCATTCGAA 右臂下游引物 P5 GTGTTAAATCGCTATCCGCTGTGGA 目的基因上游引物 P6 TTAGATCGGCAGCTTGTCGAGG 目的基因下游引物 P7 CGATTGCTACACCTGCAAGAACTACA 左臂外侧验证上游引物 P8 GATGTACTCGGTATCCCCCTTGC 右臂外侧验证下游引物 表 2 ΔsecD抗生素耐药性检测结果
Table 2 Antibiotic resistance of A.hydrophila and ΔsecD strain
分类
Category名称
Name最低抑菌质量浓度
MIC/(μg·mL−1)分类
Category名称
Name最低抑菌质量浓度
MIC/(μg·mL−1)野生株
A.hydrophila缺失株
ΔsecD野生株
A.hydrophila缺失株
ΔsecD四环素类
Tetracyclines盐酸土霉素
Oxytetracycline
hydrochloride2.5 10 氨基糖苷类
Aminoglycosides链霉素
Streptomycin20 20 四环素
Tetracycline2.5 10 硫酸新霉素
Neomycin sulfate6.25 6.25 盐酸金霉素
Chlortetracycline
hydrochloride20 20 卡那霉素
Kanamycin12.5 12.5 多西霉素
Doxycycline10 10 硫酸安普霉素
Apramycin Sulfate25 25 强力霉素
Doxycycline10 10 庆大霉素
Gentamicin1.25 1.25 大环内酯类
Macrolides红霉素
Erythromycin32 16 硫酸巴龙霉素
Paromomycin sulfate10 10 罗红霉素
Roxithromycin32 32 妥布霉素
Tobramycin1.25 1.25 阿奇霉
Azithromycin0.5 0.5 壮观霉素
Spectinomycin32 32 那他霉素
Natamycin10 10 阿米卡星
Amikacin12.8 12.8 乙酰螺旋霉素
Acetylspiramycin512 512 利福霉素类
Rifamycins利福平
Rifampicin6.4 6.4 奎诺酮类
Quinolones恩诺沙星
Enrofloxacin0.125 0.125 头孢菌素类
Cephalosporins头孢美唑钠
Cefmetazole8 8 依诺沙星
Enoxacin0.0125 0.0500 头孢米诺
Cefminox64 64 培氟沙星
Pefloxacin0.125 0.125 头孢唑啉钠
Cefazolin256 256 环丙沙星
Ciprofloxacin0.00625 0.01250 头孢噻肟钠
Cefotaxime1.2500 0.3125 巴洛沙星
Balofloxacin0.625 0.625 头孢他啶
Ceftazidime128 128 萘啶酸
Nalidixic acid0.5 0.5 头孢曲松钠
Ceftriaxone0.25 0.25 左氧氟沙星
Levofloxacin0.015625 0.015625 多肽类
Polypeptides硫酸粘菌素
Colistin5 5 氧氟沙星
Ofloxacin0.025 0.025 硫酸多粘菌素
B Polymyxin B6.25 6.25 诺氟沙星
Norfloxacin0.02 0.04 碳青霉烯类
Carbapenems美罗培南
Meropenem0.0625 0.2500 莫西沙星
Moxifloxacin0.0625 0.0625 亚胺培南
Imipenem128 128 -
[1] 霍诗天, 焦厚琪, 李清, 等. 克氏原螯虾嗜水气单胞菌噬菌体的分离鉴定和应用 [J]. 水生生物学报, 2021, 45(2):366−375. HUO S T, JIAO H Q, LI Q, et al. Isolation, identification and preliminary application of Aeromonas hydrophila phage from Procambarus clarkii [J]. Acta Hydrobiologica Sinica, 2021, 45(2): 366−375.(in Chinese)
[2] 戴瑜来, 戴杨鑫, 马恒甲, 等. 气单胞菌对水生动物的危害及噬菌体防控研究进展 [J]. 水产养殖, 2019, 40(2):48−50. DAI Y L, DAI Y X, MA H J, et al. Research progress on harm of Aeromonas to aquatic animals and phage control [J]. Journal of Aquaculture, 2019, 40(2): 48−50.(in Chinese)
[3] RAMSAMY Y, AMOAKO D G, ABIA A L K, et al. First genome sequence of Aeromonas hydrophilia novel sequence type 658 strain isolated from livestock in South Africa [J]. Journal of Global Antimicrobial Resistance, 2021, 24: 175−177. DOI: 10.1016/j.jgar.2020.12.021
[4] 杜雪晴, 古河祥, 萨家祺, 等. 马来穿山甲源嗜水气单胞菌亚种的分离鉴定及生物学特性分析 [J]. 中国动物检疫, 2021, 38(4):124−131. DU X Q, GU H X, SA J Q, et al. Isolation and identification of Aeromonas dhakensis derived from Manis javanica and analysis on its biological characteristics [J]. China Animal Health Inspection, 2021, 38(4): 124−131.(in Chinese)
[5] STRATEV D, ODEYEMI O A. Antimicrobial resistance of Aeromonas hydrophila isolated from different food sources: A mini-review [J]. Journal of Infection and Public Health, 2016, 9(5): 535−544. DOI: 10.1016/j.jiph.2015.10.006
[6] LEE S W, WENDY W. Antibiotic and heavy metal resistance of Aeromonas hydrophila and Edwardsiella tarda isolated from red hybrid tilapia (Oreochromis spp. ) coinfected with motile Aeromonas septicemia and edwardsiellosis [J]. Veterinary World, 2017, 10(7): 803−807. DOI: 10.14202/vetworld.2017.803-807
[7] 张洋, 贾凯翔, 张秀文, 等. 噬菌体PZL-Ah1的生物学特性及其治疗嗜水气单胞菌感染的效果评价 [J]. 中国预防兽医学报, 2021, 43(6):602−608. ZHANG Y, JIA K X, ZHANG X W, et al. Biological characteristics of bacteriophage PZL-Ah1 and evaluation of its efficacy in the treatment of Aeromonas hydrophila infection [J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(6): 602−608.(in Chinese)
[8] SMETS D, LOOS M S, KARAMANOU S, et al. Protein transport across the bacterial plasma membrane by the sec pathway [J]. The Protein Journal, 2019, 38(3): 262−273. DOI: 10.1007/s10930-019-09841-8
[9] Nickerson C A, SCHURR M J. Molecular paradigms of infectious disease: a bacterial perspective (Emerging infectious diseases of the 21st century)[M]. New York: Springer, 2006.
[10] JIN J S, HSIEH Y H, CHAUDHARY A S, et al. SecA inhibitors as potential antimicrobial agents: Differential actions on SecA-only and SecA-SecYEG protein-conducting channels [J]. FEMS Microbiology Letters, 2018, 365(15): fny145. DOI: 10.1093/femsle/fny145
[11] RAO C V S, DE WAELHEYNS E, ECONOMOU A, et al. Antibiotic targeting of the bacterial secretory pathway [J]. Biochimica et Biophysica Acta, 2014, 1843(8): 1762−1783. DOI: 10.1016/j.bbamcr.2014.02.004
[12] CHAUDHARY A S, CHEN W X, JIN J S, et al. SecA: A potential antimicrobial target [J]. Future Medicinal Chemistry, 2015, 7(8): 989−1007. DOI: 10.4155/fmc.15.42
[13] GARDEL C, JOHNSON K, JACQ A, et al. The secD locus of E. coli codes for two membrane proteins required for protein export [J]. The EMBO Journal, 1990, 9(12): 4205−4206. DOI: 10.1002/j.1460-2075.1990.tb07645.x
[14] GUO L N, HUANG L X, SU Y Q, et al. secA, secD, secF, yajC, and yidC contribute to the adhesion regulation of Vibrio alginolyticus [J]. MicrobiologyOpen, 2018, 7(2): e00551. DOI: 10.1002/mbo3.551
[15] CRANE J M, RANDALL L L. The sec system: Protein export in Escherichia coli[J]. EcoSal Plus, 2017, 7(2): 10.1128/ecosalplus. ESP-10.1128/ecosalplus0002-2017.
[16] PRADEL N, DELMAS J, WU L F, et al. Sec- and Tat-dependent translocation of beta-lactamases across the Escherichia coli inner membrane [J]. Antimicrobial Agents and Chemotherapy, 2009, 53(1): 242−248. DOI: 10.1128/AAC.00642-08
[17] FU Y Y, ZHANG L S, WANG G B, et al. The LysR-type transcriptional regulator YeeY plays important roles in the regulatory of furazolidone resistance in Aeromonas hydrophila [J]. Frontiers in Microbiology, 2020, 11: 577376. DOI: 10.3389/fmicb.2020.577376
[18] FU Y Y, CAI Q L, WANG Y Q, et al. Four LysR-type transcriptional regulator family proteins (LTTRs) involved in antibiotic resistance in Aeromonas hydrophila [J]. World Journal of Microbiology and Biotechnology, 2019, 35(8): 127. DOI: 10.1007/s11274-019-2700-3
[19] 李碗芯, 赵怡扬, 林玲, 等. 嗜水气单胞菌中转录因子AHA_1581对细菌生理功能调控机制的研究 [J]. 微生物学报, 2021, 61(11):3594−3606. LI W X, ZHAO Y Y, LIN L, et al. Study on the transcription factor AHA_1581 in Aeromonas hydrophila on the regulation mechanism of bacterial physiological functions [J]. Acta Microbiologica Sinica, 2021, 61(11): 3594−3606.(in Chinese)
[20] HERNÁNDEZ-MORALES A, MARTÍNEZ-PENICHE R A, ARVIZU-GÓMEZ J L, et al. Production of a mixture of fengycins with surfactant and antifungal activities by Bacillus sp. MA04, a versatile PGPR [J]. Indian Journal of Microbiology, 2018, 58(2): 208−213. DOI: 10.1007/s12088-018-0711-7
[21] VIJAYARAGHAVAN P, VINCENT S G P. A simple method for the detection of protease activity on agar plates using bomochresolgreen dye [J]. Journal of Biochemical Technology, 2013, 4(3): 628−630.
[22] OGAKI M, FURUICHI Y, KURODA K, et al. Importance of co-cultivation medium pH for successful Agrobacterium-mediated transformation of Lilium × formolongi [J]. Plant Cell Reports, 2008, 27(4): 699−705. DOI: 10.1007/s00299-007-0481-x
[23] AHMED H, MOHAMED M, REZK M, et al. Aeromonas hydrophila in fish and humans; prevalence, virulotyping and antimicrobial resistance [J]. Slovenian Veterinary Research, 2018, 55: 112−113.
[24] INNES G K, RANDAD P R, KORINEK A, et al. External societal costs of antimicrobial resistance in humans attributable to antimicrobial use in livestock [J]. Annual Review of Public Health, 2020, 41: 141−157. DOI: 10.1146/annurev-publhealth-040218-043954
[25] CHATZI K E, SARDIS M F, KARAMANOU S, et al. Breaking on through to the other side: Protein export through the bacterial Sec system [J]. The Biochemical Journal, 2013, 449(1): 25−37. DOI: 10.1042/BJ20121227
[26] QUIBLIER C, SEIDL K, ROSCHITZKI B, et al. Secretome analysis defines the major role of SecDF in Staphylococcus aureus virulence [J]. PLoS One, 2013, 8(5): e63513. DOI: 10.1371/journal.pone.0063513
[27] YAN S M, WU G. Evolutionary evidence on suitability of SecD as a target for development of antibacterial agents against Staphylococcus aureus [J]. Ecology and Evolution, 2016, 6(5): 1393−1410. DOI: 10.1002/ece3.1951




 下载:
下载: