Dual PCR Detection of Type 2 and 3 Cyprinus Herpesvirus
-
摘要:目的 鲤疱疹病毒2型和3型对鲤科鱼类危害严重,本研究旨在建立快捷、高效且能同时检测2种鲤疱疹病毒的检测技术。方法 根据鲤疱疹病毒 2 型和3型的DNA聚合酶基因保守序列,设计2对特异性引物,通过对双重PCR反应条件的优化,建立检测鲤疱疹病毒2型和3型的双重PCR方法;使用该方法对试验室保存的鲫和鲤病鱼组织样品进行检测。结果 该方法能够分别对鲤疱疹病毒2型和鲤疱疹病毒3型各扩增出715 bp和456 bp的特异性条带,表现出良好的特异性;敏感性试验结果显示,该方法的检测极限值为100 copies·μL-1,具有较高的灵敏性。使用该方法对本试验室保存的18份临床病料进行PCR检测并对PCR产物进行测序验证,结果显示CyHV-2和CyHV-3阳性的各有3份,其阳性率都为33.3%;分别对2份CyHV-2和CyHV-3阳性样品混合后进行检测,结果混合样品均为CyHV-2和CyHV-3双阳性,与常规检测方法得到的结果相同。结论 本研究建立的双重PCR检测方法特异性强、灵敏度高,可用于CyHV-2和CyHV-3的快速检测和鉴别诊断。Abstract:Objective A PCR method for simultaneously detecting Type 2 and Type 3 Cyprinid herpesvirus that cause serious diseases on Cyprinidae was developed and tested for clinical diagnosis.Methods Two pairs of specific primers were designed according to the conserved sequences of the DNA polymerase gene of the two types of virus, CyHV-2 and CyHV-3. PCR reaction conditions of the method were optimized. The assay was applied on the stored tissue samples of diseased Carassius auratus and Cyprinus carpio to verify validity of the methodology.Result The newly developed Dual PCR Assay amplified specific bands with the base numbers of 715 bp for CyHV-2 and 456 bp for CyHV-3. It exhibited high sensitivity with a detection limit of 100 copies·μL−1. On the 18 clinical samples, 3 were found to be CyHV-2 and 3 CyHV-3 with a positive detection rate of 33.3%. Furthermore, the assay successfully identified the two type viruses in a mixed sample of CyHV-2 and CyHV-3 in a challenge test.Conclusion The Dual PCR Assay demonstrated high specificity and sensitivity in simultaneously detecting CyHV-2 and CyHV-3. It could be adequately applied for rapid diagnosis of the viral diseases on carps.
-
Keywords:
- Cyprinus carpio /
- Cyprinus herpesvirus /
- Double PCR
-
0. 引言
【研究意义】鲫(Carassius auratus)、金鱼(Carassius auratus L.)、鲤(Cyprinus carpio)、锦鲤(Cyprinus carpio Koi)均为鲤科鱼类,与人类生活、生产密切相关。2021年,我国鲤和鲫的产量均达280万t[1],为人类提供了重要的蛋白质来源[2]。锦鲤和金鱼属于观赏鱼类,其单个鱼体的经济价值较高,且承载了人们的情感寄托[2]。鲤疱疹病毒 2 型(Cyprinid herpesvirus 2,CyHV-2)主要引起鲫造血器官坏死病,该病毒在中国、日本、美国、澳大利亚、新西兰及欧洲一些国家均有报道,可造成养殖鲫鱼和金鱼大量死亡,严重危害金鱼、鲫养殖业[3]。鲤疱疹病毒 3 型(Cyprinid herpesvirus 3,CyHV-3)主要引起鲤和锦鲤发生肾脏出血红肿和鳃坏死病变,死亡率达到80%以上,甚至可达100%[4-5]。因此,建立鲤和鲫的鲤疱疹病毒2型和3型检测手段对二者的预防和控制具有重要意义。【前人研究进展】研究人员对零售、野生、养殖金鱼采样检测,均检测到 CyHV-2阳性样品[6-7];在野生鲤和观赏锦鲤中也发现CyHV-3的潜伏感染[8],鲤也可以携带CyHV-2但不发病[9]。Waltzek[10]采用解旋酶基因对CyHV-2进行PCR检测和鉴定,分辨率达到78 copies·μL−1;Bercovier等[11]采用胸苷激酶(Thymidine kinase,TK)基因对CyHV-3进行PCR检测和鉴定,分辨率可达到30个病毒粒子的水平。两种病毒均可感染鲤、鲫、锦鲤、金鱼等鲤科鱼类。随着锦鲤、金鱼等观赏鲤科鱼类的线上和线下的销售越来越活跃,鱼类病毒在国内跨区域传播的风险逐渐增加。而且鲤和鲫的杂交品种繁多,病毒的感染情况较为复杂。【本研究切入点】对于两种病毒还未有成熟有效的防控药物或疫苗。因此,在实际检测的需求中,需要能够同时对两种病毒进行检测。【拟解决的关键问题】本研究根据鲤疱疹病毒 2 型和3型的聚合酶基因,设计2对特异性引物,通过对双重PCR反应条件的优化,建立检测鲤疱疹病毒2型和3型的双重PCR方法,以期丰富和完善鲤疱疹病毒2型和3型检测方法,为两种疱疹病毒预控工作提供参考。
1. 材料与方法
1.1 病毒
石斑鱼神经坏死病毒(Grouper nervous necrosis virus,GNNV)、石斑鱼虹彩病毒(Grouper iridovirus,SGIV)、大黄鱼虹彩病毒(Yellow croaker iridovirus,YCIV)、蛙虹彩病毒(Frog virus,FV)、鳗疱疹病毒(Anguillae herpesvirus,AHV)、鲤疱疹病毒 2 型(CyHV-2)、鲤疱疹病毒 3 型(CyHV-3)由本实验室保存。
1.2 主要试验试剂
Taq 2×PCR Master Mix with Dye购自武汉艾博泰克生物技术有限公司。2000 DNA Marker、琼脂糖、Gelstain等购自北京全式金生物技术有限公司。其他试剂均采用国产分析纯试剂。
1.3 标准品的制备
将CyHV-2、CyHV-3相应的DNA聚合酶基因DNA片段合成并连接到pUC57 载体上,从而构建CyHV-2和CyHV-3的标准质粒,并根据以下公式计算其拷贝数:拷贝数(copies·μL−1)=6.02×1023(copies·mol−1)× 质粒浓度(ng·μL−1)×10‒9 /质粒分子量(g·mol−1)。
1.4 引物的设计与合成
根据 GenBank 中鲤疱疹病毒2型的基因序列(KM2007221.1)和3型的基因序列(MN913971.1),根据CyHV-2、CyHV-3 的DNA聚合酶序列设计2对特异性引物(表1),并由福州尚亚生物技术有限公司合成。
表 1 双重PCR引物序列Table 1. Sequence of primer for Dual PCR Assay引物名称
Primer name引物序列(5′-3′)
Primer sequence (5′-3′)片段长度
Fragment length/bpCyHV-2-F CTGATTATTACGGAGAGTATGAC 715 CyHV-2-R CTGTGAGACTTTTGTAGATTATTC CyHV-3-F CTATGCTGGAACTGGTGATC 456 CyHV-3-R GAGAGATTCTGACGGTGAAG 1.5 双重 PCR 检测方法的建立与优化
将 CyHV-2、CyHV-3的质粒拷贝数换算到同一数量级后按比例混合,以混合后的质粒为 DNA 模板,进行双重 PCR 扩增。2 对引物 (10 μmol·L−1)的添加量均设0.1~0.6 μL 的6 个梯度处理,退火温度设置 9个梯度(52~68 ℃),其他反应条件参考Taq 2 × PCR Master Mix with Dye 的说明书,根据扩增结果选择最佳引物量和退火温度。
1.6 敏感性试验
将CyHV-2、CyHV-3的质粒拷贝数稀释到同一数量级后,10倍梯度稀释,含量范围为 1×100 ~1×1011 copies·μL−1,以各梯度含量的混合质粒为 DNA 模板,采用优化后的双重 PCR 检测方法进行PCR扩增,测试该方法的灵敏性。
1.7 特异性试验
分别以CyHV-2、CyHV-3、GNNV、SGIV、YCIV、FV、AHV的DNA或cDNA为模板,采用优化后的双重PCR检测方法进行扩增,同时以CyHV-2和CyHV-3的混合DNA为模板,分别进行只添加单对引物的单重PCR反应,以检测该方法的特异性。
1.8 临床样品检测
取本实验室保存的18份锦鲤和金鱼疑似感染组织样品作为DNA模板,同时分别对2份CyHV-2和CyHV-3阳性样品进行人工混合,用优化后的双重PCR检测方法进行PCR扩增并对扩增产物进行测序;分别以国家标准《金鱼造血器官坏死病毒检测方法》(GB/T 36194—2018)和水产行业标准《鲤疱疹病毒检测方法第一部分:锦鲤疱疹病毒》(SC/T 7212.1—2011)推荐的检测方法为标准,将阳性和双阳性样品分别通过两种病毒的常规检测方法进行检测验证,以验证上述方法的可靠性。
2. 结果与分析
2.1 双重PCR 最佳退火温度和最佳引物浓度的选择
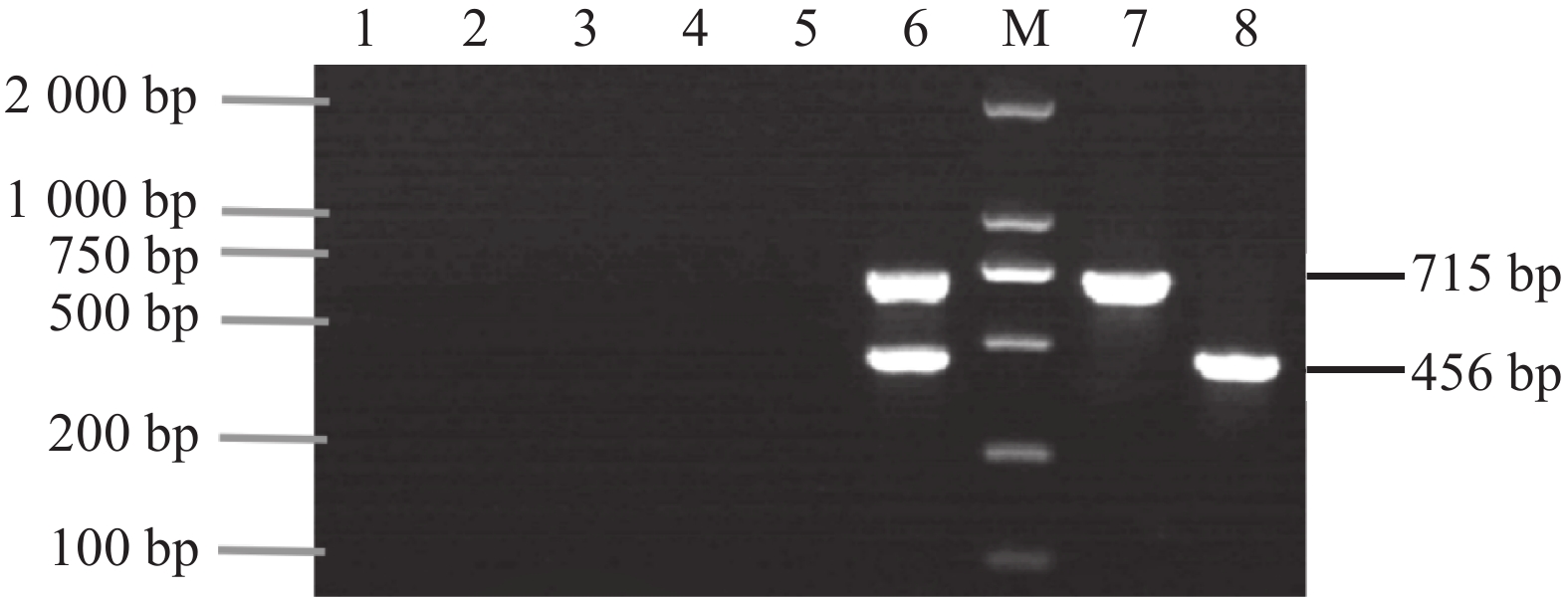
根据PCR扩增结果,退火温度选择58 ℃进行后续试验(图1),引物浓度选择加入0.3 μL进行后续试验(图2)。最佳的PCR体系总计20 μL,Template 2 μL、CyHV-2-F(10 μmol·L−1)0.3 μL、CyHV-2-R (10 μmol·L−1)0.3 μL、CyHV-3-F (10 μmol·L−1)0.3 μL、CyHV-3-R (10 μmol·L−1)0.3 μL、Taq 2× PCR Master Mix with Dye 10 μL、Nuclease-free Water 6.8 μL;后续试验采用的PCR反应程序如下:95 ℃ 30 s,(95 ℃ 30 s,58 ℃ 60 s,68 ℃ 60 s)30个循环,68 ℃ 5 min,12 ℃+∞。
2.2 敏感性试验
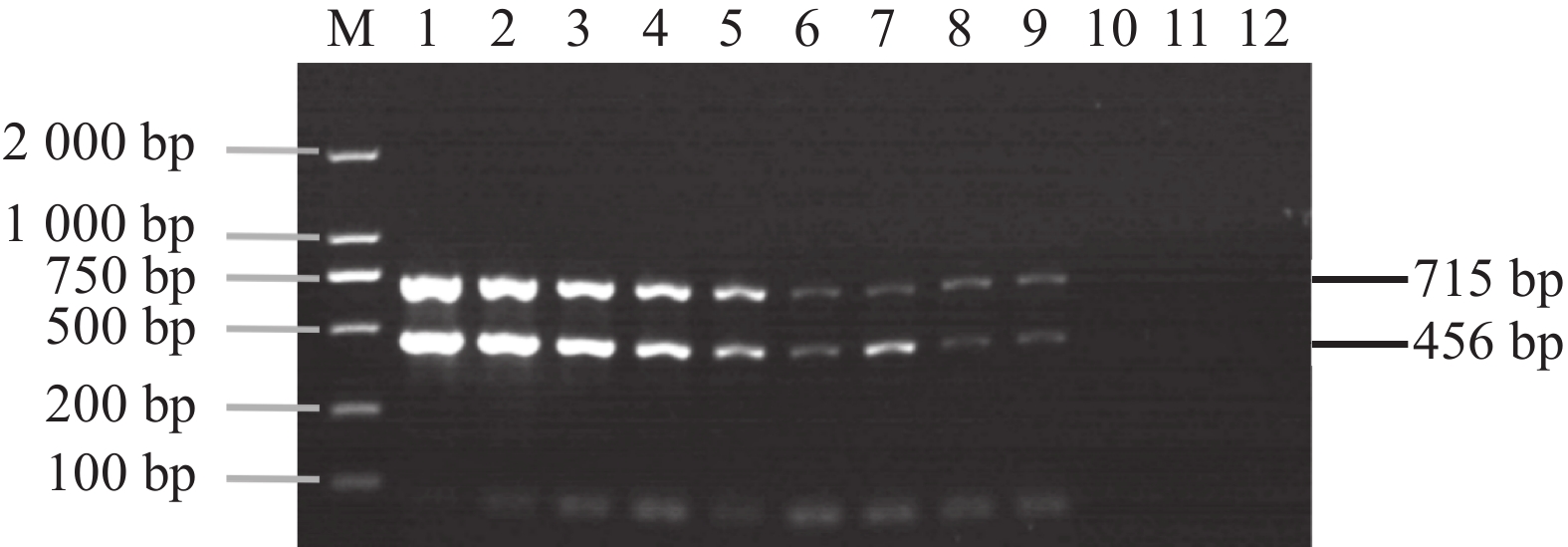
分别以 1×1010~1×101 copies·μL−1 的混合质粒为模板进行双重 PCR 扩增,结果显示,随着模板浓度的降低,目的条带的亮度也逐渐降低,该方法能检测到的质粒最低极限为100 copies·μL−1(图3)。
![]() 图 3 双重PCR 敏感性试验结果M:2000 DNA Marker;1:CyHV-2 和 CyHV-3混合质粒初始含量1×1011 copies·μL−1;2~12:以10倍比稀释1×1010 ~1×100 copies·μL−1混合质粒含量。Figure 3. Sensitivity of Dual PCR AssayM: 2000 DNA Marker; 1: mixed plasmid of CyHV-2 and CyHV-3 as template (initial concentration 1×1011 copies·μL−1) ; 2–12: diluted at 10 times ratio 1×1010–1×100 copies·μL−1.
图 3 双重PCR 敏感性试验结果M:2000 DNA Marker;1:CyHV-2 和 CyHV-3混合质粒初始含量1×1011 copies·μL−1;2~12:以10倍比稀释1×1010 ~1×100 copies·μL−1混合质粒含量。Figure 3. Sensitivity of Dual PCR AssayM: 2000 DNA Marker; 1: mixed plasmid of CyHV-2 and CyHV-3 as template (initial concentration 1×1011 copies·μL−1) ; 2–12: diluted at 10 times ratio 1×1010–1×100 copies·μL−1.2.3 PCR特异性试验
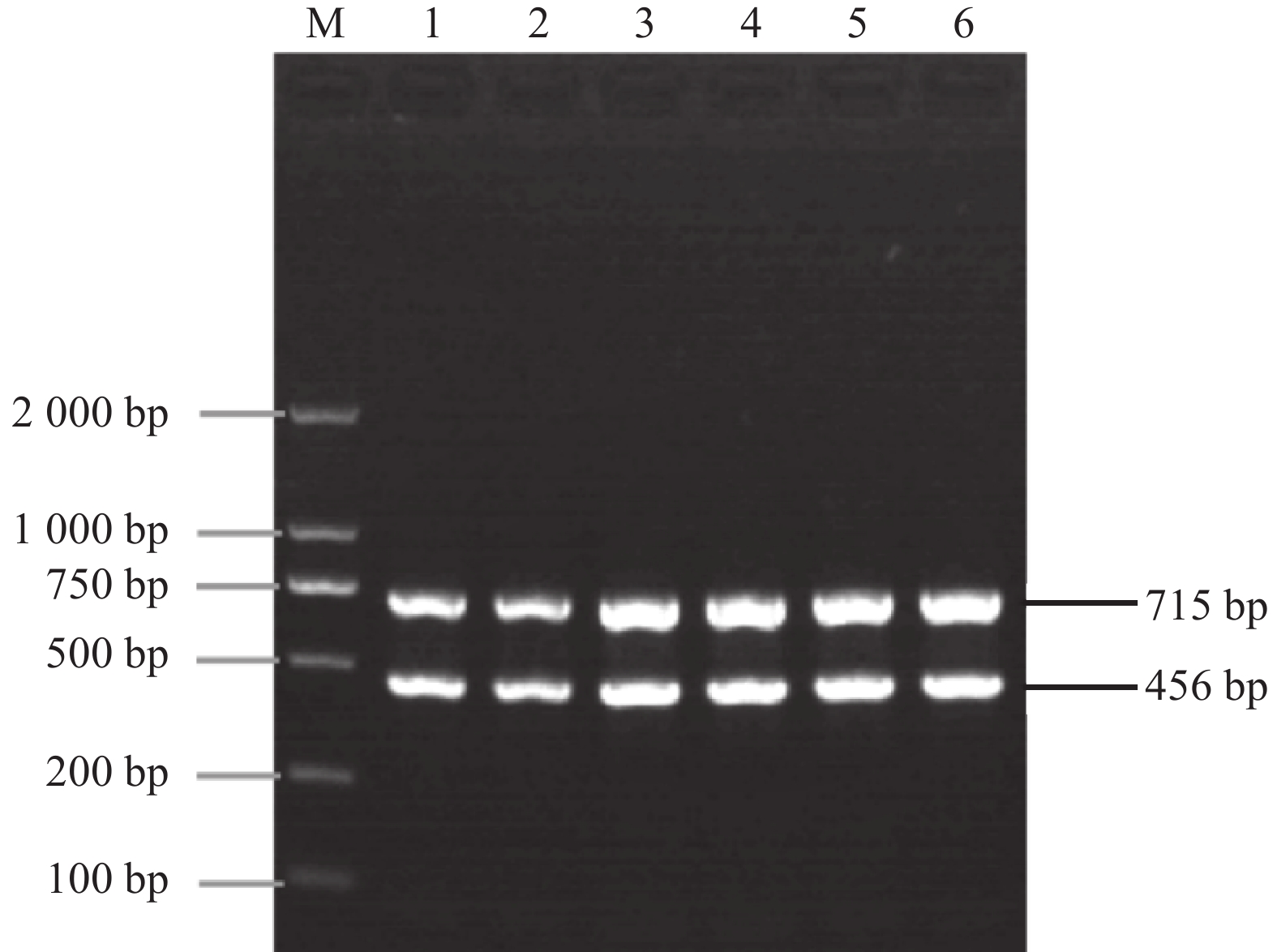
特异性试验表明,GNNV、SGIV、YCIV、FV、AHV为模板的双重 PCR 反应均未扩增出任何条带(图4)。以 CyHV-2 和 CyHV-3 为模板的双重 PCR 反应和分别添加单对引物进行的单重 PCR 反应均可扩增出相应的目的条带,无交叉反应。
2.4 临床样品检测结果
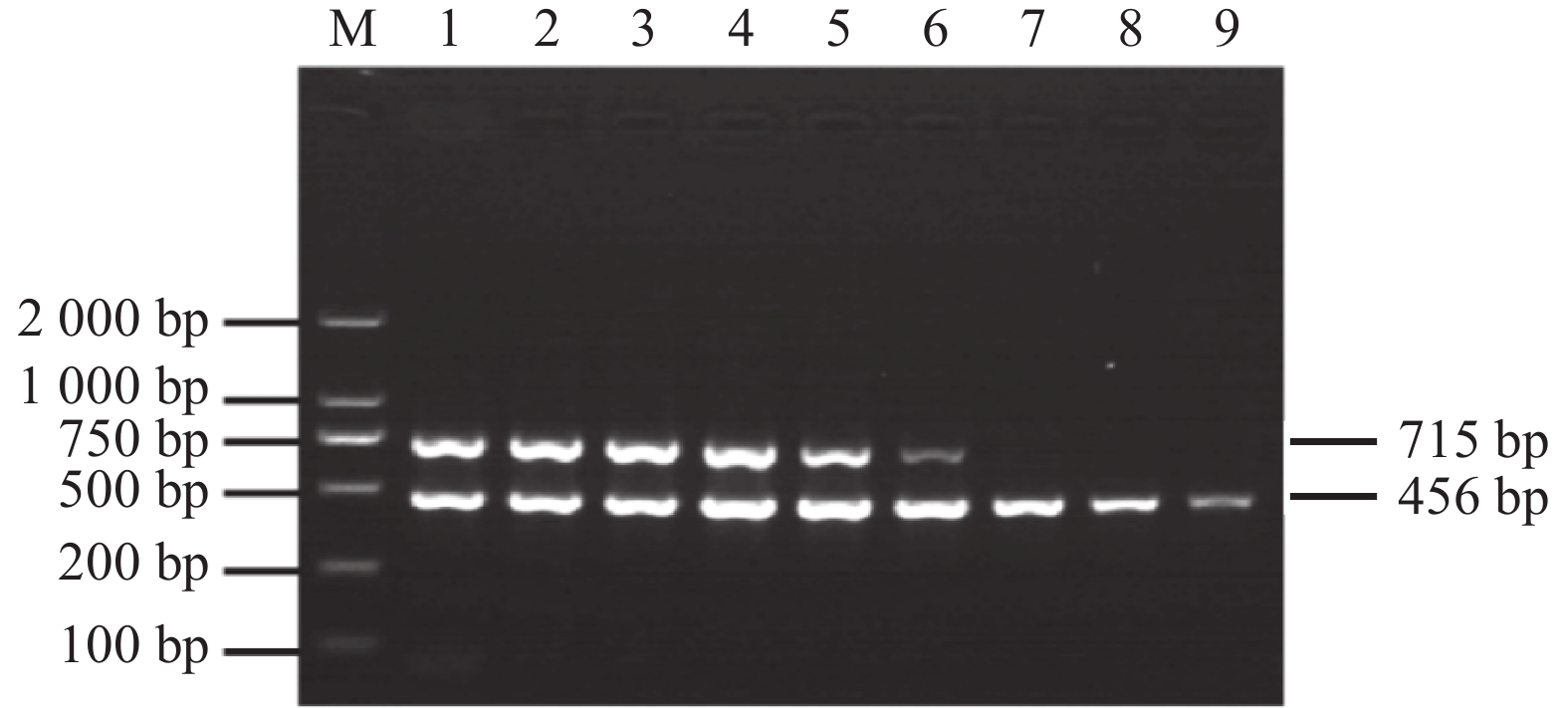
利用建立的双重PCR方法对本实验室保存的9份金鱼和9份锦鲤临床样品进行检测,同时设阳性和阴性对照。分别在金鱼和锦鲤样品中得到3个PCR阳性条带,经测序得到的阳性条带的序列与相应的标准样品序列的同源性均大于95%,综合PCR和测序的两者结果,判定CyHV-2和CyHV-3阳性样品各有3份,阳性率均为33.3%;对2份CyHV-2和CyHV-3阳性临床样品进行混合,经双重PCR检测,混合样品均为CyHV-2和CyHV-3双阳性。经过国家标准和水产行业标准的检测和判定,其结果与本试验的判定结果一致(表2)。以上结果表明,本研究建立的双重PCR方法具有较好的临床实用性,可用于临床样品的检测,同时能够检测到共感染的样品。
表 2 样品检测结果Table 2. Detection on clinical samples by Dual PCR Assay检测方法
Detection method鱼种
Fish species阳性样品数/样品数
Positive samples/Total samplesCyHV-2 CyHV-3 《金鱼造血器官坏死病毒检测方法》(GB/T 36194—2018)
Detection method of goldfish haemotopoietic necrosis virus金鱼 3/9 — 混合样 2/2 — 《鲤疱疹病毒检测方法第一部分:锦鲤疱疹病毒》(SC/T 7212.1—2011)
Detection methods of cyprinid herpesvirus(CyHV)Part 1: Koi herpevirus锦鲤 — 3/9 混合样 — 2/2 双重PCR方法
Double PCR detection金鱼 3/9 — 锦鲤 — 3/9 混合样 2/2 2/2 3. 讨论与结论
由于鲤科鱼类能够在属间水平相互杂交,因此品种繁多,同时鲤疱疹病毒2型和3型对鲤科鱼类绝大多数品种都具有感染能力,仅仅检测一种病原效率较低,需要一种能够同时检测两种病毒的检测方法。张文等[12]采用双重实时荧光定量PCR检测方法同时对鲤浮肿病毒 (Carp edema virus, CEV) 和CyHV-3进行了检测。该试验根据CEV的P4a基因和CyHV-3的ORF7保守基因序列设计。CEV和CyHV-3的检测灵敏度均为1.5×101 copies·μL−1,而本研究中采用双重PCR,灵敏度仅与之相差1个数量级。徐晔等[13]根据CyHv-2的DNA聚合酶基因,设计的荧光定量检测方法灵敏度为 5 copies·μL−1,灵敏度较高,但实时荧光定量PCR方法需要的仪器、试剂、引物等较为昂贵。本研究中采用双重PCR可使用普通PCR仪进行试验,两对引物无交叉反应,且对GNNV、 SGIV、YCIV、FV、AHV等5种常见水生动物病毒无扩展条带,具备良好的特异性;与常规检测方法能达到同样的检测效果,且能够同时对金鱼和锦鲤的两种病毒进行检测,不仅大大节约了检测所需时间,同时也节省了试剂,使检测成本显著下降,具备高效、便捷、经济和准确等优点。彭军辉等[14]根据DNA 聚合酶基因(2、3 型)、解旋酶基因(2型)和胸苷激酶基因(3型)的保守序列设计了3对引物,建立了检测CyHV-2和CyHV-3的三重PCR检测方法,PCR产物的电泳结果会产生两个条带,需要通过两个条带的位置和PCR产物的测序结果来判定两种病毒。而本研究中,仅需要2对引物的位置和PCR产物的测序结果即可根据PCR产物大小差异,实现便捷的判定CyHV-2和CyHV-3的快速鉴别诊断。
另外,目前虽然还未发现有CyHV-2和CyHV-3混合感染病例,但随着养殖产业的发展和新品种的不断出现,对于可能出现的混合感染情况,采用本研究建立的双重PCR方法亦可进行有效检测。
综上所述,本研究建立了一种快速、特异、灵敏的检测鲤疱疹病毒2型和3型的双重PCR方法,为试验室CyHV-2和CyHV-3的快速确诊、养殖场和交易市场的流行病学调查、病毒的综合防控提供了技术支撑,为CyHV-2和CyHV-3在鲤科鱼类中的分子诊断及流行病学调查奠定了基础。
-
图 3 双重PCR 敏感性试验结果
M:2000 DNA Marker;1:CyHV-2 和 CyHV-3混合质粒初始含量1×1011 copies·μL−1;2~12:以10倍比稀释1×1010 ~1×100 copies·μL−1混合质粒含量。
Figure 3. Sensitivity of Dual PCR Assay
M: 2000 DNA Marker; 1: mixed plasmid of CyHV-2 and CyHV-3 as template (initial concentration 1×1011 copies·μL−1) ; 2–12: diluted at 10 times ratio 1×1010–1×100 copies·μL−1.
表 1 双重PCR引物序列
Table 1 Sequence of primer for Dual PCR Assay
引物名称
Primer name引物序列(5′-3′)
Primer sequence (5′-3′)片段长度
Fragment length/bpCyHV-2-F CTGATTATTACGGAGAGTATGAC 715 CyHV-2-R CTGTGAGACTTTTGTAGATTATTC CyHV-3-F CTATGCTGGAACTGGTGATC 456 CyHV-3-R GAGAGATTCTGACGGTGAAG 表 2 样品检测结果
Table 2 Detection on clinical samples by Dual PCR Assay
检测方法
Detection method鱼种
Fish species阳性样品数/样品数
Positive samples/Total samplesCyHV-2 CyHV-3 《金鱼造血器官坏死病毒检测方法》(GB/T 36194—2018)
Detection method of goldfish haemotopoietic necrosis virus金鱼 3/9 — 混合样 2/2 — 《鲤疱疹病毒检测方法第一部分:锦鲤疱疹病毒》(SC/T 7212.1—2011)
Detection methods of cyprinid herpesvirus(CyHV)Part 1: Koi herpevirus锦鲤 — 3/9 混合样 — 2/2 双重PCR方法
Double PCR detection金鱼 3/9 — 锦鲤 — 3/9 混合样 2/2 2/2 -
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022: 25. [2] BALON E K. Origin and domestication of the wild carp, Cyprinus carpio: From Roman gourmets to the swimming flowers [J]. Aquaculture, 1995, 129(1/2/3/4): 3−48.
[3] GOODWIN A E, SADLER J, MERRY G E, et al. Herpesviral haematopoietic necrosis virus (CyHV-2) infection: Case studies from commercial goldfish farms [J]. Journal of Fish Diseases, 2009, 32(3): 271−278. DOI: 10.1111/j.1365-2761.2008.00988.x
[4] HEDRICK R P, GILAD O, YUN S, et al. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp [J]. Journal of Aquatic Animal Health, 2000, 12(1): 44−57. DOI: 10.1577/1548-8667(2000)012<0044:AHAWMM>2.0.CO;2
[5] AOKI T, HIRONO I, KUROKAWA K, et al. Genome sequences of three koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide [J]. Journal of Virology, 2007, 81(10): 5058−5065. DOI: 10.1128/JVI.00146-07
[6] BECKER J A, TWEEDIE A, RIMMER A, et al. Incursions of Cyprinid herpesvirus 2 in goldfish populations in Australia despite quarantine practices [J]. Aquaculture, 2014, 432: 53−59. DOI: 10.1016/j.aquaculture.2014.04.020
[7] 李莉娟, 罗杨志, 刘学芹, 等. 金鱼鲤疱疹病毒Ⅱ型的分子诊断 [J]. 华中农业大学学报, 2013, 32(1):92−96. DOI: 10.3969/j.issn.1000-2421.2013.01.018 LI L J, LUO Y Z, LIU X Q, et al. Molecular surveillance of Cyprinid herpesvirus 2 in goldfish cultured in China [J]. Journal of Huazhong Agricultural University, 2013, 32(1): 92−96.(in Chinese) DOI: 10.3969/j.issn.1000-2421.2013.01.018
[8] XU J R, BENTLY J, BECK L, et al. Analysis of koi herpesvirus latency in wild common carp and ornamental koi in Oregon, USA [J]. Journal of Virological Methods, 2013, 187(2): 372−379. DOI: 10.1016/j.jviromet.2012.11.015
[9] GOODWIN A E, KHOO L, LAPATRA S E, et al. Goldfish hematopoietic necrosis herpesvirus (cyprinid herpesvirus 2) in the USA: Molecular confirmation of isolates from diseased fish [J]. Journal of Aquatic Animal Health, 2006, 18(1): 11−18. DOI: 10.1577/H05-007.1
[10] WALTZEK T B, KUROBE T, GOODWIN A E, et al. Development of a polymerase chain reaction assay to detect cyprinid herpesvirus 2 in goldfish [J]. Journal of Aquatic Animal Health, 2009, 21(1): 60−67. DOI: 10.1577/H08-045.1
[11] BERCOVIER H, FISHMAN Y, NAHARY R, et al. Cloning of the koi herpesvirus (KHV) gene encoding thymidine kinase and its use for a highly sensitive PCR based diagnosis [J]. BMC Microbiology, 2005, 5: 13. DOI: 10.1186/1471-2180-5-13
[12] 张文, 徐立蒲, 吕晓楠, 等. 鲤浮肿病毒和锦鲤疱疹病毒三重PCR检测方法的建立及初步应用 [J]. 检验检疫学刊, 2019, 29(1):1−5. ZHANG W, XU L P, LV X N, et al. Establishment and preliminary application of triplex PCR detection method for carp edema virus and koi herpesvirus [J]. Journal of Inspection and Quarantine, 2019, 29(1): 1−5.(in Chinese)
[13] 徐晔, 段宏安, 周毅, 等. 鲤科疱疹病毒2型TaqMan荧光定量PCR检测方法的建立 [J]. 中国预防兽医学报, 2014, 36(12):952−956. DOI: 10.3969/j.issn.1008-0589.2014.12.09 XU Y, DUAN H A, ZHOU Y, et al. Establishment of real-time PCR assay for detection of Cyprinid herpesvirus 2 [J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(12): 952−956.(in Chinese) DOI: 10.3969/j.issn.1008-0589.2014.12.09
[14] 彭军辉, 安伟, 张明辉. 鲤疱疹病毒2型和3型三重PCR检测方法的建立与应用 [J]. 渔业科学进展, 2021, 42(6):158−164. DOI: 10.19663/j.issn2095-9869.20201124002 PENG J H, AN W, ZHANG M H. Establishment and application of the triplex PCR method for simultaneous detection of cyprinid herpesvirus 2 and cyprinid herpesvirus 3 [J]. Progress in Fishery Sciences, 2021, 42(6): 158−164.(in Chinese) DOI: 10.19663/j.issn2095-9869.20201124002
-
期刊类型引用(1)
1. 钟亮宁,何洪桂,李小军,叶毅飞,王红兵,刘烺,潘杰,谢海燕,莫钻兰,赖颖,黄洁莹,朱燕秋,李敏,张险朋. 锦鲤疱疹病毒微滴式数字PCR检测方法的建立及临床应用. 广东海洋大学学报. 2024(06): 19-28 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: