Microbial Diversity in Rhizosphere Soil of Pseudostellaria heterophylla and Its Correlation with Main Soil Physicochemical Factor
-
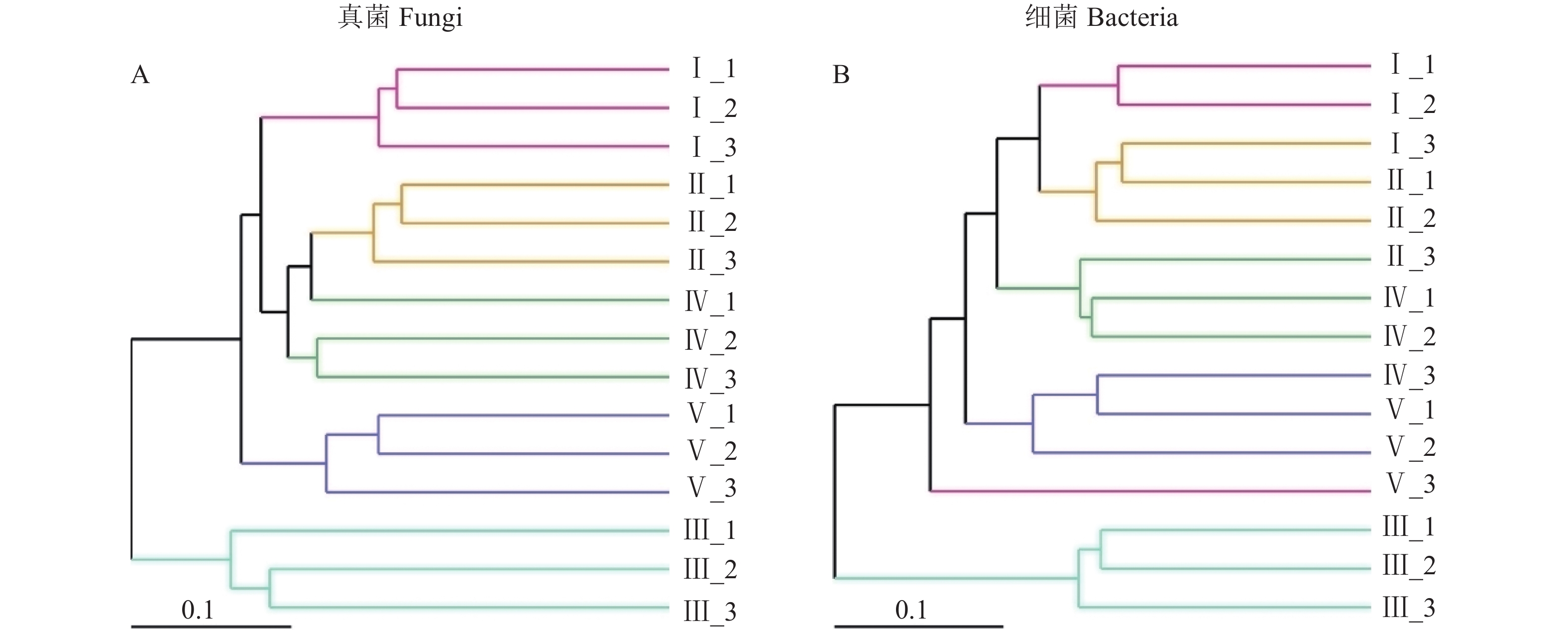
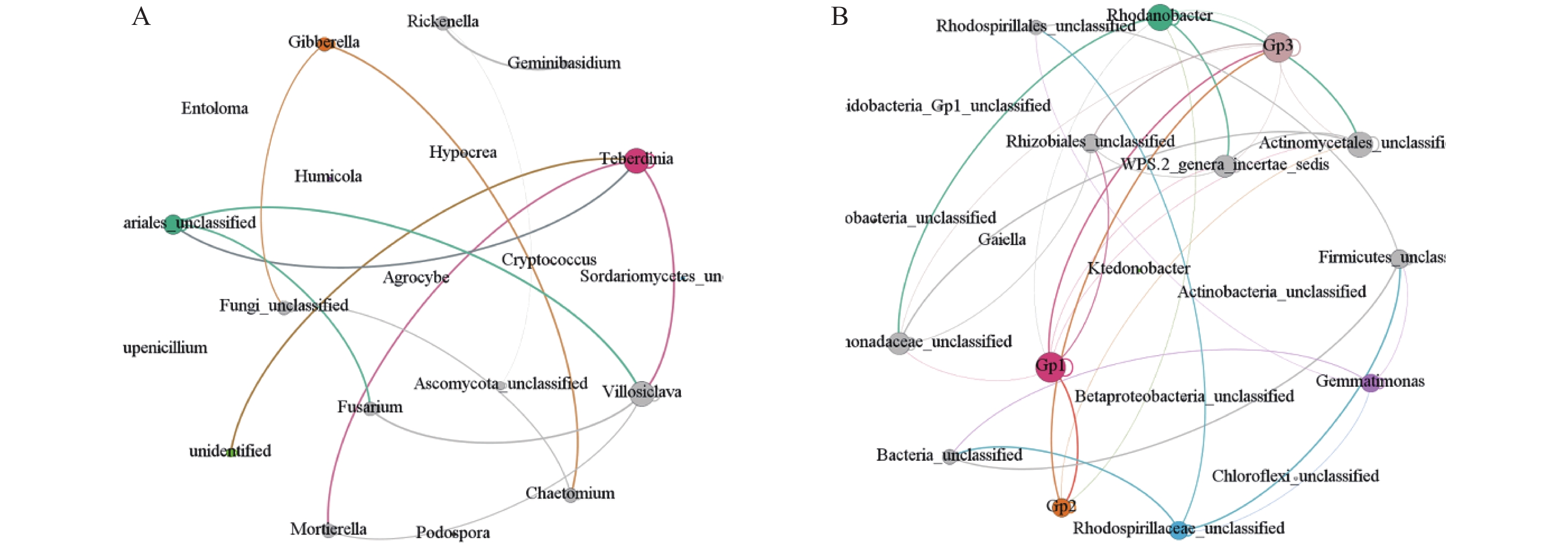
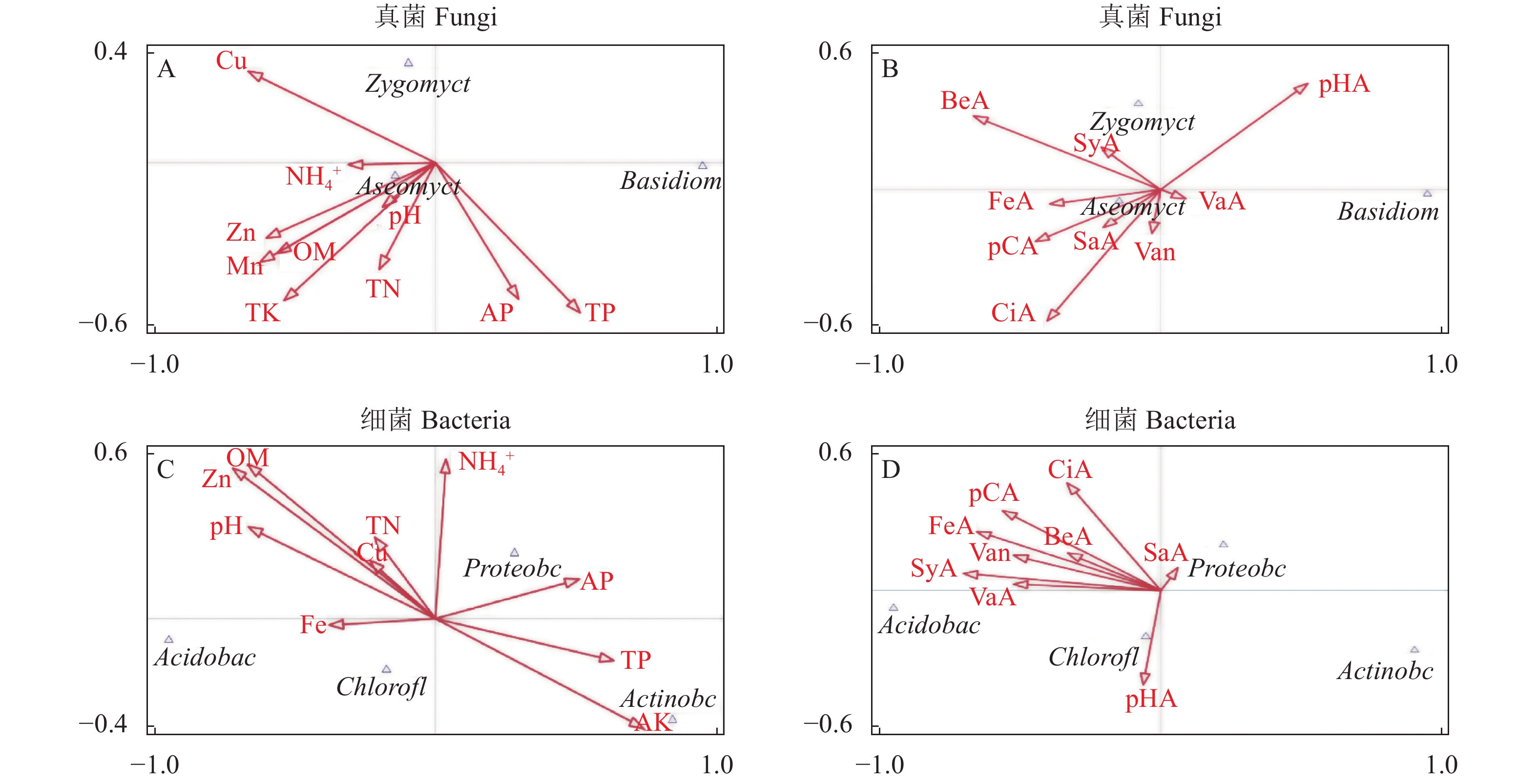
摘要:目的 探究不同区域栽培太子参产生连作效应的潜在原因。方法 采用高通量测序对柘荣县5个样地的太子参根际土壤进行微生物群落结构及多样性分析。结果 土壤真菌的有效序列共744 331条,聚类后获得1314个真菌分类单元;获得细菌1032029条有效序列,聚类后获得10310个细菌分类单元。5个样地的共有OTU数明显多于每个样地特有的OTU数,表明不同样地的太子参根际土壤微生物群落趋势大致相同。α多样性分析表明,不同样地根际土壤微生物群落组成及丰度之间有明显差异,Ⅳ、Ⅱ、Ⅰ样地的物种丰度较高,而Ⅴ、Ⅲ样地的物种丰度较低。典范对应分析表明土壤化学性质和根系分泌物酚酸类物质影响太子参根际土壤微生物的群落分布。5个样地中都鉴定到镰刀菌属等致病真菌,且致病菌的含量与根际土壤其他微生物物种数呈反比,暗示镰刀菌影响太子参根际土壤其他微生物物种数。结论 太子参连作效应及其病害的成因很大程度上归因于其根系分泌物参与调控的根际微生物菌群结构和多样性演变,导致病原菌增多。Abstract:Objective Chemical and microbial factors in field soils related to disease occurrence of continuously cropped Pesudostellaria heterophylla were investigated.Method Microbial community structure and diversity of rhizosphere soil from 5 continuous cropping P. heterophylla fields in Zherong County, Fujian were analyzed on data obtained by high-throughput sequencing technology. Correlation analysis of the microbial distribution was conducted based on the chemical properties of rhizosphere soil and phenolic acids.Result A clustering analysis on 744,331 fungal and 1,032,029 bacterial effective sequences resulted in 1,314 operational taxonomic units for the fungi and 10,310 for the bacteria. At each of the 5 locations, the number of common OTUs was significantly greater than that of unique ones. On the other hand, the alpha diversity analysis showed significant differences in microbial composition and abundance among the habitats as the species richness at Habitat Ⅳ, Ⅱ, and Ⅰ were higher than those at Habitat Ⅴ and Ⅲ. The canonical correspondence analysis indicated the soil chemical properties and phenolic acids in the root exudates significantly affected the microbial distribution. Fusarium and other pathogenic fungi were found at all 5 sites with the count of the pathogenic fungi inversely proportional to that of other microbial species, i.e., a possible correlation between Fusarium and the rhizosphere community.Conclusion It appeared that the continuous cropping that frequent fungal diseases on the plants might be significantly associated with the evolution of rhizosphere microbial structure and diversity mediated by the root exudate from P. heterophylla itself.
-
0. 引言
【研究意义】春兰Cymbidium goeringii为兰科Orchidaceae兰属Cymbidium的多年生草本植物,是我国兰科植物(国兰)中资源最丰富、分布最广的种类之一[1],一般于早春开花,花姿优美,气质优雅,备受国人喜爱,有“天下第一香”和“花中君子”的称号[2];然而,高昂的售价与新品种培育周期漫长等问题一直制约着春兰的规模化发展,长期以来国内春兰的商品市场主要依赖日本、台湾等地的返销苗,该类苗与原生苗相比存在着成活率差、倒苗等问题[3]。目前兰花快速繁殖的主要途径是通过组织培养技术[4],因此如何借用组织培养技术培育开品好、生长周期快的本土优良新品种提升产品自信、丰富春兰市场是解决这一问题最有效的方法。【前人研究进展】近年来关于国兰杂交种的组培技术已有不少报道,常见于‘宋梅’ב集圆’[5]、‘宋梅’ב韩国桃花’[6]和‘春绿兰’ב虎雪兰’[7]等;前人对国兰组培研究的基本培养基多使用MS培养基[5-7],后期兴起的Hyponex培养基为兰花组培提供了更为简便的配制方法,多见于蝴蝶兰[8-9]、墨兰[10]等研究中。【本研究切入点】目前关于春兰‘黄梅’ב黄荷’F1的研究尚未见报道,同时Hyponex对国兰生长影响的报道较少,尤其针对春兰组培的研究仅在简报中出现[11];此外,本课题组的前期研究发现,不同品种的春兰对组培条件的需求仍然存在差异,缺少科学完整且适用于工厂规模化生产的技术理论,为此,本试验对春兰‘黄梅’ב黄荷’F1根状茎及其组培苗的增殖、分化、生根培养和炼苗移栽的关键影响因子进行了相关研究。【拟解决的关键问题】本试验选取了稳定性强及市场上易获取的基本培养基(MS和HyponexⅡ)、细胞分裂素(6-BA和TDZ)、生长素(NAA和IBA)和有机添加剂(蛋白胨)为春兰‘黄梅’ב黄荷’F1组培各阶段寻找最佳培养条件,旨在建立优良、高效的春兰快繁体系,形成规模化种植,从而提高春兰在我国花卉市场的竞争力。
1. 材料与方法
1.1 试验材料
以2015年9月取自福建连城兰花股份有限公司的春兰‘黄梅’ב黄荷’F1无菌播种形成的根状茎为试验材料。试验于福建农林大学下安园林植物实验室进行。
1.2 试验方法
1.2.1 增殖培养
采用L9(34)正交试验[12]研究不同基本培养基、6-BA和NAA对春兰根状茎增殖培养的影响(表1),所有处理附加1.0 g·L−1 活性炭(AC)+30.0 g·L−1 白砂糖(Su)+7.0 g·L−1 琼脂(Ag),pH 5.6~5.8。选取长1.5~2.0 cm的健壮根状茎(无分支)接入上述增殖培养基中。试验每组接种10瓶,每瓶接种5个材料,2次重复。光照时间12 h·d−1,培养温度(26±2)℃,散射光培养,120 d后统计根状茎的生长速度和增殖系数。
表 1 根状茎增殖培养配方正交设计L9(34)Table 1. Orthogonal design L9 (34) on culture media for rhizome propagation水平
Level因素 Factor 基本培养基 Basic medium 6-BA/(mg·L−1) NAA/(mg·L−1) 1 1/2MS 0.1 2.0 2 Revised 1/2MS 0.3 3.0 3 Hyponex Ⅱ3.0 g·L−1 0.5 5.0 注:改良1/2MS为不含有微量元素的1/2MS培养基。
Note: Modified ½ MS was regular ½ MS without added microelements.生长速度=(增殖后根状茎质量−接种时根状茎质量)/接种时根状茎质量 (1) 增殖系数=接种根状茎上新增侧枝数/接种根状茎数(新增根状茎长度>0.5cm) (2) 1.2.2 分化培养
以1/2MS培养基(30.0 g·L−1 Su,7.0 g·L−1 Ag,pH 5.6~5.8)为基本培养基,针对NAA(0.3和0.5 mg·L−1)、6-BA(0.0,1.0,2.0和3.0 mg·L−1)和TDZ(0.0,0.5,1.0和1.5 mg·L−1)配置培养基探索其对春兰根状茎分化的影响(表2)。材料选取、接种方式同1.2.1。光照时间12 h·d−1,培养温度26±2℃,前30 d散射光培养,之后转入500~1 500 lx光强下培养,120 d后统计根状茎的分化率和芽诱导个数。
表 2 根状茎分化培养试验设计Table 2. Experimental design on culture media for rhizome differentiation处理号 Number NAA/(mg·L−1) 6-BA/(mg·L−1) TDZ/(mg·L−1) 1 0.3 1.0 0.0 2 0.3 2.0 0.0 3 0.3 3.0 0.0 4 0.3 0.0 0.5 5 0.3 0.0 1.0 6 0.3 0.0 1.5 7 0.5 1.0 0.0 8 0.5 2.0 0.0 9 0.5 3.0 0.0 10 0.5 0.0 0.5 11 0.5 0.0 1.0 12 0.5 0.0 1.5 分化率=分化根状茎个数/接种根状茎数×100% (3) 芽诱导个数=诱导出的芽个数/分化根状茎数(新芽>0.5cm) (4) 1.2.3 IBA和蛋白胨对组培苗生根的培养
以1/2MS为基本培养基,对IBA(0.5、1.0和1.5 mg·L−1)和蛋白胨(1.0、2.0和3.0 g·L−1)进行全因素试验设计(表3),所有处理附加1.0 g·L−1 AC+25.0 g·L−1 Su+7.0 g·L−1 Ag(pH 5.6~5.8),研究其对株高(6±2) cm组培苗(无根)生根的影响。每组接种10瓶,每瓶接种3株,重复2次。光照时间12 h·d−1,培养温度(26±2)℃,光强500~1 000 lx,120 d后统计根状茎的生根率和生根数。
表 3 组培苗生根培养全因素设计Table 3. All factor design on culture media for plantlet rooting处理号 Number IBA/(mg·L−1) 蛋白胨 Peptone/(g·L−1) 1 0.5 1.0 2 0.5 2.0 3 0.5 3.0 4 1.0 1.0 5 1.0 2.0 6 1.0 3.0 7 1.5 1.0 8 1.5 2.0 9 1.5 3.0 生根率=生根株数/接种株数×100% (5) 生根数=生根根条数/生根株数(每条根长度>0.5cm) (6) 1.2.4 炼苗移栽
选取生长健壮、叶色正常,株高(10±2) cm,根皮色白中带绿、无黑色、畸形、变异的组培苗为试验材料,清净根部培养基,在阴凉处晾干2 d,移栽至树皮(2~3 cm)和火烧石等体积混合的基质中,60 d后观察生长状态并统计成活率。
成活率=成活的株数/移栽株数×100% (7) 1.2.5 数据统计分析
使用Excel 2010计算平均值和标准差,SPSS 19.0统计分析软件对数据进行方差分析和Least-Significant Difference(LSD)多重比较,水平0.01<P≤0.05差异显著;水平0<P≤0.01差异极显著。
2. 结果与分析
2.1 基本培养基、6-BA和NAA对根状茎增殖的影响
接种时根状茎上无明显凸起(图1-A),培养15 d后有明显萌动,新萌动的根状茎向下扎入培养基中(图1-B),培养120 d时根状茎数量明显增多,且新生根状茎亦会出现分支现象(图1-C)。
![]() 图 1 离体培养各个阶段注:A为增殖培养第1 d;B为增殖培养第15 d;C为增殖培养120 d;D为分化培养第1 d;E为分化培养第15 d;F为分化培养120 d;G为生根培养120 d;H为组培苗练苗移栽60 d。Figure 1. Tissue cultures at various development stagesNote: A is multiplication culture on 1st day; B, 15th day; and, C, 120th day. D is differentiation culture on 1st day; E, 15th day; and, F, 120th day. G is rooting culture on 120th day. H indicates plantlets on 60th day after transplantation.
图 1 离体培养各个阶段注:A为增殖培养第1 d;B为增殖培养第15 d;C为增殖培养120 d;D为分化培养第1 d;E为分化培养第15 d;F为分化培养120 d;G为生根培养120 d;H为组培苗练苗移栽60 d。Figure 1. Tissue cultures at various development stagesNote: A is multiplication culture on 1st day; B, 15th day; and, C, 120th day. D is differentiation culture on 1st day; E, 15th day; and, F, 120th day. G is rooting culture on 120th day. H indicates plantlets on 60th day after transplantation.由表4可知:比较生长速度和增殖系数指标中各因素R值,均表明基本培养基的影响高于6-BA和NAA,6-BA对生长速度的影响大于NAA,NAA对增殖系数的影响大于6-BA。
表 4 不同处理对根状茎增殖培养的影响Table 4. Effects of medium composition on rhizome propagation处理号
NumberA:基本培养基
Basic mediumB:6-BA/(mg·L−1) C:NAA/(mg·L−1) 生长速度
Speed of growth增殖系数
Proliferation coefficient1 1 1 1 2.53±0.35 Bd 7.40±0.42 Aa 2 1 2 2 4.19±0.14 Bbcdd 6.69±0.0 5 Aab 3 1 3 3 4.76±0.31 ABbc 7.46±0.66 Aa 4 2 1 2 2.91±0.18 Bcd 6.27±0.31 Aab 5 2 2 3 3.46±0.15 Bbcd 7.20±0.30 Aa 6 2 3 1 4.19±0.47 Bbcd 5.85±0.07 Aab 7 3 1 3 5.21±0.41 ABb 5.41±0.54 Ab 8 3 2 1 5.10±0.53 ABbc 5.93±0.10 Aab 9 3 3 2 7.31±0.27 Aa 6.02±0.82 Aab ka1 3.83 3.55 3.94 Ra值排序:A>B>C
最优水平:A3B3C2
Rb值排序:A>C>B
最优水平:A1B2C3ka2 3.52 4.25 4.80 ka3 5.87 5.42 4.48 Ra 2.35 1.87 0.87 kb1 7.18 6.36 6.39 kb2 6.44 6.61 6.33 kb3 5.79 6.45 6.69 Rb 1.39 0.25 0.37 注:ka表示生长速度;Ra表示生长速度的极差;kb表示增殖系数;Rb表示增殖系数的极差。大写字母表示在0.01水平下的差异,小写字母表示0.05水平下的差异,下同。
Note: ka stands for speed of growth; Ra, variance of ka; kb, multiplication coefficient; and, Rb, variance of kb. Capital letters indicate significantly different at P<0.01, lowercase significantly different at P<0.05. Same for Table 5&6.通过极差分析得出:最有利于根状茎生长的培养基为3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA+3.0 mg·L−1 NAA(即处理9);有利于提高根状茎增殖系数的培养基为:1/2MS+0.3 mg·L−1 6-BA+5.0 mg·L−1 NAA。方差分析表明:基本培养基(P=0.000<0.01)和6-BA(P=0.005<0.01)对春兰根状茎生长速度的影响极显著,NAA的影响不显著;基本培养基(P=0.009<0.01)对春兰增殖系数的影响极显著,6-BA和NAA的影响不显著。
进一步用LSD多重比较不同水平的基本培养基和6-BA对根状茎生长速度的影响:3.0 g·L−1 HyponexⅡ与1/2MS(P=0.000<0.01)、改良1/2MS(P=0.000<0.01)之间差异极显著,后两者之间差异不显著;0.1 mg·L−1 6-BA与0.5 mg·L−1 6-BA差异极显著(P=0.005<0.01),0.3 mg·L−1 6-BA与其他2个浓度之间差异不显著。进一步用LSD多重比较不同水平的基本培养基对根状茎增殖系数的影响:1/2MS和3.0 g·L−1 HyponexⅡ对增殖系数差异极显著(P=0.002<0.01),改良1/2MS与前两者之间差异不显著。由此可见:缺少微量元素的1/2MS对根状茎增殖培养无明显促进作用;HyponexⅡ对比1/2MS更有利于春兰根状茎的增殖培养;1/2MS更有利于促进春兰根状茎的分支生长;6-BA浓度的升高有利于春兰根状茎的诱导。
2.2 NAA、6-BA和TDZ对根状茎芽分化的影响
接种时1.5~2.0 cm的根状茎上无明显的芽点凸起(图1-D),培养30 d后诱导出肉眼可见的向上生长的芽(图1-E),培养120 d时根状茎上形成了叶片2片以上的春兰小苗(图1-F)。
由表5可知:有6-BA参与的处理中,0.3 mg·L−1水平的NAA比0.5 mg·L−1水平分化率更高;有TDZ参与的处理中,1.0 mg·L−1 TDZ更有利于提高分化率。芽诱导个数最多的是处理2(5.44个),其次为处理3(4.90个),处理9的芽诱导个数最少(3.09个),12个处理中0.3 mg·L−1 NAA的芽诱导个数普遍比0.5 mg·L−1 NAA更多,有TDZ参与的处理中,1.0 mg·L−1 TDZ更有利于提高芽诱导个数。1.0 mg·L−1 6-BA时株高保持了较高高度,处理7达2.77 cm,处理1达2.70 cm,处理6的株高最低(1.06 cm),随着6-BA或者TDZ的浓度升高,株高随之降低。
表 5 NAA、6-BA和TDZ对根状茎芽分化的影响Table 5. Effects of varied concentrations of NAA, 6-BA, and TDZ on rhizome differentiation处理号 Number 分化率 Differentiation rate /% 芽诱导个数 Number of Induced bud /个 株高 Plant height/cm 1 98.00±6.32 Aa 4.07±0.53 BCDEbcde 2.70±0.81 Aa 2 90.00±10.44 ABabcd 5.44±0.78 Aa 2.53±0.75 Aa 3 94.55±12.93 ABab 4.90±0.52 ABab 1.51±0.42 DEFcd 4 78.08±19.10 Bcd 4.48±0.71 ABCDbc 1.70±0.36 CDEc 5 91.67±13.37 ABabc 4.78±0.63 ABCab 1.26±0.27 EFde 6 77.14±15.41 Bd 4.07±0.50 BCDEbcde 1.06±0.16 Fe 7 94.00±13.50 ABab 3.55±0.36 CDEcde 2.77±0.90 Aa 8 87.27±13.48 ABabcd 3.31±0.33 DEde 2.49±0.79 ABa 9 80.00±16.33 ABcd 3.09±0.33 Ee 2.07±0.55 BCb 10 46.00±9.66 Ce 3.15±0.48 Ee 1.77±0.47 CDbc 11 88.33±10.30 ABabcd 4.18±0.47 BCDEbcd 1.51±0.30 DEFcd 12 81.43±11.43 ABbcd 3.80±0.45 BCDEcde 1.47±0.33 DEFcd 方差分析表明:NAA对春兰根状茎的分化率(P=0.000<0.01)、芽诱导个数(P=0.000<0.01)和株高(P=0.001<0.01)的影响极显著;6-BA(P=0.000<0.01)对株高的影响极显著,对分化率和芽诱导个数的影响不显著;TDZ对根状茎的分化率(P=0.000<0.01)和株高(P=0.000<0.01)的影响极显著,对芽诱导个数不显著。
处理1、2和3的芽分化效果都较好,但高浓度的6-BA(3.0 mg·L−1)不利于组培苗株高的伸长;处理2的分化率较处理1低8%,芽诱导个数平均多出1.37个芽,株高上无明显差异;考虑需高效的分化培养基诱导组培苗转接至生根壮苗培养,分析可知12组处理中处理2培养基最适合诱导芽的分化。
2.3 IBA和蛋白胨对组培苗生根的影响
接种时组培苗底部竖向插入培养基适当深度,培养120 d 时组培苗底部的假鳞茎周边新生出若干的肉质根,同时叶片适当的伸长变壮(图1-G)。
由表6可知:随着IBA浓度升高,生根率呈逐渐升高的趋势,处理8的生根率(100.00%)和生根数(8.03条)都表现最好。方差分析表明:IBA对生根率(P=0.031<0.05)和生根数(P=0.036<0.05)影响显著,对平均根长(P=0.006<0.01)影响极显著;蛋白胨对生根率、生根数和平均根长影响不显著;IBA和蛋白胨对平均根长(P=0.000<0.01)影响极显著,对生根率和生根数影响不显著。
表 6 不同IBA和蛋白胨对组培苗生根的影响Table 6. Effects of varied concentrations of IBA and peptone on rooting of seedlings处理号 Number 生根率 Rooting rate/% 生根数 Number of roots/条 平均根长 Average root length /cm 1 72.73±16.61 Aa 5.25±0.76 ABb 2.65±1.19 Bc 2 82.86±12.87 Aa 5.89±1.16 ABab 2.80±1.20 ABbc 3 83.33±18.25 Aa 4.53±0.61 Bb 2.77±1.13 Bbc 4 89.47±15.29 Aa 5.25±1.00 ABb 2.75±1.30 Bbc 5 88.24±15.94 Aa 5.29±1.79 ABb 2.91±1.27 ABabc 6 77.42±12.62 Aa 6.87±1.09 ABab 3.18±1.12 Aa 7 97.14±9.24 Aa 6.46±1.17 ABab 3.19±1.20 Aa 8 100.00±0 Aa 8.03±1.38 Aa 3.00±1.16 ABab 9 96.43±7.91 Aa 6.31±1.37 ABab 2.75±1.08 Bbc 进一步用LSD多重比较IBA的3个不同水平对生根率的影响:0.5 mg·L−1和1.5 mg·L−1之间差异显著(P=0.006<0.01),1.0 mg·L−1和前两者之间差异不显著。进一步用LSD多重比较IBA的3个不同水平对生根数的影响:0.5 mg·L−1和1.5 mg·L−1之间差异显著(P=0.027<0.05),1.0 mg·L−1和前两者之间差异不显著。进一步用LSD多重比较IBA的3个不同水平对平均根长的影响:0.5 mg·L−1和1.0 mg·L−1(P=0.004<0.01)、1.5 mg·L−1(P=0.001<0.01)之间差异极显著,后两者之间差异不显著。表明在一定范围内,IBA浓度的升高有利于提高春兰组培苗的生根率、生根数和根长的生长。
2.4 炼苗移栽
春兰组培苗在树皮(2~3 cm)和火烧石等体积混合的基质中移栽60 d后,存活率达96.53%(图1-H)。
3. 讨论与结论
3.1 讨论
3.1.1 增殖的影响
增殖培养在兰花组培中是至关重要的一环,有研究表明春兰对培养基中无机盐浓度要求较低,若长时间继代培养1/2MS较合适,近年来对春兰组织培养广泛使用的基本培养基多为MS[13];有研究指出春兰[14]、蕙兰[15]、建兰[16]适合培养在低水平的无机盐和氨态氮培养基中,若长期继代培养以1/2MS为宜,寒兰[17]、墨兰[18]则适合培养在高水平的无机盐培养基中。在前人的研究基础上,本试验采用正交设计了多因素共同作用对根状茎增殖的影响,对低水平的无机盐(1/2MS)进行了改良,结果表明缺少微量元素对春兰根状茎的增殖未起到促进作用;目前关于Hyponex对春兰根状茎增殖影响的研究报道较少,在郑艳艳[10]对墨兰‘奇花’的研究中表明,当MS和Hyponex同时添加2.0 mg·L−1 BA + 0.1 mg·L−1 NAA+1.0 g·L−1蛋白胨时,HyponexⅠ和HyponexⅡ混合使用时的增殖效果优于MS培养基;本试验结果显示HyponexⅡ的参与对比MS、6-BA和NAA起到了明显的促进作用,甚至大过植物生长调节剂在增殖阶段的优势,但若缺少合适的生长调节剂配合,根状茎多短小似桑葚状聚集在一起。由此可知,春兰根状茎对无机盐、植物生长调节剂的选择与浓度之间具有紧密联系,Hyponex作为基本培养基时需要配合适当的植物生长调节剂引导根状茎伸长。
一般在增殖继代培养阶段,生长素(NAA、IBA等)与细胞分裂素(BA、TDZ等)的所需量成反比,即生长素相对较多,细胞分裂素相对需求较少,同时也要注意生长素和细胞分裂素之间的平衡关系[19]。孙芳[20]对‘如意素’ב集园’的研究表明当0.5 mg·L−1 6-BA + 2.0 mg·L−1 NAA时为最佳增殖培养基,增殖系数为5.25,当IBA替代NAA即0.1 mg·L−1 6-BA + 2.0 mg·L−1 IBA时增殖系数为4.38;刘幸佳[21]对‘宋梅’的研究表明当0.1 mg·L−1 6-BA与1.0 mg·L−1 IBA或5.0 mg·L−1 NAA搭配时为最佳增殖培养基,增殖系数均为5.8;牛田[19]对‘金荷鼎’与‘赤蕙’的研究表明当0.5 mg·L−1 6-BA + 1.0 mg·L−1 NAA时为最佳增殖培养基,增殖系数为5.67。在前人的研究基础上,本试验根据规律选取了低浓度6-BA搭配高浓度NAA对春兰进行增殖培养研究,最高增殖系数可达7.40;在实际生产中兰花根状茎的生长速度与增殖系数是同样重要的一项评判标准,因此对比前人研究,本试验增加了生长速度的评判因子,本研究结果显示,春兰根状茎在3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA + 3.0 mg·L−1 NAA(处理9)中生长速度远远快于其他处理,增殖系数处于中间值,在保障一定增殖系数的条件下,生长速度快的处理可解决春兰在组培快繁期间培养周期长的问题,即可实现一年内2次转接增至3次,此配方不仅提高了增殖系数,同时缩短了增殖培育时间。此外,结合本试验多重比较的结果针对该杂交春兰增殖阶段可继续尝试6-BA浓度高于0.5 mg·L−1的研究。
3.1.2 芽分化的影响
影响根状茎芽分化的因素是比较复杂的,除去生长调节剂的作用,还与活性炭[21]和外援添加物[22]有着密不可分的关系。王永清等[23]研究表明高水平6-BA(2.0 mg·L−1)与低水平NAA(0.5 mg·L−1)有利于春兰芽的分化,高水平NAA(2.0 mg·L−1)有利于根的诱导;在前人的研究基础上,本试验仅针对生长调节剂(NAA、6-BA、TDZ)进行了探讨:0.3 mg·L−1 NAA的分化效果整体优于0.5 mg·L−1,研究中最低水平的6-BA(1.0 mg·L−1)和NAA(0.3 mg·L−1)分化率最高(98%),但在规模化生产中分化阶段考虑的不仅仅是分化率,需同时考虑芽诱导个数和株高等评判因子,综合考虑较优组合为2.0 mg·L−1 6-BA+0.3 mg·L−1 NAA。本试验还对TDZ进行了探讨,目前关于TDZ对春兰根状茎分化培养阶段的影响未见报道,多集中在国兰的增殖培养阶段[24-25],刘昳雯[26]对莲瓣兰的研究结果表明TDZ高效的细胞分裂活性在其芽分化阶段优于6-BA,在本研究中在同为细胞分裂素的TDZ替代6-BA的情况下,高浓度的TDZ(0.5~1.5 mg·L−1)不利于春兰的分化,这可能是不同兰属在芽分化阶段对生长调节剂的需求有着一定的差异,在实际应用过程中应根据不同品种不同阶段进行适当的调整,同时在后期的研究中可适当降低TDZ浓度对春兰分化继续进行探讨。
3.1.3 生根的影响
IBA是组培植物生根壮苗的关键[27]。李玉萍[6]利用正交试验对比了IBA、NAA和BA对‘宋梅’ב韩国桃花’生根的影响,其研究结果表明对平均根数的影响大小为IBA>NAA>BA,同时表明不添加或低浓度的有机质对杂交兰幼根生长更有利;卜朝阳[28]的研究也表明了在0.1 mg·L−1 6-BA+0.5 mg·L−1 NAA的基础上,添加0.2 mg·L−1 IBA更有利于蝴蝶兰生根。本试验经过120 d的培养,结果表明IBA有利于春兰生根培养,且高水平IBA(1.5 mg·L−1)对春兰根部生长更有利;该研究结果与魏韩英[29]对春兰‘宋梅’生根的研究结果相反,其认为在添加0.1 mg·L−1 6-BA+0.5 / 1.0 / 2.0 mg·L−1 IBA的全因素处理中,低浓度IBA(0.5 mg·L−1)生根效果最好,这可能是因为降低无机盐浓度改变了植物体内的渗透压,从而影响了植物体的代谢[30]。本研究结果显示蛋白胨浓度对春兰组培苗生根的影响很小,这可能由于培养基中氮源已经充足,1.0~3.0 g·L−1水平的蛋白胨不是春兰生根的关键。
3.2 结论
本试验从不同基本培养基(MS和Hyponex)、细胞分裂素(6-BA和TDZ)、生长素(NAA和IBA)和有机添加剂(蛋白胨)对春兰‘黄梅’ב黄荷’杂交根状茎组培快繁各阶段进行了研究。结果表明:增殖最适培养基为3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA+3.0 mg·L−1 NAA+1.0 g·L−1 AC+30.0 g·L−1 Su+7.0 g·L−1 Ag,生长速度和增殖系数分别为7.31和6.02;分化最适培养基为2.0 mg·L−1 6-BA+0.3 mg·L−1 NAA+30.0 g·L−1 Su+7.0 g·L−1 Ag,分化率、芽诱导个数和株高分别为90.00%、5.44个和2.53 cm;生根最适培养基为1.5 mg·L−1 IBA+2.0 g·L−1蛋白胨+1.0 g·L−1 AC+25.0 g·L−1 Su+7.0 g·L−1 Ag,生根率、生根数和根长分别为100.00%、8.03条和3.00 cm;练苗移栽60 d后存活率达96.53%。
-
图 4 太子参根际土壤优势微生物群落组成
A:“门”水平真菌组成;B:“门”水平细菌组成;C:“属”水平真菌热图;D:“属”水平细菌热图。
Figure 4. Compositions of dominant microbial communities in rhizosphere soil of P. heterophylla habitats
Note: A: fungi community at phylum level; B: bacteria community at phylum level; C: fungi heatmap at genus level; D: bacteria heatmap at genus level.
图 6 太子参根际土壤微生物群落分布、化学性质和酚酸物质的典范对应分析
OM:有机质;TN:总氮;TP:总磷;TK:总钾;NH4+:铵态氮;AP:有效磷;AK:速效钾;Fe:有效态铁;Mn:有效态猛;Zn:有效态锌;Cu:有效态铜;VaA:香草酸;SyA:丁香酸;Van:香兰素;pHA:对羟基苯甲酸;pCA:对香豆酸;FeA:阿魏酸;BeA:安息香酸;SaA:水杨酸;CiA:肉桂酸。
Figure 6. Canonical correspondence analysis on community distribution, chemical properties and phenolic acids in rhizosphere soil of P. heterophylla habitats
Note: OM: organic matter; TN: total nitrogen; TP: total phosphorus; TK: total potassium; NH4+: ammonium nitrogen; AP: available phosphorus; AK: available potassium; Fe: iron element; Mn: manganese element; Zn: zinc element; Cu: copper element; VaA: vanillic acid; SyA: syringic acid; Van: vanillin; pHA: p-Hydroxybenzoic acid: pCA: p-Coumaric acid; FeA: ferulic acid; BeA: benzoic acid; SaA: salicylic acid; CiA: cinnamic acid.
表 1 太子参根际土壤样品信息
Table 1 Information on soils sampled from rhizosphere of P. heterophylla habitats
序号
Number采集地点
Collection places经纬度
Latitude-longitude采样条件
Sampling conditionsⅠ 柘荣县英山乡油麻厝村 Youmacuo Village, Yingshan Township, Zherong County N27°16′42″ E119°49′2″ 一年生 annual Ⅱ 柘荣县东源乡鸳鸯头村 Yuanyangtou Village, Dongyuan Township, Zherong County N27°10′17″ E119°56′42″ 一年生 annual Ⅲ 柘荣县东源乡绸岭村 Chouling Village, Dongyuan Township, Zherong County N27°11′20″ E119°55′3″ 一年生 annual Ⅳ 柘荣县东源乡东源村 Dongyuan Village, Dongyuan Township, Zherong County N27°13′1″ E119°53′40″ 一年生 annual Ⅴ 柘荣县乍洋乡束刘厝村 Shuliucuo Village, Zhayang Township, Zherong County N27°11′54″ E119°59′43″ 一年生 annual 表 2 样品α多样性指数
Table 2 α diversity indices on 5 rhizosphere soil samples at P. heterophylla habitats
微生物 Microbe 样本 Samples 物种丰富度指数 Observed_species 香农指数 Shannon 辛普森指数 Simpson Chao1指数 Chao1 细菌 Bacteria Ⅰ 5016.67ab 10.51a 1.00a 6403.94ab Ⅱ 5458.00a 10.94a 1.00a 6804.53a Ⅲ 3019.67c 9.32b 0.99a 3907.68c Ⅳ 5502.00a 10.68a 1.00a 7007.58a Ⅴ 4407.33b 10.19ab 0.99a 5717.60b 真菌 Fungi Ⅰ 470.00a 6.09a 0.97a 565.75a Ⅱ 417.67a 5.74a 0.95a 512.36a Ⅲ 348.33a 4.70a 0.82a 426.65a Ⅳ 469.00a 6.18a 0.97a 501.44a Ⅴ 410.67a 4.68a 0.81a 506.34a 注:同列数据后字母分别表示差异显著(P<0.05). 表5~8同.
Note: Data with letters on same column indicate significant difference (P<0.05). Same for Table 5-8.表 3 不同样地太子参根际土壤真菌群落中前20种优势分类单元及其相对丰度
Table 3 Top 20 dominant taxa and their relative abundance of fungi community in rhizosphere soil of P. heterophylla habitats
属名 Genus 相对丰度 Relative abundance /% Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ 子囊菌门_未分类 Ascomycota_unclassified 12.98 a 14.06 a 3.13 a 12.37 a 24.03 a 未鉴定 unidentified 14.85 a 13.25 ab 4.96 b 17.16 a 8.03 ab 被孢霉菌属 Mortierella 20.14 a 9.03 b 6.78 b 11.65 b 6.13 b 粪壳菌纲_未分类 Sordariomycetes_unclassified 3.44 a 6.54 a 15.03 a 1.72 a 26.65 a 腐质霉属 Humicola 7.14 a 6.06 a 4.60 a 3.93 a 7.25 a 赤霉属 Gibberella 1.74 a 2.99 b 2.96 b 9.45 a 1.90 b 瘦脐菇属 Rickenella 0.01 a 0.00 a 17.27 a 1.18 a 0.00 a 捷别尔达孢属 Teberdinia 3.51 ab 0.95 b 0.07 b 7.59 a 0.16 b 双担菌属 Geminibasidium 0.01 b 0.00 b 10.59 a 0.15 b 0.00 b 粪壳菌目_未分类 Sordariales_unclassified 1.98 bc 3.93 a 0.06 d 3.05 ab 1.00 cd 隐球菌属 Cryptococcus 3.52 a 1.00 b 2.27 ab 0.59 b 1.16 b 正青霉属 Eupenicillium 2.69 a 1.67 a 1.42 a 0.84 a 1.70 a 稻曲菌属 Villosiclava 2.74 a 2.53 a 0.07 b 2.22 a 0.11 b 粉褶蕈属 Entoloma 0.19 a 7.24 a 0.02 a 0.03 a 0.10 a 柄孢壳属 Podospora 3.75 a 1.76 ab 0.87 ab 0.22 b 0.31 b 真菌_未分类 Fungi_unclassified 0.02 a 1.53 a 1.66 a 1.94 a 0.06 a 肉座菌属 Hypocrea 0.31 a 0.34 a 0.36 a 1.29 a 2.44 a 毛壳菌属 Chaetomium 0.22 b 0.33 b 0.90 b 2.18 a 0.23 a 镰刀菌属 Fusarium 0.57 a 0.69 a 0.06 a 1.66 a 0.40 a 田头菇属 Agrocybe 0.51 a 0.21 a 0.11 a 0.23 a 0.25 a 注:同行数据后字母分别表示差异显著(P<0.05).表4同。
Note: Data with letters on same row indicate significant difference (P<0.05). Same for Table 4.表 4 不同样地太子参根际土壤细菌群落中前20种优势分类单元及其相对丰度
Table 4 Top 20 dominant taxa and their relative abundance of bacteria community in rhizosphere soil of P. heterophylla habitats
属名 Genus 相对丰度 Relative abundance/% Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ 酸杆菌 Gp1 8.28a 9.13a 5.91a 8.98a 5.51a 厚壁菌门_未分类 Firmicutes_unclassified 2.26b 3.19b 6.20a 4.60ab 4.40ab 黄单胞菌科_未分类 Xanthomonadaceae_unclassified 3.25a 1.33a 3.73a 2.14a 8.35a 绿弯菌门_未分类 Chloroflexi_unclassified 3.79a 3.02a 3.76a 3.28a 2.75a β-变形菌纲_未分类 Betaproteobacteria_unclassified 3.58a 3.36ab 1.94b 3.33ab 2.61ab 罗河杆菌属 Rhodanobacter 2.48ab 0.20b 7.51a 0.34b 3.67ab γ-变形菌纲_未分类 Gammaproteobacteria_unclassified 3.22a 1.83b 2.63b 3.41a 2.57ab 细菌_未分类 Bacteria_unclassified 2.20a 2.73a 2.83a 2.90a 2.49a 芽单孢菌属 Gemmatimonas 3.13a 3.76a 1.70a 2.06a 2.34a 放线菌目_未分类 Actinomycetales_unclassified 2.03ab 1.09c 5.72a 1.47ab 2.20a 酸杆菌 Gp3 2.50a 2.77a 1.66a 3.28a 2.12a 红螺菌科_未分类 Rhodospirillaceae_unclassified 1.32b 2.02ab 3.62a 2.51ab 1.55b 根瘤菌目_未分类 Rhizobiales_unclassified 2.09a 2.34a 2.00a 2.31a 2.21a 红螺菌目_未分类 Rhodospirillales_unclassified 1.76b 1.50b 3.84a 2.16b 1.46b 纤线杆菌属 Ktedonobacter 2.51a 1.72ab 1.33b 1.71ab 2.57a 酸杆菌 Gp2 1.75ab 2.14b 1.01c 3.29a 1.34ab 酸杆菌门_酸杆菌_未分类 Acidobacteria_Gp1_unclassified 2.21a 1.84ab 2.01ab 1.42bc 1.23c 勒氏菌属 Gaiella 1.36a 1.23a 2.06a 1.96a 1.81a 放线菌纲_未分类 Actinobacteria_unclassified 2.44a 1.72ab 1.31b 1.96ab 0.95b 未命名 WPS-2_genera_incertae_sedis 1.51a 1.16a 1.68a 1.16a 1.12a 表 5 不同样地太子参根际土壤化学性质
Table 5 Chemical properties of rhizosphere soil from P. heterophylla habitats
序号
Number酸碱度
pH有机质
Organic matter/
(g·kg−1)全氮
Total N/
(g·kg−1)全磷
Total P/
(g·kg−1)全钾
Total K/
(g·kg−1)铵态氮
Ammonium N/
(mg·kg−1)有效磷
Available P/
(mg·kg−1)速效钾
Available K/
(mg·kg−1)Ⅰ 4.82c 32.56c 1.58b 1.54e 1.05b 14.67b 45.90ab 90.00b Ⅱ 5.31a 43.83a 2.37a 2.06c 1.08b 14.00b 51.30ab 62.00c Ⅲ 4.64d 23.30d 1.36c 2.59a 0.67c 14.00b 52.20b 195.00a Ⅳ 4.95b 38.07b 1.28c 1.61d 1.10b 18.67a 44.00b 107.00b Ⅴ 4.82c 39.84b 2.27a 2.38b 2.19a 14.67b 54.50a 106.50b 表 6 不同样地太子参根际土壤中有效态微量元素的含量
Table 6 Content of available trace elements in rhizosphere soil of P. heterophylla habitats
序号
Number有效态锰
Available Mn/(mg·kg−1)有效态铜
Available Cu/(mg·kg−1)有效态锌
Available Zn/(mg·kg−1)有效态铁
Available Fe/(mg·kg−1)Ⅰ 18.45d 4.18a 9.35d 151.94a Ⅱ 19.33c 1.23d 13.19a 64.08c Ⅲ 16.80e 0.76e 5.19e 43.85e Ⅳ 23.14a 2.53c 11.80b 98.50b Ⅴ 21.22b 3.29b 11.61c 49.46d 表 7 不同样地太子参根系分泌物酚酸的含量
Table 7 Content of phenolic acids in root exudates of P. heterophylla at different locations
序号
Number香草酸
Vanillic acid/(mg·kg−1)丁香酸
Syringic acid/(mg·kg−1)对羟基苯甲酸
p-Hydroxybenzoic acid/(mg·kg−1)对香豆酸
p-Coumaric acid/(mg·kg−1)Ⅰ 0.84b 2.99b 1.73c 3.83c Ⅱ 1.38a 4.05a 1.86a 6.07a Ⅲ 0.78c 1.93e 1.76b 1.83e Ⅳ 0.87b 2.85c 1.53d 3.28d Ⅴ 0.71d 2.19d 1.28e 4.77b 表 8 不同样地太子参根系分泌物酚酸的含量
Table 8 Content of phenolic acids in root exudates of P. heterophylla at different locations
序号
Number香兰素
Vanillin/(mg·kg−1)阿魏酸
Ferulic acid/(mg·kg−1)安息香酸
Benzoic Acid/(mg·kg−1)水杨酸
Salicylic acid/(mg·kg−1)肉桂酸
Cinnamic acid/(mg·kg−1)Ⅰ 0.68d 1.45b 3.83a 1.51ab 0.13c Ⅱ 1.02a 2.03a 2.58c 1.40b 0.15a Ⅲ 0.65e 0.90d 2.45c 1.37bc 0.12d Ⅳ 0.72b 1.35c 3.31b 1.24c 0.13b Ⅴ 0.70c 1.46b 3.37b 1.57a 0.15d -
[1] 黄泽豪. 太子参 [J]. 生命世界, 2015(10):38−39. HUANG Z H. Pseudostellaria heterophylla [J]. LIFE WORLD, 2015(10): 38−39.(in Chinese)
[2] 黄冬寿, 王树贵. 福建“柘荣太子参”栽培环境的道地性研究 [J]. 中国野生植物资源, 2010, 29(2):12−14. DOI: 10.3969/j.issn.1006-9690.2010.02.004 HUANG D S, WANG S G. Research on planting environment of genuine Pseudostellaria heterophylla from Zherong, Fujian Province [J]. Chinese Wild Plant Resources, 2010, 29(2): 12−14.(in Chinese) DOI: 10.3969/j.issn.1006-9690.2010.02.004
[3] 曾令杰, 林茂兹, 李振方, 等. 连作对太子参光合作用及药用品质的影响 [J]. 作物学报, 2012, 38(8):1522−1528. ZENG L J, LIN M Z, LI Z F, et al. Effects of continuous cropping on photosynthesis and medicinal quality of Pseudostellariae heterophylla [J]. Acta Agronomica Sinica, 2012, 38(8): 1522−1528.(in Chinese)
[4] 张重义, 林文雄. 药用植物的化感自毒作用与连作障碍 [J]. 中国生态农业学报, 2009, 17(1):189−196. DOI: 10.3724/SP.J.1011.2009.00189 ZHANG Z Y, LIN W X. Continuous cropping obstacle and allelopathic autotoxicity of medicinal plants [J]. Chinese Journal of Eco-Agriculture, 2009, 17(1): 189−196.(in Chinese) DOI: 10.3724/SP.J.1011.2009.00189
[5] 陈建祥, 王飞, 左群, 等. 贵州省施秉县太子参生产存在问题与高产栽培关键技术 [J]. 农技服务, 2011, 28(2):231−232. DOI: 10.3969/j.issn.1004-8421.2011.02.065 CHEN J X, WANG F, ZUO Q, et al. Shibing County, Guizhou Province Radix pseudostellariae produces have problem and high-yield culture key technology [J]. Agricultural Technology Service, 2011, 28(2): 231−232.(in Chinese) DOI: 10.3969/j.issn.1004-8421.2011.02.065
[6] 林文雄, 熊君, 周军建, 等. 化感植物根际生物学特性研究现状与展望 [J]. 中国生态农业学报, 2007, 15(4):1−8. LIN W X, XIONG J, ZHOU J J, et al. Research status and its perspective on the properties of rhizosphere biology mediated by allelopathic plants [J]. Chinese Journal of Eco-Agriculture, 2007, 15(4): 1−8.(in Chinese)
[7] 吴宗伟, 王明道, 刘新育, 等. 重茬地黄土壤酚酸的动态积累及其对地黄生长的影响 [J]. 生态学杂志, 2009, 28(4):660−664. WU Z W, WANG M D, LIU X Y, et al. Phenolic compounds accumulation in continuously cropped Rehmannia glutinosa soil and their effects on R. glutinosa growth [J]. Chinese Journal of Ecology, 2009, 28(4): 660−664.(in Chinese)
[8] MCCULLY M. Rhizosphere allelopathy [J]. Allelopathy Journal, 2007, 19(1): 75−84.
[9] 陈军, 黄珊瑜, 刘冰, 等. 不同菌肥处理对太子参根际微生物群落的影响 [J]. 福建农业学报, 2015, 30(12):1171−177. DOI: 10.3969/j.issn.1008-0384.2015.12.008 CHEN J, HUANG S Y, LIU B, et al. Effects of microbial fertilizers on microbial community structure in Radix pseudostellariae Rhizosphere [J]. Fujian Journal of Agricultural Sciences, 2015, 30(12): 1171−177.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2015.12.008
[10] 邹立思, 马阳, 侯娅, 等. 基于磷脂脂肪酸(PLFA)技术的不同产地太子参根际土壤微生物群落结构多样性分析 [J]. 中药材, 2018, 41(5):1054−1060. ZOU L S, MA Y, HOU Y, et al. Analysis of diversity of microbial community in rhizosphere soil of Pseudostellaria heterophylla in different habitats based on phospholipid fatty acid(PLFA) [J]. Journal of Chinese Medicinal Materials, 2018, 41(5): 1054−1060.(in Chinese)
[11] 袁济端. 福建柘荣太子参基地土壤肥力状况评价 [J]. 福建热作科技, 2007, 32(3):3−7. DOI: 10.3969/j.issn.1006-2327.2007.03.002 YUAN J D. An evaluation of the fertility of the soil for Pseudostellaria heterophylla falsestarwort at Zherong, fujain [J]. Fujian Science & Technology of Tropical Crops, 2007, 32(3): 3−7.(in Chinese) DOI: 10.3969/j.issn.1006-2327.2007.03.002
[12] 陈雅涵, 谢宗强, 薛丽萍. 碳氮元素分析仪测试土壤与植物样品的流程优化 [J]. 现代化工, 2016, 36(4):185−187, 189. CHEN Y H, XIE Z Q, XUE L P. Process optimization for measurements of soil and plant samples with carbon/nitrogen element analyzer [J]. Modern Chemical Industry, 2016, 36(4): 185−187, 189.(in Chinese)
[13] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 36-148. [14] 曾豪杰, 刘宇, 祝建国, 等. 电感耦合等离子体发射光谱法测定土壤中铁、锌、铜、锰元素含量 [J]. 中兽医医药杂志, 2016, 35(5):45−47. ZENG H J, LIU Y, ZHU J G, et al. Determination of Fe, Zn, Cu and Mn in Dawashan soils by inductively coupled plasma-atomic emission spectrometry [J]. Journal of Traditional Chinese Veterinary Medicine, 2016, 35(5): 45−47.(in Chinese)
[15] 吴丹, 赵立, 庞文生, 等. 太子参根际土壤酚酸类自毒物质的分析测定 [J]. 中国民族民间医药, 2017, 26(24):32−34. WU D, ZHAO L, PANG W S, et al. Analysis and determination of phenolic acid self-toxic substances inrhizosphere soil of Radix pseudostellariae [J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2017, 26(24): 32−34.(in Chinese)
[16] 吴红淼, 林文雄. 药用植物连作障碍研究评述和发展透视 [J]. 中国生态农业学报(中英文), 2020, 28(6):775−793. WU H M, LIN W X. A commentary and development perspective on the consecutive monoculture problems of medicinal plants [J]. Chinese Journal of Eco-Agriculture, 2020, 28(6): 775−793.(in Chinese)
[17] HU J, PANG W S, CHEN J L, et al. Hypoglycemic effect of polysaccharides with different molecular weight of Pseudostellaria heterophylla [J]. BMC Complementary and Alternative Medicine, 2013, 13(1): 1−9. DOI: 10.1186/1472-6882-13-1
[18] 赵庆芳, 周紫鹃, 王树红, 等. 7种植物对黄芪根腐病病原菌的抑制作用研究 [J]. 西北师范大学学报(自然科学版), 2009, 45(5):92−95. ZHAO Q F, ZHOU Z J, WANG S H, et al. Study on the inhibition effects of 7 kinds of plant to the growth of Astragalus membranaceus root rot fungi [J]. Journal of Northwest Normal University (Natural Science), 2009, 45(5): 92−95.(in Chinese)
[19] 薛彩云, 严雪瑞, 林天行, 等. 五味子茎基腐病发生初报 [J]. 植物保护, 2007(4):96−99. DOI: 10.3969/j.issn.0529-1542.2007.04.027 XUE C Y, YAN X R, LIN T X, et al. A preliminary report on occurrence of Schisandra berry stalk rot [J]. Plant Protection, 2007(4): 96−99.(in Chinese) DOI: 10.3969/j.issn.0529-1542.2007.04.027
[20] 朱春雨, 刘西莉, 董槿, 等. 麻黄根腐病病原物的分离及鉴定 [J]. 植物病理学报, 2003(3):193−197. DOI: 10.3321/j.issn:0412-0914.2003.03.001 ZHU C Y, LIU X L, DONG J, et al. Isolation and identification of the pathogens causing root rot disease of Chinese Ephedra [J]. Acta Phytopathologica Sinica, 2003(3): 193−197.(in Chinese) DOI: 10.3321/j.issn:0412-0914.2003.03.001
[21] CHEN J, WU L K, XIAO Z G, et al. Assessment of the diversity of Pseudomonas spp. and Fusarium spp. in Radix pseudostellariae rhizosphere under monoculture by combining dgge and quantitative pcr [J]. Frontiers in Microbiology, 2017, 8: 1748. DOI: 10.3389/fmicb.2017.01748
[22] WU L K, CHEN J, WU H M, et al. Insights into the regulation of rhizosphere bacterial communities by application of bio-organic fertilizer in Pseudostellaria heterophylla monoculture regime [J]. Frontiers in Microbiology, 2016, 7: 1788.
[23] DE FERRIGO D, MONDIN M, LADURNER E, et al. Effect of seed biopriming with Trichoderma harzianum strain INAT11 on Fusarium ear rot and Gibberella ear rot diseases [J]. Biological Control, 2020, 147: 104286. DOI: 10.1016/j.biocontrol.2020.104286
[24] 胡贤锋, 王健, 李明, 等. 水稻稻曲病菌侵染行为的研究现状及展望 [J]. 河南农业科学, 2020, 49(7):1−7. HU X F, WANG J, LI M, et al. Progress and perspect of infection behavior of Ustilaginoidea virens [J]. Journal of Henan Agricultural Sciences, 2020, 49(7): 1−7.(in Chinese)
[25] 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展 [J]. 生物技术通报, 2016, 32(2):14−20. WANG G H, LIU J J, YU Z H, et al. Research progress of Acidobacteria ecology in soils [J]. Biotechnology Bulletin, 2016, 32(2): 14−20.(in Chinese)
[26] 徐志霞, 王璇, 李慧敏, 等. 不同林龄木麻黄林地土壤细菌及与土壤因子的相关性分析 [J]. 基因组学与应用生物学, 2018, 37(2):780−788. XU Z X, WANG X, LI H M, et al. Correlative analysis of soil factors and soil bacteria in Casuarina equisetifolia woodlands at different stand ages [J]. Genomics and Applied Biology, 2018, 37(2): 780−788.(in Chinese)
[27] 葛艺, 徐绍辉, 徐艳. 根际微生物组构建的影响因素研究进展 [J]. 浙江农业学报, 2019, 31(12):2120−2130. DOI: 10.3969/j.issn.1004-1524.2019.12.21 GE Y, XU S H, XU Y. Review on influencing factors of rhizosphere microbiome assemblage [J]. Acta Agriculturae Zhejiangensis, 2019, 31(12): 2120−2130.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2019.12.21
[28] LIU J G, LI X G, JIA Z J, et al. Effect of benzoic acid on soil microbial communities associated with soilborne peanut diseases [J]. Applied Soil Ecology, 2017, 110: 34−42. DOI: 10.1016/j.apsoil.2016.11.001
[29] WU H M, QIN X J, WANG J Y, et al. Rhizosphere responses to environmental conditions in Radix pseudostellariae under continuous monoculture regimes [J]. Agriculture, Ecosystems & Environment, 2019, 270/271: 19−31.
[30] 高慧芳, 彭晓倩, 李赣新, 等. 太子参根际土壤中群体感应产生菌与淬灭菌筛选、鉴定及对太子参生长的影响 [J]. 中国科技论文在线, 2016, 9(2):1−8. GAO H F, PENG X Q, LI G X, et al. Screening and identification of quorum sensing and quorum quenching bacteria of Pseudostellaria heterophylla in rhizosphere soil and their effects on the growth of Pseudostellaria heterophylla [J]. Sciencepaper Online, 2016, 9(2): 1−8.(in Chinese)
[31] 高慧芳, 彭晓倩, 郭泽望, 等. 太子参连作过程根系分泌物中酚酸类物质的测定及其对黏质沙雷氏菌生长的影响 [J]. 中国科技论文在线, 2017, 1(3):1−7. GAO H F, PENG X Q, GUO Z W, et al. Assay of phenolic acid from root exudates during continuous cropping process of Pseudostellaria heterophylla and their effects on the growth of Serratia marcescens from rhizosphere soil [J]. Sciencepaper Online, 2017, 1(3): 1−7.(in Chinese)
[32] ZHANG L Y, GUO Z W, GAO H F, et al. Interaction of Pseudostellaria heterophylla with quorum sensing and quorum quenching bacteria mediated by root exudates in a consecutive monoculture system [J]. Journal of Microbiology and Biotechnology, 2016, 26(12): 2159−2170. DOI: 10.4014/jmb.1607.07073
-
期刊类型引用(3)
1. 陈兰芬,陈卿然,汤久杨,王颖,宋彩凤. 国兰新品种‘森彩菊韵’组培快繁技术研究. 现代园艺. 2024(04): 10-12 .  百度学术
百度学术
2. 杨松敏,唐若楠,程梦雅,牛沐奇,陈和明,彭东辉. 杂交兰‘红美人’×寒兰‘杨贵妃’杂交后代增殖与分化研究. 北方园艺. 2023(14): 63-70 .  百度学术
百度学术
3. 卢雪兰,罗雯,黄琼英,冠巍,徐俊强. 无性繁殖技术在植物中药材繁殖和生产中的应用研究进展. 现代园艺. 2021(07): 31-35 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: