Transcriptome Analysis on Cryotherapy-treated Virus-free Plantlets of Red Bud Taro at Yanshan, Jiangxi Province
-
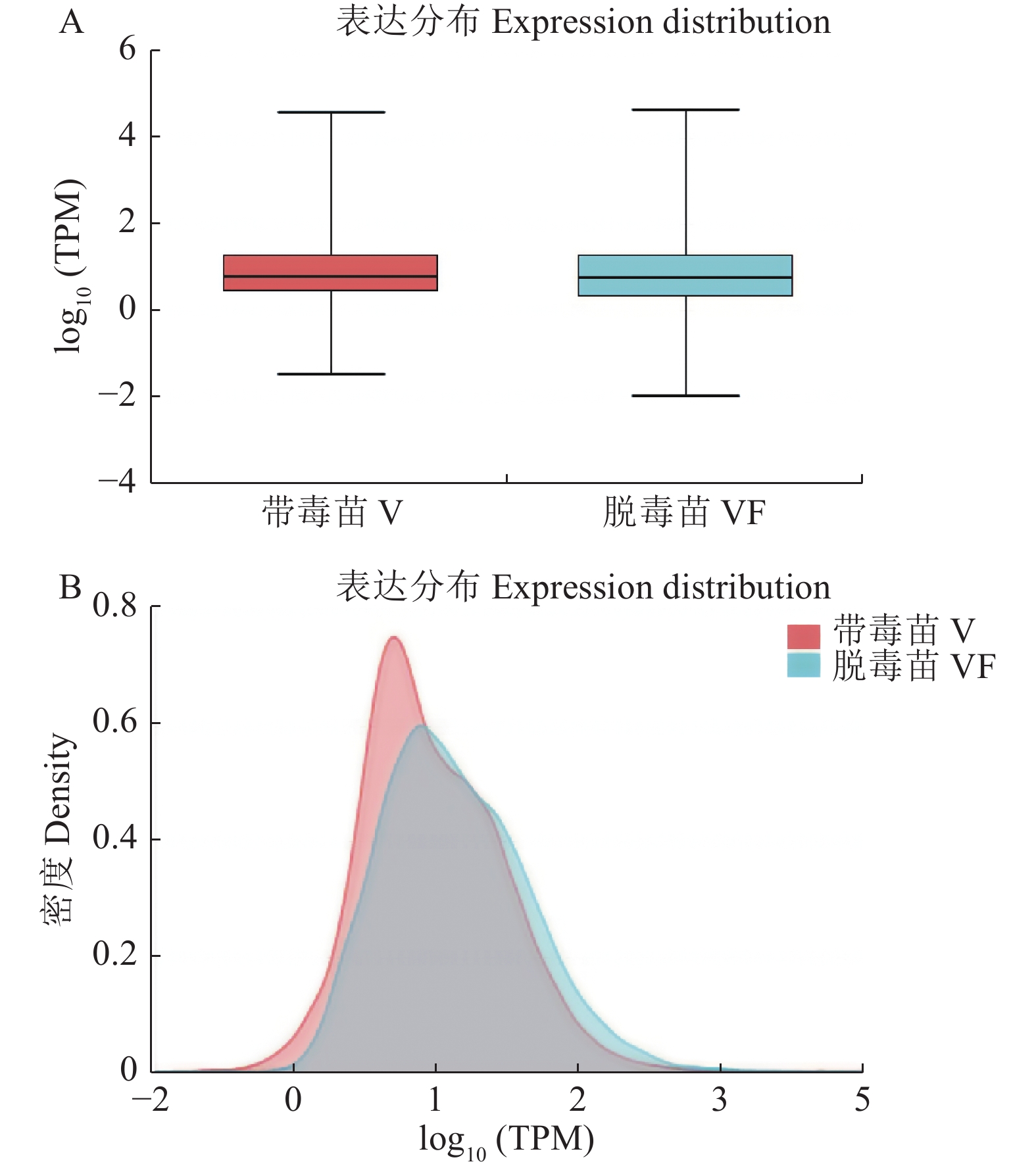
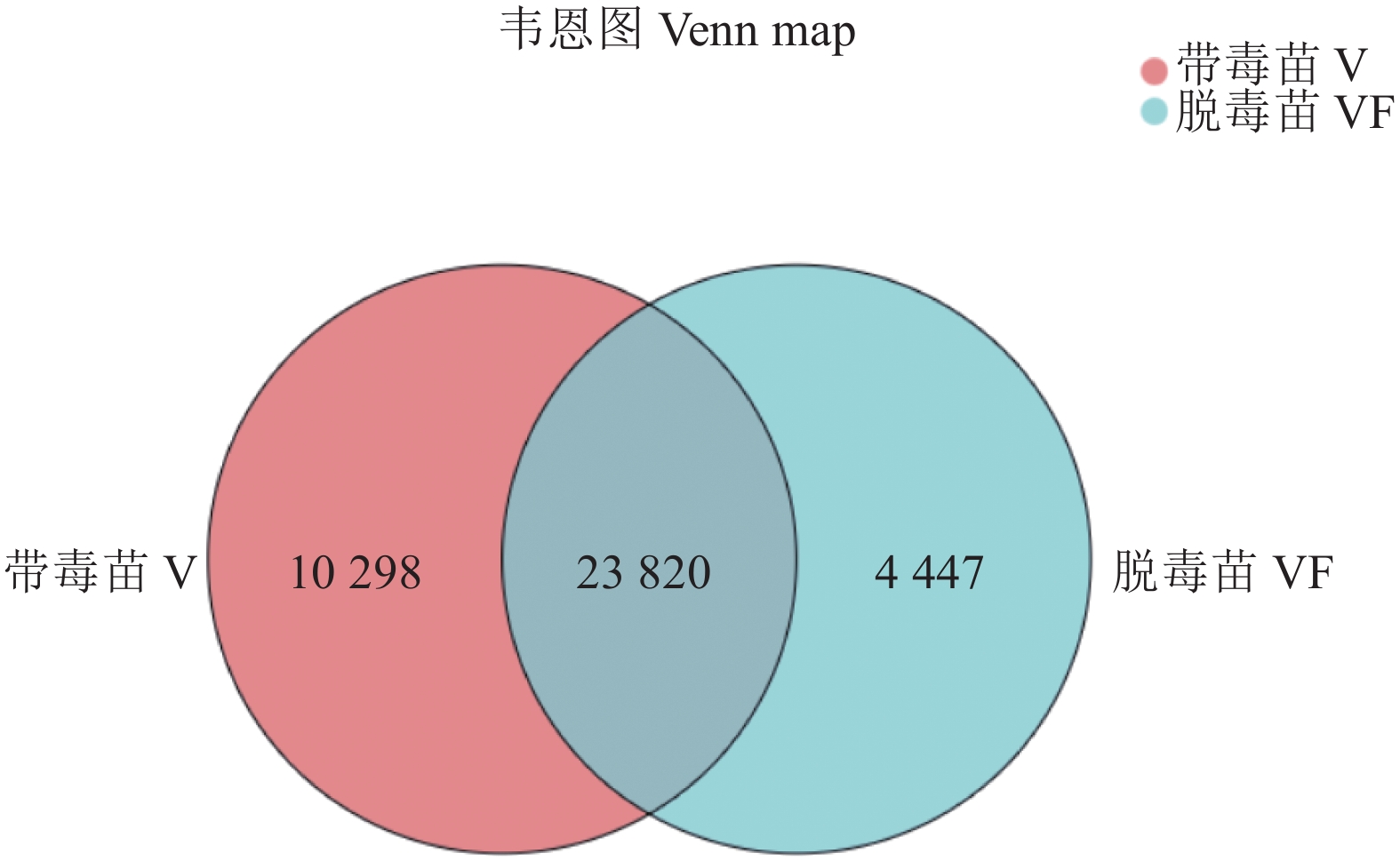
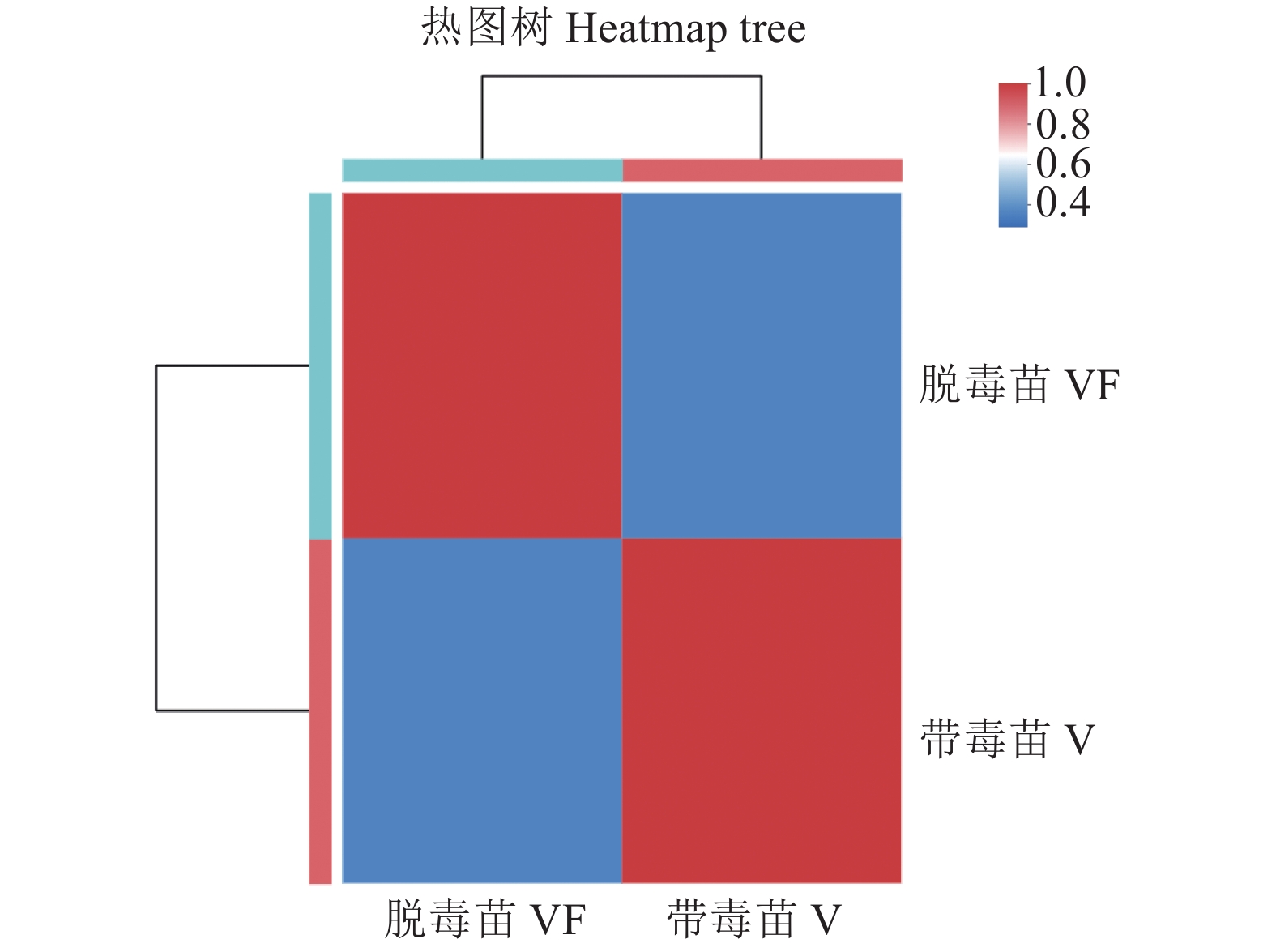
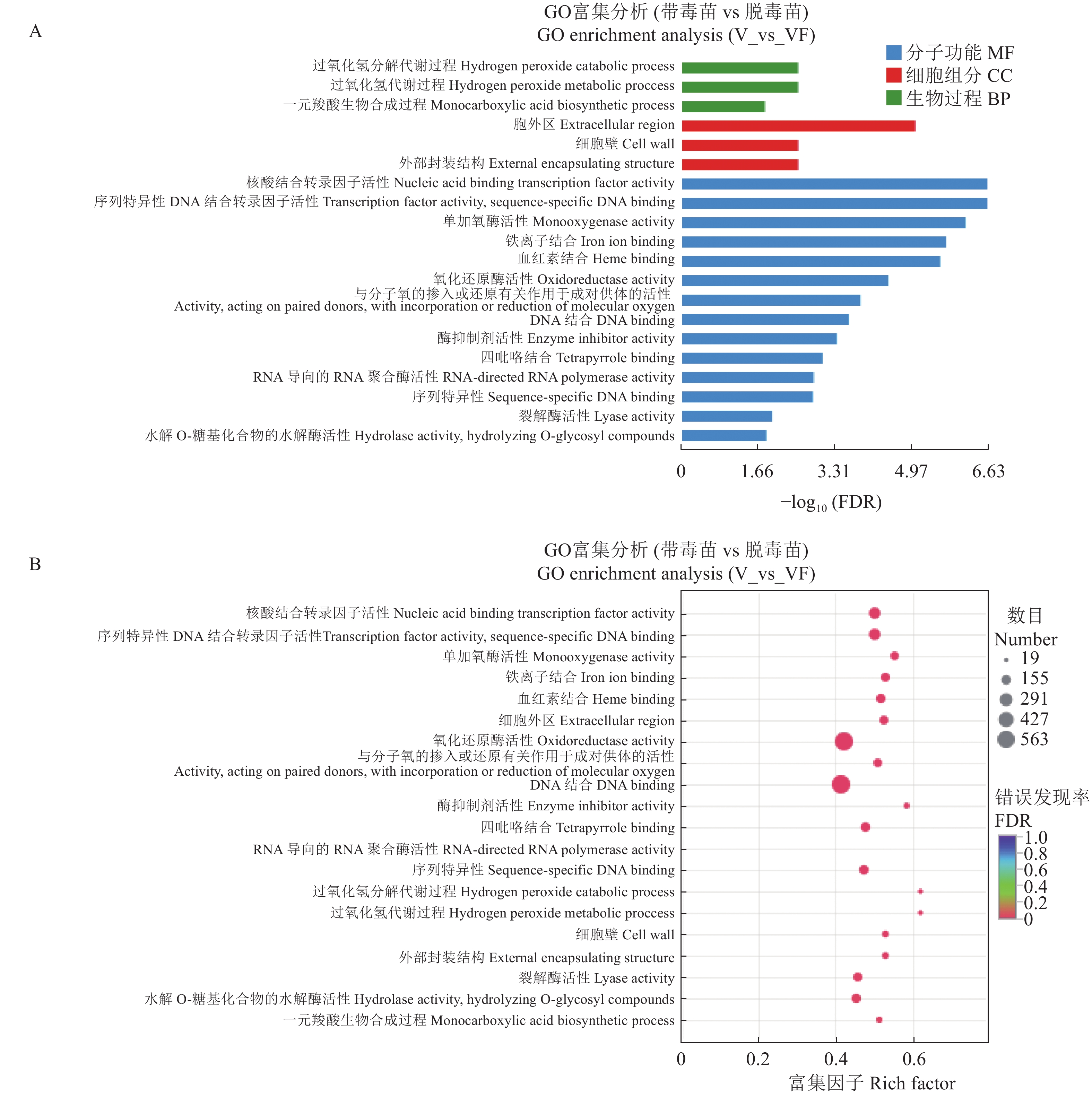
摘要:目的 探究江西铅山红芽芋对超低温疗法脱毒的转录组响应机制,为江西铅山红芽芋超低温疗法脱毒苗的规模化应用奠定理论依据。方法 以江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)试验材料进行转录组比较分析。结果 VF组Clean reads为42 406 188,GC含量为54.09%;V组Clean reads为46 818 060,GC含量为50.36%。VF组和V组表达量FPKM的对数值在0~2,表达量密度在0~0.8。VF组和V组表达的共有基因数为23 820,V组单独表达的基因数为10 298,VF组单独表达的基因数为4 477。VF组和V组表达量的相关系数为0.287,样本间相关性较差。VF组和V组共产生差异表达基因5 282 个,与V组比较,VF组上调基因3 011,下调基因2 271。GO 富集分析显示,差异基因主要注释到过氧化氢分解过程、过氧化氢代谢过程、一元羧酸生物合成过程、多糖分解代谢过程、金属离子输运、细胞外区、细胞壁、外部封装结构、膜的固有成分、质膜固有成分、核酸结合转录因子活性、序列特异性DNA结合转录因子活性、单加氧酶活性、铁离子结合、血红素结合等功能。KEGG 富集分析显示,差异基因主要注释到苯丙酸生物合成、类黄酮生物合成、二苯乙烯类和二芳基庚烷类以及姜辣素的生物合成、MAPK信号通路-植物、淀粉和蔗糖代谢、酪氨酸代谢、植物激素信号转导、戊糖和葡萄糖醛酸的相互转化、过氧化物酶体、α-亚麻酸代谢、苯丙氨酸代谢、氰胺酸代谢、类胡萝卜素生物合成、异喹啉生物碱的生物合成、泛醌和其他萜类醌的生物合成、甘氨酸、丝氨酸和苏氨酸代谢、植物昼夜节律、果糖和甘露糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢等途径。结论 F-box家族蛋白、脱落酸受体PYR1、乙烯受体2、生长素响应因子1、BZIP转录因子家族蛋白、过氧化物酶、过氧化氢酶1、超氧化物歧化酶[Cu-Zn]、植物抗病反应蛋白、抗病蛋白、抗病蛋白RPS2、抗病蛋白RPS5、抗病蛋白RGA2、抗病反应蛋白、转座子TNT的逆转录病毒相关Pol多蛋白、逆转录病毒相关Pol多聚蛋白系1、类烟草病毒增殖蛋白3、烟草病毒增殖蛋白1、转座子RE1的逆转录病毒相关Pol多蛋白、蔗糖合成酶等基因是江西铅山红芽芋的超低温疗法脱毒的主要响应基因。Abstract:Objective Mechanism of red bud taro in response to cryotherapy was studied by transcriptome analysis for extended application of the virus-free seedlings at Yanshan, Jiangxi.Method Transcriptomes of virus-free (VF) and virus-carrying (V) red bud taro plantlets that had been cryo-therapeutically treated were analyzed and compared.Result In the VF plantlets, the clean reads were 42 406 188 with a GC content of 54.09%; while, in the V plantlets, the clean reads were 46 818 060 with a GC content of 50.36%. For either group, the FPKM was between 0-2, and the expression density between 0-0.8. There were 23 820 genes commonly expressed in both VF and V, while 4 477 independently expressed in VF, and 10 298 in V. There was a low correlation between VF and V with a coefficient of 0.287, and were 5 282 differentially expressed genes (DEG) in them. Compared to V, VF had 3 011 genes were up-regulated and 2 271 down-regulated. The Go enrichment analysis showed that the differential genes were annotated mainly in the processes of hydrogen peroxide catabolism, hydrogen peroxide metabolism, monocarboxylic acid biosynthesis, and polysaccharide catabolism, metal ion transport, extracellular region, cell wall, external encapsulating structure, intrinsic components of membrane and plasma membrane as well as the activities of nucleic acid binding transcription factor, transcription factor, sequence-specific DNA binding, monooxygenase, iron ion binding, heme binding, etc. The KEGG enrichment analysis indicated that the differential genes were annotated largely to the biosynthesis of phenylpropanoid, flavonoid, stilbenoid, diarylheptanoid, gingerol, carotenoid, isoquinoline alkaloid, ubiquinone, and other terpenoid-quinones, the metabolisms of starch, sucrose, tyrosine, alpha-Linolenic acid, phenylalanine, cyanoamino acid, glycine, serine, threonine, fructose, mannose, galactose, amino sugar, and nucleotide sugar, and the pathways of MAPK signaling-plant, plant hormone signal transduction, pentose and glucuronate interconversions, peroxisome, circadian rhythm-plant, and others,Conclusion The genes of F-box family protein, abscisic acid receptor PYR1, ethylene receptor 2, auxin response factor 1, BZIP transcription factor family protein, peroxidase, catalase 1, superoxide dismutase [Cu-Zn], plant disease resistance response protein, disease resistance protein, disease resistance protein RPS2, disease resistance protein RPS5, disease resistance protein RGA2, disease resistance response protein, retrovirus-related Pol polyprotein from transposon TNT, retrovirus-related Pol polyprotein LINE-1, tobamovirus multiplication protein 3-like, tobamovirus multiplication protein 1, retrovirus-related Pol polyprotein from transposon RE1, sucrose synthase, etc. were the predominant genes in the virus-free red bud taro plantlets that responded to the cryotherapy.
-
0. 引言
【研究意义】木棉(Bombax ceiba)为木棉科(Bombaceae)木棉属(Bombax)落叶大乔木,在华南地区被广泛应用于园林绿化。但每年6月前后,木棉果实成熟之际,果实中的絮毛爆裂而出,四处飘散,给市民的生活和健康带来了严重困扰。通过在适宜的生长阶段注射或喷施植物生长调节剂调节开花、结果和飘絮已在杨树[1]、柳树[2]上开展了相关研究,而对于木棉开花或结果的调节研究鲜见报道。探究木棉花芽分化过程及此过程中的内源激素水平,可为人工利用植物生长调节剂进行飞絮防控的治理提供科学参考与理论依据。【前人研究进展】在植物学领域中,花芽的形成和发育是一个复杂而精妙的过程,其调控机制涉及多种内源性植物激素的相互作用,这些激素在花芽分化的进程中扮演着关键角色。研究表明,包括赤霉素(Gibberellin Acid, GA3)、生长素(Indoleacetic acid, IAA)、玉米核苷素(trans-Zeatin riboside, ZR)和脱落酸(Abscisci acid, ABA)在内的植物激素,对于花芽的诱导和成熟具有不可忽视的影响[3]。有研究表明低水平的GA3,以及高水平的ZR含量在花芽分化过程中起积极正面的作用。例如刺梨(Rosa roxburghii)[4]和枇杷(Eriobotrya japonica)[5]花芽分化过程中GA3含量均保持在较低水平,而荔枝(Litchi chinensis)[6]和紫苏(Perilla frutescens)[7]花芽分化过程中高水平ZR促进了花芽分化。然而,在植物的花芽发育进程中,ABA与IAA的功能因物种和发育阶段的不同而存在差异。例如,在油桐(Vernicia fordii)[8]中,高水平的ABA含量有利于由花芽生理分化期向花芽形态分化期的转变,而相对低水平的ABA含量有助于其花芽形态分化;在银杏(Ginkgo biloba)雌花芽[9]和莲花(Nelumbo nucifera)[10]花芽分化进程中,高含量IAA促进成花,但在葡萄(Vitis vinifera)[11]中起到的作用与之相反。除了单一激素的影响外,各激素之间的相互作用与调节也影响着植物的花芽分化进程[12],例如,高水平的ABA/GA3在平阴玫瑰(Rosa rugosa cv. Plena)[13]花芽分化过程中起正向作用,高比值的ABA/IAA、ZR/IAA、ZR/GA3对于叶底红(Phyllagathis fordii)[14]花芽分化起到促进作用。【本研究切入点】尽管在多种物种中的研究已表明GA3、IAA、ZR、ABA等内源激素在植物花芽分化过程中起到的重要作用,但关于木棉的花芽分化过程的相关研究则鲜见报道,也未见关于木棉开花与内源激素关系的研究报道。【拟解决的关键问题】探究木棉花芽分化过程主要内源激素GA3、IAA、ZR、ABA含量的变化,为了解木棉开花规律、调控其开花结果提供理论基础,从而为治理果实飘絮提供参考。
1. 材料与方法
1.1 试验地及植物材料
试验地位于福建省福州市三江口生态公园(119°39′E, 26°01′N),地处亚热带,温和湿润气候。该地年平均气温19.7 ℃,温度变化幅度适中,其中最冷月(1月份)的平均气温约为10.6 ℃,而最热月(8月份)的平均气温可达到28.8 ℃。试验材料为8年生木棉植株,株高约20 m,生长状况良好,无病虫害。
1.2 试验方法
1.2.1 样品采集与处理
2023年10月上旬至2024年3月上旬,对福州市三江口生态公园中生长的木棉进行取样,随机选取样株树冠外围不同方向的枝条采集花芽,采集部位多集中于枝端和叶腋。每7 d进行1次采集,持续20次。每次采集样品30个混合后均分为3份,1份保鲜带回实验室,用于外部形态观察;1份投放入FAA固定液(70% 乙醇∶冰乙酸∶38% 甲醛=18∶1∶1)保存固定,于−4 ℃低温保存;1份采集后立即用锡箔纸包裹,放在液氮中速冻后置于干冰盒内保存,于−80 ℃冰箱,用于内源激素测定。
1.2.2 花芽外部形态与内部结构观察
对保鲜带回的花芽进行外部形态的观察记录,并用数码相机进行拍摄记录。花芽内部结构的观察参照倪子轶[15]的方法,具体内容包括材料酒精脱水、二甲苯透明、变温浸蜡、包埋、切片。切片厚度为10 μm。切片后续经脱蜡、染色、封片后在显微镜下观察和拍照。
1.2.3 GA3、ZR、IAA、ABA含量测定
以花芽石蜡切片显示的花芽分化阶段为基础,选取相对应时期超低温保存的植物样品,采用酶联免疫吸附法(ELLSA)(上海酶联生物科技有限公司)测定植物样品中GA3、ZR、IAA、ABA的含量,具体方法参照试剂盒说明书进行。
1.3 数据分析
试验数据使用Excel 2016软件进行初步处理,使用SPSS 26软件进行方差分析,采用Graph Prism Pad9作图。
2. 结果与分析
2.1 木棉花芽分化过程外部形态与内部结构
通过石蜡切片观察木棉花芽的内部结构,发现木棉的花芽分化开始于10月下旬,结束于11月下旬。石蜡切片结果显示,木棉的花芽分化过程可分为前分化期、花原基分化期、萼片原基分化期、花瓣原基分化期、雌雄蕊原基分化期、雌雄蕊形成期(图1)。
![]() 图 1 木棉花芽不同分化期外部形态特征及内部形态结构A1~F1分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)植物样品外部形态;A2~F2分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)内部形态结构。GP: 生长点;FP:花原基;SE:花萼原基;PE:花瓣原基;PP:雌蕊原基;SP:雄蕊原基;PI:雌蕊;ST:雄蕊。Figure 1. External morphology and internal structure of B. ceiba flower buds at differentiation phasesA1: external morphology of Phase I plant; B1: external morphology of Phase II plant; C1: external morphology of Phase III plant; D1: external morphology of Phase IV plant; E1: external morphology of Phase V plant; F1: external morphology of Phase VI plant; A2: internal structure of Phase I plant; B2: internal structure of Phase II plant; C2: internal structure of Phase III plant; D2: internal structure of Phase IV plant; E2: internal structure of Phase V plant; F2: internal structure of Phase VI plant; GP: growing point; FP: flower primordial; SE: sepal; PE: Petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen. GP: growing point; FP: flower primordial; SE: sepal; PE: petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen.
图 1 木棉花芽不同分化期外部形态特征及内部形态结构A1~F1分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)植物样品外部形态;A2~F2分别为前分化期(I)、花原基分化期(II)、萼片原基分化期(III)、花瓣原基分化期(IV)、雌雄蕊原基分化期(V)、雌雄蕊形成期(VI)内部形态结构。GP: 生长点;FP:花原基;SE:花萼原基;PE:花瓣原基;PP:雌蕊原基;SP:雄蕊原基;PI:雌蕊;ST:雄蕊。Figure 1. External morphology and internal structure of B. ceiba flower buds at differentiation phasesA1: external morphology of Phase I plant; B1: external morphology of Phase II plant; C1: external morphology of Phase III plant; D1: external morphology of Phase IV plant; E1: external morphology of Phase V plant; F1: external morphology of Phase VI plant; A2: internal structure of Phase I plant; B2: internal structure of Phase II plant; C2: internal structure of Phase III plant; D2: internal structure of Phase IV plant; E2: internal structure of Phase V plant; F2: internal structure of Phase VI plant; GP: growing point; FP: flower primordial; SE: sepal; PE: Petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen. GP: growing point; FP: flower primordial; SE: sepal; PE: petal; PP: pistil primordial; SP: stamen primordial; PI: pistil; ST: stamen.前分化期(I):在前分化期,花芽的芽点从木棉枝端或者叶腋处萌发,从外部形态看与叶芽无明显区别(图1A1),从石蜡切片来看,未出现凸起的生长锥(图1A2)。
花原基分化期(II):十月上旬木棉进入花芽的形态分化期。花芽开始分化,此时从外部形态来看枝端生长点无明显凸起,表面有即将脱落叶片组织覆被(图1B1)。切片显示出现凸起的生长锥,生长锥所在横径增宽,生长锥附近的细胞排列紧密,生长速度快(图1B2)。
萼片原基分化期(III):十月中旬,采集的植物样品从外部可观察到类似芽或茎尖组织样的形态(图1C1)。切片显示生长锥继续增宽,且在生长锥附近(两侧)会出现2个明显的凸起(图1C2),即萼片原基。凸起组织细胞密度大且生长迅速,逐渐向上伸长并向中间内部弯曲(图1C2),当萼片原基组织生长弯曲至能够覆盖住生长点时表明花萼分化结束。
花瓣原基分化期(IV):10月下旬,枝端生长点逐渐膨大,出现花苞片,颜色为红褐色(图1 D1)。随着萼片原基的发育,其内侧在生长点附近又出现了新的凸起,即花瓣原基。花瓣原基分化较快,其纵向生长快于横向生长,长大于宽,最后形成花瓣(图1D2)。
雌雄蕊原基分化期(V):在11月中上旬,木棉枝端进一步膨大,形状为尖圆,红褐色变淡,木棉进入花器官原基分化期(图1E1)。在花瓣原基发育完成的后期,雌雄蕊原基开始出现。雌雄蕊原基分化的形成分为前期和后期。在雌雄蕊原基分化的前期,生长点向上继续生长,并且在生长点的两侧出现了小的凸起。在雌雄蕊原基分化的后期,生长点的纵向生长不明显,四周的凸起增多。中间比较大的为雌蕊原基,四周小而多的为雌蕊原基,后期明显形成了多层雄蕊围绕着雌蕊生长。雌雄蕊原基形成后,花芽分化过程完成,进入花器官发育阶段(图1E2)。
雌雄蕊形成期(VI):11月下旬开始,木棉花芽继续膨大,形状变化为钝圆,花苞逐渐变绿,进入雌雄蕊成熟期(图1F1)。在这一阶段花柱继续伸长,雄蕊及花药也在不断发育。木棉花芽雌、雄蕊成熟所需时间较长,次年的3月才会发育成熟(图1F2)。
2.2 花芽分化过程中内源激素含量的变化
木棉花芽分化过程中,ABA和GA3的含量明显高于IAA和ZR的含量。脱落酸ABA含量整体呈现下降的趋势,但在第III阶段的含量相比第I和第II阶段有轻微上升,但无显著差异(图2A)。随着花芽分化进程的继续,ABA鲜重含量在IV、V、VI阶段持续显著下降(图2A),在花器官形成期降至最低(48.43 ng·g−1),相比第I阶段下降了122.97 ng·g−1(图2A)。
赤霉素GA3鲜重含量总体也呈现下降趋势,第II和III阶段相比第I阶段有显著下降(图2B),在第IV阶段继续显著下降,在第V阶段时有回升,但与第II和III阶段相比无显著变化(图2B)。随后在最后VI阶段又显著下降至最低(29.66 ng·g−1),相比第I阶段下降了133.47 ng·g−1(图2B)。
生长素IAA含量在木棉花芽分化过程中呈现先下降后上升再下降的变化趋势,从第I阶段到第III阶段IAA含量持续显著下降(图2C)。第V阶段IAA含量有回升,但相比第I阶段仍有差距(图2C)。在接下来的分化过程中,IAA含量继续下降,但第V和VI阶段的含量与第III阶段相比无显著差异。IAA含量在第I阶段前分化期最高(79.12 ng·g−1),在第III阶段萼片原基分化期最低(26.97 ng·g−1)。
ZR含量在木棉花芽分化前期呈上升趋势,而后下降(图2D),从花原基分化开始到花瓣原基分化含量逐渐上升,第IV阶段花瓣原基分化期达到最高,随后ZR含量开始显著下降(图2D),在花器官形成期降至最低(13.06 ng·g−1)。
2.3 木棉花芽分化过程中内源激素比值的变化
木棉花芽分化过程中ABA/GA3比值呈现“上升-下降-上升”的变化趋势,从第I阶段到第IV阶段花瓣原基分化期上升,在第V阶段雌雄蕊分化期显著下降,而雌雄蕊形成期又出现显著回升(图3A)。GA3/IAA比值花芽分化过程中整体呈下降趋势,但在第III阶段萼片原基分化期和第V阶段雌雄蕊分化期显著上升,在雌雄蕊形成期达到最低值(图3B)。ZR/GA3比值整体呈升高趋势,但中间有波动。从第I阶段前分化期到第IV阶段花瓣原基分化阶段持续显著上升(图3C),但在第V阶段雌雄蕊分化期出现回落,第VI阶段又显著上升(图3C)。ZR/IAA比值在花芽分化过程中先上升后下降,第I阶段前分化期到第III阶段萼片原基分化期持续上升(图3D),在第III阶段的萼片原基分化期达到最大,随后逐渐下降(图3D)。
(GA3+ZR+IAA)/ABA比值在分化过程中呈现“下降-上升-下降”的变化趋势(图3E),从第I阶段前分化期到第III阶段萼片原基分化期逐渐下降(图3E),到第V阶段雌雄蕊分化期达最大值,随后在第VI阶段雌雄蕊形成期又出现显著下降(图3E)。(ZR+IAA)/GA3总体呈上升趋势,第II、IV、VI阶段的比值相比第I阶段均有显著增加,但在第III阶段萼片原基分化期和第V阶段雌雄蕊分化期出现显著下降(图3F)。
3. 讨论与结论
3.1 木棉花芽分化形态结构变化
花芽分化是一个比营养器官分化更为复杂的过程,在植物的开花结果的发育进程中起着至关重要的作用[16]。明确花芽分化的时期,了解木棉花芽分化的全过程,不仅可以为掌握木棉生物学特性提供基础资料,也可以为木棉引种栽培、花期调控提供理论依据[17]。对于不同植物,花芽分化的时期划分会存在一定差异[18]。美丽异木棉(Ceiba speciosa)的花芽分化被分为前分化期、萼片分化期、花瓣形成期、雄蕊附属物及子房形成期、雌雄蕊形成期、胚珠形成期6个时期[19],这与本研究的木棉的花芽分化时期存在区别,但也有着一定的重叠。枣(Ziziphusjujuba Mill.)的花芽分化进程则被分为未分化期、分化初期、萼片分化期、花瓣分化期、雄蕊分化期和雌蕊分化期[20]。目前对于木棉花芽分化的研究还未见报道。本研究按照各原基出现的先后顺序,并参考其他物种的研究结果,将木棉的花芽分化分为前分化期、花原基分化期、萼片原基分化期、花瓣原基分化期、雌雄蕊原基分化期以及雌雄蕊形成期。
3.2 内源激素含量变化与木棉花芽分化的关系
GA3是一种重要的植物激素,可促进植物节间伸长、萌发,对花和果实的发育也起到了重要的调控作用[21]。有研究认为GA3参与植物的成花调控,在植物的花芽分化进程中表现为高水平抑制,反之低浓度则能够促进花芽分化。本研究中GA3在木棉花芽中含量相较IAA和ZR更高,且随着花芽分化的进程推进总体持续降低,其含量变化与花芽分化过程呈现负相关,表明低水平GA3有利于诱导木棉花芽的形成,这与墨兰[Cymbidium sinense(Jackson ex Andr.)Willd.][22]和广西盾翅藤(Aspidopterys concava)[3]花芽分化过程中GA3含量变化趋势相似,说明在花芽分化前期提高GA3含量可能可以抑制木棉花芽的分化,从而影响其后续的开花及结果过程。
IAA既可以促进植物生长、促进植物器官的建成,也具有抑制植物生长的作用[23]。易仁知等[24]研究认为IAA含量高有利于花芽分化;张宁等[25]、宋杨等[26]则认为低浓度IAA有利于花芽分化。在本研究中,木棉花芽中IAA含量在木棉花芽分化进程中整体呈现下降趋势,但在分化IV期出现较显著的回升,相关原因还需进一步研究。但本研究的结果表明低水平的IAA水平可能有利于木棉花芽分化。
脱落酸(ABA)具有引起芽的休眠、促进叶片的脱落和抑制细胞生长等生理作用。ABA在花芽分化中起到的作用一直存在争议。赵志珩等[27]在对板栗的研究中发现,高水平ABA促进休眠,低水平ABA有利于花芽分化的启动;马亮等[28]在对不同陆地棉品种的研究中发现,在花芽分化过程中,随着生长发育的进行,ABA含量逐渐增高,高浓度的ABA有利于花芽分化。本研究中,木棉分化的前3个阶段(I~III)花芽中ABA含量无显著变化,但从花瓣原基分化阶段(IV)开始,ABA开始显著持续下降,与后续花芽分化过程呈明显负相关。说明对木棉而言,低水平的ABA有利于木棉花瓣原基及后续雄蕊和雌蕊的分化。这个结果也表明,在木棉花芽花瓣原基分化时期提高ABA含量可能可以抑制木棉花芽的后续分化,从而影响其开花及结果过程。
ZR能促进细胞分裂,还能起到促进细胞分化和形态建成以及推迟衰老等作用。前人在对黄花美冠兰(Eulophia flava)[29]和小叶丁香(Syringa microphylla)[30]的研究中发现较高的ZR水平有利于花芽分化进程的完成;艾星梅等[31]研究结果表明在马铃薯(Solanum tuberosum)花芽分化进程中,ZR含量高既有利于其成花诱导,也能促进花原基形态的建成。本研究中,ZR含量在木棉花芽分化过程中先上升后下降,表明高浓度的ZR可能有利于木棉花芽分化中期器官原基(萼片原基和花瓣原基)的分化,这与在小叶丁香[30]中的研究结果一致,但在花芽分化的整个进程中未表现出明显的相关性。
木棉花芽分化过程中,GA3和ABA的含量相比IAA和ZR更高,且与花芽分化过程呈现明显负相关关系,在花芽分化前期提高GA3水平,或花瓣原基分化期提高ABA水平可能可以起到抑制花芽分化的作用,从而抑制后期木棉的开花和结果进程。
3.3 内源激素平衡与木棉花芽分化的关系
植物花芽分化过程不仅仅受单一激素含量变化的影响,与各内源激素之间的相互调节与平衡也是息息相关的,各种激素的相互作用也能对花芽分化起到促进作用[32]。大樱桃(Prunus avium L.)[33]花芽在孕育过程中ABA/GA3、ZR/GA3、ZR/IAA值增大,促进了芽体由营养生长转向生殖生长。枣(Ziziphus jujuba Mill.)[20]花芽分化发育过程中较高的ABA/GA3值能有效促进花芽孕育及其后续的发育;低水平的IAA/GA3则可提高花芽的形成效率。本研究中, ABA/GA3、ZR/GA3、(ZR+IAA)/GA3比值在木棉花芽分化过程中波动上升,与GA3含量在花芽分化过程中持续下降的结果相对应。此结果与其在广西盾翅藤(Aspidopterys concava)[3]花芽分化中的变化规律一致,说明该比值升高有利于木棉花芽的膨大与花器官的分化。 GA3/IAA和ZR/IAA比值在中期达到较高水平,表明GA3/IAA和ZR/IAA比值增高有利于木棉花芽器官原基的分化,但其比值变化在花芽分化过程中无明显上升或下降趋势,无显著规律性。(GA3+IAA+ZR)/ABA比值的变化表现为先下降后上升又下降的趋势,可能是由于GA3和ABA含量在此过程中均下降,而ZR含量则先上升后下降,这种变化趋势与花芽分化过程也未表现出明显的规律性。
ZR/GA3、(ZR+IAA)/GA3在木棉花芽分化过程中整体呈现波动上升的变化趋势,其他不同激素的比值在木棉花芽分化过程中未表现明显规律性,说明木棉不同的分化时期对各激素的要求各异,相比多激素水平的调节,单一激素含量的调控可能在实践中更可行。
-
表 1 qRT-PCR引物序列
Table 1 Primers designed for qRT-PCR
基因
Gene方向
Direction引物序列
Primer sequence(5′-3′)大小
Size/bpTM值
TM value抗病反应蛋白 Disease resistance response protein F TTCGCGACGAAAGGTAAAACGA 105 55 R CACCCACAGGATGGACCAGAGG 抗病蛋白RGA2 Disease resistance protein RGA2 F CGGTTCAGAAGGGAGCCTATTGT 199 53.3 R AAACTCTTATACCTTTGGGGGGC 乙烯受体2 Ethylene receptor 2 F TCCCTTTTGACCTTGTTCTTTTG 137 52 R TACATTCTCCCGTGTACTTGCAG 过氧化氢酶1 Catalase 1 F CAGTGTCAAGACACGGTCGCATG 198 53.8 R CTAGTAACCGCTAGGGCCGTTGG 蔗糖合成酶 Sucrose synthase F GCCCCGTCTTATTCATACCCTCG 173 54.6 R CATGCTTTTCCCATTTTGTCCTCA 抗病蛋白RPS5 Disease resistance protein RPS5 F GTCCCAACTTATCCGTCATTTCT 168 51.4 R TAAAGGAGCTGCCACTCACAGTC 抗病蛋白 Disease resistance protein F TGTGTCTCCCTCCAGTGCTCA 145 53.6 R TTTCTCGCCCCCCCTGTTCA 类烟草病毒增殖蛋白3 Tobamovirus multiplication protein 3-like F GGTGTCTCGTTGTTTGCTGCTC 103 52.1 R GTTTCTTGCGTCGCCCTTTC 植物抗病反应蛋白 Plant disease resistance response protein F TGCCCTGAGCGTTCCCTAC 178 58.3 R ACCCGCCTCCACTTCTTCC F-box家族蛋白 F-box family protein F CGCCAAGAGGGAAATGAAACC 195 58.5 R CGGGAACATGGAGCAGTGGTA 超氧化物歧化酶[Cu-Zn] Superoxide dismutase [Cu-Zn] F CTGAGGCAACGATTGTGGATA 130 53.2 R CCCGTGCTAAGGCTAAGTTCAT 逆转录病毒相关Pol多聚蛋白系-1
Retrovirus-related Pol polyprotein line-1F CCCTTCTTTGTTAATGCCCACCA 156 49.9 R CGTCCTTAATGCACGGAAGCA 转座子RE1的逆转录病毒相关Pol多蛋白
Retrovirus-related Pol polyprotein from transposon RE1F GTCCAGATTGAAGTCGCTCCC 117 53.5 R CCTTGTACTGTGACAACAATGCC 转座子TNT逆转录病毒相关Pol多蛋白
Retrovirus-related Pol polyprotein from transposon TNTF GATAGACCATCAGGCACTTTAGG 151 48.5 R CTAAGTCATTCTTGGGACACTGTAA BZIP转录因子家族蛋白 BZIP transcription factor family protein F CATCGCCGAGCACTTGCACCGTCTC 95 55.6 R GCTTCTGGCATCTTTACCACTTTC 过氧化物酶 Peroxidase F CCAACTCCCAGGACTTCTTCTTCC 136 57.9 R CTGGCTGGCTAGTGGTGCTTGTT 脱落酸受体PYR1 Abscisic acid receptor PYR1 F CTCCATTTCGCCCTGATTCCATT 139 54.6 R TCAAACATCCCTTTCACCATTCCTAT 抗病蛋白RPS2 Disease resistance protein RPS2 F ATCCATTCCTTGCCAGATGAC 115 53.4 R ACCTTATTAACCGCAGCACCA 生长素反应因子1 Auxin response factor 1 F CTTTCACGCCCAATCGACCAC 169 57.6 R TCGGCTTCTTGCTTTCTGCTGTC 烟草病毒增殖蛋白1 Tobamovirus multiplication protein 1 F CTGTGGGAAGACTTCTTGCCTGAT 108 50.9 R TCGCTTTGGTATTATTGGACCTG 甘油醛-3-磷酸脱氢酶 GAPDH (内参 Reference gene) F ATCAAGCCCTCAACAATGCCAAA 179 54.8 R GCCAAGAAGGTCGTCATCTCAGC 表 2 V组和VF组测序数据统计
Table 2 Statistical sequencing data on V and VF plantlets
样本 Sample 带毒苗 V 脱毒苗 VF 原始序列
Raw reads47 418 842 43 025 444 原始总碱基数
Raw bases7 160 245 142 6 496 842 044 过滤后序列
Clean reads46 818 060 42 406 188 质控后总碱基数
Clean bases6 964 653 736 6 305 931 529 测序错误率
Error rate/%0.023 1 0.024 6 大于20的碱基数占总碱基的百分比
Q20/%98.83 98.26 大于30的碱基数占总碱基的百分比
Q30/%96.08 94.50 G、C碱基的总数量占总碱基数量的百分比
GC content/%50.36 54.09 表 3 测序数据与组装结果比对统计
Table 3 Comparison on sequencing data and assembly results
样本
Sample过滤后测序
数据的条数
Clean reads能比对到组装
转录本上的
Clean reads数
Mapped reads能定位到组装转
录本上的Clean
reads所占百分比
Mapped ratio/%脱毒苗VF 42 406 188 34 683 956 81.79 带毒苗V 46 818 060 38 036 872 81.24 表 4 VF组和V组表达量差异统计(前10)
Table 4 Top 10 statistical expression differences between VF and V plantlets
基因编号
Gene_ID差异表达倍数
FC(VF/V)差异表达倍数
以2为底的
对数值
log2FC
(VF/V)P值
P value矫正后 P值
P adjust显著性
Significance调节
Regulate带毒苗
表达量
Expression
in V脱毒苗
表达量
Expression
in VFNR描述
NR
descriptionTRINITY_DN56_c0_g1 5.15×10−6 −17.57 5.30×10−41 1.65×10−36 是 Yes 下调
Down33445.52 0.12 假设蛋白质
Hypothetical proteinTRINITY_DN56_c1_g1 5.39×10−6 −17.50 8.29×10−41 1.65×10−36 是 Yes 下调
Down2710.44 0.01 假设蛋白质
MIMGU_mgv1a026582mg,
hypothetical protein
MIMGU_mgv1a026582mgTRINITY_DN388_c0_g1 1.36×10−5 −16.16 4.43×10−40 5.88×10−36 是 Yes 下调
Down37524.60 0.40 假设蛋白质
Hypothetical proteinTRINITY_DN56_c0_g2 2.62×10−5 −15.22 7.54×10−40 7.52×10−36 是Yes 下调
Down24571.29 0.53 假设蛋白质
Hypothetical proteinTRINITY_DN1368_c0_g1 2.82×10−5 −15.11 8.27×10−39 6.59×10−35 是 Yes 下调
Down16978.15 0.39 未注释 No TRINITY_DN863_c0_g2 2.14×10−5 −15.51 4.02×10−38 2.67×10−34 是 Yes 下调
Down2861.27 0.05 假设蛋白质
MIMGU_mgv1a026582mg hypothetical protein MIMGU_mgv1a026582mgTRINITY_DN1333_c0_g1 2.42×10−5 −15.33 1.41×10−37 8.01×10−34 是 Yes 下调
Down8296.82 0.16 未注释 No TRINITY_DN893_c0_g2 2.93×10−6 −18.38 3.72×10−35 1.86×10−31 是 Yes 下调
Down11335.30 0.00 假设蛋白质
Hypothetical proteinTRINITY_DN4426_c0_g1 8.51×10−5 −13.52 7.01×10−35 3.11×10−31 是 Yes 下调
Down31665.60 4.91 假设蛋白质
Hypothetical proteinTRINITY_DN6139_c0_g1 6.48×10−5 −13.91 4.83×10−34 1.93×10−30 是 Yes 下调
Down17471.00 0.87 外壳蛋白
Coat protein表 5 部分差异表达基因GO富集结果
Table 5 GO enrichment results of some differentially expressed genes
富集到该GO term的基因
转录本数目
Number of genes enriched to the GO termGO Term对应
的编号
ID Corresponding
to Go termGO三大分类
Three categories
of GOGO功能描述
Go function description该GO在目
标基因集中
占有的比例
The proportion of the GO in the target gene set/%该GO在背景基因转录本中占有的比例
The proportion of the GO in the background gene/%未经校正
的P值
P value
uncorrected校正后
的P值
P value
corrected37 GO:0042744 生物过程 BP 过氧化氢分解过程
Hydrogen peroxide catabolic process0.62 0.35 0.00 0.00 37 GO:0042743 生物过程 BP 过氧化氢代谢过程
Hydrogen peroxide metabolic process0.62 0.35 0.00 0.00 65 GO:0072330 生物过程 BP 一元羧酸生物合成工艺
Monocarboxylic acid biosynthetic process1.09 0.75 0.00 0.02 48 GO:0000272 生物过程 BP 多糖分解代谢过程
Polysaccharide catabolic process0.80 0.54 0.00 0.04 54 GO:0030001 生物过程 BP 金属离子输运
Metal ion transport0.91 0.62 0.00 0.04 128 GO:0005576 细胞组分 CC 细胞外区
Extracellular region2.15 1.45 0.00 0.00 73 GO:0005618 细胞组分 CC 细胞壁 Cell wall 1.23 0.82 0.00 0.00 73 GO:0030312 细胞组分 CC 外部封装结构
External encapsulating structure1.23 0.82 0.00 0.00 2136 GO:0031224 细胞组分 CC 膜的固有成分
Intrinsic component of membrane35.88 34.47 0.00 0.15 37 GO:0031226 细胞组分 CC 质膜固有成分
Intrinsic component of plasma membrane0.62 0.43 0.00 0.18 209 GO:0001071 分子功能 MF 核酸结合转录因子活性
Nucleic acid binding transcription factor activity3.51 2.48 0.00 0.00 209 GO:0003700 分子功能 MF 序列特异性DNA结合转录因子活性
Transcription factor activity, sequence-specific DNA binding3.51 0.48 0.00 0.00 118 GO:0004497 分子功能 MF 单加氧酶活性
Monooxygenase activity1.98 1.27 0.00 0.00 137 GO:0005506 分子功能 MF 铁离子结合
Iron ion binding2.30 1.54 0.00 0.00 147 GO:0020037 分子功能 MF 血红素结合
Heme binding2.47 1.69 0.00 0.00 表 6 差异表达基因KEGG富集部分分析
Table 6 Partial results of analysis on KEGG enrichment of differentially expressed genes
基因数目
Gene number通路编号
Pathway ID描述
Description该KEGG在目标基因
集中占有的比例
The proportionof KEGG in
target gene concentration/%该KEGG在背景中
占有的比例
The proportion of the
KEGG in the background/%未经校正的P值
P value uncorrected校正后的P值
P value corrected78 map00940 苯丙酸生物合成
Phenylpropanoid biosynthesis2.71 1.36 0.00 0.00 26 map00941 类黄酮生物合成
Flavonoid biosynthesis0.90 0.38 0.00 0.00 17 map00945 二苯乙烯类、二芳基庚烷类和姜辣素的生物合成
Stilbenoid, diarylheptanoid and gingerol biosynthesis0.59 0.26 0.00 0.00 71 map04016 MAPK信号通路-植物
MAPK signaling pathway-plant2.47 1.67 0.00 0.00 63 map00500 淀粉和蔗糖代谢
Starch and sucrose metabolism2.19 1.52 0.00 0.01 26 map00350 酪氨酸代谢
Tyrosine metabolism0.90 0.52 0.00 0.01 92 map04075 植物激素信号转导
Plant hormone signal transduction3.20 2.42 0.00 0.01 26 map00040 戊糖和葡萄糖醛酸的相互转化
Pentose and glucuronate interconversions0.90 0.53 0.00 0.01 39 map04146 过氧化物酶体
Peroxisome1.36 0.88 0.00 0.01 28 map00592 α-亚麻酸代谢
alpha-Linolenic acid metabolism0.97 0.60 0.00 0.02 20 map00360 苯丙氨酸代谢
Phenylalanine metabolism0.69 0.40 0.00 0.03 24 map00460 氰胺酸代谢
Cyanoamino acid metabolism0.83 0.50 0.00 0.03 16 map00906 类胡萝卜素生物合成
Carotenoid biosynthesis0.56 0.31 0.00 0.05 16 map00950 异喹啉生物碱的生物合成
Isoquinoline alkaloid biosynthesis0.56 0.31 0.00 0.04 23 map00130 泛醌和其他萜类醌的生物合
Ubiquinone and other terpenoid-quinone biosynthesis0.80 0.50 0.00 0.05 32 map00260 甘氨酸、丝氨酸和苏氨酸代谢
Glycine, serine and threonine metabolism1.11 0.78 0.00 0.06 23 map04712 植物昼夜节律
Circadian rhythm-plant0.80 0.52 0.00 0.06 28 map00051 果糖和甘露糖代谢
Fructose and mannose metabolism0.97 0.65 0.00 0.07 22 map00052 半乳糖代谢
Galactose metabolism0.76 0.50 0.01 0.10 50 map00520 氨基糖和核苷酸糖代谢
Amino sugar and nucleotide sugar metabolism1.74 1.34 0.01 0.10 表 7 20个差异表达基因qRT-PCR的RQ值
Table 7 RQ values of qRT-PCR for 20 differentially expressed genes
基因
Gene正常种
RQ值
RQ value in CK平原种植
退化种 RQ值
RQ value in BZ调节
RegulationRNA-seq调节
Regulation in
RNA-seq抗病反应蛋白 Disease resistance response protein 1.00 b 216.68 a 上调 Up 上调 Up 抗病蛋白 RGA2 Disease resistance protein RGA2 1.00 b 6.29 a 上调 Up 上调 Up 乙烯受体2 Ethylene receptor 2 1.00 a 0.48 b 下调 Down 下调 Down 过氧化氢酶1 Catalase 1 1.00 b 8.23 a 上调 Up 上调 Up 蔗糖合成酶 Sucrose synthase 1.00 b 10.50 a 上调 Up 上调 Up 抗病蛋白 RPS5 Disease resistance protein RPS5 1.00 b 10.02 a 上调 Up 上调 Up 抗病蛋白 Disease resistance protein 1.00 b 10.04 a 上调 Up 上调 Up 类烟草病毒增殖蛋白3 Tobamovirus multiplication protein 3-like 1.00 a 0.78 b 下调 Down 下调 Down 植物抗病反应蛋白 Plant disease resistance response protein 1.00 b 10.01 a 上调 Up 上调 Up F-box家族蛋白 F-box family protein 1.00 b 7.815577 a 上调 Up 上调 Up 超氧化物歧化酶 [Cu-Zn] Superoxide dismutase [Cu-Zn] 1.00 b 9.217215 a 上调 Up 上调 Up 逆转录病毒相关 Pol多聚蛋白系-1 Retrovirus-related Pol polyprotein LINE-1 1.00 a 0.13 b 下调 Down 下调 Down 转座子 RE1的逆转录病毒相关 Pol多蛋白 Retrovirus-related Pol polyprotein from transposon RE1 1.00 a 0.01 b 下调 Down 下调 Down 转座子 TNT逆转录病毒相关 Pol多蛋白 Retrovirus-related Pol polyprotein from transposon TNT 1.00 a 0.06 b 下调 Down 下调 Down BZIP转录因子家族蛋白 BZIP transcription factor family protein 1.00 a 0.46 b 下调 Down 下调 Down 过氧化物酶 Peroxidase 1.00 b 16.00 a 上调 Up 上调 Up 脱落酸受体 PYR1 Abscisic acid receptor PYR1 1.00 a 0.25 b 下调 Down 下调 Down 抗病蛋白 RPS2 Disease resistance protein RPS2 1.00 b 5.40 a 上调 Up 上调 Up 生长素反应因子1 Auxin response factor 1 1.00 a 0.50 b 下调 Down 下调 Down 烟草病毒增殖蛋白1 Tobamovirus multiplication protein 1 1.00 a 0.49 b 下调 Down 下调 Down 甘油醛-3-磷酸脱氢酶 GAPDH 1.00 a 1.00 a - - 注:同行数据后不同小写字母表示显著性差异(P<0.05)。
Note: Different lowercase letters in each line indicate significant difference at 0.05 level. -
[1] 余志平, 林海红, 余俊红, 等. 铅山红芽芋产业发展概况 [J]. 长江蔬菜, 2016(20):34−36. DOI: 10.3865/j.issn.1001-3547.2016.20.015 YU Z P, LIN H H, YU J H, et al. Development of red bud taro industry in Yanshan [J]. Journal of Changjiang Vegetables, 2016(20): 34−36.(in Chinese) DOI: 10.3865/j.issn.1001-3547.2016.20.015
[2] 姜绍通, 程元珍, 郑志, 等. 红芽芋营养成分分析及评价 [J]. 食品科学, 2012, 33(11):269−272. JIANG S T, CHENG Y Z, ZHENG Z, et al. Analysis and evaluation of nutritional components of red bud taro (Colocasia esulenla L. Schott) [J]. Food Science, 2012, 33(11): 269−272.(in Chinese)
[3] 山娜, 杨文俊, 李斌. 举全县之力, 打造铅山红芽芋支柱产业 [J]. 长江蔬菜, 2016(4):9−10. DOI: 10.3865/j.issn.1001-3547.2016.04.005 SHAN N, YANG W J, LI B. Take the efforts of the whole county to build the pillar industry of red bud taro [J]. Journal of Changjiang Vegetables, 2016(4): 9−10.(in Chinese) DOI: 10.3865/j.issn.1001-3547.2016.04.005
[4] 李火金. 铅山红芽芋茎尖脱毒组培繁育及高产栽培 [J]. 中国蔬菜, 2012(2):45−46. LI H J. Virus free tissue culture and high yield cultivation of the shoot tips of the red bud taro [J]. China Vegetables, 2012(2): 45−46.(in Chinese)
[5] 江芹, 廖华俊, 董玲, 等. 红芽芋的丛生芽诱导和再生体系建立 [J]. 分子植物育种, 2015, 13(3):675−679. JIANG Q, LIAO H J, DONG L, et al. Induction of multiple shoot and establishment of regeneration system in Clocasia escalenta schott [J]. Molecular Plant Breeding, 2015, 13(3): 675−679.(in Chinese)
[6] 邓接楼, 曹昊玮, 李玲, 等. 脱毒红芽芋试管芋盆栽种植的农艺性状分析 [J]. 分子植物育种, 2019, 17(22):7500−7506. DENG J L, CAO H W, LI L, et al. Analysis on agronomic traits of virus-free test-tube taro planted in pots [J]. Molecular Plant Breeding, 2019, 17(22): 7500−7506.(in Chinese)
[7] 胡国君, 董雅凤, 张尊平, 等. 植物类病毒脱除技术进展 [J]. 植物保护学报, 2017, 44(2):177−184. HU G J, DONG Y F, ZHANG Z P, et al. Progress in plant viroid elimination techniques [J]. Acta Phytophylacica Sinica, 2017, 44(2): 177−184.(in Chinese)
[8] YANG X X, POPOVA E, SHUKLA M R, et al. Root cryopreservation to biobank medicinal plants: A case study for Hypericum perforatum L [J]. In Vitro Cellular & Developmental Biology-Plant, 2019, 55(4): 392−402.
[9] KULUS D, REWERS M, SEROCKA M, et al. Cryopreservation by encapsulation-dehydration affects the vegetative growth of Chrysanthemum but does not disturb its chimeric structure [J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2019, 138(1): 153−166. DOI: 10.1007/s11240-019-01614-6
[10] LI W B, HARTUNG J S, LEVY L. Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with Citrus huanglongbing [J]. Journal of Microbiological Methods, 2006, 66(1): 104−115. DOI: 10.1016/j.mimet.2005.10.018
[11] WANG Q C, VALKONEN J P T. Cryotherapy of shoot tips: Novel pathogen eradication method [J]. Trends in Plant Science, 2009, 14(3): 119−122. DOI: 10.1016/j.tplants.2008.11.010
[12] HELLIOT B, PANIS B, POUMAY Y, et al. Cryopreservation for the elimination of cucumber mosaic and banana streak viruses from banana (Musa spp.) [J]. Plant Cell Reports, 2002, 20(12): 1117−1122. DOI: 10.1007/s00299-002-0458-8
[13] 李涵, 陆琳, 瞿素萍, 等. 杂交兰种苗超低温脱毒技术研究 [J]. 中国农业科技导报, 2018, 20(1):147−153. LI H, LU L, QU S P, et al. Study of hybrid orchid seedlings on virus elimination using cryopreservation technology [J]. Journal of Agricultural Science and Technology, 2018, 20(1): 147−153.(in Chinese)
[14] 李艳林, 渠慎春, 栾雨婷, 等. 苹果茎尖超低温脱毒体系的建立 [J]. 分子植物育种, 2019, 17(9):2982−2995. LI Y L, QU S C, LUAN Y T, et al. Establishment of cryopreservation detoxification system of apple shoot-tips [J]. Molecular Plant Breeding, 2019, 17(9): 2982−2995.(in Chinese)
[15] 周金鑫, 胡新文, 张海文, 等. ABA在生物胁迫应答中的调控作用 [J]. 农业生物技术学报, 2008, 16(1):169−174. DOI: 10.3969/j.issn.1674-7968.2008.01.032 ZHOU J X, HU X W, ZHANG H W, et al. Regulatory role of ABA in plant response to biotic stresses [J]. Journal of Agricultural Biotechnology, 2008, 16(1): 169−174.(in Chinese) DOI: 10.3969/j.issn.1674-7968.2008.01.032
[16] XANTHOPOULOU A, GANOPOULOS I, PSOMOPOULOS F, et al. De novo comparative transcriptome analysis of genes involved in fruit morphology of pumpkin cultivars with extreme size difference and development of EST-SSR markers [J]. Gene, 2017, 622: 50−66. DOI: 10.1016/j.gene.2017.04.035
[17] UNAMBA C I N, NAG A, SHARMA R K. Next generation sequencing technologies: The doorway to the unexplored genomics of non-model plants [J]. Frontiers in Plant Science, 2015, 6: 1074.
[18] COSTA V, ANGELINI C, DE FEIS I, et al. Uncovering the complexity of transcriptomes with RNA-seq [J]. Journal of Biomedicine and Biotechnology, 2010, 2010: 1−19.
[19] WANG Z, GERSTEIN M, SNYDER M. RNA-Seq: a revolutionary tool for transcriptomics [J]. Nature Reviews Genetics, 2009, 10(1): 57−63. DOI: 10.1038/nrg2484
[20] VIEIRA R L, SILVA A L, ZAFFARI G R, et al. Efficient elimination of virus complex from garlic (Allium sativum L.) by cryotherapy of shoot tips [J]. Acta Physiologiae Plantarum, 2014, 37(1): 1−11.
[21] WANG B, WANG R R, CUI Z H, et al. Potential applications of cryogenic technologies to plant genetic improvement and pathogen eradication [J]. Biotechnology Advances, 2014, 32(3): 583−595. DOI: 10.1016/j.biotechadv.2014.03.003
[22] WANG Q C, PANIS B, ENGELMANN F, et al. Cryotherapy of shoot tips: A technique for pathogen eradication to produce healthy planting materials and prepare healthy plant genetic resources for cryopreservation [J]. Annals of Applied Biology, 2009, 154(3): 351−363. DOI: 10.1111/j.1744-7348.2008.00308.x
[23] 何广深. 百子莲胚性愈伤组织超低温保存中钙离子的分布变化及逆境应答机制初探 [D]. 上海: 上海交通大学, 2014. HE G S. Distribution change of Ca2+ and stress response mechanism research of Agapanthus praecox embryogenic callus during cryopreservation [D]. Shanghai: Shanghai Jiaotong University, 2014.(in Chinese)
[24] 滕进婧, 李梦芸, 郭纯, 等. 冷冻胁迫转金柑MLP2-1基因拟南芥的转录组测序和代谢通路 [J]. 湖南农业大学学报(自然科学版), 2018, 44(4):376−381. TENG J J, LI M Y, GUO C, et al. Transcriptome sequencing and metabolic pathway analysis of transgenic MLP2-1 gene in Arabidopsis under cold stress [J]. Journal of Hunan Agricultural University (Natural Sciences Edition), 2018, 44(4): 376−381.(in Chinese)
[25] 苏谦, 安冬, 王库. 植物激素的受体和诱导基因 [J]. 植物生理学通讯, 2008, 44(6):1202−1208. SU Q, AN D, WANG K. Phytohormone receptors and induced genes in plants [J]. Plant Physiology Communications, 2008, 44(6): 1202−1208.(in Chinese)
[26] OHRI P, BHARDWAJ R, BALI S G, et al. The common molecular players in plant hormone crosstalk and signaling [J]. Current Protein & Peptide Science, 2015, 16(5): 369−388.
[27] 杨家书, 吴畏, 吴友三, 等. 植物苯丙酸类代谢与小麦对白粉病抗性的关系 [J]. 植物病理学报, 1986, 16(3):169−174. YANG J S, WU W, WU Y S, et al. Relation of metabolism of plant phenylalanine and resistance of wheat to powdery mildew [J]. Acta Phytopathologica Sinica, 1986, 16(3): 169−174.(in Chinese)
[28] 陈建中, 盛炳成, 刘克均. 苯丙酸类代谢与苹果对轮纹病抗性的关系 [J]. 果树科学, 1986, 16(3):169−174. CHEN J Z, SHENG B C, LIU K J, et al. The relation between metabolism of phenylalanine and resistance to Physalospora piricola Nose in apple trees [J]. Acta Phytopathologica Sinica, 1986, 16(3): 169−174.(in Chinese)
[29] DUAN P G, RAO Y C, ZENG D L, et al. SMALL GRAIN 1, which encodes a mitogen-activated protein kinase kinase 4, influences grain size in rice [J]. The Plant Journal, 2014, 77(4): 547−557. DOI: 10.1111/tpj.12405
[30] LIU S Y, HUA L, DONG S J, et al. OsMAPK6, a mitogen-activated protein kinase, influences rice grain size and biomass production [J]. The Plant Journal, 2015, 84(4): 672−681. DOI: 10.1111/tpj.13025
[31] LI Y B, FAN C C, XING Y Z, et al. Natural variation in GS5 plays an important role in regulating grain size and yield in rice [J]. Nature Genetics, 2011, 43(12): 1266. DOI: 10.1038/ng.977
[32] 苑智华, 何秀丽, 徐哲, 等. 唐菖蒲球茎形成期蔗糖和淀粉代谢及其相关酶活性 [J]. 林业科学, 2008, 44(8):47−51. DOI: 10.3321/j.issn:1001-7488.2008.08.008 YUAN Z H, HE X L, XU Z, et al. Metabolism and related enzymes activities of sucrose and starch in the stages of bulb formation of Gladiolus hybridus [J]. Scientia Silvae Sinicae, 2008, 44(8): 47−51.(in Chinese) DOI: 10.3321/j.issn:1001-7488.2008.08.008
[33] 孙红梅, 何玲, 王微微, 等. IBA与GA3调控百合鳞片扦插繁殖的 “淀粉-蔗糖” 代谢机制 [J]. 中国农业科学, 2011, 44(4):798−806. DOI: 10.3864/j.issn.0578-1752.2011.04.018 SUN H M, HE L, WANG W W, et al. Mechanism of starch-sucrose metabolism regulated by IBA as well as GA3 during scale cutting propagation in Lilium [J]. Scientia Agricultura Sinica, 2011, 44(4): 798−806.(in Chinese) DOI: 10.3864/j.issn.0578-1752.2011.04.018
[34] HU J P, BAKER A, BARTEL B, et al. Plant peroxisomes: Biogenesis and function [J]. The Plant Cell, 2012, 24(6): 2279−2303. DOI: 10.1105/tpc.112.096586
[35] SANDALIO L M, RODRÍGUEZ-SERRANO M, ROMERO-PUERTAS M C, et al. Role of peroxisomes as a source of reactive oxygen species (ROS) signaling molecules[C]//Peroxisomes and Their Key Role in Cellular Signaling and Metabolism, 2013: 231-225.
[36] MITTLER R, VANDERAUWERA S, SUZUKI N, et al. ROS signaling: The new wave? [J]. Trends in Plant Science, 2011, 16(6): 300−309. DOI: 10.1016/j.tplants.2011.03.007
[37] 于妍, 宋万坤, 刘春燕, 等. 植物天冬氨酸代谢途径关键酶基因研究进展 [J]. 生物技术通报, 2008(S1):7−11, 17. YU Y, SONG W K, LIU C Y, et al. Research development of key enzymes gene on aspartic acid metabolic pathway in plants [J]. Biotechnology Bulletin, 2008(S1): 7−11, 17.(in Chinese)
[38] 马瑞肖, 张慧杰, 李馨慧, 等. 丝氨酸/甘氨酸代谢在肿瘤中的研究进展 [J]. 现代肿瘤医学, 2020, 28(6):1021−1024. DOI: 10.3969/j.issn.1672-4992.2020.06.033 MA R X, ZHANG H J, LI X H, et al. The progress of serine/Glycine metabolism in tumor [J]. Journal of Modern Oncology, 2020, 28(6): 1021−1024.(in Chinese) DOI: 10.3969/j.issn.1672-4992.2020.06.033





 下载:
下载: