Effects of Red and Blue LED Light at Night on Growth and Leaf Quality of Tea Plants
-
摘要:目的 探索红蓝LED光源补光对贵州茶区春茶产量和品质的影响,为春茶高品质栽培提供理论依据。方法 通过随机区组试验,设夜间不补光(CK)、LED1(红蓝光质比0.81)补光、LED2(红蓝光质比1.65)补光和LED3(红蓝光质比2.10)补光等4种处理,于茶树新梢开始生长时进行不同光源补光处理(21d),研究不同光源补光对春季茶树芽叶生长和品质的影响。结果 不同补光处理均能促进茶树芽叶生长及提高茶叶品质,不同红蓝光质比表现不同,其中以蓝光占比最大的LED1处理(红蓝光质比0.81)的补光效果最好,与不补光(对照)相比,可显著增加单芽和一芽二叶的芽头数量(47.4%和74.89%)、重量(12.36%和41.56%);显著增加一芽一叶和一芽二叶的总叶绿素(25.61%和12.61%)、多酚(23.42%和23.29%)和游离氨基酸含量(32.23%和29.38%),降低酚氨比(-8%和-11.1%)。结论 早春低温弱光环境下的茶园应用红蓝光质比为0.81的LED灯进行补光,可延长茶树光合作用时间,提高光合效率,实现高产优质。Abstract:Objective Effects of red and blue LEDs applied at night in early spring on the growth and tea quality of Qianmei 601 (Camellia sinensis) were studied for the application at plantations in Guizhou.Method Red and blue LEDs at a ratio of 0.81, 1.65 or 2.1 were shone on the tea plants at night for 21 days at a plantation for the experimentation.Result The lighting promoted the bud and leave growth and improved the tea quality. Different red-to-blue light ratios produced different results. The treatment with a 0.81 ratio significantly increased the fresh leaf weight, bud density, total chlorophylls, total polyphenols, and free amino acids in the leaves and decreased the polyphenols/amino acids ratio as compared to control that grew under natural conditions.Conclusion Supplementing light at night with red and blue LEDs at 0.81 ratio on tea plants in early spring when the sunlight and temperature are relatively low appeared beneficial for the biomass buildup and quality improvement.
-
0. 引言
【研究意义】猪轮状病毒(porcine rotavirus, PoRV)属于呼肠孤病毒科(Reoviridae)轮状病毒属(Rotaviruses),基因组由11个双链RNA片段组成,轮状病毒根据VP6基因的核苷酸同源性分为10个群(RVA~RVJ),其中以RVA感染为主[1]。猪A群轮状病毒(porcine rotavirus group A, PoRV A)是引起猪群病毒性腹泻的重要病原体之一[2],主要通过粪口传播,感染的猪群表现为水样稀粪、呕吐等症状,严重者脱水死亡,持续发病可导致猪群严重消瘦[3],解剖病猪可以观察到肠管变薄、肠系淋巴结肿大等病变[4]。猪轮状病毒可感染不同阶段的猪群,并且每只猪可经历一次或多次轮状病毒感染的情况。哺乳仔猪对PoRV病毒特别易感,尤其是不足一周龄的仔猪,不仅最易感染,而且一旦感染,病情也最为严重,其病死率可达100%;相比之下,成年猪感染PoRV时往往表现为无症状的隐性感染[5]。目前,由于PoRV复杂的基因型[1],市场上缺少针对PoRV的特效药,因此建立快速、灵敏、高效的PoRV检测手段,对该病的防治具有重要意义。【前人研究进展】PoRV检测方法主要有病毒分离、免疫荧光、普通PCR等技术。病毒分离技术在研究和防疫检测中发挥着重要作用[6],但是操作技术复杂、消耗成本高、耗时;免疫荧光技术,利用荧光标记的抗体来检测和定位细胞或组织中的特定抗原[7],荧光标记的抗体在长时间的光照下可能会发生荧光淬灭,导致信号减弱,结果判定不准确;普通PCR方法处理样本时间长,结果可能出现假阳性[8]。这些传统方法操作复杂、耗时长等缺点,在检测上具有一定的局限性[9]。【本研究切入点】猪A群轮状病毒的VP6基因适用于多种猪A群轮状病毒亚型的检测[10]。近年来,轮状病毒的高重组率引发了VP6基因在遗传进化上的变化,尽管VP6基因通常被认为高度保守,但已有研究证实该基因也存在基因重组现象[11]。本研究参考了近年来新出现的毒株以及经典毒株的VP6基因片段保守区,设计的TaqMan荧光定量RT-PCR方法既保留了对经典毒株的检测能力,也能有效应对较新的毒株。【拟解决的关键问题】本研究基于猪A群轮状病毒VP6基因,建立适用于PoRV检测及其流行病学调查的TaqMan实时荧光定量PCR检测方法。
1. 材料与方法
1.1 核酸和临床样品
猪轮状病毒(PoRV)、猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)、猪德尔塔冠状病毒(porcine deltacorona virus, PDCoV)、猪传染性胃肠炎病毒(transmissible gastroenteritis of swine, TGEV)核酸,由福建省农业科学院畜牧兽医所猪病研究室保存。疑似PoRV感染的临床样品151份,包括肠道和粪便样品,来源于福建省福州、三明、龙岩、泉州、南平、宁德等地的规模化猪场,−80 ℃保存。
1.2 试剂
SimplyP病毒RNA提取试剂盒(BSC56S1)购自博日科技股份有限公司(杭州);HiScript II One Step RT-PCR Kit试剂盒(P612)购自生物科技股份有限公司(南京);One Step RT-qPCR Probe Kit(BBI,B639278)购自生工生物工程有限公司(上海)。
1.3 引物设计
根据GenBank 中已有的PoRV A VP6基因的序列(登录号MT025937.1、OP978242.1、PP566178.1),并用NCBI BLAST比对选取保守区域,利用Oligo 7和Primer 5设计引物(PoRV-F3、PoRV-R3)及探针(PoRV-Probe)用于TaqMan实时荧光定量RT-PCR体系的建立(表1)。参考Tao等[12]所描述的方法合成针对PoRV VP6基因的特异性引物(PoRV-F2、PoRV-R2),用于逆转录聚合酶链反应(RT-PCR)检测。引物和探针由尚亚生物技术有限公司(福州)合成。
表 1 PoRV引物和探针Table 1. PoRV primers and probes引物/探针
Primer/Probe引物序列(5′-3′)
Sequence(5′-3′)产物大小
Product size/bp用途
UsagePoRV-F1 GGCTTTTAAACGAAGTCTTC 1209 RT-PCR PoRV-R1 GGTCACATCCTCTCACT PoRV-F2 GGCTTTTAAACGAAGTCTTC 598 RT-PCR PoRV-R2 CCAGCTACYTGAATTTCTGA PoRV-F3 ATTAAGTGAGGACTAGGCTAA 114 RT-qPCR PoRV-R3 ACTCTACGTAGCGAGTATGA PoRV-Probe FAM-ATGTAGCTATGTCAAGTCAATCAGA-TAMRA RT-qPCR 1.4 PoRV A阳性质粒构建
利用病毒核酸提取试剂盒(BSC56S1)提取病毒总RNA,使用诺维赞一步法试剂盒(P612)扩增PoRV A VP6基因片段。扩增程序:50 ℃ 30 min,94 ℃ 3 min;94 ℃ 15 s,54 ℃ 30 s,72 ℃ 30 s(35个循环);72 ℃ 7 min。扩增体系:2×One Step Mix 25.0 μL,模板 5.0 μL,One Step Enzyme Mix 2.5 μL,引物PoRV- F1、PoRV- R1(10 μmol·L−1)各2.0 μL,RNase-free ddH2O 添加至 50.0 μL。经琼脂糖凝胶电泳及凝胶成像系统分析,回收纯化PCR产物,连接至pUC57载体。质粒转化至DH5α感受态细胞中,并在LB液体培养基中以37 ℃、180 r·min−1的条件培养,提取转化后感受态细胞中的重组质粒。含有VP6靶向基因序列的阳性质粒通过琼脂糖凝胶电泳与凝胶成像系统分析,并送至尚亚生物技术有限公司(福州)测序证实是否成功构建。
1.5 反应体系的优化
通过测定最低Ct值和最高荧光强度判定优化结果。将引物对(PoRV- F3、PoRV- R3)与探针(PoRV-Probe)分别稀释至1、3、6、9、10 μmol·L−1,以筛选出最优的引物浓度、探针浓度。反应体系根据试剂说明书推荐的一步法反转录荧光定量探针试剂盒20 μL体系,以2.7×104 copies·μL−1拷贝数的阳性质粒为模板,并设置阴性对照。
1.6 标准曲线的绘制
将标准品阳性质粒按10倍倍比稀释,将稀释好的(107~103)浓度质粒作为模板。标准曲线的绘制与计算参考陈秋勇等[13]的方法。
1.7 特异性试验
根据优化后的反应体系进行实时荧光定量RT-PCR扩增,以PEDV、TGEV、PDCoV、PoRV A的RNA为模板,同时设置阴性对照,以评价该检测方法的特异性。
1.8 敏感性试验
将标准品阳性质粒按10倍倍比稀释,将稀释好的质粒(浓度为108~101)为模板,同时加入阴性对照,分别进行实时荧光定量RT-PCR反应和RT-PCR反应,比较两种方法能够检测到的最低浓度,评估其灵敏度。
1.9 重复性试验
取重组质粒浓度为 2.7×105 copies·μL−1、2.7×104 copies·μL−1、2.7×103 copies·μL−1分别进行3次组内、组间重复性试验,以判定该方法的重复性。
1.10 临床样品检测
对收集自福建地区猪场疑似PoRV的151份病料采用建立的方法进行检测和分析,并与RT-PCR方法进行对比,比较二者检测符合率。
2. 结果与分析
2.1 PoRV A质粒的鉴定
PoRV A质粒通过测序验证连接成功。通过NanoDrop2000测定PoRVA质粒浓度,根据质粒浓度计算公式[14],经计算可知质粒拷贝数为2.7×1010 copies·μL−1。PCR鉴定在598 bp处可见条带,与预期相符(图1)。测序结果显示,测序结果与目的序列一致。
2.2 反应体系优化
经条件优化后的荧光定量PCR体系:RT-qPCR Probe Mix 10.0 μL,模板 5.0 μL,RT Enzyme Mix 0.5 μL,引物PoRV- F3、PoRV- R3(10 μmol·L−1)各0.9 μL,探针(10 μmol·L−1)0.4 μL,RNase-free ddH2O 2.3 μL,总体系为 20.0 μL;程序:55 ℃ 15 min,95 ℃ 30 s;95 ℃ 15 s,60 ℃ 1 min(荧光采集),40个循环。
2.3 标准曲线的绘制
绘制的标准曲线如图2所示。PoRV A标准曲线线性方程为 y=−3.484x+40.086,相关系数R2达到
0.9991 ,扩增效率E为93.7%。结果表明,标准品模板的拷贝数与各自Ct值呈现良好的线性关系。2.4 特异性试验
利用优化后的TaqMan RT-qPCR反应体系和条件进行特异性检测。结果如图3所示,除PoRV A产生扩增荧光信号外,其他病毒和阴性对照均未检测到扩增信号,表明本试验建立的TaqMan荧光定量检测方法特异性强,不受其他常见猪源腹泻病毒影响。
2.5 敏感性试验
以10倍梯度稀释(2.7×101~2.7×108 copies·μL−1)的阳性质粒为模板,分别以建立的RT-qPCR方法和常规RT-PCR方法进行检测比较,其结果如图4和图5所示。 RT-qPCR检测方法的最低检测浓度为 2.7×101 copies·μL−1(以2.7×108~2.7×101 copies·μL−1为模板的RT-qPCR检测到的Ct值分别为9.22、11.83、15.20、18.60、21.26、24.79、27.62、31.92);常规RT-PCR方法的最低检测浓度为2.7×103 copies·μL−1。RT-qPCR检测灵敏度是RT-PCR灵敏度的100倍。
2.6 重复性试验
以 2.7×105 copies·μL−1、2.7×104 copies·μL−1、2.7×103 copies·μL−1的PoRV A质粒作为模板,应用建立的方法分别进行组内、组间重复试验。数据显示(表2),3个浓度均能有效扩增,该方法的组内变异系数为0.401%~0.932%;组间变异系数为0.359%~1.026%,说明该方法重复性好。
表 2 PoRV TaqMan RT-qPCR重复性试验结果Table 2. Results of PoRV TaqMan RT-qPCR assay质粒浓度
Concentration/
(copies·μL−1)组内变异试验
Intra-assay variability组间变异试验
Inter-assay variability平均数
¯X±SD变异系数
CV/%平均数
¯X±SD变异系数
CV/%2.7×105 21.553±0.201 0.932 22.507±0.231 1.026 2.7×104 24.413±0.098 0.401 24.853±0.127 0.511 2.7×103 27.177±0.248 0.912 27.540±0.099 0.359 2.7 临床样品检测
将收集到的151份来自福建省的疑似PoRV的临床样品分别使用TaqMan RT-qPCR与RT-PCR方法进行检测,结果如表3所示,TaqMan RT-qPCR的检出率为42.38%(64/151),可疑病料(Ct值35~40)有9份;RT-PCR的检出率为33.11%(50/151);荧光定量RT-PCR与RT-PCR结果符合率为78.16%(50/64)。
表 3 临床样品检测结果比较Table 3. Comparison of testing results on clinical specimens指标
Index阳性
Positive/份可疑
Suspicious/份阴性
Negative/份总计
Total/份RT-PCR 50 0 101 151 荧光定量 RT-PCR 64 9 78 151 3. 讨论与结论
猪腹泻类病毒对猪群危害大,临床监测重心一般为PEDV、PoRV、TGEV等病毒。PoRV A、PoRV B、PoRV C均可感染猪群,其中以PoRV A感染为主。感染PoRV的猪只通常会表现出腹泻、呕吐和脱水等典型症状。此外,轮状病毒感染的临床症状轻重取决于发病的日龄、免疫状态和环境条件,根据猪只的生长阶段不同,腹泻的具体表现也会有所差异。未满20日龄且缺乏母源抗体保护的仔猪,在感染PoRV后,会出现严重的水样腹泻,这导致仔猪严重脱水的同时死亡率增高。大于1月龄的仔猪在PoRV感染后虽然症状较轻,但也会出现腹泻呕吐的症状,对仔猪后续的生长发育造成影响[12]。妊娠期的母猪感染该病毒可能会导致流产和产出死胎。
凭借其高灵敏度和强特异性,实时荧光定量PCR技术在当前的检测条件下,能够实现对病原体快速且准确的检测。探针法与染料法相比,探针与扩增的目的序列的特异性结合产生荧光信号,不受引物二聚体的影响,也不受非特异性扩增的影响。因此,TaqMan荧光定量PCR技术已成为目前诊断多种病原体的关键方法。TaqMan荧光定量PCR与RT-PCR相比更加省时、快捷,并且实现病毒核酸定量[15]。采用一步法扩增,操作简单,同时避免了逆转录过程中需要频繁打开PCR管导致的核酸污染情况。
本研究以PoRV的VP6基因序列为基础,设计特异性引物与探针,建立了猪A群轮状病毒 TaqMan实时荧光定量PCR检测方法。目前VP6基因已经成为国内外研究轮状病毒的主要分子靶点,主要是由于VP6基因与其他基因片段相比变异程度小,序列相对保守[10]。特异性检测结果显示,该方法只特异性扩增PoRV A的核酸,对其他猪源腹泻类病毒均无扩增,表明该方法特异性强。敏感性试验结果显示,最低可以检测到浓度为27.0 copies·μL−1,敏感度是常规逆转录聚合酶链反应(RT-PCR)检测方法的100倍;与陈小飞等[16]建立的实时荧光定量PCR方法相比灵敏度更高,对于PoRV的早期诊断更具优势。重复性试验的结果表明,无论是组内试验还是组间试验,其变异系数均低于1.10%,这证实了该方法具有良好的稳定性和重复性。用该方法对收集自福建地区猪场疑似PoRV的151份病料进行检测结果显示,荧光定量RT-PCR方法的检出率为42.38%(64/151),逆转录聚合酶链反应(RT-PCR)方法的检出率为33.11%(50/151),说明该方法与常规逆转录聚合酶链反应(RT-PCR)的检测相比更加灵敏,同样说明PoRV是福建省猪场病毒性腹泻的病原之一,这值得我们更加重视PoRV的防控。
近些年来PoRV检出率逐渐增高,在我国湖北、河南、江苏、江西、浙江等地区均有报道,其检出率最高可达66.7%[4,17~20],国内PoRV流行病学调查报道2012年全国13个省份PoRV的感染率为3.20%[21];2021年左右,在何晓明等[22]的研究中,对我国6个省市的调查发现PoRV的感染率为27.89%;2023年关于PoRV的研究中发现江苏的PoRV阳性检出率达57.70%,江西地区的阳性检出率达55.71%[23],贵州的阳性检出率为38.79%[24]。本研究对福建地区151份病料的检测结果显示,PoRV的检出率为42.38%(64/151),与其他地区报道的数据相比,虽然不同地区的检出率存在差异,但检出率整体处于较高水平。
-
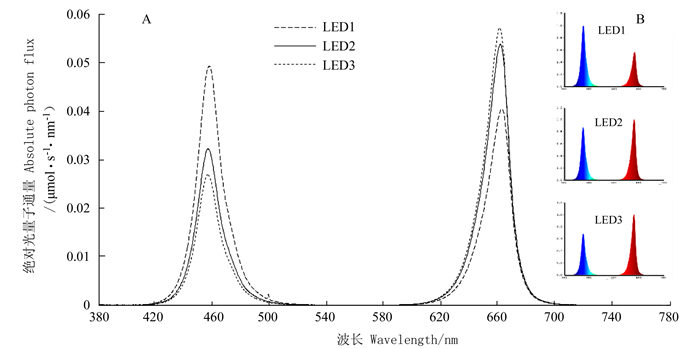
表 1 试验用LED灯泡的光电特性
Table 1 Specifications of LEDs
处理
Treat-ment红蓝LED组件数量比
Chip number ratio of red & blue最大入射波长
Peak wavelengeh Λp/nm光合有效辐射
Photosynthetically active radiation PAR/W光合量子通量
Photosynthetic photon flux/(μmol·s-1)光子通量
Yield photon flux
/(μmol·s-1·W-1)红蓝光质比Photosynthetic photon flux ratio of red light & blue light LED1 1:1 457.4 & 662.8 2.49 11.01 4.42 0.81 LED2 2:1 456.6 & 661.0 2.20 10.37 4.70 1.65 LED3 3:1 455.8 & 660.2 2.08 10.01 4.79 2.10 表 2 不同LED灯茶园补光21d后对茶树新梢芽叶的生长影响
Table 2 Growth of buds on Qianmei 601 plants under LED settings for 21 days
处理
Treatment百芽鲜重Fresh weight of 100/(个·g-1) 发芽密度Bud density/(个·m-2) 单芽
Apical bud一芽一叶
Apical bud and subtending one leaf一芽二叶
Apical bud and subtending two leaves单芽
Apical bud一芽一叶
Apical bud and subtending one leaf一芽二叶
Apical bud and subtending two leavesCK 6.886±0.71b 15.909±1.10b 20.675±2.61b 365±79b 286±57a 219±52b LED1 7.737±0.70a 17.348±3.19a 29.267±1.69a 538±86a 229±51a 383±55a LED2 7.023±0.42b 14.314±1.65bc 22.483±2.46b 617±116a 191±39a 271±68b LED3 6.873±0.43b 13.345±1.56c 21.700±1.13b 737±143a 254±46a 209±36b 注:表中同一指标用不同小写字母标识表示处理间差异显著(P < 0.01)。表 3、4同。
Note:Different letter within a columnindicates the significantly difference at the 1% levels.The same as table 3-4.表 3 不同LED灯茶园补光21d后对茶树新梢芽叶的色素影响
Table 3 Chlorophyll in buds of Qianmei 601 plants under LED settings for 21 days
处理
Treatment一芽一叶Apical bud and subtending one leaf 一芽二叶Apical bud and subtending two leaves 总叶绿素
Total Chlorophylls/%类胡萝卜素
Carotenoids/%花黄素
Flavone/(mg·g-1)总叶绿素
Total Chlorophylls/%类胡萝卜素
Carotenoids/%花黄素
Flavone/(mg·g-1)CK 0.701±0.015b 0.241±0.017a 7.19±0.68b 0.904±0.07c 0.296±0.017a 7.45±0.58b LED 1 0.892±0.008a 0.212±0.015a 6.08±1.25b 1.018±0.017a 0.241±0.017b 6.77±0.79b LED2 0.850±0.016a 0.210±0.014a 7.14±0.80b 1.008±0.034a 0.256±0.019b 9.32±1.10a LED3 0.756±0.063ab 0.220±0.017a 9.43±0.49a 0.943±0.024b 0.257±0.0164b 10.71±1.20a 表 4 不同LED灯茶园补光21d后对茶树叶片多酚及游离氨基酸含量的影响
Table 4 Polyphenols and amino acids in leaves of Qianmei plants under LED settings for 21 days
处理
Treatment一芽一叶Apical bud and subtending one leaf 一芽二叶Apical bud and subtending two leaves 多酚
Total ployphenols/%游离氨基酸
Free amino acid/%酚氨比 多酚
Total ployphenols/%游离氨基酸
Free amino acid/%酚氨比 CK 23.91±1.35c 2.091±0.199c 11.52±1.33b 22.67±0.73c 1.838±0.178c 12.6±1.03b LED 1 29.51±0.89a 2.765±0.303a 10.60±1.10c 27.95±0.96a 2.378±0.221a 11.2±1.01c LED2 28.0±0.56ab 2.479±0.243b 11.38±1.05b 25.57±0.63b 1.947±0.179b 13.22±1.23a LED3 25.96±0.65b 1.968±0.188c 13.28±1.25a 24.05±0.53c 1.772±0.179d 13.69±1.42a -
[1] YAMAMOTO T, JUNEJA L R, KIM M.Chemistry and applications of green tea[M]. New York:CRC press, 1997:160.
[2] WEI C L, YANG H, WANG S B, et al.Draft genome sequence of Camellia sinensis var.sinensis provides insights into the evolution of the tea genome and tea quality[J]. Proc Natl Acad Sci, 2018, 115(18):4151-4158. DOI: 10.1073/pnas.1719622115
[3] ZHOU Q Q, CHEN Z D, LEE J, et al.Proteomic analysis of tea plants (Camellia sinensis) with purple young shoots during leaf development[J]. PLOS ONE, 2017, 12(5): 11-18. http://www.ncbi.nlm.nih.gov/pubmed/28520776
[4] DONG C, FU Y, LIU G, et al.Low light intensity effects on the growth, photosynthetic characteristics, antioxidant capacity, yield and quality of wheat (Triticumaestivum L.) at different growth stages in BLSS[J]. Adv Space Res, 2014, 53:1557-1566. DOI: 10.1016/j.asr.2014.02.004
[5] HU D, LI L, LI Y, et al.Gas equilibrium regulation by closed-loop photo bioreactor built on system dynamics, fuzzy inference system and computer simulation[J]. Comput Electron Agric, 2014, 103: 114-121. DOI: 10.1016/j.compag.2014.02.002
[6] MASSA G D, KIM H H, WHEELERRM, et al.Plant productivity in response to LED lighting[J]. Hort Science, 2008, 43: 951-956. http://agris.fao.org/openagris/search.do?recordID=US201301566148
[7] MORROW R C.LED lighting in horticulture[J]. Hort Science, 2008, 43: 1947-1950. http://d.old.wanfangdata.com.cn/Conference/8380085
[8] BROWN C S, SCHUERGER A C, SAGER J C.Growth and photomorphogenesis of pepper plants under red light-emitting diodes with supplemental blue or far-red lighting[J]. Journal of the American Society of Horticultural Science, 1995, 120: 808-813. DOI: 10.21273/JASHS.120.5.808
[9] TENNESSEN D J, SLNGSAAS E L, SHARKEY T D.Light-emitting diodes as a light source for photosynthesis research[J]. Photosynthesis Research, 1994, 39:85-92. DOI: 10.1007/BF00027146
[10] CURREY C J, LOPEZ R G.Cuttings of Impatiens, Pelargonium, and Petunia propagated under light-emitting diodes and high-pressure sodium lamps have comparable growth, morphology, gas exchange, and post-transplant performance[J]. HortScience, 2013, 48:428-434. DOI: 10.21273/HORTSCI.48.4.428
[11] 刘厚诚.植物照明研究与应用新进展[J].照明工程学报, 2018, 29(4):3. http://d.old.wanfangdata.com.cn/Periodical/zmgcxb201804030 LIU H C.New progress in research and application of plant lighting[J]. China Illuminating Engineering Journal, 2018, 29(4):3.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/zmgcxb201804030
[12] 刘文科.LED植物工厂光质生物学研究与应用现状[J].中国农业科技导报, 2018, 20(10):9-14. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgnykjdb201810002 LIU W K.Research on spectral biology of plant factory with LED lighting and application status[J]. Journal of Agricultural Science and Technology, 2018, 20(10):9-14.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgnykjdb201810002
[13] 张彤, 李成宇, 池建义, 等.稀土LED植物补光灯在设施农业上的应用[J].照明工程学报, 2018, 29(4):22-24. DOI: 10.3969/j.issn.1004-440X.2018.04.004 ZHANG T, LI C Y, CHI J Y, et al.Application of rare earth LED lights for plant in protected agriculture[J]. China Illuminating Engineering Journal, 2018, 29(4):22-24.(in Chinese) DOI: 10.3969/j.issn.1004-440X.2018.04.004
[14] OWEN W G, LOPEZ R G.End-of-production supplemental lighting with red and blue light-emitting Diodes (LEDs) influences red pigmentation of four lettuce varieties[J]. Hort Science, 2015, 5:676-684. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=af194f012a9c3bda59dcbbaafcb0e5d2
[15] RABINOWITCH E I.Photosynthesis and related processes[M]. New York:Interscience Publishers, Inc, 1945.
[16] MCCREE K J.The action spectrum, absorptance and quantum yield of photosynthesis in crop plants[J]. Agricultural Meteorology, 1972, 9: 191-216. DOI: 10.1016-0002-1571(71)90022-7/
[17] GOINS G D, YOTIO N C, SANWO M M, et al.Photo morphogenesis, photosynthesis, and seed yield of wheat plants grown under light emitting diodes(LEDs)with or without supplemental blue lighting[J]. J Exp Bot, 1997, 48: 1407-1413. DOI: 10.1093/jxb/48.7.1407
[18] 朱旗.茶学概论[M].北京:中国农业出版社, 2013:24-26. ZHU Q.Overview of Tea Science[M]. Beijing: China Agriculture Press, 2013:24-26.(in Chinese)
[19] 姚江, 胡建程, 谢丰镐.茶叶中叶绿素研究[J].浙江农业大学学报, 1990, 16(4):421-426. http://d.old.wanfangdata.com.cn/Periodical/ahnykx201120043 YAO J, HU J C, XIE F H.Study on chlorophyll constituents of tea[J]. Acta Agriculturae University Zhejiang, 1990, 16 (4):421- 426.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/ahnykx201120043
[20] 范培珍, 薄晓培, 王梦馨, 等.4个等级内山六安瓜片茶叶氨基酸的组成及差异[J].安徽农业大学学报, 2017, 44(1):14-21. http://d.old.wanfangdata.com.cn/Periodical/ahnydxxb201701003 FAN P Z, BO X P, WANG M X, et al.Similarities and differences in composition of amino acids in four grades of Liu'anNeishanGuapianTea[J]. Journal of Anhui Agricultural University, 2017, 44(1):14-21.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/ahnydxxb201701003
[21] 余涛, 胡波, 孙睿, 等.茶叶光谱与叶绿素、茶氨酸、茶多酚含量关系分析[J].遥感技术与应用, 2016, 31(5):872-878. http://d.old.wanfangdata.com.cn/Periodical/ygjsyyy201605005 YU T, HU B, SUN R, et al.Relationship between tea spectra and contents of chlorophyll, theanine an polyphenols[J]. Remote Sensing Technology and Application, 2016, 31(5):872-878.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/ygjsyyy201605005
[22] KOWALLIK W.Blue light effects on respiration[J]. Annu Rev Plant Physiol, 1982, 33: 51-72. DOI: 10.1146/annurev.pp.33.060182.000411
[23] 孙君, 朱留刚, 林志坤, 等.茶树光合作用研究进展[J].福建农业学报, 2015, 30 (12):1231-1237. DOI: 10.3969/j.issn.1008-0384.2015.12.018 SUN J, ZHU L G, LIN Z K, et al.Research progress on photosynthesis of tea plants[J]. Fujian Journal Agricultural Sciences, 2015, 30(12):1231-1237.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2015.12.018
-
期刊类型引用(10)
1. 谢侗,燕飞,曲东,江海,周祎炜,闫瑞瑞. 人工光源对茶树生长及茶叶品质的影响研究进展. 茶叶通讯. 2024(01): 8-15 .  百度学术
百度学术
2. 张成,黄藩,王高熙,黄颖博,葛诗蓓,罗凡. 光调控在茶树栽培和茶叶加工中的应用研究进展. 中国茶叶. 2024(05): 10-16 .  百度学术
百度学术
3. 谢侗,燕飞,江海. 红光和蓝光对茶叶萎凋过程中关键物质生成比较研究. 农业与技术. 2023(20): 28-32 .  百度学术
百度学术
4. 黄海涛,牛小军,丁一,李红莉,赵芸,毛宇骁. 茶园反光膜补光对龙井茶品质的影响. 茶叶. 2022(02): 81-84 .  百度学术
百度学术
5. 闾怡清,金晶,胡美娟,叶红燕,叶俭慧,梁月荣. 光信号对茶树叶片类黄酮合成调节机制的研究进展. 中国茶叶. 2022(07): 16-22 .  百度学术
百度学术
6. 王加真,刘义富,肖尧,何佳,曾一霞,周玲艳,赵蛾. 不同光质对福鼎大白茶叶片叶绿素荧光参数和呈味氨基酸积累的影响. 江苏农业科学. 2022(17): 132-138 .  百度学术
百度学术
7. 盖淑杰,王奕雄,李兰,刘硕谦,李银花,程孝,夏茂,刘仲华,周智. 茶树生长光调控研究进展. 茶叶科学. 2022(06): 753-767 .  百度学术
百度学术
8. 王加真,刘义富,肖尧,秦中,李丹,蒋兴娇,杨素群,吴国丽. 室温条件下储藏年限对湄潭翠芽品质及三维荧光指纹图谱的影响. 遵义师范学院学报. 2021(03): 94-97+101 .  百度学术
百度学术
9. 王加真,金星,万雪. 贵州绿茶滋味物质的浸出特征及三维荧光指纹图谱分析. 遵义师范学院学报. 2019(06): 81-84+95 .  百度学术
百度学术
10. 于敬亚,庄晓丽,郭楚嘉,于学领,项应萍,徐邢燕,郝志龙. 补光对‘金观音’相关酶活性的影响. 亚热带农业研究. 2019(04): 246-250 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: