SYBR Green Ⅰ RT-qPCR Assay for Mycoplasma ovipneumoniae Detection
-
摘要: 根据GenBank公布的绵羊肺炎支原体Y-98株(No.KM435069.1)P80基因序列,利用Beacon Designer 7.9软件设计1对特异性引物,建立了绵羊肺炎支原体的SYBR Green Ⅰ实时荧光定量检测方法。结果显示,该方法可以特异性检测绵羊肺炎支原体,对其他羊常见病原扩增结果无特异性扩增;该方法最低检测限为10 copies·μL-1,组内和组间变异系数均小于2%;采用该方法对96份临床样品进行检测,绵羊肺炎支原体的阳性率为67.7%(65/96),结果显示该方法与TaqMan实时荧光定量PCR方法检测结果一致。以上结果表明本研究建立的绵羊肺炎支原体SYBR Green Ⅰ实时荧光定量PCR方法特异性强、灵敏度高、重复性好,可用于绵羊肺炎支原体的病原学检测和流行病学调查。
-
关键词:
- 绵羊肺炎支原体 /
- SYBR Green Ⅰ /
- 荧光定量PCR
Abstract: A SYBR Green Ⅰ RT-qPCR assay was established for detecting the pathogenic Mycoplasma ovipneumoniae in sheep.Using Beacon Designer 7.9 software, a pair of specific primers based on the P80 gene of the M.ovipneumoniae strain Y-98 in Genbank (accession number. No.KM435069.1) was designed for the experiment. The result showed that the new methodology could specifically detect the target pathogen but not any others from sheep or goats. The detection limit was 10 copies·μL-1, and the Ct of intra-and inter-variation all below 2%. The assay method was subsequently applied on 96 clinical samples to yield a positive rate of 67.7% (i.e., 65 out of 96), which was as sensitive as TaqMan RT-PCR. It suggested that the newly established methodology was high on sensitivity, specificity and reproducibility, and applicable for the diagnosis and epidemiologic studies on M.ovipneumoniae.-
Keywords:
- Mycoplasma ovipenumon iae /
- SYBR Green Ⅰ /
- RT-qPCR
-
绵羊肺炎支原体Mycoplasma ovipneumoniae, Mo是引起绵羊和山羊支原体性肺炎的主要病原体之一[1],羊感染发病后病程较长,康复羊亦可长期带菌,因此消灭困难。羔羊感染发病后死亡率高,通常病死率为30%~50%,甚至高达80%[2-3]。羊支原体性肺炎在全世界养羊国家均有存在,我国四川、贵州、内蒙古、青海、广西、福建等地均有该病发生的报道[4-5],对养殖户造成了严重的经济损失,限制了养羊业的健康发展。
绵羊肺炎支原体与其他引起羊支原体性肺炎的病原之间缺乏交叉免疫反应,免疫预防困难,且其所引起疾病的症状与传染性胸膜肺炎极为相似,因此很有必要建立快速准确检测绵羊肺炎支原体的方法。当前绵羊肺炎支原体常用的检测方法有分离鉴定法、常规PCR法、血清学方法和实时荧光定量PCR。由于支原体的分离鉴定法、常规PCR法和血清学方法存在费时费力、灵敏度低、特异性差等缺点,不能满足大批量样品的实时监测;而实时荧光定量PCR方法灵敏度高,操作简单,可进行批量检测,已有Yang等[6]、程振涛等[7]、尹正军[8]、王华[9]分别根据p113基因、16S rRNA、tuf基因和NA基因建立了SYBR Green Ⅰ和TaqMan实时荧光定量PCR方法。林裕胜等[10]用P80基因建立了检测羊口疮病毒和绵羊肺炎支原体的双重PCR方法。但目前尚未见关于P80基因荧光定量PCR方法检测绵羊肺炎支原体的报道。本研究基于绵羊肺炎支原体P80基因建立了绵羊肺炎支原体染料法SYBR Green Ⅰ实时荧光定量PCR方法,以期为该病的检测提供参考。
1. 材料与方法
1.1 菌株及临床样品
山羊支原体山羊肺炎亚种模式株F38和山羊支原体山羊亚种核酸由中国农业科学院兰州兽医研究所储岳峰研究员馈赠;大肠杆菌、多杀性巴氏杆菌、绵羊肺炎支原体FJ01-CL、莱氏无胆甾原体、金黄色葡萄球菌、牛支原体、丝状支原体山羊亚种,溶血性曼氏杆菌,均为本研究室分离、鉴定和保存;96份疑似羊支原体性肺炎鼻拭子样品,为2014年9月至2018年6月采集于福建省内山羊场。
1.2 主要仪器、试剂和耗材
荧光定量PCR仪,购自eppendorf公司;染料SYBR Premix Ex Taq试剂(200次)、RNase-Free Water、DNA Marker,均购自宝生物工程(大连)有限公司;质粒提取试剂盒,购自Omega公司;细菌基因组DNA抽提试剂盒,购自生工生物工程(上海)有限公司;胶回收试剂盒,购自康宁生命科学有限公司。
1.3 引物的设计与合成
根据GenBank公布的绵羊肺炎支原体P80(GenBank No.KM435069.1)基因,在其保守区用Beacon Designer 7.9设计1对特异性引物(P80F:5′-CCT TAT ACA CGC TAT GGT-3′/P80R:5′-CGA TGT TAG ATT CTT CCT ATC-3′),引物由宝生物工程(大连)有限公司合成。
1.4 标准品的制备
参考文献[11-12]的方法提取绵羊肺炎支原体的DNA和质粒,-70℃保存备用。
1.5 反应条件的优化
按照参考文献[11]建立25 μL反应体系:上、下游引物(10 μmol·μL)各0.5 μL,染料试剂SYBR Premix Ex Taq酶12.5 μL,模板2 μL,RNase-Free水8.5 μL。初步反应条件为:95℃ 30 s;95℃ 5 s,退火温度以2℃为梯度从50℃依次增加到62℃,30 s,共40个循环;退火延伸时检测荧光信号,以产生的荧光值(△Rn)最高和最小的Ct值,并且在熔解曲线中无非特异性峰值为最佳优化标准。
1.6 标准曲线的建立
按照参考文献[12]换算公式将测定的阳性重组质粒的OD260值换算为拷贝数浓度,然后进行10倍倍比稀释,按照上述优化条件进行荧光定量PCR扩增。
1.7 特异性试验
在上述优化条件下,分别对绵羊肺炎支原体、山羊支原体山羊亚种、牛支原体、丝状支原体山羊亚种等核酸进行荧光定量PCR检测,检验该方法的特异性。
1.8 敏感性试验
以不同稀释浓度的标准品为模版,用建立的荧光定量PCR方法进行检测;同时用林裕胜等[12]建立的绵羊肺炎支原体TaqMan实时荧光定量PCR方法进行检测,比较两种方法的敏感性。
1.9 重复性试验
以1×107、1×105、1×103copies·μL-1等3个浓度的标准品参照参考文献[12]进行组内和组间重复试验。
1.10 临床样本检测
应用建立的荧光定量PCR方法对采集的96份疑似羊支原体性肺炎的鼻拭子样品进行检测,同时与林裕胜等[12]建立的TaqMan实时荧光定量PCR方法进行比较,评估该方法的准确性。
2. 结果与分析
2.1 阳性标准品的制备
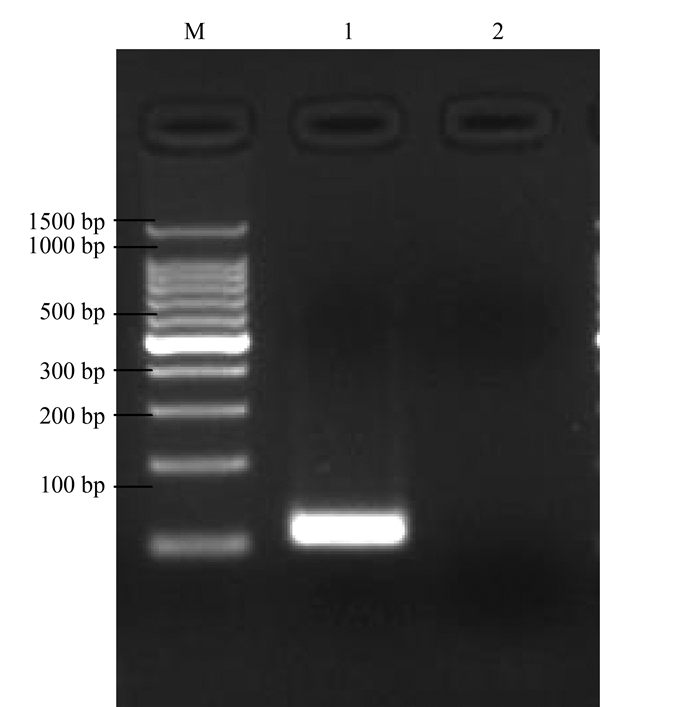
绵羊肺炎支原体FJ01-CL质粒P80部分基因重组质粒经PCR和测序鉴定,电泳图片可见扩增出与预期大小一致的条带,为126 bp(图 1);将测序结果与GenBank公布的绵羊肺炎支原体P80基因(GenBank No.KM435069.1)进行比对,两者的相似性为100%。
2.2 反应条件的优化及标准曲线的建立
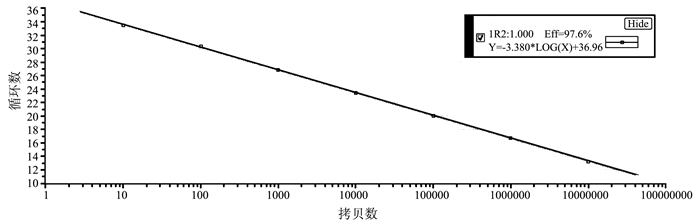
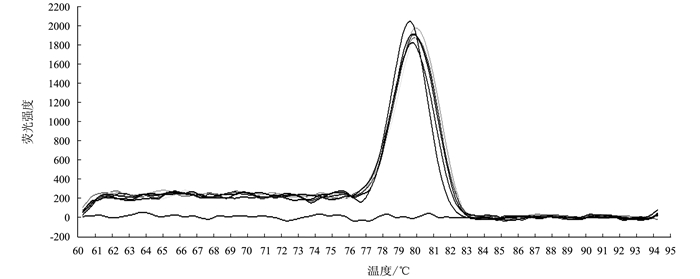
通过对绵羊肺炎支原体荧光定量PCR反应条件的优化,获得最佳反应条件为:95℃ 30 s预变性;95℃ 5 s,60℃ 30 s,共40个循环。从图 2可以看出,在1×101~1×107copies·μL-1具有良好线性关系,标准曲线相关系数R2=1.00,扩增效率E=97.6%。由图 3可见,当Tm=(79.5±0.23)℃时,没有非特异性扩增产物,仅有单特异性峰生成。
2.3 特异性分析
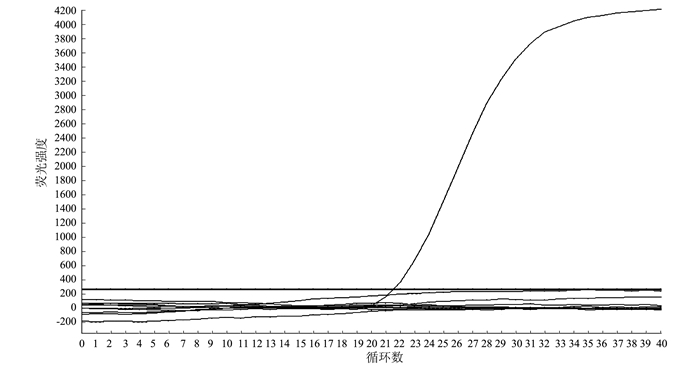
利用上述优化方法分别对绵羊肺炎支原体、丝状支原体山羊亚种、山羊支原体山羊肺炎亚种等核酸进行荧光定量PCR检测,结果(图 4)可见,除绵羊肺炎支原体能扩增出S型曲线外,其他羊常见病原均无扩增。
2.4 灵敏度分析
灵敏性试验结果显示,建立的荧光定量PCR方法与TaqMan实时荧光定量PCR方法敏感性一致,对阳性标准品的最低检测值均为10 copies ·μL-1,表明建立的方法灵敏度高。
2.5 稳定性分析
选取1×107、1×105和1×103copies ·μL-1的阳性标准品进行组内和组间重复试验,结果(表 1)可知,3份不同稀释度模板组内变异系数为0.64%~1.78%,组间变异系数为0.69%~1.65%,具有良好的重复性。
表 1 绵羊肺炎支原体实时荧光定量PCR的重复性试验结果Table 1. Repeatability of M.ovipneumoniae detection by RT-qPCR重组质粒Mo
浓度/
(copies·μL-1)组内重复 组间重复 Ct平均值±
标准差变异系数
/%Ct平均值±
标准差变异系数
/%1×107 13.52±0.19 1.41 13.53±0.18 1.33 1×105 20.19±0.13 0.64 20.13.±0.14 0.69 1×103 26.35±0.47 1.78 26.12±0.43 1.65 2.6 临床样品检测
分别利用本研究建立的SYBR Green Ⅰ荧光定量PCR和林裕胜等[12]建立的TaqMan实时荧光定量PCR对从福建省内采集的96份临床疑似羊支原体性肺炎的鼻拭子样品进行DNA检测,比较两者结果的符合率。结果(表 2)表明,二者检测结果完全一致,阳性率均为67.7%。
表 2 SYBR Green Ⅰ荧光定量PCR和TaqMan荧光定量PCR法临床样品检测结果比较Table 2. M. ovipneumoniae detections on clinical samples using SYBR Green Ⅰ RT-qPCR and TaqMan RT-qPCR检测方法 样品数 阳性
样品数阴性
样品数阳性率
/%SYBR Green Ⅰ荧光定量PCR 96 65 31 67.7 TaqMan荧光定量PCR 96 65 31 67.7 3. 讨论
绵羊肺炎支原体是引起羊支原体性肺炎的主要病原,在我国羊群中的感染率很高。羊支原体性肺炎临床症状以高热、咳嗽、流涕为特征,病死率高,严重制约了养羊产业的健康发展[1]。目前福建省大多数羊场均存在该病[4]。由于羊支原体性肺炎与山羊传染性胸膜肺炎临床上很容易混淆,同时,绵羊肺炎支原体分离培养困难、耗时长,不适于该病的快速诊断,因此,很有必要建立绵羊肺炎支原体快速、特异和敏感的检测方法,为羊支原体性肺炎病的科学防控提供技术支持。
普通PCR检测样品过程中,需要在反应结束后,将扩增产物在琼脂糖胶上电泳后才能得到检测结果,整个操作过程较为繁琐,费时费力,在样品量多的情况下容易出现污染,而且容易假阳性[13]。而荧光定量PCR在加样后整个过程都可以在仪器上实时监控,减少后续电泳和凝胶成像步骤,极大地减少了人力。荧光定量PCR又分为染料法和探针法,染料法与探针法相比,具有成本低、且引物设计简单,容易操作等优势[14]。
绵羊肺炎支原体P80基因编码膜蛋白,虽然其免疫特性尚未深入研究,但已用于构建遗传进化树,比较不同菌株之间的亲缘关系[15],并且已有研究根据该基因序列建立了常规PCR方法[10],应用于临床样品的检测。本研究采用染料法SYBR Green Ⅰ根据P80基因保守序列设计特异性引物建立了绵羊肺炎支原体荧光定量PCR检测方法。研究结果显示,本研究建立的方法特异性强,对丝状支原体山羊亚种、牛支原体、山羊支原体山羊肺炎亚种、山羊支原体山羊亚种等羊常见病原均无反应;标准曲线具有良好的线性关系,相关系数R2为1.00,扩增效率为97.6%;组内和组间变异系数均小于2%,说明该方法具有很高的精确度和良好的稳定性。Yang等[6]、程振涛等[7]、尹正军[8]、王华[9]分别建立了绵羊肺炎支原体实时荧光定量PCR方法,其最低检测限分别为3、10、22、5 copies· μL-1。本研究建立的方法最低检测限为10 copies· μL-1,与程振涛等[7]依据16S rRNA基因建立的染料法和林裕胜等[12]依据p113基因建立的TaqMan荧光定量PCR方法的敏感性一致,与Yang等[6]和王华[9]依据p113基因和NA基因建立的染料法敏感性相当。应用本研究建立的方法对福建省内96份鼻拭子样品进行检测并与TaqMan荧光定量PCR法进行比较,结果显示,二者敏感性一致,表明P80基因作为靶基因应用于绵羊肺炎支原体的检测是可行的,本研究建立的方法可以用于绵羊肺炎支原体的准确快速检测。
96份鼻拭子样品中绵羊肺炎支原体检测的阳性率为67.7%。如此高的阳性率与养殖户疫苗使用不当有一定关系,结合本研究室近几年检测结果来看,引起福建省羊支原体性肺炎的病原是绵羊肺炎支原体和丝状支原体山羊亚种,福建省尚未检测到山羊传染性胸膜肺炎病原。而福建省养殖户当前免疫的疫苗主要有小反刍兽疫弱毒疫苗、山羊传染性胸膜肺炎灭活疫苗、口蹄疫疫苗和羊痘疫苗,很少用绵羊肺炎支原体和丝状支原体山羊亚种二联灭活苗进行免疫,因此导致羊支原体性肺炎发病率居高不下。
综上所述,本研究建立的绵羊肺炎支原体SYBR Green Ⅰ实时荧光定量PCR可用于绵羊肺炎支原体的准确快速检测和流行病学调查。
-
表 1 绵羊肺炎支原体实时荧光定量PCR的重复性试验结果
Table 1 Repeatability of M.ovipneumoniae detection by RT-qPCR
重组质粒Mo
浓度/
(copies·μL-1)组内重复 组间重复 Ct平均值±
标准差变异系数
/%Ct平均值±
标准差变异系数
/%1×107 13.52±0.19 1.41 13.53±0.18 1.33 1×105 20.19±0.13 0.64 20.13.±0.14 0.69 1×103 26.35±0.47 1.78 26.12±0.43 1.65 表 2 SYBR Green Ⅰ荧光定量PCR和TaqMan荧光定量PCR法临床样品检测结果比较
Table 2 M. ovipneumoniae detections on clinical samples using SYBR Green Ⅰ RT-qPCR and TaqMan RT-qPCR
检测方法 样品数 阳性
样品数阴性
样品数阳性率
/%SYBR Green Ⅰ荧光定量PCR 96 65 31 67.7 TaqMan荧光定量PCR 96 65 31 67.7 -
[1] 杜鲜, 乔军, 陈诚, 等.绵羊肺炎支原体降落PCR-侧向层析快速检测方法的建立[J].中国预防兽医学报, 2017, 39(6):466-470. http://d.old.wanfangdata.com.cn/Periodical/zgyfsyxb201706010 [2] BESSER T E, CASSIRER E F, POTTER K A, et al. Exposure of bighorn sheep to domestic goats colonized with Mycoplasma ovipneumoniae induces sub-lethal pneumonia[J]. J ClinMicrobiol, 2008, 46(2):423-430. http://europepmc.org/abstract/MED/28591169
[3] RIFATBEGOVIC M, MAKSIMOVIC Z, HULAJ B, et al. Mycoplasma ovipneumoniae associated with severe respiratory disease in goats[J]. Vet Record, 2011, 168(21):565. http://www.ncbi.nlm.nih.gov/pubmed/21610002
[4] 江锦秀, 林裕胜, 游伟, 等.福建省羊支原体性肺炎分子流行病学研究[J].福建农业学报, 2017, 32(1):12-16. http://d.old.wanfangdata.com.cn/Periodical/fjnyxb201701003 [5] YANG F, TANG C, WANG Y, et al. Genome sequence of Mycoplasma ovipneumoniae strain SC01[J]. J Bacteriol, 2011, 193(18):5018. DOI: 10.1128/JB.05363-11
[6] YANG F, DAO X, RODRIGUEZ-PALACIOS A, et al. A real-time PCR for detection and quantification of Mycoplasma ovipneumoniae[J]. J Vet Medical Science, 2014, 76(12):1631-1634. DOI: 10.1292/jvms.14-0094
[7] 程振涛, 张双翔, 王慧, 等.绵羊肺炎支原体实时荧光定量PCR检测方法的建立[J].西北农业学报, 2013, 22(2):7-12. http://d.old.wanfangdata.com.cn/Periodical/xbnyxb201302002 [8] 尹正军.基于绵羊肺炎支原体tuf基因的荧光定量PCR方法的建立及应用[D].成都: 西南民族大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10656-1015994233.htm [9] 王华.四川省山羊支原体肺炎流行病学调查及检测山羊肺炎支原体PCR方法的建立[D].成都: 西南民族大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10656-1011303222.htm [10] 林裕胜, 江锦秀, 江斌, 等.ORFV和Mo双重PCR检测方法的建立及应用[J].农业生物技术学报, 2017, 25(8):1374-1380. http://d.old.wanfangdata.com.cn/Periodical/nyswjsxb201708018 [11] 林裕胜, 江锦秀, 张靖鹏, 等.丝状支原体山羊亚种SYBR Green ⅠqRT-PCR快速检测方法的建立[J].农业生物技术学报, 2017, 25(11):1895-1902. http://d.old.wanfangdata.com.cn/Periodical/nyswjsxb201711017 [12] 林裕胜, 江锦秀, 张靖鹏, 等.绵羊肺炎支原体TaqMan荧光定量PCR检测方法的建立[J].中国预防兽医学报, 2018, 40(4):316-320. http://d.old.wanfangdata.com.cn/Periodical/zgyfsyxb201804009 [13] 林裕胜, 江锦秀, 张靖鹏, 等.羊传染性脓疱病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立[J].福建农业学报, 2018, 33(4):341-345. http://d.old.wanfangdata.com.cn/Periodical/fjnyxb201804002 [14] GALLINA L, DALPOZZO F, MCINNES C J, et al. A real time PCR assay for the detection and quantification of orf virus[J]. J Virol Methods, 2006, 134(1-2):140-145. DOI: 10.1016/j.jviromet.2005.12.014
[15] 马玉, 乔军, 孟庆玲, 等.绵羊肺炎支原体新疆流行株的分离鉴定及其膜蛋白P80基因序列分析[J].西南农业学报, 2015, 28(3):1375-1380. http://d.old.wanfangdata.com.cn/Periodical/xnnyxb201503083 -
期刊类型引用(1)
1. 张靖鹏,江锦秀,林裕胜,游伟,刘道泉,毛坤明,江斌,胡奇林. 山羊地方性鼻内肿瘤病毒(ENTV-2)SYBR-GreenⅠ实时荧光定量PCR检测方法的建立与应用. 福建农业学报. 2021(07): 779-784 .  本站查看
本站查看
其他类型引用(5)




 下载:
下载: