N-hydroxyamobarbital-producing Bacillus-like Strains
-
摘要: 采用液相-四级杆飞行时间质谱的方法筛选产N-羟基异戊巴比妥(N-Hydroxy Amobarbital)的芽胞杆菌菌株。通过分析73株芽胞杆菌菌株发酵液中胞外化合物成分,筛选出合成N-Hydroxy Amobarbital的4株芽胞杆菌,为栗褐芽胞杆菌Bacillus plakortidis(FJAT-8757)、内生芽胞杆菌Bacillus endophyticus(FJAT-10010)、米氏解硫胺素芽胞杆菌Aneurinibacillus migulanus(FJAT-14205)和休闲地芽胞杆菌Bacillus novalis(FJAT-14227),该成分在发酵液中的相对含量分别为6.04%、4.85%、1.61%和1.61%,ATPA与色谱库检索得分(Score)分别为96.25、94.33、96.72和94.91。
-
关键词:
- LC-QTOF MS /
- 芽胞杆菌 /
- N-羟基异戊巴比妥 /
- 巴比妥
Abstract: Bacillus-like bacteria were screened for their N-hydroxyamobarbital productivities. Extracellular metabolites of 73 candidates were analyzed using the liquid chromatography-hybrid quadrupole time-of-flight mass spectrometry (LC-QTOF MS) and Metlin database. The relative contents of N-hydroxyamobarbital in the culture media on strains that showed substantial levels were 6.04%, 4.85%, 1.61% and 1.61% for B. plakortidis FJAT-8757, B. endophyticus FJAT-10010, Aneurinibacillus migulanus FJAT-14205, and B. novalis FJAT-14227, respectively. The specialized m/z scores on FJAT-8757, FJAT-10010, FJAT-14205 and FJAT-14227 matched to ATPA were 96.25, 94.33, 96.72 and 94.91, respectively.-
Keywords:
- LC-QTOF MS /
- Bacillus /
- N-hydroxyamobarbital /
- barbiton
-
0. 引言
【研究意义】酿酒酵母直投式菌剂是以固体干物质形式存在、可使酵母菌在常温下长期贮存而不失去活性、在一定条件下复水活化后即恢复成自然状态并具有正常酵母活性的细胞[1-3]。高活力酵母直投式菌剂的研发与应用,对酿酒酵母产业化推广应用具有重要意义[4]。【前人研究进展】常用的菌剂干燥方法有冷冻干燥、喷雾干燥、真空干燥、流化床热风干燥、沸腾炉干燥等[5]。孙康等[6]优化了美极梅奇酵母真空冷冻干燥的复合保护剂配方,确定了最佳离心条件,菌存活率可达90%以上;李东歌等[7]采用鼓风干燥技术制备出葡萄酒酿酒活性干酵母;周亚男等 [8]研究了鲁氏酵母的喷雾干燥最佳工艺,并建立干燥过程菌存活率与喷雾进口温度的干燥动力学模型;张鸿雁等[9]优化了膜醭毕赤酵母真空干燥预处理工艺,提高了菌活性。可见,冷冻干燥技术存在菌体存活率高的优点,但其生产成本较高、干燥时间较长,不适宜酵母的产业化应用[5]。喷雾干燥、沸腾炉干燥等高温热风干燥技术存在高效、低耗能和可连续生产的特点[10],但干燥过程中高温和失水会对微生物产生损伤或死亡,降低菌体活力[11],影响菌剂在生产上的使用效果[12]。因此,研究酵母菌在热风干燥时快速死亡机制、提高酵母菌在热风干燥过程的存活率,是酿酒酵母菌剂制备的关键。【本研究切入点】已有研究结果发现,热风干燥过程干燥温度、干燥时间、干燥保护剂配比等条件会对菌存活率产生显著影响[13-15],但其影响机制尚不明晰,鲜有见菌存活率与水分含量、干燥温度相关性及最适干燥温度理论极值的研究报道。【拟解决的关键问题】本文旨在研究干燥温度、时间等条件对水分含量变化及菌存活率的影响,阐明酵母菌在热风干燥时快速死亡机制,明确干燥温度理论极值,建立酿酒酵母菌剂热风干燥过程等温干燥曲线及其存活率干燥动力学模型,研究干燥温度、水分含量与菌存活率的相关性,明确高活力酿酒酵母菌热风干制的关键控制点,为高活力酿酒酵母直投式发酵剂的研发提供理论与技术支持。
1. 材料与方法
1.1 菌株
酿酒酵母JH301:分离于红曲米,由福建省农产品(食品)加工重点实验室选育,保藏号:CCTCC M2015226[16]。
1.2 培养基
红曲糟多肽糖蜜培养基:参照苏昊等[17]的方法配置,用于酿酒酵母的培养。
孟加拉红培养基:市售,用于酿酒酵母计数。
1.3 仪器与设备
SPX-250BS-II生化培养箱,上海新苗医疗器械制造有限公司;YXQ-CS-50S II全自动立式压力蒸汽灭菌器,上海博达实业有限公司医疗设备厂;SW-CJ-1FD型单人单面净化工作台,苏州净化设备有限公司;UV-1750紫外可见分光光度计,苏州岛津仪器有限公司;FE28型pH酸度计,梅特勒-托利多;HH-8数显电热恒温水浴锅,常州亿通分析仪器制造有限公司;KRH-BPJ50微生物发酵罐,江苏科海生物工程设备有限公司;GQ142RZ管式离心机,绍兴市搏盛机械科技有限公司;XMGY1/250-U 隔膜式压滤机,大洋机械有限公司;AD500S-HCH-30型槽形混合机,常州市凯全干燥设备有限公司;ZL-150G型高效旋转式颗粒机,江阴市高宏机械制造有限公司;FG-15沸腾干燥机,江苏先锋干燥工程有限公司。
1.4 菌剂制备工艺流程
JH301活化→发酵罐发酵→离心取菌坭→加水重悬→调整菌悬液pH值→压榨收集菌坭→加保护剂搅拌→造粒→沸腾炉热风干燥→包装成品。
1.5 酵母菌的培养与造粒
将酿酒酵母JH301菌种接入红曲糟多肽糖蜜培养基,在(30±1) ℃培养24 h,获得种子液。将种子液以5%的接种量接入红曲糟多肽糖蜜培养基,于(25±1) ℃发酵18 h。发酵液在10000 g离心,取菌坭加10倍重量无菌水重悬,调节pH值至6.5±0.1,压滤机压榨,取菌坭添加一定量红曲糟多肽,混合均匀,60目筛网造粒,得到酵母菌颗粒。
1.6 酿酒酵母菌剂沸腾炉热风干燥工艺
将菌颗粒置于沸腾炉中,分别在40、45、50、55、60 ℃干燥一定时间。每间隔2 min取样检测菌剂水分含量和菌存活率等指标,绘制菌剂沸腾炉干燥过程等温干燥曲线;分析水分含量变化与菌存活率相关性,建立菌存活率干燥动力学模型;并采用核磁共振技术考察不同温度热风干燥过程水分分布的变化规律。
1.7 指标测定
1.7.1 酿酒酵母生物量
参照GB 4789.15—2016《食品卫生微生物学检验霉菌和酵母计数》[18]中的方法,采用平板计数法测定酵母菌生物量。
1.7.2 菌剂水分含量测定
参照GB 31639—2016《食品加工用酵母》[19]中的水分测定方法。
1.7.3 热风干燥过程菌存活率计算
Y/{\text{%}}=\frac{(100–{M}_{0})\times {G}_{t}}{(100-{M}_{{t}})\times {G}_{0}}\times 100 式中,Mt表示干燥t min后菌剂水分含量,g·hg−1;Gt表示干燥t min后菌剂生物量,cfu·g−1;M0干燥前湿菌坭水分含量,g·hg−1;G0干燥前湿菌坭生物量,cfu·g−1。
1.7.4 水分分布的测定
采用低频氢谱核磁共振仪测试干燥后酵母菌剂的水分弛豫时间,以评价各水分组成变化。称取1.00 g酵母菌粉于15 mm口径的核磁管中进行水分测试,采用CPMG程序系列测试。测试温度25 ℃,重复采样间隔时间为2500 ms,回波时间为0.1 ms,回波数量为6000,累计采样次数为8次。仪器记录下不同水分组分的信号强度,弛豫时间0~1 ms为结合水,弛豫时间1~100 ms为束缚水,弛豫时间100 ms以上为自由水[20]。
1.7.5 热风干燥过程结合水逃逸速率计算
S/(\mathrm{A}\mathrm{u}\cdot\mathrm{m}\mathrm{i}\mathrm{n}^{-1})=\frac{({X}_{0}-{X}_{{t}})}{{T}_{{t}}} 式中,Xt表示干燥t min后菌剂弛豫时间0~1 ms结合水强度,Au;X0表示湿菌坭弛豫时间0~1 ms结合水强度,Au;Tt表示干燥时间,min。
1.8 数据分析
采用R语言、DPS6.01、Origin等软件进行数据分析及绘图。
2. 结果与分析
2.1 酿酒酵母菌剂热风干燥等温干燥曲线
酵母菌颗粒在40 ℃、45 ℃、50 ℃、55 ℃、60 ℃下干燥,绘制酿酒酵母等温干燥曲线(图1)。不同温度沸腾炉热风干燥过程中,酵母菌剂水分含量均呈先快速下降后趋于平缓的趋势。酿酒酵母菌剂热风干燥等温干燥曲线符合Henderson指数函数模型[21] M=a×EXP(b×T),M代表水分含量(g·hg−1),T代表干燥时间(min),a、b均为与干燥温度W相关的常数。进一步拟合求解,得出a=−0.31W + 81.36(R2=0.968),b=−0.0094W + 0.27(R2=0.956)。对40 ℃、45 ℃、50 ℃、55 ℃、60 ℃下干燥曲线方程进行拟合验证,决定系数R2分别为0.987、0.972、0.967、0.978、0.982,说明该等温干燥曲线模型M=a×EXP(b×T)实测值与预测值均拟合较好,可用来反映酿酒酵母不同温度沸腾炉热风干燥过程水分含量的变化规律。
2.2 酵母菌存活率的热风干燥动力学
由图2可知,酿酒酵母沸腾炉热风干燥过程中,随着菌剂水分含量的下降,菌存活率呈先平缓下降后快速下降趋势,各温度干燥过程均存在菌存活率拐点水分阈值。在水分含量高于菌存活率拐点水分阈值的干燥期,菌存活率下降缓慢;在水分含量低于菌存活率拐点水分阈值的干燥期,菌存活率快速下降。以菌存活率拐点水分阈值为分界,菌存活率干燥动力学模型分别符合:y前= a前x+b前、y后= a后x+b后,其中y前、y后代表水分阈值前、后干燥期的菌存活率,a、b均为与温度W相关的常数。进一步通过拟合分析,可得a前= 0.014W+0.20(R2= 0.967)、b前=−0.90W+81.64(R2=0.983)、a后=0.36W−14.04(R2=0.989)、b后=−2.77W+159.40 (R2=0.995)。对各温度干燥动力学方程进行拟合验证,决定系数R2均达0.95以上,说明所建立的干燥动力学模型y前=a前x+b前和y后=a后x+b后的实测值与预测值均拟合较好,可用来反映系统内在规律。y前与y后的交叉点即为菌存活率拐点水分阈值,即当a前=a后时,不存在菌存活率拐点水分阈值,存在存活率拐点水分阈值最低干燥温度的理论值为41.2 ℃。
2.3 模型参数预测与验证
根据菌存活率干燥动力学及等温干燥曲线模型测算,不同干燥温度的酿酒酵母菌剂菌存活率及其拐点水分阈值预测值见表1。菌存活率拐点水分阈值(Y)、菌存活率(Z)、干燥时间(T)与干燥温度(W)的相关性分别符合模型Y=0.024W+3.86(R2=0.830)、Z=−0.81W+81.91(R2=0.999)、T=−0.80W+54.52(R2=0.873)。菌存活率拐点水分阈值均低于GB 31639—2016《食品加工用酵母》要求的5.5%。热风干燥过程干燥温度与菌存活率拐点水分阈值呈正相关,与菌存活率、干燥时间均呈负相关,因此选择最优干燥温度应为存在菌存活率拐点水分阈值的最低温度。理论最优干燥温度为41.2 ℃,干燥时间20.8 min,菌存活率49.03%。但考虑到干燥工艺温度会有±0.5 ℃的波动,因此选择干燥温度为42 ℃,根据等温干燥曲线模型测算,42 ℃条件下菌剂干燥至水分含量5.5%的干燥时间为19.7 min。试验通过采用42 ℃沸腾炉干燥20 min进行验证,此条件下干燥的菌剂水分含量为(5.24±0.12)%,菌存活率为(48.24±0.15)%,与菌存活率干燥动力学及等温干燥曲线模型预测值水分含量5.21%、菌存活率48.10%的差异均不显著(P>0.05)。
表 1 不同干燥温度菌存活率拐点水分阈值的模型预测值Table 1. Predicted water threshold at inflection point on kinetic equations of S. cerevisiae survival rate under different drying temperatures干燥温度
Temperature/℃干燥时间
Time/min菌存活率拐点水分阈值
Water threshold inflection
point of survival
rate of strains/%菌存活率
Survival rate
of strains/%60 8.3 5.28 33.22 55 10.0 5.25 37.35 50 12.5 5.17 41.44 45 16.7 4.90 45.37 42 23.9 3.15 46.42 2.4 不同温度热风干燥过程酵母菌细胞水分分布的变化
采用核磁共振技术,考察酵母菌沸腾炉干燥过程与菌存活率拐点水分阈值最接近的3个取样时间点的菌剂水分迁移分布变化规律,结果见图3,横坐标代表横向弛豫时间,它表征水分流动性,弛豫时间值越小代表该水分的流动性越小,与菌细胞结合越紧密[22,23];计算酵母菌剂热风干燥过程结合水(0~1 ms)、束缚水(1~100 ms)和自由水(100 ms以上)的强度变化[20],结果见表2。在沸腾炉热风干燥过程中,随着菌剂水分含量的下降,结合水、束缚水和自由水均呈下降趋势。在水分含量高于菌存活率拐点水分阈值的干燥期,菌剂水分含量较高,干燥过程逃逸的水分主要为自由水、部分的束缚水;在水分含量低于菌存活率拐点水分阈值的干燥期,自由水、束缚水含量处于较低水平,干燥逃逸的水分主要为结合水。45 ℃、50 ℃、55 ℃、60 ℃干燥12 min时的结合水逃逸速率分别为0.02、49.62、83.79、96.15(Au·min−1),可见干燥温度越低,结合水逃逸速率越慢,菌存活率越高;干燥温度越高,结合水逃逸速率越快,菌存活率越低。结果表明,在酵母菌剂热风干燥过程中,细胞结合水的逃逸速率与菌存活率负相关,是菌快速死亡的主要影响因素。
表 2 热风干燥过程酵母菌剂理化指标的变化Table 2. Changes on physiochemical indices of S. cerevisiae during hot air dehydration干燥温度
Temperature/℃干燥时间
Time/min水分含量
Moisture
content/%结合水含量
Combined
water content/Au束缚水含量
Bound water
content/Au自由水含量
Free water
content/Au菌存活率
Survival rate of
strains/%结合水逃逸速率
Escape rate of
combined water/(Au·min−1)45 12 7.33±0.12 1649.06±25.34 700.02±36.82 369.41±5.47 49.72±0.32 0.02±0.00 14 5.31±0.36 1255.67±38.63 947.65±38.03 267.42±15.25 46.12±0.06 28.11±2.15 16 4.40±0.06 1087.21±23.44 911.21±45.45 229.07±25.51 42.01±0.06 35.13±2.18 50 10 8.30±0.24 1634.83±15.85 457.72±15.19 239.38±23.99 45.06±0.00 1.44±0.01 12 4.96±0.18 1053.79±43.64 982.08±42.74 198.16±28.16 41.00±0.16 49.62±0.73 14 4.17±0.06 761.07±25.34 934.04±28.51 158.20±21.35 36.02±0.32 63.44±1.15 55 8 9.84±0.12 1627.97±37.44 777.24±13.28 298.61±23.34 40.89±0.32 2.66±0.10 10 5.29±0.06 933.68±33.68 859.06±35.46 264.82±17.13 37.31±0.06 71.56±1.12 12 3.95±0.06 643.76±12.77 850.28±35.31 123.76±12.33 29.74±0.32 83.79±1.03 60 8 6.55±0.18 1197.14±15.31 806.91±18.64 260.68±10.65 38.17±0.06 56.52±2.12 10 4.63±0.18 844.76±22.19 980.59±22.11 186.94±5.34 30.68±0.18 80.45±3.05 12 3.76±0.06 495.51±5.34 1047.06±15.12 158.90±25.11 23.42±0.18 96.15±1.12 CK 0 60.97±0.06 1649.27±18.83 5471.2±35.15 6788.8±38.34 100±0.00 3. 讨论与结论
酵母菌剂常用的干燥方法有冷冻干燥、喷雾干燥、沸腾炉干燥等。冷冻干燥技术菌存活率较高,通常在90%以上[6],但存在生产成本较高、干燥时间较长等缺点[5, 24]。热风干燥技术虽然干燥成本较低,但干燥过程中温度和时间会对菌存活率产生较大影响。本研究在45~60 ℃条件下干燥30 min,菌存活率均低于25%。已有学者通过研究适宜热风干燥工艺、筛选适宜干燥保护剂,提高了热风干燥菌存活率[7-8,13-15],最高可达90%以上[9]。因此综合考虑成本和菌存活率,酿酒酵母适宜的干燥方式为热风干燥。
虽然国内外学者已有针对热风干燥工艺的诸多报道,但酵母菌在热风干燥时快速死亡机制尚不明晰,适宜干燥温度的理论极值也未见报道。本文建立了酿酒酵母热风干燥过程菌存活率干燥动力学模型:y前=a前x+b前、y后=a后x+b后,发现酿酒酵母热风干燥过程中,随着菌剂水分含量的下降,菌存活率呈先平缓下降后快速下降趋势,存在菌存活率拐点水分阈值(y前与y后的交点)。在水分含量高于菌存活率拐点水分阈值的干燥期,菌剂水分含量较高,干燥逃逸的水分主要为自由水、束缚水,干燥过程菌存活率缓慢下降,结合水含量几乎没有变化;在水分含量低于菌存活率拐点水分阈值的干燥期,此时自由水和束缚水含量较低,干燥逃逸的水分主要为结合水,干燥过程菌存活率快速下降。结合水是酵母菌细胞膜的主要水分,与构成细胞膜的生物大分子(如蛋白质、多糖等)具有较强的相互作用,结合得非常紧密[25,26]。本研究结果表明,细胞结合水的逃逸速率与菌存活率负相关,这与菌细胞脱结合水会引起膜的流动性的改变、破坏蛋白质与水分子、细胞膜之间的相互作用力有关,导致维持蛋白质正常三级结构的作用力减弱,从而引起蛋白质构象发生改变从而丧失功能[27];同时菌细胞脱水会引起细胞膜的脂质氧化,使细胞膜结构和稳定性发生变化[28],致使菌体快速死亡。因此,在热风干燥过程中,应选择较低的温度,并控制菌剂最终水分含量在菌存活率拐点水分阈值与国标要求的5.5%之间,以使菌剂保持较高的菌存活率。本研究通过对酿酒酵母菌剂等温干燥曲线及其存活率干燥动力学的测算,明确菌存活率拐点水分阈值的最低干燥温度理论值为41.2 ℃。通过对模型参数预测与验证,最终确定酿酒酵母菌剂热风干燥适宜的干燥温度为42 ℃,时间为20 min,菌剂水分含量为(5.24±0.12)%,菌存活率可达(48.24±0.15)%。
本研究结果明确细胞结合水的逃逸速率与菌存活率负相关,是菌快速死亡的主要影响因素。在实际生产中可通过添加抑制结合水干燥逃逸保护剂[4]、调控热风干燥过程酿酒酵母结合水的逃逸速率,减缓细胞膜热胁迫损伤,提高菌存活率[29]。
-
表 1 供试芽胞杆菌菌株
Table 1 Bacillus strains tested
序号 供试菌株数量 学名 中文名称 属名 1 1 Aneurinibacillus aneurinilyticus 解硫胺素硫胺素芽胞杆菌 解硫胺素芽胞杆菌 2 1 Aneurinibacillus migulanus 米氏解硫胺素芽胞杆菌 解硫胺素芽胞杆菌 3 1 Bacillus acidiceler 酸快生芽胞杆菌 芽胞杆菌属 4 1 Bacillus alcalophilus 嗜碱芽胞杆菌 芽胞杆菌属 5 4 Bacillus amyloliquefaciens 解淀粉芽胞杆菌 芽胞杆菌属 6 10 Bacillus anthracis 炭疽芽胞杆菌 芽胞杆菌属 7 4 Bacillus aryabhattai 阿氏芽胞杆菌 芽胞杆菌属 8 1 Bacillus azotoformans 产氮芽胞杆菌 芽胞杆菌属 9 1 Bacillus badius 栗褐芽胞杆菌 芽胞杆菌属 10 1 Bacillus butanolivorans 食丁酸芽胞杆菌 芽胞杆菌属 11 1 Bacillus cecembensis 科研中心芽胞杆菌 芽胞杆菌属 12 1 Bacillus cellulosilyticus 解纤维素脂环酸芽胞杆菌 芽胞杆菌属 13 2 Bacillus cereus 蜡样芽胞杆菌 芽胞杆菌属 14 1 Bacillus cibi 食物芽胞杆菌 芽胞杆菌属 15 1 Bacillus circulans 环状芽胞杆菌 芽胞杆菌属 16 12 Bacillus clausii 克劳芽胞杆菌 芽胞杆菌属 17 1 Bacillus coagulaus 凝结芽胞杆菌 芽胞杆菌属 18 1 Bacillus endophyticus 内生芽胞杆菌 芽胞杆菌属 19 1 Bacillus firmus 坚强芽胞杆菌 芽胞杆菌属 20 2 Bacillus fordii 福氏芽胞杆菌 芽胞杆菌属 21 1 Bacillus ginsengihumi 人参土芽胞杆菌 芽胞杆菌属 22 1 Bacillus hemicellulosilyticus 解半纤维素芽胞杆菌 芽胞杆菌属 23 1 Bacillus indicus 印度芽胞杆菌 芽胞杆菌属 24 1 Bacillus isronensis 印空研芽胞杆菌 芽胞杆菌属 25 1 Bacillus koreensis 韩国芽胞杆菌 芽胞杆菌属 26 1 Bacillus lehensis 列城芽胞杆菌 芽胞杆菌属 27 10 Bacillus licheniformis 地衣芽胞杆菌 芽胞杆菌属 28 1 Bacillus megaterium 巨大芽胞杆菌 芽胞杆菌属 29 2 Bacillus methylotrophicus 甲基营养型芽胞杆菌 芽胞杆菌属 30 1 Bacillus novalis 休闲地芽胞杆菌 芽胞杆菌属 31 1 Bacillus plakortidis 海绵芽胞杆菌 芽胞杆菌属 32 1 Bacillus.flexus 弯曲芽胞杆菌 芽胞杆菌属 33 2 Fictibacillus barbaricus 奇异虚构芽胞杆菌 虚构芽胞杆菌属 表 2 产N-羟基戊巴比妥芽胞杆菌
Table 2 N-hydroxyamobarbital-producing Bacillus strains
序号 菌株名称 菌株编号 保留时间
/min匹配度 相对含量
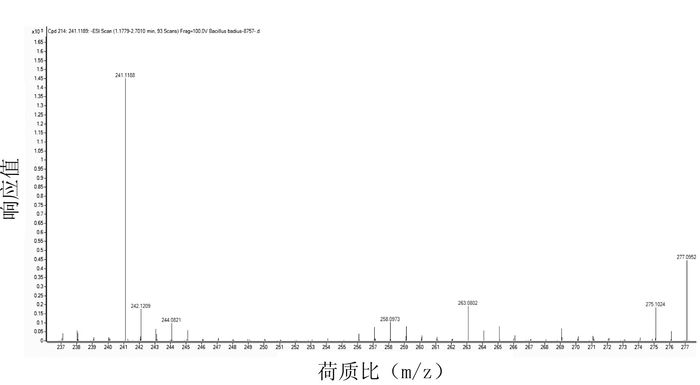
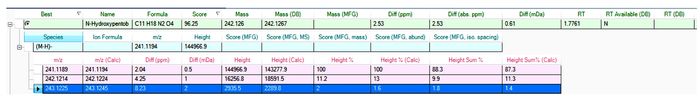
/%精确分子量 质核比 CAS 1 栗褐芽胞杆菌 FJAT-8757 1.7761 96.25 6.04 242.1260 241.1189 62298-51-5 2 内生芽胞杆菌 FJAT-10010 1.7759 94.33 4.85 242.1257 241.1186 62298-51-5 3 米氏解硫胺素芽胞杆菌 FJAT-14205 1.6689 96.72 1.61 242.1269 241.1198 62298-51-5 4 休闲地芽胞杆菌 FJAT-14227 1.6630 94.91 1.61 242.1276 241.1204 62298-51-5 -
[1] TANG B K, INABA T, KALOW W. N-Hydroxylation of pentobarbital in man[J]. Drug Metab Dispos, 1977, 5(1):71-74. https://www.ncbi.nlm.nih.gov/pubmed/13978/
[2] KALOW W, KADAR D, INABA T, et al. A case of deficiency of N-hydroxylation of amobarbital[J]. Clin Pharmacol Ther, 1977, 21(5):530-535. DOI: 10.1002/cpt.1977.21.issue-5
[3] SAKA K, UEMURA K, SHINTANI-ISHIDA K, et al.Determination of amobarbital and phenobarbital in serum by gas chromatography-mass spectrometry with addition of formic acid to the solvent[J]. J Chromatography B, 2008, 869:9-15. DOI: 10.1016/j.jchromb.2008.05.004
[4] 张博, 马淑涛异戊巴比妥的杂质研究和化学合成[J].山东化工, 2011, (40):6-8. http://www.wenkuxiazai.com/doc/8b7c6eb3453610661ed9f4f9.html [5] 陈立新, 谢治民, 谭年元.巴比妥类药物的极谱分析方法[J].湖南工程学院学报, 2009, 19(3):60-63. http://www.cnki.com.cn/Article/CJFDTotal-GCHZ200903020.htm [6] 张海棠, 王自良, 王艳荣.苯巴比妥在动物生产中的非法使用及毒性作用[J].山西农业科学, 2008, 36(4):29-31. http://d.wanfangdata.com.cn/Periodical/shanxnykx200804011 [7] HAIXIANG ZHAO, LIPING WANG, YUEMING QIU, et al. Simultaneous determination of three residual barbiturates in pork using accelerated solvent extraction and gas chromato-graphymass spectrometry[J]. Journal of Chromatography B, 2006, 840:139-145. DOI: 10.1016/j.jchromb.2006.05.002
[8] 周天红.高效液相法测定新复方大青叶片中异戊巴比妥的检测[J].中国医疗前沿, 2008, 3(2):102-103. http://www.cqvip.com/QK/88918X/200811/30145887.html [9] 胡陈云, 李勇, 刘敏, 等.枯草芽孢杆菌ge25对两种人参病原菌的抑制作用及脂肽类抑菌代谢产物的鉴定[J].中国生物防治学报, 2015, 31(3):386-393. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zswf201503014&dbname=CJFD&dbcode=CJFQ [10] 郑梅霞, 陈峥, 刘波, 等.产鸭嘴花酚碱芽胞杆菌的筛选[J].福建农业学报, 2017, 32(1):63-67. http://www.fjnyxb.cn/CN/abstract/abstract3099.shtml [11] 郑雪芳, 陈峥, 刘波, 等.高效液相色谱/四级杆飞行时间质谱法筛选产溶血磷脂酸芽胞杆菌[J].福建农业学报, 2016, 31(11):1252-1256. http://www.fjnyxb.cn/CN/abstract/abstract3066.shtml [12] 陈德局, 陈峥, 陈小强, 等.基于液相色谱/四极杆飞行时间质谱的产ATPA的芽胞杆菌筛选[J].氨基酸和生物资源, 2016, 38(4):37-41. http://www.cqvip.com/QK/71822X/201602/668272219.html [13] 陈峥, 刘波, 朱育菁, 等.基于液相色谱/四极杆飞行时间质谱的产非蛋白质氨基酸-今可豆氨酸芽胞杆菌筛选[J].食品安全质量检测学报, 2015, (10):4121-4128. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=spaj201510059&dbname=CJFD&dbcode=CJFQ [14] 曾东.苯巴比妥、托吡酯片、丙戊酸钠治疗小儿癫痫的疗效及预后评价[J].中国实用医药, 2015, 10(24):123-124. http://d.wanfangdata.com.cn/Periodical/zgsyyy201524088 [15] 张仁祥, 陈淑萍, 马广明.苯巴比妥方案对治疗惊厥性癫痫患者的疗效观察[J].医学理论与实践, 2012, 25(10):1182-1183. DOI: 10.3969/j.issn.1001-7585.2012.10.022 [16] AKMAN C I, MICIC V, QUACH M, et al. Application of envelope trend to analyze early EEG changes in the frontal regions during intracarotid amobarbital procedure in children[J]. Epilepsy Behav, 2015, 43:66-73. DOI: 10.1016/j.yebeh.2014.08.011
[17] TROTTA N, GOLDMAN S, LEGROS B, et al. Metabolic evidence for episodic memory plasticity in the nonepileptic temporal lobe of patients with mesial temporal epilepsy[J]. Epilepsia, 2011, 52(11):2003-2012. DOI: 10.1111/epi.2011.52.issue-11
[18] 张冬梅, 陈嫒, 王蓉, 等.益生菌治疗化疗相关性腹泻的前瞻性研究[J].临床消化病杂志, 2013, (1):20-22. http://www.wenkuxiazai.com/doc/ce43c489f90f76c660371a15.html [19] 王秀华, 赵红立, 周慧, 等.凝结芽孢杆菌活菌片预防小儿肺炎继发性腹泻疗效观察[J].中国微生态学杂志, 2012, 24(6):534-536. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zgws201206018&dbname=CJFD&dbcode=CJFQ [20] 张正帆, 郭春华, 彭忠利, 等.益生菌在养猪业中的应用进展[J].西南民族大学学报:自然科学版, 2015, 41(2):160-165. http://www.wenkuxiazai.com/doc/3e089dd6a8114431b90dd8d5.html -
期刊类型引用(0)
其他类型引用(1)







 下载:
下载: