Pathogen and Control Agent Gray Mold Disease on Anoectochium roxborghil
-
摘要:目的
明确金线兰(Anoectochilus roxburghii)灰霉病的病原菌,了解其对不同金线兰种质的致病力,并筛选出适宜防治效果的杀菌剂,为其田间防治提供指导。
方法采用组织分离法对金线兰灰霉病病原菌进行分离纯化;通过形态学结合ITS、G3PDH、HSP60与RPB2序列进化树分析鉴定其分类;通过在不同温度以及接种不同金线兰及其他兰科种质分析其致病力;采用菌丝生长速率法筛选高效杀菌剂。
结果从三明市农业科学研究院的金线兰植株获得致病性最强的菌株A2C-1-1,接种株发病症状与田间一致。经形态学鉴定与进化树分析显示,A2C-1-1与Botrytis cinerea B05.10一致性达100%,鉴定为灰葡萄孢B. cinerea。该菌可侵染福建的主要金线兰栽培种,在25 ℃下致病力最强,其中金线兰红霞、德化野生金线兰病情指数较高,台湾银线兰与金线兰尖叶种病情指数较低,而其他兰科植物中铁皮石斛、南茜文心兰表现较强抗性,病情指数均为23.33,姬蝴蝶兰和建兰表现较弱抗性,病情指数分别为70.00和73.33。药剂筛选结果表明,氟硅唑和氟啶胺对金线兰灰霉病病原菌的抑制作用最强,其EC50值为2.624×10−20 g·L−1和1.000×10−15 g·L−1。
结论金线兰灰霉病由灰葡萄孢侵染引起。A2C-1-1菌株可侵染福建主要的金线兰栽培种和其他兰科植物,氟硅唑对该菌有较强抑制作用。
Abstract:ObjectivePathogen of and effective germicide for controlling the gray mold disease on Anoectochium roxborghil were identified.
MethodThe tissue isolation method was applied to isolate pathogenic microbes. Based upon morphological observations and phylogenetic tree analysis on the sequences of ITS , G3PDH, HSP60, and RPB2, the isolates were classified. Pathogenicity and application conditions of germicides on various A. roxborghil germplasms were determined based on the hyphal growth rate of the isolates under the treatments.
ResultsA2C-1-1 inoculated on an A. roxborghil plant at Sanming Academy of Agricultural Sciences showing identical disease symptoms in the field had the greatest pathogenicity of all pathogens isolated. The morphology and phylogenetic tree of the stain perfectly matched those of B. cinerea B05.10. It could infect the main cultivars of A. roxborghil in Fujian with the strongest pathogenicity at 25 ℃. Among various germplasms, Clematis chinensis Hongxia and C. dehuaensis displayed high disease indices, while Gladiolus taiwanensis and Orchid chinensis low; and Dendrobium officinale and O. Wenxinensis more resistant with disease indices of 23.33 and 23.33, respectively, while Phalaenopsis chinensis and O. Jianlan slightly resistant with disease indices of 70.00 and 73.33, respectively. Of the fungicides tested, flusilazole EC and fluridimide suspension exhibited the most significant inhibitory effect on B. cinerea with EC50 of 2.624×10−20g·L−1 and 1.000×10−15g·L−1, respectively.
ConclusionThe grey mold disease on A. roxborghil was confirmed to be caused by B. cinerea A2C-1-1. The strain could infect the main A. roxborghil cultivars as well as other orchid species in Fujian. Flusilazole EC appeared to be effective for treating the disease.
-
Keywords:
- Anoectochilus roxburghii /
- grey mold disease /
- identify /
- Botrytis cinerea /
- fungicides
-
0. 引言
【研究意义】 金线莲为兰科(Orchid)花叶开唇兰属(Anoectochilus)金线兰(Anoectochium roxburghii)及其近缘种植物的统称,为多年生草本植物,在福建民间为传统用药,有“药王”之称[1, 2],在我国福建、浙江、贵州以及台湾等地区广泛种植[3]。金线兰对生长环境有着严苛的要求,在人工栽培的实践中,营养水平、光照条件及温度等因素的变化,易诱发一系列真菌性病害,包括白绢病、灰霉病和茎腐病等[2]。在这些病害中,灰霉病是为害程度较高的病害之一,它能够导致金线兰的叶片腐烂,茎部萎缩,甚至引起植株倒伏。一旦病害发生,其蔓延速度极快,易给金线兰生产带来巨大的经济损失[4]。因此,灰霉病病原菌的鉴定及防治已成为金线兰产业亟需解决的问题。【前人研究进展】此前,已在广东省[4]、云南省[5]以及福建省[6]的金线兰灰霉病发病植株中分离到灰葡萄孢(Botrytis cinerea)。灰葡萄孢具有广泛的寄主范围,且能通过空气传播,其致病性强,能在短时间内引发植物大规模病害,对植物的生长产生显著影响[5] 。【本研究切入点】目前国内虽对金线兰灰霉病有少量报道,但其对金线兰不同种质及不同气候条件下的致病性分析,以及针对该菌的有效防治药剂尚有待进一步研究。【拟解决的关键问题】 通过分离金线兰灰霉病病原菌,采用形态学观察结合基于rDNA-ITS、G3PDH、HSP60及RPB2多基因序列分析的系统发育树构建方法,旨在明确引起金线兰灰霉病的病原菌分类学地位,筛选出有效的防治药剂,为金线兰灰霉病有效防控提供参考依据。
1. 材料与方法
1.1 试验材料
1.1.1 供试病株
金线兰灰霉病病样于2024年2月采集自三明市农业科学研究院药用植物研究所金线兰温室(26°23′11″N, 117°50′53″E,海拔146.2 m)。
1.1.2 供试植株
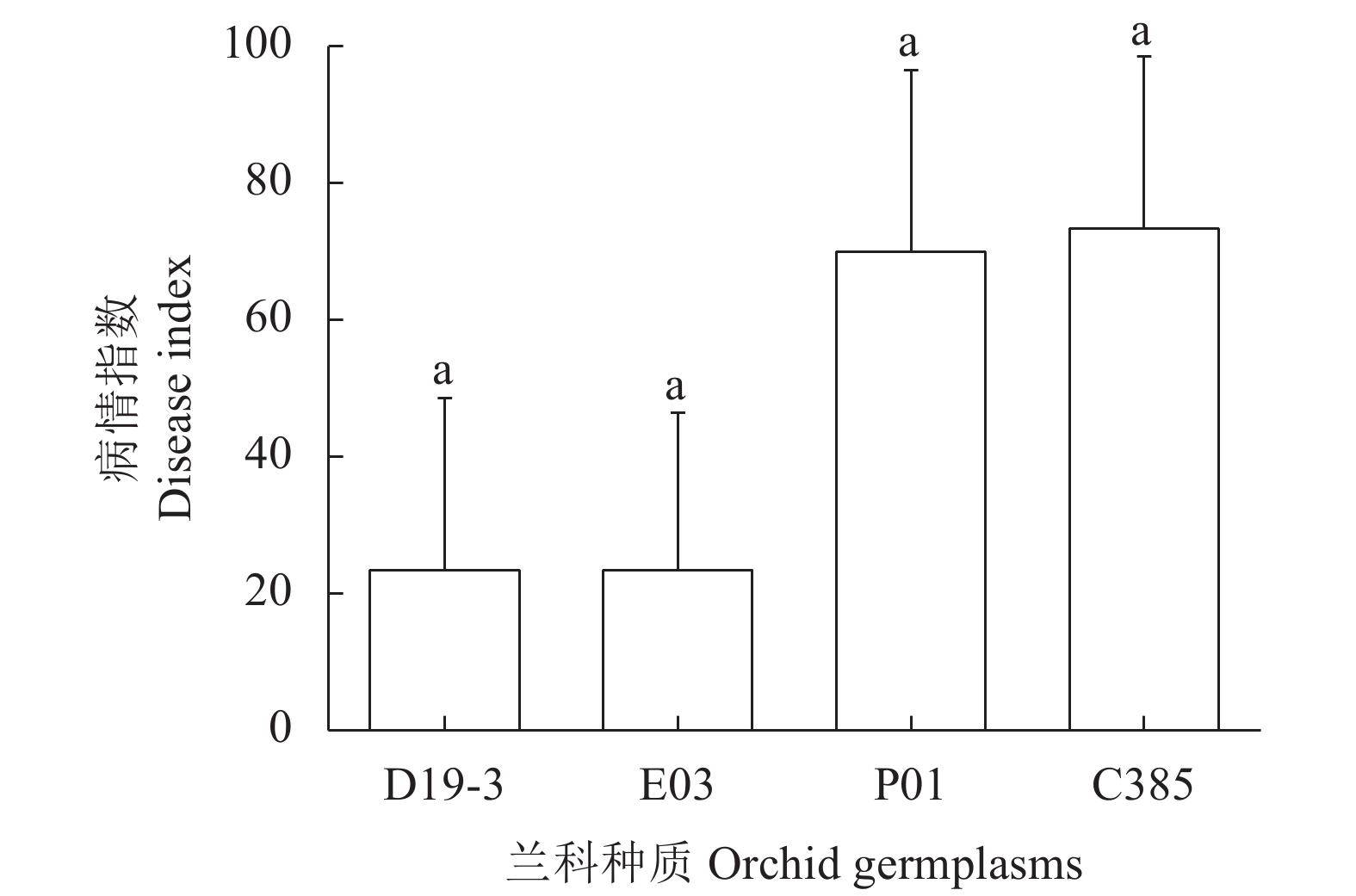
台湾银线兰(Anoectochilus formosanus) (种质保存号:A17E-1)、金线兰尖叶种(Anoectochilus roxburghii ‘Jianye’)(种质保存号:A23)、金线兰红霞(Anoectochilus roxburghii ‘Hongxia’)(种质保存号:A56)、德化野生金线兰(A.roxburghii ‘Dehua’)(种质保存号:A47)、铁皮石斛(Dendrobium officinale)(种质保存号:D19-3)、南茜文心兰(Oncidium 'Gower Ramsey')(种质保存号:E03)、姬蝴蝶兰(Phalaenopsis equestris)(种质保存号:P01)、建兰(Cymbidium ensifolium)(种质保存号:C385),均保存于三明市农业科学院药用植物研究所。
1.1.3 供试培养基
根据文献[7]配制马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA),用于金线兰灰霉病病菌的分离培养。
1.1.4 供试药剂
99%噁霉灵(hymexazol)原药(青岛鑫润生物科技有限公司);96.5 %咪鲜胺(prochloraz)原药(辉丰农化股份有限公司);94.5%氟啶胺(fluazinam)原药(利尔化学股份有限公司);95%氟硅唑(flusilazole)原药(四川国光农化股份有限公司);90%乙蒜素(ethylicin)原药(海南正业中农高科股份有限公司);95%嘧菌酯(azoxystrobin)原药(北京颖泰康有限公司);90.5%代森锰锌(mancozeb)原药(江苏辉丰农化股份有限公司)。
1.2 试验方法
1.2.1 病原菌分离与纯化
参照文献[8],采用组织分离法分离病原菌。选取带病斑的金线兰植株,于病健交界处剪取0.5 cm2组织块,经75%乙醇处理15 s后,用无菌水冲洗3次,再置于0.01%升汞溶液中10 min,最后用无菌水冲洗3次。将组织块取出置于无菌滤纸上吸干表面水分,接种至无菌苗植株于 25 ℃、2 000 lx,光周期14 L∶10 D的条件下培养持续观察5~7 d。当组织出现病症,再从病健交界处挑选新的组织块,接种至 PDA 培养基,在25 ℃黑暗条件下继续培养3~5 d,从培养基的边缘挑取菌丝进行纯化培养,直至获取性状稳定、单一的菌株。金线兰无菌苗的诱导与继代方法参照文献[9]。纯化的病原菌在4 ℃条件下保存,备用。
1.2.2 病原菌的致病性测定
为验证病原菌致病力,依据柯赫氏法则,选取金线兰植株健康叶片茎段组织作材料。用无菌枪头对组织造伤,菌丝块进行侵染,以无菌PDA培养基块作对照。25 ℃下培养7 d,观察结果与田间自然发病症状比对。
1.2.3 病原菌的形态学鉴定
参照文献[8],将纯化后的菌株置于25 ℃黑暗条件下培养7 d,使用显微镜(Olympus BX53)拍照记录菌丝和孢子的形态特征。
1.2.4 病原菌的分子生物学鉴定
参照文献[8],采用十六烷基三甲基溴化铵 (cetyltrimethylammonium Bromide, CTAB)法提取纯化后的菌株总DNA。以获得的基因组DNA为模板,通过设计特异性引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[10]、G3PDH-F(5′-ATTGACATCGTCGCTGTCAACGA-3′)/G3PDH-R(5′-ACCCCACTCGTTGTCGTACCA-3′)[11]、HSP60-F(5′-CAACAATTGAGATTTGCCCACAAG-3′)/HSP60-R(5′-GATGGATCCAGTGGTACCGAGCAT-3′)[12]和RPB2-F(5′-GATGATCGTGATCATTTCGG-3′)/RPB2-R(5′-CCCATAGCTTGCTTACCCAT-3′)[13]分别扩增rDNA-ITS、G3PDH、HSP60和RPB2的基因序列。PCR反应体系:9.5 μL的2×Taq预混液,1 μL的上游引物和1 μL的下游引物(浓度10 μmol·L−1),1 μL的菌株DNA模板,用双蒸水补充至总体积25 μL。PCR反应条件:94 ℃预变性5 min; 94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃下终延伸10 min。PCR扩增得到的产物经1%琼脂糖凝胶电泳,回收目的片段委托铂尚生物技术有限公司进行测序。测序结果通过BLAST进行比对分析,并将结果上传至数据库。利用MEGA 11.0软件的Neighbor-joining法构建系统发育树。
1.2.5 病原菌的致病性分析
为了研究不同温度对金线兰灰霉病病菌生长的影响,将直径为6 mm的新鲜菌饼置于PDA平板的中央,在5、10、15、20、25、30、35 ℃的梯度温度条件下培养7 d,每处理均重复4次。采用十字交叉法测量菌落直径。
在不同温度梯度下对不同金线兰和兰科种质进行侵染试验,观察灰霉病病菌在不同种质金线兰上的侵染过程。观察菌丝对叶片或茎段的影响,采用针刺或不针刺处理,置于7个温度梯度下培养7 d,以无菌水作对照,设3次重复。并通过拍照和计算病情指数的方式进行分析。病情指数的计算基于病斑与叶面积的比值, 0级:全叶无病斑;1级:病斑面积占叶面积的10%以下;2级:病斑面积占叶面积的11%~20%;3级:病斑面积占叶面积的21%~30%;4级: 病斑面积占叶面积的31%~40%;5级:病斑面积占叶面积的41%~50%;6级:病斑面积占叶面积的51%~60%;7级:病斑面积占叶面积的61%~70%;8级:病斑面积占叶面积的71%~80%;9级:病斑面积占叶面积的81%~90%;10级:病斑面积占叶面积的90%以上;病情指数=[∑(各级病叶数×相应病级数值)/调查总叶数×10]×100。
1.2.6 防治药剂筛选
为评估8种杀菌剂对病原菌A2C-1-1的室内毒力,采用菌丝生长速率法进行毒力测定试验。根据预设的配比,将各供试药剂加入PDA培养基中,以制备出具有不同药物浓度的培养平板。而后在每个平板的中央接种直径为6 mm的新鲜菌饼,并设置无药剂添加的空白PDA平板作为参照,设3次重复。在25 ℃条件下对这些平板进行3 d的培养,采用十字交叉法测量菌落的直径,计算抑菌率[14]。抑菌率/%=[(空白对照菌落半径−药剂处理菌落半径)/空白对照菌落半径]×100。
通过设定杀菌剂浓度的对数值为自变量x,以及抑菌率的概率值为因变量y,得出每种药剂的毒力回归方程y=a+bx,将 y=0.5(抑制率为50%的概率值)代入各毒力方程求出 x,x的对数即EC50。
2. 结果与分析
2.1 金线兰灰霉病病原物病况
于三明市农业科学研究院金线兰温室获得金线兰灰霉病发病植株。灰霉病主要危害金线兰的叶片和茎基部。发病初期叶片表面或边缘出现水渍状圆形病斑,病斑周围叶片组织褪绿而呈红色或粉红色。而茎部发病初期为水渍状,之后病部溢缩变软(图1)。
2.2 金线兰灰霉病病原菌分离与致病性测定
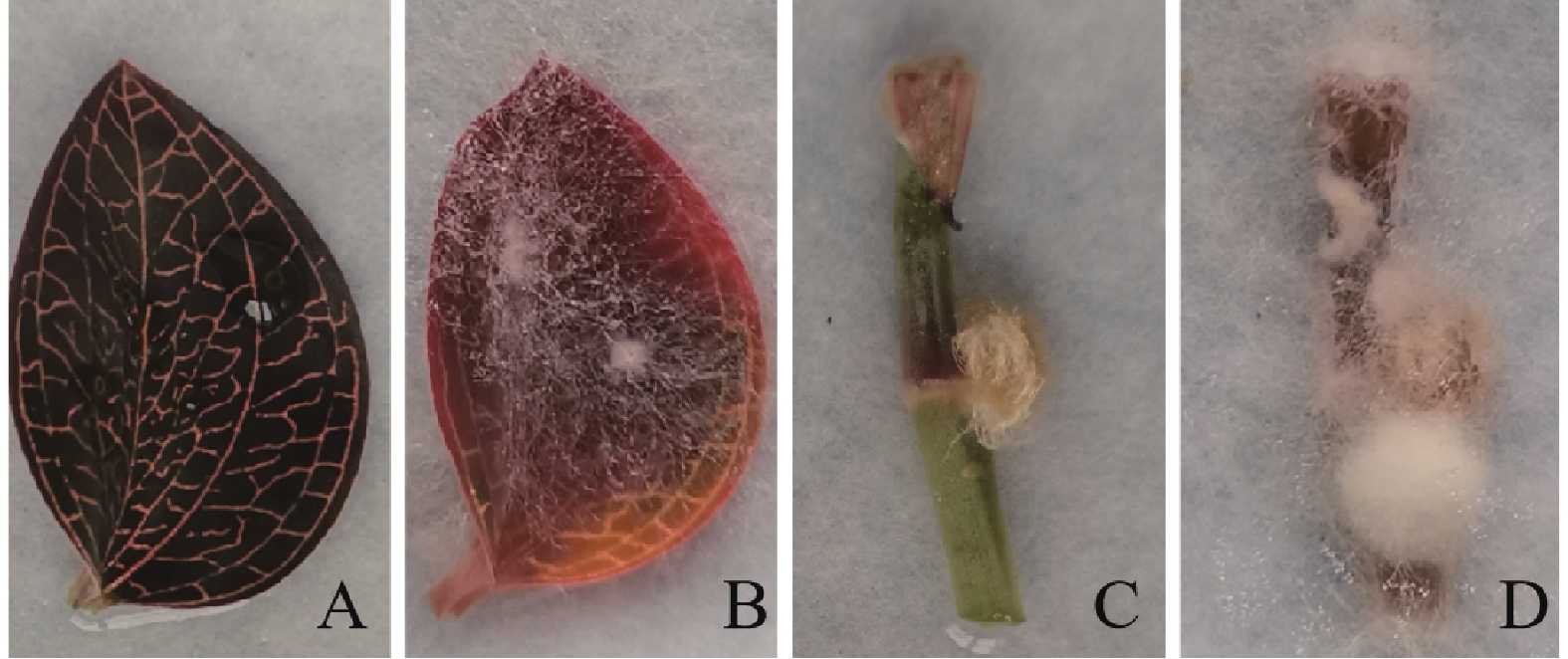
将分离出的金线兰灰霉病病原菌于无菌条件下接种于针刺无菌叶片与茎部表面,接菌7 d后,金线兰叶片和茎段有水渍及褐化病斑,菌丝出现并发生腐烂;15 d后金线莲植株明显溢缩,病斑扩大,茎叶变软并腐烂,病斑处有灰霉层。与初次发现金线莲病株症状一致,而对照没有出现类似症状,符合柯赫氏法则。将病健结合部位的组织块于PDA培养基,经纯化培养获得A2C-1-1菌株(图2)。
2.3 金线兰灰霉病病原菌的鉴定
2.3.1 病原菌的形态学鉴定
将分离纯化后的A2C-1-1菌株进行接种观察,培养3 d后,菌落呈现白色并呈放射状扩展,其菌丝半透明且分布稀疏;培养7 d后菌落中央逐渐转为灰褐色,并出现黑色菌核(图3A、B)。进一步通过显微镜观察,发现该菌株的菌丝具有隔膜并存在分支,同时观察到分生孢子梗丛生并呈现分支形态;此外,分生孢子则簇生于分生孢子梗的顶端,其形态为卵圆形(图3C~F)。这些形态特征与灰葡萄孢较为一致。
2.3.2 病原菌的分子生物学鉴定
扩增菌株A2C-1-1的ITS、G3PDH、HSP60和RPB2基因,获得的序列片段大小依次为700、
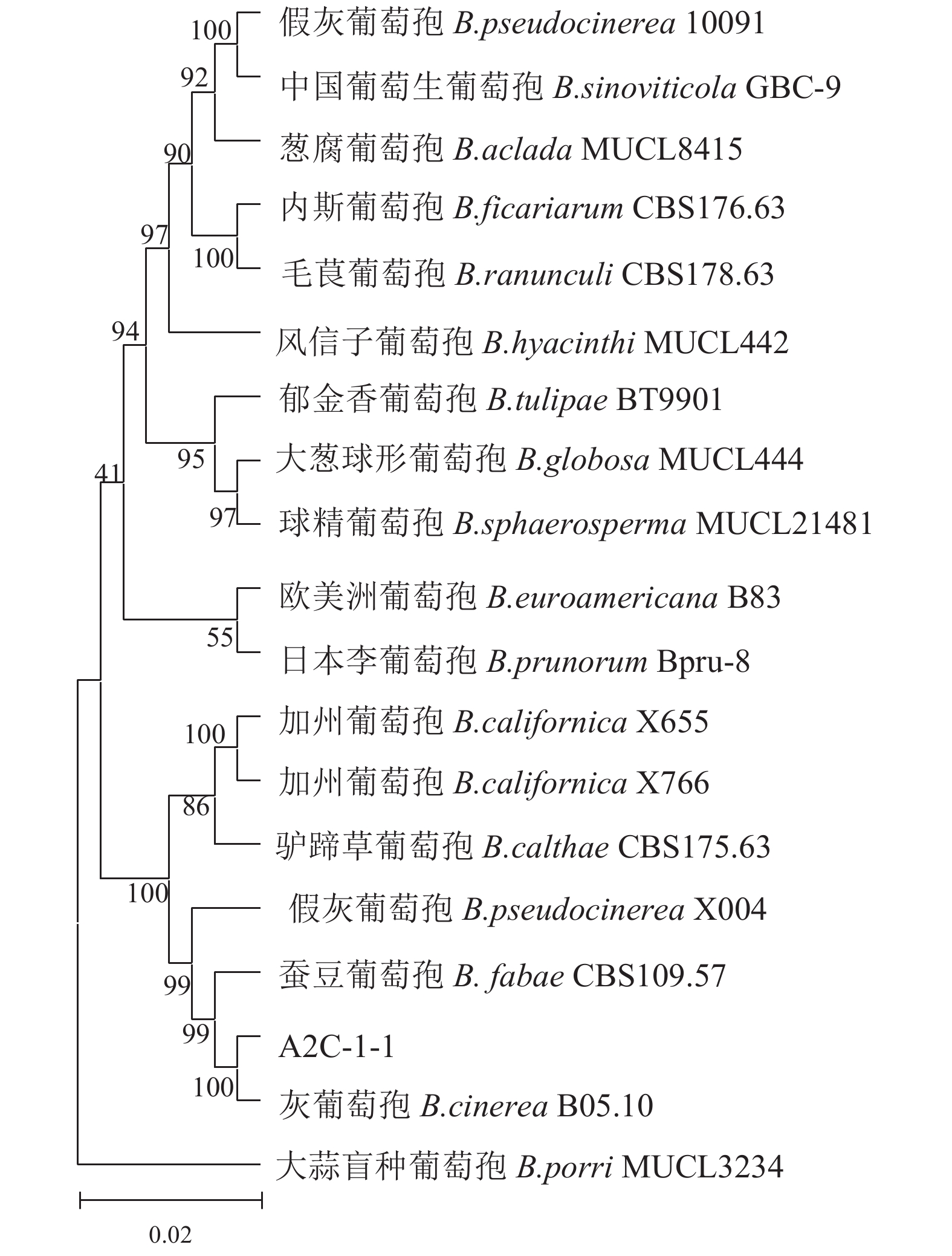
1000 、1200 、1500 bp,NCBI GenBank登录号分别为PP762057、PP779728、PP779729和PP785399,利用BLAST对上述4种基因进行最佳匹配,结果显示,4种基因序列均能在灰葡萄孢的不同株系找到高度相似的匹配,其中RPB2基因在白及(Bletilla striata)寄主的灰葡萄孢菌BSFC-7株系找到完全一致的匹配序列,显示了极高的序列保守性;ITS和G3PDH基因分别在草莓(Fragaria ananassa)和荞麦(Fagopyrum tataricum)的灰葡萄孢菌寄主中找到将近一致的匹配序列,一致性分别为99.59 %和99.69 %;HSP60基因在沉香(Aquilaria sinensis)寄主的灰葡萄孢菌中找到显著匹配的序列,一致性为91.98 %(表1)。在NCBI数据库进行BLAST比对,进一步构建了基于ITS、G3PDH、HSP60以及RPB2基因联合序列的系统发育树(图4)。结果表明,A2C-1-1均与已知灰葡萄孢菌株处在同一分支,表明所分离金线兰灰霉病的致病菌为灰葡萄孢。表 1 基因序列最佳BLAST结果Table 1. Best BLAST results of gene sequences基因
Gene长度
Length/bpBLAST最佳结果 BLAST best results 一致性
Consistency/%登录号
Accession No.E 值
E value物种
Species寄主
HostITS 570 KC172064 0.0 灰葡萄孢菌 Botrytis cinerea Z17 草莓 Fragaria ananassa 99.59 G3PDH 966 MG846500 0.0 灰葡萄孢菌 Botrytis cinerea Poly-5 荞麦 Fagopyrum tataricum 99.69 HSP60 1019 MN159921 1e−133 灰葡萄孢菌 Botrytis cinerea 19-0004 沉香 Aquilaria sinensis 91.98 RPB2 1175 OR255924 0.0 灰葡萄孢菌 Botrytis cinerea BSFC-7 白及 Bletilla striata 100.00 2.4 病原菌的致病性分析
2.4.1 不同温度对病原菌生长的影响
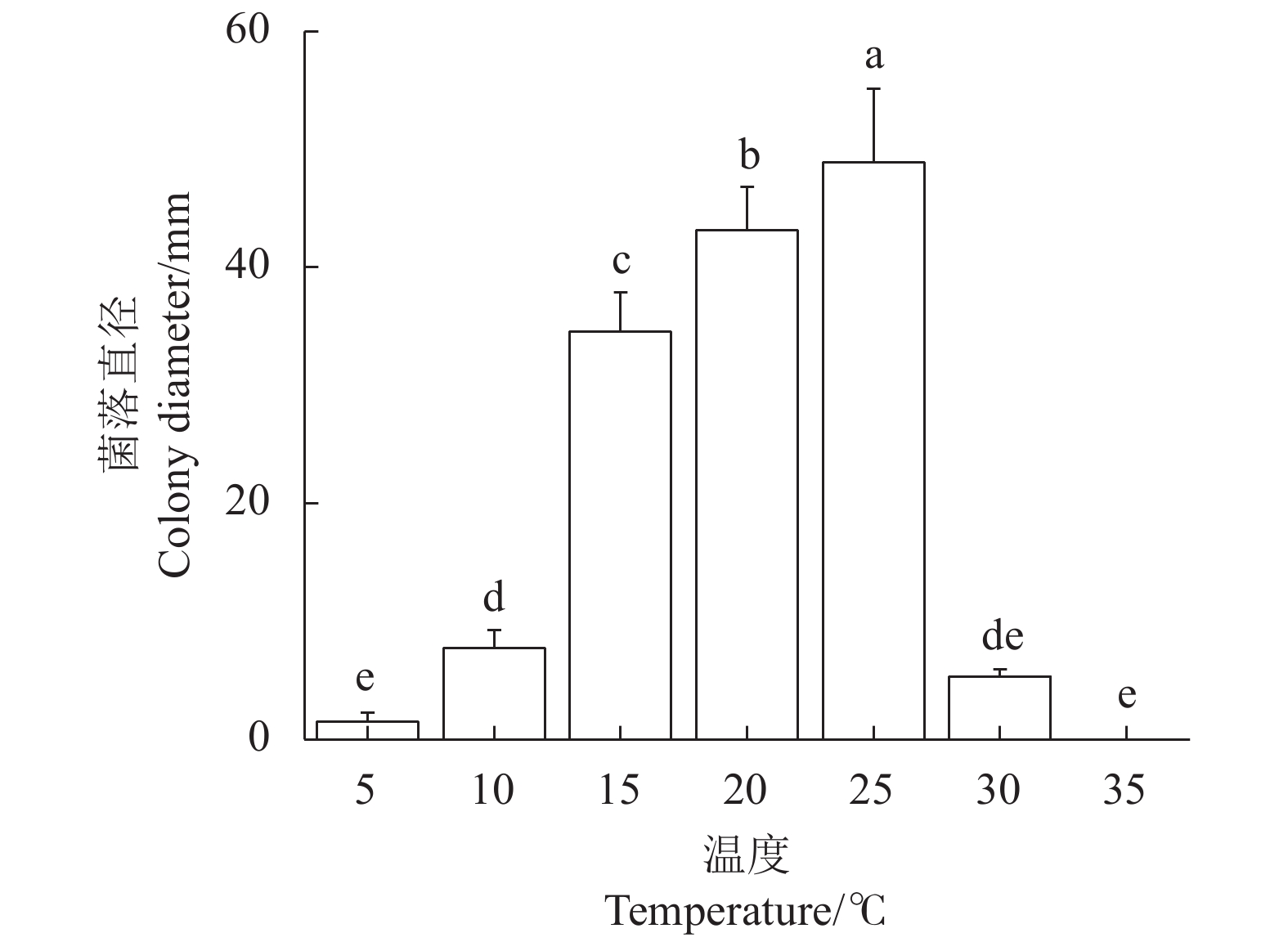
温度对病原菌A2C-1-1的菌丝生长有显著影响(图5)。适合菌丝生长的温度范围为15~25 ℃,菌落直径为34.53~48.92 mm;当温度低于10 ℃或高于30 ℃时,菌落生长缓慢,直径显著下降;当温度为35 ℃时,菌丝停止生长。25 ℃最适宜灰霉病病菌生长,菌落直径为48.92 mm。
2.4.2 灰霉病病原菌不同接种方式及对不同种质金线兰的致病力
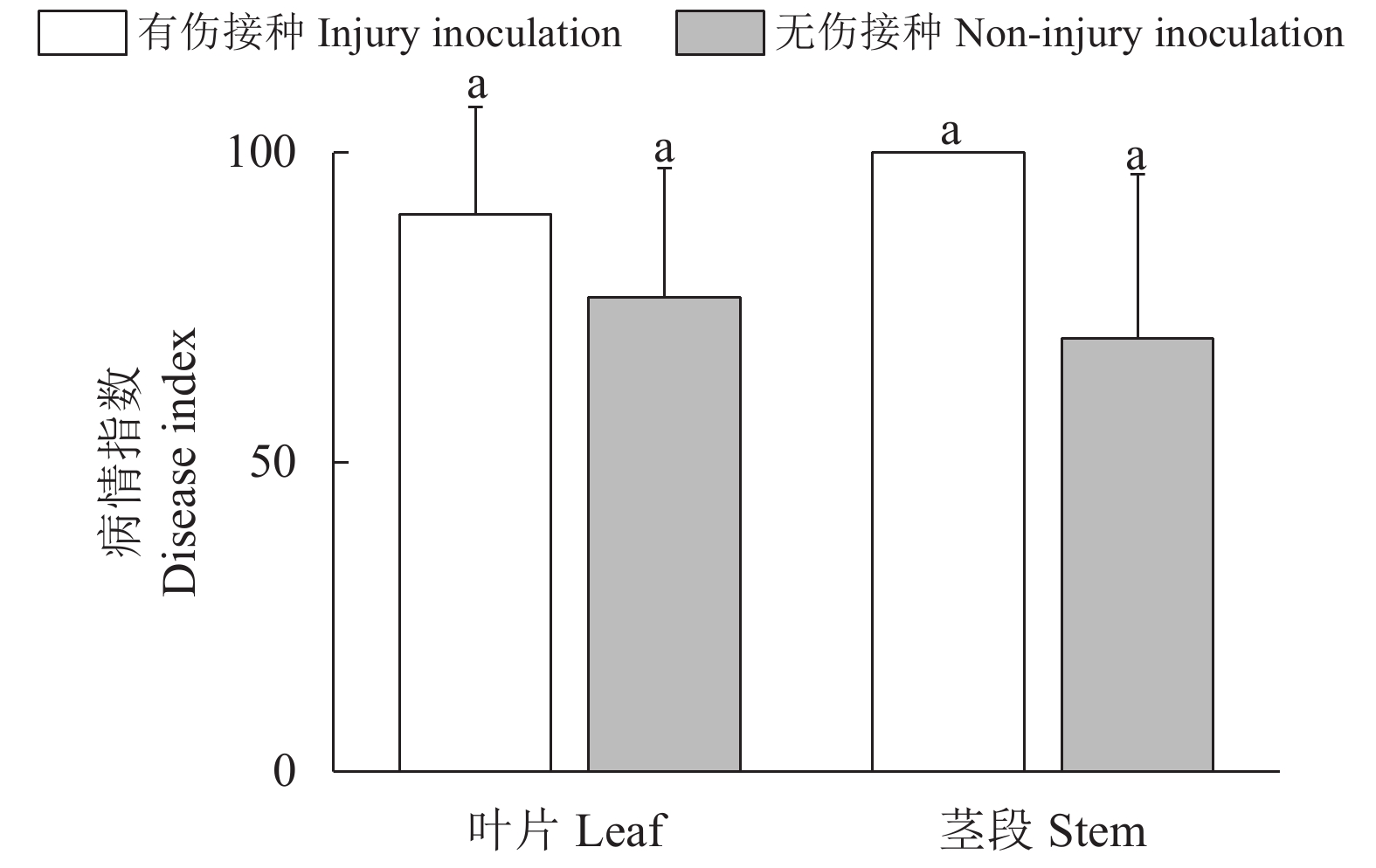
金线兰组织接种7 d后,观察到部分未进行针刺处理的金线莲叶片和茎段区域出现水渍化和失绿现象,经过针刺处理的叶片和茎段则展现出明显的病症,而接种无菌水的对照组中,叶片和茎段并未出现任何发病症状(图6、7)。这一结果说明,菌丝本身可在无物理性创口的植株中具备足够的侵染能力,但物理性的创口加速了灰葡萄孢对叶片和茎段的感染过程。
不同金线兰及近缘种对侵染的敏感性不同。试验结果表明,金线兰红霞和德化野生金线兰的病情指数较高,分别为71.00和50.00,对A2C-1-1表现较弱抗性;而金线兰尖叶种和台湾银线兰病情指数较低,分别为50.00和22.75,表现较强抗性(图8、9)。
2.4.3 A2C-1-1对不同兰科种质的致病性差异
为进一步了解A2C-1-1对不同兰科种质的致病情况,在铁皮石斛、南茜文心兰、姬蝴蝶兰及建兰无菌叶片上接种A2C-1-1的菌丝,以接种无菌水为对照。接种7 d后,铁皮石斛和南茜文心兰表现较强抗性,病情指数分别为23.33和23.33,而姬蝴蝶兰和建兰表现较弱抗性,病情指数分别为70.00和73.33(图10、11)。
2.5 防治药剂筛选
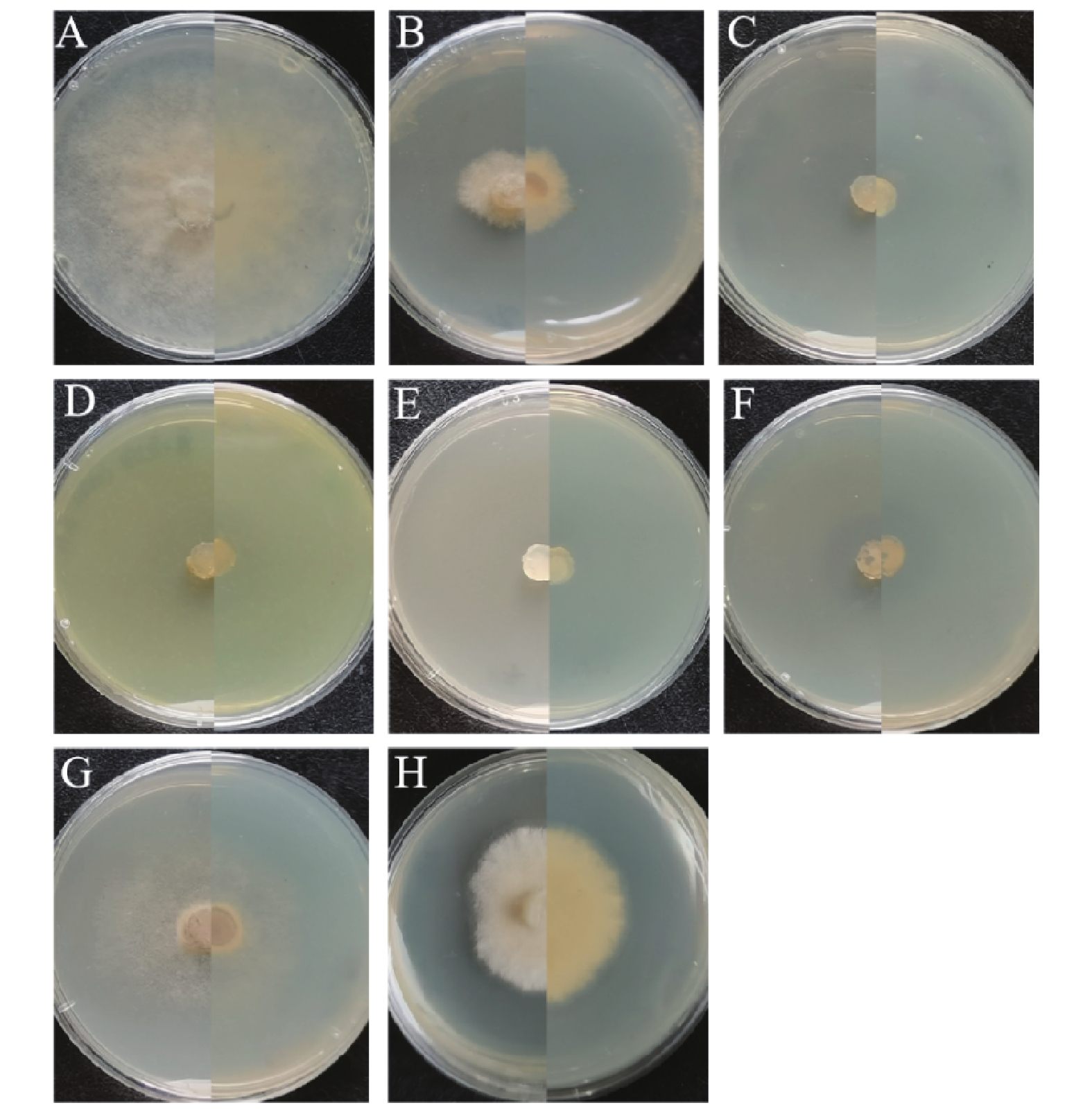
7种杀菌剂均对A2C-1-1有一定的抑制效果,不同药剂的抑制效果存在明显差异(图12)。95% 氟硅唑抑制作用最强,EC50值为2.624×10−20 g·L−1;其次是94.5% 氟啶胺、96.5% 咪鲜胺、90% 乙蒜素,EC50值分别为1.000×10−15、2.420×10−10、5.861×10−7 g·L−1。 而99% 噁霉灵、95% 嘧菌酯、90.5% 代森锰锌的抑制效果较差,EC50值分别为0.215、0.401、22.522 g·L−1(表2)。
![]() 图 12 不同药剂对A2C-1-1菌株的抑菌效果(3 d)A.无菌水(对照);B. 99% 噁霉灵;C. 95% 氟硅唑;D. 94.5% 氟啶胺;E. 96.5% 咪鲜胺;F. 90% 乙蒜素;G. 95% 嘧菌酯;H. 90.5% 代森锰锌。Figure 12. Inhibition effect of fungicides on A2C-1-1 (3 d)A. sterile water (control); B. 99% hymexazol; C. 95% flusilazole; D. 94.5% fluazinam; E. 96.5% prochloraz; F. 90% ethylicin; G. 95% azoxystrobin; H. 90.5% mancozeb.表 2 不同药剂对A2C-1-1菌株的抑制效果Table 2. Inhibition effect of fungicides on A2C-1-1
图 12 不同药剂对A2C-1-1菌株的抑菌效果(3 d)A.无菌水(对照);B. 99% 噁霉灵;C. 95% 氟硅唑;D. 94.5% 氟啶胺;E. 96.5% 咪鲜胺;F. 90% 乙蒜素;G. 95% 嘧菌酯;H. 90.5% 代森锰锌。Figure 12. Inhibition effect of fungicides on A2C-1-1 (3 d)A. sterile water (control); B. 99% hymexazol; C. 95% flusilazole; D. 94.5% fluazinam; E. 96.5% prochloraz; F. 90% ethylicin; G. 95% azoxystrobin; H. 90.5% mancozeb.表 2 不同药剂对A2C-1-1菌株的抑制效果Table 2. Inhibition effect of fungicides on A2C-1-1杀菌剂
Fungicides毒力回归方程
Toxicity equation相关系数
Correlation coefficient R2EC50/
(g·L−1)99% 噁霉灵 99% hymexazol y= 0.1021 x+0.2618 0.9883 0.215 96.5% 咪鲜胺 96.5% prochloraz y=− 0.2061 x−1.4818 0.9789 2.420×10−10 94.5% 氟啶胺 94.5% fluazinam y=− 0.0424 x−0.0033 0.9786 1.000×10−15 95% 氟硅唑 95% flusilazole y=− 0.0409 x−0.0562 0.9998 2.624×10−20 90% 乙蒜素 90% ethylicin y= 0.1215 x+0.8927 1.000 5.861×10−7 95% 嘧菌酯 95% azoxystrobin y= 0.0784 x+0.7663 0.9995 0.401 90.5% 代森锰锌 90.5% mancozeb y=0.038x+ 0.3346 0.8369 22.522 3. 讨论与结论
本研究从金线兰灰霉病植株分离纯化获得菌株A2C-1-1,采用形态学特征及rDNA-ITS、G3PDH、HSP60及RPB2基因序列联合分析,确定引起金线兰灰霉病病原菌为灰葡萄孢,这与刘惠英等[5]报道的金线莲灰霉病病原菌为子囊菌亚门核盘菌科灰葡萄孢的结论较一致。此外,在序列分析中分析,HSP60基因序列包含大段多态性高的内含子片段,可独立应用于灰葡萄孢的种间鉴定。
灰葡萄孢作为一种强致病性的真菌,其可通过气孔进入宿主,或通过短分生孢子胚管穿透角质层,能够在短时间内对植物造成大规模的病害侵袭,对植物的生长产量产生不利影响[15],这与本试验菌丝在无创口下本身具备侵染能力结论较一致。灰霉病通常在3~5月的高湿度环境下爆发,尤其是在田间温度维持在25 ℃时,病害更为严重,导致植株整株甚至整片倒伏[16]。本试验结果表明,A2C-1-1在15~25 ℃下生长最为迅速,最适生长温度是25 ℃。此前的研究发现湖北贝母(Fritillaria hupehensis) [16]、百合(Lilium brownii var. viridulum) [17]和藜麦(Chenopodium quinoa)[18]灰霉病病原菌在菌丝生长的最适温度均落在15~25 ℃,这与本试验的结果较为一致。而杨囡君[19]的研究发现,河南商丘番茄灰霉病病菌的最适生长温度为28 ℃,这与A2C-1-1病原菌存在温度差异。这一差异可能归因于不同寄主植物上灰霉病病原菌所处环境的多样性,进而导致各菌株间生物学特性的差异性。
灰葡萄孢寄主范围很广,可引起世界范围内
1000 种以上植物发生灰霉病[20],如烟草(Nicotiana tabacum)灰霉病[21]、猕猴桃(Actinidia chinensis)灰霉病[22],同时也是草莓[23]和番茄(Solanum lycopersicum)[24]等植物灰霉病的病原菌。在药用植物中,灰霉病亦对浙贝母(Fritillaria thunbergii)、铁皮石斛[25]和滇黄精(Polygonatum kingianum)[26]多种中药材造成严重危害。其还可危害湖北省铁皮石斛叶片[27]、蝴蝶兰[28]等多种兰科植物。本研究对福建省内4种金线兰品种与4种兰科植物分别进行致病性分析,发现A2C-1-1菌株具有广谱致病性,其对参试的试验组金线兰品种均致病,在接种菌丝后均表现水渍及褐化病斑,其中台湾银线兰与金线兰尖叶种表现较强抗性,说明不同金线兰品种之间具有遗传多样性,细胞壁中阿拉伯聚糖的组成差异导致对宿主渗透程度不同[29];其对不同种质兰科也有不同程度致病性,其中铁皮石斛与南茜文心兰表现较强抗性,说明可能不同兰科种质在进化过程中形成了独特防御机制。本研究选取的 7 种杀菌剂对金线兰灰霉病病原菌防治测定表明,95%氟硅唑、96.5%咪鲜胺、90%乙蒜素和 94.5%氟啶胺 4 种药剂对金线兰灰霉病病菌有较好的抑制效果。王帆帆等[16]研究针对湖北贝母灰霉病病原菌的防治进行测定,揭示8%氟硅唑与氟啶胺化学杀菌剂,在抑制病原菌方面具显著效果,80%乙蒜素生物杀菌剂亦列为备选药剂,这些发现与针对病原菌A2C-1-1的研究结果较一致。 而杨囡君[19]在探究番茄灰霉菌防治的过程中,观察到嘧菌酯对病原菌的抑制效果最为突出,这一结果与针对A2C-1-1病原菌的研究存在明显差异,这可能是因为嘧菌酯属于甲氧基丙烯酸酯类高抗性风险杀菌剂[30],而近几年国内采集的灰葡萄孢菌株对这类杀菌剂产生了不同程度的抗药性[31],抗性频率高达43.3%[32],从而导致其对A2C-1-1菌株防治效果下降。因此,为实现科学有效的病害防控,针对不同寄主植物的同一病害类型,开展针对性杀菌剂筛选,并开发作用机制新颖的药剂,以延缓病原菌抗药性发展显得尤为重要。
-
图 12 不同药剂对A2C-1-1菌株的抑菌效果(3 d)
A.无菌水(对照);B. 99% 噁霉灵;C. 95% 氟硅唑;D. 94.5% 氟啶胺;E. 96.5% 咪鲜胺;F. 90% 乙蒜素;G. 95% 嘧菌酯;H. 90.5% 代森锰锌。
Figure 12. Inhibition effect of fungicides on A2C-1-1 (3 d)
A. sterile water (control); B. 99% hymexazol; C. 95% flusilazole; D. 94.5% fluazinam; E. 96.5% prochloraz; F. 90% ethylicin; G. 95% azoxystrobin; H. 90.5% mancozeb.
表 1 基因序列最佳BLAST结果
Table 1 Best BLAST results of gene sequences
基因
Gene长度
Length/bpBLAST最佳结果 BLAST best results 一致性
Consistency/%登录号
Accession No.E 值
E value物种
Species寄主
HostITS 570 KC172064 0.0 灰葡萄孢菌 Botrytis cinerea Z17 草莓 Fragaria ananassa 99.59 G3PDH 966 MG846500 0.0 灰葡萄孢菌 Botrytis cinerea Poly-5 荞麦 Fagopyrum tataricum 99.69 HSP60 1019 MN159921 1e−133 灰葡萄孢菌 Botrytis cinerea 19-0004 沉香 Aquilaria sinensis 91.98 RPB2 1175 OR255924 0.0 灰葡萄孢菌 Botrytis cinerea BSFC-7 白及 Bletilla striata 100.00 表 2 不同药剂对A2C-1-1菌株的抑制效果
Table 2 Inhibition effect of fungicides on A2C-1-1
杀菌剂
Fungicides毒力回归方程
Toxicity equation相关系数
Correlation coefficient R2EC50/
(g·L−1)99% 噁霉灵 99% hymexazol y= 0.1021 x+0.2618 0.9883 0.215 96.5% 咪鲜胺 96.5% prochloraz y=− 0.2061 x−1.4818 0.9789 2.420×10−10 94.5% 氟啶胺 94.5% fluazinam y=− 0.0424 x−0.0033 0.9786 1.000×10−15 95% 氟硅唑 95% flusilazole y=− 0.0409 x−0.0562 0.9998 2.624×10−20 90% 乙蒜素 90% ethylicin y= 0.1215 x+0.8927 1.000 5.861×10−7 95% 嘧菌酯 95% azoxystrobin y= 0.0784 x+0.7663 0.9995 0.401 90.5% 代森锰锌 90.5% mancozeb y=0.038x+ 0.3346 0.8369 22.522 -
[1] 郑纯,黄以钟,季莲芳. 金钱莲文献考证、原植物及商品调查[J]. 中草药,1996,27(3) :169−172. ZHENG C,HUANG Y Z,JI L F. Pharmacognostic studies on Jinxianlian Ⅰ. bencaologic review,resource survey and taxonomic identification[J]. Chinese Traditional and Herbal Drugs,1996,27(3) :169−172. (in Chinese)
[2] 林江波,王伟英,邹晖,等. 大棚金线莲栽培主要病害及防治技术[J]. 福建农业科技,2017,48(9) :34−35. LIN J B,WANG W Y,ZOU H,et al. Main diseases in greenhouse cultivation of Anoectochilus roxburghii and the control measures[J]. Fujian Agricultural Science and Technology,2017,48(9) :34−35. (in Chinese)
[3] 黄靖,陈婵. 接种促生菌对金线莲生物活性成分及土壤细菌群落的影响[J]. 江苏农业科学,2022,50(23) :184−191. HUANG J,CHEN C. Influences of inoculation of growth-promoting bacteria on bioactive constituents and soil bacterial communities of Anoectochilus roxburghii[J]. Jiangsu Agricultural Sciences,2022,50(23) :184−191. (in Chinese)
[4] 王丽,何琴,李惠玲,等. 金线莲灰霉病病原菌的分离与鉴定[J]. 广东农业科学,2014,41(18) :63−65,2. DOI: 10.3969/j.issn.1004-874X.2014.18.016 WANG L,HE Q,LI H L,et al. Isolation and molecular identification of grey mould pathogen in Anoectochilus roxburghii[J]. Guangdong Agricultural Sciences,2014,41(18) :63−65,2. (in Chinese) DOI: 10.3969/j.issn.1004-874X.2014.18.016
[5] 刘惠英,杨世福,赵志博,等. 金线莲灰霉病病害鉴定[J]. 云南农业大学学报(自然科学) ,2020,35(4) :601−607. DOI: 10.12101/j.issn.1004-390X(n).201906036 LIU H Y,YANG S F,ZHAO Z B,et al. Identification of the pathogen of grey mold on Anoectochilus roxburghii[J]. Journal of Yunnan Agricultural University (Natural Science) ,2020,35(4) :601−607. (in Chinese) DOI: 10.12101/j.issn.1004-390X(n).201906036
[6] 姜鼎煌. 金线莲灰霉病诊断和病原鉴定[J]. 中国植保导刊,2014,34(7) :73−74. DOI: 10.3969/j.issn.1672-6820.2014.07.016 JIANG D H. Diagnosis and pathogen identification of Botrytis cinerea in Anoectochilus roxburghii[J]. China Plant Protection,2014,34(7) :73−74. (in Chinese) DOI: 10.3969/j.issn.1672-6820.2014.07.016
[7] 董汉松. 植病研究法[M]. 北京:中国农业出版社,2012. [8] 王培育,张婧,张春柳,等. 文心兰叶片褐斑病病原物鉴定及生防菌筛选[J]. 宁德师范学院学报(自然科学版) ,2020,32(2) :179−182. WANG P Y,ZHANG J,ZHANG C L,et al. Identification of the pathogen of leaf brown spot of Oncidium and screening biocontrol microbes[J]. Journal of Ningde Normal University (Natural Science) ,2020,32(2) :179−182. (in Chinese)
[9] 罗庆国,叶炜,江金兰,等. 金线莲组培快繁技术研究[J]. 南方农业(园林花卉版) ,2011,5(5) :43−44. DOI: 10.3969/j.issn.1673-890X-B.2011.05.018 LUO Q G,YE W,JIANG J L,et al. Study on tissue culture and rapid propagation of Anoectochilus roxburghii[J]. South China Agriculture,2011,5(5) :43−44. (in Chinese) DOI: 10.3969/j.issn.1673-890X-B.2011.05.018
[10] 李吉二,温思思,张羽加,等. 浙贝母灰霉病病原真菌的分子鉴定[J]. 植物保护,2022,48(2) :151−156. LI J E,WEN S S,ZHANG Y J,et al. Molecular identification of pathogenic fungi of gray mold in Fritillaria thunbergii[J]. Plant Protection,2022,48(2) :151−156. (in Chinese)
[11] YOHALEM D S,NIELSEN K,NICOLAISEN M. Taxonomic and nomenclatural clarification of the onion neck rotting Botrytis species[J]. Mycotaxon,2003,85:175−182.
[12] 陈东亮,李明远,程曦,等. 北京万寿菊灰霉病病原菌分离鉴定[J]. 中国植保导刊,2018,38(4) :11−16. DOI: 10.3969/j.issn.1672-6820.2018.04.002 CHEN D L,LI M Y,CHENG X,et al. Isolation and identification of pathogen of Botrytis cinerea in Beijing marigold[J]. China Plant Protection,2018,38(4) :11−16. (in Chinese) DOI: 10.3969/j.issn.1672-6820.2018.04.002
[13] CHEN J,ZHU J Z,LI X G,et al. Botrytis cinerea causing gray mold of Polygonatum sibiricum (Huang Jing) in China[J]. Crop Protection,2021,140:105424. DOI: 10.1016/j.cropro.2020.105424
[14] 王潞伟,任潇妍,刘源源,等. 山西省蔬菜灰霉病菌对咯菌腈的抗性及生物学性状[J]. 植物病理学报,2024(4) :1−12. WANG L W,REN X Y,LIU Y Y,et al. Resistance and Biological Characteristics of Botrytis cinerea in Vegetables from Shanxi Province to Fusarium oxysporum[J]. Phytopathology Research,2024(4) :1−12. (in Chinese)
[15] BI K,LIANG Y,MENGISTE T,et al. Killing softly:A roadmap of Botrytis cinerea pathogenicity[J]. Trends in Plant Science,2023,28(2) :211−222. DOI: 10.1016/j.tplants.2022.08.024
[16] 王帆帆,毛婷,唐涛,等. 湖北贝母灰霉病病原菌鉴定及防治药剂筛选[J]. 北方园艺,2023(17) :102−109. WANG F F,MAO T,TANG T,et al. Identification of pathogenic bacteria and screening of control agents for gray mold in Hubei Fritillaria thunbergii[J]. Northern Horticulture,2023(17) :102−109. (in Chinese)
[17] 杜艳丽,曹兴,王桂清,等. 百合灰霉病病原菌鉴定及其部分生物学特性测定[J]. 南方农业学报,2019,50(2) :307−314. DOI: 10.3969/j.issn.2095-1191.2019.02.13 DU Y L,CAO X,WANG G Q,et al. Identification and partial biological characteristics of pathogen causing lily gray mold[J]. Journal of Southern Agriculture,2019,50(2) :307−314. (in Chinese) DOI: 10.3969/j.issn.2095-1191.2019.02.13
[18] 殷辉,陈亚蕾,秦楠,等. 藜麦灰霉病病原菌鉴定及环境因子对其菌丝生长和分生孢子萌发的影响[J]. 植物保护学报,2022,49(3) :899−908. YIN H,CHEN Y L,QIN N,et al. Identification of the pathogen causing gray mold in Chenopodium quinoa and the effects of environmental factors on its mycelial growth and conidia germination[J]. Acta Phytophylacica Sinica,2022,49(3) :899−908. (in Chinese)
[19] 杨囡君. 河南省番茄灰霉病病原菌鉴定、生物学特性分析及杀菌剂筛选[J]. 陕西农业科学,2024,70(2) :33−38,97. DOI: 10.3969/j.issn.0488-5368.2024.02.007 YANG N J. Identification,biological characteristics analysis and fungicide screening for pathogenic pathogen causing tomato gray mold in Henan Province[J]. Shaanxi Journal of Agricultural Sciences,2024,70(2) :33−38,97. (in Chinese) DOI: 10.3969/j.issn.0488-5368.2024.02.007
[20] VELOSO J,VAN KAN J A L. Many shades of grey in Botrytis–host plant interactions[J]. Trends in Plant Science,2018,23(7) :613−622. DOI: 10.1016/j.tplants.2018.03.016
[21] 卢燕回,谭海文,袁高庆,等. 烟草灰霉病病原鉴定及其生物学特性[J]. 中国烟草学报,2012,18(3) :61−66. DOI: 10.3969/j.issn.1004-5708.2012.03.011 LU Y H,TAN H W,YUAN G Q,et al. Identification and evaluation in biological characteristics of tobacco grey mould pathogen[J]. Acta Tabacaria Sinica,2012,18(3) :61−66. (in Chinese) DOI: 10.3969/j.issn.1004-5708.2012.03.011
[22] 潘慧,龙超安,钱国良,等. 猕猴桃采后真菌病害生物防治研究进展[J]. 微生物学杂志,2024,44(1) :100−106. DOI: 10.3969/j.issn.1005-7021.2024.01.012 PAN H,LONG C A,QIAN G L,et al. Research progress on biological control of post harvest fungal diseases in Actinidia chinensis[J]. Journal of Microbiology,2024,44(1) :100−106. (in Chinese) DOI: 10.3969/j.issn.1005-7021.2024.01.012
[23] 慈志娟,黄丽,张天英,等. 草莓灰霉病的发生与防治[J]. 烟台果树,2022(2) :43. DOI: 10.3969/j.issn.1005-9938.2022.02.021 CI Z J,HUANG L,ZHANG T Y,et al. Occurrence and control of strawberry gray mold[J]. Yantai Fruits,2022(2) :43. (in Chinese) DOI: 10.3969/j.issn.1005-9938.2022.02.021
[24] 高婧,刘燕,杨永青,等. 设施番茄灰霉病病原菌的分离与鉴定[J]. 北方农业学报,2023,51(2) :83−90. DOI: 10.12190/j.issn.2096-1197.2023.02.10 GAO J,LIU Y,YANG Y Q,et al. Isolation and identification of gray mold pathogen on facility tomato[J]. Journal of Northern Agriculture,2023,51(2) :83−90. (in Chinese) DOI: 10.12190/j.issn.2096-1197.2023.02.10
[25] 戴德江,沈颖,沈瑶,等. 浙产特色中药材病虫害化学防治的研究进展[J]. 农药学学报,2019,21(S1) :759−771. DAI D J,SHEN Y,SHEN Y,et al. Research progress on chemical control of pests and diseases of characteristic Chinese herbal medicines produced in Zhejiang Province[J]. Chinese Journal of Pesticide Science,2019,21(S1) :759−771. (in Chinese)
[26] 柳敏,成忠均,徐庆祝,等. 滇黄精灰霉病菌鉴定与室内防治药剂筛选[J]. 中药材,2024(5) :1100−1105. LIU M,CHENG Z J,XU Q Z,et al. Identification of Polygonatum kingianum Botrytis cinerea and screening of indoor control agents[J]. Journal of Chinese Medicinal Materials,2024(5) :1100−1105. (in Chinese)
[27] 游景茂,郭杰,李哲,等. 铁皮石斛灰霉病病原分离鉴定及防治[J]. 中国中药杂志,2019,44(18) :3954−3959. YOU J M,GUO J,LI Z,et al. Isolation and identification of pathogen of Dendrobium officinale gray mold and its prevention and control[J]. China Journal of Chinese Materia Medica,2019,44(18) :3954−3959. (in Chinese)
[28] 丁银花,刘行. 温室蝴蝶兰主要真菌、细菌病害及防治技术研究[J]. 特种经济动植物,2020,23(8) :49−52. DOI: 10.3969/j.issn.1001-4713.2020.08.021 DING Y H,LIU X. Study on main fungal and bacterial diseases of Phalaenopsis in greenhouse and their control techniques[J]. Special Economic Animal and Plant,2020,23(8) :49−52. (in Chinese) DOI: 10.3969/j.issn.1001-4713.2020.08.021
[29] CHEUNG N,TIAN L,LIU X R,et al. The destructive fungal pathogen Botrytis cinerea:Insights from genes studied with mutant analysis[J]. Pathogens,2020,9(11) :923. DOI: 10.3390/pathogens9110923
[30] 路粉,吴杰,李洋,等. 北方三省(自治区) 马铃薯晚疫病菌对QoI类杀菌剂敏感性动态监测[J/OL]. 植物病理学报,2023,53(4) :655–665. LU F,WU J,LI Y,et al. Dynamic monitoring of sensitivity of Phytophthora infestans to QoI fungicides in three northern provinces (autonomous regions) [J/OL]. China Industrial Economics,2023,53(4) :655–665. (in Chinese)
[31] SHAO W Y,ZHAO Y F,MA Z H. Advances in understanding fungicide resistance in Botrytis cinerea in China[J]. Phytopathology,2021,111(3) :455−463.
[32] YIN W X,ADNAN M,SHANG Y,et al. Sensitivity of Botrytis cinerea from nectarine/cherry in China to six fungicides and characterization of resistant isolates[J]. Plant Disease,2018,102(12) :2578−2585. DOI: 10.1094/PDIS-02-18-0244-RE





 下载:
下载: