Sequencing, Protein Expression, and Polyclonal Antibody Preparation of MyD88 in Larus ridibundus
-
摘要:目的
分析红嘴鸥(Larus ridibundus)髓样分化因子88(myeloid differentiation factor 88, MyD88)基因序列并制备多克隆抗体,以期了解红嘴鸥MyD88蛋白的结构和功能,获得针对该物种天然免疫信号通路机制的研究工具。
方法采用Trizol法提取红嘴鸥外周血淋巴细胞的总RNA,通过RT-PCR扩增MyD88基因,利用生物信息学软件对红嘴鸥MyD88基因的相似性、亲缘关系、蛋白理化性质、蛋白二级和三级结构等进行分析;构建红嘴鸥MyD88基因重组原核表达载体,转化获得MyD88重组蛋白原核表达菌株并优化诱导条件获得重组表达蛋白。采用Ni柱法、超滤法和梯度透析方式纯化重组蛋白,将其与弗氏佐剂乳化后免疫新西兰大白兔,制备多克隆抗体血清,通过双向琼脂扩散实验测定多抗血清滴度,同时通过SDS-PAGE 和 Western Blotting对MyD88重组蛋白多克隆抗体的特异性进行鉴定。
结果红嘴鸥MyD88基因CDS区长921 bp,共编码306个氨基酸;该基因同三趾鸥(Rissa tridactyla)的基因相似性最高,为98.8%,同绿头鸭(Anas platyrhynchos)MyD88基因相似性较低,为84.6%;进化树结果表明,其与三趾鸥亲缘关系最近,同家禽类亲缘关系较远;其编码蛋白的分子大小约34.5 kDa,含1个N-糖基化位点和24个磷酸化位点,无信号肽和跨膜结构,属于亲水性蛋白;MyD88蛋白二级结构以无规则卷曲为主,三级结构与二级结构一致,且蛋白含有完整的死亡结构域和TIR结构域。红嘴鸥MyD88重组蛋白在37 ℃、1.0 mmoL·L−1 IPTG诱导4 h时表达最佳,大小为54 kDa。制备的多克隆抗体血清效价为1∶16,能识别红嘴鸥MyD88重组蛋白,具有较好的特异性。
结论红嘴鸥MyD88基因编码蛋白为富含磷酸化位点且具有完整死亡结构域和TIR结构域的亲水性蛋白。红嘴鸥MyD88重组蛋白能在体外进行大量表达且具有较好的免疫原性,制备的多克隆抗体具有较好的特异性。
Abstract:ObjectiveGene sequence and polyclonal antibodies of myeloid differentiation factor 88 (MyD88) in Larus ridibundus were studied to reveal the protein structure and functions for further research on the innate immune signaling pathway.
MethodTotal RNA was extracted from the peripheral blood lymphocytes of L. ridibundus using the trizol method. MyD88 was amplified by RT-PCR. The similarity, genetic relationship, physiochemical properties, secondary and tertiary structures of the gene were analyzed using bioinformatics software. Prokaryotic expression strain of MyD88 recombinant protein was obtained by transformation with the induction conditions optimized and purified by Ni-column, ultrafiltration and gradient dialysis followed by emulsification with Freund's adjuvant to immunize New Zealand white rabbits in preparing the polyclonal antibody serum. Titer of the obtained polyclonal antibody was determined by two-way agar diffusion assay, and specificity against MyD88 recombinant protein identified by SDS-PAGE and western blotting.
ResultThe CDS region of MyD88 was 921 bp encoding 306 amino acids. The similarity of the gene with that of Rissa tridactyla was the highest at 98.8%, while the lowest at 84.6% with that of Anas platyrhynchos. It had a molecular size of approximately 34.5 kDa that contained one N-glycosylation site and 24 phosphorylation sites. There was no signal peptide and transmembrane structure. The secondary structure of the MyD88 protein was mainly random coil, while the tertiary structure, consistent with the secondary structure. The hydrophilic protein consisted of a complete death domain and TIR domain. The expression of the 54 kDa prokaryotic protein peaked in 4 h at 37 ℃ in 1.0 mmol·L−1 IPTG. The prepared polyclonal antibody serum had a titer of 1∶16 that could effectively recognize the recombinant MyD88 protein of L. ridibundus indicating high in specificity.
ConclusionA hydrophilic protein, MyD88 encoded rich in phosphorylation sites with a complete death domain and TIR domain. The constructed recombinant protein could be expressed in large quantities in vitro exerting strong immunogenicity, and the prepared polyclonal antibodies were highly specific.
-
0. 引言
【研究意义】红嘴鸥(Larus ridibundus)是鸻形目(Charadriiformes)鸥科(Laridae)彩头鸥属(Chroicocephalus)的一种广布型野生水禽,广泛分布于亚欧大陆及北美东部沿海,是中国南方和南亚大陆常见的冬候鸟[1]。作为杂食性鸟类,红嘴鸥主要以小鱼、虾等水生动物为食,为适应环境变化其已形成进入城市觅食的习惯,显著增加了与人类活动的接触频率[2]。值得警惕的是,研究显示人兽共患病病毒库中约有167万未知病毒潜藏于鸟类等动物宿主[3],而红嘴鸥已被证实可携带沙门氏菌(Salmonella)、产气荚膜梭菌(Clostridium perfringens)及冠状病毒(Coronavirus)等病原[4−6]。尤其需要关注的是,红嘴鸥每年冬季会进行大规模南迁行为,迁徙路线跨越多个地理区域与生态环境[7]。这种迁徙特性与野生动物作为71.8%人兽共患病源头的现状形成风险叠加,更凸显其作为病原传播媒介的潜在公共卫生意义[8]。髓样分化因子88(myeloid differentiation factor 88, MyD88)蛋白是由MyD88基因编码的一种衔接蛋白,其结构包含TIR结构域和死亡结构域,在先天免疫应答中起核心作用;作为TLRs/MyD88/NF-κB信号通路的核心枢纽,MyD88通过衔接上游Toll样受体与下游NF-κB信号级联反应,不仅激活炎症基因表达以启动先天免疫应答,还参与细胞增殖与器官稳态维持[9−12]。【前人研究进展】在禽类模型中,E3泛素连接酶SPOP通过介导MyD88的K197/K234位点K48多聚泛素化修饰,促进其蛋白酶体降解。进一步研究发现,SPOP过表达可抑制MyD88/NF-κB信号通路活性并减少炎症因子分泌[13]。MyD88的功能调控不仅限于蛋白稳定性层面,其磷酸化修饰也被证实是免疫调控的重要环节,如在PTPN6突变小鼠模型中,MyD88的磷酸化是炎症性疾病发生的必要条件[14]。同时,DuMyD88的X2亚型因TIR结构域缺失81个氨基酸,感染新城疫病毒后基因表达水平显著低于X1亚型,提示结构域完整性可能通过影响蛋白稳定性或信号转导效率调控免疫应答强度[15]。这种结构-功能关系在不同病原感染模型中进一步得到验证,如白羽肉鸡感染禽腺病毒4型(fowl adenovirus serotupe 4, FAdV-4)后MyD88基因是病毒性炎症反应的核心驱动因子[16]。而鸭传染性浆膜炎感染模型中,TLR4/MyD88信号轴与IFN-γ、IL-4、IL-8等细胞因子的协同上调,凸显了该通路在免疫应答级联放大中的枢纽地位[17]。在细胞层面,MyD88可抑制鸡巨噬细胞增殖并促进其凋亡,发挥双重调控作用[18]。更引人注目的是,MyD88的免疫指示作用已延伸至跨物种感染研究领域。周浩等[19]通过检测鸭源坦布苏病毒感染雏鹅后免疫器官中MyD88及IL-6等细胞因子的转录动态,不仅证实了该病毒跨物种传播的免疫逃逸特性,更确立了MyD88作为免疫应答核心生物标志物的研究价值。【本研究切入点】尽管MyD88的功能在家禽中已有较深入解析,但红嘴鸥作为野生迁徙物种,其MyD88的分子特征及免疫调控机制尚未明确,这种知识空白限制了对红嘴鸥种群生态与公共卫生风险的全面评估。【拟解决的关键问题】鉴于红嘴鸥MyD88基因的基础分子特征尚未明确,且缺乏特异性研究工具,本研究拟将RT-PCR扩增获得的红嘴鸥MyD88基因序列进行分析,揭示红嘴鸥MyD88基因所编码蛋白的理化性质、糖基化和磷酸化位点等方面特征;将转化获得的红嘴鸥MyD88蛋白免疫新西兰大白兔,制备特异性多克隆抗体;为后续深入研究红嘴鸥MyD88蛋白在先天免疫中的作用机制提供支持。
1. 材料与方法
1.1 试验动物
使用0.55 mm一次性采血针翅下静脉采集10管昆明滇池的红嘴鸥抗凝血样。3只1.5~1.8 kg健康的雄性新西兰大白兔,由昆明医科大学提供。
1.2 主要试剂和菌株
大肠杆菌DH5α、RNAiso Plus、pMD18-T Vector、36 mm透析袋和PVDF膜均购自Takara公司,Transetta(DE3)和反转录试剂盒购自TransGen Biotech公司,胶回收试剂盒购自天根生化科技(北京)有限公司,鸡外周血淋巴细胞分离试剂盒购自Solarbio,RPMI Medium 1640 培养基购自Biosharp,优级胎牛血清(Gibco)购自昆明驰普生物技术有限公司。pET32a(+)载体由云南农业大学兽医公共卫生学研究平台提供,山羊抗兔HRP标记二抗购自北京中杉金桥生物技术有限公司,Protein A重力预装柱购自苏州博特龙免疫技术有限公司。
1.3 红嘴鸥外周血淋巴细胞RNA提取及cDNA合成
按照淋巴细胞分离试剂盒的操作说明将采集获得的红嘴鸥血样进行处理,获得淋巴细胞。随后,用1 mL细胞完全培养液(含10%胎牛血清、1%双抗)重悬细胞并接种于六孔板中,置于37 ℃、5% CO2的培养箱中培养24 h。培养结束后,使用Trizol法提取RNA,最后将提取的RNA进行凝胶电泳检测。将合格的RNA使用反转录试剂盒反转为cDNA。
1.4 红嘴鸥MyD88基因克隆及测序
根据GenBank中红嘴鸥MyD88基因全序列(登录号:OR145974),使用Primer6.0设计引物。引物序列为:MyD88-F:5′-CGGAATTCATGGGCACGGCGCC-3′(EcoR Ⅰ);MyD88-R:5′-CCCTCGAGTGGCAGCATGAGGGATT-3′(Xho I),下划线标注为限制性内切酶对应碱基。
以cDNA为模板进行PCR扩增,程序为:95 ℃预变性5 min,95 ℃变性50 s,56 ℃退火50 s,72 ℃延伸50 s,循环30次,72 ℃延伸10 min。反应结束后使用1.0%琼脂糖凝胶电泳分析扩增片段。将经胶回收试剂盒回收纯化的片段和pMD18-T载体连接,转化到感受态细胞DH5α中,抽提质粒进行凝胶电泳,验证目的条带,将验证合格的质粒送生物公司进行测序分析。
1.5 红嘴鸥MyD88基因序列及蛋白功能分析
将克隆获得的红嘴鸥MyD88基因序列运用Expasy-ProtParam(https://web.expasy.org/protparam/)分析蛋白质理化性质;Expasy-ProtScale(https://web.expasy.org/protscale/)进行亲疏水性分析;NetNGlyc1.0(services.healthtech.dtu.dk/services/NetNGlyc-1.0/)进行糖基化位点分析;NetPhos3.1(services.healthtech.dtu.dk/services/NetPhos-3.1/)进行磷酸化位点分析;TMHMM2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)、SignalP4.1(https://services.healthtech.dtu.dk/services/SignalP-4.1/)进行蛋白质跨膜区域和信号肽分析;SOPMA(https: //npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.htm)及SWISS-MODEL(https://swissmodel.expasy.org/)进行蛋白二级和三级结构分析;NCBI中的CD-Search进行蛋白结构域预测。
1.6 红嘴鸥MyD88原核表达载体构建
分别从培养的MyD88克隆菌株和pET-32a(+)载体中提取质粒后,采用EcoR Ⅰ和Xho Ⅰ限制性内切酶进行双酶切,反应体系于37 ℃下孵育5 h,然后使用T4连接酶在16 ℃下将回收得到的酶切片段进行过夜连接。将产物加入到DH5α感受态细胞中,37 ℃培养后吸取2 mL菌液送生工生物有限公司进行测序,将测序验证正确的菌株命名为pET32a-MyD88并保存。
1.7 红嘴鸥MyD88重组蛋白的体外诱导表达条件筛选
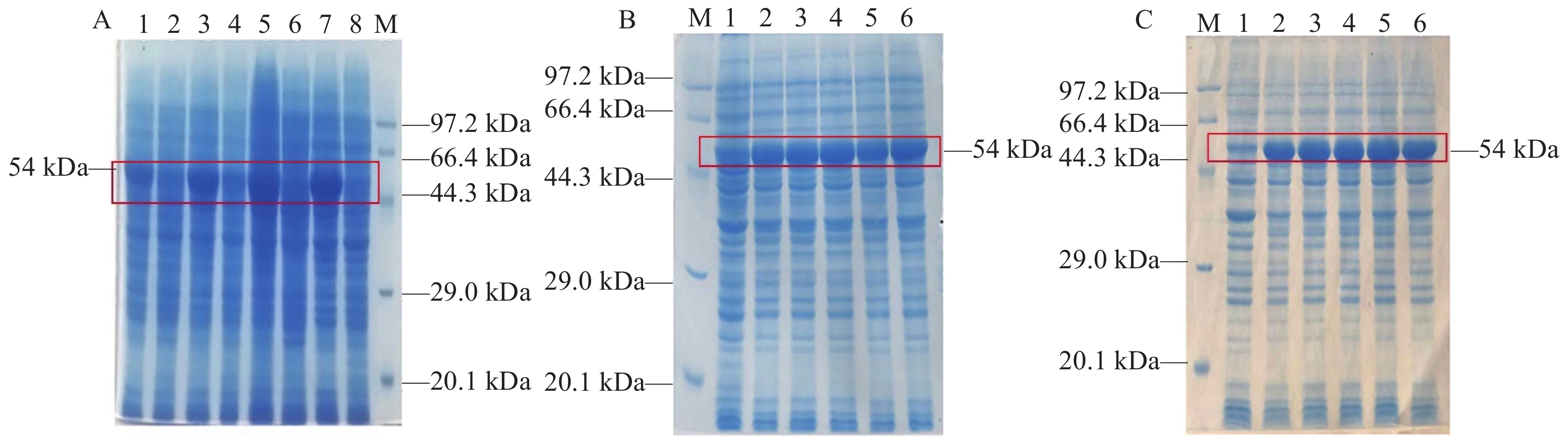
将鉴定正确的pET32a-MyD88表达载体转化至感受态细胞Transetta(DE3)中,挑取阳性单菌落并接种到含1%双抗(Amp+、Chi+)的LB液体培养基中培养至菌液对数生长期。在后续试验中,严格控制变量,系统筛选出最佳诱导条件。首先,维持IPTG终浓度为1.0 mmol·L−1,将菌液分别置于28、30、37 、40 ℃下诱导5 h。接着,在确定的最佳温度和IPTG浓度恒定条件下,将菌液分别诱导2、3、4和5 h。最后,在已确定的温度和时间基础上,对IPTG浓度进行筛选,使用终浓度分别为0.2、0.5、1.0、1.5、2.0 mmol·L−1的IPTG将菌液进行诱导。最后,将各组重组蛋白SDS-PAGE检测结果进行对比,筛选出诱导红嘴鸥MyD88重组蛋白表达的最佳温度、诱导时间以及IPTG浓度。
1.8 红嘴鸥MyD88重组蛋白的纯化
超声破碎诱导表达的2 L菌液,将破碎后的沉淀用2、4、6 mol·L−1的尿素溶液进行梯度洗涤,随后,用8 mol·L−1尿素充分将沉淀溶解。将溶解液通过镍离子柱进行纯化,并将收集液装入透析袋内,依次使用6、4、2、1 mol·L−1的尿素溶液和生理盐水进行梯度复性,每个浓度透析4 h。使用SDS-PAGE对复性后的蛋白纯度进行检测,使用超滤管将蛋白进行浓缩。
1.9 红嘴鸥MyD88蛋白多克隆抗体的制备及特异性检验
将浓缩的重组蛋白与弗氏佐剂按照1∶1的比例在低温环境下进行乳化,按每只1.0 mg的剂量进行皮下接种。首次免疫后的第1周和第2周,分别进行一次加强免疫。第三次免疫后14 d,通过颈动脉放血的方法收集血液并分离血清。取适量血清,按1∶1、1∶2、1∶4、1∶8、1∶16的比例稀释后进行琼脂扩散试验测定血清效价。随后运用Protein A亲和层析法纯化血清中的多克隆抗体IgG,并使用SDS-PAGE技术检测纯化效果。将检测后的重组蛋白使用湿膜法转印至PVDF膜上,转印完成后快速将膜置于快速封闭液中,37 ℃恒温孵育1 h。接着,将纯化的多克隆抗体按1∶200比例稀释后,4 ℃孵育12 h,孵育结束后,用TBST洗涤3次(10 min·次−1)。随后,加入1∶
5000 比例稀释的HRP标记的二抗,37 ℃孵育40 min,孵育结束后再次洗涤。最后,使用DAB显色液避光孵育10 min。2. 结果与分析
2.1 红嘴鸥淋巴细胞RNA检测和MyD88基因扩增
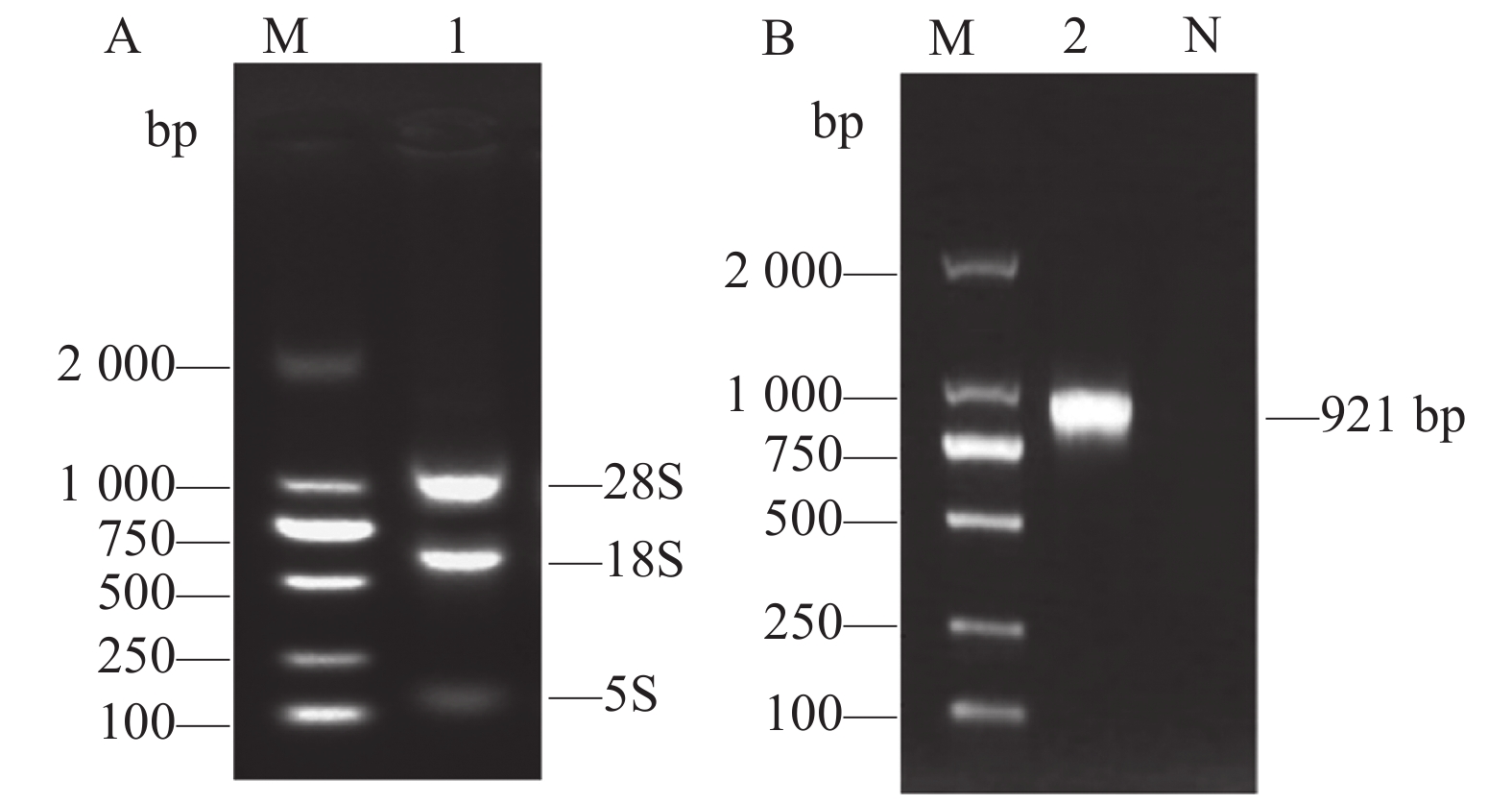
琼脂糖凝胶结果显示,提取的红嘴鸥淋巴细胞RNA有完整的3条带质量较好(图1A),测定总RNA浓度为636.4 ng·μL−1,D260/D280为2.03。成功扩增红嘴鸥MyD88目的基因,大小为921 bp(图1B)。
![]() 图 1 红嘴鸥淋巴细胞RNA和MyD88基因PCR扩增A:红嘴鸥淋巴细胞RNA电泳;B:红嘴鸥MyD88基因PCR电泳;M:DL2000 DNA marker;1:红嘴鸥淋巴细胞RNA;2:红嘴鸥MyD88基因;N:阴性对照。Figure 1. Agarose gel electrophoresis of PCR amplification of lymphocyte RNA and MyD88 in L. ridibundusA: gel image of L. ridibundus lymphocyte RNA; B: PCR results of MyD88; M: DL2000 DNA marker; 1: RNA of L. ridibundus; 2: L. ridibundus MyD88 gene; N: negative control.
图 1 红嘴鸥淋巴细胞RNA和MyD88基因PCR扩增A:红嘴鸥淋巴细胞RNA电泳;B:红嘴鸥MyD88基因PCR电泳;M:DL2000 DNA marker;1:红嘴鸥淋巴细胞RNA;2:红嘴鸥MyD88基因;N:阴性对照。Figure 1. Agarose gel electrophoresis of PCR amplification of lymphocyte RNA and MyD88 in L. ridibundusA: gel image of L. ridibundus lymphocyte RNA; B: PCR results of MyD88; M: DL2000 DNA marker; 1: RNA of L. ridibundus; 2: L. ridibundus MyD88 gene; N: negative control.2.2 红嘴鸥MyD88基因序列的比较分析
将红嘴鸥MyD88基因测序结果与GenBank数据库中的其余14种不同鸟类基因序列进行比对分析,发现红嘴鸥MyD88基因与有迁徙习惯的水禽三趾鸥(Rissa tridactyla)相似性高达98.8%;与原鸽(Columba livia)的相似性为89.7%,变异度为11.2%;与绿头鸭(Anas platyrhynchos)MyD88基因相似性较低,为84.6%,变异度达17.3%(图2)。进化树结果显示,红嘴鸥与三趾鸥的亲缘关系相对较近,而与鸡、鸭和鹅等家禽类群则呈现出较远的亲缘关系(图3)。
2.3 红嘴鸥MyD88蛋白功能分析
2.3.1 红嘴鸥MyD88蛋白理化性质
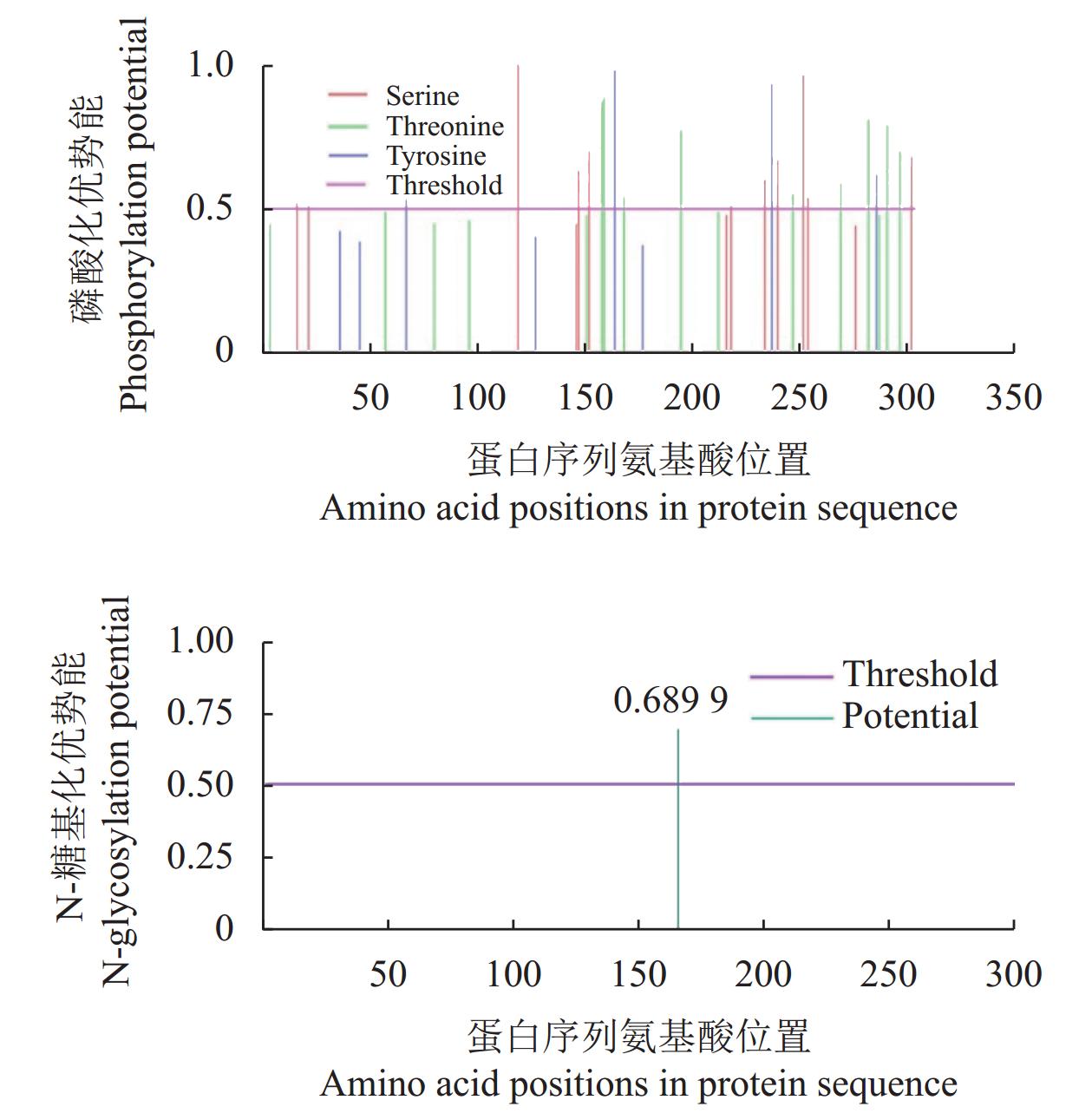
ProtParam预测结果显示,MyD88蛋白共编码306个氨基酸,蛋白大小约34.5 kDa;理论等电点为5.26,在偏酸性的环境中较稳定。亲疏水性预测结果显示,亲水性平均值预测值为–0.278,亲水性残基比例最高,为亲水性蛋白。红嘴鸥MyD88蛋白序列同时共检测到24个磷酸化位点,其中包含常见的丝氨酸磷酸化位点11个,苏氨酸磷酸化位点9个,酪氨酸磷酸化位点4个(图4);在序列的第166位含1个势能较高的N-糖基化位点,该氨基酸是天冬酰胺(图4)。
MyD88蛋白信号肽位点和跨膜区预测结果显示,红嘴鸥MyD88蛋白在S值(信号肽得分)、C值(跨膜螺旋中心位置得分)以及Y值(跨膜螺旋综合得分)上均表现出平稳的趋势,且最高峰值均未超过0.2。结果表明,蛋白质无信号肽切割位点,同时也不包含跨膜区域。
2.3.2 MyD88蛋白二级、三级结构预测和结构域分析
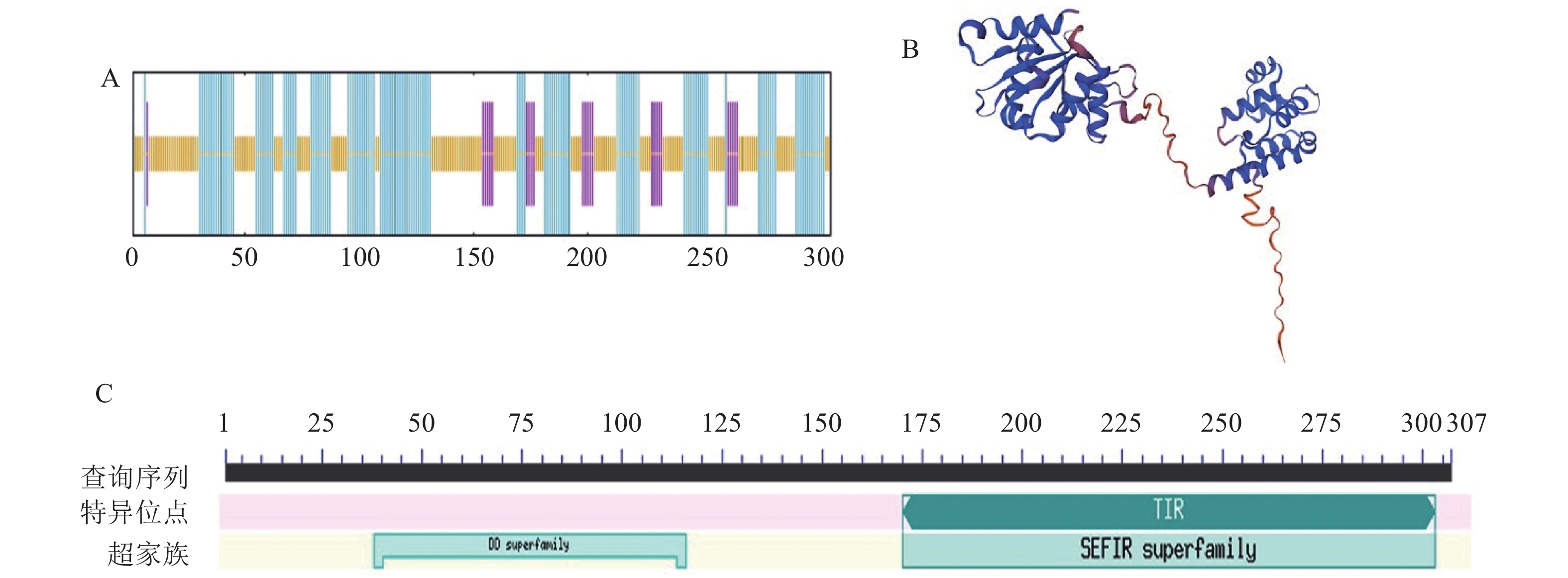
红嘴鸥MyD88蛋白二级结构主要为α螺旋(43.79%)、延伸链(8.17%)和无规则卷曲(48.04%)(图5A),三级结构主要为无规则卷曲(图5B)。保守结构域预测显示,MyD88蛋白具有死亡结构域(DD)超家族和TIR家族结构域(图5C)。
![]() 图 5 MyD88蛋白二级、三级结构预测和结构域分析A:蛋白二级结构,蓝色线条为α-螺旋;紫色线条为延伸链β-折叠;黄色线条为无规则卷曲;B:蛋白三级结构;C:蛋白结构域分析。Figure 5. Predicted secondary and tertiary structures of MyD88 and structural domain analysisA: protein secondary structure; blue lines: α-helix; purple lines: extended chain of β-turn; yellow lines: irregular curls. B: protein tertiary structure; C: protein domain analysis.
图 5 MyD88蛋白二级、三级结构预测和结构域分析A:蛋白二级结构,蓝色线条为α-螺旋;紫色线条为延伸链β-折叠;黄色线条为无规则卷曲;B:蛋白三级结构;C:蛋白结构域分析。Figure 5. Predicted secondary and tertiary structures of MyD88 and structural domain analysisA: protein secondary structure; blue lines: α-helix; purple lines: extended chain of β-turn; yellow lines: irregular curls. B: protein tertiary structure; C: protein domain analysis.2.4 红嘴鸥MyD88重组蛋白的诱导表达及纯化
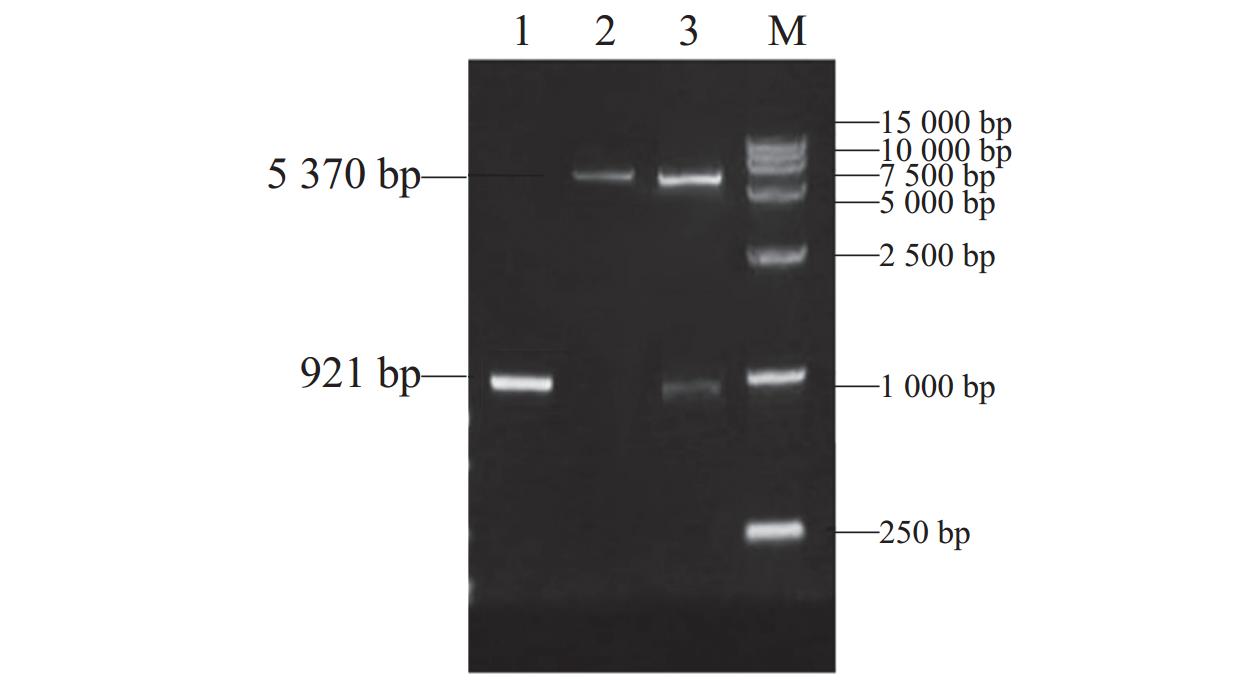
酶切后的质粒经电泳检测,结果呈现出一条
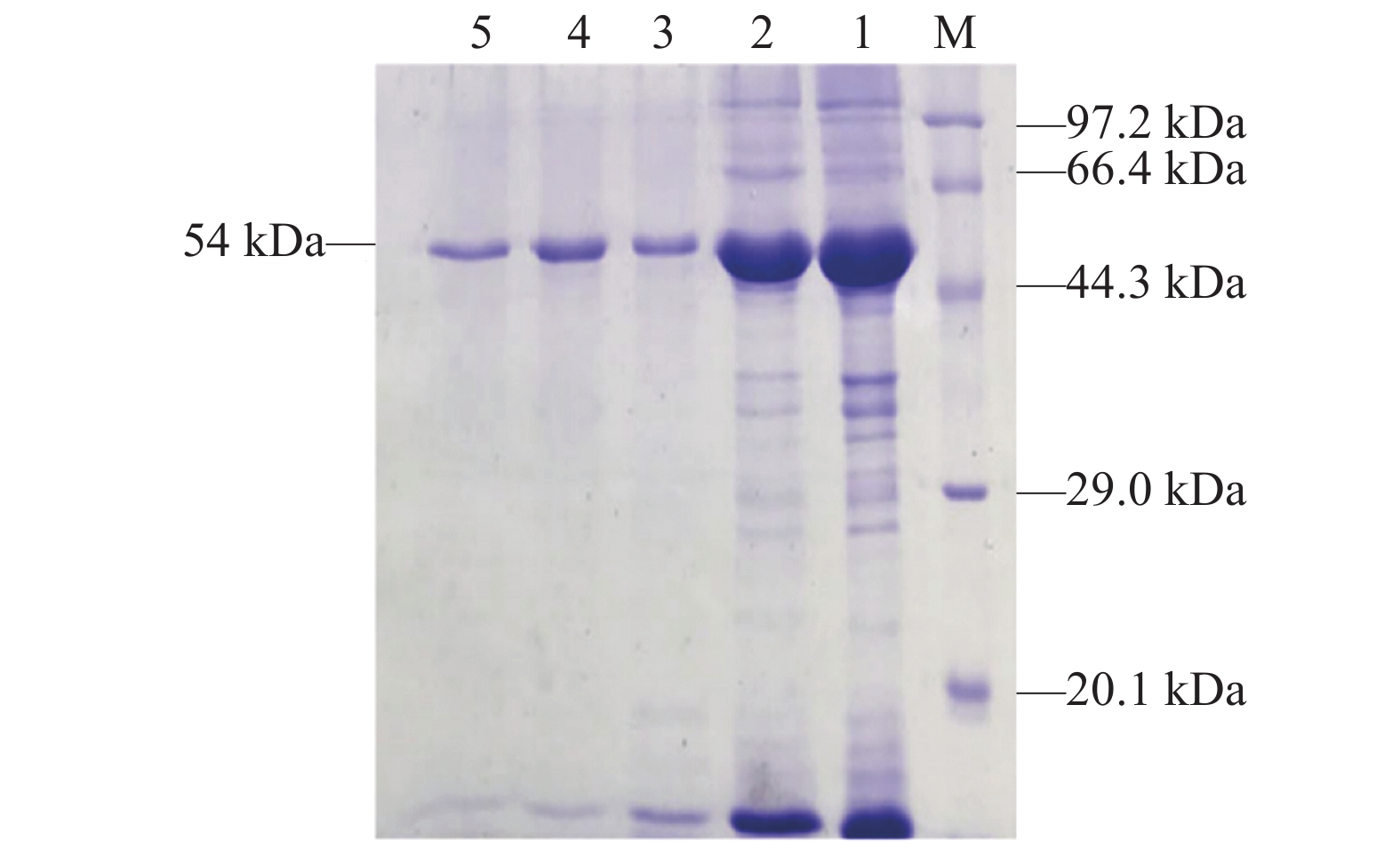
5370 bp的载体片段和一条921 bp的目的基因片段(图6),测序结果并未发现红嘴鸥MyD88基因有突变密码子和开放阅读框有移码,表明红嘴鸥MyD88基因成功插入表达载体。经诱导表达重组蛋白大小约54 kDa,筛选出最佳重组蛋白体外表达最适温度为37 ℃(图7A),蛋白表达最佳时间为4 h(图7B),IPTG最佳诱导浓度为1.0 mol·L−1(图7C)。蛋白纯化后经SDS-PAGE分析,结果显示纯化复性后的蛋白无其余杂蛋白,纯度较好,条带位置及大小均正确(图8)。![]() 图 6 红嘴鸥pET32a-MyD88重组质粒酶切鉴定1:红嘴鸥MyD88基因胶回收;2:pET32a载体胶回收;3:重组质粒pET32a-MyD88双酶切;M:DL15000 DNA marker。Figure 6. L. ridibundus pET32a-MyD88 recombinant plasmid restriction enzyme digestion identification1: MyD88 gel extraction; 2: pET32a gel extraction; 3: pet32a-MyD88 plasmid double enzyme cleaving; M: DL15000 DNA marker.
图 6 红嘴鸥pET32a-MyD88重组质粒酶切鉴定1:红嘴鸥MyD88基因胶回收;2:pET32a载体胶回收;3:重组质粒pET32a-MyD88双酶切;M:DL15000 DNA marker。Figure 6. L. ridibundus pET32a-MyD88 recombinant plasmid restriction enzyme digestion identification1: MyD88 gel extraction; 2: pET32a gel extraction; 3: pet32a-MyD88 plasmid double enzyme cleaving; M: DL15000 DNA marker.![]() 图 7 红嘴鸥pET32a-MyD88原核表达条件优化A:温度优化;1、3、5、7: 25、30、37、40 ℃诱导;2、4、6、8:25、30、37、40 ℃未诱导;M:protein marker。B:诱导时间优化;M:Protein marker;1:37 ℃未诱导;2~6:2、3、4、5、6 h诱导。C:IPTG浓度优化;M:protein marker;1:37 ℃未诱导;2~6:0.2、0.5、1.0、1.2、2.0 mmol·L−1 IPTG诱导。Figure 7. Prokaryotic expression of pET32a-MyD88 in L. ridibundusA: temperature selection; 1, 3, 5, and 7: induced by 25, 30, 37, and 40℃, respectively; 2, 4, 6, and 8: uninduced at 25, 30, 37, and 40℃, respectively; M: protein marker. B: time selection; M: protein marker; 1: uninduced at 37℃; 2–6: induced for 2, 3, 4, 5, and 6 h, respectively. C: IPTG concentration selection; M: protein marker; 1: uninduced at 37 ℃; 2–6: induced by 0.2, 0.5, 1.0, 1.2, and 2.0 mmol·L−1IPTG, respectively.
图 7 红嘴鸥pET32a-MyD88原核表达条件优化A:温度优化;1、3、5、7: 25、30、37、40 ℃诱导;2、4、6、8:25、30、37、40 ℃未诱导;M:protein marker。B:诱导时间优化;M:Protein marker;1:37 ℃未诱导;2~6:2、3、4、5、6 h诱导。C:IPTG浓度优化;M:protein marker;1:37 ℃未诱导;2~6:0.2、0.5、1.0、1.2、2.0 mmol·L−1 IPTG诱导。Figure 7. Prokaryotic expression of pET32a-MyD88 in L. ridibundusA: temperature selection; 1, 3, 5, and 7: induced by 25, 30, 37, and 40℃, respectively; 2, 4, 6, and 8: uninduced at 25, 30, 37, and 40℃, respectively; M: protein marker. B: time selection; M: protein marker; 1: uninduced at 37℃; 2–6: induced for 2, 3, 4, 5, and 6 h, respectively. C: IPTG concentration selection; M: protein marker; 1: uninduced at 37 ℃; 2–6: induced by 0.2, 0.5, 1.0, 1.2, and 2.0 mmol·L−1IPTG, respectively.2.5 红嘴鸥MyD88蛋白多克隆抗体制备及纯化
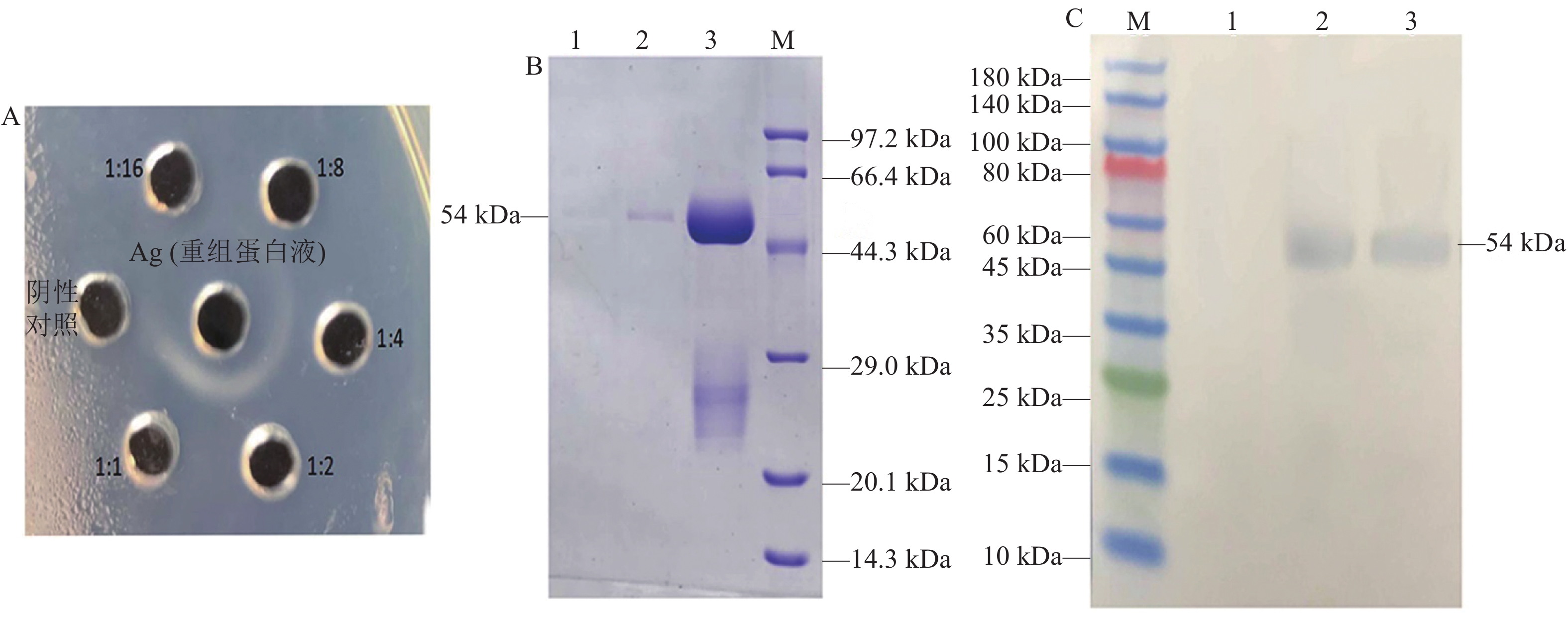
琼脂扩散试验结果显示,包被20 μL MyD88重组蛋白且抗体滴度达到1∶16时(图9A),试验兔产生良好的免疫反应。将粗提的兔抗高免血清IgG经SDS-PAGE检测,结果显示获得的IgG抗体纯度较高(图9B)。针对红嘴鸥MyD88融合蛋白开展Western blotting验证,结果呈现出与预期大小契合的条带(图9C),证实所制备的多克隆抗体能与重组蛋白发生特异性结合。
![]() 图 9 红嘴鸥pET32a-MyD88多克隆抗体的制备及纯化A:琼脂糖凝胶扩散检测抗体效价。B:兔抗重组蛋白高免血清IgG纯化结果;1为流穿液 (未结合蛋白流出液),2~3为洗脱液(纯化后的血清IgG)。C:重组蛋白pET32a-MyD88的Western Blot分析;1:阴性对照;2~3:试验组。Figure 9. Preparation and purification of polyclonal antibody against L. ridibundus pET32a-MyD88A: effect of antibody titer on agarose gel diffusion detection. B: purified rabbit anti-recombinant protein high-titer serum IgG; 1 was flow-through liquid (unbound protein effluent), 2–3 were elution buffer( purified serum IgG). C: western blot on recombinant protein pET32a-MyD88; 1: negative control; 2–3: experimental group.
图 9 红嘴鸥pET32a-MyD88多克隆抗体的制备及纯化A:琼脂糖凝胶扩散检测抗体效价。B:兔抗重组蛋白高免血清IgG纯化结果;1为流穿液 (未结合蛋白流出液),2~3为洗脱液(纯化后的血清IgG)。C:重组蛋白pET32a-MyD88的Western Blot分析;1:阴性对照;2~3:试验组。Figure 9. Preparation and purification of polyclonal antibody against L. ridibundus pET32a-MyD88A: effect of antibody titer on agarose gel diffusion detection. B: purified rabbit anti-recombinant protein high-titer serum IgG; 1 was flow-through liquid (unbound protein effluent), 2–3 were elution buffer( purified serum IgG). C: western blot on recombinant protein pET32a-MyD88; 1: negative control; 2–3: experimental group.3. 讨 论
本研究对红嘴鸥MyD88基因序列比对发现,红嘴鸥的MyD88基因与迁徙水禽三趾鸥的核苷酸相似性高达98.8%,显著高于与家禽类的相似度。该结果与红嘴鸥和三趾鸥同属鸥科,且均为迁徙性水禽的生物学特性相契合。类似现象在东方白鹳中亦有报道,野生个体导航、肌肉发育及免疫基因多样性显著高于圈养个体[20]。通过进化树分析,进一步验证了红嘴鸥与三趾鸥在基因层面的紧密联系,同时也暗示MyD88基因在迁徙物种中可能具有较高的功能保守性。Recuerda 等[21]研究证实,这种高相似性很可能与迁徙行为所需的环境适应性和免疫应答效率密切相关。
红嘴鸥MyD88蛋白预测结果显示,其富含亲水区域,属于不稳定的亲水性蛋白。其丰富的亲水区域有利于在胞内环境中维持溶解性,同时促进抗原结合位点形成;其次,结构柔性使其更易发生酶促反应和蛋白翻译后修饰[22−24]。此外,该蛋白含有丰富的磷酸化位点,这些位点的分布与TIR结构域高度重叠,提示其可能通过磷酸化修饰精细调控MyD88蛋白的构象变化及下游信号分子的相互作用效率,从而调控TLR信号通路动态平衡[25,26]。更为重要的是,该蛋白N端存在一个高保守的糖基化修饰位点。已有研究表明,糖基化修饰不仅能通过改变蛋白表面电荷分布增强其与病原体相关配体的结合能力,还可通过内质网质量控制机制提升重组蛋白的表达效率与稳定性[27,28]。这种独特的修饰特征可能使红嘴鸥MyD88蛋白在分子层面增强信号转导效能,在生理层面提升机体应对复杂病原暴露的免疫防御能力。
选用pET32a载体进行蛋白表达,是一种极为常见且效果良好的方法,但诱导温度、诱导时间及IPTG浓度会影响蛋白表达水平[29,30]。为此,本研究对已成功构建的pET32a-MyD88重组质粒进行诱导条件优化,最终确定1.0 mmol·L−1 IPTG 浓度、37 ℃培养环境下诱导4 h,可实现目标蛋白的高效可溶性表达,为后续功能研究奠定了物质基础。在蛋白功能机制研究中,多克隆抗体是解析蛋白互作网络及信号通路的关键工具[31]。然而在鸟类免疫学研究中,特异性抗体的缺乏常限制其功能机制的深入分析。本研究制备的多克隆抗体验证表明,该抗体可特异性识别MyD88蛋白,为后续在蛋白水平解析红嘴鸥MyD88的功能提供了关键工具。
本研究系统解析红嘴鸥MyD88的分子特征并制备特异性抗体,可以为后期MyD88蛋白在鸟类免疫防御中的作用研究提供切入点。未来将结合实验室已经成功获取的红嘴鸥TLR7基因,构建红嘴鸥TLR7/MyD88信号通路的体外研究模型,重点解析MyD88作为核心接头蛋白在病毒识别与免疫激活中的"分子桥梁"作用,从而完善从基因序列分析到蛋白功能验证的全链条研究体系。
4. 结 论
本研究首次克隆并解析了红嘴鸥MyD88基因,其基因片段大小921 bp,与三趾鸥同源性达98.8%,蛋白为不稳定亲水性蛋白,含24个磷酸化位点和1个N-糖基化位点,无跨膜区和信号肽;成功表达和纯化重组蛋白并制备特异性的多克隆抗体。
-
图 1 红嘴鸥淋巴细胞RNA和MyD88基因PCR扩增
A:红嘴鸥淋巴细胞RNA电泳;B:红嘴鸥MyD88基因PCR电泳;M:DL2000 DNA marker;1:红嘴鸥淋巴细胞RNA;2:红嘴鸥MyD88基因;N:阴性对照。
Figure 1. Agarose gel electrophoresis of PCR amplification of lymphocyte RNA and MyD88 in L. ridibundus
A: gel image of L. ridibundus lymphocyte RNA; B: PCR results of MyD88; M: DL2000 DNA marker; 1: RNA of L. ridibundus; 2: L. ridibundus MyD88 gene; N: negative control.
图 5 MyD88蛋白二级、三级结构预测和结构域分析
A:蛋白二级结构,蓝色线条为α-螺旋;紫色线条为延伸链β-折叠;黄色线条为无规则卷曲;B:蛋白三级结构;C:蛋白结构域分析。
Figure 5. Predicted secondary and tertiary structures of MyD88 and structural domain analysis
A: protein secondary structure; blue lines: α-helix; purple lines: extended chain of β-turn; yellow lines: irregular curls. B: protein tertiary structure; C: protein domain analysis.
图 6 红嘴鸥pET32a-MyD88重组质粒酶切鉴定
1:红嘴鸥MyD88基因胶回收;2:pET32a载体胶回收;3:重组质粒pET32a-MyD88双酶切;M:DL15000 DNA marker。
Figure 6. L. ridibundus pET32a-MyD88 recombinant plasmid restriction enzyme digestion identification
1: MyD88 gel extraction; 2: pET32a gel extraction; 3: pet32a-MyD88 plasmid double enzyme cleaving; M: DL15000 DNA marker.
图 7 红嘴鸥pET32a-MyD88原核表达条件优化
A:温度优化;1、3、5、7: 25、30、37、40 ℃诱导;2、4、6、8:25、30、37、40 ℃未诱导;M:protein marker。B:诱导时间优化;M:Protein marker;1:37 ℃未诱导;2~6:2、3、4、5、6 h诱导。C:IPTG浓度优化;M:protein marker;1:37 ℃未诱导;2~6:0.2、0.5、1.0、1.2、2.0 mmol·L−1 IPTG诱导。
Figure 7. Prokaryotic expression of pET32a-MyD88 in L. ridibundus
A: temperature selection; 1, 3, 5, and 7: induced by 25, 30, 37, and 40℃, respectively; 2, 4, 6, and 8: uninduced at 25, 30, 37, and 40℃, respectively; M: protein marker. B: time selection; M: protein marker; 1: uninduced at 37℃; 2–6: induced for 2, 3, 4, 5, and 6 h, respectively. C: IPTG concentration selection; M: protein marker; 1: uninduced at 37 ℃; 2–6: induced by 0.2, 0.5, 1.0, 1.2, and 2.0 mmol·L−1IPTG, respectively.
图 9 红嘴鸥pET32a-MyD88多克隆抗体的制备及纯化
A:琼脂糖凝胶扩散检测抗体效价。B:兔抗重组蛋白高免血清IgG纯化结果;1为流穿液 (未结合蛋白流出液),2~3为洗脱液(纯化后的血清IgG)。C:重组蛋白pET32a-MyD88的Western Blot分析;1:阴性对照;2~3:试验组。
Figure 9. Preparation and purification of polyclonal antibody against L. ridibundus pET32a-MyD88
A: effect of antibody titer on agarose gel diffusion detection. B: purified rabbit anti-recombinant protein high-titer serum IgG; 1 was flow-through liquid (unbound protein effluent), 2–3 were elution buffer( purified serum IgG). C: western blot on recombinant protein pET32a-MyD88; 1: negative control; 2–3: experimental group.
-
[1] 韩联宪,邓章文,鲁红林,等. 越冬期人工投食与自然觅食红嘴鸥形态特征比较[J]. 西南林业大学学报,2012,32(3) :104−106. DOI: 10.3969/j.issn.2095-1914.2012.03.023 HAN L X,DENG Z W,LU H L,et al. Morphological comparison between the naturally and artificially fed black-headed gull during wintering period[J]. Journal of Southwest Forestry University,2012,32(3) :104−106. (in Chinese) DOI: 10.3969/j.issn.2095-1914.2012.03.023
[2] 周洪庆,孙继旭,郭华兵,等. 七星河自然保护区红嘴鸥孵化期行为研究[J]. 国土与自然资源研究,2015(1) :91−93. DOI: 10.3969/j.issn.1003-7853.2015.01.029 ZHOU H Q,SUN J X,GUO H B,et al. Research on pre-reproduction behavior of black-headed gull(Larus ridibundu) in Qixinghe Natural Reserve,Heilongjiang Province,China[J]. Territory & Natural Resources Study,2015(1) :91−93. (in Chinese) DOI: 10.3969/j.issn.1003-7853.2015.01.029
[3] WILLE M,HOLMES E C. Wild birds as reservoirs for diverse and abundant gamma- and deltacoronaviruses[J]. FEMS Microbiology Reviews,2020,44(5) :631−644. DOI: 10.1093/femsre/fuaa026
[4] 祝令伟,景洁,梁冰,等. 野生水鸟感染霍乱弧菌和沙门菌等病原菌的分离和鉴定[J]. 中国人兽共患病学报,2019,35(3) :212−215,222. ZHU L W,JING J,LIANG B,et al. Isolation and identification of pathogenetic bacteria including Vibrio cholerae and Salmonella from wild birds[J]. Chinese Journal of Zoonoses,2019,35(3) :212−215,222. (in Chinese)
[5] 姜林,邓巍,张淑霞,等. 野生鸟类趾爪携带细菌多样性及其潜在致病性种群分析[J]. 中国公共卫生,2023,39(1) :36−41. DOI: 10.11847/zgggws1137091 JIANG L,DENG W,ZHANG S X,et al. Species diversity and potential pathogenicity of bacteria carried by wild birds' claws in Yunnan province[J]. Chinese Journal of Public Health,2023,39(1) :36−41. (in Chinese) DOI: 10.11847/zgggws1137091
[6] 黄皓. 云南省部分地区水鸟、蝙蝠与鼠形动物携带冠状病毒的调查研究[D]. 大理:大理大学,2023. HUANG H. Investigation of coronaviruses carried by waterbirds,bats and mouse like mammals in some areas of Yunnan Province,China[D]. Dali:Dali University,2023. (in Chinese)
[7] 梁良,姜志诚,王方,等. 中国红嘴鸥研究进展[J]. 野生动物学报,2019,40(2) :484−490. DOI: 10.3969/j.issn.1000-0127.2019.02.037 LIANG L,JIANG Z C,WANG F,et al. Research on black-headed gull in China[J]. Chinese Journal of Wildlife,2019,40(2) :484−490. (in Chinese) DOI: 10.3969/j.issn.1000-0127.2019.02.037
[8] 王瑞. 云南省鸟类携带病毒筛查及基因特征分析[D]. 昆明:昆明理工大学,2023. WANG R. Screening and genetic characterization of viruses carried by birds in Yunnan Province[D]. Kunming:Kunming University of Science and Technology,2023. (in Chinese)
[9] 陈小雅. 鸡Toll样受体15单克隆抗体的研制及其初步应用[D]. 扬州:扬州大学,2024. CHEN X Y. Preparation of monoclonal antibodies against chicken Toll-like receptor15 and their preliminary application[D]. Yangzhou:Yangzhou University,2024. (in Chinese)
[10] 曹宝兰. 鮸鱼MyD88介导信号通路的分子调控机制研究[D]. 上海:上海海洋大学,2023. CAO B L. Molecular regulation mechanism of MyD88-mediated signaling pathway in Miichthys miiuy[D]. Shanghai:Shanghai Ocean University,2023. (in Chinese)
[11] 李春华,缪德年,夏叶,等. 沙门氏菌感染相关的鸡Toll样受体研究进展[J]. 动物医学进展,2022,43(2) :103−106. DOI: 10.3969/j.issn.1007-5038.2022.02.020 LI C H,MIAO D N,XIA Y,et al. Progress on chicken toll-like receptors related to Salmonella infection[J]. Progress in Veterinary Medicine,2022,43(2) :103−106. (in Chinese) DOI: 10.3969/j.issn.1007-5038.2022.02.020
[12] CHEN C L,LI J C,ZHANG W,et al. Mycoplasma gallisepticum triggers immune damage in the chicken Thymus by activating the TLR-2/MyD88/NF-κB signaling pathway and NLRP3 inflammasome[J]. Veterinary Research,2020,51(1) :52. DOI: 10.1186/s13567-020-00777-x
[13] LI Q H,WANG F,WANG Q,et al. SPOP promotes ubiquitination and degradation of MyD88 to suppress the innate immune response[J]. PLoS Pathogens,2020,16(5) :e1008188. DOI: 10.1371/journal.ppat.1008188
[14] GURUNG P,FAN G F,LUKENS J R,et al. Tyrosine kinase SYK licenses MyD88 adaptor protein to instigate IL-1α-mediated inflammatory disease[J]. Immunity,2017,46(4) :635−648. DOI: 10.1016/j.immuni.2017.03.014
[15] CHENG Y Q,WANG H G,YAN Y X,et al. Two myeloid differentiation factor 88 (MyD88) isoforms identified in ducks[J]. Developmental & Comparative Immunology,2015,52(2) :144−154.
[16] ZHANG J Q,ZOU Z,HUANG K,et al. Insights into leghorn male hepatocellular cells response to fowl adenovirus serotype 4 infection by transcriptome analysis[J]. Veterinary Microbiology,2018,214:65−74. DOI: 10.1016/j.vetmic.2017.12.007
[17] TAO Z Y,ZHU C H,XU W J,et al. Riemerella anatipestifer infection affects intestinal barrier structure and immune reactions in the duck Caecum[J]. Avian Pathology,2020,49(6) :572−580. DOI: 10.1080/03079457.2020.1792414
[18] 丁梦霞,朱召岩,于燕鸽,等. 鸡MyD88基因对巨噬细胞增殖和凋亡的影响[J]. 中国兽医学报,2023,43(8) :1703−1709. DING M X,ZHU Z Y,YU Y G,et al. Effect of chicken MyD88 gene on macrophage proliferation and apoptosis[J]. Chinese Journal of Veterinary Science,2023,43(8) :1703−1709. (in Chinese)
[19] 周浩,陈舜,程安春,等. 一株鸭源坦布苏病毒诱导鹅抗病毒细胞免疫应答的初步探索[C]//第三届水禽疫病防控研讨会论文集. 成都,2015:80. [20] YANG S C,LIU Y,ZHAO X Q,et al. Genomic exploration of the endangered oriental stork,Ciconia boyciana,sheds light on migration adaptation and future conservation[J]. GigaScience,2024,13:giae081. DOI: 10.1093/gigascience/giae081
[21] RECUERDA M,MONTOYA J C H,BLANCO G,et al. Repeated evolution on oceanic islands:Comparative genomics reveals species-specific processes in birds[J]. BMC Ecology and Evolution,2024,24(1) :140. DOI: 10.1186/s12862-024-02320-4
[22] 金会会,孙业富,郭俊荣. Omicron病毒S蛋白序列特征分析[J]. 扬州职业大学学报,2024,28(1) :40−43. DOI: 10.3969/j.issn.1008-3693.2024.01.010 JIN H H,SUN Y F,GUO J R. Analysis of S protein sequence characteristics on Omicron strain[J]. Journal of Yangzhou Polytechnic College,2024,28(1) :40−43. (in Chinese) DOI: 10.3969/j.issn.1008-3693.2024.01.010
[23] 翟俊琼,吴亚江,代军威,等. 东北虎γ-干扰素基因的克隆、生物信息学分析及其在毕赤酵母中的表达[J]. 中国畜牧兽医,2021,48(1) :72−82. ZHAI J Q,WU Y J,DAI J W,et al. Cloning and bioinformatics analysis of the Siberian tiger γ-interferon gene and its expression in Pichia pastoris[J]. China Animal Husbandry & Veterinary Medicine,2021,48(1) :72−82. (in Chinese)
[24] 桂沄坤,王锋,陈舒情,等. 鹰嘴桃过敏原的鉴定及其生物学特性分析[J]. 广东农业科学,2024,51(9) :129−138. GUI Y K,WANG F,CHEN S Q,et al. Identification and analysis of biological characteristics of allergens in olecranon peach[J]. Guangdong Agricultural Sciences,2024,51(9) :129−138. (in Chinese)
[25] CHEN L F,ZHENG L L,CHEN P Q,et al. Myeloid differentiation primary response protein 88 (MyD88) :The central hub of TLR/IL-1R signaling[J]. Journal of Medicinal Chemistry,2020,63(22) :13316−13329. DOI: 10.1021/acs.jmedchem.0c00884
[26] MINDERMAN M,LANTERMANS H,VAN DER ZWAAN C,et al. The oncogenic human B-cell lymphoma MYD88 L265P mutation genocopies activation by phosphorylation at the Toll/interleukin-1 receptor (TIR) domain[J]. Blood Cancer Journal,2023,13(1) :125. DOI: 10.1038/s41408-023-00896-6
[27] ZHOU Q,QIU H W. The mechanistic impact of N-glycosylation on stability,pharmacokinetics,and immunogenicity of therapeutic proteins[J]. Journal of Pharmaceutical Sciences,2019,108(4) :1366−1377. DOI: 10.1016/j.xphs.2018.11.029
[28] 郑小菊,刘长松,王凤山. 糖基化修饰对蛋白质和肽性质的影响及修饰方法[J]. 生命的化学,2024,44(7) :1291−1297. ZHENG X J,LIU C S,WANG F S. The effects of glycosylation modification on protein and peptide properties and modification methods[J]. Chemistry of Life,2024,44(7) :1291−1297. (in Chinese)
[29] 高炳淼,刘云海,彭超,等. 融合表达载体pET32a/Trx-EK-MrVIB的构建及在大肠杆菌中表达[J]. 基因组学与应用生物学,2015,34(2) :326−331. GAO B M,LIU Y H,PENG C,et al. The construction of fusion expression vector p ET32a/trx-EK-mr VIB and expression in Escherichia coli[J]. Genomics and Applied Biology,2015,34(2) :326−331. (in Chinese)
[30] 刘东,兰艳平,张丽,等. 棉花GhPDP基因原核表达条件的优化[J]. 华北农学报,2020,35(5) :55−61. DOI: 10.7668/hbnxb.20191119 LIU D,LAN Y P,ZHANG L,et al. Optimization of prokaryotic expression conditions of cotton GhPDP gene[J]. Acta Agriculturae Boreali-Sinica,2020,35(5) :55−61. (in Chinese) DOI: 10.7668/hbnxb.20191119
[31] 吴婕,杜菁,樊繁,等. 猪流行性腹泻病毒N蛋白原核表达及多克隆抗体制备[J]. 中国畜牧兽医,2024,51(10) :4522−4530. WU J,DU J,FAN F,et al. Prokaryotic expression of N protein of porcine epidemic diarrhea virus and preparation of polyclonal antibodies[J]. China Animal Husbandry & Veterinary Medicine,2024,51(10) :4522−4530. (in Chinese)




 下载:
下载: