RT-RPA Microfluidic Chips-based Visualizable Rapid Method for Detecting Bovine Parainfluenza Virus Type 3
-
摘要:目的
采用逆转录重组酶聚合酶扩增(reverse transcription-recombinase polymerase amplification, RT-RPA)、磁捕获和微流控芯片相结合的技术,建立一种牛副流感病毒3型(bovine parainfluenza virus type 3, BPIV3)快速可视化分子检测方法。
方法根据BPIV3 gp3基因设计特异性引物和探针,以牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)、牛腺病毒3型(bovine adenovirus type 3, BADV3)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus, IBRV)为对照组,分析该方法的特异性。通过BPIV3标准菌(毒)株的RNA提取液进行10倍稀释确定该方法的灵敏度。收集56份疑似感染BPIV3急性期病牛的血清和鼻拭子样本,血清样本利用该方法检测,鼻拭子样本经过分离后,通过对比分析反转录PCR(reverse transcription-PCR, RT-PCR)检测法和该方法检测结果,以评估其应用价值。
结果BPIV3标准菌(毒)株的RNA提取液RT-RPA扩增子大小为404 bp,对照组无扩增子,扩增子测序结果显示与BPIV3的高度保守区gp3基因(NC_002161.1)同源性为100%。对不同浓度BPIV3标准菌(毒)株的RNA提取液进行检测,结果显示本检测方法的最低检测限为2.26×103 copies·µL−1。对56份疑似感染BPIV3急性期病牛血清样本进行检测时,发现编号为SD0078、SD0114、SD0319、SD0601、SD0714和SD0755的牛均已感染了BPIV3,与RT-PCR和该方法对鼻拭子分离样本的检测结果一致。本检测方法从样本处理到获得检测结果全流程时长为92 min。
结论本研究将RT-RPA、磁捕获和微流控芯片技术相结合,建立了一种BPIV3快速可视化分子检测的方法,具有良好的特异性、灵敏度和适用性。
-
关键词:
- 牛副流感病毒3 /
- 逆转录重组酶聚合酶扩增技术 /
- 磁捕获 /
- 微流控芯片技术
Abstract:ObjectiveA rapid and visualizable method for detecting bovine parainfluenza virus type 3 (BPIV3) was developed utilizing the reverse transcription-recombinase polymerase amplification (RT-RPA), magnetic capture, and microfluidic chips.
MethodsSpecific primers and probes were designed based on the BPIV3 gp3 gene. The bovine viral diarrhea virus (BVDV), bovine adenovirus type 3 (BADV3), and bovine infectious rhinotracheitis virus (IBRV) were used as control to determine assay specificity. Assay sensitivity was examined on a 10× dilution of RNA extraction solution of the standard BPIV3 strain. Fifty-six serum and nasal swab samples from the cattle suspected of acute BPIV3 infection were collected for detection using the newly established method. Test results were compared with those obtained on nasal swab samples by RT-PCR.
ResultsThe amplicon from the RNA extract of the standard BPIV3 strain sized 404 bp, with none detected in control, obtained by the assay. A 100% homology with the highly conserved gp3 gene NC_002161.1 of BPIV3 was shown. At different concentrations of the extract, the lowest assay detection limit was 2.26×103 copies·L−1. From the 56 serum samples, the cows, coded SD0078, SD0114, SD0319, SD0601, SD0714, and SD0755, were identified to be positively infected by BPIV3. The results agreed with what were obtained from RT-PCR on the nasal swab isolation samples. It took the assay merely 92 min from sample preparation to data acquisition.
ConclusionA rapid and visualizable method for BPIV3 detection was developed using RT-RPA, magnetic capture, and microfluidic chips. The assay was high on specificity, sensitivity, and applicability for the intended purpose.
-
0. 引言
【研究意义】牛副流感病毒3型(bovine parainfluenza virus type 3, BPIV3)是副粘病毒科(Paramyxoviridae)呼吸道病毒属(Respirovirus)的重要呼吸道病原体之一,是牛呼吸道疾病综合征(bovine respiratory disease complex, BRDC)的主要病原体之一[1,2],根据全基因组序列的系统发育研究,该病毒被划分为A、B和C等3个基因型,其中C型首先在中国被鉴定[3]。现阶段,中国境内已确认存在BPIV3的3种基因型[4]。血清流行病学调查显示,吉林、新疆、内蒙古和山西等地区BPIV3抗体的阳性率均超过80%[5],证实该病毒在中国北方地区广泛流行。因此,建立一种特异性强、灵敏度高且可现场检测的方法对于BPIV3检测和控制至关重要。【前人研究进展】目前,针对BPIV3的检测主要包括病毒分离鉴定、基于抗原-抗体反应的血清学检测(如中和试验、酶联免疫吸附试验)、基于核酸分子检测[如反转录聚合酶链式反应(reverse transcription polymerase chain reaction, RT-PCR)和荧光定量PCR]等[6]。病毒分离鉴定既耗时又费力,且对实验室生物安全要求较高,不利于BPIV3的现场检测。尽管常用的中和试验和酶联免疫吸附试验具有简单、快速的优势,但由于检测窗口期的存在,其应用范围受到限制[7]。RT-PCR和荧光定量PCR已广泛应用于BPIV3的检测,这两种方法具备快速响应和高灵敏度的优势,然而其实施过程对精密仪器和专业操作人员存在高度依赖性,无法实现现场检测。近年来,重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)的应用使现场分子检测成为可能。RPA可在37 ℃恒温条件下完成核酸扩增,无需依赖核酸扩增仪,其扩增子可通过琼脂糖凝胶电泳、荧光染料或侧向层析试纸条进行分析[8,9]。在资源有限的地区,RPA检测缺乏一个可便携的仪器设备。微流控芯片是微型化设备,可将检测过程集成在一张芯片上,从而减少样本和试剂的消耗量[10],在亚毫米尺度的微通道内,微流控芯片能够精确操控纳升至皮升级别的流体,实现样品快速分析。此外,磁捕获技术利用功能化磁性纳米颗粒,可快速完成靶标的富集和纯化[11,12]。因此,将微流控芯片技术、RPA技术以及磁捕获技术结合,可突破仪器、专业技术人员以及多次人工操作的限制,在较短时间内实现可视化检测[13−16]。【本研究切入点】对于BPIV3的RT-RPA、磁捕获技术及微流控芯片3种方法结合检测目前尚未见报道。【拟解决的关键问题】针对BPIV3 gp3基因设计的特异性引物和互补探针,建立一种RT-RPA、磁性探针捕获和微流控芯片技术相结合的快速可视化分子检测方法,为现场检测BPIV3提供新的技术手段。
1. 材料与方法
1.1 病毒标准菌(毒)株和病毒样本
牛副流感病毒3型(菌种保藏号GDV079)、牛腺病毒3型(bovine adenovirus type 3, BADV3,菌种保藏号GDV075)购自中国典型培养物保藏中心;牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV) (菌种保藏号CVCC AV68)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus, IBRV) (菌种保藏编号CVCC AV1547)均购自国家兽医微生物菌(毒)种保藏中心;从山东省某养殖场采集的56份疑似感染BPIV3高热病牛的血清与鼻腔分泌物样本,所有样本均在−70 ℃条件下保存。
1.2 主要试剂
DNA&RNA快速共提取试剂盒(货号:IE-PQN)购自黑龙江淳佳融(哈尔滨)科技有限公司;Twist Amp Liquid Basic、TwistAmp® Liquid Basic RT试剂盒(货号:WLRB8204KIT)购自英国TwistDx公司;分子量标准(DNA Marker 2000)购自武汉齐美欣科生物技术有限公司(货号:GM6025L);MDBK细胞(货号:FH1040)购自上海富衡生物科技有限公司;链霉亲和素磁珠(Dynabeads™ M-270,货号:65305)购自美国Invitrogen公司;所有试剂均在4 ℃条件下保存。
1.3 主要设备
紫外可见分光光度仪购自上海元析仪器有限公司,微流控芯片购自苏州中芯启恒科学仪器有限公司,荧光显微镜(CX23)购自奥林巴斯(广州)工业有限公司。
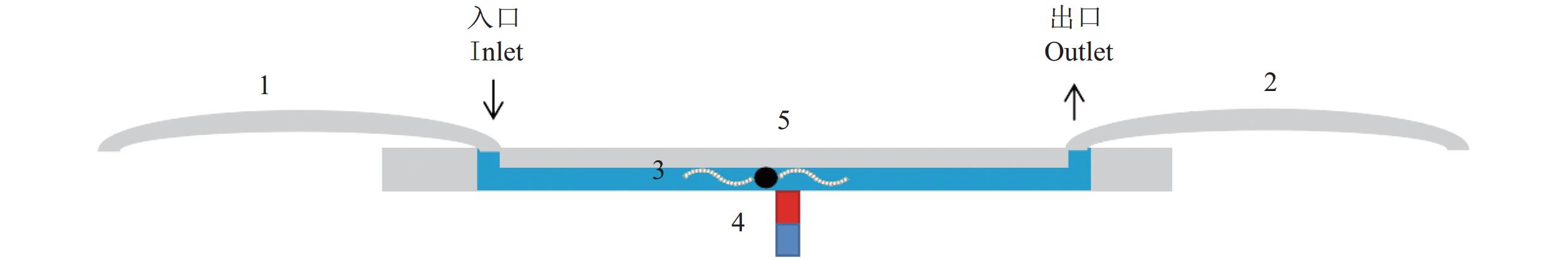
1.4 芯片设计
微流控装置的核心组件包括微型注射驱动单元及带有直线型通道的芯片结构。该芯片采用聚二甲基硅氧烷作为主要制造材料,其线性流道长度为41 mm,通道横截面积为100 µm×100 µm(长×宽)。在芯片底部中央区域设置有磁铁,具体位置如图1所示。
1.5 DNA/RNA提取
按照DNA&RNA快速共提取试剂盒说明书对100 µL标准菌(毒)株液样本提取BPIV3和其他牛呼吸道病毒的DNA/RNA,于−70 ℃条件下保存备用。
1.6 BPIV3检测引物和探针序列
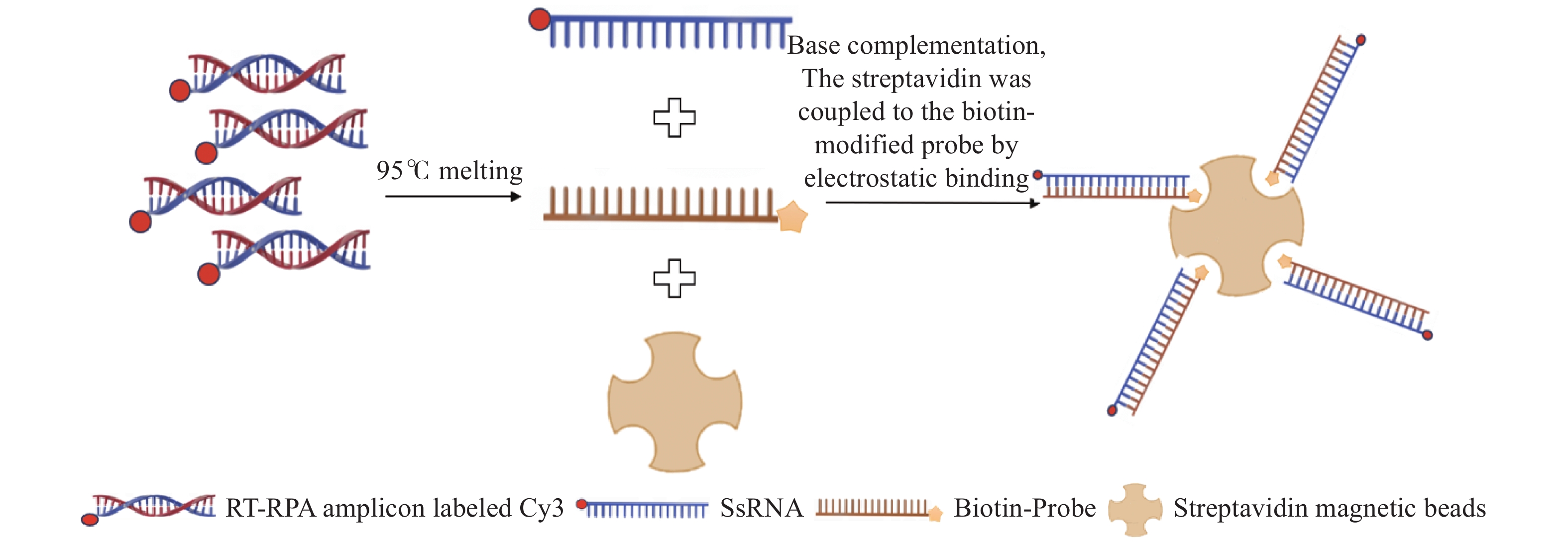
通过GenBank数据库获取BPIV3的gp3基因保守区域(登录号:NC_002161.1),借助Primer 6.0软件完成引物设计,所得扩增产物长度为404 bp。为构建检测方法,针对扩增片段的核心区域设计了与链霉亲和素磁珠相连接的探针,同时在下游引物5′端进行Cy3荧光标记。探针设计时在5'端引入了4 bp的非互补序列,以此降低生物素可能产生的空间位阻。所有引物与探针均由上海生工生物工程有限公司负责合成,其具体序列信息详见表1。
表 1 引物和探针序列Table 1. Primer and probe sequences引物与探针
Primer and probe序列
Sequence (5′-3′)扩增子大小
Product length/bp扩增子位置
Product location/bpBPIV3-F CAACATAGAGCCGTTACCACTCAAGGTCAATGA 404 3794 ~4197 BPIV3-R Cy3-TATTAGCGTCAAATAACATCCCTTTTCTTAAT 探针 Probe 5′Biotin-TCCGAATGTTCCAAACACCGAGACCTAGTA 下划线为核酸探针与扩增子不互补序列。
Underline indicates nucleic acid probe sequence not complementary to amplicon sequence.1.7 磁性探针合成
在磁性探针的制备过程中,首先对磁珠进行预处理:链霉亲和素磁珠使用前涡旋振荡20 s,重悬磁珠。取100 µL磁珠(10 mg·mL−1)至新的离心管中,磁吸去掉磁选液,用1 mL PBS(100 mmol·L−1,pH 7.2)重悬磁珠。接着进行探针合成:加入一定体积的probe至终浓度为100 µmol·L−1,充分振荡重悬磁珠,将离心管置于垂直混合仪上,室温混合30 min。磁吸去掉磁选液,用1 mL PBS重悬磁珠,合成磁性探针。置于4 ℃冰箱保存备用。通过磁性探针浓度与初始探针浓度计算探针@磁珠的偶联率。
C/%=C1C2×100 其中,C为偶联率,C1为探针@磁珠浓度(µmol·L−1),C2为初始探针浓度(100 µmol·L−1)。
1.8 RT-RPA体系及扩增序列分析
按照Twist Amp® Liquid Basic RT试剂盒说明书建立反应体系,添加5 µL乙酸镁(280 mmol·L−1)启动反应。将反应管放入37 ℃孵育7 min后,进行短暂离心再次重悬,接着,将反应管置于37 ℃继续孵育40 min。采用琼脂糖凝胶电泳对RT-RPA扩增子进行初步分析,扩增子由生工生物工程(上海)公司测序,使用BLAST进行同源性分析。
1.9 RT-RPA扩增子磁捕获及观察
采用50 µL的酚/氯仿混合液(V/V=1∶1)对RT-RPA扩增子进行脱蛋白处理,随后12 000 r·min−1离心5 min,收集5 µL上清液(即RT-RPA扩增子溶液)与25 µL浓度为2 mg·mL−1的探针@磁珠混合。如图2所示,将混合物在95 ℃烘箱中孵育5 min后,转移至37 ℃培养箱继续孵育5 min,实现RT-RPA扩增子与探针的杂交,形成磁性复合物(扩增子@探针@磁珠)。通过微流控注射泵以5 µL·min−1的流速将磁性复合物溶液注入芯片,然后将PBS缓冲液以3 µL·min−1的流速冲洗芯片通道10 min。最终,将微流控芯片置于荧光显微镜下,在550 nm激发波长下进行观察。
1.10 BPIV3检测特异性分析
BPIV3、BVDV、BADV3、IBRV的RNA/DNA提取溶液作为RT-RPA模板,无酶水作为阴性对照,按照上述方法进行分子检测,通过凝胶成像仪和荧光显微镜分析该方法检测的特异性。
1.11 BPIV3检测灵敏度分析
采用梯度稀释法处理BPIV3标准菌(毒)株的RNA样本(初始浓度2.26×107 copies·µL−1),选取1 µL不同稀释梯度的溶液作为RT-RPA扩增模板,验证该检测方法的最低检测限,计算RNA 拷贝数。RNA 拷贝数=浓度(ng·µL−1)×10−9×6.02×1023/[DNA扩增产物长度 (bp) ×340]。
1.12 临床样本检测
利用本研究建立的检测方法对56份疑似感染BPIV3高热病牛的血清样本进行检测。参考吕香玉等[17]建立的BPIV3病原分离方法对56份疑似感染BPIV3高热病牛的鼻拭子样本进行病原分离,通过RT-PCR检测和用本研究建立的检测方法对不同BPIV3分离株进行检测,比较分析两种检测方法的结果,以评价建立的检测方法的实际应用价值。将本研究建立的检测方法获得的扩增子由生工生物工程(上海)公司测序,使用MegAlign软件将分离株序列与GenBank中的毒株序列进行同源性比对。
2. 结果与分析
2.1 RT-RPA反应体系扩增子鉴定
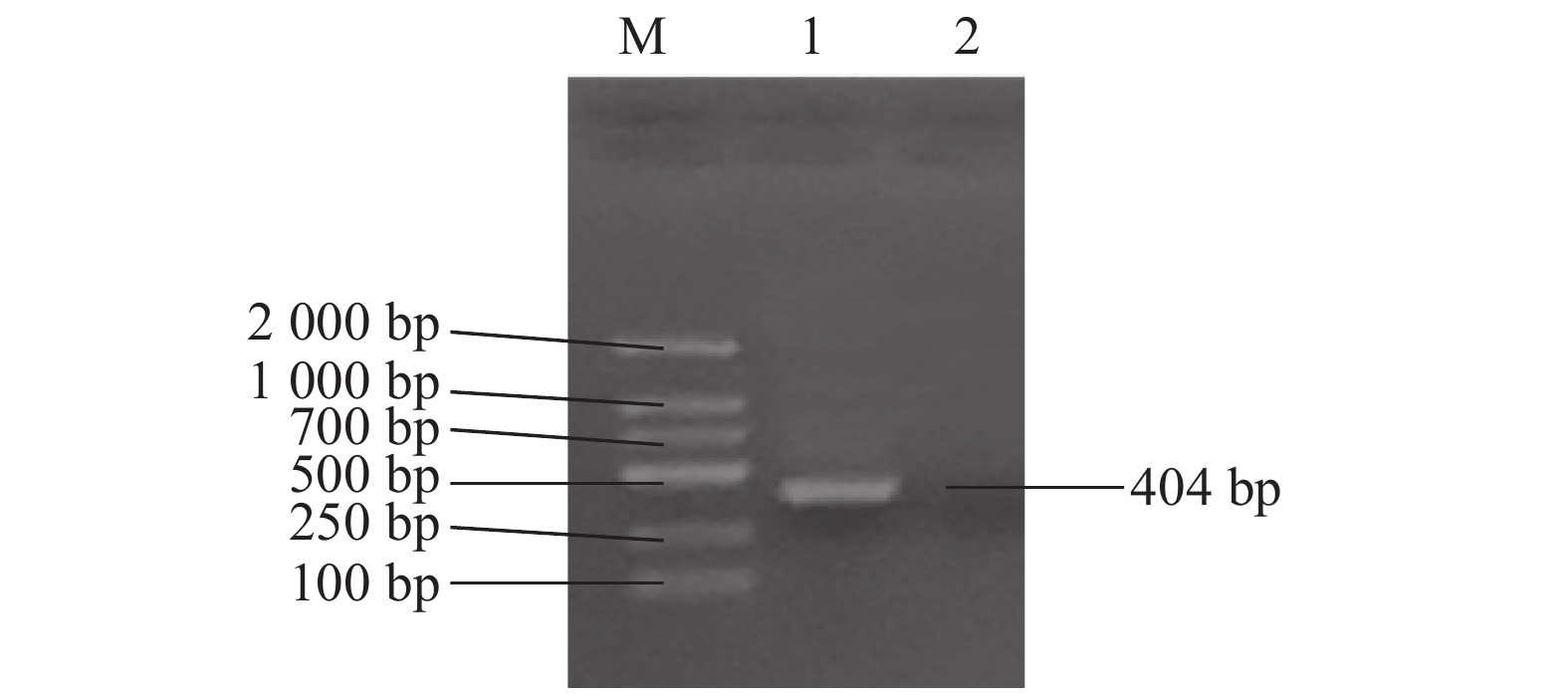
RT-RPA扩增以BPIV3标准菌(毒)株核酸为模板,成功获得404 bp目标产物(图3)。经测序分析,该扩增片段与参考序列NC_002161.1中gp3基因的保守区域具有100%同源匹配度。
2.2 磁珠与探针偶联率
采用分光光度法定量检测生物素标记探针与链霉亲和素磁珠的偶联效果,结果显示74.36%的结合率,成功验证复合物的功能性构建,达到下游试验要求。
2.3 BPIV3特异性检测
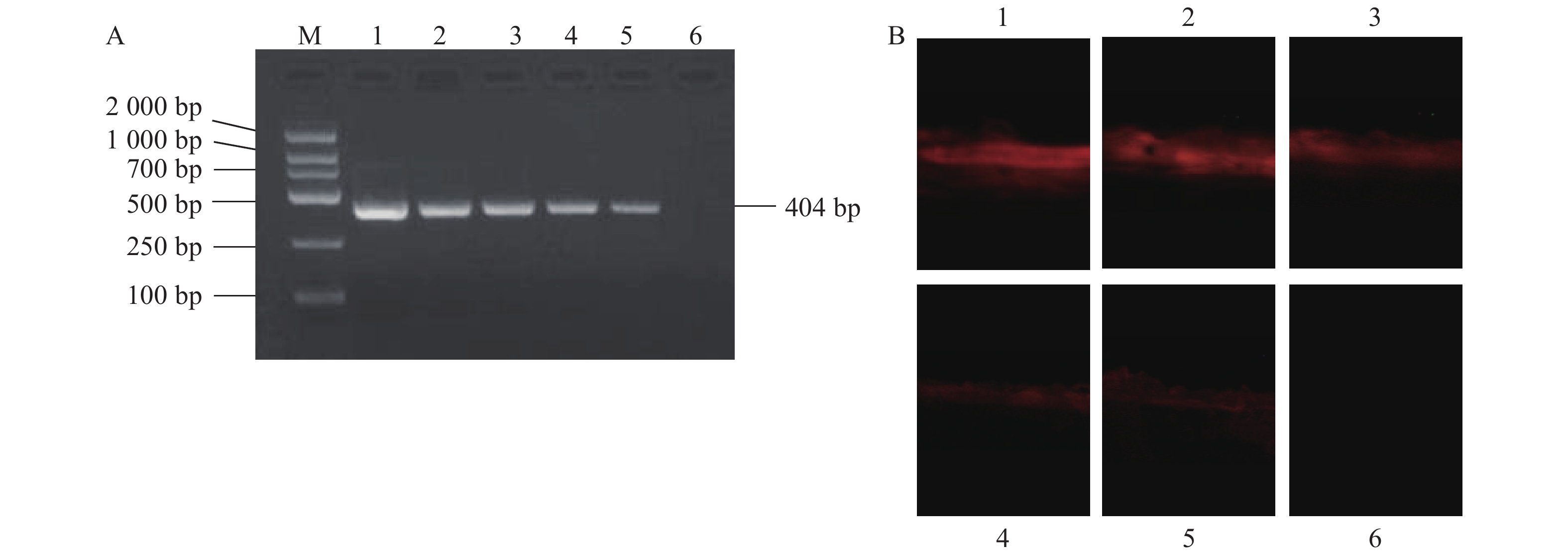
通过RT-RPA对BPIV3、BVDV、BADV3和IBRV的核酸提取液进行扩增,以评估该检测方法的特异性。琼脂糖凝胶电泳分析表明,当以BPIV3标准菌(毒)株的RNA为模板时,RT-RPA反应产生了特异性扩增子,而其余病毒样本均未呈现相应条带(图4A)。微流控芯片的荧光显微观察进一步证实,仅对应的BPIV3标准菌(毒)株出现橙红色荧光信号,其他病毒样本均未显现荧光特征(图4C)。表明该检测方法对BPIV3标准菌(毒)株具有高度特异性。
![]() 图 4 RT-RPA检测特异性A:RT-RPA扩增子琼脂糖凝胶电泳图;M:分子量标准(DNA Marker 2000);1:BPIV3;2:BVDV;3:BADV3;4:IBRV;5:无酶水;B:自然光下磁捕获结果;C:荧光显微镜下磁捕获结果;1:BPIV3;2:BVDV;3:BADV3;4:IBRV。Figure 4. Specificity of RT-RPA reactionA: agarose gel electrophoresis of RT-RPA amplicon; M: molecular weight standard, DNA marker 2000; 1: BPIV3; 2: BVDV; 3: BADV3; 4: IBRV; 5: enzyme-free water. B: magnetic capture under natural light; C: magnetic capture under fluorescence microscope; 1: BPIV3; 2: BVDV; 3: BADV3; 4: IBRV.
图 4 RT-RPA检测特异性A:RT-RPA扩增子琼脂糖凝胶电泳图;M:分子量标准(DNA Marker 2000);1:BPIV3;2:BVDV;3:BADV3;4:IBRV;5:无酶水;B:自然光下磁捕获结果;C:荧光显微镜下磁捕获结果;1:BPIV3;2:BVDV;3:BADV3;4:IBRV。Figure 4. Specificity of RT-RPA reactionA: agarose gel electrophoresis of RT-RPA amplicon; M: molecular weight standard, DNA marker 2000; 1: BPIV3; 2: BVDV; 3: BADV3; 4: IBRV; 5: enzyme-free water. B: magnetic capture under natural light; C: magnetic capture under fluorescence microscope; 1: BPIV3; 2: BVDV; 3: BADV3; 4: IBRV.2.4 BPIV3灵敏度检测
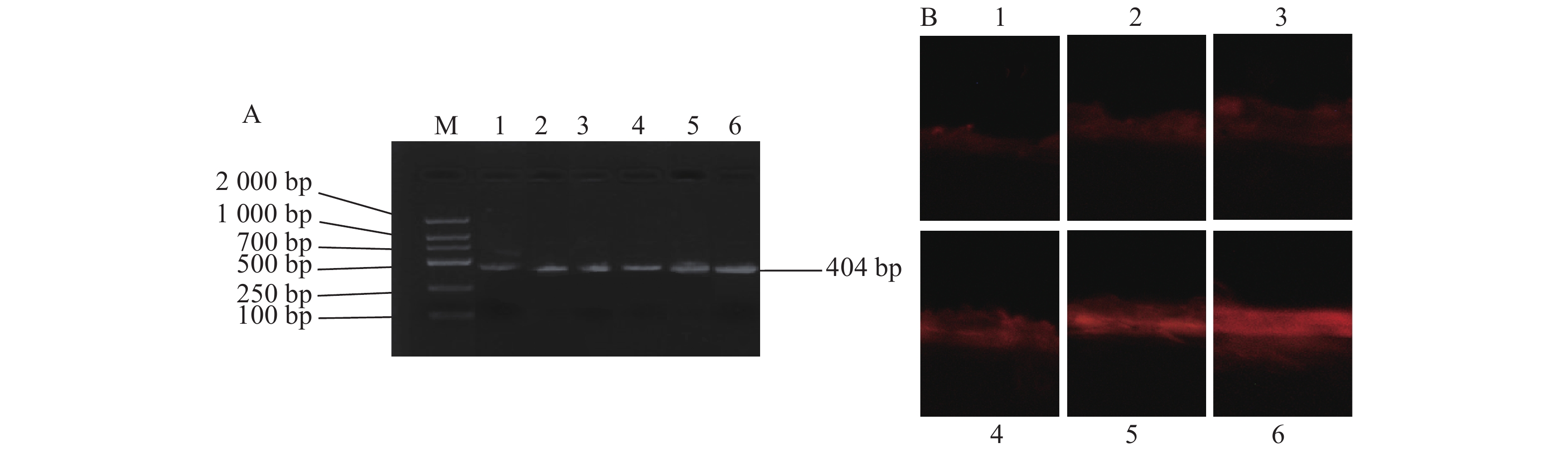
采用梯度稀释的BPIV3标准菌(毒)株RNA提取物作为RT-RPA反应的模板,通过琼脂糖凝胶电泳分析发现,当RNA模板为2.26×103 copies·µL−1时能够观察到明显的扩增产物,而低于该浓度则无法检测到有效扩增(图5A)。微流控芯片荧光显微检测结果与电泳分析数据相吻合(图5B),进一步证实了该检测方法对BPIV3的最低检出限为2.26×103 copies·µL−1。
![]() 图 5 RT-RPA结合微流控芯片检测灵敏度A:BPIV3的RNA模板进行10倍稀释RT-RPA扩增子琼脂糖凝胶电泳图;M:分子量标准(DNA Marker 2000);1:2.26×107 copies·µL−1;2:2.26×106 copies·µL−1;3:2.26×105 copies·µL−1;4:2.26×104 copies·µL−1;5:2.26×103 copies·µL−1;6:2.26×102 copies·µL−1。B:RT-RPA扩增子磁捕获荧光显微镜图;1:2.26×107 copies·µL−1,2:2.26×106 copies·µL−1;3:2.26×105 copies·µL−1;4:2.26×104 copies·µL−1;5:2.26×103 copies·µL−1;6:2.26×102 copies·µL−1。Figure 5. Sensitivity of RT-RPA microfluidic chips-based assayA: agarose gel electrophoresis diagram of RT-RPA amplicon presented following a 10× dilution of BPIV3 RNA template; M: molecular weight standard, DNA Marker 2000; 1: 2.26×107 copies·µL−1; 2: 2.26×106 copies·µL−1; 3: 2.26×105 copies·µL−1; 4: 2.26×104 copies·µL−1; 5: 2.26×103 copies·µL−1; 6: 2.26×102 copies·µL−1. B: magnetic capture fluorescence microscopy images of RT-RPA amplicons; 1: 2.26×107 copies·µL−1; 2: 2.26×106 copies·µL−1; 3: 2.26×105 copies·µL−1; 4: 2.26×104 copies·µL−1; 5: 2.26×103 copies·µL−1; 6: 2.26×102 copies·µL−1.
图 5 RT-RPA结合微流控芯片检测灵敏度A:BPIV3的RNA模板进行10倍稀释RT-RPA扩增子琼脂糖凝胶电泳图;M:分子量标准(DNA Marker 2000);1:2.26×107 copies·µL−1;2:2.26×106 copies·µL−1;3:2.26×105 copies·µL−1;4:2.26×104 copies·µL−1;5:2.26×103 copies·µL−1;6:2.26×102 copies·µL−1。B:RT-RPA扩增子磁捕获荧光显微镜图;1:2.26×107 copies·µL−1,2:2.26×106 copies·µL−1;3:2.26×105 copies·µL−1;4:2.26×104 copies·µL−1;5:2.26×103 copies·µL−1;6:2.26×102 copies·µL−1。Figure 5. Sensitivity of RT-RPA microfluidic chips-based assayA: agarose gel electrophoresis diagram of RT-RPA amplicon presented following a 10× dilution of BPIV3 RNA template; M: molecular weight standard, DNA Marker 2000; 1: 2.26×107 copies·µL−1; 2: 2.26×106 copies·µL−1; 3: 2.26×105 copies·µL−1; 4: 2.26×104 copies·µL−1; 5: 2.26×103 copies·µL−1; 6: 2.26×102 copies·µL−1. B: magnetic capture fluorescence microscopy images of RT-RPA amplicons; 1: 2.26×107 copies·µL−1; 2: 2.26×106 copies·µL−1; 3: 2.26×105 copies·µL−1; 4: 2.26×104 copies·µL−1; 5: 2.26×103 copies·µL−1; 6: 2.26×102 copies·µL−1.2.5 临床样本检测结果
为评估本研究建立的BPIV3检测方法在临床场景中的适用性,对56份疑似感染BPIV3高热病牛的血清标本进行了分析。检测结果(图6)显示,运用本研究建立的检测方法对56份血清样本进行检测,有6份样本为阳性,对应病牛编号分别为SD0078、SD0114、SD0319、SD0601、SD0714和SD0755。
![]() 图 6 BPIV3临床血清样本检测A:RT-RPA扩增子琼脂糖凝胶电泳结果;M:分子量标准(DNA Marker 2000);1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755;B:BPIV3血清阳性样本的RT-RPA扩增子磁捕获荧光显微镜图;1:SD0078,2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。Figure 6. Assay on detecting BPIV3 in clinical serum samplesA: RT-RPA amplicon agarose gel electrophoresis; M: DNA marker 2000; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755; B: RT-RPA amplicon magnetic capture fluorescence microscopy of BPIV3 serum-positive samples; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755.
图 6 BPIV3临床血清样本检测A:RT-RPA扩增子琼脂糖凝胶电泳结果;M:分子量标准(DNA Marker 2000);1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755;B:BPIV3血清阳性样本的RT-RPA扩增子磁捕获荧光显微镜图;1:SD0078,2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。Figure 6. Assay on detecting BPIV3 in clinical serum samplesA: RT-RPA amplicon agarose gel electrophoresis; M: DNA marker 2000; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755; B: RT-RPA amplicon magnetic capture fluorescence microscopy of BPIV3 serum-positive samples; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755.进一步采用RT-PCR方法对同批次病牛的鼻拭子分离株进行平行检测,发现上述6例阳性样本对应的血清样本检测结果完全一致(图7A和图7B),表明两种检测方法具有良好的一致性。经扩增子测序及同源性分析证实,本研究方法检测获得的阳性样本序列与参考株(NC_002161.1)核苷酸序列同源性达100%(图8)。结果表明,本研究建立的BPIV3检测方法同样适用于BPIV3分离株检测。
![]() 图 7 BPIV3临床鼻拭子样本检测A:RT-RPA扩增子琼脂糖凝胶电泳结果;M:分子量标准(DNA Marker 2000);1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。B:BPIV3鼻拭子阳性样本的RT-RPA扩增子磁捕获荧光显微镜图;1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。Figure 7. BPIV3 detection on clinical nasal swab samplesA: RT-RPA amplication agarose gel electrophoresis; M: DNA marker 2000; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755; B: RT-RPA amplicon magnetic capture fluorescence microscopy of BPIV3 nasal swab positive samples; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755.
图 7 BPIV3临床鼻拭子样本检测A:RT-RPA扩增子琼脂糖凝胶电泳结果;M:分子量标准(DNA Marker 2000);1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。B:BPIV3鼻拭子阳性样本的RT-RPA扩增子磁捕获荧光显微镜图;1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。Figure 7. BPIV3 detection on clinical nasal swab samplesA: RT-RPA amplication agarose gel electrophoresis; M: DNA marker 2000; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755; B: RT-RPA amplicon magnetic capture fluorescence microscopy of BPIV3 nasal swab positive samples; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755.3. 讨论
BPIV3是引发BRDC的主要病原体之一。在应激条件下,该病毒可突破宿主免疫屏障引发感染,继而通过免疫抑制效应导致继发性细菌和支原体感染,最终形成多病原协同致病的BRDC病理过程[18],每年给养殖业造成重大经济损失[19]。因此,开展BPIV3的研究对我国BRDC的防控具有重要的意义。
目前,检测BPIV3的方法主要是分子生物学方法,其中RT-PCR、实时荧光定量PCR较常用,在临床应用的过程中,RT-PCR快速准确、灵敏度高,但该方法需要复杂的反应仪器且用时较长,不适用于病原微生物的快速检测;其次,荧光定量PCR检测室因气溶胶污染引起假阳性检测结果的情况也是屡见不鲜[20−23]。RPA是目前不依赖PCR仪、在常温条件下完成核酸扩增的一种先进技术。同时,RPA技术对环境要求低,适合现场核酸检测。通过将RPA与凝胶电泳或侧向层析试纸条相结合,可建立快速检测体系,但各自存在技术局限:在RPA-电泳联用方案中,虽然扩增过程处于密闭状态,但电泳检测时需开启反应容器,可能导致气溶胶污染;RPA-侧向层析试纸条则面临多重检测能力有限及样本基质效应等问题[24]。本研究整合了RT-RPA、磁捕获以及微流控芯片检测技术,开发了一种新的检测方法。该方法的优势在于具有实现全流程自动化、集成化、低污染、高通量检测的潜力,为野外现场实现“样本进-结果出”的全流程自动化操作提供技术基础[25]。针对BPIV3 gp3基因序列设计荧光标记的引物和磁性探针,成功建立了BPIV3可视化检测方法。试验证实,该方法获得的RT-RPA扩增子与gp3基因序列同源性为100%,且仅对BPIV3核酸具有扩增能力,对其他牛呼吸道病原体均无反应,充分体现了其高度特异性。
杨帆等[25]建立的多重反转录PCR对3种BPIV3基因型进行检测,最低检测限分别为0.89×104、0.92×104、1.53×104 copies·µL−1。张晓梅等[26]建立了BPIV3的反转录PCR检测方法,其检测下限为2.42×103 copies·μL−1。相比之下,本研究建立的检测方法检测下限为2.26×103 copies·µL−1,灵敏度更好。另外,为验证该检测方法的临床应用价值,对收集的56份疑似感染BPIV3高热病牛样本,包括血清与鼻拭子。结果显示,56份血清和鼻拭子样本中均有6例样本检测结果呈现阳性,血清样本和鼻拭子样本检测结果一致。通过对56例鼻拭子样本进行检测以验证临床适用性,本研究建立的方法与RT-PCR检测结果相符,具有一致性。吕香玉等[17]建立的病原分离检测技术至少需要5 d;杨帆等[25]建立RT-PCR检测BPIV3,从样本处理到获得结果至少需要140 min。本研究建立方法从样本处理至检测结果输出的总耗时为92 min(包括病毒样本RNA提取5 min,RT-RPA扩增47 min,扩增子@探针@磁珠合成10 min;磁捕获30 min),与普通RT-PCR检测方法相比(包括病毒样本RNA提取5 min,反转录18 min,PCR扩增100~120 min,琼脂糖凝胶电泳15 min),显著缩短了时间。
本研究将生物素修饰的探针偶联在链霉亲和素磁珠表面,通过磁性探针与RT-RPA荧光扩增子进行分子杂交,在微流控的流动系统内完成磁捕获,通过荧光显微镜观察微流控芯片是否有荧光产生,实现对病原体的可视化检测。既利用了PRA和微流控芯片技术的优势,又结合磁捕获的特性,从样本处理到获得检测结果全流程时长为92 min,只需借助磁铁和荧光显微镜,具有准确、快速、简单等特点,可以成为检测其他病原体和其他生物目标的通用平台。
-
图 4 RT-RPA检测特异性
A:RT-RPA扩增子琼脂糖凝胶电泳图;M:分子量标准(DNA Marker 2000);1:BPIV3;2:BVDV;3:BADV3;4:IBRV;5:无酶水;B:自然光下磁捕获结果;C:荧光显微镜下磁捕获结果;1:BPIV3;2:BVDV;3:BADV3;4:IBRV。
Figure 4. Specificity of RT-RPA reaction
A: agarose gel electrophoresis of RT-RPA amplicon; M: molecular weight standard, DNA marker 2000; 1: BPIV3; 2: BVDV; 3: BADV3; 4: IBRV; 5: enzyme-free water. B: magnetic capture under natural light; C: magnetic capture under fluorescence microscope; 1: BPIV3; 2: BVDV; 3: BADV3; 4: IBRV.
图 5 RT-RPA结合微流控芯片检测灵敏度
A:BPIV3的RNA模板进行10倍稀释RT-RPA扩增子琼脂糖凝胶电泳图;M:分子量标准(DNA Marker 2000);1:2.26×107 copies·µL−1;2:2.26×106 copies·µL−1;3:2.26×105 copies·µL−1;4:2.26×104 copies·µL−1;5:2.26×103 copies·µL−1;6:2.26×102 copies·µL−1。B:RT-RPA扩增子磁捕获荧光显微镜图;1:2.26×107 copies·µL−1,2:2.26×106 copies·µL−1;3:2.26×105 copies·µL−1;4:2.26×104 copies·µL−1;5:2.26×103 copies·µL−1;6:2.26×102 copies·µL−1。
Figure 5. Sensitivity of RT-RPA microfluidic chips-based assay
A: agarose gel electrophoresis diagram of RT-RPA amplicon presented following a 10× dilution of BPIV3 RNA template; M: molecular weight standard, DNA Marker 2000; 1: 2.26×107 copies·µL−1; 2: 2.26×106 copies·µL−1; 3: 2.26×105 copies·µL−1; 4: 2.26×104 copies·µL−1; 5: 2.26×103 copies·µL−1; 6: 2.26×102 copies·µL−1. B: magnetic capture fluorescence microscopy images of RT-RPA amplicons; 1: 2.26×107 copies·µL−1; 2: 2.26×106 copies·µL−1; 3: 2.26×105 copies·µL−1; 4: 2.26×104 copies·µL−1; 5: 2.26×103 copies·µL−1; 6: 2.26×102 copies·µL−1.
图 6 BPIV3临床血清样本检测
A:RT-RPA扩增子琼脂糖凝胶电泳结果;M:分子量标准(DNA Marker 2000);1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755;B:BPIV3血清阳性样本的RT-RPA扩增子磁捕获荧光显微镜图;1:SD0078,2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。
Figure 6. Assay on detecting BPIV3 in clinical serum samples
A: RT-RPA amplicon agarose gel electrophoresis; M: DNA marker 2000; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755; B: RT-RPA amplicon magnetic capture fluorescence microscopy of BPIV3 serum-positive samples; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755.
图 7 BPIV3临床鼻拭子样本检测
A:RT-RPA扩增子琼脂糖凝胶电泳结果;M:分子量标准(DNA Marker 2000);1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。B:BPIV3鼻拭子阳性样本的RT-RPA扩增子磁捕获荧光显微镜图;1:SD0078;2:SD0114;3:SD0319;4:SD0601;5:SD0714;6:SD0755。
Figure 7. BPIV3 detection on clinical nasal swab samples
A: RT-RPA amplication agarose gel electrophoresis; M: DNA marker 2000; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755; B: RT-RPA amplicon magnetic capture fluorescence microscopy of BPIV3 nasal swab positive samples; 1: SD0078; 2: SD0114; 3: SD0319; 4: SD0601; 5: SD0714; 6: SD0755.
表 1 引物和探针序列
Table 1 Primer and probe sequences
引物与探针
Primer and probe序列
Sequence (5′-3′)扩增子大小
Product length/bp扩增子位置
Product location/bpBPIV3-F CAACATAGAGCCGTTACCACTCAAGGTCAATGA 404 3794 ~4197 BPIV3-R Cy3-TATTAGCGTCAAATAACATCCCTTTTCTTAAT 探针 Probe 5′Biotin-TCCGAATGTTCCAAACACCGAGACCTAGTA 下划线为核酸探针与扩增子不互补序列。
Underline indicates nucleic acid probe sequence not complementary to amplicon sequence. -
[1] LEAL É,LIU C,ZHAO Z Z,et al. Isolation of a divergent strain of bovine parainfluenza virus type 3 (BPIV3) infecting cattle in China[J]. Viruses,2019,11(6) :489. DOI: 10.3390/v11060489
[2] MAKOSCHEY B,BERGE A C. Review on bovine respiratory syncytial virus and bovine parainfluenza - usual suspects in bovine respiratory disease-a narrative review[J]. BMC Veterinary Research,2021,17(1) :261. DOI: 10.1186/s12917-021-02935-5
[3] ZHU Y M,SHI H F,GAO Y R,et al. Isolation and genetic characterization of bovine parainfluenza virus type 3 from cattle in China[J]. Veterinary Microbiology,2011,149(3/4) :446−451.
[4] WANG X,HU J J,MENG F Y,et al. Isolation,identification,and genetic phylogenetic analysis of two different genotypes of bovine parainfluenza 3 virus in China[J]. Viruses,2022,14(10) :2221. DOI: 10.3390/v14102221
[5] GUO T,ZHANG J H,CHEN X D,et al. Investigation of viral pathogens in cattle with bovine respiratory disease complex in Inner Mongolia,China[J]. Microbial Pathogenesis,2021,153:104594. DOI: 10.1016/j.micpath.2020.104594
[6] 路荣. 内蒙古地区牛副流感病毒3型的分离及鉴定[D]. 呼和浩特:内蒙古农业大学,2020. LU R. Isolation and identification of a strain bovine parainfluenza virus type 3 in Inner Mongolia[D].Hohhot:Inner Mongolia Agricultural University,2020. (in Chinese)
[7] BU T,HUANG Q,YAN L Z,et al. Ultra technically-simple and sensitive detection for Salmonella Enteritidis by immunochromatographic assay based on gold growth[J]. Food Control,2018,84:536−543. DOI: 10.1016/j.foodcont.2017.08.036
[8] PIEPENBURG O,WILLIAMS C H,STEMPLE D L,et al. DNA detection using recombination proteins[J]. PLoS Biology,2006,4(7) :e204. DOI: 10.1371/journal.pbio.0040204
[9] LI J,MACDONALD J,VON STETTEN F. Review:A comprehensive summary of a decade development of the recombinase polymerase amplification[J]. Analyst,2018,144(1) :31−67.
[10] AHMAD F,HASHSHAM S A. Miniaturized nucleic acid amplification systems for rapid and point-of-care diagnostics:A review[J]. Analytica Chimica Acta,2012,733:1−15. DOI: 10.1016/j.aca.2012.04.031
[11] DU J,LI Z S,GUO J L,et al. Development of a magnetic separation method for rapid isolation and enrichment of bacteria in raw pork using chitosan functionalized magnetic Fe3O4@MIL-100(Fe) composites[J]. Journal of Food Science,2024,89(10) :6628−6637. DOI: 10.1111/1750-3841.17345
[12] ZHANG Z Y,SHI S J,JIN K W,et al. MoSe2-based magnetic nanosystem for clinical enrichment,retrieval and elimination of circulating tumor cells[J]. Nano Today,2024,57:102330. DOI: 10.1016/j.nantod.2024.102330
[13] KONG M Q,LI Z H,WU J G,et al. A wearable microfluidic device for rapid detection of HIV-1 DNA using recombinase polymerase amplification[J]. Talanta,2019,205:120155. DOI: 10.1016/j.talanta.2019.120155
[14] LI Q,DUAN L J,JIN D S,et al. A real-time fluorogenic recombinase polymerase amplification microfluidic chip (on-chip RPA) for multiple detection of pathogenic microorganisms of penaeid shrimp[J]. Aquaculture,2024,578:740017. DOI: 10.1016/j.aquaculture.2023.740017
[15] LEON F,PINCHON E,MAYRAN C,et al. Magnetic field-enhanced agglutination readout combined with isothermal reverse transcription recombinase polymerase amplification for rapid and sensitive molecular detection of dengue virus[J]. Frontiers in Chemistry,2022,9:817246. DOI: 10.3389/fchem.2021.817246
[16] HONG S L,WANG X,BAO Z H,et al. Simultaneous detection of multiple influenza virus subtypes based on microbead-encoded microfluidic chip[J]. Analytica Chimica Acta,2023,1279:341773. DOI: 10.1016/j.aca.2023.341773
[17] 吕香玉,郭宇,高登军,等. 一株牛副流感病毒3型毒株的分离鉴定与全基因序列分析[J]. 中国病原生物学杂志,2024,19(5) :520−523. LYU X Y,GUO Y,GAO D J,et al. Isolation,identification and complete genome analysis of a bovine parainfluenza virus type 3[J]. Journal of Pathogen Biology,2024,19(5) :520−523. (in Chinese)
[18] BRYSON D G,MCFERRAN J B,BALL H J,et al. Observations on outbreaks of respiratory disease in housed calves:(1) Epidemiological,clinical and microbiological findings[J]. Veterinary Record,1978,103(22) :485−489. DOI: 10.1136/vr.103.22.485
[19] 楚会萌,任亚初,程凯慧,等. 一株牛副流感病毒3型的分离鉴定及基因组序列分析[J]. 中国病原生物学杂志,2020,15(9) :1038−1041. CHU H M,REN Y C,CHENG K H,et al. Isolation,identification,and genome sequencing of a bovine parainfluenza virus type 3 strain[J]. Journal of Pathogen Biology,2020,15(9) :1038−1041. (in Chinese)
[20] 马祥,戴镜红,王长年,等. 兽医PCR实验室的污染控制策略[J]. 广东畜牧兽医科技,2020,45(3) :20−23. DOI: 10.3969/j.issn.1005-8567.2020.03.007 MA X,DAI J H,WANG C N,et al. Prevention and control strategy of pollution in veterinary PCR lab[J]. Guangdong Journal of Animal and Veterinary Science,2020,45(3) :20−23. (in Chinese) DOI: 10.3969/j.issn.1005-8567.2020.03.007
[21] 杨忠苹,赵和平,周光斌,等. 动物疫病荧光定量PCR检测假阳性的分析与控制[J]. 上海畜牧兽医通讯,2021(3) :55−57. YANG Z P,ZHAO H P,ZHOU G B,et al. Analysis and control of false positive detection of animal epidemic diseases by fluorescence quantitative PCR[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,2021(3) :55−57. (in Chinese)
[22] 张梅,高军军,康文彪. 动物疫病荧光PCR检测中假阳性的原因分析与控制[J]. 甘肃畜牧兽医,2022,52(10) :15−18. ZHANG M,GAO J J,KANG W B. Cause analysis and control of false positive in fluorescent PCR detection of animal diseases[J]. Gansu Animal Husbandry and Veterinary Medicine,2022,52(10) :15−18. (in Chinese)
[23] WANG Y,XU L Z,NOLL L,et al. Development of a real-time PCR assay for detection of African swine fever virus with an endogenous internal control[J]. Transboundary and Emerging Diseases,2020,67(6) :2446−2454. DOI: 10.1111/tbed.13582
[24] 江永忠. 基于磁性/荧光微球的新型病毒核酸现场检测方法[D]. 武汉:武汉大学,2021. JIANG Y Z. Field-deployable detection methods for novel viral nucleic acids based on magnetic/fluorescent microspheres[D].Wuhan:Wuhan University,2021. (in Chinese)
[25] 杨帆,石顺利,徐娜,等. 牛副流感病毒3型3种基因型多重RT-PCR检测方法的建立[J]. 中国畜牧兽医,2018,45(1) :32−38. YANG F,SHI S L,XU N,et al. Establishment of a multiplex RT-PCR detection method for three genotypes of bovine parainfluenza virus type 3[J]. China Animal Husbandry & Veterinary Medicine,2018,45(1) :32−38. (in Chinese)
[26] 张晓梅,姜晓霞,孙晓波,等. 牛病毒性呼吸道疾病主要病原多重PCR检测方法的建立与应用[J]. 中国兽医科学,2022,52(8) :957−963 ZHANG X M,JIANG X X,SUN X B,et al. Development and application of a multiplex PCR method for major viruses causing bovine viral respiratory disease[J]. Chinese Veterinary Science,2022,52(8) :957−963. (in Chinese)




 下载:
下载: