Pathogenic Functions of MoDock1 and MoElmo1 in Magnaporthe oryzae
-
摘要:目的
稻瘟病菌(Magnaporthe oryzae)是引起水稻稻瘟病的病原菌,探究其功能基因以揭示致病分子机理。
方法通过生物信息学方法鉴定稻瘟病菌中Dock180和ELMO的同源蛋白,对其编码基因进行敲除并对获得的基因缺失突变体进行表型分析,再通过免疫共沉淀试验分析二者的互作关系。
结果稻瘟病菌中鉴定得到MoDOCK1和MoELMO1基因,并获得各自基因缺失突变体,两种突变体具有几乎一致的表型。MoDock1、MoElmo1的缺失影响了稻瘟病菌分生孢子的粘着,造成芽管变长且有隔膜,附着胞形成延缓。加入8-Br-cAMP或IBMX可以修复附着胞形成过程中的缺陷,表明MoDock1、MoElmo1可能在稻瘟病菌cAMP-PKA信号途径中发挥功能。洋葱表皮侵染试验结果表明基因缺失突变体的侵染能力有所下降。水稻接种显示,MoDock1、MoElmo1的缺失导致稻瘟病菌的致病性减弱。最后,通过免疫共沉淀证明,MoDock1和MoElmo1存在相互作用。
结论MoDock1和MoElmo1存在相互作用,二者是稻瘟病菌分生孢子粘着能力、附着胞正常形成和完整致病性所必需的。
Abstract:ObjectiveRoles of the genes associated with MoDock1 and MoElmo1 proteins in Magnaporthe oryzae played in rice blast disease were studied.
MethodsHomologies of Dock180 and ELMO in M. oryzae were identified by bioinformatics method, and the coding genes knocked out to create mutants for determinations of phenotype and interactions between the two proteins by a co-immunoprecipitation test.
ResultsMoDOCK1 and MoELMO1 were identified in M. oryzae and deleted to obtain the mutants that were almost identical in phenotype. Absence of the two proteins in the mutants significantly affected the conidial adhesion resulting in long bud tubes with septum and delayed the appressoria formation. Since the defective appressoria formation could be repaired by the addition of 8-Br-cAMP or IBMX, it suggested that MoDock1 and MoElmo1 might be involved in the cAMP-PKA signaling pathway. To test that hypothesis, onion epidermis was infected with the mutants to show a declined infectious ability, and on a rice plant, a lowered pathogenicity. Furthermore, the co-immunoprecipitation experiment confirmed the MoDock1-MoElmo1 interaction as well.
ConclusionMoDock1 and MoElmo1 in M. oryzae provided the conidia adhesion and appressoria formation essential for the pathogenicity of the pathogen on rice.
-
Keywords:
- Magnaporthe oryzae /
- Dock1 /
- Elmo1 /
- conidial adhesion /
- appressorium
-
0. 引言
【研究意义】水稻(Oryza sativa L.)作为全球性关键粮食作物,关乎人类生存与健康。 由稻瘟病菌(Magnaporthe oryzae)引起的稻瘟病严重影响世界粮食安全,气候的变化有加重该病害发生的趋势[1, 2]。稻瘟病菌除了引起水稻叶片病害,还能引起节瘟、穗颈瘟,此外还能侵染小麦等禾本科植物[3, 4]。稻瘟病菌作为最早被全基因组测序的植物病原菌,已成为研究宿主与病原微生物互作的模式生物[5]。通过研究稻瘟病菌功能基因,解析病原菌致病分子机理,有助于挖掘潜在药物靶标,对稻瘟病的防控具有重要意义。【前人研究进展】Rho家族蛋白是一类小GTP酶,在丝状真菌中通常包括Rho1~Rho4等4个Rho蛋白以及各1个Rac1和Cdc42蛋白[6]。Rho蛋白具有GTP结合的激活态和GDP结合的失活态,鸟苷酸交换因子(GEF)促进Rho蛋白从GDP结合态转换成GTP结合态,激活Rho蛋白的活性[7]。在哺乳动物细胞中,Dock180蛋白能与ELMO蛋白相互作用来充当GEF的角色,活化Rac、Cdc42,参与细胞的迁移、凋亡细胞、神经元的极化等生命活动[8, 9]。Dock180只有在和ELMO结合的时候才能活化Rac,单独的Dock180即便过表达也不能代替ELMO 的角色[9, 10]。在植物病原真菌中,已有不少对Rho蛋白的研究,但对植物病原真菌Rho蛋白上游调控元件GEF的研究还很少。在禾谷镰刀菌(Fusarium graminearum)中,FgRho1是菌株生存所必需的;FgRac1和FgCdc42调控着病原菌的极性生长、两性发育和致病性;FgRho4主要调控菌株隔膜形成和细胞核的分裂;FgRho2、FgRho3则分别与营养生长和细胞壁敏感性相关[11]。相对于对Rho蛋白较为系统的研究,目前仅发现FgBud3这一GEF蛋白参与对FgRho4的调控[12]。在稻瘟病菌中,MoRho3、MoCdc42和MoRac1均与病原菌的致病性相关,其中,MoRac1通过Chm1和Nox通路来分别调控无性发育和致病性[13−15]。在白色念珠菌(Candida albicans)中,Dock180同源蛋白Dck1作为Rac1的GEF,调控着白色念球菌的极性生长[16, 17]。【本研究切入点】目前,已有很多关于稻瘟病菌功能基因的研究,但暂未见关于稻瘟病菌潜在Rho GEF的研究。在哺乳动物中,Dock180与ELMO协同作用以活化Rac蛋白[10]。在稻瘟病菌可能也存在Dock180和ELMO的同源蛋白且通过对MoRac1蛋白的调控来参与稻瘟病菌的致病进程。【拟解决的关键问题】本研究对稻瘟病菌中Dock180和ELMO同源物进行分析,探究二者在病原菌生长发育和致病进程中的作用以及是否充当MoRac1蛋白GEF的角色,以期为探明稻瘟病菌致病分子机制提供依据。
1. 材料与方法
1.1 试验材料
稻瘟病菌菌株Δku80、ΔModock1-3、ΔModock1-10、ΔMoelmo1-10和ΔMoelmo1-34由福建农林大学生物农药与化学生物学教育部重点实验室保存。病原菌接种试验所用水稻品种为'CO39'。CM培养基、SYM培养基和燕麦培养基(50 g·L−1燕麦,20 g·L−1蔗糖,20 g·L−1琼脂粉)均经高压灭菌,室温保存[14]。
1.2 试验方法
1.2.1 MoDock1与MoElmo1氨基酸序列的获得与蛋白结构域分析
利用智人(Homo sapiens)Dock180和Elmo1的氨基酸序列,在稻瘟病菌基因组数据库进行比对以探寻稻瘟病菌同源蛋白。利用Pfam、InterPro数据库对蛋白进行结构域分析[18, 19]。
1.2.2 MoDOCK1与MoELMO1基因的敲除
扩增MoDOCK1基因上游片段,用Hind Ⅲ和EcoR Ⅰ双酶切后插入pCX62载体的潮霉素磷酸转移酶基因(HYG)上游;扩增下游片段,用BamH Ⅰ和Xba Ⅰ双酶切后插入HYG下游,从而获得MoDOCK1基因敲除载体(表1)。不同于构建含有同源重组片段的敲除载体的方法,MoELMO1基因的敲除采用融合PCR方式获取同源重组片段AHY和YGB(表1)。上述载体或片段转化入Δku80原生质体中。
表 1 本研究所用到的引物Table 1. Primers applied引物
Primers序列(5′ - 3′)
Sequences (5′ - 3′)用途
ApplicationdockAF GCGAAGCTTGAGCACATCCATGCGGTAG 扩增MoDOCK1上游片段 dockAR GCGAATTCGCAATCGGGACTGTAGGC dockBF GCGGGATCCCGTTGAGAAGAGGGTGCT 扩增MoDOCK1下游片段 dockBR AGCTCTAGAACCGAAAGCGGCCTGAAA dockOF GCAGTCCTTCACTAGCGTT 扩增MoDOCK1 ORF、筛选MoDOCK1缺失突变体 dockOR AGGAATTGGCCTTCAACGT dockUA TGTCCTGTTACTTGTCTGG 筛选MoDOCK1缺失突变体 H853 GACAGACGTCGCGGTGAGTT dockRTF GCGAGTACCACAGCCGATTC MoDOCK1缺失突变体RT-PCR验证 dockRTR GCCAGACATTTCTTGCGTTTT dockPF GGTACGACTTTAGACCAAATA 扩增MoDOCK1缺失突变体,Southern杂交验证验证探针 dockPR TTCGAGAGGTCTGTGTGA elmoAF TCTGCGCCGACTGATTGCA 扩增MoELMO1上游片段 elmoAR TTGACCTCCACTAGCTCCAGCCAAGCCAGTAGGCGAGGGTGTTGC elmoBF GAATAGAGTAGATGCCGACCGCGGGTTCAAGGACGTGCTAGAGGTTG 扩增MoELMO1下游片段 elmoBR ATTGTGATCTTGGTGGTCG elmoOF GCTCATCATGACCACTGGT 扩增MoELMO1 ORF、筛选MoELMO1缺失突变体 elmoOR AACCATGCTGACGGCAAAGCT elmoUA GTCCTGTGCAGTGGGCAACAA 筛选MoELMO1缺失突变体 elmoRTF TGGAAGGAGGTCCGTGTCG MoELMO1缺失突变体RT-PCR验证 elmoRTR GTGCTCGTAAAGAACCATGCTGA elmoAF2 CAGTATGGGATGAGCACC 扩增MoELMO1缺失突变体,Southern杂交验证验证探针 elmoAR2 CAGAGTCGCCGAGTCTTA dockFlgF CAGATCTTGGCTTTCGTAGGAACCCAATCTTCAATGCCCTGGCACCCTTTGCC 构建pDOCK:FLAG载体 dockFlgR CTTTATAATCACCGTCATGGTCTTTGTAGTCTTCCTCATCGACGCTTCCCATG elmoGF CAGATCTTGGCTTTCGTAGGAACCCAATCTTCAATGGACCAGGCCGACATAC 构建pELMO:GFP载体 elmoGR CACCACCCCGGTGAACAGCTCCTCGCCCTTGCTCACGACCTCGTAGTAGTAATTCTCATCCAG 原生质体的制备及转化参照He等的方法,采用潮霉素来筛选转化子[20]。提取转化子基因组DNA作为模板,利用各自基因的OF/OR和UA/H853这2对引物组合,通过PCR筛选转化子中的目的基因缺失突变体,利用OF/OR引物,通过反转录PCR(RT-PCR)检测菌株转录物中是否含有目的基因以及Southern杂交来进一步确认相应突变体(表1)。
1.2.3 基因缺失突变体的表型分析
参照Li等[21] 的方法,测量在SYM培养基上生长10 d的菌落直径,收集10 日龄燕麦培养基上的分生孢子并计算产孢量。参照Bae等[22]的方法,将孢子液滴加在疏水膜上,在不同时间点用水冲洗后统计孢子粘着率。参照Li等[23] 的方法,观察菌株不同时间点的附着胞形成情况。通过滴加Calcofluor染液,使Calcofluor终浓度为0.005%,于荧光显微镜下观察隔膜。加入8-Br-cAMP或IBMX观察附着胞形成时,终浓度分别为5 mmol·L−1和2.5 mmol·L−1。参照Xu等[24]的方法进行洋葱表皮侵染试验观察附着胞的穿透能力,并喷雾接种三叶一心期的水稻,5 d后观察发病情况。
1.2.4 免疫共沉淀试验
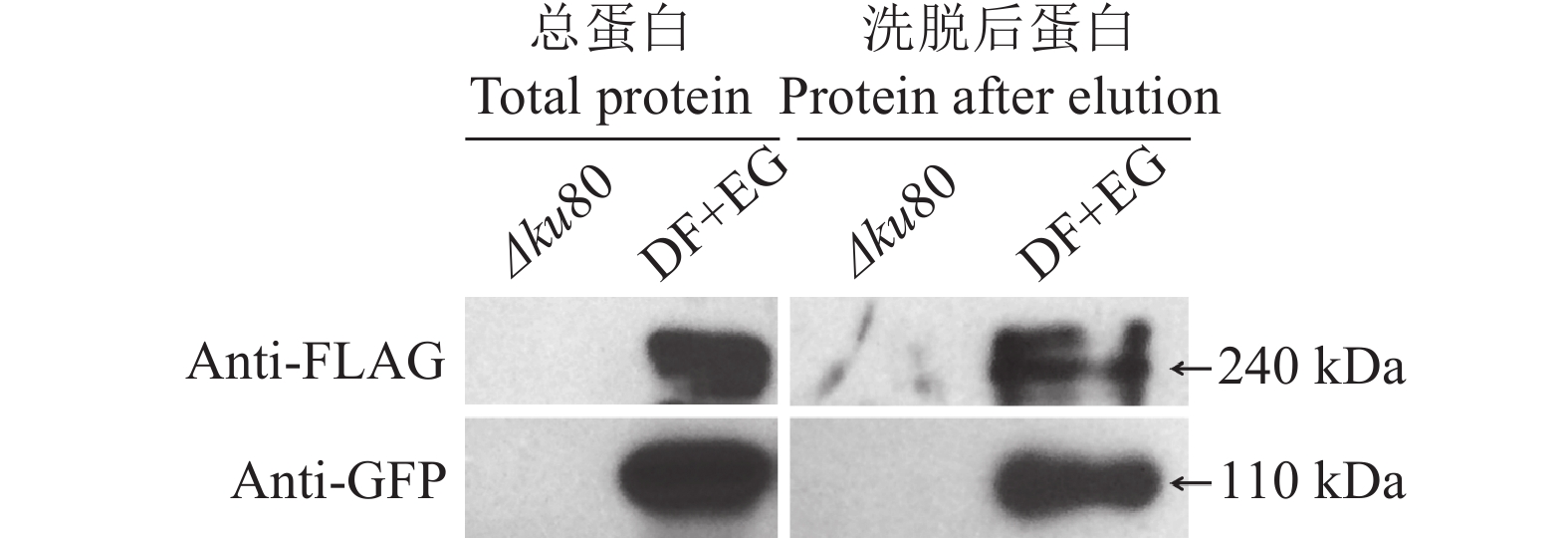
利用引物elmoGF/GR扩增出带有自身启动子序列不含有终止密码子序列的MoELMO1的ORF序列连接入载体pDL2的GFP基因的上游,构建出pELMO:GFP质粒;利用引物dockFlgF/FlgR扩增出带有自身启动子序列不含有终止密码子序列的MoDOCK1的ORF序列接入载体pFL7的FLAG基因的上游,构建出pDOCK:FLAG质粒。将上述2种质粒同时转化入Δku80原生质体中,通过PCR筛选出同时含有MoELMO1:GFP和MoDOCK1:FLAG序列的转化子菌株DF+EG。提取DF+EG菌株的总蛋白,并于含有GFP抗体的琼脂糖珠子共同孵育。洗脱被珠子吸附的蛋白后进行Western杂交,分别用FLAG和GFP的抗体检测[25]。
2. 结果与分析
2.1 稻瘟病菌MoDock1与MoElmo1蛋白结构域分析
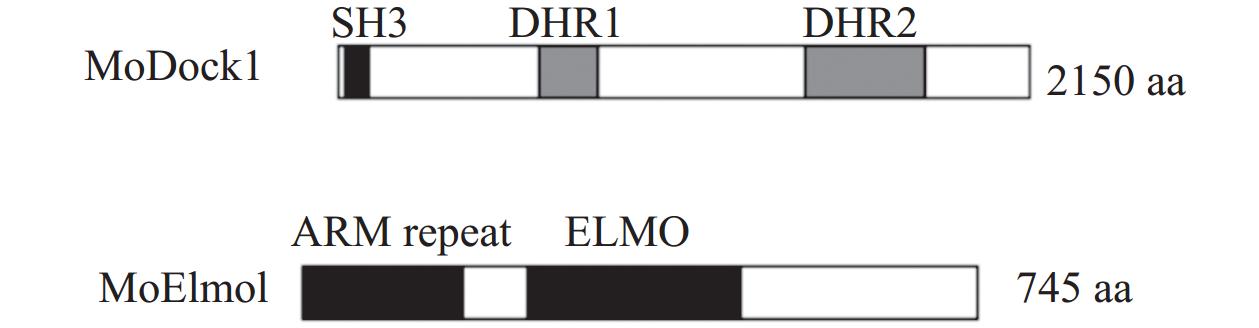
通过同源比对找到MoDOCK1(MGG_03275.7)与MoELMO1(MGG_09944.7),MoDOCK1编码
2050 个氨基酸,MoELMO1编码745个氨基酸。结构域分析发现,MoDock1 N端含有SH3结构域和DHR1结构域,C端则是DHR2结构域;MoElmo1的N端由ARM repeat组成,中段是该家族的标志性ELMO结构域(图1)。2.2 MoDOCK1与MoELMO1的敲除
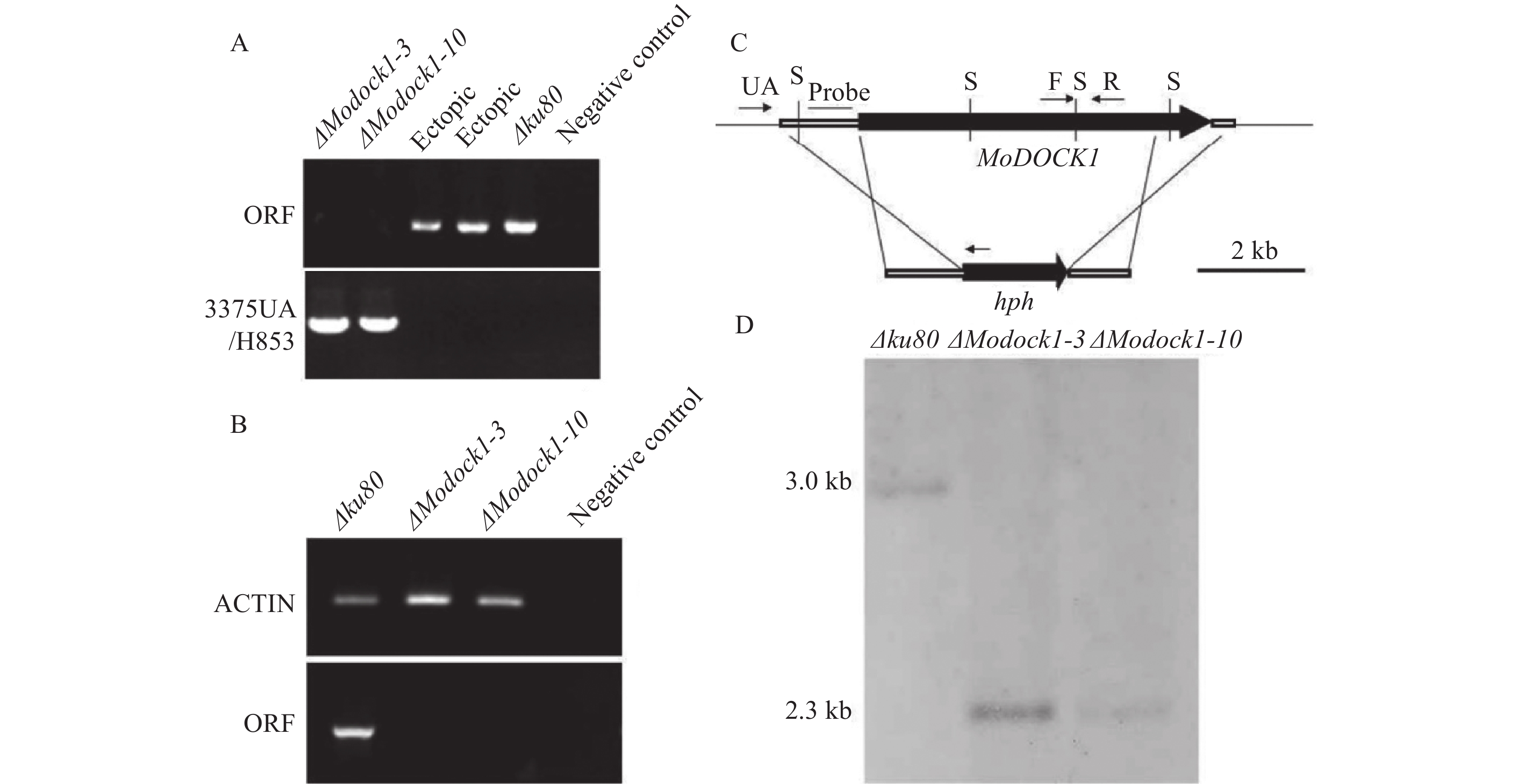
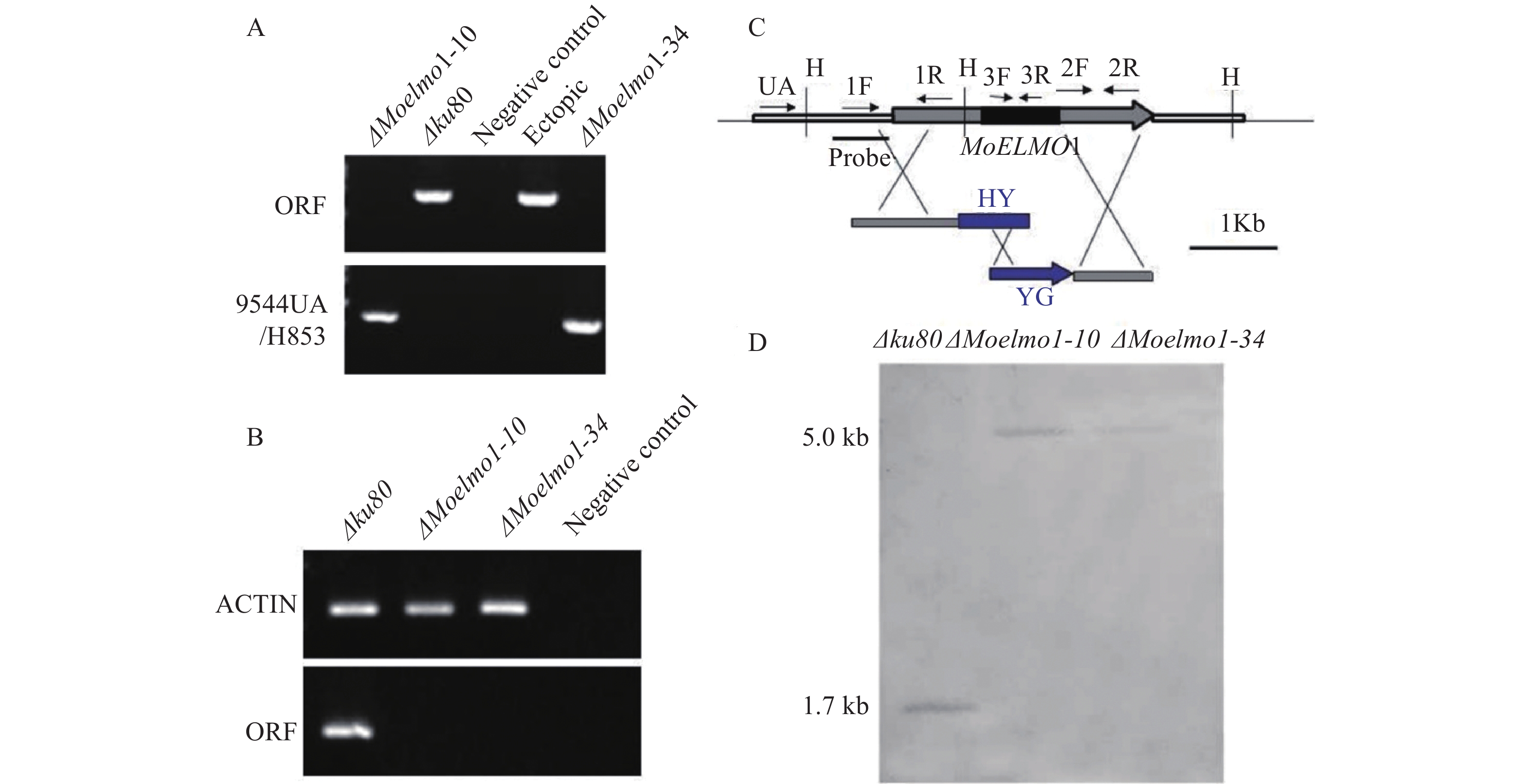
基因缺失突变体的验证,以MoDOCK1的敲除为例,转化后得到若干具潮霉素抗性的转化子,使用引物对dockOF/OR和dockUA/H853分别进行PCR扩增,筛选获得MoDOCK1的缺失突变体ΔModock1-3和ΔModock1-10。随后通过RT-PCR,验证ΔModock1-3和ΔModock1-10菌株的转录物中不含有MoDOCK1的转录产物。进一步通过Southern杂交,菌株ΔModock1-3和ΔModock1-10杂交结果中含有预期2.3 kb的条带,区别于Δku80中的3.0 kb条带,证明ΔModock1-3和ΔModock1-10是正确的MoDOCK1的缺失突变体菌株(图2)。通过同样的3种验证方法,得到MoELMO1的缺失突变体菌株ΔMoelmo1-10和ΔMoelmo1-34(图3)。
![]() 图 2 MoDOCK1基因敲除突变体的验证A:MoDOCK1基因敲除突变体的PCR验证;B:MoDOCK1基因敲除突变体的RT-PCR验证;C:MoDOCK1基因敲除和Southern杂交策略图,S代表Sac Ⅰ;D:MoDOCK1基因敲除突变体的Southern杂交验证。Figure 2. Verification of MoDOCK1-deleted mutantsA: verification of MoDOCK1-deleted mutants by PCR; B: verification of MoDOCK1-deleted mutants by RT-PCR; C: strategy of MoDOCK1 deletion and Southern blot; S: Sac Ⅰ; D: verification of MoDOCK1-deleted mutants by Southern blot.
图 2 MoDOCK1基因敲除突变体的验证A:MoDOCK1基因敲除突变体的PCR验证;B:MoDOCK1基因敲除突变体的RT-PCR验证;C:MoDOCK1基因敲除和Southern杂交策略图,S代表Sac Ⅰ;D:MoDOCK1基因敲除突变体的Southern杂交验证。Figure 2. Verification of MoDOCK1-deleted mutantsA: verification of MoDOCK1-deleted mutants by PCR; B: verification of MoDOCK1-deleted mutants by RT-PCR; C: strategy of MoDOCK1 deletion and Southern blot; S: Sac Ⅰ; D: verification of MoDOCK1-deleted mutants by Southern blot.![]() 图 3 MoELMO1基因敲除突变体的验证A:MoELMO1基因敲除突变体的PCR验证;B:MoELMO1基因敲除突变体的RT-PCR验证;C:MoELMO1基因敲除和Southern杂交策略图,H代表Hind Ⅲ;D:MoELMO1基因敲除突变体的Southern杂交验证。Figure 3. Verification of MoELMO1-deleted mutantsA: Verification of MoELMO1-deleted mutants by PCR; B: verification of MoELMO1-deleted mutants by RT-PCR; C: strategy of MoELMO1 deletion and Southern blot; H: Hind Ⅲ; D: verification of MoELMO1-deleted mutants by Southern blot.
图 3 MoELMO1基因敲除突变体的验证A:MoELMO1基因敲除突变体的PCR验证;B:MoELMO1基因敲除突变体的RT-PCR验证;C:MoELMO1基因敲除和Southern杂交策略图,H代表Hind Ⅲ;D:MoELMO1基因敲除突变体的Southern杂交验证。Figure 3. Verification of MoELMO1-deleted mutantsA: Verification of MoELMO1-deleted mutants by PCR; B: verification of MoELMO1-deleted mutants by RT-PCR; C: strategy of MoELMO1 deletion and Southern blot; H: Hind Ⅲ; D: verification of MoELMO1-deleted mutants by Southern blot.2.3 MoDOCK1、MoELMO1的缺失对稻瘟病菌营养生长的影响
为了分析MoDOCK1、MoELMO1的缺失对稻瘟病菌营养生长的影响,在SYM培养基上接种了菌株,生长10 d后观察菌落形态并测量菌落直径,结果(表2)显示,相比于Δku80,ΔModock1-3、ΔModock1-10、ΔMoelmo1-10、ΔMoelmo1-34的生长速率有所减缓,但菌落形态正常(图4)。
表 2 菌株菌落直径与产孢量Table 2. Colony diameter and conidiation of different strains菌株 Strain 菌落直径 Colony diameter /cm 产孢量 Conidiation /(×104/皿) Δku80 6.29±0.07 a 167.6±24.4 a ΔModock1-3 5.04±0.14 c 163.3±37.3 a ΔModock1-10 5.07±0.06 c 174.0±36.7 a ΔMoelmo1-10 5.25±0.08 b 173.2±30.0 a ΔMoelmo1-34 5.20±0.13 b 158.6±25.9 a 同列数据后不同的小写字母表示 0.05 水平上差异显著。
Data with different lowercase letters on same column indicate significant difference at 0.05 level.2.4 MoDOCK1、MoELMO1的缺失对分生孢子粘着的影响
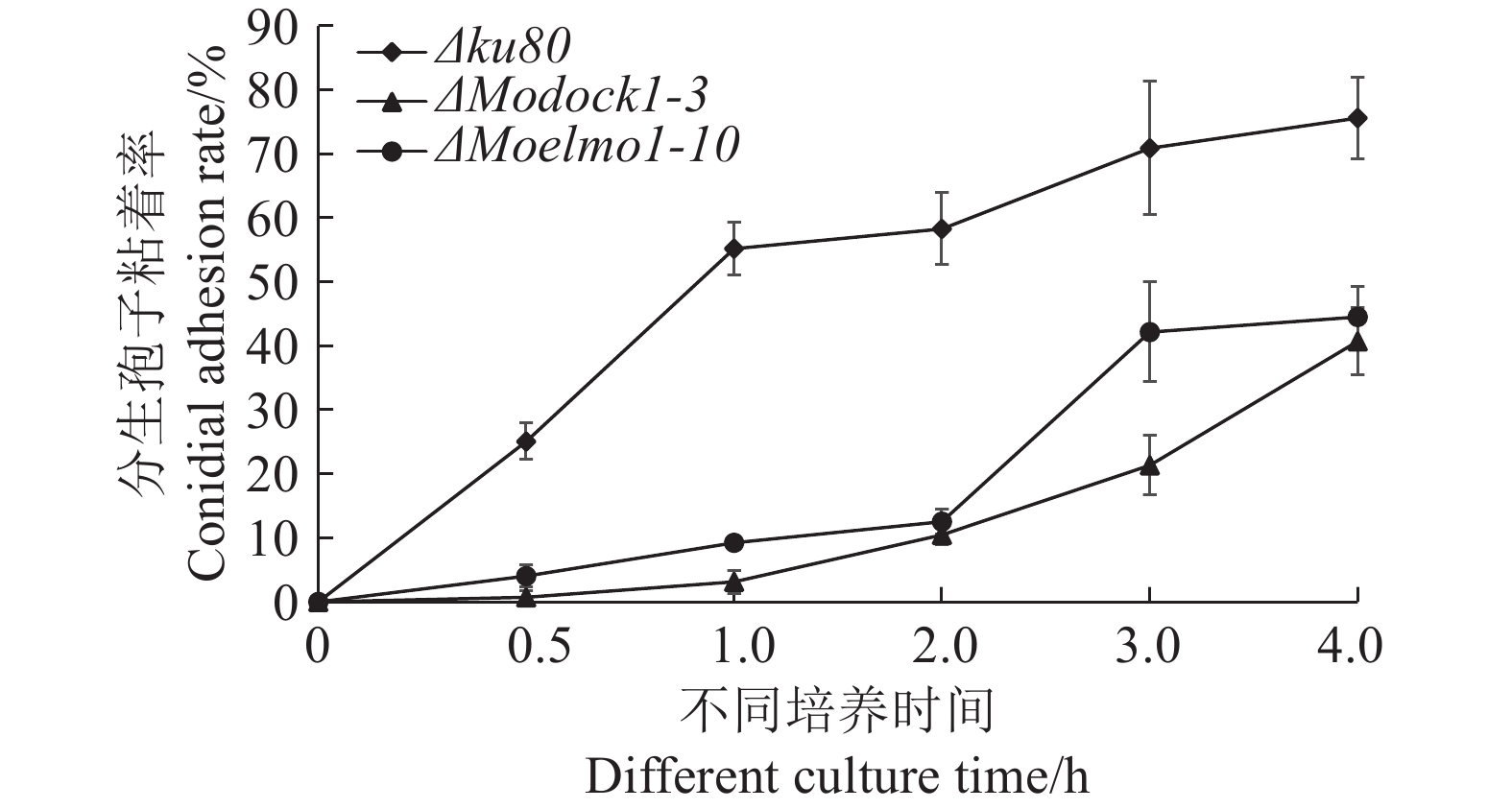
将菌株接种在燕麦培养基上10 d后收集分生孢子并统计产孢量。结果显示ΔModock1-3、ΔMoelmo1-10的产孢量较野生型Δku80没有明显区别(表2)。进一步观察分生孢子在疏水膜上的粘着情况发现,在孢子滴接触到疏水膜上的2 h内,ΔModock1-3、ΔMoelmo1-10的粘着率皆低于20%,远小于野生型Δku80 60%的粘着率。随着时间的延长,在分生孢子滴接触到疏水膜上4 h,突变体及野生型的粘着率均有所上升,但突变体黏附在疏水膜上的孢子数仍远低于对照组Δku80(图5)。这些结果表明MoDock1、MoElmo1与稻瘟病菌分生孢子的黏附能力相关。
2.5 MoDock1、MoElmo1对附着胞发育的调控
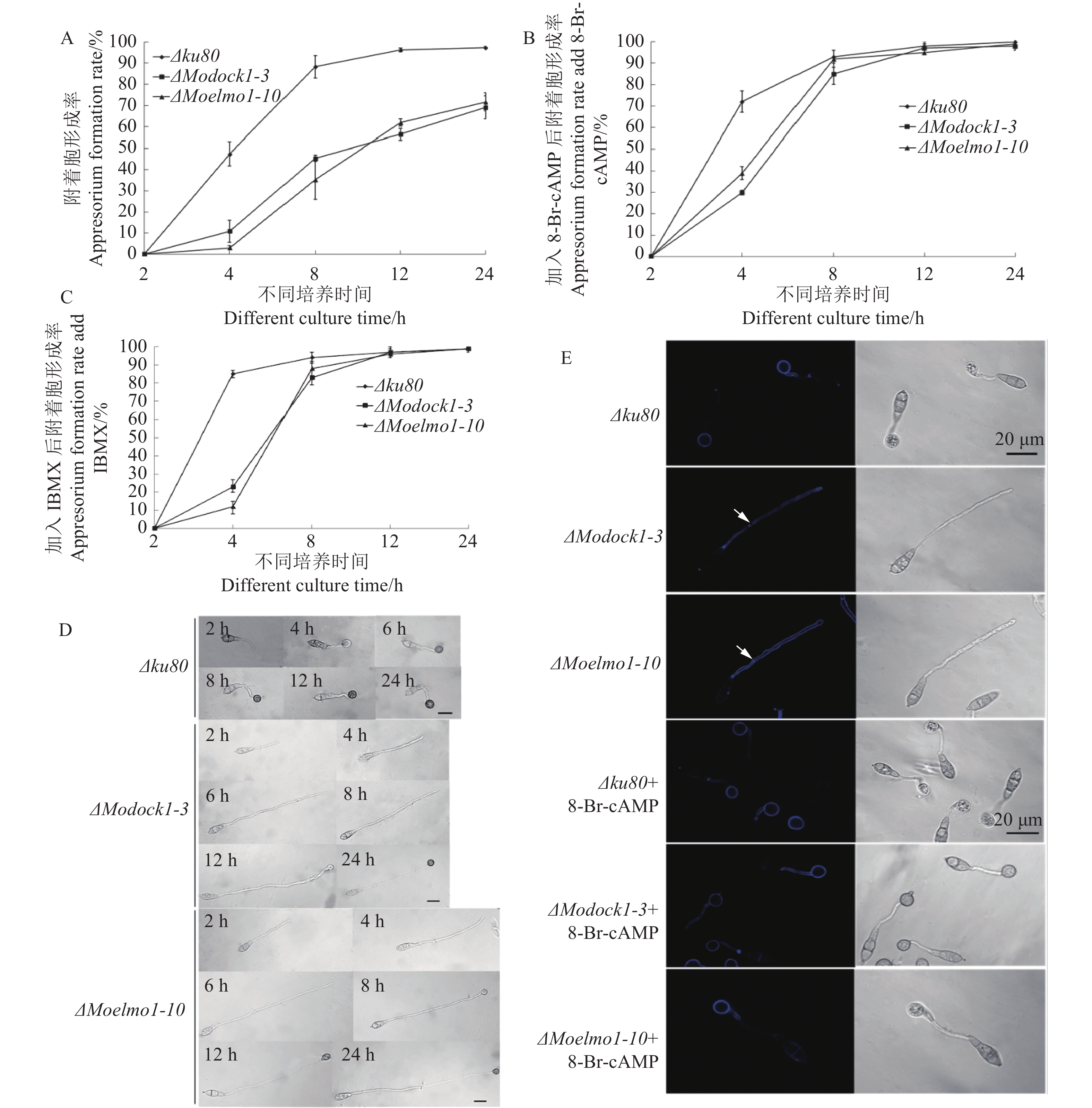
附着胞诱导试验结果显示,MoDOCK1、MoELMO1的缺失导致附着胞形成有所延迟(图6A-C)。4 h时,Δku80的附着胞形成率约50%,而ΔModock1-3、ΔMoelmo1-10还不到20%;8 h时,Δku80的附着胞形成率达近90%,而ΔModock1-3、ΔMoelmo1-10还不到50%;24 h时,相较于Δku80接近100%的附着胞形成率,ΔModock1-3、ΔMoelmo1-10仅有70%左右。不仅如此,MoDOCK1、MoELMO1的缺失导致芽管变长(图6D、E)。
![]() 图 6 附着胞形成率与形态A-C:不同菌株在含有或不含有8-Br-cAMP或IBMX时的附着胞形成率;D:不同菌株附着胞形态;E:不同菌株在诱导6 h后的附着胞形态以及芽管隔膜染色,箭头指示隔膜。Bar=20 μm。Figure 6. Appressorium formation rate and appressorium morphologyA-C: appressorium formation rates of different strains with or without 8-Br-cAMP or IBMX; D: appressorium morphology of different strains; E: appressorium morphology and stained bud tube septum of different strains after inducing for 6 h. Arrow indicates septum. Bar = 20 μm.
图 6 附着胞形成率与形态A-C:不同菌株在含有或不含有8-Br-cAMP或IBMX时的附着胞形成率;D:不同菌株附着胞形态;E:不同菌株在诱导6 h后的附着胞形态以及芽管隔膜染色,箭头指示隔膜。Bar=20 μm。Figure 6. Appressorium formation rate and appressorium morphologyA-C: appressorium formation rates of different strains with or without 8-Br-cAMP or IBMX; D: appressorium morphology of different strains; E: appressorium morphology and stained bud tube septum of different strains after inducing for 6 h. Arrow indicates septum. Bar = 20 μm.cAMP-PKA信号通路调控着稻瘟病菌附着胞的发育,通过外源添加cAMP类似物能够部分恢复因通路上游部分基因缺失所造成的附着胞形成上的缺陷[24, 26−28]。通过加入cAMP类似物,5 mmol·L−18-Br-cAMP或2.5 mmol·L−1 IBMX诱导后,ΔModock1-3、ΔMoelmo1-10突变体的附着胞形成率明显提升(图6A-C)。这些结果表明, MoDock1、MoElmo1可能在稻瘟病菌cAMP-PKA信号途径中发挥作用。
在附着胞形成初期,芽管与初始附着胞之间不会形成隔膜,待细胞核转移到附着胞后,附着胞与芽管的交界处才形成隔膜[29]。通过隔膜染色发现,ΔModock1-3、ΔMoelmo1-10的芽管在疏水膜上诱导6 h后就出现异常分隔,而Δku80的芽管中并未形成隔膜但已形成初始附着胞。突变体这种不正常隔膜现象在加入外源的8-Br-cAMP和IBMX后得到修复(图6C)。上述结果说明MoDock1、MoElmo1调控稻瘟病菌附着胞的正常发育。
2.6 MoDOCK1和MoELMO1的缺失对侵染能力的影响
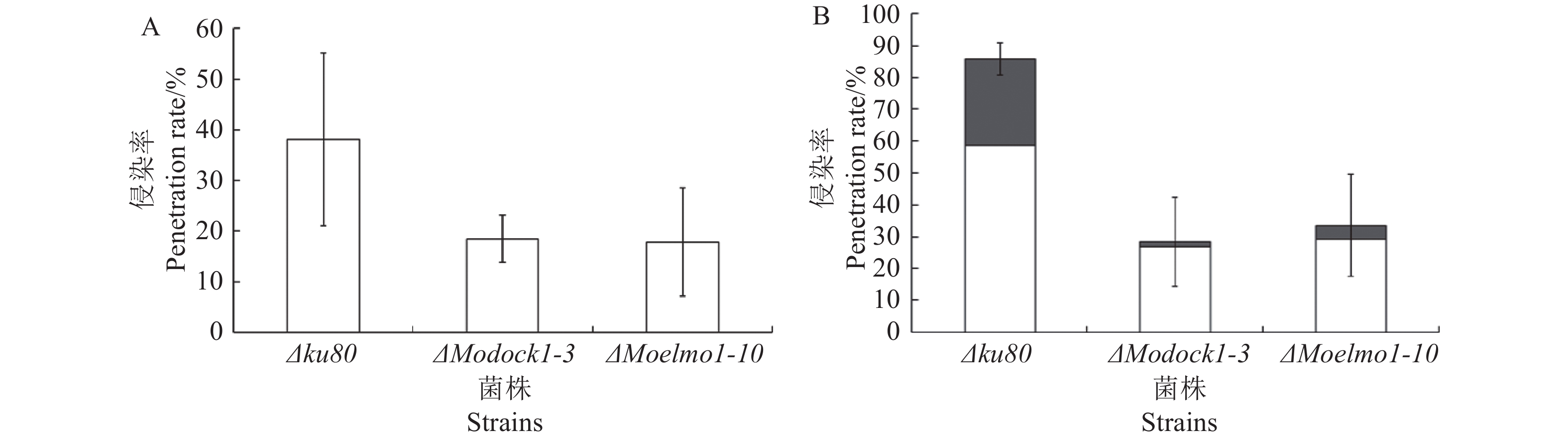
通过洋葱表皮侵染试验表明,Δku80和ΔModock1-3、ΔMoelmo1-10在洋葱表皮都能形成附着胞。接种洋葱表皮24 h后,Δku80已有约40%附着胞产生了侵入栓并侵入第一个细胞,但并未扩展至相邻细胞,而这一数值在突变体中仅为不到20%;接种48 h后,Δku80超过80%的附着胞产生侵染栓并侵入细胞,其中约1/3已扩展到相邻细胞,而突变体大部分附着胞仍没有形成侵染栓。以上结果表明,MoDOCK1和MoELMO1的缺失导致稻瘟病菌在洋葱表皮的侵染能力下降(图7)。
![]() 图 7 不同菌株侵染洋葱的侵染率A:不同菌株侵染洋葱24 h后的侵染率;B:不同菌株侵染洋葱48 h后的侵染率。柱子中的白色部分代表附着胞侵入细胞但并未扩展至相邻细胞这一状态占所有附着的的比例,灰色部分代表附着胞侵入细胞后继续扩展至相邻细胞这一状态占所有附着胞的比例。Figure 7. Penetration rates of onions infected by different strainsA: penetration rates of onions infected by different strains after 24 h; B: penetration rates of onions infected by different strains after 48 h. White part of column represents proportion of appressorium invaded a cell without entering neighboring cells; and grey part, that of appressorium extended invasion into neighboring cells.
图 7 不同菌株侵染洋葱的侵染率A:不同菌株侵染洋葱24 h后的侵染率;B:不同菌株侵染洋葱48 h后的侵染率。柱子中的白色部分代表附着胞侵入细胞但并未扩展至相邻细胞这一状态占所有附着的的比例,灰色部分代表附着胞侵入细胞后继续扩展至相邻细胞这一状态占所有附着胞的比例。Figure 7. Penetration rates of onions infected by different strainsA: penetration rates of onions infected by different strains after 24 h; B: penetration rates of onions infected by different strains after 48 h. White part of column represents proportion of appressorium invaded a cell without entering neighboring cells; and grey part, that of appressorium extended invasion into neighboring cells.2.7 MoDOCK1和MoELMO1的缺失对稻瘟病菌完整致病效果的影响
水稻喷雾接种试验显示,MoDOCK1、MoELMO1缺失突变体在水稻叶片上依然能形成病斑且能扩展,但病斑数较对照组Δku80有所减少(图8)。这些结果表明,MoDOCK1和MoELMO1的缺失对稻瘟病菌的完整致病性有负面影响。
2.8 MoDock1和 MoElmo1互作
ΔModock1与 ΔMoelmo1几乎一致的表型特征表明,MoDock1与 MoElmo1之间很可能存在互作关系。在哺乳动物中,Dock180和Elmo1可以形成复合体[10]。通过构建MoDock1:FLAG和MoElmo1:GFP载体并共转化入Δku80菌株,对获得的共表达MoDock1:FLAG和MoElmo1:GFP的菌株进行免疫共沉淀,试验表明MoDock1与 MoElmo1存在互作关系(图9)。
3. 讨论与结论
哺乳动物中,Dock180/ELMO发挥着Rac GEF的功能参与诸多基础生命活动[8]。在真菌中,关于Dock180或ELMO同源蛋白的研究还很少,尚未见其在植物病原真菌中的研究。稻瘟病菌Rac1调控着菌株生长发育、无性繁殖和致病性等过程,尚未发现调控Rac1的GEF,稻瘟病菌中Dock180/ELMO的同源物可能就充当这一角色[14]。本研究通过氨基酸序列同源比对在稻瘟病菌中找到Dock180/ELMO的同源基因MoDOCK1与MoELMO1,分析二者编码蛋白所含有的结构域,并通过基因敲除获得各自基因的缺失突变体。通过对基因缺失突变体表型的分析显示MoDock1与MoElmo1蛋白发挥着近乎一样的功能,二者主要参与了对稻瘟病菌分生孢子粘着能力和附着胞发育的调控,间接影响了稻瘟病菌对水稻的致病性。
MoDOCK1、MoELMO1对稻瘟病菌的营养生长和产孢并非是必不可少的,但MoDOCK1、MoELMO1的缺失严重影响了稻瘟病菌分生孢子的粘着。作为稻瘟病菌分生孢子侵染的初始活动,分生孢子尖端产生的尖端黏液使得分生孢子紧紧黏附在宿主表面,以防雨水的冲刷[22, 30]。MoDOCK1、MoELMO1的缺失使分生孢子粘着能力下降,很可能就是由于影响了尖端粘着液的产生。
MoDOCK1、MoELMO1的缺失导致稻瘟病菌附着胞发育异常,外源8-Br-cAMP和IBMX可以修复。细胞表面信号传导相关蛋白Pal1的缺失造成稻瘟病菌附着胞发育的缺陷,亦可通过添加外源cAMP类似物可恢复表型缺陷[27]。上述例子说明MoDock1、MoElmo1可能和Pal1蛋白的角色类似,处于稻瘟病菌cAMP-PKA信号途径腺苷酸环化酶Mac1的上游[27, 28]。ΔModock1-3、ΔMoelmo1-10长而直的芽管,可能是不能有效识别分生孢子所在表面的特性,变得没有方向性,从而导致附着胞形成的延迟。附着胞的形成与稻瘟病菌分生孢子即将萌发出芽管的细胞有丝分裂及分隔有关, MoDOCK1、MoELMO1的缺失导致稻瘟病菌附着胞形成过程中出现分隔紊乱的现象,突变体在尚未形成附着胞时就在芽管中形成隔膜,外源cAMP类似物弥补这些缺陷。这些结果暗示着MoDock1、MoElmo1和cAMP-PKA信号通路参与附着胞形成过程中的核分裂以及隔膜形成。
喷雾接种的结果显示,MoDOCK1、MoELMO1的缺失突变体仍然具有致病性,但病斑数下降,说明MoDock1、MoElmo1对于稻瘟病菌完整的致病性有一定的影响。分生孢子在水稻叶片表面的成功粘着是致病的关键。MoDOCK1、MoELMO1的缺失导致的分生孢子粘着能力下降是导致致病性下降的重要因素。此外,洋葱表皮侵染试验显示MoDOCK1、MoELMO1的缺失导致分生孢子侵染效率下降,这也是致病性有所下降的因素之一。
由于ΔModock1与 ΔMoelmo1有着几乎完全一样的表型, MoDock1与 MoElmo1很可能与哺乳动物中同源蛋白类似,二者形成复合体共同发挥作用。免疫共沉淀试验证明证实了这一猜想。在已报道的其他物种中,Dock180/ELMO作为Rac的GEF行使功能,然而将稻瘟病菌ΔModock1与 ΔMoelmo1的表型与ΔMorac1相比较发现较大差异,推断在稻瘟病菌中MoDock1与 MoElmo1并非激活MoRac1的主要GEF,二者可能是在cAMP-PKA信号通路中发挥重要作用[8, 9, 14]。在粗糙脉孢霉中的研究显示,Rho蛋白与Rho GEF之间并非一一对应的关系, Rho4就具有2个GEF,而Cdc24却同时发挥着Cdc42和Rac1 GEF的角色 [31, 32]。在稻瘟病菌中,Cdc24可能充当Rac1GEF的角色,还有待进一步的试验证明。
综上,本研究通过对稻瘟病菌中MoDock1与 MoElmo1蛋白功能的研究,推断二者在cAMP-PKA信号通路中发挥重要作用,明确了二者在稻瘟病菌分生孢子粘着和附着胞发育过程中的重要作用,对稻瘟病菌完整致病性亦有一定的影响。本研究对进一步深入解析稻瘟病菌的致病分子机制有重要意义,间接助力于稻瘟病菌防治策略的制定。
-
图 2 MoDOCK1基因敲除突变体的验证
A:MoDOCK1基因敲除突变体的PCR验证;B:MoDOCK1基因敲除突变体的RT-PCR验证;C:MoDOCK1基因敲除和Southern杂交策略图,S代表Sac Ⅰ;D:MoDOCK1基因敲除突变体的Southern杂交验证。
Figure 2. Verification of MoDOCK1-deleted mutants
A: verification of MoDOCK1-deleted mutants by PCR; B: verification of MoDOCK1-deleted mutants by RT-PCR; C: strategy of MoDOCK1 deletion and Southern blot; S: Sac Ⅰ; D: verification of MoDOCK1-deleted mutants by Southern blot.
图 3 MoELMO1基因敲除突变体的验证
A:MoELMO1基因敲除突变体的PCR验证;B:MoELMO1基因敲除突变体的RT-PCR验证;C:MoELMO1基因敲除和Southern杂交策略图,H代表Hind Ⅲ;D:MoELMO1基因敲除突变体的Southern杂交验证。
Figure 3. Verification of MoELMO1-deleted mutants
A: Verification of MoELMO1-deleted mutants by PCR; B: verification of MoELMO1-deleted mutants by RT-PCR; C: strategy of MoELMO1 deletion and Southern blot; H: Hind Ⅲ; D: verification of MoELMO1-deleted mutants by Southern blot.
图 6 附着胞形成率与形态
A-C:不同菌株在含有或不含有8-Br-cAMP或IBMX时的附着胞形成率;D:不同菌株附着胞形态;E:不同菌株在诱导6 h后的附着胞形态以及芽管隔膜染色,箭头指示隔膜。Bar=20 μm。
Figure 6. Appressorium formation rate and appressorium morphology
A-C: appressorium formation rates of different strains with or without 8-Br-cAMP or IBMX; D: appressorium morphology of different strains; E: appressorium morphology and stained bud tube septum of different strains after inducing for 6 h. Arrow indicates septum. Bar = 20 μm.
图 7 不同菌株侵染洋葱的侵染率
A:不同菌株侵染洋葱24 h后的侵染率;B:不同菌株侵染洋葱48 h后的侵染率。柱子中的白色部分代表附着胞侵入细胞但并未扩展至相邻细胞这一状态占所有附着的的比例,灰色部分代表附着胞侵入细胞后继续扩展至相邻细胞这一状态占所有附着胞的比例。
Figure 7. Penetration rates of onions infected by different strains
A: penetration rates of onions infected by different strains after 24 h; B: penetration rates of onions infected by different strains after 48 h. White part of column represents proportion of appressorium invaded a cell without entering neighboring cells; and grey part, that of appressorium extended invasion into neighboring cells.
表 1 本研究所用到的引物
Table 1 Primers applied
引物
Primers序列(5′ - 3′)
Sequences (5′ - 3′)用途
ApplicationdockAF GCGAAGCTTGAGCACATCCATGCGGTAG 扩增MoDOCK1上游片段 dockAR GCGAATTCGCAATCGGGACTGTAGGC dockBF GCGGGATCCCGTTGAGAAGAGGGTGCT 扩增MoDOCK1下游片段 dockBR AGCTCTAGAACCGAAAGCGGCCTGAAA dockOF GCAGTCCTTCACTAGCGTT 扩增MoDOCK1 ORF、筛选MoDOCK1缺失突变体 dockOR AGGAATTGGCCTTCAACGT dockUA TGTCCTGTTACTTGTCTGG 筛选MoDOCK1缺失突变体 H853 GACAGACGTCGCGGTGAGTT dockRTF GCGAGTACCACAGCCGATTC MoDOCK1缺失突变体RT-PCR验证 dockRTR GCCAGACATTTCTTGCGTTTT dockPF GGTACGACTTTAGACCAAATA 扩增MoDOCK1缺失突变体,Southern杂交验证验证探针 dockPR TTCGAGAGGTCTGTGTGA elmoAF TCTGCGCCGACTGATTGCA 扩增MoELMO1上游片段 elmoAR TTGACCTCCACTAGCTCCAGCCAAGCCAGTAGGCGAGGGTGTTGC elmoBF GAATAGAGTAGATGCCGACCGCGGGTTCAAGGACGTGCTAGAGGTTG 扩增MoELMO1下游片段 elmoBR ATTGTGATCTTGGTGGTCG elmoOF GCTCATCATGACCACTGGT 扩增MoELMO1 ORF、筛选MoELMO1缺失突变体 elmoOR AACCATGCTGACGGCAAAGCT elmoUA GTCCTGTGCAGTGGGCAACAA 筛选MoELMO1缺失突变体 elmoRTF TGGAAGGAGGTCCGTGTCG MoELMO1缺失突变体RT-PCR验证 elmoRTR GTGCTCGTAAAGAACCATGCTGA elmoAF2 CAGTATGGGATGAGCACC 扩增MoELMO1缺失突变体,Southern杂交验证验证探针 elmoAR2 CAGAGTCGCCGAGTCTTA dockFlgF CAGATCTTGGCTTTCGTAGGAACCCAATCTTCAATGCCCTGGCACCCTTTGCC 构建pDOCK:FLAG载体 dockFlgR CTTTATAATCACCGTCATGGTCTTTGTAGTCTTCCTCATCGACGCTTCCCATG elmoGF CAGATCTTGGCTTTCGTAGGAACCCAATCTTCAATGGACCAGGCCGACATAC 构建pELMO:GFP载体 elmoGR CACCACCCCGGTGAACAGCTCCTCGCCCTTGCTCACGACCTCGTAGTAGTAATTCTCATCCAG 表 2 菌株菌落直径与产孢量
Table 2 Colony diameter and conidiation of different strains
菌株 Strain 菌落直径 Colony diameter /cm 产孢量 Conidiation /(×104/皿) Δku80 6.29±0.07 a 167.6±24.4 a ΔModock1-3 5.04±0.14 c 163.3±37.3 a ΔModock1-10 5.07±0.06 c 174.0±36.7 a ΔMoelmo1-10 5.25±0.08 b 173.2±30.0 a ΔMoelmo1-34 5.20±0.13 b 158.6±25.9 a 同列数据后不同的小写字母表示 0.05 水平上差异显著。
Data with different lowercase letters on same column indicate significant difference at 0.05 level. -
[1] KOBAYASHI K,WANG X H,WANG W Q. Genetically modified rice is associated with hunger,health,and climate resilience[J]. Foods,2023,12(14) :2776. DOI: 10.3390/foods12142776
[2] 卢宣君,苏珍珠,刘小红,等. 稻瘟病菌致病机制及绿色防控新策略[J]. 浙江大学学报(农业与生命科学版) ,2022,48(6) :721−730. DOI: 10.3785/j.issn.1008-9209.2022.07.012 LU X J,SU Z Z,LIU X H,et al. Review on pathogenic mechanism of Magnaporthe oryzae and new green prevention and control strategy[J]. Journal of Zhejiang University (Agriculture and Life Sciences) ,2022,48(6) :721−730. (in Chinese) DOI: 10.3785/j.issn.1008-9209.2022.07.012
[3] BAKER B,ZAMBRYSKI P,STASKAWICZ B,et al. Signaling in plant-microbe interactions[J]. Science,1997,276(5313) :726−733. DOI: 10.1126/science.276.5313.726
[4] NIZOLLI V O,VIANA V E,PEGORARO C,et al. Wheat blast:The last enemy of hunger fighters[J]. Genetics and Molecular Biology,2023,46(1 suppl 1) :e20220002.
[5] DEAN R A,TALBOT N J,EBBOLE D J,et al. The genome sequence of the rice blast fungus Magnaporthe grisea[J]. Nature,2005,434(7036) :980−986. DOI: 10.1038/nature03449
[6] HARRIS S D. Cdc42/rho GTPases in fungi:Variations on a common theme[J]. Molecular Microbiology,2011,79(5) :1123−1127. DOI: 10.1111/j.1365-2958.2010.07525.x
[7] MOSADDEGHZADEH N,AHMADIAN M R. The RHO family GTPases:Mechanisms of regulation and signaling[J]. Cells,2021,10(7) :1831. DOI: 10.3390/cells10071831
[8] CÔTÉ J F,VUORI K. GEF what?Dock180 and related proteins help Rac to polarize cells in new ways[J]. Trends in Cell Biology,2007,17(8) :383−393. DOI: 10.1016/j.tcb.2007.05.001
[9] GRIMSLEY C M,KINCHEN J M,TOSELLO-TRAMPONT A C,et al. Dock180 and ELMO1 proteins cooperate to promote evolutionarily conserved rac-dependent cell migration[J]. Journal of Biological Chemistry,2004,279(7) :6087−6097. DOI: 10.1074/jbc.M307087200
[10] BRUGNERA E,HANEY L,GRIMSLEY C,et al. Unconventional Rac-GEF activity is mediated through the Dock180–ELMO complex[J]. Nature Cell Biology,2002,4(8) :574−582. DOI: 10.1038/ncb824
[11] ZHANG C K,WANG Y,WANG J Q,et al. Functional characterization of Rho family small GTPases in Fusarium graminearum[J]. Fungal Genetics and Biology,2013,61:90−99. DOI: 10.1016/j.fgb.2013.09.001
[12] ZHANG C K,LUO Z H,HE D D,et al. FgBud3,a Rho4-interacting guanine nucleotide exchange factor,is involved in polarity growth,cell division and pathogenicity of Fusarium graminearum[J]. Frontiers in Microbiology,2018,9:1209. DOI: 10.3389/fmicb.2018.01209
[13] ZHENG W,ZHAO Z Y,CHEN J S,et al. A Cdc42 ortholog is required for penetration and virulence of Magnaporthe grisea[J]. Fungal Genetics and Biology,2009,46(6/7) :450−460.
[14] CHEN J S,ZHENG W,ZHENG S Q,et al. Rac1 is required for pathogenicity and Chm1-dependent conidiogenesis in rice fungal pathogen Magnaporthe grisea[J]. PLoS Pathogens,2008,4(11) :e1000202. DOI: 10.1371/journal.ppat.1000202
[15] ZHENG W,CHEN J S,LIU W D,et al. A Rho3 homolog is essential for appressorium development and pathogenicity ofMagnaporthe grisea[J]. Eukaryotic Cell,2007,6(12) :2240−2250. DOI: 10.1128/EC.00104-07
[16] HOPE H,SCHMAUCH C,ARKOWITZ R A,et al. The Candida albicans ELMO homologue functions together with Rac1 and Dck1,upstream of the MAP Kinase Cek1,in invasive filamentous growth[J]. Molecular Microbiology,76(6) :1572–1590.
[17] HOPE H,BOGLIOLO S,ARKOWITZ R A,et al. Activation of Rac1 by the guanine nucleotide exchange factor Dck1 is required for invasive filamentous growth in the PathogenCandida albicans[J]. Molecular Biology of the Cell,2008,19(9) :3638−3651. DOI: 10.1091/mbc.e07-12-1272
[18] PAYSAN-LAFOSSE T,BLUM M,CHUGURANSKY S,et al. InterPro in 2022[J]. Nucleic Acids Research,2023,51(D1) :D418−D427. DOI: 10.1093/nar/gkac993
[19] PUNTA M,COGGILL P C,EBERHARDT R Y,et al. The pfam protein families database[J]. Nucleic Acids Research,2012,40(D1) :D290−D301. DOI: 10.1093/nar/gkr1065
[20] HE M,XU Y P,CHEN J H,et al. MoSnt2-dependent deacetylation of histone H3 mediates MoTor-dependent autophagy and plant infection by the rice blast fungusMagnaporthe oryzae[J]. Autophagy,2018,14(9) :1543−1561. DOI: 10.1080/15548627.2018.1458171
[21] LI C H,CAO S L,ZHANG C K,et al. MoCDC14 is important for septation during conidiation and appressorium formation in Magnaporthe oryzae[J]. Molecular Plant Pathology,2018,19(2) :328−340. DOI: 10.1111/mpp.12523
[22] BAE C Y,KIM S,CHOI W B,et al. Involvement of extracellular matrix and integrin-like proteins on conidial adhesion and appressorium differentiation in Magnaporthe oryzae[J]. Journal of Microbiology and Biotechnology,2007,17(7) :1198−1203.
[23] LI L,XUE C Y,BRUNO K,et al. Two PAK kinase genes,CHM1 and MST20,have distinct functions in Magnaporthe grisea[J]. Molecular Plant-Microbe Interactions®,2004,17(5) :547−556.
[24] XU J R,URBAN M,SWEIGARD J A,et al. The CPKA gene of Magnaporthe grisea is essential for appressorial penetration[J]. Molecular Plant-Microbe Interactions®,1997,10(2) :187−194.
[25] LI Y,ZHANG X,HU S,et al. PKA activity is essential for relieving the suppression of hyphal growth and appressorium formation by MoSfl1 in Magnaporthe oryzae[J]. PLoS Genetics,2017,13(8) :e1006954. DOI: 10.1371/journal.pgen.1006954
[26] LI G T,ZHOU X Y,XU J R. Genetic control of infection-related development in Magnaporthe oryzae[J]. Current Opinion in Microbiology,2012,15(6) :678−684. DOI: 10.1016/j.mib.2012.09.004
[27] CHEN D,HU H,HE W H,et al. Endocytic protein Pal1 regulates appressorium formation and is required for full virulence ofMagnaporthe oryzae[J]. Molecular Plant Pathology,2022,23(1) :133−147. DOI: 10.1111/mpp.13149
[28] CHOI W,DEAN R A. The adenylate cyclase gene MAC1 of Magnaporthe grisea controls appressorium formation and other aspects of growth and development[J]. The Plant Cell,1997,9(11) :1973−1983.
[29] 林福呈. 稻瘟病菌附着胞形成的细胞生物学[J]. 植物病理学报,2001,31(2) :97−101. DOI: 10.3321/j.issn:0412-0914.2001.02.001 LIN F C. Cell biology of appressorium formation of Magnaporthe grisea[J]. Acta Phytopathologica Sinica,2001,31(2) :97−101. DOI: 10.3321/j.issn:0412-0914.2001.02.001
[30] BRETH B,ODENBACH D,YEMELIN A,et al. The role of the Tra1p transcription factor of Magnaporthe oryzae in spore adhesion and pathogenic development[J]. Fungal Genetics and Biology,2013,57:11−22. DOI: 10.1016/j.fgb.2013.05.008
[31] ARAUJO-PALOMARES C L,RICHTHAMMER C,SEILER S,et al. Functional characterization and cellular dynamics of the CDC-42–RAC–CDC-24 module in Neurospora crassa[J]. PLoS One,2011,6(11) :e27148. DOI: 10.1371/journal.pone.0027148
[32] JUSTA-SCHUCH D,HEILIG Y,RICHTHAMMER C,et al. Septum formation is regulated by the RHO4-specific exchange factors BUD3 and RGF3 and by the landmark protein BUD4 in Neurospora crassa[J]. Molecular Microbiology,2010,76(1) :220−235. DOI: 10.1111/j.1365-2958.2010.07093.x




 下载:
下载: