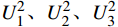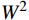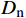Genetic Analysis on Resistance of Bitter Gourd to Fusarium Wilt
-
摘要:目的
培育抗病苦瓜品种是防控由尖孢镰孢菌苦瓜专化型引起苦瓜枯萎病的关键措施。本研究旨在明确苦瓜枯萎病抗性遗传规律,为苦瓜抗枯萎病种质创制及新品种选育提供理论依据。
方法以苦瓜高代自交系高抗种质父本材料Mc176与高代自交系感病种质母本材料Mc131杂交,构建四世代遗传群体(P1、P2、F1、 F2),获得四世代种子后播种,并使用灌根接菌法在苦瓜两叶一心时期接种尖孢镰孢菌苦瓜专化型,接种后25 d进行抗性鉴定。采用R-4.1.1软件包SEA对24个主基因+多基因混合遗传模型分析,确定苦瓜枯萎病抗性遗传最适模型。
结果苦瓜枯萎病抗性遗传符合“1MG-AD”模型,即1对加性-显性主基因模型,加性效应和显性效应值分别为2.347 9和0.646 7,一对主基因在F2代中遗传率为30.86 %,受环境因素影响为69.14 %。
结论苦瓜枯萎病抗性具有显著数量性状特点,在Mc131×Mc176杂交组合中枯萎病抗性受一对主基因调控,控制枯萎病抗性的主基因以加性效应为主,且枯萎病抗性受环境条件影响较大。
-
关键词:
- 苦瓜 /
- 枯萎病 /
- 遗传分析 /
- 主基因+多基因混合模型
Abstract:ObjectiveGenetics of bitter gourd in resisting Fusarium wilt was analyzed to better understand the most effective way of the disease control by breeding wilt-resistant variety.
MethodA population of P1, P2, F1, and F2 generations was established by crossing a highly resistant Mc176 as the male parent and a susceptible Mc131 as the female parent. The seeds from the plants were sown, and the seedlings at two-leaves-and-one-bud stage inoculated with Fusarium oxysporum Schl. f. sp. momordicae by root-grafting. Twenty-five days afterward, phenotypic identification was performed on the plants. The SEA package in the R-4.1.1 software was used to analyze 24 mixed major gene+polygene models to select the best fit one for predicting bitter gourd resistance to Fusarium wilt.
ResultThe 1MG-AD model was found to satisfactorily represent the wilt resistance. The additive and dominant effect values generated by the model were 2.3479 and 0.6467, respectively, with 30.86 % heritability on a pair of the major genes in F2 population.
ConclusionThe Fusarium wilt resistance of bitter gourd demonstrated a significant quantitative characteristic. In the Mc131× Mc176 hybrid combination, the resistance was regulated by a pair of mainly additive genes that controlled the trait. Since the environmental factors affected more significantly than genetics on the heritability of the major genes in F2 generation population, further experiments taking external conditions into consideration are in order.
-
0. 引言
【研究意义】苦瓜(Momordica charantia L.)又称凉瓜、癞瓜,原产于非洲热带地区[1],属于葫芦科苦瓜属一年生草本蔬菜作物。苦瓜富含维生素C和苦瓜素等活性成分,具有较高的营养和药用价值[2]。在市场上,苦瓜主要以菜肴形式被食用,或通过深加工制成苦瓜茶、苦瓜粉和苦瓜饼干等产品[3]。苦瓜枯萎病是由尖孢镰孢菌苦瓜专化型(Fusarium oxysporum Schl. f. sp. momordicae)引起的一种土传病害[4]。病害发生时,苦瓜叶脉失绿变黄,植株萎蔫,严重时整株死亡。苦瓜枯萎病一般发病率为15%~25%,严重时高达60%~80%[5]。陈振东[6]对广西苦瓜主产区调研发现,大棚连作的苦瓜在盛花期枯萎病平均发病率为13.50%~51.80%,盛果期达40.35%~80.84%,苦瓜枯萎病的发生严重影响苦瓜品质和产量。因此,探讨苦瓜枯萎病抗性遗传机制,对创制高抗苦瓜新品种提供技术支持与理论指导,对推动苦瓜产业的持续健康发展具有重要意义。【前人研究进展】在生产中,防治苦瓜枯萎病主要依赖于综合防治措施,如生物防治[7]、化学防治[8]和农业管理措施[9]等。然而,这些方法存在一定的局限性且效果欠佳,选育高抗枯萎病的苦瓜品种被视为最根本且有效的防治途径。苦瓜中枯萎病抗性表现出显著的分化特征,且苦瓜高抗种质资源甚少。关峰[5]和林永胜[10]等对不同来源的苦瓜品种及种质资源进行了枯萎病抗性鉴定,各自筛选出2份高抗枯萎病苦瓜品种及种质资源。王艳茹等[4]对191份苦瓜种质资源抗性进行鉴定,未发现高抗枯萎病的苦瓜种质。为了加速苦瓜枯萎病抗性数量性状基因座(quantitative trait locus, QTL)的定位工作,并缩短高抗新品种的培育周期,对苦瓜枯萎病抗性遗传的基因对数及其遗传效应进行深入分析显得尤为必要。不同于质量性状采用经典遗传学方式进行遗传规律分析,数量性状借助数理统计方法,能够有效分析性状遗传规律[11]。近年来,利用植物数量性状分离分析软件(segregation analysis, SEA)分析数量性状遗传模型的方法已经在茄子(Solanum melongena L.)[12]、节瓜(Benincasa hispida var. chiehqua How)[13]、番茄(Solanum lycopersicum L.)[14]、辣椒(Capsicum annuum L.)[15]、菊花(Chrysanthemum × morifolium Ramat.)[16]等多种作物中得到应用。该方法通过主基因+多基因混合遗传分析,确定目的性状受主基因和多基因控制的比率,从而有助于选择合适的育种方法,实现转移主基因或者聚合多基因[17],对选择育种有重要的指导意义。目前,关于苦瓜枯萎病抗性遗传规律的研究已有少量相关报道,但结果并不统一。赵秀娟等[18]研究认为,苦瓜枯萎病抗性是由单一显性核基因控制,而刘子记等[19]和琚茜茜等[20]则认为苦瓜枯萎病抗性受到两对主基因和多基因的共同作用。【本研究切入点】鉴于前人研究结果存在差异,同时考虑到不同遗传群体可能对目标性状的遗传规律产生影响,本研究采用苦瓜枯萎病抗性精确鉴定评价体系,以获得精准的表型数据,并以此为基础分析苦瓜枯萎病抗性的遗传规律。【拟解决的关键问题】采用苦瓜枯萎病高抗种质材料Mc176和高感种质材料Mc131配制杂交组合,构建一个四世代群体(P1, P2, F1, F2),通过主基因+多基因混合遗传模型分析苦瓜枯萎病抗性遗传规律,为苦瓜抗枯萎病种质创制及新品种选育提供理论参考。
1. 材料与方法
1.1 试验材料
供试苦瓜高代自交系高抗材料Mc176和苦瓜高代自交系感病材料Mc131,由中国热带农业科学院热带作物品种资源研究所冬季瓜菜研究中心提供。以Mc176为父本、Mc131为母本构建杂交群体,父母本在花期经人工授粉后获得F1代种子,F1代播种定植后自交获得F2代。苦瓜枯萎病菌使用尖孢镰孢菌苦瓜专化型‘
4501 ’’,由广西壮族自治区农业科学院陈振东研究员提供。1.2 苦瓜枯萎病接种及抗性鉴定
1.2.1 苦瓜枯萎病菌液配制
将尖孢镰孢菌苦瓜专化型4501转移到马铃薯葡萄糖琼脂培养基平板,并将平板放置于28 ℃恒温培养箱培养7~12 d。待尖孢镰孢菌长满平板后使用无菌打孔器取直径1 cm的菌饼,将菌饼转移到高温灭菌后的马铃薯葡萄糖肉汤液体培养基。将液体培养基置于26 ℃、120 r·min−1摇床里振荡培养7 d后,使用双层灭菌医用纱布过滤菌丝,取10 μL尖孢镰孢菌母液,采用血细胞计数板在显微镜下计数孢子并计算母液浓度。最后用无菌水将母液稀释配制成1×106 cfu·mL−1的孢子悬浮液,用于后期苦瓜苗期接种。
1.2.2 苦瓜枯萎病菌接种与抗性分级
采用本课题组建立的苦瓜枯萎病精准鉴定评价体系进行枯萎病菌接种与病情鉴定[21]。将四世代苦瓜种子浸泡在55 ℃温热水中,浸泡8 h后,用上下双层无菌湿润纱布包裹,置于28 ℃光照培养箱中催芽,待种子萌发后,播种于装有灭菌基质土的7 cm×7 cm×8 cm小花盆中。每个花盆中播种1粒萌发的苦瓜种子,待苦瓜幼苗长至两叶一心时期,使用灌根接种法接种尖孢镰孢菌,使用一次性注射器向苦瓜茎基部土壤注入菌液,每株苦瓜幼苗菌液接种量为20 mL。接菌后的四世代苦瓜于温度(28±1) ℃、光周期16L∶8D、相对湿度80%~85%的植物培养室中培养。
接种25 d后,调查各世代群体苦瓜发病株数和发病情况,计算病情指数。病情分级标准[21]:0级,无病症;1级,子叶萎蔫或部分子叶与真叶轻微萎蔫;2级,1片真叶萎蔫或子叶较重萎蔫(≤60%);3级,子叶及部分真叶萎蔫(>60%);4级,整株萎蔫,60%以上枯死,但心叶仍成活;5级,整株枯死。病情指数(disease index, DI)=Σ(病株数×该级代表值)/(总株数×最高级代表)×100。据病情指数给定世代群体抗病表型,高抗(HR):DI<10;抗病(R):10≤DI<30;中抗(MR):30≤DI<50;感病(S):50≤DI<70;高感(HS):DI≥70。
1.3 数据分析
利用Excel 2016和SPSS 22.0软件对各世代苦瓜群体的表型数据进行统计分析。利用基于R-4.1.1的SEA v2.0包对多世代群体联合分析,根据赤池信息量准则(Akaike information criterion, AIC)值最小准则备选遗传模型,对备选模型进行适合性检验(
U21、U22、U23、nW2、Dn ),适合性检验量达到显著水平的个数最少的遗传模型为最佳遗传模型。2. 结果与分析
2.1 苦瓜各世代枯萎病抗性鉴定
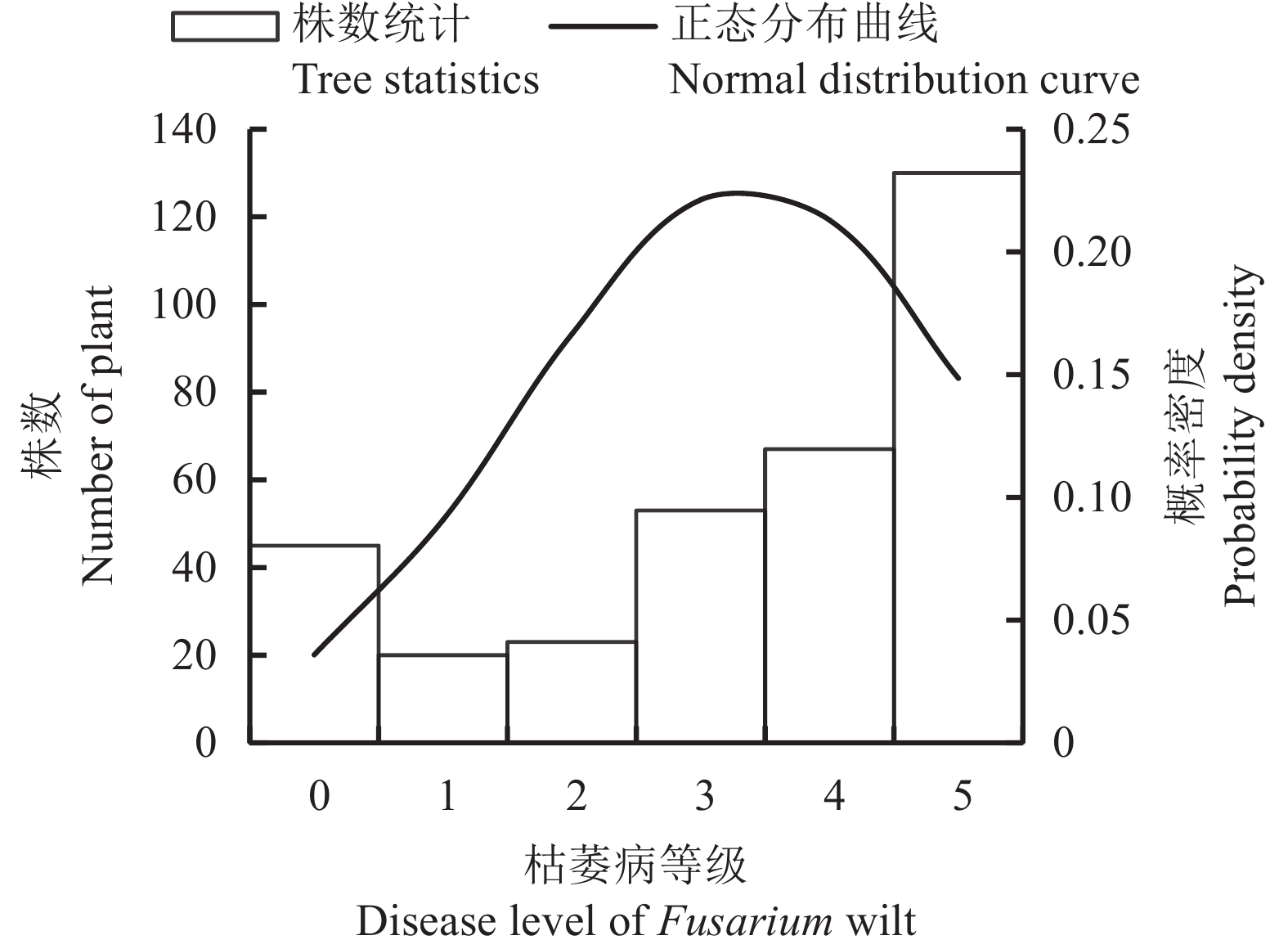
统计四世代群体枯萎病抗性等级,结果显示(表1),Mc176与Mc131两亲本对枯萎病抗性表现出显著差异(P<0.05),F1代和F2代与感病亲本Mc131抗性表现无显著差异,但F2代较F1代病情指数有降低,说明Mc176种质中抗病性状遗传到后代群体中并且提高后代抗性水平。统计四世代群体抗病类型频率(表2),除Mc176抗病材料中抗病类型为中抗、感病和高感植株不存在,其他世代在各抗病类型统计中均有分布,说明Mc176抗病材料中抗性表现较稳定,Mc131感病材料表现不稳定,后代群体中性状分离情况不满足经典遗传规律,苦瓜枯萎病为数量性状。采用SPSS 22.0对F2代分离群体进行正态分布分析,峰度为−0.670<0、偏度为−0.823<0,表现为负偏态分布(图1)。综合结果表明,苦瓜枯萎病遗传规律复杂,病情等级呈现连续性分布,具有广泛的数量性状遗传特征。
表 1 苦瓜四世代群体枯萎病抗性评价Table 1. Fusarium wilt resistance of 4 bitter gourd generations世代
Generation各病情等级株数
Number of each disease grade总株数
Number of plants发病率
Incidence/%病情指数
Disease index抗性
Resistance0 1 2 3 4 5 P1(Mc131) 1 10 6 9 18 34 78 98.72 74.62±1.47 ab HS P2(Mc176) 83 23 0 0 0 0 106 21.70 4.34±0.41 c HR F1(Mc131×Mc176) 4 1 2 11 2 29 49 91.84 77.96±1.58 a HS F2(Mc131×Mc176) 45 20 23 53 67 130 338 86.69 67.63±1.76 b S 同列数据后不同小写字母表示不同世代间差异达显著水平(P<0.05)。
Data with different lowercase letters on same column indicate significant difference among different generations at 0.05 level.表 2 苦瓜各世代群体枯萎病抗病类型频率分布Table 2. Frequency distribution of Fusarium wilt resistance types in generations of bitter gourd(单位: %) 世代
Generation抗病类型频率
Frequency of disease resistance types高抗 HR 抗病 R 中抗 MR 感病 S 高感 HS P1(Mc131) 1.28 12.82 7.69 11.54 66.67 P2(Mc176) 78.30 21.70 0 0 0 F1(Mc131×Mc176) 8.16 2.04 4.08 22.45 63.27 F2(Mc131×Mc176) 13.31 5.92 6.80 15.68 58.28 2.2 苦瓜枯萎病抗性遗传模型确定
利用R-4.1.1软件加载SEA包对Mc131×Mc176的四个世代群体(P1、P2、F1、F2)枯萎病抗性进行遗传分析,得到24个遗传模型(表3)。根据AIC值最小选择准则,筛选出枯萎病抗性候选模型为1MG-AD、1MG-NCD和1MG-A,即一对加性-显性主基因模型、一对负向完全显性主基因模型和一对加性主基因模型。进一步对3个候选模型进行适合性检验(表4),即均匀性检验(
U21、U22、U23 )、Smirnov检验(nW2 )与Kolmogorov检验(Dn ),分析3个候选遗传模型中各世代适合性检验参数显著水平(P<0.05),经统计在3个候选遗传模型中达到显著水平的适合性检验参数均为12个。因此,结合AIC值最小准则与达到显著水平统计量越少越符合遗传模型原则,适合Mc131×Mc176组合苦瓜枯萎病抗性的遗传模型为1MG-AD,即1对加性-显性主基因模型。表 3 苦瓜24个遗传模型AIC值和极大似然函数值Table 3. Max likelihood and AIC values of 24 genetic models for bitter gourd模型代码
Model code遗传模型
Genetic model极大似然值
Max likelihood valueAIC值
AIC valueA-1 1MG-AD 3 245.820 −6 479.641 A-2 1MG-A −396.892 803.783 A-3 1MG-EAD −884.929 1 779.858 A-4 1MG-NCD 3 213.302 −6 416.603 B-1 2MG-ADI −971.713 1 965.427 B-2 2MG-AD −977.259 1 968.518 B-3 2MG-A −608.557 1 227.115 B-4 2MG-EA −562.894 1 133.788 B-5 2MG-CD −870.855 1 751.709 B-6 2MG-EAD −793.595 1 595.190 C-0 PG-ADI −1 032.785 2 077.571 C-1 PG-AD −1 043.304 2 096.607 D-0 MX1-AD-ADI −969.631 1 955.262 D-1 MX1-AD-AD −976.896 1 967.792 D-2 MX1-A-AD −1 019.057 2 050.114 D-3 MX1-EAD-AD −976.896 1 965.791 D-4 MX1-NCD-AD −1 038.338 2 088.676 E-0 MX2-ADI-ADI −969.631 1 963.263 E-1 MX2-ADI-AD −970.565 1 959.130 E-2 MX2-AD-AD −976.896 1 963.791 E-3 MX2-A-AD −1 019.058 2 044.115 E-4 MX2-EA-AD −1 020.407 2 044.814 E-5 MX2-CD-AD −976.896 1 959.791 E-6 MX2-EAD-AD −996.144 1 996.287 MG:主基因模型;MX:主基因+多基因混合模型;PG:多基因遗传模型;A:加性效应;AD:加性-显性;ADI:加性-显性-上位性;EA:等加性;EAD:等加性-显性;NCD:负向完全显性;CD:完全显性。
MG: major gene model; MX: major gene+polygene mixed model; PG: poly gene genetic model; A: additive effect; AD: additive-dominance; ADI: additive-dominance-epistasis; EA: equally additive; EAD: equally additive-dominance; NCD: negatively complete dominance; CD: complete dominance.表 4 苦瓜抗枯萎病备选遗传模型的适合性检验Table 4. Fitting of genetic model for predicting Fusarium wilt resistance of bitter gourd模型
Model世代
GenerationsP (U21) P (U22) P (U23) P (nW2) P (Dn) 1MG-AD P1 0.315 3 0.254 2 0.501 7 0.002 5* 0.000 2* P2 0.050 5 0.043 5* 0.618 2 0.002 4* 0.000 0* F1 0.330 9 0.379 2 0.803 9 0.002 0* 0.000 0* F2 0.001 4* 0.000 0* 0.000 0* 0.001 2* 0.000 0* 1MG-NCD P1 0.315 4 0.254 2 0.501 6 0.002 5* 0.000 2* P2 0.050 5 0.043 5* 0.618 1 0.002 4* 0.000 0* F1 0.330 8 0.379 2 0.803 7 0.002 0* 0.000 0* F2 0.000 7* 0.000 0* 0.000 0* 0.003 2* 0.000 0* 1MG-A P1 0.315 3 0.254 2 0.501 4 0.002 5* 0.000 2* P2 0.050 5 0.043 5* 0.618 2 0.002 4* 0.000 0* F1 0.330 9 0.379 1 0.804 2 0.002 0* 0.000 0* F2 0.000 8* 0.000 0* 0.000 0* 0.003 1* 0.000 0* U21、U22、U23:均匀性检验;nW2:Smirnov检验;Dn:Kolmogorov检验;*:表示差异达显著水平(P<0.05)。
U21、U22、U23: uniformity test; nW2: Smirnov test; Dn: Kolmogorov test; *: significant difference at 0.05 level.2.3 苦瓜枯萎病抗性最适遗传模型相关遗传参数估算
根据选择的最适模型,估算最适模型中的相关遗传参数(表5)。一对主基因的加性效应值与显性效应值均大于0,表明加性效应与显性效应均起到加效的效果,并且主基因加性效应(da)> 主基因显性效应(ha),加性效应作用效果大于显性效应。根据SEA软件对苦瓜枯萎病抗性遗传参数计算,一对主基因在F2代中遗传率为30.86 %,受环境因素影响为69.14%,表明苦瓜枯萎病抗性遗传受环境影响大于遗传因素。
表 5 苦瓜杂交群体在最适合遗传模型下的遗传参数估计值Table 5. Estimated genetic parameters of bitter gourd hybrid combinations in best fit model一阶、二阶遗传参数
First and second genetic parameterMc131×Mc176 群体平均数m(m1) 2.652 1 主基因加性效应da 2.347 9 主基因显性效应ha 0.646 7 F2主基因遗传方差σ2mg 0.957 7 F2主基因遗传率h2mg/% 30.862 1 环境因素影响率(1-h2mg)/% 69.137 9 3. 讨论与结论
明确苦瓜枯萎病抗性的遗传规律,有利于选育高抗苦瓜品种,从根源上防治枯萎病的发生。本研究结果表明,苦瓜枯萎病抗性由一对主基因主导,这与赵秀娟[18]研究结论一致,而刘子记等[19]和琚茜茜等[20]则认为苦瓜枯萎病抗性受到两对主基因和多基因的调控。研究结果的差异,可能与苦瓜枯萎病的抗性鉴定方法以及鉴定时间差异有关。本研究采用未进行伤根处理的灌根法接种苦瓜植株,接种后观察期较长(25 d),而刘子记[19]和琚茜茜[20]等采用未伤根处理的浸根法接种,并在接种后15 d调查植株发病情况。这一情况在其他葫芦科作物枯萎病抗性遗传研究中也有所体现,不同抗性鉴定方法下抗性基因的遗传规律结果存在差异[22,23]。此外,也可能与病原菌致病力差异有关,随着继代代数增加,病原菌可能发生部分变异从而影响植株发病程度[24]。周红梅等[25]和毛爱军等[26]研究显示,黄瓜枯萎病抗性在‘WIS2757’与‘津研2号’遗传群体中枯萎病抗性为单基因显性调控,在‘Cu13’与‘京育202’遗传群体中枯萎病抗性为多基因调控,枯萎病抗性遗传规律受遗传背景因素影响。因此,在分析植株目标性状遗传规律时,需综合考虑遗传群体遗传背景的多样性,采用精准的性状鉴定与评价方法,以确保原始病原菌菌株致病力的稳定,这些因素对准确评估遗传群体的抗性表现、确定抗性基因对数及其遗传效应具有重要作用。
本研究中调控苦瓜枯萎病抗性的一对主基因遗传率为30.86 %,环境因素影响率为69.14 %,表明枯萎病抗性受环境条件影响较大,为数量性状的典型特征。主基因遗传率低于环境因素影响的原因可能主要包括以下两个方面:其一,基因型与环境的复杂互作显著影响植株抗性表型,导致抗性表型在不同环境条件下表现出较大变异,从而削弱了主基因的遗传贡献率;其二,主基因的遗传效应可能受到其他基因的多重掩盖或修饰作用,进一步降低了其遗传效应。为了更全面地解析苦瓜枯萎病抗性的遗传机制,提升抗性育种效率,后续可进一步优化试验设计,如采用回交策略将抗性主效基因与微效多基因聚合[27],深入探索遗传与环境互作机制,利用多组学联合分析苦瓜枯萎病抗性遗传机制,挖掘苦瓜枯萎病抗性基因,加速高抗枯萎病苦瓜新品种的培育进程。
-
表 1 苦瓜四世代群体枯萎病抗性评价
Table 1 Fusarium wilt resistance of 4 bitter gourd generations
世代
Generation各病情等级株数
Number of each disease grade总株数
Number of plants发病率
Incidence/%病情指数
Disease index抗性
Resistance0 1 2 3 4 5 P1(Mc131) 1 10 6 9 18 34 78 98.72 74.62±1.47 ab HS P2(Mc176) 83 23 0 0 0 0 106 21.70 4.34±0.41 c HR F1(Mc131×Mc176) 4 1 2 11 2 29 49 91.84 77.96±1.58 a HS F2(Mc131×Mc176) 45 20 23 53 67 130 338 86.69 67.63±1.76 b S 同列数据后不同小写字母表示不同世代间差异达显著水平(P<0.05)。
Data with different lowercase letters on same column indicate significant difference among different generations at 0.05 level.表 2 苦瓜各世代群体枯萎病抗病类型频率分布
Table 2 Frequency distribution of Fusarium wilt resistance types in generations of bitter gourd
(单位: %) 世代
Generation抗病类型频率
Frequency of disease resistance types高抗 HR 抗病 R 中抗 MR 感病 S 高感 HS P1(Mc131) 1.28 12.82 7.69 11.54 66.67 P2(Mc176) 78.30 21.70 0 0 0 F1(Mc131×Mc176) 8.16 2.04 4.08 22.45 63.27 F2(Mc131×Mc176) 13.31 5.92 6.80 15.68 58.28 表 3 苦瓜24个遗传模型AIC值和极大似然函数值
Table 3 Max likelihood and AIC values of 24 genetic models for bitter gourd
模型代码
Model code遗传模型
Genetic model极大似然值
Max likelihood valueAIC值
AIC valueA-1 1MG-AD 3 245.820 −6 479.641 A-2 1MG-A −396.892 803.783 A-3 1MG-EAD −884.929 1 779.858 A-4 1MG-NCD 3 213.302 −6 416.603 B-1 2MG-ADI −971.713 1 965.427 B-2 2MG-AD −977.259 1 968.518 B-3 2MG-A −608.557 1 227.115 B-4 2MG-EA −562.894 1 133.788 B-5 2MG-CD −870.855 1 751.709 B-6 2MG-EAD −793.595 1 595.190 C-0 PG-ADI −1 032.785 2 077.571 C-1 PG-AD −1 043.304 2 096.607 D-0 MX1-AD-ADI −969.631 1 955.262 D-1 MX1-AD-AD −976.896 1 967.792 D-2 MX1-A-AD −1 019.057 2 050.114 D-3 MX1-EAD-AD −976.896 1 965.791 D-4 MX1-NCD-AD −1 038.338 2 088.676 E-0 MX2-ADI-ADI −969.631 1 963.263 E-1 MX2-ADI-AD −970.565 1 959.130 E-2 MX2-AD-AD −976.896 1 963.791 E-3 MX2-A-AD −1 019.058 2 044.115 E-4 MX2-EA-AD −1 020.407 2 044.814 E-5 MX2-CD-AD −976.896 1 959.791 E-6 MX2-EAD-AD −996.144 1 996.287 MG:主基因模型;MX:主基因+多基因混合模型;PG:多基因遗传模型;A:加性效应;AD:加性-显性;ADI:加性-显性-上位性;EA:等加性;EAD:等加性-显性;NCD:负向完全显性;CD:完全显性。
MG: major gene model; MX: major gene+polygene mixed model; PG: poly gene genetic model; A: additive effect; AD: additive-dominance; ADI: additive-dominance-epistasis; EA: equally additive; EAD: equally additive-dominance; NCD: negatively complete dominance; CD: complete dominance.表 4 苦瓜抗枯萎病备选遗传模型的适合性检验
Table 4 Fitting of genetic model for predicting Fusarium wilt resistance of bitter gourd
模型
Model世代
GenerationsP (U21) P (U22) P (U23) P (nW2) P (Dn) 1MG-AD P1 0.315 3 0.254 2 0.501 7 0.002 5* 0.000 2* P2 0.050 5 0.043 5* 0.618 2 0.002 4* 0.000 0* F1 0.330 9 0.379 2 0.803 9 0.002 0* 0.000 0* F2 0.001 4* 0.000 0* 0.000 0* 0.001 2* 0.000 0* 1MG-NCD P1 0.315 4 0.254 2 0.501 6 0.002 5* 0.000 2* P2 0.050 5 0.043 5* 0.618 1 0.002 4* 0.000 0* F1 0.330 8 0.379 2 0.803 7 0.002 0* 0.000 0* F2 0.000 7* 0.000 0* 0.000 0* 0.003 2* 0.000 0* 1MG-A P1 0.315 3 0.254 2 0.501 4 0.002 5* 0.000 2* P2 0.050 5 0.043 5* 0.618 2 0.002 4* 0.000 0* F1 0.330 9 0.379 1 0.804 2 0.002 0* 0.000 0* F2 0.000 8* 0.000 0* 0.000 0* 0.003 1* 0.000 0* U21、U22、U23:均匀性检验;nW2:Smirnov检验;Dn:Kolmogorov检验;*:表示差异达显著水平(P<0.05)。
U21、U22、U23: uniformity test; nW2: Smirnov test; Dn: Kolmogorov test; *: significant difference at 0.05 level.表 5 苦瓜杂交群体在最适合遗传模型下的遗传参数估计值
Table 5 Estimated genetic parameters of bitter gourd hybrid combinations in best fit model
一阶、二阶遗传参数
First and second genetic parameterMc131×Mc176 群体平均数m(m1) 2.652 1 主基因加性效应da 2.347 9 主基因显性效应ha 0.646 7 F2主基因遗传方差σ2mg 0.957 7 F2主基因遗传率h2mg/% 30.862 1 环境因素影响率(1-h2mg)/% 69.137 9 -
[1] SCHAEFER H,RENNER S S. A three-genome phylogeny of Momordica (Cucurbitaceae) suggests seven returns from dioecy to monoecy and recent long-distance dispersal to Asia[J]. Molecular Phylogenetics and Evolution,2010,54(2) :553−560. DOI: 10.1016/j.ympev.2009.08.006
[2] 李成,成佳聪,谭苏航,等. α-苦瓜素对巨噬细胞炎性细胞因子风暴的选择性抑制作用[J]. 中国药理学通报,2023,39(10) :1846−1852. DOI: 10.12360/CPB202301028 LI C,CHENG J C,TAN S H,et al. Selective inhibition of inflammatory cytokine storm in macrophages by α-momorcharin[J]. Chinese Pharmacological Bulletin,2023,39(10) :1846−1852. (in Chinese) DOI: 10.12360/CPB202301028
[3] 彭飞飞,彭兴兴,付烙扬. 凉瓜的药食价值与开发利用研究进展[J]. 现代食品,2023,29(17) :74−79. PENG F F,PENG X X,FU L Y. Research progress on medicinal and food value and development and utilization of bitter gourd[J]. Modern Food,2023,29(17) :74−79. (in Chinese)
[4] 王艳茹,杨衍,牛玉,等. 苦瓜种质资源枯萎病抗性评价[J]. 分子植物育种,2022,20(6) :1909−1922. WANG Y R,YANG Y,NIU Y,et al. Resistance evaluation of bitter gourd germplasm to Fusarium wilt[J]. Molecular Plant Breeding,2022,20(6) :1909−1922. (in Chinese)
[5] 关峰,张景云,石博,等. 苦瓜枯萎病抗性鉴定及枯萎病菌胁迫下生理响应差异分析[J]. 植物生理学报,2019,55(10) :1481−1488. GUAN F,ZHANG J Y,SHI B,et al. Resistance identification to Fusarium wilt and difference in physiological response under stress of Fusarium oxysporum f. sp. momordicae in bitter gourd[J]. Plant Physiology Journal,2019,55(10) :1481−1488. (in Chinese)
[6] 陈振东,宋焕忠,秦健,等. 苦瓜枯萎病的发生与防治[J]. 中国蔬菜,2016(7) :87−89. DOI: 10.3969/j.issn.1000-6346.2016.07.026 CHEN Z D,SONG H Z,QIN J,et al. Occurrence and control of Fusarium wilt in bitter gourd[J]. China Vegetables,2016(7) :87−89. (in Chinese) DOI: 10.3969/j.issn.1000-6346.2016.07.026
[7] 何美仙,罗军. 苦瓜枯萎病非化学药剂防治技术研究进展[J]. 安徽农学通报,2013,19(11) :49−51. DOI: 10.3969/j.issn.1007-7731.2013.11.026 HE M X,LUO J. Research progress of non-chemical control technology for bitter gourd Fusarium wilt[J]. Anhui Agricultural Science Bulletin,2013,19(11) :49−51. (in Chinese) DOI: 10.3969/j.issn.1007-7731.2013.11.026
[8] 王炎峰,田叶韩,魏滟洁,等. 生防菌+恶霉灵最优组合的筛选及对苦瓜枯萎病的防治效果研究[J]. 中国蔬菜,2019(7) :67−73. WANG Y F,TIAN Y H,WEI Y J,et al. Screening of optimum combination of biocontrol Bacteria+Hymexazol and studies on its control effect on bitter gourd Fusarium wilt[J]. China Vegetables,2019(7) :67−73. (in Chinese)
[9] 田叶韩. 苦瓜枯萎病关键防控技术的应用与基础研究[D]. 泰安:山东农业大学,2020. TIAN Y H. Basic research and application of key prevention technologies for Fusarium wilt of bitter gourd[D]. Taian:Shandong Agricultural University,2020. (in Chinese)
[10] 林永胜,张玉灿,张武君,等. 苦瓜品种资源对枯萎病的抗性评价[J]. 蔬菜,2017(11) :46−51. DOI: 10.3969/j.issn.1001-8336.2017.11.013 LIN Y S,ZHANG Y C,ZHANG W J,et al. Evaluation of resistance of bitter gourd germplasm resources to Fusarium wilt[J]. Vegetables,2017(11) :46−51. (in Chinese) DOI: 10.3969/j.issn.1001-8336.2017.11.013
[11] 朱军. 遗传学[M]. 4版. 北京:中国农业出版社,2018:280. [12] 郑洁明,李永强,吴元彩,等. 茄子青枯病抗性遗传效应分析[J]. 南方农业学报,2023,54(12) :3502−3513. DOI: 10.3969/j.issn.2095-1191.2023.12.005 ZHENG J M,LI Y Q,WU Y C,et al. Genetic effect of eggplant resistance to bacterial wilt[J]. Journal of Southern Agriculture,2023,54(12) :3502−3513. (in Chinese) DOI: 10.3969/j.issn.2095-1191.2023.12.005
[13] 高银,彭家柱,汪国平,等. 节瓜种子大小的主基因+多基因遗传分析[J]. 广东农业科学,2023,50(4) :51−59. GAO Y,PENG J Z,WANG G P,et al. Genetic analysis on seed size of chieh-qua by mixture model of major genes and polygenes[J]. Guangdong Agricultural Sciences,2023,50(4) :51−59. (in Chinese)
[14] 张宁,刘文超,李毅丰,等. 番茄苗期节间长度的遗传规律分析[J]. 中国果菜,2022,42(3) :62−66,71. ZHANG N,LIU W C,LI Y F,et al. Genetic analysis of internode length in tomato seedlings stage[J]. China Fruit & Vegetable,2022,42(3) :62−66,71. (in Chinese)
[15] 杨辉,沈火林.辣椒抗黄瓜病毒的主基因-多基因混合遗传分析[J].安徽农业科学, 2023,51(13):86-88. YANG H, SHEN H L. Analysis of main gene and polygene mixture heredity in pepper to CMV[J]. Journal of Anhui Agricultural Sciences, 2023,51(13):86-88. (in Chinese)
[16] GAO K,SONG X B,KONG D Y,et al. Genetic analysis of leaf traits in small-flower Chrysanthemum (Chrysanthemum × morifolium Ramat. ) [J]. Agronomy,2020,10(5) :697. DOI: 10.3390/agronomy10050697
[17] 王靖天,张亚雯,杜应雯,等. 数量性状主基因+多基因混合遗传分析R软件包SEA v2.0[J]. 作物学报,2022,48(6) :1416−1424. DOI: 10.3724/SP.J.1006.2022.14088 WANG J T,ZHANG Y W,DU Y W,et al. SEA v2.0:An R software package for mixed major genes plus polygenes inheritance analysis of quantitative traits[J]. Acta Agronomica Sinica,2022,48(6) :1416−1424. (in Chinese) DOI: 10.3724/SP.J.1006.2022.14088
[18] 赵秀娟,唐鑫,胡开林. 苦瓜枯萎病抗性鉴定与抗性遗传规律研究[J]. 园艺学报,2013,40(4) :685−692. ZHAO X J,TANG X,HU K L. Studies on the identification technology and inheritance of disease resistance to Fusarium wilt in bitter gourd[J]. Acta Horticulturae Sinica,2013,40(4) :685−692. (in Chinese)
[19] 刘子记,朱婕,牛玉,等. 苦瓜枯萎病抗性材料Thai4-6的遗传模型分析[J]. 热带作物学报,2018,39(8) :1501−1506. DOI: 10.3969/j.issn.1000-2561.2018.08.005 LIU Z J,ZHU J,NIU Y,et al. Genetic model analysis of wilt resistance in bitter gourd germplasm Thai4-6[J]. Chinese Journal of Tropical Crops,2018,39(8) :1501−1506. (in Chinese) DOI: 10.3969/j.issn.1000-2561.2018.08.005
[20] 琚茜茜,黄如葵,黄熊娟,等. 苦瓜种质枯萎病抗性鉴定与抗性遗传特征分析[J]. 分子植物育种,2024,22(15) :5014−5023. JU X X,HUANG R K,HUANG X J,et al. Germplasm screening and genetic analysis for Fusarium wilt resistance of Momordica charantia L[J]. Molecular Plant Breeding,2024,22(15) :5014−5023. (in Chinese)
[21] 凌怡,杨衍,牛玉,等. 苦瓜枯萎病抗性生理研究及鉴定评价体系构建[J]. 中国瓜菜,2024,37(6) :69−78. LING Y,YANG Y,NIU Y,et al. Resistance physiological study and evaluation system establishment on Fusarium wilt of bitter gourd[J]. China Cucurbits and Vegetables,2024,37(6) :69−78. (in Chinese)
[22] DONG J P,XU J,XU X W,et al. Inheritance and quantitative trait locus mapping of Fusarium wilt resistance in cucumber[J]. Frontiers in Plant Science,2019,10:1425. DOI: 10.3389/fpls.2019.01425
[23] 乐素菊,陈珉,吴定华,等. 黄瓜枯萎病抗性遗传规律研究[J]. 安徽农业大学学报,2014,41(2) :270−272. LE S J,CHEN M,WU D H,et al. Inheritance of resistance to Fusarium wilt in cucumber[J]. Journal of Anhui Agricultural University,2014,41(2) :270−272. (in Chinese)
[24] 刘月,谭阳,邓华凤,等. 水稻稻瘟病抗性鉴定用菌株继代培养遗传变异研究[J]. 杂交水稻,2019,34(2) :53−58. LIU Y,TAN Y,DENG H F,et al. Genetic variation of the strains of Magnaporthe oryzae for identification of rice blast resistance in subculture[J]. Hybrid Rice,2019,34(2) :53−58. (in Chinese)
[25] 周红梅,毛爱军,张丽蓉,等. 黄瓜枯萎病接种方法及抗性遗传的研究[J]. 华北农学报,2010,25(4) :186−190. DOI: 10.7668/hbnxb.2010.04.039 ZHOU H M,MAO A J,ZHANG L R,et al. Research on inoculation method and the inheritance of resistance to Fusarium oxysporum f. sp. cucumerinum on cucumber[J]. Acta Agriculturae Boreali-Sinica,2010,25(4) :186−190. (in Chinese) DOI: 10.7668/hbnxb.2010.04.039
[26] 毛爱军,张峰,张丽蓉,等. 黄瓜品系WIS2757对黄瓜枯萎病生理小种4和黑星病的抗性遗传与连锁分析[J]. 中国农业科学,2008,41(10) :3382−3388. DOI: 10.3864/j.issn.0578-1752.2008.10.062 MAO A J,ZHANG F,ZHANG L R,et al. Analysis on the inheritance of resistance to Fusarium wilt race 4 and cucumber scab and their linkage in cucumber WIS2757[J]. Scientia Agricultura Sinica,2008,41(10) :3382−3388. (in Chinese) DOI: 10.3864/j.issn.0578-1752.2008.10.062
[27] COLLARD B C Y,MACKILL D J. Marker-assisted selection:An approach for precision plant breeding in the twenty-first century[J]. Philosophical Transactions of the Royal Society of London Series B,Biological Sciences,2008,363(1491) :557−572.




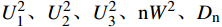
 下载:
下载: