Enzyme Generation and Effect in Composting of Cellulolytic Bacteria
-
摘要:目的
筛选出适用于青海地区纤维素类物质降解的菌株,提高堆肥效果。
方法以青海省海北州森林土壤为样品,采用刚果红染色法和3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid, DNS)法筛选高效纤维素降解菌株,利用生理生化试验和16S rDNA序列分析对菌株进行鉴定,并优化其发酵产纤维素酶条件,制成菌剂后按1%的接种量接种于堆肥试验中,测定堆肥各项腐熟指标。
结果筛选出的高活性降解菌MX-1-1为蕈状芽胞杆菌(Bacillus mycoides),该菌株羧甲基纤维素酶、滤纸酶和外切-β-葡聚糖酶活性分别为24.95、11.36、16.15 U·mL−1。最适产羧甲基纤维素酶发酵条件:氮源牛肉膏、碳源CMC-Na、培养基初始pH 5.0、发酵温度20 ℃、培养时间3 d,优化后羧甲基纤维素酶活力提高了51.5%。堆肥过程中,添加MX-1-1菌剂的堆体升温快,高温期持续时间长,pH波动幅度小。堆肥结束时,堆体电导率为0.96 ms·cm−1,含水量最低,硝态氮和铵态氮含量均达腐熟标准,全氮和有机质含量优于未添加菌剂堆体和D50菌剂堆体。
结论菌株MX-1-1具有较强的纤维素降解能力,能够促进堆体微生物代谢,加快堆体腐熟,并提高堆肥品质。
Abstract:ObjectiveMicrobes capable of degrading cellulose in compost and suitable for application in Qinghai-Tibet Plateau region were tested, and fermentation conditions to maximize the enzyme generation optimized.
MethodSoil samples were collected at the forests in Haibei Prefecture, Qinghai Province. Cellulolytic bacteria were isolated by the Congo red staining and 3,5- Dinitrosalicylic acid (DNS) methods. Highly efficient cellulose-degrading strains were identified by physiochemical tests and 16S rDNA sequencing. Conditions to effectively generate cellulase by the bacteria were optimized. Extracts of the enzymes produced from the fermentation were diluted to 1% and added to compost with cellulolytic process and compositing conditions monitored.
ResultThe isolated MX-1-1, which was subsequently identified as a strain of Bacillus mycoides, displayed the greatest degradation activities on carboxymethyl cellulose, filter paper, and exo-β-glucanose at 24.95, 11.36, and 16.15 U·mL−1, respectively. In generating carboxymethyl cellulase, the fermentation that increased 51.5% in activity over control employed beef paste for nitrogen and CMC-Na for carbon in a medium of an initial pH of 5.0 at 20 ℃ for 3 d. With the addition of MX-1-1 extract, the compost rose rapidly to a lasting high temperature with relatively stable pHs. At the end of fermentation, the compost showed a conductivity of 0.96 ms·cm−1 with the moisture content at its lowest level, the nitrate and ammonium nitrogen at the matured decomposition level, and the total nitrogen and organic matter higher than those in asepsis or D50 compost.
ConclusionMX-1-1, a strain of Bacillus mycoides, was found highly cellulolytic. By adding it for composting farm waste, the metabolic activity was significantly enhanced to hasten the cellulose decomposition.
-
Keywords:
- cellulolytic bacteria /
- cellulase /
- optimized enzyme generation /
- compost
-
0. 引言
【研究意义】纤维素类生物质,如农业废弃秸秆和牛羊粪,是目前常用的生物质肥料[1],这些生物质富含纤维素,自然条件下降解时间长,不利于快速提升土壤肥力[2],尤其在青藏高原高寒地区低温持续时间长,造成堆肥效率低,腐熟不彻底,导致堆渣病原菌和虫害残留,阻碍幼苗扎根和病虫害蔓延,严重影响作物生长[3−4]。在堆肥过程中,添加微生物菌剂降解纤维素类物质具有易处理、成本低和适用范围广等特点[3],已成为国内外广泛提倡的处理方式。【前人研究进展】筛选高效纤维素降解菌株是微生物堆肥的基础,现已发现具有降解纤维素的微生物种类繁多,主要包括细菌中的布鲁氏菌属(Brucella)[5]、类芽孢杆菌属(Paenibacillus)[6]、芽孢杆菌属(Bacillus)[7]、 微杆菌属(Microbacterium)[8]、根瘤菌属(Rhizobium)[9]、代尔夫特菌属(Delftia)等[10];放线菌中的红球菌属(Rhodococcus)[11] 和内氏放线菌(Actinomyces naeslundii)[12];真菌中的木霉属(Trichoderma)[13]、交链孢霉属(Alternaria sp.)、枝孢属(Cladosporium)[14]和根霉属(Rhizopus)[15]等。细菌具有生长速度快,产酶周期短的优势,成为研究产纤维素酶的首选。放线菌能分泌胞外代谢酶,且对逆境环境具备稳定抗性,但产酶能力弱,繁殖周期长,更适合筛选具备抗性代谢物的菌株[16]。真菌能够分泌大量纤维素酶,然而真菌基因工程改造难和培养周期长的问题,阻碍了产生纤维素酶真菌的实际应用[16]。纤维素降解菌在堆肥过程中往往会出现产酶能力降低情况,说明纤维素降解菌降解能力不仅与菌株本身产代谢酶活力有关,还受产酶培养条件(碳氮源、培养温度、pH值和发酵时间)影响[9]。通过优化降解菌株的培养条件可以有效提高菌株产酶活性,促进秸秆堆肥效率。【本研究切入点】目前,微生物菌剂已广泛应用于青海地区各种纤维素类物质的堆肥过程中,但绝大部分微生物菌剂为购买的商业菌剂。由于地域差异性和气候因素影响,使得商业菌剂中所包含微生物的功能活性受到抑制[17]。且现有的市售微生物菌剂中,能适应青海地区高寒环境的菌剂较少[18]。因此,只有从青海地区原地微生物群落中筛选纤维素降解菌,制备适宜在青海地区使用的微生物菌剂,才能达到高效降解纤维素类物质的目的。青海地处青藏高原东北部,低温、干旱、高海拔、高辐射等独特的自然环境和气候特征孕育出独特的微生物群落[19],这为筛选高效纤维素降解菌提供了丰富的菌种资源,分离菌株能在高寒条件下具有稳定产酶活力,可提高纤维素资源的堆肥效率,还可应用于土壤肥力的调节和生态系统的修复。【拟解决的关键问题】从青海森林土样中筛选具备产纤维素酶能力的菌株,优化菌株产羧甲基纤维素酶的培养条件,并测定菌株堆肥腐熟效果,以期为开发优质纤维素降解菌的菌株资源奠定基础,同时也为高寒地区纤维素类物质合理资源化利用提供实践参考。
1. 材料与方法
1.1 试验材料
1.1.1 样品采集
2021年6月,采集于青海省海北州门源县仙米农场(37°15′35″N, 102°58′13″E,海拔
2730 m)森林表层土样,过40目筛,于4 ℃冰箱保存,备用。1.1.2 培养基
富集培养基:牛肉膏3.0 g,蛋白胨8.0 g,KH2PO4 2.0 g,NaCl 5.0 g,MgSO4 0.5 g,FeSO4·7H2O 0.01 g,pH 7.0,蒸馏水
1000 mL。CMC功能培养基:羧甲基纤维素钠(CMC-Na)10.0 g, NaNO3 1.0 g,蛋白胨1.5 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4·7H2O 0.01 g,FeSO4·7H2O 0.01 g,琼脂20.0 g,蒸馏水
1000 mL。产纤维素酶培养液:CMC-Na 20.0 g,(NH4)2SO4 5.0 g,KH2PO4 2.0 g,FeSO4·7H2O 0.01 g,CaCl2 0.5 g,NaCl 5.0 g,蒸馏水
1000 mL。各培养基121 ℃、101 kPa灭菌30 min,备用。
1.1.3 堆肥原料
堆肥主要原料猪粪和秸秆分别由青海泰和苑生物有限公司和互助昱青投资开发公司提供,混合均匀后添加2%麻渣和0.1%麸皮。普通复合菌剂D50购自金远洋生物科技有限公司,是一种兼具好氧和厌氧微生物群落的复合菌剂,有效菌种包括巨大芽孢杆菌、嗜酸乳杆菌、嗜冷杆菌、黄杆菌,产品形态为粉剂,有效活菌数2.0亿·g−1,是一类主要应用于秸秆有机堆肥的复合微生物菌剂[20]。
1.2 纤维素降解菌的分离与初筛
称取混合均匀土样10 g,装入含90 mL无菌水的三角瓶中,180 r·min−1振荡2 h,进行梯度稀释,吸取不同梯度稀释液100 μL涂布至LB固体培养基,每一梯度设置3个重复,25 ℃培养4 d。挑取单菌落进行纯化,保存于−80 ℃冰箱备用。
将分离菌株接种于CMC-Na培养基中央,25 ℃恒温培养4 d。使用0.2 mg·mL−1的刚果红溶液染色20 min,再用无菌水脱色15 min[10]。分别测量透明圈直径(D,mm)与菌落直径(d,mm),通过降解指数(D/d值)大小比较菌株降解纤维素能力的强弱,比值越大说明降解纤维素能力越强。
1.3 纤维素降解菌的复筛
初筛分离降解菌接种至富集培养液中,25 ℃、180 r·min−1振荡培养2 d。取10%富集培养液转接至产酶培养基中,25 ℃、180 r·min−1培养4 d,
12000 ×g离心后取上清液作为粗酶液,采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid, DNS)法[14]分别测定菌株产羧甲基纤维素酶、滤纸酶和外切-β-葡聚糖酶活力。羧甲基纤维素酶(Carboxymethyl Cellulosease)的测定:取1 mL粗酶液,加入1 mL含1% CMC-Na的无菌水中(pH 4.5),于50 ℃水浴锅中反应60 min,加入1 mL DNS试剂终止反应,沸水浴10 min,冷却至室温后,定容至10 mL,测定540 nm处的光度值,以灭活粗酶液作为空白对照,计算羧甲基纤维素酶活力。以1 min催化底物生成1 µmol的葡萄糖为一个酶活力(U),以U·mL−1表示。
滤纸酶活性(Filter Paper Activity)的测定:取1 mL粗酶液和0.1 g经打孔准备好的滤纸片,加至含1 mL无菌水的试管中,于50 ℃水浴锅反应60 min,最后加入1 mL DNS试剂,终止反应后的处理与羧甲基纤维素酶测定方式相同。
外切-β-葡聚糖酶(Exoglucanase)的测定:取1 mL粗酶液至装有1 mL 微晶纤维素溶液的试管中,于50 ℃水浴锅反应60 min,加入1 mL DNS试剂,终止反应后的处理与羧甲基纤维素酶测定方式相同。
1.4 菌种鉴定
菌株生理生化鉴定:将分离纯化后菌株接种至LB培养基,25 ℃恒温培养72 h后,观察菌体形态特征。采用生化反应试管进行生理生化测定,测试项目包括革兰氏染色、过氧化氢酶、葡萄糖分解、甲基红试验、V-P试验、明胶液化、H2S试验、柠檬酸盐试验和淀粉水解试验等8项指标[21]。
分子生物学鉴定:采用天根生化科技(北京)有限公司细菌基因组DNA抽提试剂盒,按试剂盒使用说明书,提取菌株MX-1-1基因组16S rDNA,利用细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)对其进行扩增。扩增体系:DNA模板1 μL,10 mol·L−1上下游引物各0.5 μL,Mix酶12.5 μL,ddH2O补足至25 μL。反应程序:95 ℃预变性4 min,95 ℃变性1 min,55 ℃退火40 s,72 ℃延伸2 min,循环25次,72 ℃ 后延伸7 min,4 ℃保存。扩增得到的PCR产物用1% 琼脂糖凝胶电泳检测主条带位置和浓度,利用GeneTools Analysis Software version 4.03.05.0(SynGene公司)对PCR产物进行浓度对比后,使用E.Z.N.A.® Gel Extraction Kit(Omega Bio-Tek公司)凝胶回收试剂盒回收PCR产物,TE缓冲液洗脱回收目标DNA片段。并送往生工生物工程(上海)股份有限公司进行测序。将测得的序列在NCBI上进行比对,使用MEGA 7.0软件基于邻接法(neighbor joining method)进行系统发育分析,构建系统发育树,以获得菌株的分类信息。
1.5 菌株产酶条件优化
羧甲基纤维素酶作用于纤维素类生物质的β-1,4-糖苷键,将长链纤维素分解为较小的纤维素,在水解纤维素的过程中有着重要作用,是目前被研究的最多的纤维素酶之一[22]。因此本研究选用羧甲基纤维素酶活进行发酵产酶条件优化。在产酶培养基[CMC-Na 20.0 g,(NH4)2SO4 5.0 g,KH2PO4 2.0 g,FeSO4·7H2O 0.01 g,CaCl2 0.5 g,NaCl 5.0 g]的基础上做以下优化。
(1)碳氮源对纤维素酶活的影响。选取4种不同碳源(CMC-Na、可溶性淀粉、油菜秸秆和蔗糖)和4种不同氮源[NH4Cl、 (NH4)2SO4、牛肉膏和蛋白胨]。将种子液以4%(m/V)的接种量接至含150 mL不同碳(氮)源的液体培养基中,25 ℃、180 r·min−1培养4 d,确定菌株产羧甲基纤维素酶的最佳碳氮源,同时测定不同处理的菌株浓度。每个处理设置3个重复。
(2)培养温度对纤维素酶活的影响。将种子液以4%(m/V)的接种量接种至最适碳氮源培养基中,分别在15、20、25、30、35 ℃温度下,180 r·min−1培养4 d,确定最适产羧甲基纤维素酶温度,同时测定不同处理的菌株浓度。每个处理3个重复。
(3)初始pH对纤维素酶活的影响。调节产酶培养基初始pH为3、4、5、6、7和8,将种子液以4%(m/V)的接种量接种至最适碳氮源培养基中,最适培养温度下,180 r·min−1培养4 d,测定羧甲基纤维素酶活力,同时测定不同处理的菌株浓度。每个处理设置3个重复。
(4)发酵时间对纤维素酶活的影响。将种子液以4%(m/V)的接种量接种至最适碳氮源培养基中,25 ℃,180 r·min−1培养,每隔1 d测定羧甲基纤维素酶活力,同时测定不同处理的菌株浓度。每个处理设置3个重复。
1.6 堆肥试验
1.6.1 试验设计
MX-1-1菌剂:将高效纤维素降解菌MX-1-1接种于优化后的产酶培养基,25 ℃、180 r·min−1培养4 d,调整菌液浓度至1×108 CFU·mL−1;D50菌剂:按照产品说明对D50商业菌剂稀释70倍;对照:不添加菌剂。
堆肥试验:MX-1-1菌剂堆体(1%的MX-1-1菌液)、D50菌剂堆体(1%的稀释商业菌液)和对照堆体(无菌水)3个处理,每个处理3个重复。堆肥选用猪粪和秸秆混合,调节C/N= 23∶1,含水量控制在60%左右,建成长、宽、高分别为1.8 m、1.5 m、0.6 m的堆体,各处理堆体均用塑料覆盖保湿保温。
1.6.2 取样及测定
采用五点取样法分别在堆体表面和内部取样,每样点取500 g样品,混合后−20 ℃保存。自制堆开始,1、3、7、14、21、28、35、42 d分别取样。
测定指标:自制堆24 h后每天测定堆体温度2次(上午10:00,下午16:00);称取5 g保存样品,采用pH计(雷磁,PHSJ-4F)和电导仪(雷磁,DDS-307A)测定样品pH和电导率(Electric conductivity);通过称重法测定样品含水量[23];样品总氮选用凯氏定氮法测定[24],有机质采用重铬酸钾容量法测定[25];样品铵态氮和硝态氮使用流动分析仪测定[26]。
2. 结果与分析
2.1 菌株初筛
从采集的森林土样中共分离纯化出35株细菌,通过刚果红染色法从中筛选出4株出现水解圈的菌株(表1),菌株MX-1-1、H37-7-4、AH-3-1和GX-2-2的水解圈D/d值均大于1。其中菌株MX-1-1菌落直径为(5.97±0.23) mm,水解圈直径为(16.83±0.27) mm,D/d值为2.81(图1),远高于其他菌株,表明MX-1-1菌株可能是1株高产纤维素酶的降解细菌。
表 1 初筛菌株在刚果红培养基上透明圈大小Table 1. Sizes of transparent rings formed on Congo red medium by preliminarily screened strains菌株Strains 菌落直径d/mm 透明圈直径D/mm 降解指数D/d MX-1-1 5.97±0.23 16.83±0.27 2.81 H37-7-4 8.67±0.20 14.54±0.20 1.68 AH-3-1 4.14±0.05 6.43±0.13 1.55 GX-2-2 11.67±0.03 23.51±0.18 2.01 2.2 菌株复筛
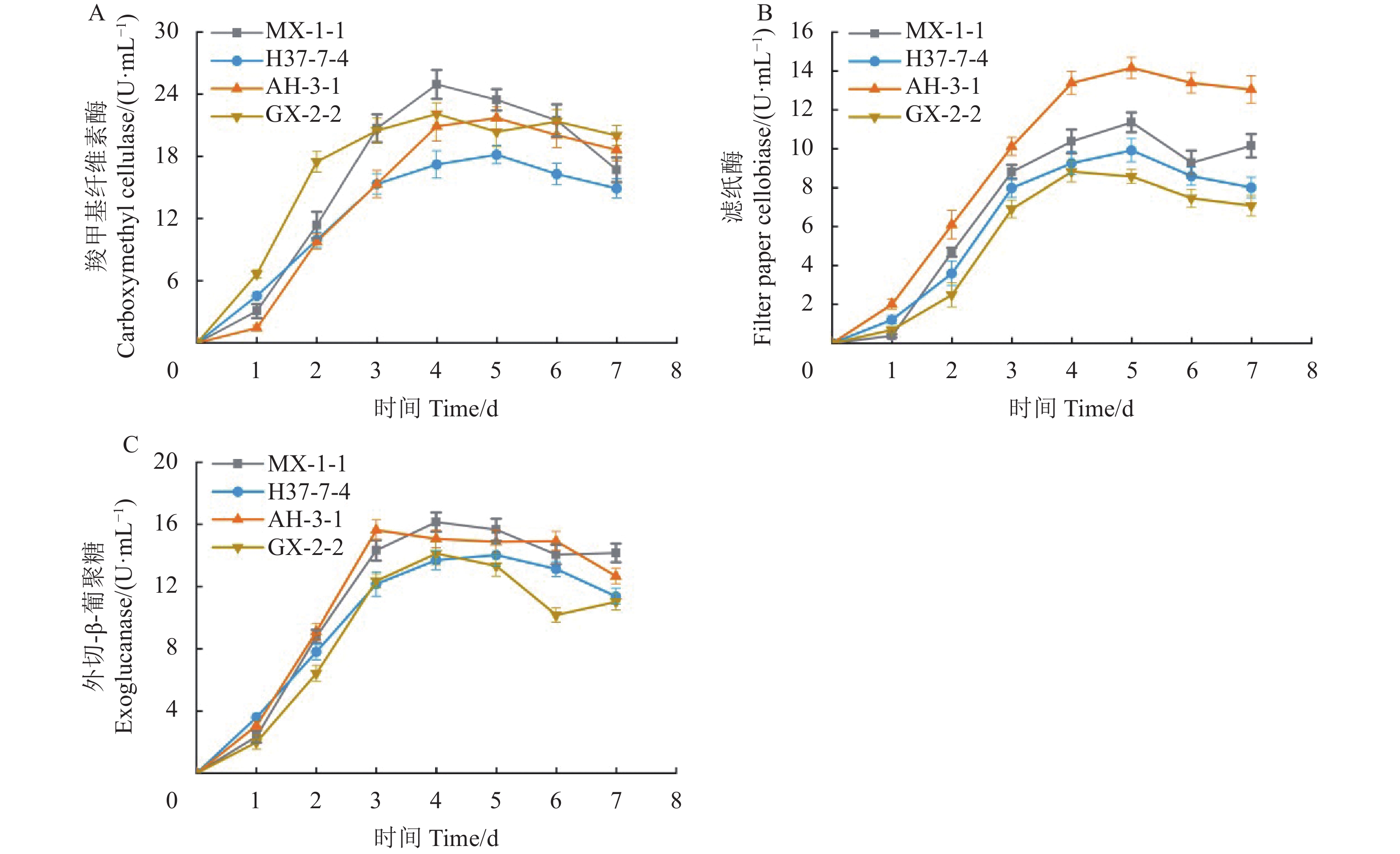
4株初筛菌株的羧甲基纤维素酶活测定结果如图2A,菌株MX-1-1和GX-2-2的羧甲基酶活最高值出现在4 d,分别为24.95 U·mL−1和22.09 U·mL−1,菌株H37-7-4和AH-3-1在培养5 d时达最大值,分别为18.16、21.69 U·mL−1。菌株MX-1-1、H37-7-4和AH-3-1的滤纸酶活最高值出现在5 d(图2B),分别为11.38 、9.92 、14.16 U·mL−1,菌株GX-2-2在4 d时滤纸酶活最高,为8.82 U·mL−1。菌株MX-1-1和GX-2-2的外切-β-葡聚糖酶活最高值出现在4 d,分别为16.15、14.12 U·mL−1,菌株H37-7-4在5 d外切-β-葡聚糖酶活达最高,为14.03 U·mL−1,菌株AH-3-1在3 d外切-β-葡聚糖酶活达最高,为15.63 U·mL−1(图2C)。综合比较,菌株MX-1-1的3类纤维素降解酶活高效稳定,优于其他菌株,具有开发为微生物菌剂的潜力。
2.3 菌株MX-1-1的鉴定
2.3.1 菌株MX-1-1生理生化特性
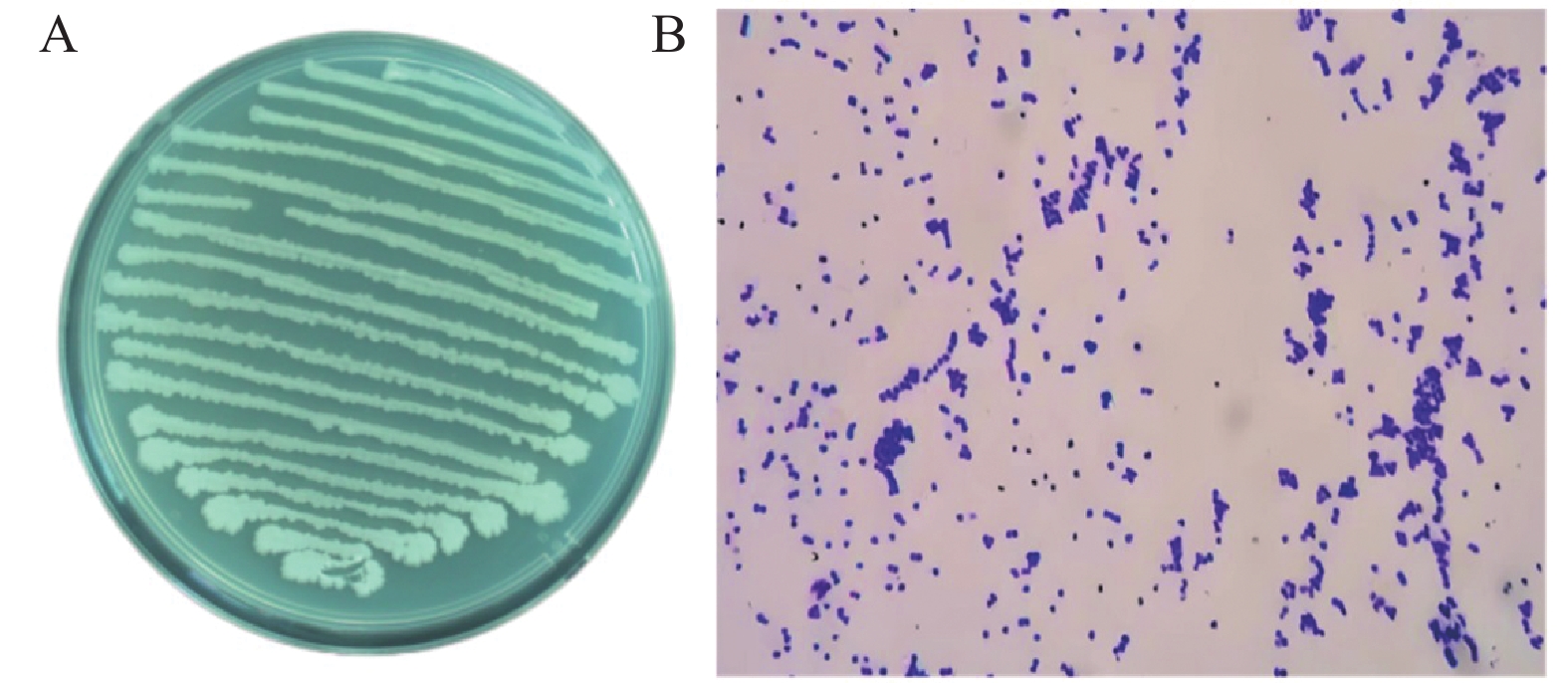
在LB固体培养基上,观察菌株MX-1-1菌落呈乳白色杆状,不透明,表面不光滑,边缘不圆整,且中部稍有隆起(图3A)。革兰氏染色为紫色,说明菌株MX-1-1为一株阳性菌(图3B)。生理生化测定结果显示(表2),MX-1-1菌株不能产生H2S;能分解葡萄糖和淀粉;加入甲基红试剂后溶液呈黄色为阴性;VP试验溶液呈红色为阳性;明胶液化试验为阳性;柠檬酸盐试验为阴性。
表 2 菌株MX-1-1的生理生化特征分析Table 2. Physiochemical characteristics of MX-1-1测试项目
Test project结果
Result测试项目
Test project结果
Result过氧化氢酶
Catalase− 明胶液化
Gelatin liquefaction+ 葡萄糖分解
Glucose decomposition+ H2S试验
H2S test− 甲基红试验
Methyl red test− 柠檬酸盐试验
Citrate test− VP试验
Voges-Proskauer test+ 淀粉水解
Amylohydrolysis+ +:阳性;−:阴性。
+: Positive; −: Negative.2.3.2 菌株MX-1-1分子生物学鉴定
对菌株MX-1-1进行PCR扩增,获得的16S rDNA片段长度为
1486 bp,利用BLAST进行序列比对分析,结果表明,菌株MX-1-1与蕈状芽胞杆菌(Bacillus mycoides)的序列相似性在99%以上。结合系统发育进化树分析结果(图4),将菌株MX-1-1鉴定为蕈状芽胞杆菌(B. mycoides)。2.4 菌株MX-1-1产酶条件优化
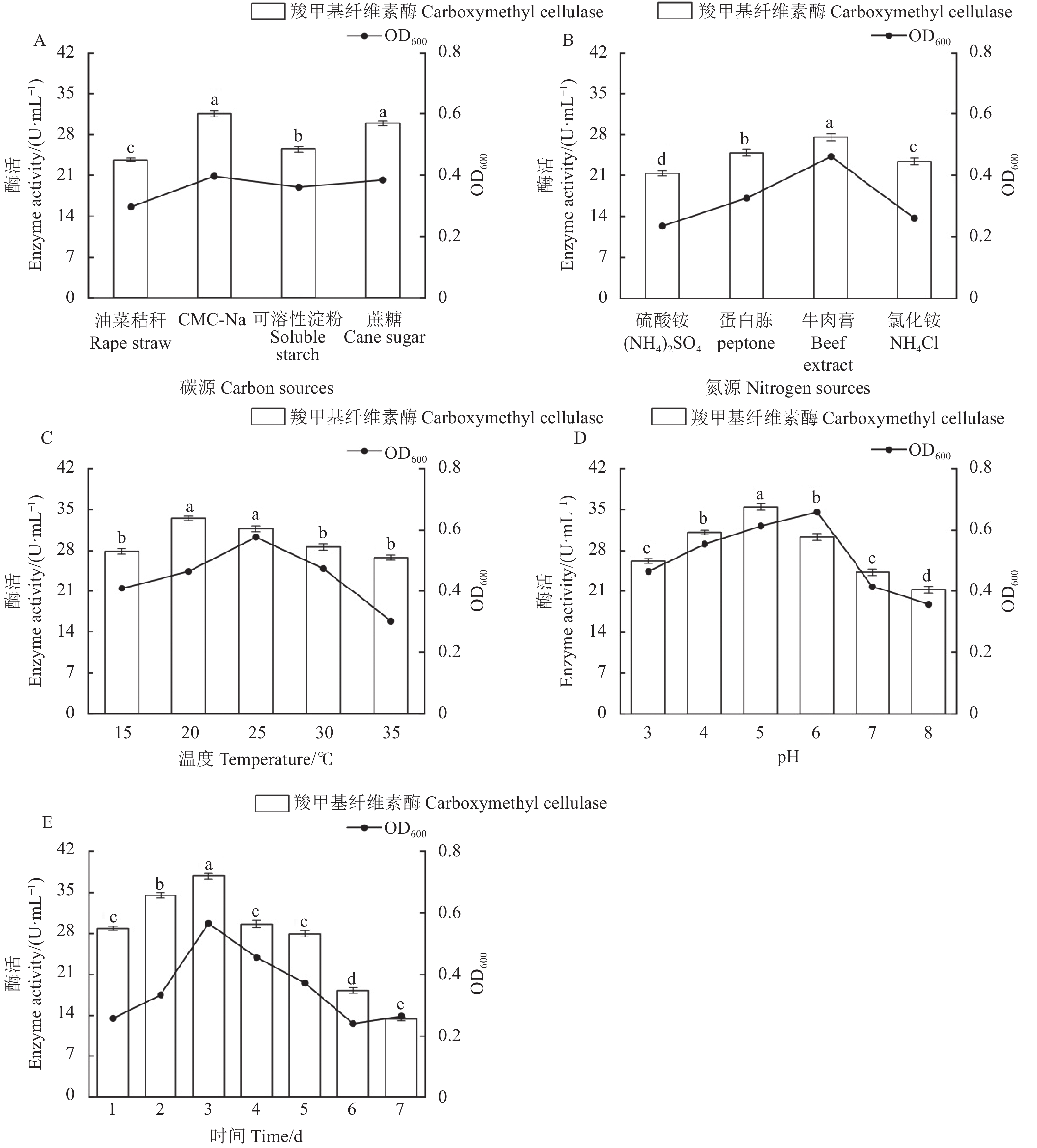
当碳源为CMC和蔗糖时(图5A),羧甲基纤维素酶的活性较高,分别为31.50、29.86 U·mL−1,显著高于其他两种碳源的酶活。其中,以CMC-Na作为碳源时,菌株的OD600最高,达0.396。因此,菌株MX-1-1的最适碳源为CMC-Na。
![]() 图 5 菌株MX-1-1的产酶条件优化(A):不同碳源;(B):不同氮源;(C):不同温度;(D):不同pH;(E):不同时间。不同小写字母代表各处理组间差异显著(P<0.05),下同。Figure 5. Optimized enzyme production by MX-1-1(A): different carbon sources; (B): different nitrogen sources; (C): different temperatures; (D): different pH; (E): different time. Data with different lowercase letters represent significant differences between treatment groups (P<0.05). Same for below.
图 5 菌株MX-1-1的产酶条件优化(A):不同碳源;(B):不同氮源;(C):不同温度;(D):不同pH;(E):不同时间。不同小写字母代表各处理组间差异显著(P<0.05),下同。Figure 5. Optimized enzyme production by MX-1-1(A): different carbon sources; (B): different nitrogen sources; (C): different temperatures; (D): different pH; (E): different time. Data with different lowercase letters represent significant differences between treatment groups (P<0.05). Same for below.用牛肉膏作氮源时(图5B),羧甲基纤维素酶活性最高,为27.50 U·mL−1,且菌株的OD600为0.461,显著高于其他氮源的酶活。因此,菌株MX-1-1的最适氮源为牛肉膏。
菌株MX-1-1的培养温度在15~35 ℃时,羧甲基纤维素酶均保持一定活力(图5C),当温度为20 ℃时,纤维素酶活力达最高,为33.51 U·mL−1。当35 ℃时酶活力为26.80 U·mL−1。表明20 ℃为最适产酶温度。且20 ℃时,菌株OD600值保持在较高活性,为0.467。
菌株MX-1-1在初始培养pH为3~8时,纤维素酶活力随着pH升高呈先升高后下降的趋势(图5D)。当pH为5的时候,纤维素酶活力达最高,为35.45 U·mL−1。当pH值大于5后,纤维素酶活力开始受到抑制,不断下降。且OD600值在pH 6时达最大值,为0.659。表明该菌株是1株耐酸性的菌株,可用于酸性环境下纤维素的降解。
菌株MX-1-1在培养的1~3 d,羧甲基纤维素酶活性处于较高水平(图5E)。在3 d,菌株的纤维素酶活性达最高,为37.80 U·mL−1。3 d后,纤维素酶活性逐渐降低,6 d时达最低值,为13.44 U·mL−1。菌株MX-1-1的OD600变化趋势与酶活性一致,3 d时OD600达最高,为0.566,之后随培养天数逐渐下降。
2.5 堆体的理化指标变化
2.5.1 添加菌剂后堆体温度的变化
MX-1-1菌剂堆体温度在2 d时达55.61 ℃(图6A),提前进入高温期,高于D50菌剂堆体温度(51.22 ℃)和对照堆体温度(48.9 ℃)。对照、MX-1-1菌剂和D50菌剂堆体维持50 ℃以上(高温期)的时间段分别为24、28、32 d。之后对照堆体从36 d开始降温到50 ℃以下(降温期),MX-1-1菌剂堆体和D50菌剂堆体从40 d开始降温。说明MX-1-1菌剂堆体升温快,进入高温期时间早,且维持时间久,加快了腐熟进程。
![]() 图 6 堆体理化指标(A):堆体温度的变化;(B):堆体pH的测定;(C):堆体电导率的变化;(D):堆体含水量的变化;(E):堆体铵态氮含量的测定;(F):堆体硝态氮含量的测定。Figure 6. Physiochemical indexes of compost(A): Changes in compost temperature; (B): compost pH; (C): variations in compost electrical conductivity; (D): fluctuations in water content of compost; (E): ammonium nitrogen content in compost; (F): nitrate nitrogen content in compost.
图 6 堆体理化指标(A):堆体温度的变化;(B):堆体pH的测定;(C):堆体电导率的变化;(D):堆体含水量的变化;(E):堆体铵态氮含量的测定;(F):堆体硝态氮含量的测定。Figure 6. Physiochemical indexes of compost(A): Changes in compost temperature; (B): compost pH; (C): variations in compost electrical conductivity; (D): fluctuations in water content of compost; (E): ammonium nitrogen content in compost; (F): nitrate nitrogen content in compost.2.5.2 pH的变化
在整个堆肥过程中,对照、MX-1-1菌剂和D50菌剂堆体pH维持在7.0~8.0的微碱环境,是微生物活动的适宜范围。MX-1-1菌剂堆体pH波动幅度较大,且升降时间早于对照和D50菌剂堆体。说明添加MX-1-1菌剂能促进堆体微生物代谢活动,产生大量次级产物,从而改变了堆体理化性质。
2.5.3 电导率(EC)的变化
一般堆肥EC值小于4.0 ms·cm−1时,对作物无毒害作用。图6C结果表明,3个处理堆体EC值呈现缓慢上升的趋势。直至堆肥结束,对照、MX-1-1菌剂和D50菌剂堆体的EC最大值分别为1.07、0.97、0.96 ms·cm−1,远小于4.0 ms·cm−1,说明腐熟堆肥对作物安全。
2.5.4 含水率的变化
3个处理堆体在升温阶段含水量快速下降,直到降温腐熟阶段含水量趋于平缓(图6D),前期由于微生物代谢活动剧烈,温度升高导致水分散失较快,到腐熟后期堆体内有机物氧化腐熟成稳定的腐殖质,微生物代谢活动减少温度降低,水分保持稳定。到50 d时,对照组、MX-1-1菌剂和D50菌剂堆体含水量分别为27.93%、22.68%和24.79%,MX-1-1菌剂堆体含水量最低,说明添加MX-1-1菌剂能促进堆体腐熟程度。
2.5.5 铵态氮含量的变化
对照和D50菌剂堆体铵态氮含量呈现逐渐降低的趋势,而MX-1-1菌剂堆体先升高后降低(图6E),在堆肥初始阶段,添加MX-1-1菌剂使堆体微生物代谢活动增强,促进铵态氮的产生,此后随着铵态氮的挥发和转化,含量逐渐减少。到堆体降温阶段,试验菌剂堆体铵态氮含量为41.40 mg·kg−1,低于对照组(49.35 mg·kg−1)和D50菌剂堆体(43.39 mg·kg−1)。表明添加MX-1-1菌剂提高了铵态氮的降解效率。
2.5.6 硝态氮含量的变化
对照、MX-1-1菌剂和D50菌剂堆体硝态氮含量呈现先升后降再升高的变化趋势(图6F)。堆肥初期,由于堆体含水量高,温度低,通气状况差,抑制了有机氮的硝化作用,所以硝态氮含量上升缓慢。进入高温期,温度持续升高以及含水量降低,硝化作用不断增强,硝态氮含量快速升高。到降温期,硝化作用减弱,硝态氮含量也不断降低。降温后期,大量铵态氮转化为硝态氮,硝态氮含量呈现有略微上升趋势。添加MX-1-1菌剂后,微生物代谢活动旺盛,堆体升温快、失水明显,为硝化反应提供良好环境条件,因此硝态氮含量升高明显,进而提高了有机氮降解效率。
2.5.7 堆肥养分含量的变化
对照、MX-1-1菌剂和D50菌剂堆体的全氮含量都有明显提升(表3),其中MX-1-1菌剂堆体全氮含量的增加率为8.06%,显著高于对照组(1.37%)和D50菌剂(3.08%),说明添加MX-1-1菌剂,增加堆体硝化作用,保证氮素的积累,提高了堆肥品质。
表 3 堆肥养分含量Table 3. Nutrients in compost处理
Treatment全氮 Total nitrogen 有机质 Organic matter 发酵前 Before fermentation/% 发酵后 After fermentation/% 增加率 Rate of increase/% 发酵前 Before fermentation/% 发酵后 After fermentation/% 增加率 Rate of increase/% CK 1.46 ±0.05 b 1.48 ±0.10 b 1.37 ±0.08 c 43.30 ±0.01 b 38.98 ±0.15 b −9.98 ±0.06 c MX-1-1菌剂
MX-1-1 bacteria agent1.24 ±0.13 c 1.34 ±0.05 c 8.06 ±0.04 a 43.26 ±0.11 b 42.14 ±0.04 a −2.81 ±0.08 a D50菌剂
D50 bacteria agent1.95 ±0.06 a 2.01 ±0.11 a 3.08 ±0.02 b 45.28 ±0.06 a 43.04 ±0.08 a −4.95 ±0.02 b 表中数据为平均值±标准差;同列数据后不同的小写字母表示0.05水平上差异显著。
Data are mean±SD; those with different lowercase letters on same column indicate significant difference at 0.05 level.有机质测定结果(表3)表明,堆肥过程中不同堆体的有机质含量均有不同程度的损失,但MX-1-1菌剂堆体的损失率(2.81%)显著低于对照堆体(4.95%)和D50菌剂堆体的损失率(9.98%)。
3. 讨论与结论
目前从青藏高原地区已分离到产纤维素酶的菌有耐冷菌或耐盐菌,如青霉菌、曲霉菌、芽胞杆菌、枝孢菌、盐单胞菌等[27-29]。其中芽孢杆菌具备强大的环境适应能力,生长pH和温度范围广,能分解多种底物且产酶活性高,是降解纤维素的优选菌株。陈欢等[30]从牛瘤胃液和粪便,蝗虫肠道等不同来源分离到6株可降解纤维素的芽孢杆菌,其中菌株Bacillus altitudinis L7降解纤维素的能力最强,其产羧甲基纤维素酶活、滤纸酶活和外切-β-葡聚糖酶活分别为5.57、2.48、2.30 U·mL−1。李婷等[31]从园林堆积废弃物残渣中分离筛选出的6株纤维素降解菌,其中有4株为芽孢杆菌,产羧甲基纤维素酶活在16.45~22.45 U·mL−1,产外切-β-葡聚糖酶活在2.9~6.2 U·mL−1。本研究筛得的菌株MX-1-1为1株蕈状芽胞杆菌(Bacillus mycoides),其羧甲基纤维素酶活、滤纸酶活和外切-β-葡聚糖酶活分别为24.95、11.36、16.15 U·mL−1,产酶活性均优于上述两个报道的菌株。
野生菌株在实际应用中,产纤维素水解酶的能力通常都很低,通过优化培养条件可提高菌株产酶活性[32]。本研究中菌株MX-1-1经过优化后羧甲基纤维素酶活提升了51.5%,这一结果与张梦君等[33]报道相近。微生物降解纤维素的过程中受多种培养条件的影响,如碳氮源、酸碱度、温度和时间。碳源的结构和性质对菌株产纤维素酶能力强弱有决定作用,氮源的类型和浓度是促进菌株产酶的重要营养物质。因此,优化培养基的碳氮源尤为重要。本研究结果显示,最适碳氮源分别为羧甲基纤维素钠和牛肉膏,且有机氮比无机氮更适合应用于培养纤维素降解菌,这一结果与前人报道[34−35]一致。李豪等[36]优化了菌株C-19产酶的最适培养温度和pH,发现最适温度为40 ℃,最适pH为5.0,表明C-19是1株耐酸耐高温的纤维素降解菌。本研究中MX-1-1菌株在15~35 ℃均具有较高酶活,说明该菌株能应用于昼夜温差大的青海地区。
微生物参与堆肥过程中基质有机物的分解,加快堆体的腐熟程度。堆肥高温期是有机物分解的关键时期,可通过高温期时间的长短判断堆肥的腐熟程度。本研究中,MX-1-1菌剂处理堆体的高温期持续时间为28 d,优于对照组(24 d),这与杨波等[37]研究结果相同,说明添加MX-1-1菌剂能提升堆肥腐熟程度。魏自民等[38]认为,大量小分子有机酸主要存在于未腐熟的堆肥中,导致堆体酸度升高,可以利用堆肥pH变化判断堆肥的腐熟度。电导率(EC)可以反映出堆肥中可溶性盐浓度的大小,堆肥中EC值过高会抑制植物的生长。邵栓等[39]研究发现,控制堆体初始含水率为50%时,无害化效果最好,当含水率过高时,堆肥将有有氧转变为厌氧发酵,产生大量发臭中间产物(硫化氢、硫醇、氨等),严重影响堆肥质量。在本研究整个堆肥过程中,不同处理堆体pH维持在7.0~ 8.0的微碱环境,有利于微生物代谢;电导率均远低于4.0 ms·cm−1,达到了有机肥生产及施用的标准;MX-1-1菌剂堆体最终含水率最低,腐熟程度优于对照和D50菌剂堆体。堆肥过程中氮的形态包括总氮、有机氮、铵态氮和硝态氮,添加微生物菌剂可有效减少堆肥肥料氮的损失[33]。MX-1-1菌剂堆体总氮含量显著高于对照和D50菌剂堆体,说明添加MX-1-1菌剂减少了有机氮的损失,同时有机质的损失量也最低,保证了堆肥的质量和品质。
本研究从森林土样中分离筛选得到的菌株MX-1-1是1株蕈状芽胞杆菌(B. mycoides),其产羧甲基纤维素酶、滤纸酶和外切-β-葡聚糖酶的活力较高。通过产酶条件优化,菌株MX-1-1产羧甲基纤维素酶的最适氮源为牛肉膏,最适碳源为CMC-Na,最适培养条件为pH 5.0、温度20 ℃,培养3 d时产羧甲基纤维素酶活力最高,比优化前提高了51.5%。另外,添加MX-1-1菌剂后堆体腐熟程度高,堆肥质量和品质显著优于对照和D50菌剂。因此,菌株MX-1-1可作为青海地区秸秆堆肥的优良菌株。本研究可为青海地区应用微生物降解秸秆提供菌种资源和理论依据。
-
图 5 菌株MX-1-1的产酶条件优化
(A):不同碳源;(B):不同氮源;(C):不同温度;(D):不同pH;(E):不同时间。不同小写字母代表各处理组间差异显著(P<0.05),下同。
Figure 5. Optimized enzyme production by MX-1-1
(A): different carbon sources; (B): different nitrogen sources; (C): different temperatures; (D): different pH; (E): different time. Data with different lowercase letters represent significant differences between treatment groups (P<0.05). Same for below.
图 6 堆体理化指标
(A):堆体温度的变化;(B):堆体pH的测定;(C):堆体电导率的变化;(D):堆体含水量的变化;(E):堆体铵态氮含量的测定;(F):堆体硝态氮含量的测定。
Figure 6. Physiochemical indexes of compost
(A): Changes in compost temperature; (B): compost pH; (C): variations in compost electrical conductivity; (D): fluctuations in water content of compost; (E): ammonium nitrogen content in compost; (F): nitrate nitrogen content in compost.
表 1 初筛菌株在刚果红培养基上透明圈大小
Table 1 Sizes of transparent rings formed on Congo red medium by preliminarily screened strains
菌株Strains 菌落直径d/mm 透明圈直径D/mm 降解指数D/d MX-1-1 5.97±0.23 16.83±0.27 2.81 H37-7-4 8.67±0.20 14.54±0.20 1.68 AH-3-1 4.14±0.05 6.43±0.13 1.55 GX-2-2 11.67±0.03 23.51±0.18 2.01 表 2 菌株MX-1-1的生理生化特征分析
Table 2 Physiochemical characteristics of MX-1-1
测试项目
Test project结果
Result测试项目
Test project结果
Result过氧化氢酶
Catalase− 明胶液化
Gelatin liquefaction+ 葡萄糖分解
Glucose decomposition+ H2S试验
H2S test− 甲基红试验
Methyl red test− 柠檬酸盐试验
Citrate test− VP试验
Voges-Proskauer test+ 淀粉水解
Amylohydrolysis+ +:阳性;−:阴性。
+: Positive; −: Negative.表 3 堆肥养分含量
Table 3 Nutrients in compost
处理
Treatment全氮 Total nitrogen 有机质 Organic matter 发酵前 Before fermentation/% 发酵后 After fermentation/% 增加率 Rate of increase/% 发酵前 Before fermentation/% 发酵后 After fermentation/% 增加率 Rate of increase/% CK 1.46 ±0.05 b 1.48 ±0.10 b 1.37 ±0.08 c 43.30 ±0.01 b 38.98 ±0.15 b −9.98 ±0.06 c MX-1-1菌剂
MX-1-1 bacteria agent1.24 ±0.13 c 1.34 ±0.05 c 8.06 ±0.04 a 43.26 ±0.11 b 42.14 ±0.04 a −2.81 ±0.08 a D50菌剂
D50 bacteria agent1.95 ±0.06 a 2.01 ±0.11 a 3.08 ±0.02 b 45.28 ±0.06 a 43.04 ±0.08 a −4.95 ±0.02 b 表中数据为平均值±标准差;同列数据后不同的小写字母表示0.05水平上差异显著。
Data are mean±SD; those with different lowercase letters on same column indicate significant difference at 0.05 level. -
[1] HARINDINTWALI J D,ZHOU J L,YU X B. Lignocellulosic crop residue composting by cellulolytic nitrogen-fixing bacteria:A novel tool for environmental sustainability[J]. Science of the Total Environment,2020,715:136912. DOI: 10.1016/j.scitotenv.2020.136912
[2] 刘树林,马丽文. 农村秸秆焚烧带来的危害及如何综合利用[J]. 农村实用技术,2023(3) :116−117. [3] 李雨佳,刘爽,孟庆欣. 纤维素降解菌在秸秆好氧堆肥中的研究进展[J]. 高师理科学刊,2023,43(8) :97−100. LI Y J,LIU S,MENG Q X. Research progress on cellulose-degrading microorganisms in straw aerobic composting[J]. Journal of Science of Teachers’ College and University,2023,43(8) :97−100. (in Chinese)
[4] GUO H W,CHANG J,YIN Q Q,et al. Effect of the combined physical and chemical treatments with microbial fermentation on corn straw degradation[J]. Bioresource Technology,2013,148:361−365. DOI: 10.1016/j.biortech.2013.09.001
[5] SUN S N,SUN S L,CAO X F,et al. The role of pretreatment in improving the enzymatic hydrolysis of lignocellulosic materials[J]. Bioresource Technology,2016,199:49−58. DOI: 10.1016/j.biortech.2015.08.061
[6] LI P P,HE C,LI G,et al. Biological pretreatment of corn straw for enhancing degradation efficiency and biogas production[J]. Bioengineered,2020,11(1) :251−260. DOI: 10.1080/21655979.2020.1733733
[7] 史国英,曾泉,叶雪莲,等. 1株纤维素降解细菌的筛选及其对甘蔗叶的降解效果[J]. 南方农业学报,2023,54(2) :488−496. SHI G Y,ZENG Q,YE X L,et al. Screening of a cellulose-degrading bacterium and its degradation effect on sugarcane leaf[J]. Journal of Southern Agriculture,2023,54(2) :488−496. (in Chinese)
[8] 张子赟,朱林,胡占琴,等. 砂姜黑土中兼具促生功能的纤维素降解菌的筛选及其应用[J]. 土壤,2023,55(5) :1062−1069. ZHANG Z Y,ZHU L,HU Z Q,et al. Screening and application of cellulose-degrading bacteria with growth-promoting function in Shajiang black soil[J]. Soils,2023,55(5) :1062−1069. (in Chinese)
[9] 王永伦,余克非,郑展望. 1株耐高温纤维素降解菌发酵条件优化与秸秆降解应用[J]. 江苏农业科学,2023,51(19) :229–236,244. WANG Y L,YU K F,ZHENG Z W. Jiangsu Agricultural Sciences,2023,51(19) :229–236,244. (in Chinese)
[10] 姚晓红,孙宏,沈琦,等. 纤维素降解菌的筛选及其对西兰花废弃茎叶品质的改善[J]. 浙江农业科学,2024,65(2) :459−464. YAO X H,SUN H,SHEN Q,et al. Screening of cellulose-degrading bacteria and its improvement on the quality of discarded stems and leaves of broccoli[J]. Journal of Zhejiang Agricultural Sciences,2024,65(2) :459−464. (in Chinese)
[11] 岳林芳,成立新,李蕴华,等. 常温和低温纤维素降解菌的筛选及其酶活特性[J]. 畜牧与饲料科学,2023,44(2) :9−16. YUE L F,CHENG L X,LI Y H,et al. Screening and enzyme activity characteristics of cellulose-degrading bacteria and fungi isolated at room and low temperatures[J]. Animal Husbandry and Feed Science,2023,44(2) :9−16. (in Chinese)
[12] KARTHIKA A,SEENIVASAGAN R,KASIMANI R,et al. Cellulolytic bacteria isolation,screening and optimization of enzyme production from vermicompost of paper cup waste[J]. Waste Management,2020,116:58−65. DOI: 10.1016/j.wasman.2020.06.036
[13] MA L L,LU Y Y,YAN H,et al. Screening of cellulolytic bacteria from rotten wood of Qinling (China) for biomass degradation and cloning of cellulases from Bacillus methylotrophicus[J]. BMC Biotechnology,2020,20(1) :2. DOI: 10.1186/s12896-019-0593-8
[14] 张运晖,赵瑛,张艳萍,等. 一株玉米秸秆纤维素降解放线菌的筛选、鉴定及酶学特性研究[J]. 微生物学杂志,2023,43(3) :52−59. ZHANG Y H,ZHAO Y,ZHANG Y P,et al. Isolation,identification and enzymology characteristics of a corn stalk cellulose-degradable actinomycetes strain[J]. Journal of Microbiology,2023,43(3) :52−59. (in Chinese)
[15] 曹慧,任世威,张腾月,等. 青藏高原低温纤维素降解菌的筛选与酶学特性[J]. 饲料工业,2021,42(8) :36−41. CAO H,REN S W,ZHANG T Y,et al. Screening and enzymatic properties of cold-adapted cellulose degradation bacteria in the Qinghai-Tibet Plateau[J]. Feed Industry,2021,42(8) :36−41. (in Chinese)
[16] 周海宾,刘娟,丁京涛,等. 采用EEM-FRI方法研究黑曲霉对牛粪堆肥腐熟及纤维素降解影响[J]. 农业工程学报,2022,38(1) :276−286. ZHOU H B,LIU J,DING J T,et al. Effects of Aspergillus niger on maturity and cellulose degradation of cow manure composting using EEM-FRI method[J]. Transactions of the Chinese Society of Agricultural Engineering,2022,38(1) :276−286. (in Chinese)
[17] 马书阁,郑维列,孙文敬,等. 西藏色季拉山冷杉林土壤纤维素降解细菌产酶能力沿海拔梯度变化[J]. 山东林业科技,2014,44(6) :11−15,54. MA S G,ZHENG W L,SUN W J,et al. The change along the altitudinal gradient of the Abides georgei var. smithii forest soil of cellulose-decomposing bacteria enzyme production capacity in Sygera Mountain[J]. Journal of Shandong Forestry Science and Technology,2014,44(6) :11−15,54. (in Chinese)
[18] 杨紫祎,黄祎晨,杨妞,等. 复合菌剂提高青藏高原羊粪和尾菜混合堆肥微生物多样性并加快堆肥腐熟[J]. 植物营养与肥料学报,2024,30(2) :406−416. YANG Z Y,HUANG Y C,YANG N,et al. Composite bacterial agent increases microbial diversity and speeds up the composting procession of sheep manure and tailed vegetables on Tibetan Plateau[J]. Plant Nutrition and Fertilizer Science,2024,30(2) :406−416. (in Chinese)
[19] 尹守亮,杨镒婴,李秋园,等. 一株高产纤维素酶真菌的分离与鉴定[J]. 纤维素科学与技术,2022,30(2) :9−18. YIN S L,YANG Y Y,LI Q Y,et al. Isolation and identification of a high efficiency cellulose degrading fungus[J]. Journal of Cellulose Science and Technology,2022,30(2) :9−18. (in Chinese)
[20] 李荣华,涂志能,Ali Amjad,等. 生物炭复合菌剂促进堆肥腐熟及氮磷保留[J]. 中国环境科学,2020,40(8) :3449−3457. LI R H,TU Z N,AMJAD A,et al. Biochar carried microbial solution promotes compost maturity and nitrogen,phosphorus conservation[J]. China Environmental Science,2020,40(8) :3449−3457. (in Chinese)
[21] 王宝腾,卓也,金锋杰,等. 高效纤维素降解菌Flavodon sp. x10的酶学活性[J]. 菌物学报,2023,42(3) :719−730. WANG B T,ZHUO Y,JIN F J,et al. Enzyme activities of a high-efficiency cellulose degrading fungus Flavodon sp. x10[J]. Mycosystema,2023,42(3) :719−730. (in Chinese)
[22] 赵钰. 产纤维素酶菌株的筛选及酶学性质研究[D]. 沈阳:沈阳农业大学,2017. ZHAO Y. Screening and enzymology properties of cellulase-producing strains[D]. Shenyang:Shenyang Agricultural University,2017. (in Chinese)
[23] 张鑫鹏,王信,孙健,等. 一株假单胞菌的分离鉴定及其在青海地区堆肥中的应用潜力[J]. 浙江农业学报,2022,34(2) :343−351. ZHANG X P,WANG X,SUN J,et al. Isolation and identification of a Pseudomonas strain and its application potential in rape straw composting in Qinghai,China[J]. Acta Agriculturae Zhejiangensis,2022,34(2) :343−351. (in Chinese)
[24] WANG J J,SUN X,DU L N,et al. Appropriate fertilization increases carbon and nitrogen sequestration and economic benefit for straw-incorporated upland farming[J]. Geoderma,2024,441:116743. DOI: 10.1016/j.geoderma.2023.116743
[25] 蔡兴,王腾飞,付小波,等. 重铬酸钾容量法和高频红外碳硫仪法测定土壤中有机质含量的比较研究[J]. 中国土壤与肥料,2024(7) :253−258. CAI X,WANG T F,FU X B,et al. Comparative study on the determination of organic matter content in soil using potassium dichromate volumetric method and high-frequency infrared carbon sulfur analyzer method[J]. Soil and Fertilizer Sciences in China,2024(7) :253−258. (in Chinese)
[26] 王军霞,韩国君,王龙天,等. 包衣尿素对土壤氮素供应量及辣椒氮素利用率的影响[J]. 北方园艺,2023(13) :1−7. WANG J X,HAN G J,WANG L T,et al. Effects of coated urea on soil nitrogen availability and nitrogen use efficiency of pepper[J]. Northern Horticulture,2023(13) :1−7. (in Chinese)
[27] WANG Y X,LIU Q,YAN L,et al. A novel lignin degradation bacterial consortium for efficient pulping[J]. Bioresource Technology,2013,139:113−119. DOI: 10.1016/j.biortech.2013.04.033
[28] 徐倩,宋佳,田汇,等. 青海省春油菜区土壤养分状况及施肥策略[J]. 植物营养与肥料学报,2019,25(1) :157−166. XU Q,SONG J,TIAN H,et al. Status of soil nutrients of spring rapeseed planting area and fertilization strategy in eastern Qinghai Province[J]. Journal of Plant Nutrition and Fertilizers,2019,25(1) :157−166. (in Chinese)
[29] BELKUM V A. Bergey’s manual of systematic bacteriology (volume 2,parts A–C,2nd edition) [J]. FEMS Immunology & Medical Microbiology,2006,46(3) :476.
[30] 陈欢,史子浩,吴春会,等. 不同来源纤维素降解菌的筛选、鉴定及产酶能力的比较[J]. 草地学报,2024,32(4) :1252−1258. CHEN H,SHI Z H,WU C H,et al. Screening,identification and comparison of enzyme production capacity of cellulose-degrading bacteria from different sources[J]. Acta Agrestia Sinica,2024,32(4) :1252−1258. (in Chinese)
[31] 李婷,蒋朵,卢映菲,等. 园林废弃物高效降解菌的分离、筛选及鉴定[J]. 现代农业科技,2022(5) :125−128,135. LI T,JIANG D,LU Y F,et al. Isolation,screening and identification of high-efficiency degrading bacteria of garden waste[J]. Modern Agricultural Science and Technology,2022(5) :125−128,135. (in Chinese)
[32] GOMES I,GOMES J,GOMES D J,et al. Simultaneous production of high activities of thermostable endoglucanase and β-glucosidase by the wild thermophilic fungus Thermoascus aurantiacus[J]. Applied Microbiology and Biotechnology,2000,53(4) :461−468. DOI: 10.1007/s002530051642
[33] 张梦君,邱晨浩,柴立伟,等. 高效降解纤维素低温真菌的筛选、鉴定及发酵优化[J]. 微生物学通报,2019,46(10) :2494−2503. ZHANG M J,QIU C H,CHAI L W,et al. Screening,identification and fermentation optimization of cold-adapted fungi with high efficiency of cellulose degradation[J]. Microbiology China,2019,46(10) :2494−2503. (in Chinese)
[34] 张佳雯,王玉芳,张忠民,等. 芽孢杆菌B55产羧甲基纤维素酶的培养优化研究[J]. 工业微生物,2024,54(1) :76−80. ZHANG J W,WANG Y F,ZHANG Z M,et al. Culture optimization of Bacillus sp. B55 for the production of carboxymethyl-cellulase[J]. Industrial Microbiology,2024,54(1) :76−80. (in Chinese)
[35] 何特,李妮,黄小菲,等. 青藏高原高寒湿地产纤维素酶菌株的分离、鉴定和产酶的初步研究[J]. 中国农业科技导报,2009,11(4) :112−117. HE T,LI N,HUANG X F,et al. Initial studies on isolation and identification of cellulase-producing strain from Qinghai-Tibetan Plateau alpine wetland and enzymatic production[J]. Journal of Agricultural Science and Technology,2009,11(4) :112−117. (in Chinese)
[36] 李豪,杨衡,张敏琪,等. 纤维素降解菌C-19的筛选鉴定、产酶优化及生物强化研究[J]. 农业生物技术学报,2023,31(11) :2377−2386. LI H,YANG H,ZHANG M Q,et al. Screening,identification,optimization of its enzyme production and research on bioaugmentation of cellulose-degrading bacteria C-19[J]. Journal of Agricultural Biotechnology,2023,31(11) :2377−2386. (in Chinese)
[37] 杨波,邬慧慧,荆焕松,等. 鹿粪纤维素降解细菌的筛选及堆肥应用[J]. 经济动物学报,2022,26(2) :138−145. YANG B,WU H H,JING H S,et al. Screening of cellulose degradation bacteria from Deer manure and composting application[J]. Journal of Economic Animal,2022,26(2) :138−145. (in Chinese)
[38] 魏自民,王佰洁,赵越,等. 堆肥低温起爆微生物筛选及其初步应用[J]. 环境科学研究,2015,28(6) :981−986. WEI Z M,WANG B J,ZHAO Y,et al. Cold-tolerant bacteria screening and its inoculation in composting at low temperatures[J]. Research of Environmental Sciences,2015,28(6) :981−986. (in Chinese)
[39] 邵栓,朱群,李慧娟,等. 复合微生物菌剂在猪粪无害化处理中的应用[J]. 畜牧与兽医,2021,53(4) :42−47. SHAO S,ZHU Q,LI H J,et al. Application of compound microbial preparation in innocuous treatment of pig manure[J]. Animal Husbandry & Veterinary Medicine,2021,53(4) :42−47. (in Chinese)




 下载:
下载: