Inhibition of Xanthine Oxidase by Enzymatic Hydrolysates of Distiller's Grains and Optimization of Enzymatic Hydrolysis Process
-
摘要:目的
探究不同酒糟源蛋白的酶解产物对黄嘌呤氧化酶(xanthine oxidase, XOD)活性抑制的影响,为酒糟源XOD抑制肽的研发提供理论基础和技术支持。
方法以红曲糟(HDG)和酱香型白酒糟(BDG)为研究对象,碱性蛋白酶为水解酶,比较两者的蛋白质酶解率、酶解产物对XOD的抑制活性,以及体外模拟胃肠道消化耐受性,并选择较好的酒糟源进行酶解工艺优化。
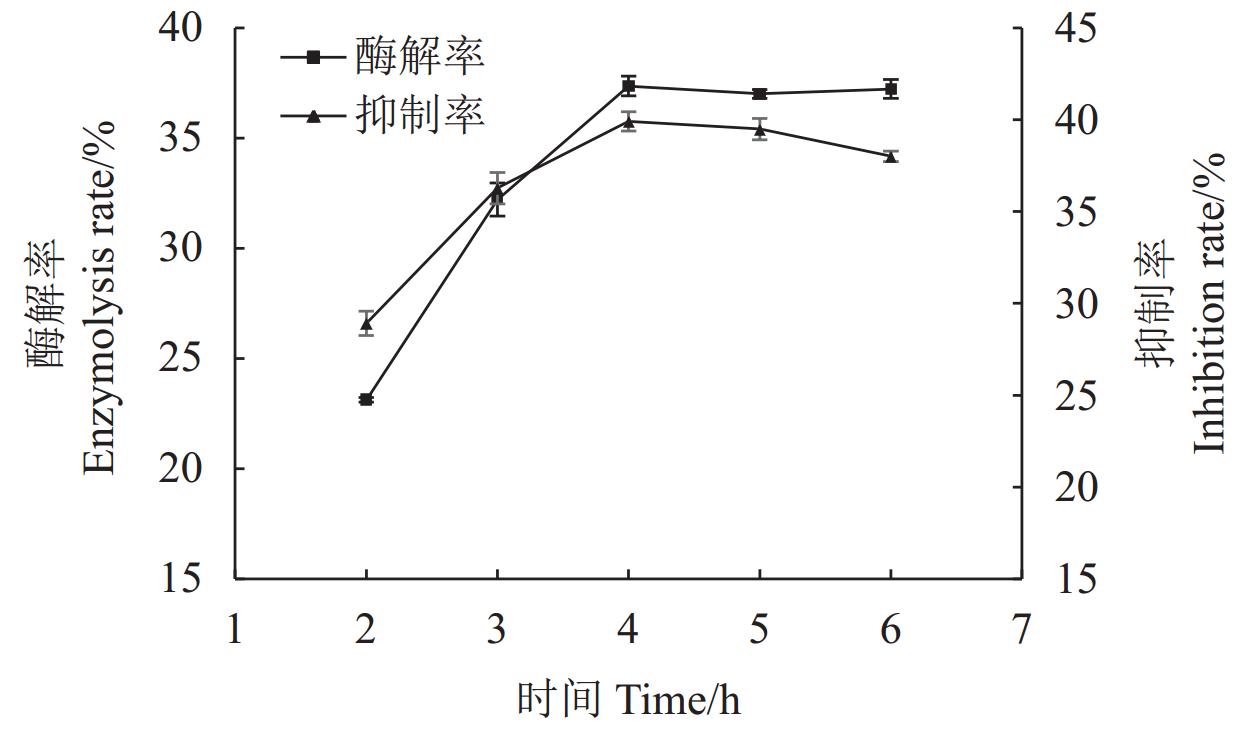
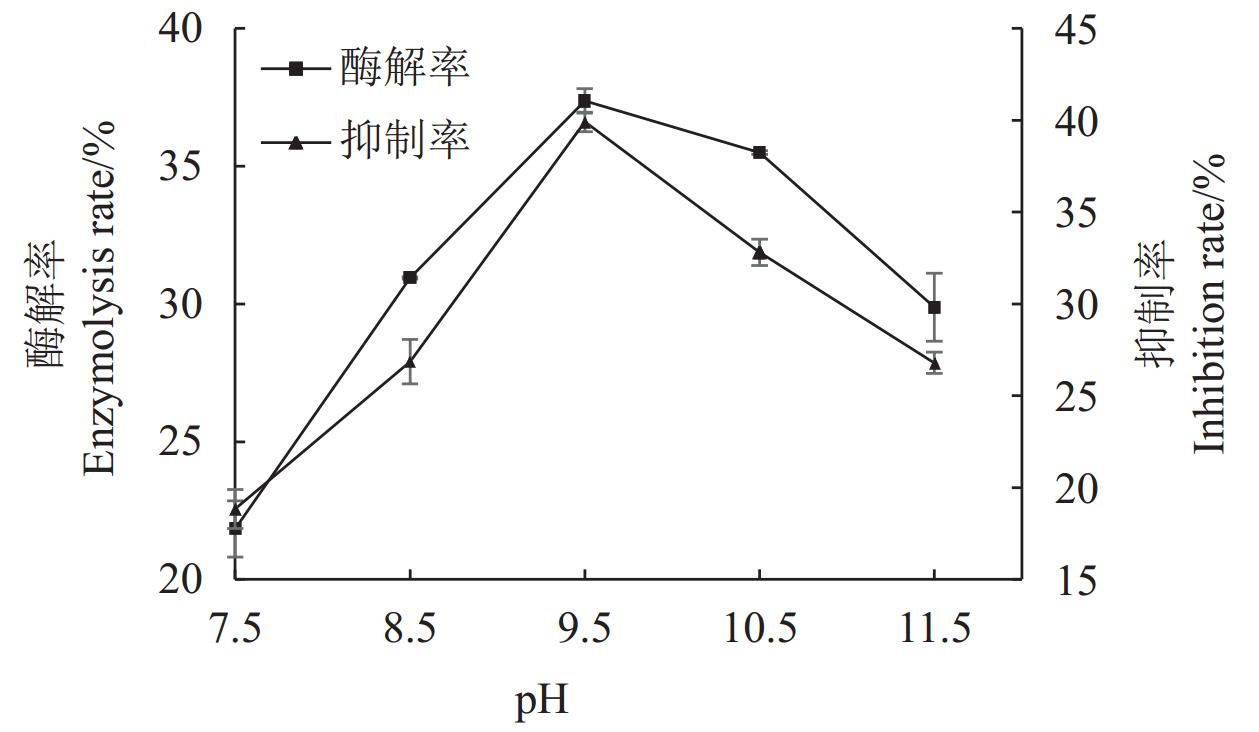
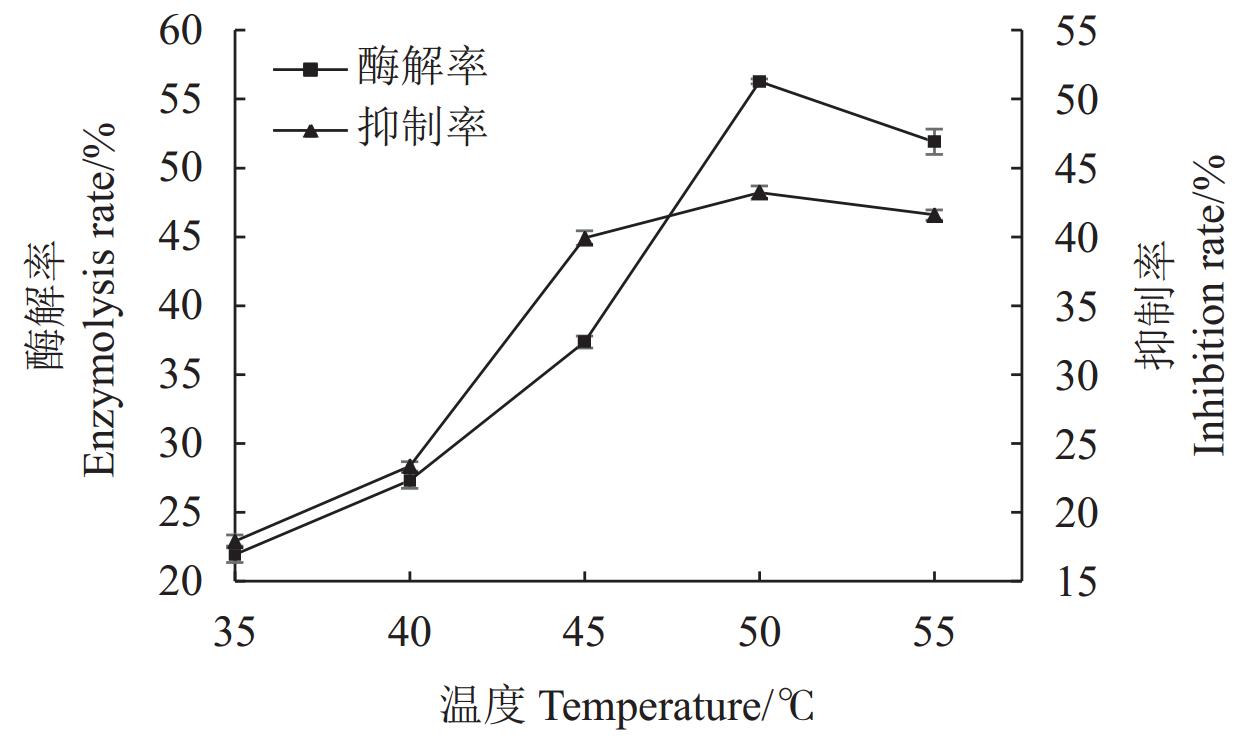
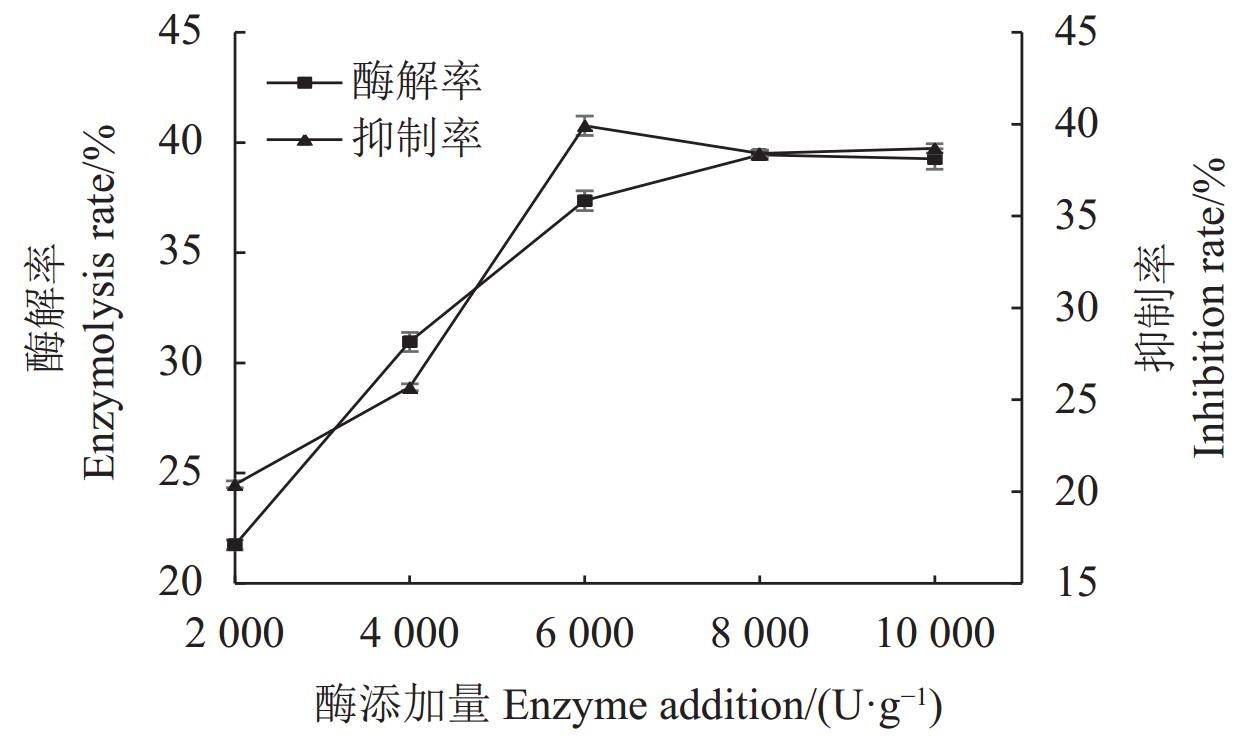
结果(1)HDG及BDG经碱性蛋白酶酶解后,其酶解产物均具有XOD抑制活性。其中以BDG原料的蛋白质酶解率更高,为(56.28±0.01)%,酶解产物对XOD抑制活性更强,对XOD的半抑制浓度(IC50)为(7.73±0.26)mg·mL−1,与HDG比较差异均达极显著水平(P<0.01)。(2)经胃肠消化后,2种酒糟源蛋白酶解产物的XOD抑制活性保持率均在31%以上,两者间差异不显著(P>0.05)。(3)以BDG为原料进行酶解,其优化工艺为碱性蛋白酶添加量
6000 U·g−1、温度50℃、pH 9.5、时间5 h,在此条件下蛋白酶解率为58.00%,酶解产物对XOD的半抑制浓度IC50为5.54 mg·mL−1。结论酱香型白酒糟(BDG)酶解产物具有较好的XOD抑制活性。BDG是制备XOD抑制肽的良好蛋白来源。
Abstract:ObjectiveTo investigate the inhibitory effects of enzymatic hydrolysates from different distiller's grain proteins on xanthine oxidase (XOD) activity, providing a theoretical basis and technical support for the development of XOD inhibitory peptides from distiller's grains.
MethodsUsing Hongqu distiller's grains (HDG) and sauce-flavor Baijiu distiller's grains (BDG) as raw materials, alkaline protease was used as the hydrolytic enzyme. The protein hydrolysis rate, XOD inhibitory activity of the hydrolysates, and their tolerance to simulated gastrointestinal digestion were compared. The optimal distiller's grain source was selected for enzymatic hydrolysis process optimization.
Results1) The enzymatic hydrolysates of both HDG and BDG exhibited XOD inhibitory activity. BDG had a higher protein hydrolysis rate (56.28±0.01)% and stronger XOD inhibitory activity, with a half-maximal inhibitory concentration (IC50) of (7.73±0.26) mg·mL−1, showing significant differences compared to HDG (P<0.01). 2) After gastrointestinal digestion, the XOD inhibitory activity retention rates of the hydrolysates from both distiller's grains were above 31%, with no significant difference between them (P>0.05). 3) The optimized enzymatic hydrolysis conditions for BDG were: alkaline protease dosage of
6000 U·g−1, temperature of 50℃, pH 9.5, and time of 5 h. Under these conditions, the protein hydrolysis rate was 58.00%, and the IC50 of the hydrolysates for XOD inhibition was 5.54 mg·mL−1.ConclusionThe enzymatic hydrolysates of sauce-flavor Baijiu distiller's grains (BDG) exhibit good XOD inhibitory activity. BDG is a promising protein source for the preparation of XOD inhibitory peptides.
-
在分析功能基因的表达水平时,为了消除不同样品在RNA的提取质量和得率及在RNA反转录成cDNA的效率上存在的差异,通常选用适当的内参基因进行校正,以确定目的基因的相对表达量。理想的内参基因要求表达量适中,表达水平稳定,不受内源性(如生长周期或不同器官)或外界条件(如实验措施或环境因素)的影响。
植物肌动蛋白(Actin)是一类古老的、由单一多肽构成的球状蛋白质[1],构成细胞的微丝系统,参与细胞分裂和形态控制、信号传导、细胞器运动等细胞生理活动[2-3];3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehyrogenase, GAPDH)是糖酵解过程中的关键酶,氧化3-磷酸甘油醛形成1, 3-二磷酸甘油酸[4],与生命活动紧密相关;微管蛋白(tubulin)不仅是细胞骨架的组成部分,而且与胞内物质运输、信号识别、细胞运动等关系密切,主要由α、β两种微管蛋白以二聚体的形式聚合而成[5]。Actin、GAPDH和tubulin表达相对稳定,常作为内参基因用于基因表达分析[6-9]。但是,已有研究发现,持家基因的表达水平也存在不稳定性[10-11],应根据不同试验目的筛选合适的内参基因。
金线莲Anoectochilusroxburghii (Wall.) Lindl是兰科Orchidaceae开唇兰属Anoectochilus植物,又称金线兰、金草,具有保肝、降血糖、抗肿瘤、提高免疫力等作用[12-13],主要分布在我国的亚热带地区,福建和台湾是主产地[14],因野生资源匮乏,主要靠种植组培苗满足市场的需求。金线莲富含黄酮、生物碱、皂苷、甾体化合物、三萜类等活性成分[15-17],而组培苗的种植时间会影响金线莲活性成分含量[18]。姜福星等[19]对台湾金线莲进行转录组测序,分析发现与黄酮类、生物碱和萜类物质代谢相关的Unigenes分别有130、114和441条,而有关金线莲活性成分合成功能基因的研究还处于起步阶段。研究金线莲药用成分合成调控关键酶基因的功能,分析关键酶基因表达模式,必须选择理想的内参基因,而目前有关金线莲内参基因的研究还鲜有报道。本研究从金线莲转录组测序数据中选择GAPDH、Actin和α-tubulin等3个Unigenes,根据序列信息设计引物,应用半定量RT-PCR技术分析不同生长期和不同温度处理条件下3个基因在金线莲茎、叶的表达水平,以期为金线莲药用活性成分合成关键酶基因的研究选择合适的内参基因。
1. 材料与方法
1.1 试验材料
金线莲(采自福建省龙岩市梅花山)生根瓶苗为本课题组培养。pMD19-T连接试剂盒、Ex Taq DNA Polymerase、PrimeScriptTM Reverse Transcriptase、RNAiso Plus购自宝生物公司。UNIQ-10柱式DNA胶回收试剂盒购自上海生工生物工程有限公司,引物合成、克隆测序委托上海生工。
1.2 金线莲温度处理
将光照培养箱的温度设置为5℃(T5)、15℃(T15)、25℃(T25)、35℃(T35),光照强度4 000 lx,待温度稳定后放入可以移栽的组培生根瓶苗,培养10 d,随机剪取15株金线莲的茎、叶,用铝箔分开包装,液氮速冻后置超低温冰箱保存。
1.3 金线莲不同生长阶段处理
2017年11月3日种植,将金线莲组培生根苗从瓶子取出,洗净根部的培养基后种植于育苗盘,每盘30株,光照强度在3 000~5 000 lx,栽培基质为泥炭土,栽培过程根据基质的干湿情况及时补水。2017年12月至2018年5月,每月取样1次(分别用P1~P6表示),随机剪取15株金线莲的茎、叶,用铝箔分开包装,液氮速冻后置超低温冰箱保存。
1.4 总RNA的提取和cDNA合成
利用RNAiso Plus提取金线莲茎、叶总RNA,经电泳检测后,用超微量紫外可见光分光光度计(ND-1000)测定RNA纯度并定量为500 ng·μL-1。
cDNA合成:在200 μL PCR管中顺序加入DEPC水3 μL,总RNA 2 μL,随机引物(50 μmol·L-1)1 μL,dNTP Mixture(各2.5 mmol·L-1)4 μL,65℃保温5 min后,迅速在冰上急冷5 min,离心数秒后加入预先混合好的5×PrimeScriptTM Buffer 4 μL,RNase inhibitor (40 U·μL-1)0.5 μL,PrimeScriptTM Reverse 0.5 μL,DEPC水5 μL,混匀后放入PCR仪,PCR仪反应程序为:30℃ 10 min,42℃ 60 min,70℃ 15 min,4℃结束反应。反应结束后利用超微量紫外可见光分光光度计(ND-1000)测定吸光值并定量为200 ng·μL-1。
1.5 引物设计及扩增特异性分析
根据金线莲转录组测序数据中的Actin、GAPDH和α-tubulin等3个Unigenes序列信息,利用primer 5.0软件设计扩增引物(表 1)。以茎、叶混合的cDNA为模板PCR扩增,验证引物特异性。扩增体系20 μL:模板1 μL,引物(10 μmol·L-1)各1 μL,10×Buffer 2 μL,Ex Taq DNA聚合酶(5 U·μL-1) 0.1 μL,dNTP Mixture(各2.5 mmol·L-1) 1.6 μL,ddH2O 13.3 μL。反应程序为:94℃预变性5 min,94℃变性30 s,退火(Actin 50℃、GAPDH 55℃、α-tubulin 55℃)30 s,72℃延伸20 s,30个循环,最后72℃延伸10 min。胶回收目的片段,与克隆载体pMD19-T连接后转化大肠杆菌DH5α感受态细胞,经验证后送上海生工测序。
表 1 PCR引物及其序列Table 1. PCR primers and sequences靶基因 引物名称 引物序列(5′-3′) 产物长度/bp Actin ArACT-F AGATGAGGCACAGTCCAAGA 228 ArACT-R GCTGGAACATTGAAGGTCTC GAPDH ArGAPDH-F CCCTTTGGACCTGTGCTACC 162 ArGAPDH-R GATTTGAACTGTGCCCGTCTC α-tubulin ArATUB-F GCTGTTGGAGGTGGGACTG 162 ArATUB-R AGAGTGTGTGGACAGGACGC 1.6 循环参数优化与表达分析
以不同处理样品总RNA反转录获得的cDNA为模板进行PCR,优化循环参数。扩增体系40 μL:模板2 μL,引物(10 μmol·L-1)各2 μL,10×Buffer 4 μL,Ex Taq DNA聚合酶(5 U·μL-1) 0.2 μL,dNTP Mixture(各2.5 mmol·L-1) 3.2 μL,ddH2O 26.6 μL。反应程序为:94℃预变性5 min,94℃变性30 s,退火30 s,72℃延伸20 s,20个循环开始取样5 μL,3个循环取样1次,取样5次,确定循环数。以优化的循环再进行PCR,重复3次,分析3个基因的表达。
2. 结果与分析
2.1 引物扩增特异性分析
为了验证设计引物扩增的特异性,以合成的引物ArACT-F和ArACT-R、ArGAPDH-F和ArGAPDH-R、ArATUB-F和ArATUB-R进行PCR扩增,从图 1可以看出,3对引物均能扩增特异性条带,无非特异性扩增,目的条带的测序结果经DNAMAN V6.0比对后确认均是目的片段,可作进一步分析。
2.2 Actin在不同处理温度和不同生长期的表达分析
以不同处理温度和不同生长期的金线莲茎、叶提取的总RNA反转录的cDNA为模板,优化PCR扩增循环参数,确定Actin扩增循环数为26。以优化的循环数进行PCR扩增,分析Actin在金线莲茎、叶中的表达情况。从图 2可以看出,不同温度处理和不同生长期,Actin在茎、叶中的表达量基本一致,表达稳定,可作为温度处理和生长期金线莲功能基因表达分析的内参基因。
2.3 GAPDH在不同处理温度和不同生长期的表达分析
以各种处理金线莲茎、叶提取的总RNA反转录的cDNA为模板,经过PCR扩增循环参数优化,确定GAPDH扩增循环数为27。以优化的循环数进行PCR扩增,分析GAPDH在金线莲茎、叶中的表达情况。从图 3可以看出,不同温度处理GAPDH表达存在明显差异,随着温度的降低,GAPDH在茎、叶中的表达量越来越高,5℃的表达量最高,说明低温能上调GAPDH的表达。不同生长期GAPDH的表达量也存在差异,随着种植时间的延长,GAPDH在茎、叶中的表达量越来越高,种植4~5个月表达量最高,种植6个月的表达量下降。
2.4 α-tubulin在不同处理温度和不同生长期的表达分析
以金线莲茎、叶各种样品提取的总RNA反转录的cDNA为模板,经优化α-tubulin扩增循环数确定为28。以优化的循环数进行PCR扩增,分析α-tubulin基因在金线莲茎、叶中的表达情况。从图 4可以看出,金线莲茎15℃处理的表达量较高,其他3个温度基本一致,叶中15℃和25℃表达量比5℃和35℃稍高。随着种植时间的延长,α-tubulin在茎、叶中的表达也越来越高,种植5个月的表达量均最高,种植6个月的表达量下降。
3. 讨论
持家基因不仅参与细胞的代谢过程,还具有其他的生理功能,不同样品、不同试验因素的内参基因不同,要根据试验目的不同,分析选择适宜的持家基因做内参,提高研究的可能性和准确性。
梁云等[20]克隆发现百合lilyActin在花蕾、叶片和鳞片中表达稳定。黄连香等[21]克隆发现三叶青肌动蛋白基因ThAct1和ThAct2在茎、普通根和块根中都稳定表达,但ThAct1比ThAct2表达量高;叶与茎、根的表达量存在差异,且叶中ThAct2的表达量稍高,而ThAct1表达量较低。亓希武等[22]克隆了金银花LjActin在幼蕾期、绿蕾期、白蕾期、银花期和金花期等5个发育阶段的花中稳定表达。敖特根白音等[23]克隆了蒙古冰草MwACT2,在高盐、干旱、低温等逆境胁迫下表达稳定。本研究中金线莲肌动蛋白基因在不同温度处理和不同生长期均能稳定表达,是研究金线莲在温度胁迫或不同生长期基因表达分析的理想内参基因。
已有研究发现植物GAPDH表达并不稳定,可被高温、低温和盐胁迫等诱导。如卜娇迪等[24]克隆了金丝小枣的ZjGAPDH,定量分析发现该基因在果实不同发育阶段表达量存在差异,全红期表达量最高,半红期最低。张霞等[25]研究发现盐穗木GAPDH受盐胁迫和ABA上调表达,盐胁迫6 h、ABA处理12 h时达到最高值。本研究也发现低温上调金线莲GAPDH的表达,不同生长期GAPDH在茎、叶中的表达量也不一致,不适宜在分析温度处理和生育期金线莲功能基因表达时作为内参基因。
Jian等[26]分析了大豆不同发育时期10个内参基因,发现α-tubulin表达稳定性最好。然而,本研究中发现金线莲α-tubulin在不同的温度和生长期的表达并不稳定,不适宜在分析温度处理和生育期金线莲功能基因表达时作为内参基因。
本研究选择金线莲的GAPDH、Actin和α-tubulin等3个持家基因,应用半定量RT-PCR技术分析了不同生长期和不同温度处理条件下3个基因在茎、叶的表达水平,没有进行准确的表达定量分析,其他环境条件下金线莲持家基因的表达稳定性也有待进一步研究。
-
表 1 BDG酶解正交试验因素水平
Table 1 Factor level of orthogonal test for optimization of enzymolysis process of BDG
水平
Levels因素
considerationsA 酶解温度
Enzymolysis
temperature / ℃B 酶解pH
Enzymolysis
pHC 酶解时间
Enzymolysis
time/hD 酶添加量
Enzyme addition
amount /(U·g−1)1 45 8.5 3 4000 2 50 9.5 4 6000 3 55 10.5 5 8000 表 2 两种酒糟源蛋白的酶解率及酶解产物XOD抑制活性
Table 2 Protein hydrolysis rate of two distillers’grains proteins and XOD inhibitory activity of enzymatic hydrolysates
项目
Items蛋白质
Protein/
(g·hg−1)酸溶性蛋白质
Acid-soluble proteins/
(g·hg−1)酶解率
Enzymolysis rate/
%酶解产物XOD抑制活性
Inhibitory effect of enzymatic
hydrolysates on XODIC50/
(mg·mL−1)AOA AOU X BDG源酶解产物
Enzymatic hydrolysate
from BDG0.94±0.00 Bb 0.93±0.00 Bb 56.28±0.01 Aa 7.73±0.26 Bb 1.93±0.08 Bb 3.34±0.12 Bb 141.51±1.55 Aa HDG源酶解产物
Enzymatic hydrolysate
from HDG1.51±0.07 Aa 1.36±0.01 Aa 48.71±0.57 Bb 16.58±0.04 Aa 4.15±0.12 Aa 7.16±0.01 Aa 105.86±1.08 Bb 同列后不同大小写字母分别表示差异达极显著(P<0.01)和显著水平(P<0.05)。下同。
Different uppercase and lowercase letters in the same column indicate extremely significant (P<0.01) and significant differences (P<0.05), respectively. Same for below.表 3 体外模拟胃肠道消化对酶解产物XOD抑制率的影响
Table 3 Effect of in vitro simulated gastrointestinal digestion on XOD inhibition rate of enzymatic hydrolysates (单位:%)
项目
Items消化前XOD
抑制率
XOD Inhibition rate before digestion胃消化后XOD
抑制率
XOD inhibition rate after gastric digestion胃消化后XOD抑制活性保持率
Retention rate of XOD inhibitory activity after gastric digestion胃肠消化后XOD抑制率
XOD inhibition rate after gastrointestinal digestion胃肠消化后XOD抑制活性保持率
Retention rate of XOD inhibitory activity after gastrointestinal digestionBDG源酶解产物
Enzymatic hydrolysate from BDG61.15±0.55 Aa 24.84±0.60 Bb 40.62±0.84 Bb 19.27±1.42 Aa 31.51±2.41 Aa HDG源酶解产物
Enzymatic hydrolysate from HDG52.33±1.76Bb 30.35±1.38 Aa 57.08±2.75 Aa 16.51±0.61 Bb 31.61±1.91 Aa HDG酶解产物蛋白质质量浓度为17.2 mg·mL−1,BDG酶解产物的蛋白质质量浓度为8.5 mg·mL−1。
The protein mass concentration of the enzymolysis product of HDG is 17.2 mg·mL−1, while that of the enzymolysis product of BDG is 8.5 mg·mL−1.表 4 以酶解率为指标的正交试验设计方案及结果
Table 4 Orthogonal experimental design scheme and results with enzymolysis rate as the index
水平
LevelsA B C D 酶解率
Enzymolysis rate /%1 1 1 1 1 39.39±0.31 2 1 2 2 2 37.37±0.31 3 1 3 3 3 39.08±0.13 4 2 1 2 3 55.99±0.44 5 2 2 3 1 58.49±0.79 6 2 3 1 2 34.23±1.56 7 3 1 3 2 42.39±0.87 8 3 2 1 3 42.04±0.63 9 3 3 2 1 22.26±1.13 K1 231.68 275.54 231.33 240.28 K2 297.42 275.80 231.22 227.98 K3 213.38 191.14 279.93 274.23 k1 38.61 45.92 38.55 40.05 k2 49.57 45.97 38.54 38.00 k3 35.56 31.86 46.65 45.70 R 14.01 14.11 8.12 7.71 最优参数
optimal parameterA2 B2 C3 D3 影响次序
Order of influenceB>A>C>D 最优组合
optimal combinationB2A2C3D3 表 5 以酶解率为指标的正交试验结果方差分析
Table 5 Variance analysis of the results of the orthogonal experiment with enzymolysis rate as the index
变异来源
Source of
variation平方和
Sum of
squares自由度
Degree of
freedom均方
Mean squareF值
F value显著性
SignificanceA 651.1282 2 325.5641 247.8128 ** B 794.1180 2 397.0590 302.2333 ** C 262.9272 2 131.4636 100.0675 ** D 191.3644 2 95.6822 72.8314 ** 误差Error 11.8238 9 1.3138 总和Total 1911.3617 表 6 以XOD抑制率为指标的正交试验设计方案及结果
Table 6 Orthogonal test design scheme and results with XOD inhibition rate of enzymatic hydrolysate of Baijiu distiller's grains as index
水平
LevelsA B C D 抑制率
Inhibition rate/%1 1 1 1 1 22.75±0.52 2 1 2 2 2 39.92±0.38 3 1 3 3 3 19.72±0.39 4 2 1 2 3 30.15±0.02 5 2 2 3 1 46.12±0.17 6 2 3 1 2 13.74±0.48 7 3 1 3 2 31.71±0.59 8 3 2 1 3 34.53±0.48 9 3 3 2 1 8.99±0.12 K1 164.77 169.22 142.04 155.70 K2 180.00 241.12 158.10 170.73 K3 150.47 84.89 195.10 168.81 k1 27.46 28.20 23.67 25.95 k2 30.00 40.19 26.35 28.45 k3 25.08 14.15 32.52 28.13 R 4.92 26.04 8.84 2.50 最优参数
optimal parameterA2 B2 C3 D2 影响次序
Order of influenceB>C>A>D 最优组合
optimal combinationB2C3A2D2 酶解产物蛋白质量浓度均为6.5 mg·mL−1。
The concentration of the enzymatic hydrolysate proteins was all 6.5 mg·mL−1.表 7 以XOD抑制率为指标的正交试验结果方差分析
Table 7 Analysis of variance of orthogonal experimental results
变异来源
Source of
variation平方和
Sum of
squares自由度
Degree of
freedom均方
Mean
squareF值
F value显著性
SignificanceA 165.4545 2 82.7273 168.870 ** B 2877.3285 2 1438.6643 2612.962 ** C 274.3291 2 137.1646 249.124 ** D 173.3129 2 86.6565 157.389 ** 误差 Error 4.4087 9 0.4899 总和 Total 3494.8339 表 8 正交试验结果验证
Table 8 Verification of the results of the orthogonal experiment
项目
Item酶解率
Enzymolysis
rate/%抑制率
Inhibition
rate/%抑制总价
Total inhibition
price工艺A Process A
(B2A2C3D3)60.56±2.29 Aa 43.47±1.25 Bb 124.30±0.35 Bb 工艺B Process B
(B2C3D2A2)58.00±1.24 Aa 59.38±1.66 Aa 164.51±0.88 Aa -
[1] DALBETH N, STAMP L K, MERRIMAN T R. The genetics of gout: Towards personalised medicine? [J]. BMC Medicine, 2017, 15(1): 108. DOI: 10.1186/s12916-017-0878-5
[2] 张梦婷, 何丽娜, 吕奕菁. 治疗高尿酸血症的药物研究进展 [J]. 中国药物经济学, 2024, 19(1):114−117,121. DOI: 10.12010/j.issn.1673-5846.2024.01.023 ZHANG M T, HE L N, LV Y J. Advances in drug therapy for hyperuricemia [J]. China Journal of Pharmaceutical Economics, 2024, 19(1): 114−117, 121. (in Chinese) DOI: 10.12010/j.issn.1673-5846.2024.01.023
[3] 刘朋, 刘利平, 熊心怡, 等. 灵芝水提物对高尿酸血症大鼠尿酸含量和肾功能的影响 [J]. 食用菌学报, 2024, 31(5):95−103. LIU P, LIU L P, XIONG X Y, et al. Effects of Ganoderma lucidum aqueous extract on uric acid level and renal function of rats with hyperuricemia [J]. Acta Edulis Fungi, 2024, 31(5): 95−103. (in Chinese)
[4] 谢博, 傅红, 杨方. 生物活性肽的制备、分离纯化、鉴定以及构效关系研究进展 [J]. 食品工业科技, 2021, 42(5):383−391. XIE B, FU H, YANG F. Research progress on preparation, purification, identification and structure-activity relationship of bioactive peptides [J]. Science and Technology of Food Industry, 2021, 42(5): 383−391. (in Chinese)
[5] 牛姣, 沈毅, 张贵虎, 等. 白酒酿造原料与酒体品质关系的研究进展 [J]. 食品与发酵工业, 2023, 49(3):322−328. NIU J, SHEN Y, ZHANG G H, et al. Research progress on the relationship between raw materials and Baijiu quality [J]. Food and Fermentation Industries, 2023, 49(3): 322−328. (in Chinese)
[6] 王卓权, 林祯芃, 陈旭东, 等. 不同原料糯米品种对绍兴黄酒品质的影响 [J]. 浙江农业学报, 2024, 36(4):773−779. DOI: 10.3969/j.issn.1004-1524.20221807 WANG Z Q, LIN Z P, CHEN X D, et al. Effects of glutinous rice characteristics of different glutinous rice varieties on the quality of Shaoxing rice wine [J]. Acta Agriculturae Zhejiangensis, 2024, 36(4): 773−779. (in Chinese) DOI: 10.3969/j.issn.1004-1524.20221807
[7] 陈娟, 喻仕瑞, 郑华艳, 等. 酱香蜂蜜酒发酵工艺优化及其品质分析 [J]. 中国酿造, 2024, 43(4):231−238. CHEN J, YU S R, ZHENG H Y, et al. Optimization of fermentation technology and quality analysis of sauce-flavor mead [J]. China Brewing, 2024, 43(4): 231−238. (in Chinese)
[8] BURKEN A J, BURKEN D B, BONDURANT R G, et al. Evaluation of performance of beef stocker cattle when fed distillers grains daily in feed bunks or distillers grains in self-feeding tubs [J]. Applied Animal Science, 2023, 39(6): 363−370. DOI: 10.15232/aas.2023-02389
[9] SOUSA D G,MCDERMOTT R L,NORMAN M M,et al. 163 Impact of feeding wet or dry traditional or fractionated (Solbran) distiller’s grains on feedlot cattle performance and carcass characteristics[J].Journal of Animal Science,2024,102(S2):207–208.
[10] 时伟, 郑红梅, 何珺珺, 等. 白酒糟中功能因子及其提取技术的研究进展 [J]. 中国酿造, 2020, 39(7):1−6. DOI: 10.11882/j.issn.0254-5071.2020.07.001 SHI W, ZHENG H M, HE J J, et al. Advances in functional factors in Baijiu distiller’s grain and its extraction techniques [J]. China Brewing, 2020, 39(7): 1−6. (in Chinese) DOI: 10.11882/j.issn.0254-5071.2020.07.001
[11] 颜家兴, 王茜, 朱英, 等. 中药治疗痛风的作用机制研究进展 [J]. 中国实验方剂学杂志, 2021, 27(12):226−236. YAN J X, WANG Q, ZHU Y, et al. Research progress on mechanism of traditional Chinese medicines in treating gout [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(12): 226−236. (in Chinese)
[12] 袁禛, 程述震, 吴迪, 等. 黄嘌呤氧化酶肽类抑制剂的研究进展 [J]. 食品科学, 2022, 43(11):355−363. DOI: 10.7506/spkx1002-6630-20210604-058 YUAN Z, CHENG S Z, WU D, et al. Advances in research on xanthine oxidase inhibitory peptides [J]. Food Science, 2022, 43(11): 355−363. (in Chinese) DOI: 10.7506/spkx1002-6630-20210604-058
[13] 张薇, 李爱琳, 李书国. 超声辅助酶解制备大米蛋白黄嘌呤氧化酶活性抑制肽的工艺条件优化[J/OL]. 中国粮油学报,2024:1–11. https://doi.org/10.20048/j.cnki.issn.1003-0174.000827. ZHANG W, LI A L, LI S G. Optimization of process conditions for xanthine oxidase activity inhibitory peptide of rice protein by ultrasound-assisted protease enzymolysis [J/OL]. Journal of the Chinese Cereals and Oils Association,2024:1–11. (in Chinese)
[14] 黎青勇. 核桃源降尿酸肽靶向抑制黄嘌呤氧化酶活性的构效机制研究[D]. 广州: 华南理工大学, 2018. LI Q Y. Study on the structure-activity mechanism of targeting inhibition of xanthine oxidase by uric acid-lowering peptides derived from walnut[D].Guangzhou:South China University of Technology,2018. (in Chinese)
[15] 马雪琪. 芸豆源抑制黄嘌呤氧化酶活性物质提取及膳食补充剂开发制备[D]. 武汉: 华中农业大学, 2022. MA X Q. Extraction of xanthine oxidase inhibiting substances from kidney bean and development and preparation of dietary supplement[D]. Wuhan:Huazhong Agricultural University,2022. (in Chinese)
[16] 孙菁茹, 孙铭爽, 吕文庆, 等. 黑豆黄嘌呤氧化酶抑制肽的制备及体外降尿酸活性 [J]. 食品科学, 2024, 45(23):2372−2380. SUN J R, SUN M S, LÜ W Q, et al. Preparation of xanthine oxidase inhibitory peptide from black bean protein by enzymatic hydrolysis and its uric acid-lowering activity in vitro [J]. Food Science, 2024, 45(23): 2372−2380. (in Chinese)
[17] JANG I T, HYUN S H, SHIN J W, et al. Characterization of an anti-gout xanthine oxidase inhibitor from Pleurotus ostreatus [J]. Mycobiology, 2014, 42(3): 296−300. DOI: 10.5941/MYCO.2014.42.3.296
[18] 姜云松. 白酒酒糟中功能性多肽的提取纯化鉴定及活性测定[D]. 北京: 北京工商大学, 2020. JIANG Y S. Extraction,purification,identification and activity determination of functional peptides from distiller’s grains[D]. Beijing:Beijing Technology and Business University,2020. (in Chinese)
[19] BRAVO F I, MAS-CAPDEVILA A, LÓPEZ-FERNÁNDEZ-SOBRINO R, et al. Identification of novel antihypertensive peptides from wine lees hydrolysate [J]. Food Chemistry, 2022, 366: 130690. DOI: 10.1016/j.foodchem.2021.130690
[20] 侯蕊, 梁璋成, 林晓婕, 等. 红曲糟源酶解蛋白肽的功能性评价 [J]. 福建农业学报, 2024, 39(3):354−361. HOU R, LIANG Z C, LIN X J, et al. Functional evaluation of enzymatic hydrolyzed peptides from Hongqu glutinous rice wine grains protein [J]. Fujian Journal of Agricultural Sciences, 2024, 39(3): 354−361. (in Chinese)
[21] 童雅婷, 熊煜丽, 黄映梅, 等. 基于Alcalase2.4FG碱性蛋白酶的玉米抗疲劳肽制备 [J]. 山东化工, 2021, 50(16):3−5. DOI: 10.3969/j.issn.1008-021X.2021.16.002 TONG Y T, XIONG Y L, HUANG Y M, et al. Preparation of corn antifatigue peptide based on Alcalase2.4FG alkaline protease [J]. Shandong Chemical Industry, 2021, 50(16): 3−5. (in Chinese) DOI: 10.3969/j.issn.1008-021X.2021.16.002
[22] 张国治, 李若昀, 白歌, 等. 用2709碱性蛋白酶水解醇洗花生蛋白制备血管紧张素转化酶(ACE)抑制肽 [J]. 河南工业大学学报(自然科学版), 2016, 37(2):64−71. ZHANG G Z, LI R Y, BAI G, et al. Preparation of ace inhibitory peptides by 2709 alkaline protease hydrolysis alcohol washing peanut protein [J]. Journal of Henan University of Technology (Natural Science Edition), 2016, 37(2): 64−71. (in Chinese)
[23] 邹琳. 鲣鱼黄嘌呤氧化酶抑制肽的酶解制备及功能活性评价[D]. 杭州: 浙江大学, 2019. ZOU L. Enzymatic preparation and functional activity evaluation of xanthine oxidase inhibitory peptide from bonito[D]. Hangzhou:Zhejiang University,2019. (in Chinese)
[24] 李娅茹, 栾宏伟, 李文娇, 等. 水产品种类对过敏原原肌球蛋白胃肠消化性能的影响[J]. 食品工业科技, 2022, 43(13). LI Y R, LUAN H W, LI W J, et al. Effects of Aquatic Species on Gastrointestinal Digestibility of Allergen Tropomyosin[J]. Science and Technology of Food Industry, 2022, 43(13): 103−110. (in Chinese)
[25] 常畅, 刘治平, 陈哲漪, 等. 棉籽蛋白ACE抑制肽的酶法制备及其体外稳定性研究 [J]. 食品科学技术学报, 2023, 41(1):106−114. DOI: 10.12301/spxb202200144 CHANG C, LIU Z P, CHEN Z Y, et al. Study on enzymatic preparation and in vitro stability of ACE inhibitory peptides from cottonseed protein [J]. Journal of Food Science and Technology, 2023, 41(1): 106−114. (in Chinese) DOI: 10.12301/spxb202200144
[26] 王锡念, 徐志善, 孙钦军, 等. 超声波辅助酶解提取鮟鱅鱼皮胶原蛋白的工艺优化 [J]. 食品工业科技, 2019, 40(1):175−180. WANG X N, XU Z S, SUN Q J, et al. Optimization of ultrasonic assisted enzymatic extraction of collagen from fish skin of Lophiiformes [J]. Science and Technology of Food Industry, 2019, 40(1): 175−180. (in Chinese)
[27] 陈冬梅, 陈耀, 韦毅, 等. 无糠壳高粱白酒糟的营养成分分析 [J]. 饲料研究, 2020, 43(7):110−113. CHEN D M, CHEN Y, WEI Y, et al. Nutrient composition analysis of sorhum distiller’s grain without chaff [J]. Feed Research, 2020, 43(7): 110−113. (in Chinese)
[28] 王艳红, 张丽娜, 牛思思, 等. 亚麻籽多肽制备工艺优化及生物活性研究 [J]. 食品研究与开发, 2022, 43(13):66−76. DOI: 10.12161/j.issn.1005-6521.2022.13.010 WANG Y H, ZHANG L N, NIU S S, et al. Optimization of the preparation process and biological activity of flaxseed polypeptide [J]. Food Research and Development, 2022, 43(13): 66−76. (in Chinese) DOI: 10.12161/j.issn.1005-6521.2022.13.010
[29] HOU M F, XIANG H, HU X, et al. Novel potential XOD inhibitory peptides derived from Trachinotus ovatus: Isolation, identification and structure-function analysis [J]. Food Bioscience, 2022, 47: 101639. DOI: 10.1016/j.fbio.2022.101639
[30] 胡晓, 周雅, 杨贤庆, 等. 食物蛋白源降尿酸活性肽的研究进展 [J]. 食品与发酵工业, 2020, 46(4):287−293. HU X, ZHOU Y, YANG X Q, et al. Research progress on anti-hyperuricemic peptides obtained from food proteins [J]. Food and Fermentation Industries, 2020, 46(4): 287−293. (in Chinese)
[31] 马洁, 胡宇, 王得发, 等. 带鱼黄嘌呤氧化酶抑制肽制备及工艺优化 [J]. 食品安全质量检测学报, 2023, 14(6):285−294. DOI: 10.3969/j.issn.2095-0381.2023.6.spaqzljcjs202306036 MA J, HU Y, WANG D F, et al. Preparation and process optimization of xanthine oxidase inhibitory peptide from Trichiurus lepturus [J]. Journal of Food Safety & Quality, 2023, 14(6): 285−294. (in Chinese) DOI: 10.3969/j.issn.2095-0381.2023.6.spaqzljcjs202306036
[32] 王晓力, 孙尚琛, 王永刚, 等. 饲料原料白酒糟基本成分测定及评价[J/OL]. 粮油加工(电子版), 2015(5): 62–65. WANG X L, SUN S C, WANG Y G, et al. Analysis and evaluation of basic elements of distiller’s grains for fodder[J/OL]. Cereals and Oils Processing (Electronic Version), 2015(5): 62–65. (in Chinese)
-
期刊类型引用(6)
1. 林江波,邹晖,黄惠明,李和平,戴艺民. 金线莲ArCRC基因的克隆、亚细胞定位和表达分析. 热带亚热带植物学报. 2025(01): 42-48 .  百度学术
百度学术
2. 林江波,黄惠明,邹晖,李和平,戴艺民. 金线莲ArLBD1基因克隆、亚细胞定位及表达分析. 北方园艺. 2024(01): 100-106 .  百度学术
百度学术
3. 张闻婷,梅瑜,王继华. 珍稀药用植物金线莲研究现状与展望. 中国农学通报. 2024(05): 16-26 .  百度学术
百度学术
4. 李和平,林江波,黄惠明,邹晖,戴艺民. 金线莲甘露糖-1-磷酸尿苷转移酶基因的克隆与表达分析. 福建农业学报. 2023(05): 537-544 .  本站查看
本站查看
5. 李和平,林江波,黄惠明,邹晖,戴艺民. 金线莲磷酸甘露糖变位酶基因的克隆与表达分析. 农业生物技术学报. 2023(11): 2284-2293 .  百度学术
百度学术
6. 林江波,王伟英,邹晖,戴艺民. 金线莲呋甾皂苷26-O-β-葡萄糖苷酶基因克隆与表达分析. 福建农业学报. 2020(04): 422-428 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载: