Identification, Biological Characteristics, and Effective Fungicide of Pathogen Causing Leaf Spot Disease on Vicia faba in Jiangsu Province
-
摘要:目的
明确江苏省蚕豆叶斑病的病原种类和病原菌生物特性,筛选适用于防控该病的化学药剂。
方法通过组织分离法获得病原菌株,结合致病性测定、形态学观察和多基因(ITS、GAPDH)序列联合分析对分离出的菌株进行鉴定,并测定病原菌生物学特性和对10种杀菌剂的敏感性。
结果蚕豆叶斑病的病原菌为链格孢(Alternaria alternata),最适生长条件:温度25 ℃,pH 6.0~9.0,连续光照或12 h光暗交替,以麦芽糖或葡萄糖为碳源,以酵母膏或牛肉膏为氮源,马铃薯葡萄糖琼脂或燕麦琼脂培养基。10种杀菌剂中苦参碱和氟啶胺对A. alternata抑菌作用最强,EC50值分别为
0.0220 、0.6309 mg·L−1。结论本研究鉴定出江苏南通蚕豆叶斑病病原菌为链格孢(A. alternata),并明确其生物学特性,苦参碱和氟啶胺对该病原菌的毒力较高,可用于防控链格孢引起的蚕豆叶斑病。
Abstract:ObjectivePathogen that caused the leaf spot disease on Vicia faba in Jiangsu Province was identified, its biological characteristics studied, and effective germicide determined.
MethodSuspected pathogens of the leaf spot disease were collected by tissue isolation culture, and subsequently, identified by a pathogenicity test, morphological observations, and a phylogenetic analysis based on ITS and GAPDH sequence. Biological characteristics and sensitivity to 10 fungicides of the identified pathogen were determined.
ResultsAlternaria alternata was identified as the pathogen that infected V. faba in Jiangsu. It grew optimally on a potato dextrose agar or an oatmeal agar medium containing maltose or glucose for carbon source and yeast or beef extract for nitrogen at 25 ℃ and pH 6.0—9.0 under continuous light exposure or 12 h alternating light and dark conditions. Among the 10 fungicides tested, sophocarpidine and fluazinam exhibited the greatest inhibition on the growth of the isolate at EC50 of 0.0220 mg·L−1 and 0.6309 mg·L−1, respectively.
ConclusionThe pathogen of the leaf spot disease on V. faba in Nantong, Jiangsu was identified to be A. alternata. Its biological characteristics and high in vitro toxicity by sophocarpidine and fluazinam were determined.
-
0. 引言
【研究意义】蚕豆(Vicia faba L.)别名胡豆、罗汉豆等,属于豆科(Leguminosae)、蝶形花亚科(Papilionoideae)、野蚕豆族(Viceae)、巢菜属(蚕豆属Vicia L.)下唯一的栽培种[1],是重要的粮、蔬、饲兼用作物,有较高的固氮能力[2]。我国是世界上蚕豆生产大国,同时也是消费大国之一。我国蚕豆种植主要分为秋播和春播,其中秋播蚕豆主要分布在云南、四川和长江流域一带[3]。蚕豆作为江苏省特别是南通市重要的越冬作物之一,在种植业结构调整中起着重要作用。随着气候变化以及人类活动等影响,蚕豆病虫害问题越发严重,造成巨大损失。在蚕豆的栽培过程中,尤其在温湿度较高及重茬连作条件下,叶部病害的发生尤为严重,导致产量大幅减少。蚕豆作为江苏南通地区传统“四青”作物之一,种植历史悠久,深受省内外居民喜爱,也带动了当地村民增收致富,但2022年以来,多处种植基地发生蚕豆叶斑病,给种植户造成严重经济损失,因此明确蚕豆叶斑病的病原菌及其生物学特性,筛选适合该病防治的药剂,对防治该病具有重要意义。【前人研究进展】目前有关蚕豆叶斑病的病原鉴定及其防治药剂筛选的研究报道较少,蚕豆叶部病害主要有赤斑病(Botrytis fabae、B. cinerea和B. fabiopsis)、锈病(Uromyces viciae)、褐斑病(Ascochyta fabae)、霜霉病(Peronospoora viciae)等[4],其中危害最广的是锈病,在亚洲、欧洲、美洲及非洲均有发生。【本研究切入点】本团队调查了当地蚕豆种植基地蚕豆病害发生情况,明确了叶斑病对当地蚕豆造成的影响,迫切需要明确引起该病的病原菌种类及其生物学特性,筛选适合该病防治的药剂,从而制定有效的防控措施。【拟解决的关键问题】通过分离纯化病原菌,观察形态学、分析系统发育以及测定生物学特性,明确病原菌的特征特性,对病原菌的室内防治药剂进行筛选,以期为研究蚕豆叶斑病的发生规律奠定基础,也为该病在生产上的防控提供参考。
1. 材料与方法
1.1 材料
供试样品:在江苏省南通市采集病样,拍照后置于4 ℃冰箱保存备用。
培养基:马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基、察氏(czapek dox agar, CZ)培养基、燕麦琼脂(oat meal agar, OMA)培养基、水琼脂(water agar, WA)培养基。
试剂及仪器:真菌基因组DNA提取试剂盒,北京索莱宝科技有限公司;其他试剂均为国产分析纯。TL3200B光学显微镜,南京泽洋生物科技有限公司;RTOP-310Y人工气候箱,浙江托普云农科技股份有限公司。
供试化学药剂:50%多菌灵可湿性粉剂,江苏蓝丰生物化工股份有限公司;72%霜脲·锰锌可湿性粉剂,河北中保绿农作物科技有限公司;75%百菌清可湿性粉剂,利民化工股份有限公司;10%苯醚甲环唑水分散粒剂,先正达南通作物保护有限公司;500 g·L−1氟啶胺悬浮剂,山东邹平农药有限公司;24%腈苯唑悬浮剂,美国陶氏益农公司;3%甲霜·噁霉灵水剂,山东东合生物科技有限公司;450 g·L−1咪鲜胺水乳剂,江西红土地化工有限公司;2%苦参碱水剂,北瑞宝德生物化学有限公司;甲霜·噁霉灵原药,上海嘉利康生物科技有限公司。
1.2 方法
1.2.1 蚕豆叶斑病病原菌的分离纯化
采用组织分离法分离病原菌,将采集的蚕豆病样用清水冲洗后晾干,在病健交界处剪取5 mm见方的组织。75%乙醇消毒45 s,3% NaClO溶液消毒35 s,无菌水清洗2~3次,灭菌滤纸吸干水分,放置在PDA培养基上,每个培养基放置5片。25 ℃黑暗条件下培养约5 d,挑取新长出的菌落边缘菌丝转接至新的PDA培养基上进行纯化6次,获得纯化菌株[5]。
1.2.2 蚕豆叶斑病病原菌的鉴定
形态学鉴定:从纯化的菌落边缘打取直径9 mm的菌饼,接种于PDA培养基上,25 ℃黑暗培养5~15 d,观察菌落的生长速度、大小、颜色等特征。挑取产生孢子的菌丝进行制片,在光学显微镜下观察菌株形态特征,对孢子的性状、大小、颜色、隔膜数进行记录[6]。
分子生物学鉴定:从PDA培养基上挑取培养约7 d的菌丝,提取病原菌的DNA。用通用引物对病原菌DNA的rDNA-ITS、3-磷酸甘油醛脱氢酶基因(GAPDH)进行PCR扩增,引物见表1。扩增产物进行测序,将获得的序列在NCBI(https: //blast.ncbi.nlm.nih.gov)进行BLAST检索分析,下载病原菌属内各近缘种模式菌株和参考菌株的ITS、GAPDH序列,采用MEGA 11.0进行比对,利用PhyloSuite v1.2.2将下载的序列按照ITS-GAPDH顺序进行拼接,使用MrBayes进行同质性检验,通过MEGA 11.0用邻接法(neighbor-Joining, NJ)构建系统发育树,确定病原菌的种类[7−8]。
表 1 扩增目的基因所用引物Table 1. Primers used for target gene amplification引物名称 Primer name 引物序列 Primer sequence ITS1 5′-TCCGTAGGTGAACCTGCGG-3′ ITS4 5′-TCCTCCGCTTATTGATATGC-3′ GAPDH-1 5′-CAACGGCTTCGGTCGCATTG-3′ GAPDH-2 5′-GCCAAGCAGTTGGTTGTGC-3′ 1.2.3 蚕豆叶斑病病原菌的致病性测定
根据柯赫氏法则,打取直径9 mm的菌饼,接种于蚕豆幼苗刺伤叶片上,以接种空白PDA作为对照,每个处理接种10片叶片,重复3次,25 ℃条件下进行黑暗培养,喷水保湿,每隔24 h观察记录叶片发病情况。待接种叶片发病后,再次分离病原菌,比较其与原菌株是否一致[9]。
1.2.4 蚕豆叶斑病病原菌的生物学特性测定
打取直径9 mm的菌饼接至培养基中央,设置以下处理。温度处理:配制PDA培养基,在5、10、15、20、25、30、35、40 ℃条件下黑暗培养[10]。pH处理:配制pH分别为5、6、7、8、9、10的PDA培养基,25 ℃黑暗培养[11]。光照处理:设置24 h连续光照、12 h光照+12 h黑暗和24 h连续黑暗,在PDA培养基上25 ℃培养[12]。碳、氮源处理:配制碳源为蔗糖、葡萄糖、乳糖和麦芽糖的察氏培养基,氮源为酵母膏、牛肉膏、硫酸铵、氯化铵、甘氨酸和蛋白胨的察氏培养基,以无碳源和氮源的察氏培养基作为对照,25 ℃条件下黑暗培养[13]。培养基处理:配制PDA、CZ、OMA和WA培养基,25 ℃条件下黑暗培养[14]。以上处理培养5 d后,采用十字交叉法测量菌落直径,每个处理重复3次。
1.2.5 蚕豆叶斑病防控药剂的筛选
防控药剂初筛:配制10种化学药剂的含药PDA培养基,药剂有效成分为
1000 mg·L−1。打取直径为9 mm的菌饼接种至含药PDA培养基,以接种等体积无菌水作为对照,25 ℃黑暗培养。5 d后测量菌落直径,每个处理重复3次。观察病原菌生长是否受到抑制,选择有抑制效果的化学药剂开展进一步的浓度筛选试验。防控药剂复筛:将对病原菌有抑制效果的化学药剂进行梯度稀释,配制不同药剂不同浓度的PDA培养基,药剂有效成分为250、100、10、1、0.1 mg·L−1。接种菌饼,以接种等体积无菌水为对照,25 ℃黑暗培养。5 d后测量菌落直径,每个处理重复3次。计算毒力回归方程、抑制中浓度(EC50)及相关系数[15−16]。
2. 结果与分析
2.1 病原菌的菌落特征、显微形态及致病性测定
在江苏省南通市发现蚕豆大面积发生病害,感病叶片起初出现褐色小点,逐渐蔓延至整张叶片(图1A)。采集病样对病原菌进行分离纯化,命名为VFL10。在PDA培养基上,VFL10菌落呈圆形,边缘整齐,菌丝致密(图1D~F)。菌丝初期为白色,之后呈现淡黄色,最后变成褐色。分生孢子梗单生或簇生,不分枝,直立或稍弯曲,淡褐色至褐色,具有隔膜。分生孢子为倒棍棒形、椭圆形或卵形,颜色褐色,具有横、纵隔膜,隔膜处缢缩,单生或串生(图1B)。通过观察分离的VFL10形态特征及其分生孢子等显微形态,可以初步判断蚕豆叶斑病的病原菌为链格孢属(Alternaria)。
![]() 图 1 蚕豆叶部病斑病原菌的分离与接种A:蚕豆田间发病症状;B:分生孢子形态;C:蚕豆接种VFL10后发病症状;D:菌株VFL10在PDA培养基25 ℃培养5 d后的菌落;E:菌株在PDA培养基25 ℃培养10 d后的菌落;F:菌株在PDA培养基25 ℃培养15 d后的菌落。Figure 1. Isolation and inoculation of pathogenA: symptoms of leaf spot disease on V. faba in the field; B: conidia of VFL10; C: symptoms on V. faba after VFL10 inoculation; D: colony of VFL10 on PDA at 25 ℃ in 5 d; E: colony of VFL10 on PDA at 25 ℃ in 10 d; F: colony of VFL10 on PDA at 25 ℃ in 15 d.
图 1 蚕豆叶部病斑病原菌的分离与接种A:蚕豆田间发病症状;B:分生孢子形态;C:蚕豆接种VFL10后发病症状;D:菌株VFL10在PDA培养基25 ℃培养5 d后的菌落;E:菌株在PDA培养基25 ℃培养10 d后的菌落;F:菌株在PDA培养基25 ℃培养15 d后的菌落。Figure 1. Isolation and inoculation of pathogenA: symptoms of leaf spot disease on V. faba in the field; B: conidia of VFL10; C: symptoms on V. faba after VFL10 inoculation; D: colony of VFL10 on PDA at 25 ℃ in 5 d; E: colony of VFL10 on PDA at 25 ℃ in 10 d; F: colony of VFL10 on PDA at 25 ℃ in 15 d.蚕豆叶片进行活体接种后,发现蚕豆叶片形成黑色的病斑,病斑逐渐扩大至叶片边缘,最终叶片变黑,枯萎死亡(图1C)。从接种VFL10的蚕豆病叶中再次分离纯化病原菌,观察到其与VFL10具有一致的形态学结构。因此,判定VFL10为江苏地区蚕豆叶斑病的致病菌。
2.2 病原菌的基因序列分析
根据VFL10的形态学鉴定结果,进一步采用分子生物学手段鉴定其具体种类。设计引物对菌株VFL10的核糖体转录间隔区序列(ITS)、GAPDH基因进行PCR扩增。通过测序得到目的基因序列,上传至GenBank中进行比对,结果表明VFL10的ITS、GAPDH基因序列与链格孢(A. alternata)菌株对应的序列具有很高的相似性。以麦根腐平脐蠕孢为外群构建多基因系统发育树,菌株VFL10与链格孢(A. alternata)菌株紧密聚类在一起(图2)。根据VFL10的回接蚕豆致病情况、PDA培养基上菌落形态特征以及显微观察到的分生孢子形态结构等,再结合其与链格孢属菌株的多基因序列联合分析,确定侵染蚕豆造成其叶部病斑病的病原菌为链格孢(A. alternata)。
2.3 病原菌的生物学特性
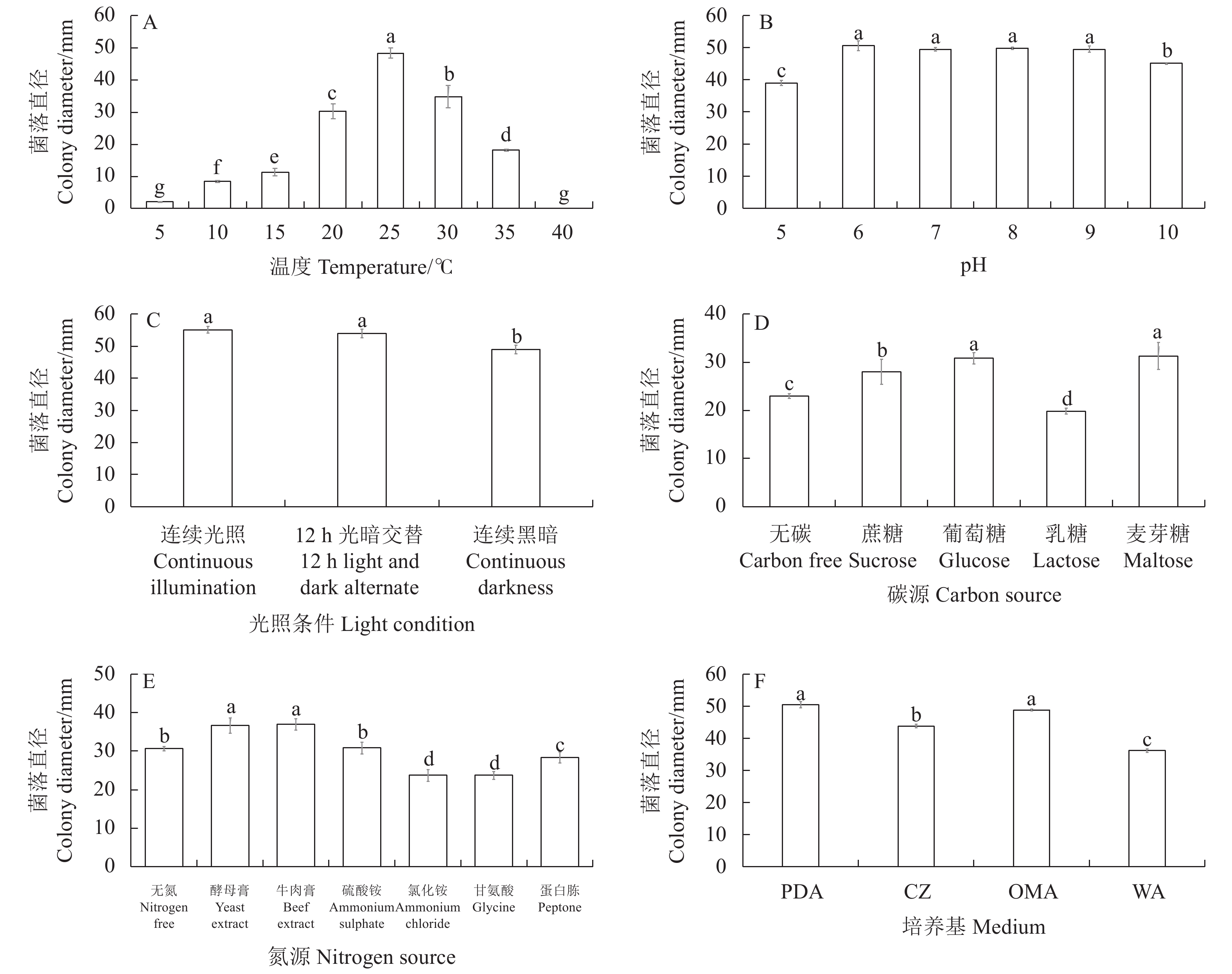
2.3.1 不同温度对病原菌生长的影响
不同温度对菌株VFL10菌丝生长有显著影响(图3A)。在5~35 ℃的温度范围内,菌丝均能生长,但不同温度条件下的生长速率有所差异。在25 ℃时,菌丝生长速率最快,菌落平均直径为48.33 mm,显著高于其他处理(P < 0.05),说明VFL10最适生长温度为25 ℃。在5 ℃时菌丝生长缓慢,温度达40 ℃时菌丝停止生长,表明VFL10属于中温型病原菌。
2.3.2 不同pH对病原菌生长的影响
不同pH对菌株VFL10菌丝生长有明显的影响(图3B)。菌株VFL10在pH 5.0~10.0的培养基上均能生长,但是在pH 6.0~9.0时生长较好,菌落平均直径显著高于pH为5.0和10.0的,表明过酸或过碱的环境均不利于VFL10的生长。
2.3.3 不同光照对病原菌生长的影响
3种光照条件下,菌株VFL10的菌丝均能生长(图3C)。在连续光照和12 h光暗交替条件下,VFL10菌丝生长无显著差异,菌落平均直径分别为55.2、54.0 mm。在连续黑暗条件下,菌株生长明显受到抑制,生长较慢,菌落平均直径为49.0 mm,比其他两种光照条件下的菌落直径减少约10%。
2.3.4 不同碳源对病原菌生长的影响
在5种碳源培养基上,菌株VFL10的菌丝均能生长,但生长速率差异较大(图3D)。在以麦芽糖和葡萄糖为碳源的培养基上,菌丝生长较快,菌落平均直径分别为31.33、30.83 mm,显著高于其他处理,表明麦芽糖和葡萄糖可以促进VFL10的生长。培养基按照其上的菌落直径从大到小排序,依次是以蔗糖、无碳、乳糖为碳源的培养基,其中以乳糖为碳源的培养基上VFL10菌落直径最小,表明乳糖是其不良碳源。
2.3.5 不同氮源对病原菌生长的影响
在7种氮源培养基上,菌株VFL10的菌丝均可以生长,与不同碳源处理的结果相似,其生长速率也有较大的差异(图3E)。在以酵母膏和牛肉膏为氮源的培养基上,菌丝生长较快,菌落平均直径分别为37.03、36.67 mm,显著高于其他处理。而以氯化铵和甘氨酸为氮源的培养基明显抑制了VFL10菌丝生长,菌落平均直径均为23.67 mm,说明氯化铵和甘氨酸是该病原菌的不良氮源。
2.3.6 不同培养基对病原菌生长的影响
在4种培养基上,菌株VFL10的菌丝均能生长(图3F)。在PDA培养基上的菌丝生长速率最快,菌落平均直径为50.50 mm,其次为OMA培养基,菌落平均直径为48.83 mm,与PDA培养基无明显差异,但显著高于其他2种培养基上的菌落直径。VFL10的菌丝在WA培养基上生长速率最慢。
2.4 不同杀菌剂对病原菌的室内毒力测定
室内毒力测定表明不同杀菌剂对菌株VFL10的抑菌效果有明显差异(表2),其中2%苦参碱悬乳剂的抑制作用最好,EC50值为
0.0220 mg·L−1,其次为500 g·L−1氟啶胺悬乳剂、450 g·L−1咪鲜胺悬乳剂、10%苯醚甲环唑可湿性粉剂,EC50值分别为0.6309 、2.4616 、4.0315 mg·L−1,24%腈苯唑悬乳剂、72%霜脲锰锌可湿性粉剂、3%甲霜噁霉灵悬乳剂、甲霜噁霉灵原药、75%百菌清可湿性粉剂抑菌效果差,50%多菌灵可湿性粉剂几乎无抑制作用。表 2 10种杀菌剂对菌株VFL10的抑制作用Table 2. Inhibition effects of ten fungicides against VFL10药剂
Fungicide毒力回归方程
Toxicity regression equationR2 EC50/(mg·L−1) 50%多菌灵
50% carbendazimy= 1.0052 x +1.3108 0.9983 4678.5928 72%霜脲·锰锌
72% cymoxanil-mancozeby = 0.9205 x +3.7128 0.9906 25.0249 75%百菌清
75% chlorothalonily = 0.4681 x +3.6632 0.9984 717.1909 10%苯醚甲环唑
10% phenylimidazoley = 0.4828 x +4.7077 0.9861 4.0315 500 g·L−1氟啶胺
500 g·L-1 fluazinamy = 0.5784 x +5.1157 0.9790 0.6309 24%腈苯唑
24% fenbuconazoley = 0.4432 x +4.4244 0.9607 19.8957 3%甲霜噁霉灵
3% methyrime dioxiny = 1.0747 x +2.8249 0.9966 105.6539 450 g·L−1咪鲜胺
450 g·L−1 prochlorazy = 0.7327 x +4.7134 0.9906 2.4616 2%苦参碱
2% sophocarpidiney = 0.1904 x +5.6277 0.9785 0.0220 甲霜噁霉灵原药
Methyrime dioxiny = 0.9525 x +3.0458 0.9939 112.6404 3. 讨论与结论
本研究表明造成蚕豆叶部病斑的病原菌为链格孢(A. alternata),与重庆地区蚕豆叶部病斑上分离的致病菌一致[17],为江苏地区首次报道由该菌引起的蚕豆病害。前人研究表明,链格孢属真菌的寄主范围十分广泛,能够侵染谷物、油料作物、蔬菜水果和观赏植物等[18]。病害的流行造成了巨大的损失,如烟草赤星病、小麦黑胚病叶斑病、马铃薯早疫病、番茄早疫病、甜瓜的黑斑病等[19−24]。本研究分离的链格孢侵染植物会引起荷花叶斑病、圆锥铁线莲叶斑病、彩叶草叶斑病等[25−27],参考链格孢侵染植物致病的病害描述,以及国外研究发现链格孢属细极链格孢(A. tenuissima)引起的蚕豆病害[28],建议将链格孢侵染蚕豆的病害命名蚕豆叶斑病。
针对蚕豆叶斑病的研究较少,对其致病菌开展生物学特性研究有利于了解病原菌与环境之间的关系,从而为病害的防控提供理论支撑。本研究结果表明该病原菌在5~35 ℃、pH 5.0~10.0条件下均可生长,最适碳源为麦芽糖或葡萄糖,氮源为酵母膏或牛肉膏,且对光照不敏感,这与陈宸等[29]和刘俏等[11]的研究结果基本一致,但在最适碳源和氮源方面的结论有所差异,可能是由于菌株在不同的生长环境及侵染物种导致其产生这种差异。蚕豆叶斑病病原菌在温度高于5 ℃时即可生长,设施栽培及春天气温开始上升时应提前做好防控措施,以降低病害发生率。
蚕豆病害的防治一般采用农业防治、生物防治、物理防治和化学防治等4种措施,目前使用杀菌剂是主要的防治措施。本研究测定了10种杀菌剂对蚕豆叶斑病病原菌VFL10的室内抑菌效果,结果表明苦参碱、氟啶胺的抑菌作用最强。王渊等[30]研究表明多菌灵对链格孢菌有明显抑制作用,但本研究中发现多菌灵对VFL10抑制效果较差,分析可能是由于供试的VFL10对多菌灵产生抗性所致。调查发现病样采集地长期以多菌灵为主施用杀菌剂来防控病害,因此在农药的选择压力下,敏感菌株逐步消失,而耐药菌株成为优势菌群,从而导致本研究出现了多菌灵对VFL10的抑菌活性较差的情况。本研究结果表明,苦参碱对病原菌的离体抑菌活性较好,能够抑制病原菌生物合成。前人研究表明苦参碱能够影响病原菌的生物氧化过程,可以有效防治小麦赤霉病、水稻稻瘟病和芍药红斑病、炭疽病等,而且苦参碱是植物源类杀菌剂,具有易降解无残留、对环境安全友好等优点,符合绿色农业的发展要求[31],但本试验仅为离体试验,其对蚕豆叶斑病的实际防控效果要进一步进行田间实验验证。
-
图 1 蚕豆叶部病斑病原菌的分离与接种
A:蚕豆田间发病症状;B:分生孢子形态;C:蚕豆接种VFL10后发病症状;D:菌株VFL10在PDA培养基25 ℃培养5 d后的菌落;E:菌株在PDA培养基25 ℃培养10 d后的菌落;F:菌株在PDA培养基25 ℃培养15 d后的菌落。
Figure 1. Isolation and inoculation of pathogen
A: symptoms of leaf spot disease on V. faba in the field; B: conidia of VFL10; C: symptoms on V. faba after VFL10 inoculation; D: colony of VFL10 on PDA at 25 ℃ in 5 d; E: colony of VFL10 on PDA at 25 ℃ in 10 d; F: colony of VFL10 on PDA at 25 ℃ in 15 d.
表 1 扩增目的基因所用引物
Table 1 Primers used for target gene amplification
引物名称 Primer name 引物序列 Primer sequence ITS1 5′-TCCGTAGGTGAACCTGCGG-3′ ITS4 5′-TCCTCCGCTTATTGATATGC-3′ GAPDH-1 5′-CAACGGCTTCGGTCGCATTG-3′ GAPDH-2 5′-GCCAAGCAGTTGGTTGTGC-3′ 表 2 10种杀菌剂对菌株VFL10的抑制作用
Table 2 Inhibition effects of ten fungicides against VFL10
药剂
Fungicide毒力回归方程
Toxicity regression equationR2 EC50/(mg·L−1) 50%多菌灵
50% carbendazimy= 1.0052 x +1.3108 0.9983 4678.5928 72%霜脲·锰锌
72% cymoxanil-mancozeby = 0.9205 x +3.7128 0.9906 25.0249 75%百菌清
75% chlorothalonily = 0.4681 x +3.6632 0.9984 717.1909 10%苯醚甲环唑
10% phenylimidazoley = 0.4828 x +4.7077 0.9861 4.0315 500 g·L−1氟啶胺
500 g·L-1 fluazinamy = 0.5784 x +5.1157 0.9790 0.6309 24%腈苯唑
24% fenbuconazoley = 0.4432 x +4.4244 0.9607 19.8957 3%甲霜噁霉灵
3% methyrime dioxiny = 1.0747 x +2.8249 0.9966 105.6539 450 g·L−1咪鲜胺
450 g·L−1 prochlorazy = 0.7327 x +4.7134 0.9906 2.4616 2%苦参碱
2% sophocarpidiney = 0.1904 x +5.6277 0.9785 0.0220 甲霜噁霉灵原药
Methyrime dioxiny = 0.9525 x +3.0458 0.9939 112.6404 -
[1] 叶茵. 中国蚕豆学[M]. 北京: 中国农业出版社, 2003. [2] ZHOU R, HYLDGAARD B, YU X Q, et al. Phenotyping of faba beans (Vicia faba L. ) under cold and heat stresses using chlorophyll fluorescence [J]. Euphytica, 2018, 214(4): 68. DOI: 10.1007/s10681-018-2154-y
[3] 陈新, 袁星星, 顾和平, 等. 江苏省食用豆生产现状及发展前景 [J]. 江苏农业科学, 2009, 37(5):4−8. CHEN X, YUAN X X, GU H P, et al. Present situation and development prospects of vegetable legume in Jiangsu Province [J]. Jiangsu Agricultural Sciences, 2009, 37(5): 4−8. (in Chinese)
[4] 陈新, 袁星星, 崔晓艳, 等. 蚕豆病害研究进展 [J]. 江西农业学报, 2011, 23(8):108−112,123. DOI: 10.3969/j.issn.1001-8581.2011.08.037 CHEN X, YUAN X X, CUI X Y, et al. Research advance in diseases of broad bean [J]. Acta Agriculturae Jiangxi, 2011, 23(8): 108−112,123. (in Chinese) DOI: 10.3969/j.issn.1001-8581.2011.08.037
[5] 马生彪, 王立, 蒋晶晶, 等. 蚕豆赤斑病病原菌分离鉴定及生物学特性研究 [J]. 西北农业学报, 2021, 30(11):1724−1732. DOI: 10.7606/j.issn.1004-1389.2021.11.015 MA S B, WANG L, JIANG J J, et al. Isolation, identification and biological characteristics of broad bean chocolate spot [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2021, 30(11): 1724−1732. (in Chinese) DOI: 10.7606/j.issn.1004-1389.2021.11.015
[6] 李培谦, 冯宝珍, 赵燕飞, 等. 芍药红斑病病原菌鉴定、生物学特性及有效药剂筛选 [J]. 核农学报, 2023, 37(8):1533−1541. DOI: 10.11869/j.issn.1000-8551.2023.08.1533 LI P Q, FENG B Z, ZHAO Y F, et al. Identification, biological characteristics and screening of effective fungicides for red spot on peony [J]. Journal of Nuclear Agricultural Sciences, 2023, 37(8): 1533−1541. (in Chinese) DOI: 10.11869/j.issn.1000-8551.2023.08.1533
[7] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols. Amsterdam: Elsevier, 1990: 315-322.
[8] 高飞, 谢源, 潘鑫, 等. 2019-2020年河南省小麦茎基腐病病原菌鉴定及致病力测定 [J]. 植物保护学报, 2023, 50(2):298−305. GAO F, XIE Y, PAN X, et al. Identification and virulence determination of pathogens of wheat crown rot in Henan Province in 2019-2020 [J]. Journal of Plant Protection, 2023, 50(2): 298−305. (in Chinese)
[9] 汪汉成, 黄宇, 黄洋, 等. 烟草叶斑病病原菌的鉴定及其生物学特性 [J]. 植物保护学报, 2023, 50(3):757−766. WANG H C, HUANG Y, HUANG Y, et al. Identification and characterization of the pathogen Didymella segeticola causing tobacco leaf spot [J]. Journal of Plant Protection, 2023, 50(3): 757−766. (in Chinese)
[10] 许蓉, 刘正慧, 付永平, 等. 灵芝蛛网病病原菌及其生物学特性 [J]. 菌物学报, 2019, 38(5):669−678. XU R, LIU Z H, FU Y P, et al. Identification and biological characteristics of Cladobotryum mycophilum causing cobweb disease on Ganoderma lingzhi [J]. Mycosystema, 2019, 38(5): 669−678. (in Chinese)
[11] 刘俏, 宁楠楠, 马永强, 等. 青海省樱桃叶斑病菌生物学特性及室内药剂毒力测定 [J]. 植物保护, 2021, 47(3):136−143,176. LIU Q, NING N N, MA Y Q, et al. Biological characteristics of pathogen causing leaf spot disease of cherry in Qinghai province and toxicity test of different fungicides in laboratory [J]. Plant Protection, 2021, 47(3): 136−143,176. (in Chinese)
[12] 席中刚, 游景茂, 郑露, 等. 湖北省黄连叶斑病病原鉴定及其生物学特性 [J]. 植物保护学报, 2018, 45(2):315−321. XI Z G, YOU J M, ZHENG L, et al. Identification and biological characteristics of the pathogen causing leaf spot on Coptis chinensis in Hubei Province [J]. Journal of Plant Protection, 2018, 45(2): 315−321. (in Chinese)
[13] 陶航, 扎依娜·玛合巴提, 张烨, 等. 芍药黑斑病病原菌鉴定及其对杀菌剂敏感性分析 [J]. 园艺学报, 2021, 48(1):173−182. TAO H, ZAYINA M H B T, ZHANG Y, et al. Identification, growth conditions and fungicide sensitivity of the pathogen causing black spot disease on peony leaves [J]. Acta Horticulturae Sinica, 2021, 48(1): 173−182. (in Chinese)
[14] 薛彩英, 武海燕, 马庆周, 等. 河南省草莓棒孢叶斑病病原菌鉴定及其生物学特性 [J]. 植物保护学报, 2023, 50(2):402−412. XUE C Y, WU H Y, MA Q Z, et al. Identification and biological characteristics of the pathogen causing Corynespora leaf spot of strawberry in Henan Province [J]. Journal of Plant Protection, 2023, 50(2): 402−412. (in Chinese)
[15] 袁潇潇, 彭科琴, 赵志博, 等. 贵州省黑皮鸡枞蛛网病病原菌的鉴定及其生物学特性分析和防控药剂筛选 [J]. 植物保护学报, 2023, 50(3):780−790. YUAN X X, PENG K Q, ZHAO Z B, et al. Identification of the pathogen causing cobweb disease on black termite mushroom Hymenopellis raphanipes in Guizhou Province, with analysis of its biological characteristics and screening of fungicides for its control [J]. Journal of Plant Protection, 2023, 50(3): 780−790. (in Chinese)
[16] 王秋萍, 吴小毛, 龙友华, 等. 甘蓝灰霉病防治药剂筛选及田间应用 [J]. 东北农业科学, 2021, 46(4):43−46. WANG Q P, WU X M, LONG Y H, et al. Selection and field application of fungicides for controlling Botrytis cinerea in cabbage [J]. Journal of Northeast Agricultural Sciences, 2021, 46(4): 43−46. (in Chinese)
[17] 马连杰, 张慧, 冯牧野, 等. 重庆地区蚕豆叶部链格孢菌的鉴定及其生物学特性研究 [J]. 安徽农业科学, 2018, 46(26):126−129. DOI: 10.3969/j.issn.0517-6611.2018.26.039 MA L J, ZHANG H, FENG M Y, et al. Identification and biological characteristics study of Vicia faba-associated Alternaria spp. in Chongqing [J]. Journal of Anhui Agricultural Sciences, 2018, 46(26): 126−129. (in Chinese) DOI: 10.3969/j.issn.0517-6611.2018.26.039
[18] LOGRIECO A, MORETTI A, SOLFRIZZO M. Alternaria toxins and plant diseases: An overview of origin, occurrence and risks [J]. World Mycotoxin Journal, 2009, 2(2): 129−140.
[19] 李茂业, 闫芳芳, 刘苏, 等. 四川烤烟赤星病的生物学特性及药剂筛选 [J]. 中国烟草科学, 2021, 42(1):54−59. LI M Y, YAN F F, LIU S, et al. Biological characteristics and fungicide screening of tobacco brown-spot disease in Sichuan Province [J]. Chinese Tobacco Science, 2021, 42(1): 54−59. (in Chinese)
[20] 李清, 郑周宜, 刘雨婷, 等. 云南省马铃薯早疫病病原及毒性特点分析 [J]. 微生物学通报, 2023, 50(2):471−485. LI Q, ZHENG Z Y, LIU Y T, et al. Analysis of pathogens and pathogenicity characteristics of potato early blight in Yunnan Province [J]. Microbiology China, 2023, 50(2): 471−485. (in Chinese)
[21] 史晓晶, 杨玥, 张新茹, 等. 山西省番茄叶部病害病原菌链格孢种类鉴定 [J]. 植物保护学报, 2022, 49(4):1279−1280. SHI X J, YANG Y, ZHANG X R, et al. Identification of common fungi Alternaria spp. associated with tomato foliar diseases in Shanxi Province [J]. Journal of Plant Protection, 2022, 49(4): 1279−1280. (in Chinese)
[22] 栾丰刚, 羌松, 段晓东. 新疆小麦黑胚病主要病原的侵染特性研究 [J]. 新疆农业科学, 2011, 48(12):2223−2229. DOI: 10.6048/j.issn.1001-4330.2011.12.011 LUAN F G, QIANG S, DUAN X D. Study on the pathogenetic fungi of the black point disease of wheat and their characteristics of infestation in Xinjiang [J]. Xinjiang Agricultural Sciences, 2011, 48(12): 2223−2229. (in Chinese) DOI: 10.6048/j.issn.1001-4330.2011.12.011
[23] 曹以勤, 刘以东, 陆家云. 小麦后期叶斑病病原菌及种子带菌的研究 [J]. 南京农业大学学报, 1992, 15(2):51−55. CAO Y Q, LIU Y D, LU J Y. Studies on fungi causing wheat leaf spot and isolated from seeds of wheat [J]. Journal of Nanjing Agricultural University, 1992, 15(2): 51−55. (in Chinese)
[24] 王艳. 甜瓜黑斑病病原菌生物学特性、杀菌剂毒力测定及抗蔓枯病的种质资源筛选[D]. 哈尔滨: 东北农业大学, 2022. WANG Y. Biological characteristics of black spot pathogen, virulence test of fungicides and screening of resistant germplasm resources to gummy stem blight[D]. Harbin: Northeast Agricultural University, 2022. (in Chinese)
[25] GONG X, KUANG W G, ZHENG X W, et al. First report of Alternaria alternata causing leaf spot on Nelumbo nucifera plants in China[J]. Plant Disease, 2022. DOI: 10.1094/PDIS-07-21-1471-PDN.
[26] SUN H F, LI N, YAN Y, et al. First report of Alternaria alternata causing leaf blight on Clematis terniflora var. mandshurica in China[J]. Plant Disease, 2022: PDIS10212139PDN.
[27] 王荣波, 陈姝樽, 李本金, 等. 福建省彩叶草叶斑病病原菌的分离鉴定与室内药剂筛选 [J]. 福建农业学报, 2021, 36(12):1471−1477. WANG R B, CHEN S Z, LI B J, et al. Pathogen identification and fungicide selection for leaf spot disease on Plectranthus scutellarioides in Fujian [J]. Fujian Journal of Agricultural Sciences, 2021, 36(12): 1471−1477. (in Chinese)
[28] RAHMAN M Z, HONDA Y, ARASE S. Red-light-induced resistance in broad bean (Vicia faba L. ) to leaf spot disease caused by Alternaria tenuissima [J]. Journal of Phytopathology, 2003, 151(2): 86−91. DOI: 10.1046/j.1439-0434.2003.00685.x
[29] 陈宸, 沙鹏飞, 江学, 等. 金森女贞叶斑病病原物的鉴定、生物学特性及防治药剂筛选 [J]. 植物病理学报, 2024, 54(1):36−48. CHEN C, SHA P F, JIANG X, et al. Identification, characterization and fungicide screening of the pathogen causing leaf spot on Ligustrum japonicum [J]. Acta Phytopathologica Sinica, 2024, 54(1): 36−48.
[30] 王渊, 张芳, 韩丽丽, 等. 6种杀菌剂对4种常见植物病原菌的抑制作用 [J]. 干旱区资源与环境, 2013, 27(11):92−98. DOI: 10.3969/j.issn.1003-7578.2013.11.016 WANG Y, ZHANG F, HAN L L, et al. Inhibitory effect of six fungicides to four common plant pathogen [J]. Journal of Arid Land Resources and Environment, 2013, 27(11): 92−98. (in Chinese) DOI: 10.3969/j.issn.1003-7578.2013.11.016
[31] 潘佳亮. 苦参碱对山核桃干腐病病原真菌(Botryosphaeria dothidea)抑菌机制研究[D]. 哈尔滨: 东北林业大学, 2018. PAN J L. Antifungal mechanism of matrine to Botryosphaeria dothidea[D]. Harbin: Northeast Forestry University, 2018. (in Chinese)




 下载:
下载: