A Rapid Method for Identifying Stem Blight Resistance of Asparagus
-
摘要:目的
建立芦笋抗茎枯病快速鉴定方法,为芦笋抗病育种及抗病品种的筛选应用提供技术支持。
方法分别采用毒素浸种法、毒素浸根法、分生孢子悬浮液浸种法、分生孢子悬浮液灌根法和田间自然诱发法测定7个芦笋品种对芦笋茎枯病的抗病性。
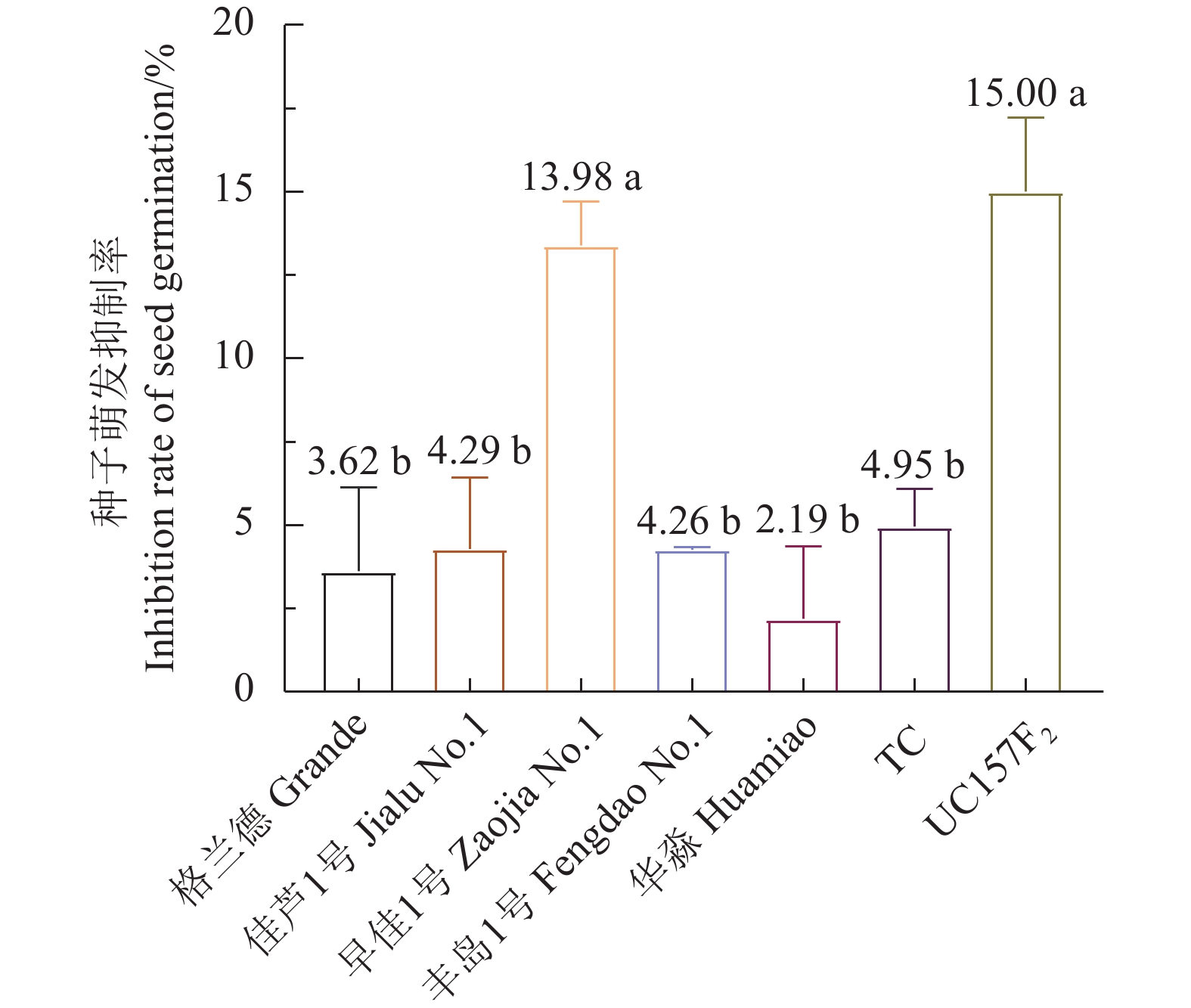
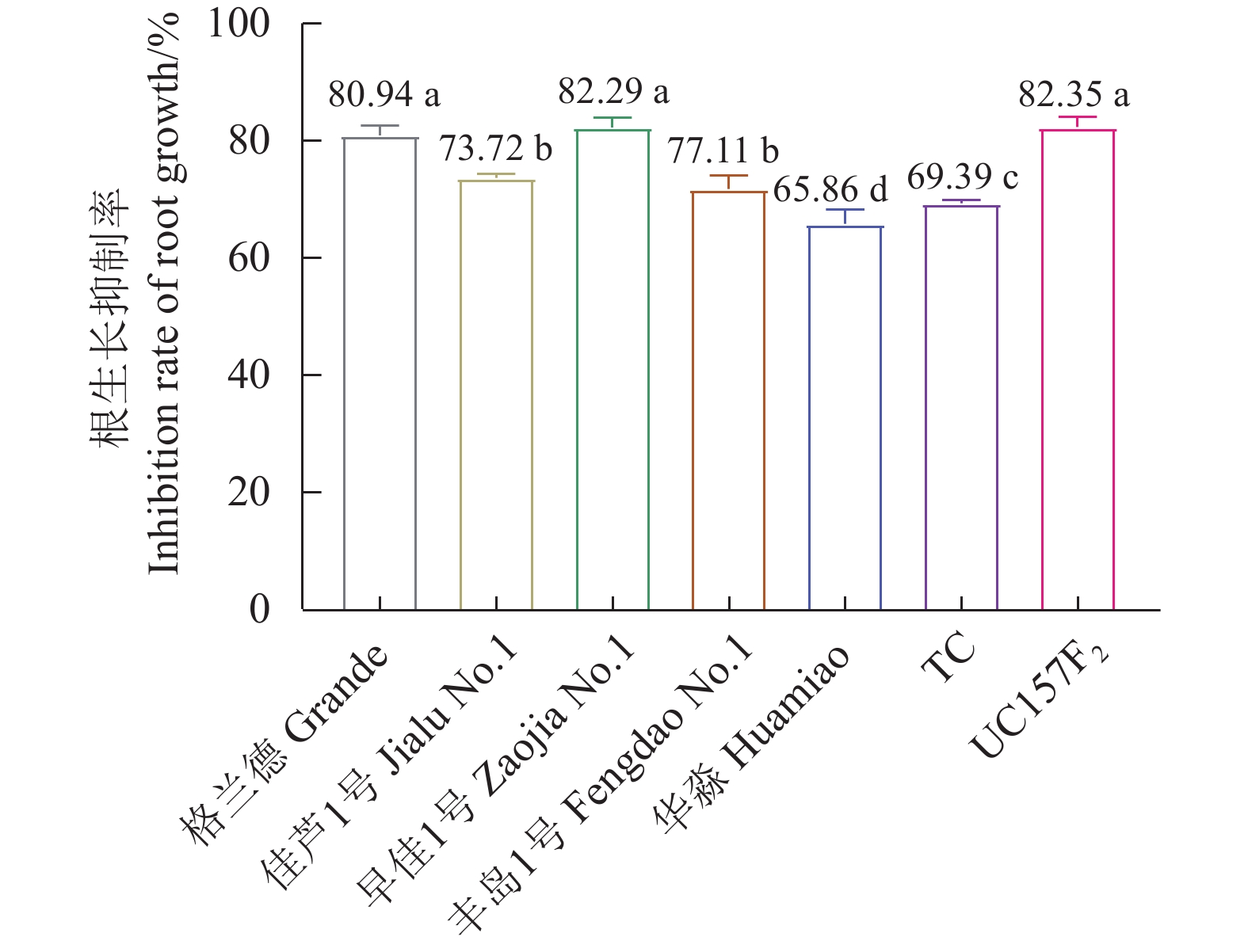
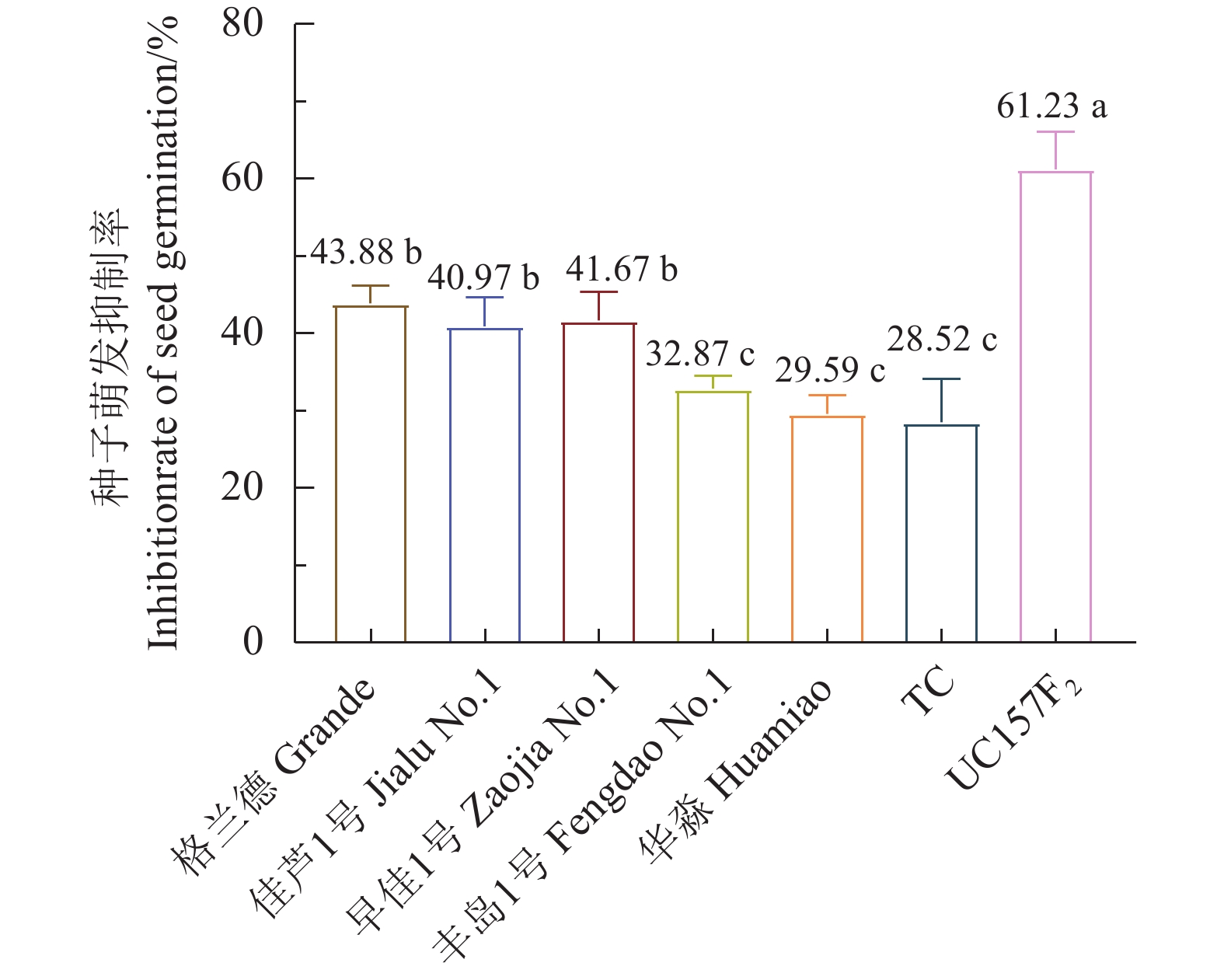
结果芦笋茎枯病菌毒素浸种24 h对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的种子萌发抑制率分别为3.62%、4.29%、13.98%、4.26%、2.19%、4.95%和15.00%,可将7个供试品种划分为感病和中抗2个类型,UC157F2和早佳1号为感病品种,其他品种表现为中抗。毒素原液浸根处理对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的根生长抑制率分别为80.94%、73.72%、82.29%、71.77%、65.86%、69.39%和82.35%,可将供试的7个芦笋品种划分为感病、中感和中抗3个类型,UC157F2、早佳1号和格兰德为感病品种,佳芦1号和丰岛1号为中感品种,TC和华淼为中抗品种。芦笋茎枯病菌分生孢子悬浮液浸种对供试芦笋种子萌发抑制作用较强,其中1.0×105个孢子·mL−1的分生孢子悬浮液浸种处理对格兰德、佳芦1号、早佳1号、丰岛1号、华淼、TC和UC157F2的种子萌发抑制率分别为43.88%、40.97%、41.67%、32.87%、29.59%、28.52%和61.23%,可将7个供试品种分为感病、中感和中抗3个类型,UC157F2为感病品种,格兰德、早佳1号和佳芦1号为中感品种,丰岛1号、华淼和TC为中抗品种。分生孢子悬浮液灌根后所有供试品种的发病率均在80%以上,不能有效区分供试品种的抗病性。田间自然诱发法可将7个供试品种划分为感病、中感和中抗3个类型,UC157F2为感病品种,早佳1号、格兰德和佳芦1号为中感品种,丰岛1号、华淼和TC为中抗品种。
结论病菌分生孢子悬浮液浸种法对芦笋品种的抗茎枯病鉴定结果与田间自然诱发法鉴定结果在0.01水平上显著相关,可以与田间自然诱发法相结合快速准确鉴定芦笋种质资源对茎枯病的抗性水平。
Abstract:ObjectiveA method was developed to rapidly evaluate the resistance of an asparagus cultivar to stem blight.
MethodSeven asparagus cultivars with varying degrees of resistance to stem blight were selected for the study. To artificially induce the disease, (1) the asparagus seeds and/or roots were soaked in an aqueous solution containing the mycotoxin produced by Phomopsis asparagi, (2) the asparagus seeds were submerged in P. asparagi spore suspension, or (3) the asparagus roots were irrigated with an aqueousP. asparagi spore suspension to compare with (4) the natural induction on asparagus plants in the field. Seed germination and seedling root growth were monitored to grade the disease resistance or susceptibility of each asparagus variety.
ResultAfter 24h soaking in an aqueous solution containing mycotoxin, the seeds of Grande, Jialu No. 1, Zaojia No. 1, Fengdao No. 1, Huamiao, TC and UC157F2 displayed inhibited germination at the rates of 3.62%, 4.29%, 13.98%, 4.26%, 2.19%, 4.95% and 15.00%, respectively. Accordingly, UC157F2 and Zaojia No. 1 were classified as the susceptible varieties and the remainders moderately resistant ones. As the root growth of Grande, Jialu No. 1, Zaojia No. 1, Fengdao No. 1, Huamiao, TC and UC157F2 plants affected by an exposure to mycotoxin were inhibited at the rates of 80.94%, 73.72%, 82.29%, 71.77%, 65.86%, 69.39% and 82.35%, respectively, the asparagus cultivars UC157F2, Zaojia No. 1 and Grande were grouped in the susceptible class, Jialu No. 1 and Fengdao No. 1 in the moderately susceptible class, and TC and Huamiao in the moderately resistant class. The significant inhibition on germination by soaking the seeds in suspension of 1.0×105 P. asparagi spores·mL−1 was at a rate of 43.88% on the Grande seeds, 40.97% on the Jialu No. 1 seeds, 41.67% on the Zaojia No. 1 seeds, 32.87% on the Fengdao No. 1 seeds, 29.59% on the Huamiao seeds, 28.52% on the TC seeds, and 61.23% on the UC157F2 seeds. The results placed UC157F2 in the susceptible, Grande, Zaojia No. 1 and Jialu No. 1 in the moderately susceptible, and Fengdao No. 1, Huamiao and TC in the moderately resistant classifications. When the plants were irrigated with the P. asparagi spore suspension, the disease incidence on all tested asparagus was greater than 80% and not adequate to differentiate the resistance grades. Finally, in comparison, the stem blight-induced UC157F2 plants in the field was the susceptible cultivar, whereas Zaojia No. 1, Grande, Jialu No. 1 and Fengdao No. 1 were the moderately susceptible and Huamiao and TC the moderately resistant varieties.
ConclusionOf the various methods for comparing resistance to stem blight of asparagus varieties, soaking the seeds in P. asparagi spore suspension rendered the classification closest to that obtained by the field induction (P<0.01). Therefore, along with field observation, it could be reliably applied to quickly estimate the disease resistance of an asparagus cultivar.
-
Keywords:
- Asparagus officinalis L. /
- asparagus stem blight /
- resistance /
- identification method
-
0. 引言
【研究意义】双孢蘑菇(Agaricus bisporus)是一种草腐型食用菌,目前在全球范围内广泛栽培,主产区包括美国、荷兰、波兰、爱尔兰、加拿大等欧美国家及中国。据中国食用菌协会统计,2017年我国双孢蘑菇总产量达到289.52万t,位列各食用菌品种第四位[1]。我国双孢蘑菇栽培从传统季节栽培开始,随着近些年欧美发达国家双孢蘑菇工厂化设备和技术的引进和吸收转化,国内部分食用菌厂商也开始进行双孢蘑菇工厂化栽培的尝试,且发展势头强劲。而工厂化栽培中培养料的性质是决定双孢蘑菇品质的关键。【前人研究进展】工厂化双孢蘑菇栽培过程中,培养料一般通过隧道发酵进行制备。隧道发酵技术最早由意大利人发明,并于20世纪70年代成功应用到荷兰及法国双孢蘑菇生产当中。隧道发酵早期只用于二次发酵,随着集中发酵原理研究的深入,一次发酵也开始采用开放式隧道进行发酵[2]。当前工厂化双孢蘑菇栽培主要以麦秆、鸡粪为主要原料,通过隧道发酵技术转化为适于蘑菇栽培的选择性培养料。当前蘑菇培养料发酵理化性质方面的研究较多,如张昊琳等[3]关于不同基质培养料理化性状与双孢蘑菇产量及农艺性状方面的研究结果表明,出菇期培养料含水量是提高蘑菇产量的关键。蒋毅敏等[4]通过配方碳氮比试验表明,培养基料中碳氮比为25.4∶1时,双孢蘑菇的产量最高。许修宏等[5]通过隧道二次发酵培养料含氮量从1.58%增加到1.85%,pH值从8.7下降到7.5,表明通过隧道二次发酵技术可以制备符合双孢蘑菇生长需要的培养料。朱燕华等[6]通过研究培养料发酵过程中的pH、电导率、含水量、灰分、碳氮比等理化性质的变化情况,对稻、麦秸秆配方工厂化栽培双孢蘑菇进行比较,获得了适于工厂化栽培的稻草秸秆配方。【本研究切入点】目前培养料隧道式发酵是双孢蘑菇工厂化栽培的关键环节,而不同含氮量培养料一次隧道发酵和二次隧道发酵过程中理化性质变化及其对出菇产量的影响的相关研究还较少。【拟解决的关键问题】本研究通过配制不同含氮量培养料配方,比较一次隧道发酵和二次隧道发酵过程中各处理理化性质的变化,以期为蘑菇培养料配方优化及与后续产量、质量相关性研究提供参考依据。
1. 材料与方法
1.1 供试双孢蘑菇菌株
试验采用双孢蘑菇菌株为W192,由福建省农业科学院食用菌研究所提供并保藏。
1.2 试验材料
试验采用传统麦草+鸡粪配方,主要原材料为麦草秸秆、鸡粪、豆粕以及石膏,原材料各理化参数见表1。麦草秸秆长度在30 cm左右,新鲜、足干,无霉变;鸡粪新鲜、颗粒状;豆粕呈颗粒状,无霉变异味;石膏纯净无杂质。
表 1 原材料部分理化性质Table 1. Physicohemical properties of raw materials原料
Raw material含氮量
Nitrogen content/%含碳量
Carbon content/%含水量
Moisture content/%灰分
Ash content/%麦秆 Wheat straw 0.48 46.50 15.32 8.11 鸡粪 Chicken manure 3.80 45.00 70.27 19.92 豆粕 Soybean meal 7.2 45.4 9.6 6.8 1.3 培养基质配方
目前隧道发酵配方碳氮配比多在1.20%~1.50%,本研究根据原料的含氮量进行配方设计,设置含氮量分别为1.15%(T1)、1.35%(T2)以及1.55%(T3)的3个处理配方。配方T1:麦秆20 t,鸡粪16.25 t;配方T2:麦秆20 t,鸡粪16.25 t,豆粕0.10 t;配方T3:麦秆20 t,鸡粪22 t,豆粕0.55 t,此外各处理石膏添加量为5.5%左右。
1.4 培养料制备及出菇方法
培养料采用隧道集中发酵工艺,并采用荷兰AEM公司隧道发酵控制系统进行温度控制,以保持各处理在隧道发酵过程具有相同的发酵条件。第1 d将麦草浸入含有鸡粪的泡料池进行预湿,然后进行建堆,建堆高度2.0~2.5 m,宽5 m,长度不限。添加辅料(石膏和豆粕),再通过抛料机进行填料,开始一次隧道发酵,抛料高度3 m左右,开启风机进行通风升温,根据升温情况,控制风机间隔运行时间,料温控制在75~85℃,每隔4 d翻堆1次,共翻堆3次。二次隧道发酵控制参考文献[7],填料高度2.2~2.5 m,通过风机控制通气量大小以及调节新风供应进行堆料温度调整,整个二次发酵过程分为平衡、升温、巴氏消毒、降温、控温培养及降温出料几个阶段,出料前测定氨气浓度,低于0.005‰才能够进行上料。其中巴氏消毒料温要保持在58~62℃,保温8 h,控温发酵温度保持在48~52℃,控温发酵4~5 d。出菇菇房为标准化出菇房,菇房采用FANCOM公司的菇房系统进行控制,保证出菇环境相同,播种、发菌、覆土和出菇管理均按常规方法进行[8]。
1.5 培养料理化性质测定
分别对进一次发酵隧道(发酵0 d)、一次转隧道(发酵4 d)、二次转隧道(发酵8 d)、三次转隧道(发酵12 d)、进二次发酵隧道(发酵16 d)和二次发酵结束(发酵23 d)的培养料进行取样,其中一次料为进二次发酵隧道时期的培养料,二次料为二次发酵结束时的培养料。采用烘干法测定含水量:取不同发酵阶段培养料样品500 g于105℃热风烘干箱中烘干24 h,然后计算样品含水量,每个阶段样品重复3次。采用奥豪斯pH计进行pH值测定:取发酵各阶段样品10 g于50 mL蒸馏水中,充分搅拌混合浸泡0.5 h后进行测定。采用马弗炉灼烧重量法测定灰分:准确称重发酵各阶段样品1 g,550℃灼烧4 h。采用凯氏定氮法测定含氮量[9]。
1.6 产量统计及数据分析
用Excel 2013和DPS v7.05对各配方不同理化性质及产量数据进行统计分析,不同潮次出菇产量,以商品菇规格为标准进行切脚并称重。
2. 结果与分析
2.1 不同含氮配方培养料发酵过程含氮量变化
根据原料的含氮量进行配方设计,实际测得各配方初始含氮量分别为1.16%(T1)、1.38%(T2)以及1.57%(T3),接近设计指标。由表2可见,不同含氮配方随着发酵过程的深入,含氮量均呈上升趋势,其含氮量的上升主要是由于微生物代谢活动对有机物的分解,以及微生物定殖增长。一次发酵结束,3个处理含氮量差异逐渐缩小,随着二次发酵的进行,由于游离的氨气被微生物固定,初始含氮量较高的处理T3二次料含氮量为2.28%,显著高于含氮量较低的处理T1和处理T2(P<0.05)。各处理发酵结束时的含氮量比较,初始含氮量越高,二次料含氮量也相对较高,但与初始含氮量存在较大的差异,随着发酵的进行,含氮量的差异逐渐缩小。
表 2 不同含氮配方培养料发酵过程含氮量变化Table 2. N content of composts with varied nitrogen contents at different stages of composting(单位:%) 处理 Treatments 不同发酵阶段 Different stages of composting 进一次 Start phaseⅠ 一转 First turning 二转 Second turning 三转 Third turning 进二次 Start phaseⅡ 出料 End phaseⅡ T1 1.16±0.01 k 1.37±0.02 j 1.59±0.02 hi 1.62±0.02 ghi 1.78±0.02 de 2.05±0.03 c T2 1.38±0.02 j 1.43±0.02 j 1.67±0.01 fg 1.67±0.02 fg 1.81±0.02 d 2.20±0.06 b T3 1.57±0.02 i 1.65±0.02 gh 1.72±0.03 ef 1.74±0.01 e 1.83±0.02 d 2.28±0.00 a 注:同列数据后不同字母表示不同处理之间差异显著(P<0.05),表3~5同。
Note: Data with different letters on same column indicate significant differences between treatments(P<0.05). Same for Tables 3–5.2.2 不同含氮配方培养料发酵过程pH变化
pH是微生物代谢活动重要的影响因素,现代隧道发酵技术一般通过强制通气的方式促进有益微生物的生长代谢。随着微生物的代谢活动,培养料料温逐步升高,同时随着有机物质的分解产生大量的氨气,造成培养料pH呈弱碱性。由表3可见,不同含氮处理pH值变化趋势基本一致,呈现先升后降的趋势,最终使培养料pH呈弱碱性。其中含氮量较高的处理T3一次料以及二次料的pH最高,T3处理二次料的pH值显著高于T2处理(P<0.05)。可见pH和原料的含氮量呈正相关性,因此在发酵过程中应特别注意氨气浓度的变化,若培养料含氮量过高,则需要注意二次发酵过程及出料前的氨气浓度的测定。
表 3 不同含氮配方培养料发酵过程pH变化Table 3. pH of composts with varied nitrogen contents at different stages of composting处理 Treatments 不同发酵阶段 Different stages of composting 进一次 Start phaseⅠ 一转 First turning 二转 Second turning 三转 Third turning 进二次 Start phaseⅡ 出料 End phaseⅡ T1 8.10±0.08 bc 8.13±0.07 abc 8.13±0.03 abc 8.04±0.04 cd 7.82±0.08 ef 7.59±0.04 gh T2 8.09±0.06 bc 8.12±0.03 abc 8.23±0.03 ab 8.16±0.02 abc 7.91±0.02 de 7.54±0.03 h T3 8.23±0.04 ab 8.27±0.03 a 8.25±0.11 ab 8.14±0.02 abc 8.02±0.08 cde 7.72±0.03 fg 2.3 不同含氮配方培养料发酵过程水分变化
双孢蘑菇生长的水分主要来源于培养料。因此,发酵好的培养料含水量在适宜范围内对双孢蘑菇产量和质量具有决定意义。含水量的指标通常与原材料的物理性状有关,发酵好的二次培养料含水量控制在65%~75%比较适宜[10]。由表4可以看出,在蘑菇培养料发酵过程,3个处理的含水量变化趋势相同。含水量随着发酵过程不断降低,这主要由于发酵过程培养料的水分随微生物代谢活动产生的高温以及强制通风被带走。二次料含水量最低的为处理T3,为65.78%,与T1、T2处理的二次料含水量差异不显著( P > 0.05),但显著低于其他发酵阶段的含水量(P<0.05),符合蘑菇生长需求。
表 4 不同含氮配方培养料发酵过程含水量变化Table 4. Moisture content of composts with varied nitrogen contents at different stages of composting(单位:%) 处理 Treatments 不同发酵阶段 Different stages of composting 进一次 Start phaseⅠ 一转 First turning 二转 Second turning 三转 Third turning 进二次 Start phaseⅡ 出料 End phaseⅡ T1 79.26±0.49 a 76.23±1.20 bcd 75.28±0.92 cdef 72.12±0.88 g 72.12±0.97 g 66.75±0.52 h T2 78.70±0.70 ab 75.69±0.91 cde 73.74±0.50 defg 72.90±1.46 fg 72.64±0.44 fg 67.62±0.95 h T3 77.48±0.64 abc 76.22±0.64 bcd 74.32±1.09 defg 72.9±1.12 efg 72.11±0.84 g 65.78±0.86 h 2.4 不同含氮配方培养料发酵过程灰分变化
灰分决定了培养料中可利用干物质含量,灰分越高则表明蘑菇菌丝可利用干物质越少,因此同等质量下灰分较低的培养料,可以提供更多的有机物供蘑菇菌丝利用。由表5可以看出,在蘑菇培养料发酵过程,3个处理的灰分变化趋势相同。由于发酵过程中微生物生长代谢使得有机物分解,灰分则随着发酵过程不断提高。同时灰分很大程度与原料中的灰分含量关系密切,由表5可以看出,处理T1初始灰分最低,发酵结束后,二次培养料灰分为30.92%,显著低于其他两个处理(P<0.05)。在蘑菇培养料的原料中灰分主要来源于鸡粪、石膏、小麦秸秆等,由于含氮量提高对应的鸡粪含量相对增加,因此含氮量高的原料配方灰分含量也相对较高。
表 5 不同含氮配方培养料发酵过程灰分变化Table 5. Ash content of composts with varied nitrogen contents at different stages of composting(单位:%) 处理 Treatments 不同发酵阶段 Different stages of composting 进一次 Start PhaseⅠ 一转 First turning 二转 Second turning 三转 Third turning 进二次 Start phaseⅡ 出料 End phaseⅡ T1 18.44±0.92 h 22.08±0.85 g 25.11±0.90 ef 27.29±1.04 de 28.31±0.18 cd 30.92±0.83 b T2 21.95±0.92 g 22.51±0.72 g 25.32±0.99 ef 28.59±0.18 bcd 29.90±0.60 bc 33.81±0.77 a T3 22.62±1.20 g 23.18±0.79 fg 26.58±0.35 de 28.86±1.02 bcd 30.06±0.23 bc 34.04±0.72 a 2.5 不同含氮配方培养料对双孢蘑菇产量的影响
由图1可以看出不同处理各采收潮次蘑菇产量的变化。产量最高的为T3处理,为20.74 kg·m−2。3个处理的前二潮出菇产量较高,分别占总产量的81.90%、78.99%、79.73%。T1处理的第三潮产量低于其他两个处理,仅有3.16 kg·m−2,而另外两个处理均超过4 kg·m−2。T3处理的第三潮产量与T1处理的第三潮产量差异显著(P<0.05)。相对而言,含氮量较高的培养料其三潮菇产量更高,同时菇质更加紧实。
3. 讨论与结论
双孢蘑菇培养料堆制发酵过程是一个需要微生物参与转化的过程,原材料中各种有机组分会被微生物消耗利用,并被转化为适宜双孢蘑菇利用的选择性培养料。目前隧道发酵配方碳氮配比多为1.20%~1.50%,因此本研究根据原料的含氮量进行配方,分别设计含氮量为1.15%(T1)、1.35%(T2)以及1.55%(T3)3个配方处理,在保证一定的出菇产量前提下设置的3个配方处理涵盖了目前主流配方含氮量,且上下限都超出常规配方要求。本研究采用隧道发酵技术比较了不同含氮培养料堆制发酵过程中理化性质的变化,在培养料堆制发酵过程的不同阶段,3个配方处理的培养料含氮量及灰分比例呈上升趋势,含水量则呈下降趋势,pH则总体呈弱碱性。在所有处理二次培养料中,处理T1的二次发酵料灰分最低,为30.92%;处理T3二次发酵料含氮量最高,为2.28%;处理T3三潮产量最高,为20.74 kg·m−2。在发酵过程中,由于微生物的代谢作用,原材料中的有机物质被分解为水和二氧化碳,并产生热量,加快了原材料腐熟和水分蒸发,因此在发酵过程中含碳量及水分呈下降趋势。同时,不能被代谢分解的矿质元素含量相对提高,从而导致培养料灰分含量随着发酵过程逐渐升高。随着微生物的繁殖生长,特别是二次发酵控温培养阶段,嗜热放线菌的不断繁殖,使pH呈弱碱性,同时产生大量的菌体蛋白,提高了培养料含氮量。姚琴等[11]研究表明,随着培养料发酵过程的进行全氮的绝对量减少,但相对含量成上升趋势,与本研究的结果一致。KARIAGA等[12]通过对培养料堆制过程中生物及理化因素进行研究,表明蘑菇培养料的选择性与培养料的理化性质相关。
隧道发酵是一种强制通风的发酵方法,Wakchaure等研究表明通风是控制堆肥周期及质量的关键参数之一[13]。采用隧道式发酵技术可以缩短制料周期,同时提高培养料质量[14]。当前越来越多的工厂化企业采用隧道发酵制备蘑菇培养料,并形成了专门的堆肥公司[15]。随着双孢蘑菇工厂化栽培技术工艺的不断进步,双孢蘑菇单产水平逐步提升,为了保证产量、质量协调提升,必须有充足的营养源,这就导致培养料中含氮量比例在逐渐提升,但随着培养料含氮量越来越高,容易引起培养料绿霉病的发生。因此,必须加强培养料隧道发酵和双孢蘑菇栽培技术管理。
-
图 1 芦笋茎枯病菌毒素浸种24 h对芦笋种子萌发的抑制率
不同小写字母表示经Duncan氏新复极差法检验差异显著(P < 0.05)。下同。
Figure 1. Germination inhibition rate of asparagus seeds soaked in mycotoxin-containing solution for 24 h
Those with different lowercase letters indicate significant difference at P<0.05 by Duncan’s new multiple range test. Same for below.
图 4 芦笋茎枯病菌1.0×103个孢子·mL−1孢子悬浮液灌根处理的发病结果
A:TC对照;B:TC分生孢子悬浮液灌根;C:UC157F2对照;D:UC157F2分生孢子悬浮液灌根。
Figure 4. Disease incident of asparagus plants with roots irrigated with 1.0×103P. asparagi spores·mL−1 suspension
A: TC control; B: TC roots irrigated with P. asparagi spore suspension; C: UC157F2 control; D: UC157F2 roots irrigated with P. asparagi spore suspension.
表 1 芦笋茎枯病菌毒素不同浸种时间对芦笋种子萌发率的影响
Table 1 Effect of soaking time in mycotoxin-containing solution on asparagus seed germination rate
浸种时间
Soaking time/h种子萌发率
Germination rate of seed /%格兰德
Grande佳芦1号
Jialu No.1早佳1号
Zaojia No.1丰岛1号
Fengdao No.1华淼
HuamiaoTC UC157F2 2 90.67a 92.00a 94.00a 92.00a 90.00a 92.67ab 90.67ab 4 91.33a 92.00a 91.33b 92.00a 90.67a 90.67ab 88.00bc 8 90.00a 91.33a 89.33b 92.00a 89.33a 92.00ab 85.33cd 16 88.00a 90.67a 84.67c 89.33a 90.67a 92.67ab 82.67de 24 89.33a 89.33a 82.00d 90.00a 89.33a 89.33b 79.33e 0 (CK) 92.00a 93.33a 94.67a 94.00a 91.33a 94.00a 93.33a 同列数据后不同小写字母表示差异显著(P<0.05)。下同。
Data with different lowercase letters on a column indicate significant differences at P<0.05. Same for below.表 2 不同浓度芦笋茎枯病菌毒素浸根对芦笋根生长的影响
Table 2 Effect of soaking in solutions containing varied concentrations of mycotoxin on growth of asparagus roots
粗毒素原液与水体积比
Volume ratio of toxin to water根生长抑制率
The inhibition rate of root growth/%格兰德
Grande佳芦1号
Jialu No.1早佳1号
Zaojia No.1丰岛1号
Fengdao No.1华淼
HuamiaoTC UC157F2 1∶0 80.94a 73.72a 82.29a 71.77a 65.86a 69.39a 82.35a 7∶1 74.96b 68.58b 77.12b 67.99b 62.30b 64.60b 77.78b 3∶1 68.99c 64.56c 72.83c 63.02c 58.45c 60.95c 74.75c 1∶1 65.45d 60.85d 68.32d 58.61d 54.54d 55.60d 70.22d 1∶3 60.82e 57.12e 63.80e 53.59e 49.11e 50.54e 66.54e 1∶7 57.28f 55.10f 59.58f 46.00f 43.44f 46.61f 60.77f 表 3 不同浓度芦笋茎枯病菌分生孢子悬浮液浸种对芦笋种子萌发率的影响
Table 3 Effect on germination rate of seeds soaked in varied P. asparagi spore suspensions
分生孢子
悬浮液浓度
Concentration of
spore suspension
/(孢子·mL-1)种子萌发率
Germination rate of seed/%格兰德
Grande佳芦1号
Jialu
No.1早佳1号
Zaojia
No.1丰岛1号
Fengdao
No.1华淼
HuamiaoTC UC-
157F21.0×103 68.00b 68.00b 66.00b 73.33b 77.33b 80.00b 49.33b 1.0×104 60.67c 61.33bc 60.67bc 69.33bc 72.00c 72.00b 44.00bc 1.0×105 52.00d 56.67c 56.00c 62.67c 66.67d 68.67b 36.67c 0 (CK) 92.67a 96.00a 96.00a 93.33a 94.67a 96.00a 94.67a 表 4 不同鉴定方法的相关性
Table 4 Correlation between evaluation methods for disease resistance of asparagus
抗性鉴定方法
Resistance-identification
methods毒素浸种法
Soaking seed
with mycotoxin毒素浸根法
Soaking root
with mycotoxin分生孢子悬浮液浸种法
Soaking seed
with spore suspension分生孢子悬浮液灌根法
Irrigating root
with spore suspension自然诱发法
Field natural
induction method毒素浸种法
Soaking seed with mycotoxin1 0.768** 0.911** 0.267 0.703** 毒素浸根法
Soaking root with mycotoxin0.768** 1 0.682** 0.327 0.682** 分生孢子悬浮液浸种法
Soaking seed with spore suspension0.911** 0.682** 1 0.373 0.761** 分生孢子悬浮液灌根法
Irrigating root with spore suspension0.267 0.327 0.373 1 0.540* 田间自然诱发法
Field natural induction method0.703** 0.682** 0.761** 0.540* 1 **表示在0.01水平(双侧)上显著相关;*表示在0.05水平(双侧)上显著相关。
** indicates significant correlation at P<0.01 (bilateral); * indicates significant correlation at P<0.05 (bilateral). -
[1] DEHGHAN-SHAHREZA F, BELADI-MOUSAVI S S, RAFIEIAN-KOPAEI M. Medicinal plants and diabetic kidney disease; an updated review on the recent findings [J]. Immunopathologia Persa, 2016, 2(1): 1−6.
[2] RUSJAN D, MIKULIC-PETKOVSEK M. Double maturation raisonnée: The impact of on-vine berry dehydration on the berry and wine composition of Merlot (Vitis vinifera L. ) [J]. Journal of the Science of Food and Agriculture, 2017, 97(14): 4835−4846. DOI: 10.1002/jsfa.8354
[3] 孙强, 赵凤, 兰波, 等. 芦笋茎枯病菌致病机制的研究进展 [J]. 安徽农业科学, 2023, 51(3):6−10. DOI: 10.3969/j.issn.0517-6611.2023.03.002 SUN Q, ZHAO F, LAN B, et al. Research progress on the pathogenic mechanism of Asparagus stem blight pathogen [J]. Journal of Anhui Agricultural Sciences, 2023, 51(3): 6−10. (in Chinese) DOI: 10.3969/j.issn.0517-6611.2023.03.002
[4] 刘志恒, 孙俊, 杨红, 等. 芦笋茎枯病菌生物学特性的研究 [J]. 沈阳农业大学学报, 2008, 39(3):301−304. DOI: 10.3969/j.issn.1000-1700.2008.03.010 LIU Z H, SUN J, YANG H, et al. Biological characteristics of Phomopsis asparagi the pathogen of Asparagus stem blight [J]. Journal of Shenyang Agricultural University, 2008, 39(3): 301−304. (in Chinese) DOI: 10.3969/j.issn.1000-1700.2008.03.010
[5] SHI N N, RUAN H C, GAN L, et al. Evaluating the sensitivities and efficacies of fungicides with different modes of action against Phomopsis asparagi [J]. Plant Disease, 2020, 104(2): 448−454. DOI: 10.1094/PDIS-05-19-1040-RE
[6] 杜宜新, 阮宏椿, 石妞妞, 等. 福建省稻瘟病菌对主要抗瘟基因及主栽品种的致病性分析 [J]. 植物保护学报, 2016, 43(3):442−451. DU Y X, RUAN H C, SHI N N, et al. Pathogenicity analysis of Magnaporthe grisea against major Pi-genes and main rice varieties in Fujian Province [J]. Journal of Plant Protection, 2016, 43(3): 442−451. (in Chinese)
[7] 中华人民共和国农业部. 水稻品种试验稻瘟病抗性鉴定与评价 技术规程: NY/T 2646—2014[S]. 北京: 中国农业出版社, 2015. [8] 程蓬, 郭璇, 辛秀丽, 等. 83份西农系小麦品种(系)抗性鉴定及抗病基因分子检测 [J]. 植物保护学报, 2024, 51(1):237−248. CHENG P, GUO X, XIN X L, et al. Disease resistance evaluation and molecular detection of resistance genes of 83 Xinong wheat varieties(lines) [J]. Journal of Plant Protection, 2024, 51(1): 237−248. (in Chinese)
[9] SONODA T, URAGAMI A, KAJI K. Evaluation of Asparagus officinalis cultivars for resistance to stem blight by using a novel inoculation method [J]. HortScience, 1997, 32(6): 1085−1086. DOI: 10.21273/HORTSCI.32.6.1085
[10] 杨迎青, 李湘民, 孟凡, 等. 芦笋茎枯病抗性鉴定方法的建立及芦笋抗病种质资源的筛选 [J]. 植物病理学报, 2012, 42(6):649−654. DOI: 10.3969/j.issn.0412-0914.2012.06.014 YANG Y Q, LI X M, MENG F, et al. Establishment of a resistance-identification method on Asparagus stem blight and evaluation of Asparagus officinalis germplasms [J]. Acta Phytopathologica Sinica, 2012, 42(6): 649−654. (in Chinese) DOI: 10.3969/j.issn.0412-0914.2012.06.014
[11] 阮宏椿, 石妞妞, 杜宜新, 等. 9个芦笋品种在福建的适应性分析 [J]. 农学学报, 2017, 7(11):31−34. DOI: 10.11923/j.issn.2095-4050.cjas17010013 RUAN H C, SHI N N, DU Y X, et al. 9 Asparagus varieties in Fujian: Adaptability analysis [J]. Journal of Agriculture, 2017, 7(11): 31−34. (in Chinese) DOI: 10.11923/j.issn.2095-4050.cjas17010013
[12] 李俊萍, 乜兰春, 王珊珊, 等. 茎枯病菌毒素制备及对芦笋愈伤组织抗性诱导的研究 [J]. 植物病理学报, 2016, 46(1):140−144. LI J P, NIE L C, WANG S S, et al. Phomopsis asparagi toxin preparation and the resistance induction on Asparagus callus by the pathogen toxin [J]. Acta Phytopathologica Sinica, 2016, 46(1): 140−144. (in Chinese)
[13] 孙丽萍, 时焦, 孟坤, 等. 利用赤星病菌毒素快速高通量鉴定烟草抗性种质的方法研究 [J]. 中国烟草科学, 2014, 35(1):80−84. SUN L P, SHI J, MENG K, et al. Investigation on the method of rapid identifying resistant tobacco germplasms to Alternaria alternata by using its mycotoxins [J]. Chinese Tobacco Science, 2014, 35(1): 80−84. (in Chinese)
[14] 杨迎青, 兰波, 胡水秀, 等. 几种因素对芦笋茎枯病菌分生孢子器和分生孢子产生量的影响 [J]. 植物保护学报, 2015, 42(4):517−522. YANG Y Q, LAN B, HU S X, et al. Effects of several factors on the production of pycnidia and conidia in Asparagus stem blight pathogen [J]. Journal of Plant Protection, 2015, 42(4): 517−522. (in Chinese)
[15] 孙大元, 张景欣, 陈冠州, 等. 空间诱变选育抗稻瘟病水稻品种研究进展与展望 [J]. 核农学报, 2017, 31(2):271−279. DOI: 10.11869/j.issn.100-8551.2017.02.0271 SUN D Y, ZHANG J X, CHEN G Z, et al. Achievements and perspective outlook of space induced mutation breeding for the rice blast resistance [J]. Journal of Nuclear Agricultural Sciences, 2017, 31(2): 271−279. (in Chinese) DOI: 10.11869/j.issn.100-8551.2017.02.0271
[16] 丁燕芳, 平文丽, 孙计平, 等. 烟草黑胫病抗性鉴定方法比较及其相关性分析 [J]. 湖北农业科学, 2017, 56(18):3477−3480. DING Y F, PING W L, SUN J P, et al. Comparison of methods to identify resistance to tobacco black shank disease and their correlation analysis [J]. Hubei Agricultural Sciences, 2017, 56(18): 3477−3480. (in Chinese)
[17] 贺红, 温雁鹰, 许仕仰, 等. 广藿香抗青枯病鉴定方法的研究 [J]. 广州中医药大学学报, 2011, 28(3):301−305. HE H, WEN Y Y, XU S Y, et al. Study on bacterial-wilt-resistance identification methods for Pogostemon cablin (Blanco) Benth [J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2011, 28(3): 301−305. (in Chinese)
[18] 王铭, 臧丽丽, 范凯, 等. 黄萎病菌毒素联合法鉴定棉花对黄萎病的抗性 [J]. 中国农业科学, 2015, 48(9):1678−1688. DOI: 10.3864/j.issn.0578-1752.2015.09.02 WANG M, ZANG L L, FAN K, et al. A combined identification method for the Verticillium wilt resistance in cotton by using pathogen toxin [J]. Scientia Agricultura Sinica, 2015, 48(9): 1678−1688. (in Chinese) DOI: 10.3864/j.issn.0578-1752.2015.09.02
[19] 周淼平, 姚金保, 张鹏, 等. 小麦幼苗纹枯病抗性评价新方法 [J]. 江苏农业学报, 2017, 33(1):61−66. DOI: 10.3969/j.issn.1000-4440.2017.01.010 ZHOU M P, YAO J B, ZHANG P, et al. New method for the resistance evaluation of wheat sharp eyespot in seedling [J]. Jiangsu Journal of Agricultural Sciences, 2017, 33(1): 61−66. (in Chinese) DOI: 10.3969/j.issn.1000-4440.2017.01.010
[20] 兰海燕. 几种向日葵菌核病抗性鉴定方法的比较 [J]. 植物保护, 2000, 26(6):26−28. DOI: 10.3969/j.issn.0529-1542.2000.06.011 LAN H Y. Comparison of several identification methods of sunflower resistance to Sclerotinia sclerotiorum [J]. Plant Protection, 2000, 26(6): 26−28. (in Chinese) DOI: 10.3969/j.issn.0529-1542.2000.06.011




 下载:
下载: