Multiomically Quantified Effects of Nematode Invasion on Pinus massoniana
-
摘要:目的 探究松材线虫入侵对寄主马尾松的影响。方法 以4年生马尾松(Pinus massoniana)为试材,以皮接法接入5 000条松材线虫的马尾松为处理组[PWN(+)组],以接入无菌水的马尾松为对照组[PWN(−)组],基于多组学(表型组学、转录组学、宏基因组学、代谢组学)量化松材线虫入侵马尾松14 d后的变化。结果 与PWN(−)组相比,PWN(+)组活性氧(ROS)含量和H2O2含量分别显著上升3.2倍和1.7倍(P<0.05);编码应激反应通路的c60547.graph_c0、c82953.graph_c0在PWN(+)组中的表达水平显著高于PWN(−)组(P<0.05),萜类生物合成途径通路的c64867.graph_c0、c68789.graph_c0及合胞体形成通路的c81022.graph_c0在PWN(+)组中的表达水平显著低于PWN(−)组(P<0.05);PWN(+)组的微生物多样性显著低于PWN(−)组(P<0.05),肉座菌目(Hypocreales)是其体内的优势微生物,在生物信息数据库KEGG的功能注释和丰度信息主要集中在复制修复通路、DNA复制通路(PATH:ko03030)、DNA复制蛋白通路(BR:ko03032);代谢组上、下调的差异代谢物分别有365个和351个,PWN(+)组中根皮素、熊去氧胆酸、羧苄青霉素等物质的含量会增加以抵御松材线虫的侵染,差异显著的代谢物显著富集于ABC转运蛋白通路、花生四烯酸代谢通路、类黄酮生物合成通路、甘油磷脂代谢通路。结论 当松材线虫入侵马尾松时,寄主会启动一系列复杂的防御反应。这些反应并非孤立存在,而是通过多种机制协同作用,共同应对松材线虫的侵染。上述结果有助于从多组学角度阐明松材线虫入侵对马尾松的影响,并为松材线虫病害诱导的森林衰退和寄主植物马尾松之间的相互作用提供依据。Abstract:Objective Effects of pine wood nematode (PWN) invasion on Pinus massoniana were quantified based on multiomics.Method Among 4-year-old Masson pine plants, a treatment, PWN(+), by inoculating 5 000 Bursaphelenchus xylophilus and a control, PWN(−), with the injection of sterile distilled water into the tree trunks were subjected to a 14 d post-inoculation followed by a quantified study including phenomics, transcriptome, microbiome, and metabolome.Result The pine trees in the PWN(+) group significantly increased over control on the contents of the reactive oxygen species (ROS) by 3.2-fold and hydrogen peroxide (H2O2) by 1.7-fold (P<0.05), on the expressions of c60547.graph_c0 and c82953.graph_c0 in the unigenes encoding stress responsive pathways (P<0.05), as well as on the expressions of c64867.graph_c0 and c68789.graph_c0 in the terpenoid biosynthesis pathways; and significantly lower on the c81022.graph_c0 in syncytium formation (P<0.05) and the microbial diversity (P<0.05). Hypocreales was the dominant order of microorganisms in the PWN(+) group. The functional annotations and abundance information from the KEGG database were mainly related to the replication and repair pathways, DNA replication pathway (PATH:ko03030), and DNA replication protein pathway (BR:ko03032). There were 365 upregulated and 351 downregulated differentially regulated metabolites in the metabolome. Metabolites like phloretin, ursodiol, and carbenpenicillin were notably enriched in the ABC transporters pathway, arachidonic acid metabolism, flavonoid biosynthesis, and glycerophospholipid metabolism in the PWN-infected pine wood to resist the invasion.Conclusion After PWN was inoculated in Masson pine, the host responded with a series of complex defensive reactions initiated by various mechanisms. Through multiomics, some such interactions between the species were unveiled providing clues for combating forestry declination by the infestation.
-
0. 引言
【研究意义】松材线虫病又称松树萎蔫病[1],被国际公认为最具危险性和毁灭性的松树疫病,是一种重大的检疫性森林病害,号称“松树的癌症”,具有蔓延迅速、发病时间短且致病力强、难防治、毁灭性强等特点[2]。松材线虫(Bursaphelenchus xylophilus,PWN)是松材线虫病的病原体,主要以墨天牛属(Monochamus spp. )昆虫为媒介进行传播[3],在我国南方地区以马尾松(Pinus massoniana)为主要寄主。探明松材线虫与寄主马尾松间的互作机理是探明松材线虫成灾机制并开发高效防治策略的重要前提。【前人研究进展】目前通过探索寄主、PWN和昆虫媒介之间的生态和遗传联系,开展了大量研究来揭示松材线虫病的致病机制[4, 5],现已提出了几个关键的致病因素,即寄主中活性氧(ROS)的异常调控、抗性基因的表达、代谢物的调控以及PWN-昆虫载体的共同进化,为松材线虫病的防治提供新的见解[6−9]。ROS的异常调节是松材线虫病最重要的早期症状[10],ROS在生物新陈代谢中具有重要作用,其产生的代谢物质是生物体内一类重要的信号物质[11]。植物抗病防御相关基因则在植物受侵染后的抗病能力调节中发挥作用[12],因此,对马尾松抗性基因的动态表达的研究至关重要,这有助于深入了解这些基因在马尾松抗病防御过程中的作用,并揭露其隐藏的机制。植物相关微生物群落为寄主植物提供了多种有益的优势,如病原体抗性[13]。研究发现松树的内生细菌和真菌受到PWN入侵的影响,寄主内生菌群的多样性随着松材线虫病的严重程度而增加[14, 15]。此外,一些产生次生代谢物的内生细菌已被证明在松材线虫病的防治中发挥作用,可生产抗生素并作为对抗PWN的生物控制剂[14, 16]。根据分析寄主植物在受到病原物侵染后的代谢产物和代谢途径,能够深入了解植物如何应对松材线虫(PWN)的入侵[17]。【本研究切入点】截至目前,大多数研究仅收集了单一的组学数据,缺乏多维度多变量的系统完整认知,这些数据仅提供了关于松材线虫病的知识片段[13],缺乏组学间的联动。【拟解决的关键问题】以4年生马尾松为研究材料,对有无PWN侵染的马尾松进行多组学协同分析,从多组学角度来探讨马尾松对PWN的防御机制,同步获取微生物群落、基因表达模式以及代谢物信息,建立不同类型数据间的动态关联,对松材线虫病传播多层次和多组学的整体调控具有较好的代表性,明晰PWN入侵前后马尾松体内的ROS变化、抗性反应特征、微生物的群落结构及代谢物变化,以期优化现有的整体防控体系,为松材线虫病的早期诊断提供依据,进而为开发长效防控机制提供理论依据。
1. 材料与方法
1.1 供试材料
1.1.1 马尾松的来源
供试4年生马尾松幼苗由福建省三明市沙县官庄国有林场(
26.5603 ° N,117.7455 ° E)提供。1.1.2 PWN的来源
选择2龄且健康的PWN作为供试PWN[11],来源于福建省福州市林业科学研究院。
1.2 试验方法
1.2.1 马尾松的培养
马尾松在接种前先在福建农林大学海峡联合研究院植物生长室中培养2个月,生长室培养条件:光周期16L∶8D,光照度1 000 lx;温度28 ℃(光)/24 ℃(暗),湿度70%。
1.2.2 PWN的培养
首先在超净工作台内,挑取盘多毛孢菌(Pestalotia spp.)菌丝于马铃薯-葡萄糖-琼脂培养基(Potato Dextrose Agar,PDA)平板上,25 ℃下黑暗培养5 d,菌丝基本长满平板。从培养松材线虫的菌板即线虫生长培养基(Nematode Growth Medium,NGM)上挑取松材线虫到盘多毛孢菌的菌丝上,25 ℃黑暗培养,待盘多毛孢菌被线虫取食尽,再次将其转接到PDA上的盘多毛孢菌中扩繁,培养好的PWN可4 ℃保存[18]。使用贝尔曼漏斗法[19]从载有PWN的培养基中分离出PWN,24 h后收集于10 mL离心管中,3 000 r·min−1离心5 min,去除上清液。将各离心管中的PWN汇集并混匀,配制成悬浊液。随机吸取1 mL PWN悬浊液于显微镜下观察计数,重复该步骤50次,计算每微升悬浊液中的PWN数量,最终制备成每毫升含5 000条PWN的悬浊液。
1.2.3 马尾松接种松材线虫
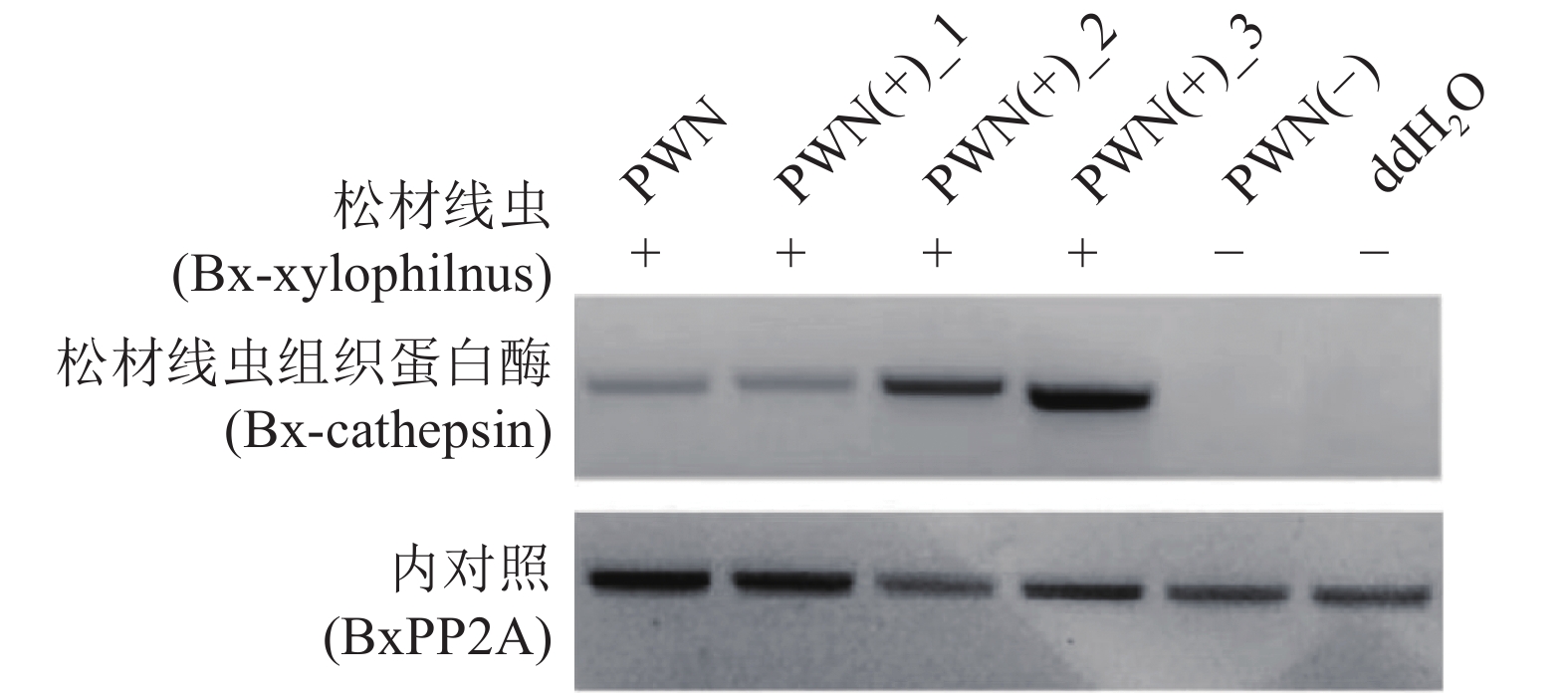
取株高、生长状况一致的健康马尾松幼苗用于接种松材线虫,采用人工皮接法[20],在距离马尾松基部10 cm的主茎的一侧用无菌刀片斜切出长度约1 cm的伤口,伤口深至木质部,剖开树皮,继而在伤口内固定一个经灭菌处理的脱脂棉球。用封口膜将棉球固定形成斜漏斗状,将树皮和棉球包围其中。用封口膜缠紧漏斗下部,用镊子夹紧接口处和下部,确保不漏水;最后用微量移液器往棉球中注入1 mL的上述松材线虫悬浊液(5 000 条·mL−1),以接种无菌水(ddH2O)的马尾松作为对照,分别记作PWN(+)组和PWN(−)组。收集处理14 d后的马尾松接种伤口以上10 cm处的茎干及松针,立即放入液氮中并储存在−80 ℃ 冰箱中,用于后续试验。
为验证松材线虫接种效率,采用MoBio PowerSoil DNA分离试剂盒(货号12855-50,MoBio,美国)提取每株马尾松茎干的总基因组DNA。采用NanoDrop 2000光度计(Thermo Fisher Scientific,USA)对DNA的浓度和质量进行检测。完整性分析通过1%(质量分数)的琼脂糖凝胶电泳来完成。提取的DNA在−20 ℃下储存备用。将上述马尾松幼苗分离出的DNA作为模板,通过PCR反应进一步验证,扩增出条带代表有效接种。以Internal control作为内参引物,以Bx-cathepsin作为扩增的目的引物[21]并列于表1。
表 1 特异引物Table 1. Specific primers引物名称
Primer name正向引物
Forward primer(5′-3′)反向引物
Reverse primer(5′-3′)内对照
BxPP2AAACGTCATTTCTAGCCGCCA TCAGCCCTACAAACCCCTCT Bx-cathepsin TTGCATTCTACGGCCAGTCC ACTGACTTTCGATGGCTCCG c60547.graph_c0 TAAATTCCAAGTGCCCCGCA ACCGTGATACACATTTCAGA c64867.graph_c0 AAATCGTGTGTGTCCCTGCA GGTTGCAATGATAACGGCCC c68789.graph_c0 CGCCCGAATCTCTGCACTTA TCGATGGTCTTGGTGATGGC c81022.graph_c0 TTGGCTGTACAGATTCCCGT ACCTATGGATGTCTGCTCCA c82953.graph_c0 ACTGTTAACCTGGCTCACGG CTACGCAAATTCACCGCCAC 1.2.4 寄主马尾松中氧化应激指标
取PWN(+) 组和PWN(−) 组的马尾松针叶研磨成粉末,ROS定量参照苏州格锐思生物科技有限公司的ROS含量试剂盒(货号ROS-1-Y,科铭生物技术有限公司,中国苏州)。H2O2定量试验参照苏州格锐思生物科技有限公司的过氧化氢含量试剂盒(货号G0112W,微板法96样)。采用SPSS 26.0进行单因素方差分析(ANOVA Tukey)来确定各组之间的差异。
1.2.5 寄主马尾松中抗性基因转录水平的定量分析
用Trizol试剂(Invitrogen,美国)从PWN(+)组和PWN(−)组马尾松针叶的总RNA,通过PrimeScriptTM RT试剂盒(TaKaRa,日本)逆转录为cDNA。马尾松体内抗松材线虫基因参照蔡守平等[21]研究中筛选出来的抗性基因(编码应激反应通路的c60547.graph_c0、c82953.graph_c0,萜类生物合成途径通路的c64867.graph_c0、c68789.graph_c0及合胞体形成通路的c81022.graph_c0)合成相应的检测引物,根据 HieffTM qPCR SYBR Green Master Mix(Low Rox Plus,叶森,中国上海)操作步骤,使用QuantStudio 6 Flex PCR(ABI,MA,美国)扩增仪进行实时荧光定量聚合酶链反应(qRT-PCR)分析,特异性引物和参考基因列于表1中。应用2−ΔΔCT方法计算PST相对表达水平[22]。设置3个生物学重复,3个技术性重复,通过单因素方差分析(ANOVA Tukey检验)确定各组之间差异的显著性水平,使用R软件(版本4.1.1)绘制聚类分组热图。
1.2.6 寄主马尾松样品的宏基因组测序与分析
将PWN(+) 组的马尾松针叶取5个样品等量混合作为1个试验样本,PWN(−)组作相同处理,将混合好的2组样本在液氮中粉碎。使用 MoBio PowerSoil DNA 分离试剂盒(12855-50,MoBio,United States)从每个样品中提取总基因组 DNA, 采用NanoDrop 2000分光光度计(Thermo Fisher Scientific,United States)测量DNA的数量和质量。然后,通过超声破碎机将DNA破碎成300 bp左右的片段,作为测序文库。而后,所有DNA测序文库在北京奥维森基因科技有限公司的Illumina HiSeq平台上进行高通量测序。测序过程中,使用Illumina Analysis Pipeline v2进行图像分析、碱基读取和误差评估。测序完成后使用Trimmomatic 软件对原始数据进行质控,包括去除接头序列和低质量数据。保留的高质量测序数据与NR数据库进行比较,得到样品中微生物群落的组成信息;此外,通过计算Alpha多样性、香农 (Shannon-Wiener index)和辛普森 (Simpson index)多样性指数表示寄主马尾松中微生物的多样性;以上分类和多样性计算均使用DIAMOND 中的相关软件包完成[23]。
1.2.7 代谢组测序和分析
代谢组测序使用的样品与宏基因组测序一致,样品的准备按Jia 等[23]的方法进行。样品经Agilent 1290 Infinity LC 超高效液相色谱系统(UHPLC)分离后,用 Triple TOF
6600 质谱仪进行质谱分析,分别采用电喷雾电离正离子和负离子模式进行检测。设置流动相的流速为0.35 mL·min−1,流动相为0.1%甲酸水溶液(A)(A117-50,Thermo Fisher Scientific,Waltham,MA,USA)和0.1%甲酸的乙腈溶液(B)(A998-4,Thermo Fisher Scientific,Waltham,MA,USA),柱温为45 ℃,自动进样器温度为4 ℃,进样体积为5 μL。而后,按照Jia等 [23] 的方法,从测序数据中对代谢物进行定量和主成分分析,并筛选差异代谢物。2. 结果与分析
2.1 松材线虫接种效果的评估
松材线虫的接种效果如图1所示,PWN(+)_1、PWN(+)_2、PWN(+)_3(接种松材线虫的马尾松)扩增出松材线虫目的基因的特异性条带,且条带大小与阳性对照PWN(松材线虫)扩增出的特异性条带大小相同,而PWN(−)(注射ddH2O的马尾松)和阴性对照双蒸水(ddH2O)没有扩增出特异性条带,说明本试验使用的人工皮接法可以使松材线虫成功接入到马尾松幼苗中。
2.2 松材线虫入侵引起寄主马尾松氧化应激指标的变化
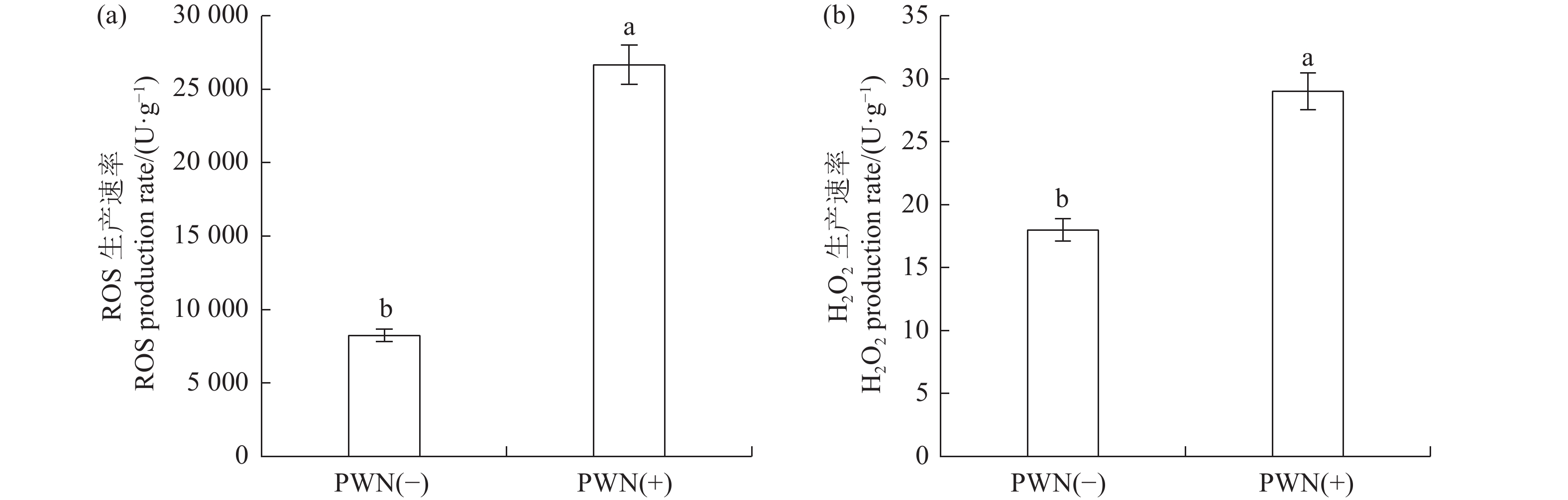
ROS作为植物抗性反应中一种十分重要的信号物质[24],H2O2是植物光呼吸过程中的代谢产物,具有较高的跨膜通透性且化学性质较为稳定,当植物受到生物或非生物刺激时,它能够诱导植物体内抗氧化保护酶活性的改变,是ROS中主要的信号分子,在防卫反应中扮演重要角色[11]。本研究在接种第14天测定ROS含量以量化松材线虫的致病性,结果表明,PWN(+)(接种松材线虫的马尾松)体内的ROS含量和H2O2含量均显著高于PWN(−)(接种ddH2O的马尾松)(P<0.05),其中,ROS含量提高了3.2倍,H2O2含量提高了1.7倍(图2)。
2.3 松材线虫入侵对寄主马尾松抗性基因表达量的变化
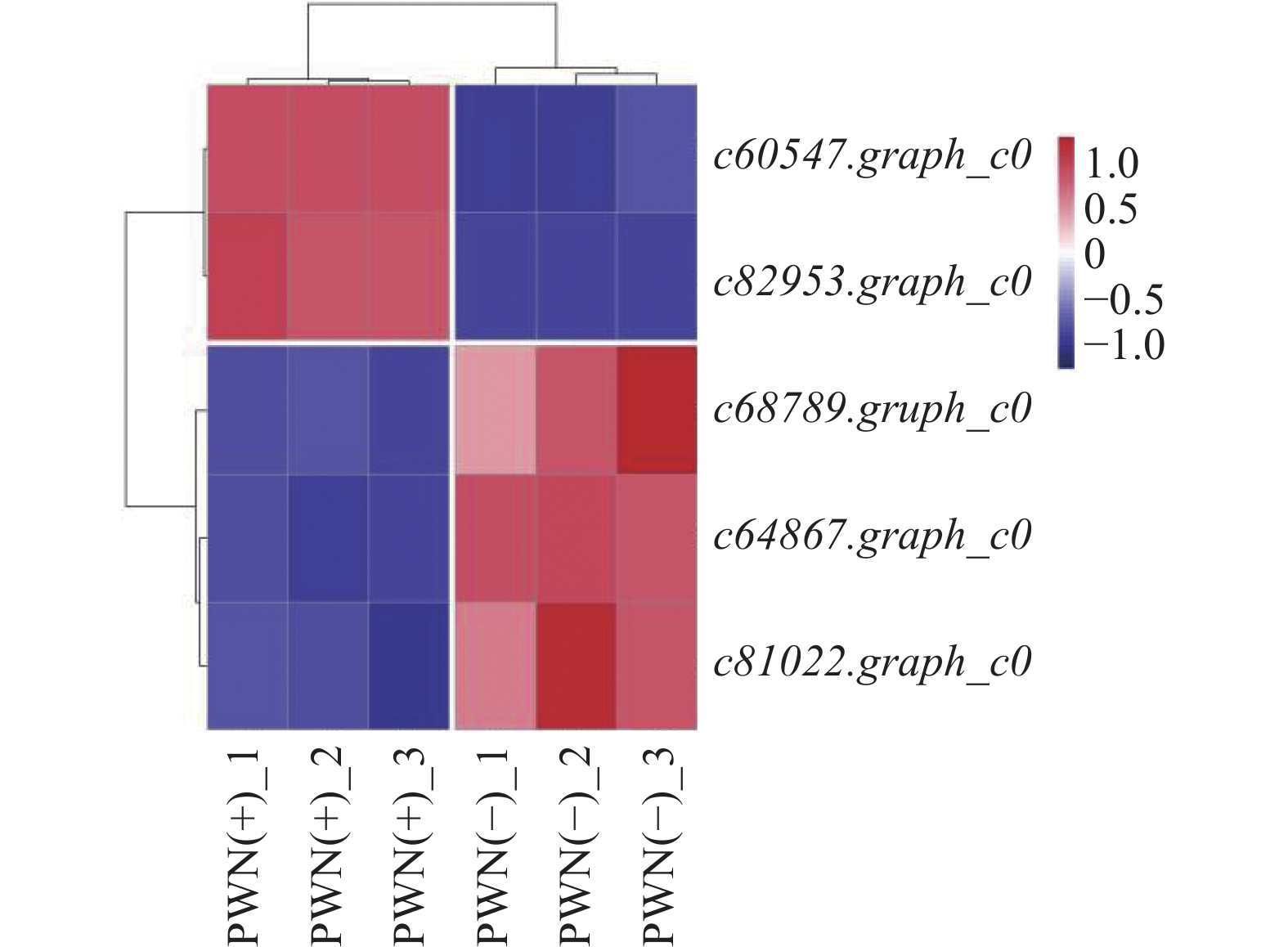
通过对2组马尾松体内抗松材线虫基因表达量进行定量,结果表明c60547.graph_c0、c82953.graph_c0在PWN(+)组中的表达水平显著高于PWN(−)组(P<0.05),c64867.graph_c0、c68789.graph_c0、c81022.graph_c0在PWN(+)组中的表达水平显著低于PWN(−)组(P<0.05)(图3)。
2.4 松材线虫入侵对寄主马尾松宏基因组的变化
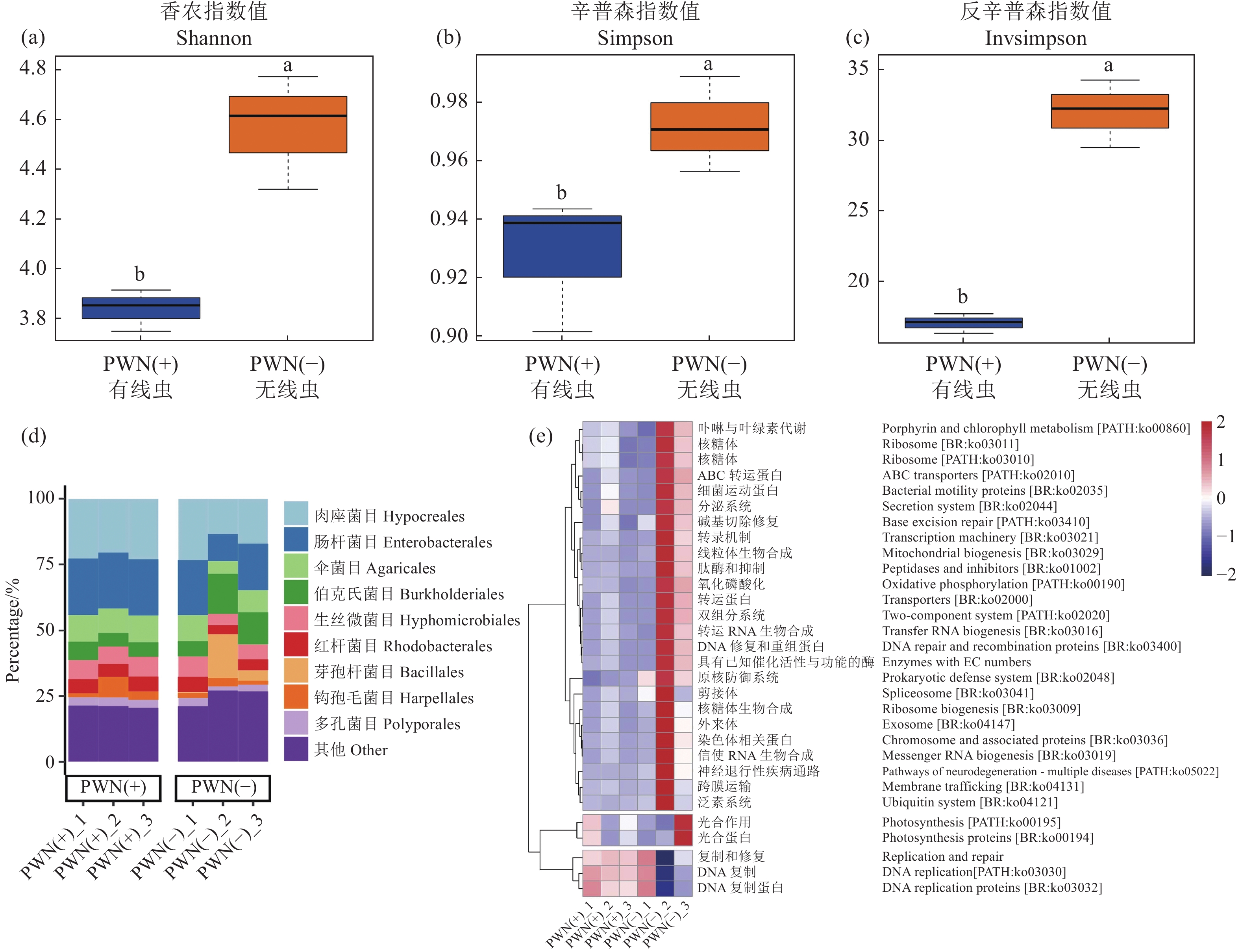
Alpha多样性主要用于衡量一定生境内或样品内生物种类菌群多样性情况,PWN (−)组的Shannon指数(图4a)、Simpson指数(图4b)、Invsimpson指数(图4c)均显著高于PWN (+)组,说明松材线虫入侵后会显著降低马尾松体内微生物的多样性和物种集中性。
![]() 图 4 不同处理条件下马尾松微生物群的多样性和结构功能不同处理组微生物群落的多样性Shannon(a)、Simpson(b)、Invsimpson(c)指数差异,不同小写字母代表差异显著(P<0.05);(d)代表样本在目水平上的聚类柱状图;(e)样本微生物在KEGG level3水平上具有显著性差异的功能预测。Figure 4. Diversity and structural functions of microflora in P. massoniana under varied conditionsDiversity of microbial communities in different sample groups differed in Shannon (a), Simpson (b), and Invsimpson (c) indexes; different lowercase letters represented significant differences at P<0.05; d: clustering histogram of samples at order level; e: functional prediction of microorganisms at KEGG level 3.
图 4 不同处理条件下马尾松微生物群的多样性和结构功能不同处理组微生物群落的多样性Shannon(a)、Simpson(b)、Invsimpson(c)指数差异,不同小写字母代表差异显著(P<0.05);(d)代表样本在目水平上的聚类柱状图;(e)样本微生物在KEGG level3水平上具有显著性差异的功能预测。Figure 4. Diversity and structural functions of microflora in P. massoniana under varied conditionsDiversity of microbial communities in different sample groups differed in Shannon (a), Simpson (b), and Invsimpson (c) indexes; different lowercase letters represented significant differences at P<0.05; d: clustering histogram of samples at order level; e: functional prediction of microorganisms at KEGG level 3.根据宏基因组测序分析得到的有效序列注释结果,选取各样品在目水平上相对丰度高于1%且前10的物种,生成物种累积相对丰度图,结果表明PWN (+) 组和PWN (−)组的优势目(图4d)均为肉座菌目(Hypocreales)>肠杆菌目(Enterobacterales)>伞菌目(Agaricales)>伯克氏菌目(Burkholderiales),但单胞菌目(Hyphomicrobiales)的相对丰度在PWN (+) 组<PWN (−)组。
如第三层级KEGG功能注释显著差异功能堆积柱状图(图4e)所示,PWN (+)组有3条通路丰度高于PWN (−)组:复制修复通路(Replication and repair)、DNA复制通路[DNA replication (PATH:ko030300)]、DNA复制蛋白通路[DNA replication proteins(BR:ko03032)]。
2.5 松材线虫入侵对寄主马尾松代谢组的变化
对2组马尾松代谢物的化学成分进行主成分分析,结果表明两组样本得分差异显著,样本全部处于95%置信区间内,第一主成分(PC1)的贡献率为15.6%,正交主成分(PC2)得分为81.6%,两个主成分的贡献率之和为97.2%(图5a)。在两个处理组的马尾松中共检测到2 072个代谢物。将筛选差异代谢物的结果以火山图(volcano plot)的形式进行可视化(图5b),共筛选到716个差异代谢物,其中PWN (+)组相对于PWN (−)组上调的差异代谢物有365个,占比51%,下调的差异代谢物有351个,占比49%。不同代谢物在PLS-DA模型第一主成分的变量投影重要度(Variable Importance in the Projection, VIP)显示前20个代谢物,说明两个处理组的样本间差异较大(图5c),其中3-Hydroxy-1-(3-hydroxy-4-methoxyphenyl)-2-{4-[(1E)-3-hydroxy-1-propen-1-yl]-2-methoxyphe-noxy}propyl-beta-D-glucopyranosid、根皮素(Phloretin)、熊去氧胆酸(Ursodiol)、鼠李蒽酚(Cascaroside D)、舍吲哚(Sertindole)、促微丝聚合剂(Jasplakinolide)、17-trifluoromethylphenyl trinor PGF2alpha isopropyl ester、羧苄青霉素(Carbenicillin)、前列腺素C2(Prostaglandin C2)这9个代谢物在PWN (+)组的含量中显著高于PWN (−)组中。KEGG通路的气泡图(只展示top 20的结果)如图5d所示,其中差异代谢物主要富集在ABC转运蛋白(ABC transporters)通路、花生四烯酸代谢(Arachidonic acid metabolism)通路、类黄酮生物合成(Flavonoid biosynthesis)通路、甘油磷脂代谢(Glycerophospholipid metabolism)通路等。聚类热图分析显示PWN (+)和PWN (−)两个处理组间诱导的代谢物组成不同(图5e)。
![]() 图 5 松材线虫入侵前后诱导的马尾松代谢物组成(a) 不同处理的OPLS-DA图;(b)不同处理间差异代谢物筛选火山图;(c)不同处理的差异代谢物VIP散点图。显示基于VIP值的前20种差异代谢物;(d)不同处理的代谢通路分析气泡图。(e)不同处理的所有差异代谢物的层次聚类分析热图。Figure 5. Metabolites in P. massoniana before and after PWN inoculation(a) OPLS-DA plots for different treatments; (b) differential metabolite screening volcano plot between different groups; (c)VIP scatter plots of differentially differentiated metabolites in different groups; top 20 differential metabolites based on VIP values are displayed; (d)Bubble map of metabolic pathway analysis in different groups;(e) Hierarchical cluster analysis heat map of all differential metabolites of groups.
图 5 松材线虫入侵前后诱导的马尾松代谢物组成(a) 不同处理的OPLS-DA图;(b)不同处理间差异代谢物筛选火山图;(c)不同处理的差异代谢物VIP散点图。显示基于VIP值的前20种差异代谢物;(d)不同处理的代谢通路分析气泡图。(e)不同处理的所有差异代谢物的层次聚类分析热图。Figure 5. Metabolites in P. massoniana before and after PWN inoculation(a) OPLS-DA plots for different treatments; (b) differential metabolite screening volcano plot between different groups; (c)VIP scatter plots of differentially differentiated metabolites in different groups; top 20 differential metabolites based on VIP values are displayed; (d)Bubble map of metabolic pathway analysis in different groups;(e) Hierarchical cluster analysis heat map of all differential metabolites of groups.3. 讨论与结论
松材线虫是当前林业发展面临的主要威胁之一,松树在受到松材线虫侵染后,其表型组、转录组、微生物组及代谢组均会产生明显变化,共同激发寄主马尾松的抗逆反应[1, 3]。在众多寄主植物应对病原物的防卫反应中,作为信号分子的H2O2、ROS等会在病原物入侵后迅速产生并参与寄主植物对病原物的过敏性反应[25]。叶建仁[2]曾指出当松材线虫入侵寄主后,寄主会通过产生大量的活性氧(ROS)和萜烯类物质等化学防御物质来抵抗或抑制松材线虫的入侵。俞禄珍等[26]的研究发现黑松受松材线虫侵染后树体内ROS活性和NO含量均升高,胡龙娇等[27]研究表明H2O2含量的积累对松树抗病性具有重要的影响,何龙喜等[11, 28]的研究表明不同抗性松树体内H2O2、ROS含量等活性的变化差异均与其抗性密切相关。陈玉惠等[29]研究表明在不同抗性松树与松材线虫互作早期,仅有感病松树接种松材线虫后H2O2不断上升,意味着活性氧及其相关酶产生特异变化在松材线虫病的发生发展中起着相当关键的作用。本研究通过松材线虫侵入寄主马尾松后的表型组学数据进行测定,发现PWN(+)组中的ROS及H2O2含量均会显著增高(P<0.05),这与前人的研究结果一致,说明松材线虫侵入马尾松体内后,寄主植物马尾松会产生防御反应,ROS和H2O2含量是马尾松受松材线虫侵染后介导抗病信号转导的重要信号物质。
基因表达分析为深入了解基因功能提供了关键的信息,已经在多个领域得到了广泛应用,其深入研究探索了疾病、非生物胁迫等相关基因表达和调控机制,揭示了生命活动的变化规律[30]。本研究利用qPCR检测松材线虫侵染下的马尾松中相关抗性基因的动态表达情况,结果发现PWN(+)组中c60547.graph_c0和c82953.graph_c0这两个基因的表达水平均显著(P<0.05)高于PWN(-)组,说明属于编码应激反应通路的这两个抗性基因在马尾松抗松材线虫病中与ROS呈正相关;而萜类生物合成途径通路的c64867.graph_c0和c68789.graph_c0以及合胞体形成通路c81022.graph_c0在PWN(+)组的表达水平则显著(P<0.05)低于PWN(-)组,说明这3个抗性基因在马尾松抗松材线虫病中与ROS呈负相关,将不利于马尾松的解毒作用而导致植株系统抗性的不断减弱,可见本试验中马尾松的基因表达量会受松材线虫的影响。这与Liu等[30]的研究结果一致。同时Han等[31]的研究也表明,松树会响应松材线虫的抗性基因发生表达,意味着松材线虫的入侵能够激发马尾松幼苗启动一系列复杂的早期防御机制。谢婉凤等[32]也研究了松材线虫侵染对马尾松基因表达的影响,发现松材线虫侵染致使马尾松中的信号传递与抗病防御相关的基因表达受到抑制,破坏其系统抗性。
物种多样性是生物多样性的核心,反映了生物群落结构的复杂性,是体现群落结构发展阶段及稳定性的一种表现形式[33]。Shannon和Simpson指数分别反映物种多样性大小和集中程度,是评价微生物群落多样性的重要指标[34]。本研究通过对松材线虫入侵寄主植物马尾松进行宏基因组分析发现,PWN(−) 组的微生物多样性均高于PWN(+)组,这表明由于松材线虫的侵染降低了马尾松微生物的多样性,温晓健等[35]通过对松材线虫侵染前后马尾松树体内微生物多样性进行分析,发现健康马尾松树体内的真菌多样性高于枯死马尾松,但健康和枯死马尾松的细菌群落具有一定的相似性,这与本研究结果一致。松树体内的微生物种群与松材线虫病的发生和发展密切相关,本研究结果表明优势真菌是肉座菌目(Hypocreales)且相对丰度PWN(+)组>PWN(−)组,Al Khoury等[36]研究发现肉座菌目(Hypocreales)长期以来一直被认为是害虫防治剂的重要微生物,朱兆香等[37]研究表明肉座菌目(Hypocreales)具有较强的杀伤能力,因而作为生物防治制剂广泛使用。可见PWN侵染后马尾松Hypocreales相对丰度的增加,可能是马尾松应对PWN的生物防治策略。
通过对两组马尾松代谢物进行分析,发现PWN(+)组高于PWN(−)组的差异代谢物主要有根皮素、熊去氧胆酸、羧苄青霉素等。根皮素是一种二氢查耳酮类黄酮,它可提高机体的抗氧化能力,抵御细胞毒性[38],抑制体内自由基异常积累[39],本研究结果中PWN(+)组中氧化性指标物质ROS及H2O2含量显著高于PWN(−)组,从而说明根皮素的升高可保护植物免受氧化损伤。熊去氧胆酸对脂质代谢至关重要,可减少细胞周期调控蛋白的表达,具有降脂和免疫调节等重要特性[40]。羧苄青霉素是一种半合成青霉素抗生素,对革兰氏阴性菌具有广谱的抗菌活性,可以干扰细菌的细胞壁合成,同时对植物组织显示出低毒性[41]。差异显著的代谢物显著富集于ABC转运蛋白通路、花生四烯酸代谢通路、类黄酮生物合成通路、甘油磷脂代谢通路。其中,ABC转运蛋白通路功能为主动向胞外排放种类繁多的内源或外源毒素,包括真菌自身产生的侵染寄主植物所需的真菌毒素、其他拮抗微生物所产生的抗生素和植物防御性物质等[42]。花生四烯酸调节多种脂质信号介质的生理反应和病理过程,包括细胞增殖、凋亡、代谢和迁移,具有促炎症和促细胞凋亡作用[43]。植物体中类黄酮合成途径是目前研究的最为清楚的次生代谢途径,周科等[44]表明具有抗病性的类黄酮生物合成通路,与植物抗逆境胁迫直接相关。赵琳儒等[45]曾在研究中表明甘油磷脂代谢通路在细胞膜融合、胞饮作用、膜运转作用及膜中酶的催化活性等方面起着重要作用,同时也在维持细胞膜结构和功能过程中发挥着优势。这说明松材线虫的入侵,激发了寄主马尾松产生与抗病和抗逆有关的防御性次生代谢物来对抗各种胁迫。
综上,本研究结果表明当松材线虫入侵马尾松时,寄主会启动一系列复杂的防御反应,这些反应并非孤立存在,而是通过多种机制协同作用,共同激发寄主马尾松的抗性反应,应对松材线虫的侵染。这对于全面深入认识松材线虫病的致病机理和寻找新的防治途径有着十分重要的意义。在未来的工作中,我们将通过筛选一系列能够在松树体内能够轻易定植并大量繁殖的功能性微生物或次生代谢物,通过人工外源导入的方式实现植物抗性的提升却不占有植物生长发育的资源,从而提供更有效的大规模虫害综合治理策略。
-
图 4 不同处理条件下马尾松微生物群的多样性和结构功能
不同处理组微生物群落的多样性Shannon(a)、Simpson(b)、Invsimpson(c)指数差异,不同小写字母代表差异显著(P<0.05);(d)代表样本在目水平上的聚类柱状图;(e)样本微生物在KEGG level3水平上具有显著性差异的功能预测。
Figure 4. Diversity and structural functions of microflora in P. massoniana under varied conditions
Diversity of microbial communities in different sample groups differed in Shannon (a), Simpson (b), and Invsimpson (c) indexes; different lowercase letters represented significant differences at P<0.05; d: clustering histogram of samples at order level; e: functional prediction of microorganisms at KEGG level 3.
图 5 松材线虫入侵前后诱导的马尾松代谢物组成
(a) 不同处理的OPLS-DA图;(b)不同处理间差异代谢物筛选火山图;(c)不同处理的差异代谢物VIP散点图。显示基于VIP值的前20种差异代谢物;(d)不同处理的代谢通路分析气泡图。(e)不同处理的所有差异代谢物的层次聚类分析热图。
Figure 5. Metabolites in P. massoniana before and after PWN inoculation
(a) OPLS-DA plots for different treatments; (b) differential metabolite screening volcano plot between different groups; (c)VIP scatter plots of differentially differentiated metabolites in different groups; top 20 differential metabolites based on VIP values are displayed; (d)Bubble map of metabolic pathway analysis in different groups;(e) Hierarchical cluster analysis heat map of all differential metabolites of groups.
表 1 特异引物
Table 1 Specific primers
引物名称
Primer name正向引物
Forward primer(5′-3′)反向引物
Reverse primer(5′-3′)内对照
BxPP2AAACGTCATTTCTAGCCGCCA TCAGCCCTACAAACCCCTCT Bx-cathepsin TTGCATTCTACGGCCAGTCC ACTGACTTTCGATGGCTCCG c60547.graph_c0 TAAATTCCAAGTGCCCCGCA ACCGTGATACACATTTCAGA c64867.graph_c0 AAATCGTGTGTGTCCCTGCA GGTTGCAATGATAACGGCCC c68789.graph_c0 CGCCCGAATCTCTGCACTTA TCGATGGTCTTGGTGATGGC c81022.graph_c0 TTGGCTGTACAGATTCCCGT ACCTATGGATGTCTGCTCCA c82953.graph_c0 ACTGTTAACCTGGCTCACGG CTACGCAAATTCACCGCCAC -
[1] 田世光, 刘晓. 松材线虫病综合防控技术、存在的问题与防控对策 [J]. 温带林业研究, 2021, 4(3):5−10. DOI: 10.3969/j.issn.2096-4900.2021.03.002 TIAN S G, LIU X. Comprehensive prevention and control techniques, existing problems and countermeasures of Bursaphelenchus xylophilus disease [J]. Journal of Temperate Forestry Research, 2021, 4(3): 5−10. (in Chinese) DOI: 10.3969/j.issn.2096-4900.2021.03.002
[2] 叶建仁. 松材线虫病在中国的流行现状、防治技术与对策分析 [J]. 林业科学, 2019, 55(9):1−10. YE J R. Epidemic status of pine wilt disease in China and its prevention and control techniques and counter measures [J]. Scientia Silvae Sinicae, 2019, 55(9): 1−10. (in Chinese)
[3] 理永霞, 张星耀. 松材线虫病致病机理研究进展 [J]. 环境昆虫学报, 2018, 40(2):231−241. LI Y X, ZHANG X Y. Research advance of pathogenic mechanism of pine wilt disease [J]. Journal of Environmental Entomology, 2018, 40(2): 231−241. (in Chinese)
[4] ZHAO L L, MOTA M, VIEIRA P, et al. Interspecific communication between pinewood nematode, its insect vector, and associated microbes [J]. Trends in Parasitology, 2014, 30(6): 299−308. DOI: 10.1016/j.pt.2014.04.007
[5] ESPADA M, SILVA A C, EVES VAN DEN AKKER S, et al. Identification and characterization of parasitism genes from the pinewood nematode Bursaphelenchus xylophilus reveals a multilayered detoxification strategy [J]. Molecular Plant Pathology, 2016, 17(2): 286−295. DOI: 10.1111/mpp.12280
[6] ZHAO L L, ZHANG X X, WEI Y N, et al. Ascarosides coordinate the dispersal of a plant-parasitic nematode with the metamorphosis of its vector beetle [J]. Nature Communications, 2016, 7: 12341. DOI: 10.1038/ncomms12341
[7] SHINYA R, MORISAKA H, TAKEUCHI Y, et al. Making headway in understanding pine wilt disease: What do we perceive in the postgenomic era? [J]. Journal of Bioscience and Bioengineering, 2013, 116(1): 1−8. DOI: 10.1016/j.jbiosc.2013.01.003
[8] WEN T Y, WU X Q, HU L J, et al. A novel pine wood nematode effector, BxSCD1, suppresses plant immunity and interacts with an ethylene-forming enzyme in pine [J]. Molecular Plant Pathology, 2021, 22(11): 1399−1412. DOI: 10.1111/mpp.13121
[9] SAJNAGA E, SKOWRONEK M, KALWASIŃSKA A, et al. Nanopore-sequencing characterization of the gut microbiota of Melolontha melolontha larvae: Contribution to protection against entomopathogenic nematodes? [J]. Pathogens, 2021, 10(4): 396. DOI: 10.3390/pathogens10040396
[10] ZHANG W, ZHAO L L, ZHOU J, et al. Enhancement of oxidative stress contributes to increased pathogenicity of the invasive pine wood nematode [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2019, 374(1767): 20180323. DOI: 10.1098/rstb.2018.0323
[11] 何龙喜, 吴小芹, 俞禄珍, 等. 不同抗性松树与松材线虫互作中H2O2及其氧化酶活性的差异 [J]. 南京林业大学学报(自然科学版), 2010, 34(6):13−17. HE L X, WU X Q, YU L Z, et al. The difference of H2O2 and oxidative enzyme in the interaction of different resistance pines and Bursaphelenchus xylophilus [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2010, 34(6): 13−17. (in Chinese)
[12] SANTOS C S, PINHEIRO M, SILVA A I, et al. Searching for resistance genes to Bursaphelenchus xylophilus using high throughput screening [J]. BMC Genomics, 2012, 13: 599. DOI: 10.1186/1471-2164-13-599
[13] NOMAN M, AHMED T, IJAZ U, et al. Plant-microbiome crosstalk: Dawning from composition and assembly of microbial community to improvement of disease resilience in plants [J]. International Journal of Molecular Sciences, 2021, 22(13): 6852. DOI: 10.3390/ijms22136852
[14] PROENÇA D N, GRASS G, MORAIS P V. Understanding pine wilt disease: Roles of the pine endophytic bacteria and of the bacteria carried by the disease-causing pinewood nematode [J]. MicrobiologyOpen, 2017, 6(2): e00415. DOI: 10.1002/mbo3.415
[15] LIU Y R, PONPANDIAN L N, KIM H, et al. Distribution and diversity of bacterial endophytes from four Pinus species and their efficacy as biocontrol agents for devastating pine wood nematodes [J]. Scientific Reports, 2019, 9: 12461. DOI: 10.1038/s41598-019-48739-4
[16] QIN S, XING K, JIANG J H, et al. Biodiversity, bioactive natural products and biotechnological potential of plant-associated endophytic Actinobacteria [J]. Applied Microbiology and Biotechnology, 2011, 89(3): 457−473. DOI: 10.1007/s00253-010-2923-6
[17] 李硕. 转录组和代谢组联合分析油松对松材线虫的早期响应[D]. 沈阳: 沈阳农业大学, 2022. LI S. Analysis of early response of Pinus tabulaeformis to Bursaphelenchus xylophilus by transcriptome and metabolome[D]. Shenyang: Shenyang Agricultural University, 2022. (in Chinese)
[18] 王新荣, 朱孝伟, 胡月清, 等. 松墨天牛携带的松材线虫PCR检测技术 [J]. 林业科学, 2009, 45(7):70−75. DOI: 10.3321/j.issn:1001-7488.2009.07.012 WANG X R, ZHU X W, HU Y Q, et al. A PCR-based method for detecting Bursaphelenchus xylophilus from Monochamus alternatus [J]. Scientia Silvae Sinicae, 2009, 45(7): 70−75. (in Chinese) DOI: 10.3321/j.issn:1001-7488.2009.07.012
[19] 冯士明. 简介松材线虫的分离方法 [J]. 云南林业, 2005, 26(2):29. FENG S M. Brief introduction to the separation method of pine wood nematode [J]. Yunnan Forestry, 2005, 26(2): 29. (in Chinese)
[20] 张治宇, 张克云, 林茂松, 等. 不同松材线虫群体对黑松的致病性测定 [J]. 南京农业大学学报, 2002, 25(2):43−46. ZHANG Z Y, ZHANG K Y, LIN M S, et al. Pathogenicity determination of Bursaphelenchus xylophilus isolates to Pine thunbergii [J]. Journal of Nanjing Agricultural University, 2002, 25(2): 43−46. (in Chinese)
[21] CAI S P, JIA J Y, HE C Y, et al. Multi-omics of pine wood nematode pathogenicity associated with culturable associated microbiota through an artificial assembly approach [J]. Frontiers in Plant Science, 2021, 12: 798539.
[22] FAN C J, MA J M, GUO Q R, et al. Selection of reference genes for quantitative real-time PCR in bamboo (Phyllostachys edulis) [J]. PLoS One, 2013, 8(2): e56573. DOI: 10.1371/journal.pone.0056573
[23] JIA J Y, CHEN L, YU W J, et al. The novel nematicide chiricanine A suppresses Bursaphelenchus xylophilus pathogenicity in Pinus massoniana by inhibiting Aspergillus and its secondary metabolite, sterigmatocystin [J]. Frontiers in Plant Science, 2023, 14: 1257744. DOI: 10.3389/fpls.2023.1257744
[24] 贾燕涛. 植物抗病信号转导途径 [J]. 植物学通报, 2003, 38(5):602−608. JIA Y T. Plant disease resistance signaling pathways [J]. Chinese Bulletin of Botany, 2003, 38(5): 602−608. (in Chinese)
[25] BORDEN S, HIGGINS V J. Hydrogen peroxide plays a critical role in the defence response of tomato to Cladosporium fulvum [J]. Physiological and Molecular Plant Pathology, 2002, 61(4): 227−236. DOI: 10.1006/pmpp.2002.0435
[26] 俞禄珍, 吴小芹, 叶建仁, 等. H2O2在黑松-松材线虫早期互作应答中的调控作用 [J]. 中国科学: 生命科学, 2013, 43(4):351−360. DOI: 10.1360/052012-274 YU L Z, WU X Q, YE J R, et al. The role of hydrogen peroxide during the early interactions between Pinus thunbergii and Bursaphelenchus xylophilus [J]. Scientia Sinica (Vitae), 2013, 43(4): 351−360. (in Chinese) DOI: 10.1360/052012-274
[27] 胡龙娇, 吴小芹. 松树抗松材线虫病机制研究进展 [J]. 生命科学, 2018, 30(6):659−666. HU L J, WU X Q. Research progress on the mechanism of pine response to the infection of Bursaphelenchus xylophilus [J]. Chinese Bulletin of Life Sciences, 2018, 30(6): 659−666. (in Chinese)
[28] 何龙喜, 吴小芹, 俞禄珍. 不同松树与松材线虫互作中超氧自由基差异与病变的关系 [J]. 南京林业大学学报(自然科学版), 2011, 35(2):25−30. HE L X, WU X Q, YU L Z. The relationship between difference of superoxide anion and lesion in the interaction of different varieties of pines and Bursaphelenchus xylophilus [J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2011, 35(2): 25−30. (in Chinese)
[29] 陈玉惠, 叶建仁, 魏初奖, 等. 松材线虫对黑松、湿地松幼苗活性氧代谢的影响 [J]. 南京林业大学学报(自然科学版), 2002, 26(4):19−22. CHEN Y H, YE J R, WEI C J, et al. Effects of pine wood nematode infection on metabolism of active oxygen in Japanese black pine and slash pine seedlings [J]. Journal of Nanjing Forestry University, 2002, 26(4): 19−22. (in Chinese)
[30] LIU Q H, WEI Y C, XU L Y, et al. Transcriptomic profiling reveals differentially expressed genes associated with pine wood nematode resistance in Masson pine (Pinus massoniana Lamb. ) [J]. Scientific Reports, 2017, 7: 4693. DOI: 10.1038/s41598-017-04944-7
[31] HAN G, MANNAA M, KIM N, et al. Response of pine rhizosphere microbiota to foliar treatment with resistance-inducing bacteria against pine wilt disease [J]. Microorganisms, 2021, 9(4): 688. DOI: 10.3390/microorganisms9040688
[32] 谢婉凤, 梁光红, 张飞萍. 松材线虫侵染对马尾松基因表达的影响 [J]. 森林与环境学报, 2018, 38(4):481−487. XIE W F, LIANG G H, ZHANG F P. Effect of Bursaphelenchus xylophilus infestation to the gene expression of Pinus massoniana [J]. Journal of Forest and Environment, 2018, 38(4): 481−487. (in Chinese)
[33] VIEIRA L C, DA SILVA D K A, DA SILVA I R, et al. Ecological aspects of arbuscular mycorrhizal fungal communities in different habitat types of a Brazilian mountainous area [J]. Ecological Research, 2019, 34(1): 182−192. DOI: 10.1111/1440-1703.1061
[34] TONG R, ZHOU B Z, JIANG L N, et al. The growth of Chinese fir is limited by nitrogen: Evidences from N: P ratio, N or P variability and NuRE based on a regional investigation [J]. Forest Ecology and Management, 2020, 460: 117905. DOI: 10.1016/j.foreco.2020.117905
[35] 温晓健, 巫建军, 李永先, 等. 松材线虫侵染前后马尾松树体内微生物多样性分析 [J]. 林业科学研究, 2022, 35(1):48−58. WEN X J, WU J J, LI Y X, et al. Microbial diversity analysis of Pinus massoniana before and after infected by pine wood nematode [J]. Forest Research, 2022, 35(1): 48−58. (in Chinese)
[36] AL KHOURY C. Can colonization by an endophytic fungus transform a plant into a challenging host for insect herbivores? [J]. Fungal Biology, 2021, 125(12): 1009−1016. DOI: 10.1016/j.funbio.2021.08.001
[37] 朱兆香, 庄文颖. 木霉属研究概况 [J]. 菌物学报, 2014, 33(6):1136−1153. ZHU Z X, ZHUANG W Y. Current understanding of the genus Trichoderma (Hypocreales, Ascomycota) [J]. Mycosystema, 2014, 33(6): 1136−1153. (in Chinese)
[38] AN R B, PARK E J, JEONG G S, et al. Cytoprotective constituent of hoveniae lignum on both hep G2 cells and rat primary hepatocytes [J]. Archives of Pharmacal Research, 2007, 30(6): 674−677. DOI: 10.1007/BF02977626
[39] MARIADOSS A V A, VINAYAGAM R, XU B J, et al. Phloretin loaded chitosan nanoparticles enhance the antioxidants and apoptotic mechanisms in DMBA induced experimental carcinogenesis [J]. Chemico-Biological Interactions, 2019, 308: 11−19. DOI: 10.1016/j.cbi.2019.05.008
[40] 尤梅桂. 熊去氧胆酸的研究概况 [J]. 药学研究, 2021, 40(3):199−202. YOU M G. Overview of research on ursodeoxycholic acid [J]. Journal of Pharmaceutical Research, 2021, 40(3): 199−202. (in Chinese)
[41] SCOTT R E, ROBSON H G. Synergistic activity of carbenicillin and gentamicin in experimental Pseudomonas bacteremia in neutropenic rats [J]. Antimicrobial Agents and Chemotherapy, 1976, 10(4): 646−651. DOI: 10.1128/AAC.10.4.646
[42] 刘艳青, 赵永芳. ABC转运蛋白结构与转运机制的研究进展 [J]. 生命科学, 2017, 29(3):223−229. LIU Y Q, ZHAO Y F. Structure and mechanism of ABC transporter [J]. Chinese Bulletin of Life Sciences, 2017, 29(3): 223−229. (in Chinese)
[43] 法博涛. 细胞色素蛋白CYP450家族特殊代谢现象的探索[D]. 上海: 上海交通大学, 2015. FA B T. Exploration of special metabolic phenomenon in CYP450 family[D]. Shanghai: Shanghai Jiao Tong University, 2015. (in Chinese)
[44] 周科, 徐千惠, 霍晓薇, 等. 杨树受溃疡病菌侵染初期的转录组 [J]. 东北林业大学学报, 2019, 47(3):100−106. DOI: 10.3969/j.issn.1000-5382.2019.03.019 ZHOU K, XU Q H, HUO X W, et al. Transcriptome of poplars with early response to Lonsdalea quercina subsp. populi infection [J]. Journal of Northeast Forestry University, 2019, 47(3): 100−106. (in Chinese) DOI: 10.3969/j.issn.1000-5382.2019.03.019
[45] 赵琳儒, 何盼, 李杰, 等. 柴芩宁神颗粒改善失眠大鼠睡眠作用的海马代谢组学研究 [J]. 中国中药杂志, 2022, 47(7):1921−1931. ZHAO L R, HE P, LI J, et al. Sleep-improving mechanism of Chaiqin Ningshen Granules in insomnia rats: Based on hippocampal metabonomics [J]. China Journal of Chinese Materia Medica, 2022, 47(7): 1921−1931. (in Chinese)




 下载:
下载: