Preparation and Application of Polyclonal Antibody of Chilli Veinal Mottle Virus Capsid
-
摘要:目的 辣椒脉斑驳病毒(Chilli veinal mottle virus, ChiVMV)是茄科植物生产上危害最严重的病毒之一,也是口岸检疫的对象。本研究旨在制备特异性强的ChiVMV外壳蛋白的多克隆抗体并用于田间病株的检测。方法 通过RT-PCR方法扩增ChiVMV贵州烟草分离物外壳蛋白基因的全长(861 bp)和部分片段(396 bp),分别重组至原核表达载体pET28a中,转化Escherichia coli BL21后进行诱导表达,表达产物层析分离和透析纯化后免疫大耳兔制备多克隆抗体,最后使用酶联免疫吸附法(ELISA)、Western blot等方法检测抗体效价和特异性。结果 成功制备了ChiVMV外壳蛋白的两种多克隆抗体antiCP1-287aa、antiCP1-132aa,抗体效价分别为1∶6400、1∶12800;两种抗体antiCP1-287aa、antiCP1-132aa均能通过Western blot方法检测到抗原;田间病株的间接ELISA检测显示,antiCP1-132aa能特异性检测ChiVMV病株,未能检测到马铃薯Y病毒(Potato virus Y, PVY)病株,而antiCP1-287aa无法区分这两种病株。结论 多克隆抗体antiCP1-132aa的特异性较强,可用于ChiVMV田间病株的检测,也为ChiVMV外壳蛋白的功能研究奠定基础。Abstract:Objective A highly specific polyclonal antibody of the capsid of chilli veinal mottle virus (ChiVMV) was prepared for field detection and quarantine inspection on infected Solanaceae plants.Methods The full-length (861 bp) and partial fragment (396 bp) of the gene from a ChiVMV GZ-Tabacco isolate were amplified using RT-PCR, recombined into the prokaryotic expression vector pET28a, and transformed into E. coil BL21 for induced expression. After chromatographic isolation and dialysis purification, the products were used to immunize Dahl rabbits for the antibody preparation. Potency and specificity of the candidate antibodies were evaluated by ELISA and western blot.Results Two polyclonal antibodies, namely antiCP1-287aa and antiCP1-132aa with the titers of 1∶6400 and 1∶12800, respectively, were obtained. Both positively detected the antigen as shown by western blot. But the indirect ELISA on the field strains revealed that antiCP1-132aa specifically detected ChiVMV not potato virus Y (PVY), whereas antiCP1-287aa failed to differentiate the two.Conclusion The identified polyclonal antibody, antiCP1-132aa was highly specific in detecting ChiVMV in field tests. It could become a useful tool for further studies on the infectious virus of chilli peppers.
-
0. 引言
【研究意义】辣椒脉斑驳病毒(Chilli veinal mottle virus, ChiVMV)是马铃薯Y病毒科(Potyviridae)Y马铃薯病毒属(Potyvirus)的确定种[1−2]。近些年,该病毒在我国的扩散速度很快,给茄科植物造成了严重的经济损失[3]。病毒病俗称“ 植物癌症” ,尚无有效药剂进行防治,其防控的关键在于“预防”。因此,早期诊断尤为关键。为有效控制ChiVMV的流行和扩散,亟需建立一种可靠、快速、高效的检测鉴定方法,为辣椒、烟草等植物的病毒病诊断和控制奠定基础。【前人研究进展】1979年马来西亚首次报道ChiVMV的危害[4],2004年其基因组全序列被测定[2]。ChiVMV的自然寄主主要为辣椒、番茄等茄科作物,在田间危害时,可造成寄主植物叶片斑驳、花叶、皱缩,以及植株矮小等症状,与很多病毒病的症状相似[5]。自然条件下主要依靠蚜虫进行非持久性传播,机械传播和汁液传播等也能传播该病毒,但病毒不能通过种子传播[3, 5−6]。在我国,该病毒最早在2003年发现于陕西的线椒上,随后在海南、云南、福建、湖南、广东、广西等省有该病毒危害的报道,ChiVMV已成为我国南方地区辣椒病毒病的优势病毒种类[3, 7−13]。世界蔬菜中心(前亚洲蔬菜研究发展中心)曾对亚洲 16 个国家或地区进行调查,结果显示有 30%的辣椒受到 CHiVMV 的侵害[14−15]。不仅如此,该病毒还向其他作物扩散,其中对烟草危害最为严重,云南、安徽、四川、贵州等省烟区均发现ChiVMV造成烟草病毒病流行危害[13, 16−18]。此外,ChiVMV常与其他病毒复合侵染,造成更严重的经济损失[10, 16]。【本研究切入点】血清学技术是检测植物病毒最经济、快速、简单的方法[19−20],而市场上尚无针对ChiVMV的特异性血清学检测产品。【拟解决的关键问题】选取ChiVMV CP基因全长和属内非保守区段,原核表达并纯化相应蛋白作为抗原,免疫动物制备多克隆抗体,以期获得特异性强的多克隆抗体用于田间病株的检测。
1. 材料与方法
1.1 试验材料
原核表达载体pET28a和Escherichia coli BL21及DH5α感受态细胞系本实验室保存。ChiVMV贵州烟草分离物(登陆号:OP378160.1)感染的烟草植株于2021年采自贵州省安顺市烟区,保存于-80 ℃超低温冰箱备用。制备多克隆抗体所需的雄性日本大耳兔,购自湖北省荆州市中心医院动物研究中心。
Trizol试剂、反转录酶、2×HiFi Taq PCR StarMix以及纯化抗原所需的金属镍高流速琼脂糖亲和介质(NTA)购自北京康润诚业生物科技有限公司,胶回收试剂盒和质粒提取试剂盒购自OMEGA 公司。DNA Marker、限制性内切酶、T4 DNA Ligase和克隆载体pMD19-T 购自Takara公司,Protein Marker、ECL显色液、PVDF膜、酶标板等购自Thermo Scientific公司,TMB显色液购自碧云天生物技术有限公司,HRP标记的羊抗兔抗体购自康为世纪生物科技有限公司。
1.2 抗原基因片段的引物设计和RT-PCR扩增
使用DNAMAN软件比较ChiVMV和PVY两种病毒外壳蛋白序列的相似性,选取全长和相似性低的区段,分别设计扩增ChiVMV贵州烟草分离物外壳蛋白基因的全长和部分片段的引物,由华大基因科技有限公司合成(表1)。病株叶片总RNA提取采用Trizol试剂盒提取,反转录实验按照试剂说明进行操作,PCR扩增按照2×HiFi Taq PCR StarMix使用说明进行操作,最后PCR产物经1%琼脂糖凝胶电泳,EB染色后于凝胶成像系统(美国BioRad公司)中观察,目的PCR产物的回收参考胶回收试剂盒说明进行。
表 1 RT-PCR扩增引物Table 1. Primers for PCR amplification引物名称
Primer names序列 (5′-3′)
Primer sequences (5′-3′)扩增位置及大小
Region and length of
PCR amplificationChiVMV-CP-F CGGAATTCGCSGGAGAGAGTGTTGATGCTG 8575~8970 nt,
396 bpChiVMV-CP-R1 CCGCTCGAGAAGAATTATTTGCATCTGGTC ChiVMV-CP-F CGGAATTCGCSGGAGAGAGTGTTGATGCTG 8575~9435 nt,
861 bpChiVMV-CP-R2 CCGCTCGAGTATTCCCCGAACGCCCAGCAGATTG 划线位置为酶切位点。
The underlined position is the enzyme cleavage site.1.3 抗原原核表达载体的构建及表达
将目的片段与克隆载体pMD19-T连接,然后转入E.coil DH5α感受态细胞,转化液涂布含氨苄青霉素的LB培养基上过夜培养,然后菌落PCR筛选阳性克隆,阳性克隆委托武汉华大基因有限公司测序验证。提取测序结果正确的阳性克隆质粒,双酶切后回收目的片段。使用T4 DNA Ligase连接目的片段和线性化的pET28a质粒,连接产物的转化和阳性克隆筛选如前所述。构建好抗原基因片段的原核表达载体后,将其转入E.coil BL21感受态细胞,转化液涂布于含卡那霉素的LB培养基上过夜培养,阳性克隆验证后37 ℃培养至OD600值约为0.6~0.8,然后加入IPTG(使培养液终浓度为1 mmol·L−1),28 ℃继续培养4 h;诱导表达后收集菌体,使用1×PBS缓冲液重悬菌体再加入5×蛋白上样缓冲液,沸水中煮5 min后12 000 r·min−1离心5 min点样检测,电泳结束后取出SDS-PAGE胶用考马斯亮蓝染色120 min,染色结束后用脱色液脱色。
1.4 抗原蛋白的可溶性分析及纯化
诱导表达后,收集菌体并加入10 mL细胞裂解液,置于37 ℃培养箱裂解30 min,然后使用超声细胞破碎仪破碎细胞裂解液10 min。取1 mL的破碎样品于3500 r·min−1离心3 min,沉淀用8 mol·L−1尿素溶解,然后用蛋白上样缓冲液(5×SDS-PAGE Loading Buffer )处理上清和沉淀,沸水煮5 min点样检测,电泳结束后染色和脱色,观察和判断抗原蛋白的可溶性。根据抗原的可溶性,选择上清或沉淀,通过0.22 μm无菌滤膜,滤液通过Ni2+-NTA 层析柱纯化获得抗原蛋白。
1.5 抗原蛋白的透析复性及多克隆抗体制备
层析纯化的抗原蛋白需要透析去盐,具体步骤参考文献[21]进行。透析完后,使用真空冷冻干燥机(上海比朗仪器制造有限公司)干燥得到纯化的、粉末状的抗原蛋白,收集后置于−80 ℃保存备用。抗原蛋白免疫动物参照文献[22]的方法,将纯化的抗原蛋白置于研钵中,加入适量的生理盐水和费氏完全佐剂进行充分研磨,然后进行皮下肌肉多点注射新西兰大白兔;之后每隔 7 d 加强免疫 1 次,共加强免疫 4 次(使用生理盐水和不完全佐剂进行匀浆)。免疫 5 次后取大白兔动脉血,37 ℃静置 1 h,4 ℃静置过夜,离心收集上清液,即为制备的含多克隆抗体的抗血清。
1.6 抗血清效价测定及其检测应用
取0.1 g 病株叶片,加入1 mL 0.01 mol·L−1 PBS提取缓冲液(pH 7.4)充分碾磨,12 000 r·min−1离心1 min取上清,每孔加入100 μL上清作为抗原,设置两组重复,以健康叶片作为阴性对照,重复上述操作。抗血清从1∶200稀释比开始进行倍比稀释,利用间接酶联免疫吸附分析法测定抗血清效价。提取健康的和感染ChiVMV的本氏烟总蛋白,将5 mg原核表达产物溶于PBS倍比稀释,通过Western blot方法检测抗血清的灵敏度。对试验田中已确定病原的39株烟草病毒病病株,使用制备的多克隆抗体通过间接ELISA方法检测,记录OD450值后分析检测结果。
2. 结果与分析
2.1 抗原选择及引物设计
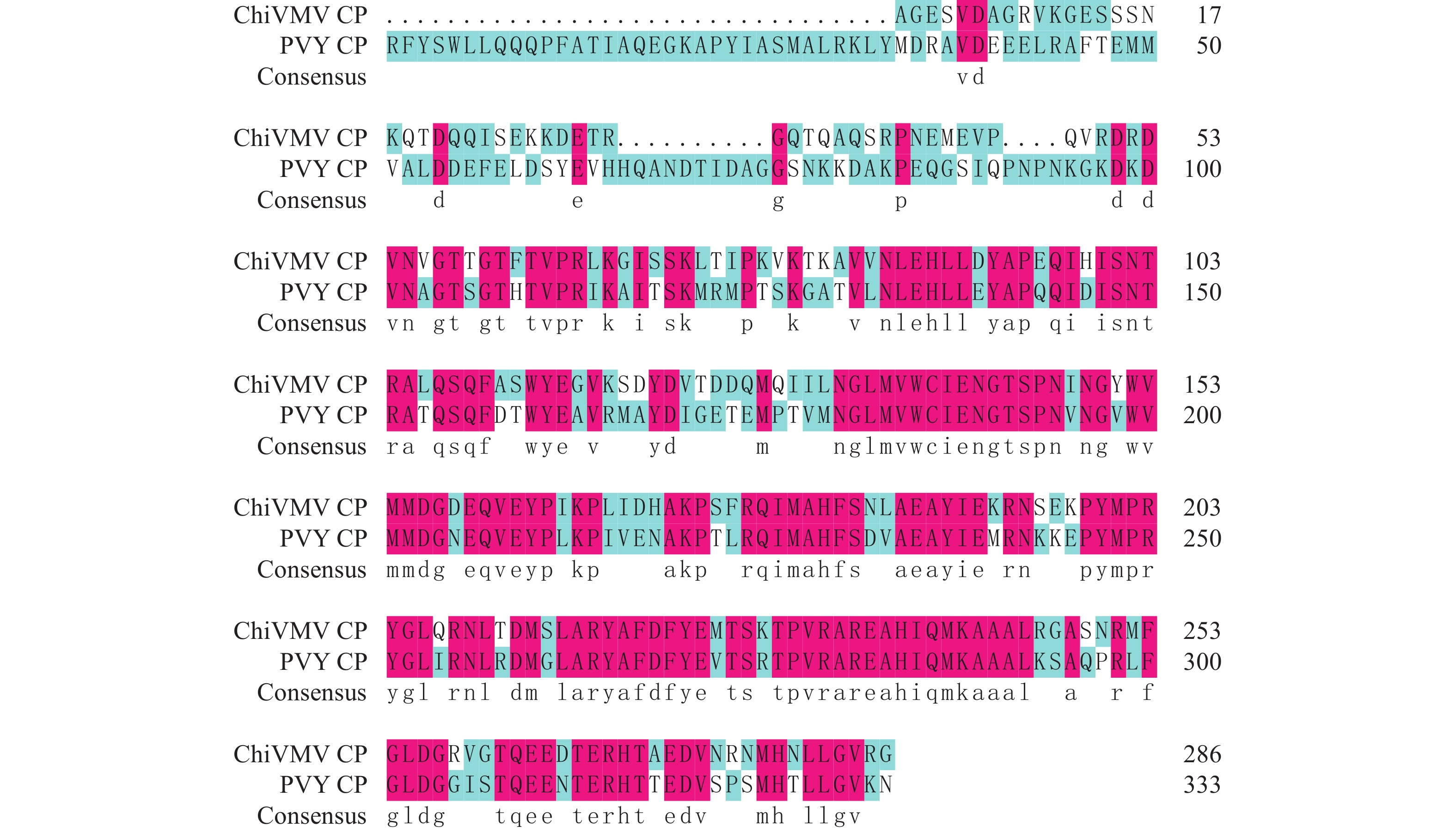
序列分析发现马铃薯Y病毒属成员之间的CP蛋白相似性较高,ChiVMV与PVY的CP蛋白氨基酸序列比较(图1)结果表明,前半部分变异较大,后半部分相对保守。以CP蛋白全长作为抗原制备的多克隆抗体可能特异性不强,而以相似性低的非保守区段作为抗原,可能会得到特异性较强的多克隆抗体。因此,同时选取ChiVMV CP全长(287 aa)以及相似性低的非保守区域(132 aa)作为抗原,设计相应基因片段的扩增引物(表1)。
2.2 抗原相应基因片段扩增和表达载体构建
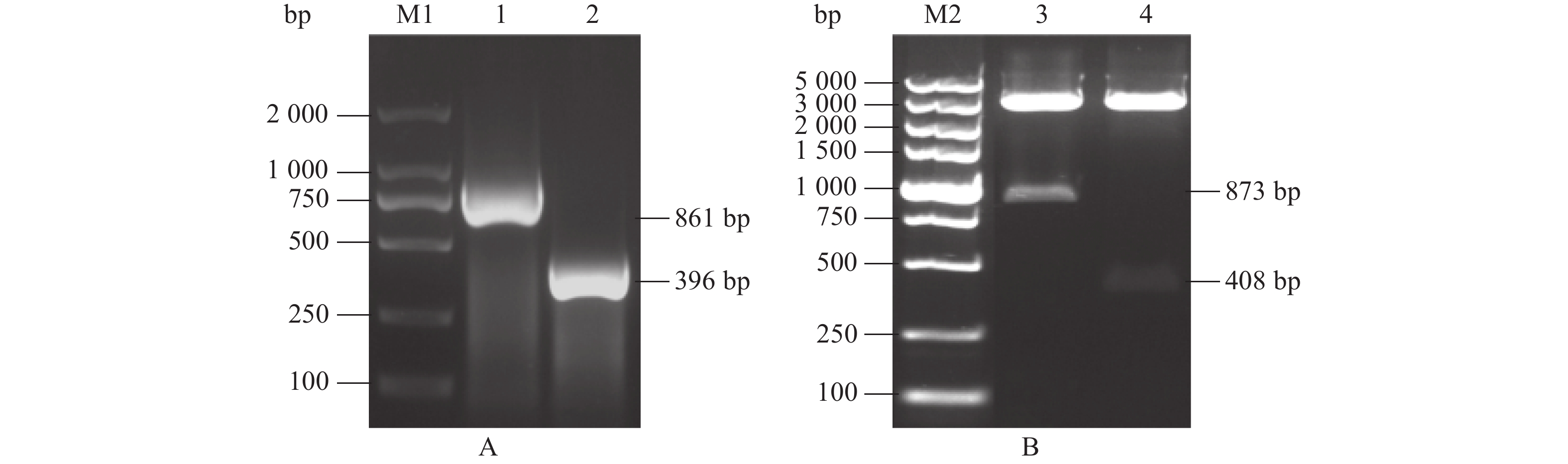
通过RT-PCR方法扩增出ChiVMV CP基因的目的DNA片段(图2),条带大小与预期相符。利用双酶切和T4 DNA连接酶等将目的片段重组至原核表达载体pET28a上,重组质粒分别标记为pET28a-ChiVMV-CP1-132aa和pET28a-ChiVMV-CP1-287aa。重组质粒双酶切验证,显示片段插入成功(图2)。测序结果显示重组质粒插入的基因片段序列正确,无 缺失、位移,说明两种抗原的原核表达载体构建成功。
![]() 图 2 两种抗原相应基因片段的扩增及其表达载体构建M1、M2,核酸分子标准DL2000、DL5000 (宝生物);A:1、2,ChiVMV CP1-287aa和CP1-132aa序列扩增;B:3、4,ChiVMV CP1-287aa和CP1-132aa重组质粒双酶切Figure 2. Amplification and expression vector construction of corresponding gene fragments of two antigensM1, M2: DL2000 DNA marker DL2000, DL5000 (Takara); A: 1, 2, amplification of ChiVMV CP1-287aa and CP1-132aa fragment; B: 3, 4, double enzyme digestion of recombinant plasmid of ChiVMV CP1-287aa and CP1-132aa fragment
图 2 两种抗原相应基因片段的扩增及其表达载体构建M1、M2,核酸分子标准DL2000、DL5000 (宝生物);A:1、2,ChiVMV CP1-287aa和CP1-132aa序列扩增;B:3、4,ChiVMV CP1-287aa和CP1-132aa重组质粒双酶切Figure 2. Amplification and expression vector construction of corresponding gene fragments of two antigensM1, M2: DL2000 DNA marker DL2000, DL5000 (Takara); A: 1, 2, amplification of ChiVMV CP1-287aa and CP1-132aa fragment; B: 3, 4, double enzyme digestion of recombinant plasmid of ChiVMV CP1-287aa and CP1-132aa fragment2.3 抗原蛋白的的纯化
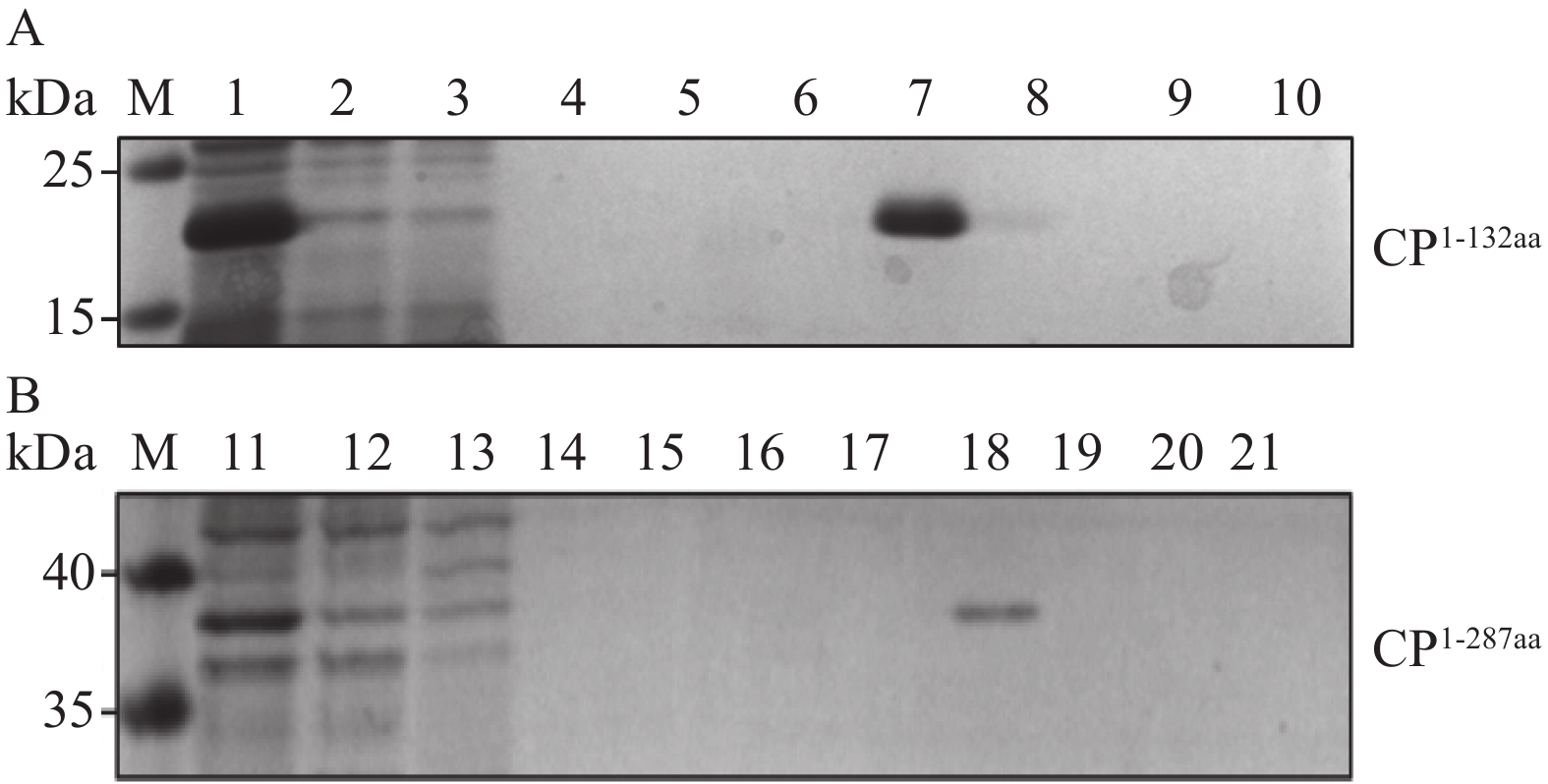
原核表达的抗原蛋白免疫动物前需要纯化。原核表达的细胞液经过超声波破碎、层析柱纯化等步骤获得抗原蛋白,检测结果如图3。图3显示抗原CP1-132aa在70 mmol·L−1咪唑洗脱液、CP1-287aa 在咪唑洗脱液80 mmol·L−1浓度下,可得到单一的条带。随后,利用透析去盐、真空冷冻干燥获得纯化的抗原蛋白粉末,于−80 ℃保存备用。
![]() 图 3 抗原蛋白的纯化M,预染蛋白分子量标准26616(赛默飞);A为CP1-132aa蛋白纯化;B为CP1-287aa蛋白纯化;1、11,未层析样品;2、12,过柱的未层析样品;3~10、13~21,不同浓度(依次为30、40、50、60、70、80、90、100、110 mmol·L−1)的咪唑洗脱液。Figure 3. Purification of antigenic proteinsM: Prestained protein Ladder 26616 (Thermo Scientific); A: for CP1-132aa protein purification; B: for CP1-287aa protein purification; 1 and 11: unstratified samples; 2 and 12: unstratified samples over the column; 3-10 and 13-21: imidazole eluates of different concentrations (i.e., 30, 40, 50, 60, 70, 80, 90, 100, and 110 mmol·L−1 in that order).
图 3 抗原蛋白的纯化M,预染蛋白分子量标准26616(赛默飞);A为CP1-132aa蛋白纯化;B为CP1-287aa蛋白纯化;1、11,未层析样品;2、12,过柱的未层析样品;3~10、13~21,不同浓度(依次为30、40、50、60、70、80、90、100、110 mmol·L−1)的咪唑洗脱液。Figure 3. Purification of antigenic proteinsM: Prestained protein Ladder 26616 (Thermo Scientific); A: for CP1-132aa protein purification; B: for CP1-287aa protein purification; 1 and 11: unstratified samples; 2 and 12: unstratified samples over the column; 3-10 and 13-21: imidazole eluates of different concentrations (i.e., 30, 40, 50, 60, 70, 80, 90, 100, and 110 mmol·L−1 in that order).2.4 多克隆抗体的制备及其效价测定
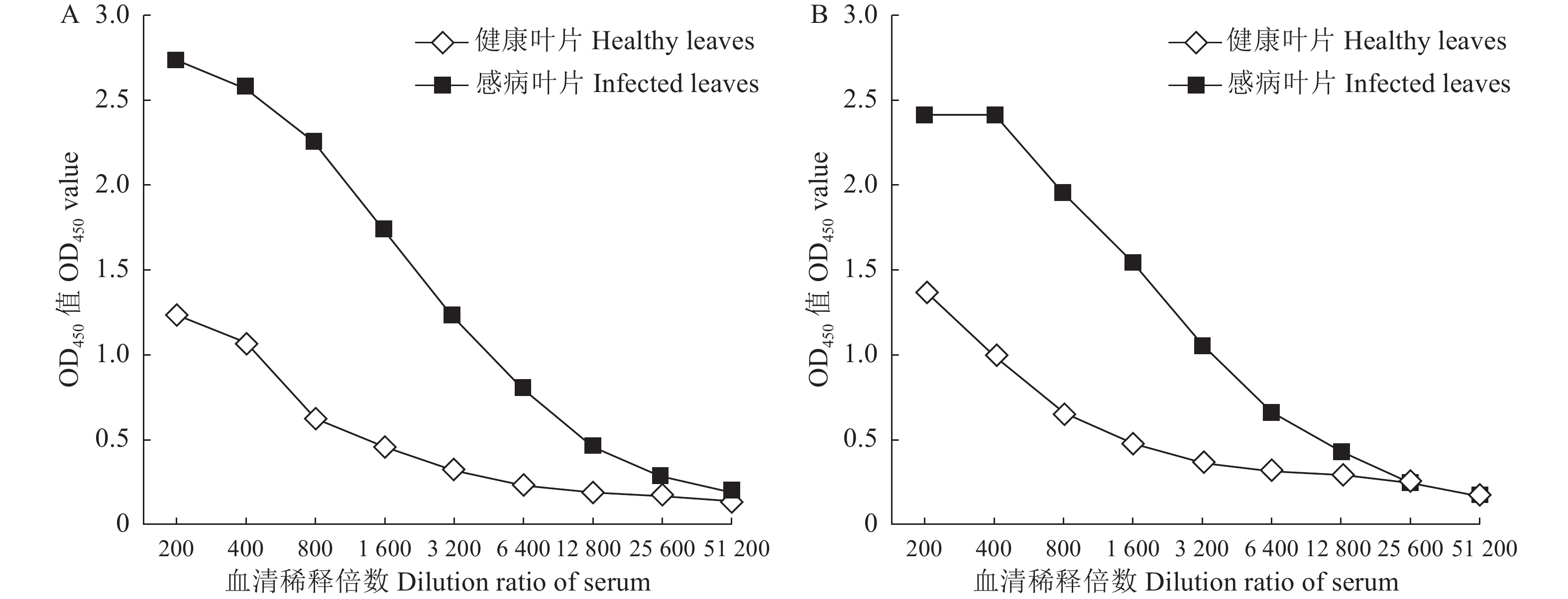
纯化的抗原蛋白与弗氏完全佐剂(FCA)或弗氏不完全佐剂(FIA)混合处理后,5次免疫动物后,获取多克隆抗体,分别标记为antiCP1-132aa、antiCP1-287aa。以健康叶片和病株叶片作为检测对象,制备的多克隆抗体作为一抗,HRP标记的羊抗兔IgG作为二抗,通过间接ELISA实验测定所制备的多克隆抗体的效价,从图4中可知,antiCP1-132aa和antiCP1-287aa在分别稀释12 800倍和6 400倍之后,不再产生阳性免疫反应,表明多克隆抗体antiCP1-132aa和antiCP1-287aa的效价分别为1∶12800和1∶6400。
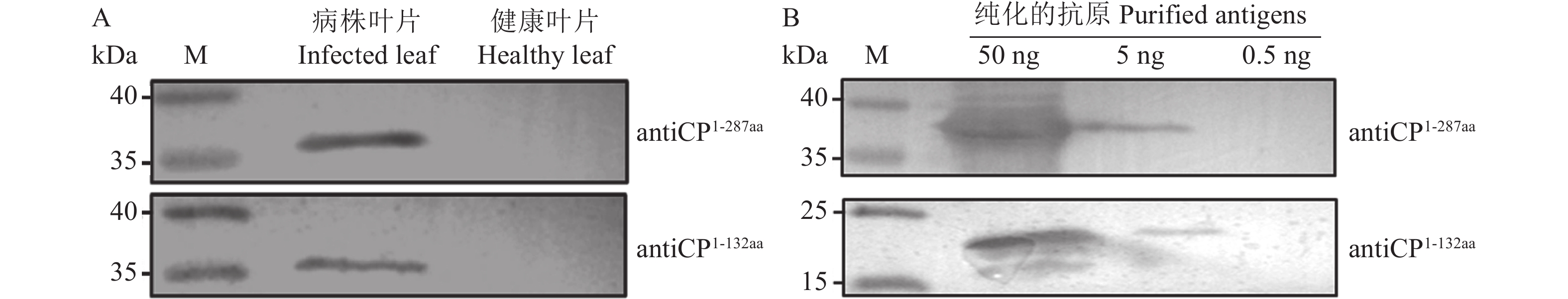
以纯化的抗原蛋白、健康叶片和病株叶片作为检测对象,通过Western blot检测多克隆抗体的特异性和灵敏度,结果如图5。从图中可知,antiCP1-132aa和antiCP1-287aa均能检测到ChiVMV病叶中的CP蛋白,无杂带存在,说明制备的多克隆抗体有一定的特异性;同时,这两种抗体能检测到5 ng纯化的抗原蛋白,显示其有较高的灵敏度。
![]() 图 5 Western blot检测多克隆抗体的灵敏度M,预染蛋白分子量标准26616(赛默飞);A为使用antiCP检测感染ChiVMV叶片; B为antiCP灵敏度检测。Figure 5. Sensitivity of polyclonal antibodies detected by western blotM: Prestained protein Ladder 26616 (Thermo Scientific); A: detection of infected ChiVMV leaves using antiCP; B: determination of antiCP sensitivity.
图 5 Western blot检测多克隆抗体的灵敏度M,预染蛋白分子量标准26616(赛默飞);A为使用antiCP检测感染ChiVMV叶片; B为antiCP灵敏度检测。Figure 5. Sensitivity of polyclonal antibodies detected by western blotM: Prestained protein Ladder 26616 (Thermo Scientific); A: detection of infected ChiVMV leaves using antiCP; B: determination of antiCP sensitivity.2.5 多克隆抗体田间检测应用
使用制备的多克隆抗体对试验田中通过RT-PCR确诊的39株烟草样品(其中包括PVY感染的烟草16株,ChiVMV感染的烟草2株)进行ELISA检测,结果如表2。从表中可知,用多克隆抗体antiCP1-287aa进行检测时,阳性株数有13株,与RT-PCR检测结果不一致,而用多克隆抗体antiCP1-132aa进行检测时,只有2个阳性样品,与RT-PCR检测结果一致,说明antiCP1-287aa无法区分ChiVMV和PVY,特异性不强,而antiCP1-132aa可以区分ChiVMV和PVY,有较强的特异性,能用于田间样品的检测。
表 2 多克隆抗体检测田间烟草样品Table 2. Field detection on tobacco samples using polyclonal antibodies多克隆抗体
Polyclonal antibodies烟草样品总数
Total number of tobacco samples阳性株数
Number of positive samples阴性株数
Number of negative samplesantiCP1-287aa 39 13 26 antiCP1-132aa 39 2 37 3. 讨论与结论
早期诊断对植物病毒的防控尤为关键。对于田间检测来说,需要一种快速、高效、经济并准确的检测方法。植物病毒快速检测和诊断方法有多种,主要是深度测序技术、血清学技术和分子生物学技术等3种方法[19−22]。由于市场上尚无ChiVMV特异性的血清学检测产品,所以目前生产上ChiVMV的检测多借助于分子生物学技术和深度测序技术,如田绍锐等[23]采用 RT-PCR 方法检测重庆地区烟叶辣椒脉斑驳病毒的发生,龚明霞等[24]采用小RNA深度测序技术分析广西辣椒上ChiVMV的发生和分布。分子生物学技术比较繁琐,如常见的 PCR 检测需要采样、总 RNA提取、逆转录和PCR 等操作。深度测序技术需要委托公司完成,价格较昂贵。血清学检测具有灵敏度高、检测样本数量大、快速、检测仪器要求低、操作简单等优点,因而被更广泛应用于田间检测[21−22]。血清学技术检测的关键是抗体的效价和特异性。本文制备获得的多克隆抗体antiCP1-132aa具有特异性较强和灵敏度高的特性,能够区分ChiVMV和PVY,可用于田间ChiVMV病株的检测。本研究制备的另外一个抗体,病毒CP蛋白全长的多克隆抗体antiCP1-287aa,尽管有较高的灵敏度,但特异性不强,其原因可能与抗原蛋白含有保守区域有关,马铃薯Y病毒属病毒的外壳蛋白的后半部分都比较保守,可能有相同或相似的抗原决定族,导致制备的多克隆抗体特异性不强,无法区分属内不同的病毒成员。这表明在抗原设计时,可通过规避相似性高的基因区段来增加多克隆抗体的特异性。综上所述,本研究所制备的antiCP1-132aa可以用于田间ChiVMV的检测,也可用于ChiVMV CP蛋白在寄主及其介体的定位研究,为ChiVMV防控和病毒基因功能研究奠定了基础。
-
图 2 两种抗原相应基因片段的扩增及其表达载体构建
M1、M2,核酸分子标准DL2000、DL5000 (宝生物);A:1、2,ChiVMV CP1-287aa和CP1-132aa序列扩增;B:3、4,ChiVMV CP1-287aa和CP1-132aa重组质粒双酶切
Figure 2. Amplification and expression vector construction of corresponding gene fragments of two antigens
M1, M2: DL2000 DNA marker DL2000, DL5000 (Takara); A: 1, 2, amplification of ChiVMV CP1-287aa and CP1-132aa fragment; B: 3, 4, double enzyme digestion of recombinant plasmid of ChiVMV CP1-287aa and CP1-132aa fragment
图 3 抗原蛋白的纯化
M,预染蛋白分子量标准26616(赛默飞);A为CP1-132aa蛋白纯化;B为CP1-287aa蛋白纯化;1、11,未层析样品;2、12,过柱的未层析样品;3~10、13~21,不同浓度(依次为30、40、50、60、70、80、90、100、110 mmol·L−1)的咪唑洗脱液。
Figure 3. Purification of antigenic proteins
M: Prestained protein Ladder 26616 (Thermo Scientific); A: for CP1-132aa protein purification; B: for CP1-287aa protein purification; 1 and 11: unstratified samples; 2 and 12: unstratified samples over the column; 3-10 and 13-21: imidazole eluates of different concentrations (i.e., 30, 40, 50, 60, 70, 80, 90, 100, and 110 mmol·L−1 in that order).
图 5 Western blot检测多克隆抗体的灵敏度
M,预染蛋白分子量标准26616(赛默飞);A为使用antiCP检测感染ChiVMV叶片; B为antiCP灵敏度检测。
Figure 5. Sensitivity of polyclonal antibodies detected by western blot
M: Prestained protein Ladder 26616 (Thermo Scientific); A: detection of infected ChiVMV leaves using antiCP; B: determination of antiCP sensitivity.
表 1 RT-PCR扩增引物
Table 1 Primers for PCR amplification
引物名称
Primer names序列 (5′-3′)
Primer sequences (5′-3′)扩增位置及大小
Region and length of
PCR amplificationChiVMV-CP-F CGGAATTCGCSGGAGAGAGTGTTGATGCTG 8575~8970 nt,
396 bpChiVMV-CP-R1 CCGCTCGAGAAGAATTATTTGCATCTGGTC ChiVMV-CP-F CGGAATTCGCSGGAGAGAGTGTTGATGCTG 8575~9435 nt,
861 bpChiVMV-CP-R2 CCGCTCGAGTATTCCCCGAACGCCCAGCAGATTG 划线位置为酶切位点。
The underlined position is the enzyme cleavage site.表 2 多克隆抗体检测田间烟草样品
Table 2 Field detection on tobacco samples using polyclonal antibodies
多克隆抗体
Polyclonal antibodies烟草样品总数
Total number of tobacco samples阳性株数
Number of positive samples阴性株数
Number of negative samplesantiCP1-287aa 39 13 26 antiCP1-132aa 39 2 37 -
[1] WYLIE S J, ADAMS M, CHALAM C, et al. ICTV virus taxonomy profile: Potyviridae [J]. The Journal of General Virology, 2017, 98(3): 352−354. DOI: 10.1099/jgv.0.000740
[2] ANINDYA R, JOSEPH J, GOWRI T D S, et al. Complete genomic sequence of pepper vein banding virus (PVBV): A distinct member of the genus Potyvirus [J]. Archives of Virology, 2004, 149(3): 625−632. DOI: 10.1007/s00705-003-0236-0
[3] 龚明霞, 王萌, 赵虎, 等. 辣椒脉斑驳病毒病研究进展 [J]. 园艺学报, 2020, 47(9):1741−1751. GONG M X, WANG M, ZHAO H, et al. Research progress on chilli veinal mottle virus disease [J]. Acta Horticulturae Sinica, 2020, 47(9): 1741−1751. (in Chinese)
[4] ONG C A, VARGHESE G, TING W P. Aetiological investigations on a vein mottle virus of chill (Capsicum anmuum L. ) newly recorded from peninsula Malaysia [J]. Malaysian Agricultural Research and Development Institute Research Bulletin, 1979, 7(1): 78−88.
[5] NG J C K, FALK B W. Virus-vector interactions mediating nonpersistent and semipersistent transmission of plant viruses [J]. Annual Review of Phytopathology, 2006, 44: 183−212. DOI: 10.1146/annurev.phyto.44.070505.143325
[6] NONO-WOMDIM R, SWAI I S, CHADHA M L, et al. Occurrence of Chilli veinal mottle virus in Solanum aethiopicum in Tanzania [J]. Plant Disease, 2001, 85(7): 801.
[7] 谭根堂, 史联联, 尚惠兰, 等. 陕西线辣椒病毒病病原检测简报 [J]. 辣椒杂志, 2003, 1(3):32−33. DOI: 10.3969/j.issn.1672-4542.2003.03.011 TAN G T, SHI L L, SHANG H L, et al. Diagnosis of viruses in chili pepper in Shanxi Province [J]. Journal of China Capsicum, 2003, 1(3): 32−33. (in Chinese) DOI: 10.3969/j.issn.1672-4542.2003.03.011
[8] WANG J, LIU Z, NIU S, et al. Natural Occurrence of Chilli veinal mottle virus on Capsicum chinense in China [J]. Plant Disease, 2006, 90(3): 377.
[9] 刘健, 张德咏, 张松柏, 等. 湖南和福建辣椒上辣椒脉斑驳病毒的检测及系统发育分析 [J]. 江苏农业科学, 2016, 44(5):184−185. LIU J, ZHANG D Y, ZHANG S B, et al. Detection and phylogenetic analysis of pepper vein mottle virus on peppers in Hunan and Fujian [J]. Jiangsu Agricultural Sciences, 2016, 44(5): 184−185. (in Chinese)
[10] 王少立, 谭玮萍, 杨园园, 等. 山东省辣椒主要病毒种类的分子检测与鉴定 [J]. 中国农业科学, 2017, 50(14):2728−2738. DOI: 10.3864/j.issn.0578-1752.2017.14.009 WANG S L, TAN W P, YANG Y Y, et al. Molecular detection and identification of main viruses on pepper in Shandong Province [J]. Scientia Agricultura Sinica, 2017, 50(14): 2728−2738. (in Chinese) DOI: 10.3864/j.issn.0578-1752.2017.14.009
[11] 王莉爽, 陈小均, 何海永, 等. 贵州辣椒脉斑驳病毒的检测及株系分化研究[J]. 南方农业学报, 2017, 48(7): 1220-1224. WANG L S, CHEN X J, HE H Y, et al. Detection of Chilli veinal mottle virus from Guizhou and its strain differentiation[J]. Journal of Southern Agriculture, 2017, 48(7): 1220-1224. (in Chinese)
[12] 汤亚飞, 裴凡, 于琳, 等. 侵染广东辣椒的辣椒脉斑驳病毒的分子特征 [J]. 园艺学报, 2018, 45(11):2209−2216. TANG Y F, PEI F, YU L, et al. Molecular Characterization of Chilli veinal mottle virus Infecting Pepper in Guangdong Province [J]. Acta Horticulturae Sinica, 2018, 45(11): 2209−2216. (in Chinese)
[13] DING M, YANG C, ZHANG L, et al. Occurrence of Chilli veinal mottle virus in Nicotiana tabacum in Yunnan, China [J]. Plant Disease, 2011, 95(3): 357.
[14] HWANG J, LI J J, LIU W Y, et al. Double mutations in eIF4E and eIFiso4E confer recessive resistance to Chilli veinal mottle virus in pepper [J]. Molecules and Cells, 2009, 27(3): 329−336. DOI: 10.1007/s10059-009-0042-y
[15] SHAH H, YASMIN T, FAHIM M, et al. Reaction of exotic and indigenous Capsicum genotypes against Pakistani isolates of chilli vein mottle virus [J]. Pakistan Journal of Botany, 2011, 43(3): 1707−1711.
[16] 杨天生. 安徽烟区烟草蚜传病毒病的检测及病毒遗传多样性分析[D]. 合肥: 安徽农业大学, 2018 YANG T S. Detection of tobacco virus disease transmitted by aphids in Anhui Province and analysis of genetic diversity of the virus[D]. Hefei: Anhui Agricultural University, 2018. (in Chinese)
[17] 李嘉伦. 泸州地区烟草病毒种类鉴定及防控技术研究[D]. 沈阳: 沈阳农业大学, 2019. LI J L. Identification and integrated control technigues on tobacco virus diseases in Luzhou city[D]. Shenyang: Shenyang Agricultural University, 2019. (in Chinese)
[18] CHEN Y, LI T T, ZHONG J, et al. First report of chilli veinal mottle virus infecting tobacco in Guizhou, China [J]. Journal of Plant Pathology, 2022, 104(3): 1159−1160.
[19] 陶源, 吴兴泉. 植物病毒检测方法的研究进展 [J]. 分子植物育种, 2017, 15(7):2901−2906. TAO Y, WU X Q. Research progress on methods for the detection of plant virus [J]. Molecular Plant Breeding, 2017, 15(7): 2901−2906. (in Chinese)
[20] 迟惠荣, 毛碧增. 植物病毒检测及脱毒方法的研究进展 [J]. 生物技术通报, 2017, 33(8):26−33. CHI H R, MAO B Z. Research advances on plant virus detection and virus-elimination methods [J]. Biotechnology Bulletin, 2017, 33(8): 26−33. (in Chinese)
[21] 吴云锋. 植物病毒学原理与方法[M]. 西安: 西安地图出版社, 1999. [22] 谢联辉, 林奇英. 植物病毒学[M]. 3版. 北京: 中国农业出版社, 2011. [23] 田绍锐, 温玉霞, 马婷, 等. 重庆地区烟叶辣椒脉斑驳病毒的检测与鉴定 [J]. 烟草科技, 2023, 56(1):33−38. DOI: 10.3969/j.issn.1002-0861.2023.1.yckj202301004 TIAN S R, WEN Y X, MA T, et al. Detection and identification of chilli veinal mottle virus infecting tobacco in Chongqing [J]. Tobacco Science & Technology, 2023, 56(1): 33−38. (in Chinese) DOI: 10.3969/j.issn.1002-0861.2023.1.yckj202301004
[24] 龚明霞, 赵虎, 王萌, 等. 广西辣椒病毒的sRNA深度测序和RT-PCR鉴定 [J]. 园艺学报, 2022, 49(5):1060−1072. GONG M X, ZHAO H, WANG M, et al. Identification of viruses infecting peppers in Guangxi by small RNA deep sequencing and RT-PCR [J]. Acta Horticulturae Sinica, 2022, 49(5): 1060−1072. (in Chinese)
-
期刊类型引用(1)
1. 温枭雄,舒琴,鲍梦楠,闫佳会. 青海省循化县辣椒脉斑驳病毒分离物的全基因组序列克隆与序列分析. 浙江农业学报. 2025(03): 612-620 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: