Cloning and Expressions of RhMAX2A in Rosa hybrida
-
摘要:目的 克隆月季( Rosa hybrida L.)RhMAX2A基因cDNA序列,分析其序列特征及其在不同组织中和去顶后的表达情况,为探究该基因在月季中的生物学功能及调控侧枝发生的转导机制提供理论支持。方法 以月季品种滇红( Rosa hybrida ‘Dianhong’)为材料,通过 RT-PCR 技术克隆RhMAX2基因的cDNA序列,利用生物信息学方法对其序列和所编码的蛋白质进行分析,利用烟草( Nicotiana tabacum )瞬时转化技术分析蛋白的亚细胞定位,同时采用实时荧光定量PCR(qRT-PCR)检测其在不同组织中及去顶后的表达情况。结果 RhMAX2A基因(GeneBank登录号为OP055810)cDNA序列长1030 bp,编码246 个氨基酸,该蛋白分子式为C2910H4793N1029O1244S210,相对分子质量为27.35 kD,总原子量为3909;该蛋白不稳定系数为53.07,脂肪系数为106.30,GRAVY值为0.049,是一类不稳定亲水性蛋白;RhMAX2A蛋白的二级结构主要由α-螺旋和无规则卷曲构成,且RhMAX2A为推定的F-box结构域,属于α/β水解酶家族。同源序列比对和系统进化树关系分析结果表明,RhMAX2A 氨基酸序列(OP055810)与同属的古老月季品种月月粉( Rosa chinensis ‘Old Blush’)氨基酸序列(XP_024283944.1)相似性最高,其次是同亚科的草莓( Fragria vesca subsp. vesca )(XP_004287076.1),三者亲缘关系较近。亚细胞定位结果显示,RhMAX2A编码蛋白位于细胞核。qRT-PCR检测结果显示,RhMAX2A基因在根、腋芽和节中表达,根中表达量最高,去顶处理显著上调RhMAX2A基因在根和腋芽中的表达。结论 成功克隆了滇红RhMAX2A基因,其编码蛋白在细胞核上发挥作用,主要在根和腋芽中表达,且受去顶诱导上调表达。Abstract:Objective Biological functions and lateral branching transduction mechanism of RhMAX2A were investigated by cloning the cDNA and determining the after-decapitation expressions in tissues of Rosa hybrida.Methods The cDNA sequence of RhMAX2A was cloned from hybrid tea rose Dianhong by RT-PCR for a bioinformatic analysis. The subcellular location of the gene was determined by transient transformation of PC1300s-RhMAX2A-GFP in tobacco leaves. After decapitating the plant, expressions of the gene in different organs were determined by qRT-PCR.Results The cDNA of RhMAX2A (GeneBank accession number: OP055810) was 1030 bp in length encoding 246 amino acids with the chemical formula of C2910H4793N1029O1244S210, a molecular weight of 27.35 kD, and a total atomic weight of 3909. The instability coefficient of the unstable hydrophilic protein was 53.07, the fat coefficient, 106.30, and the GRAVY value, 0.049. The protein secondary structure was mainly α-helix and random coil of a presumed F-box domain belonging to the α/β hydrolase family. RhMAX2A (OP055810) had the highest homology with that in R. chinensis Old Blush (XP_024283944.1) followed by that in Fragaria vesca subsp. vesca (XP_004287076.1) of the same closely related subfamily. The encoded protein was in the nucleus. The gene expressed most highly in the roots but also in the axillary buds, and nodes among tested organs. Decapitation on the plant significantly upregulated RhMAX2A in the roots and axillary buds.Conclusion RhMAX2A was successfully cloned from R. hybrida Dianhong, which functioned in the nucleus, expressed mainly in the roots and axillary buds, and could be upregulated by plant decapitation.
-
Keywords:
- Rosa hybrida /
- MAX2A /
- Cloning /
- Subcellular localization /
- Expression analysis
-
0. 引言
【研究意义】月季作为木本园林植物,位于世界四大切花之首,同时被广泛应用在盆栽、园林景观等领域,具有较高的商业价值及园林应用价值[1]。花型、花色、株型是月季的主要观赏要素,而侧枝是地上株型的重要组成部分,直接决定了月季产量、品质和生产效率等,其形成受到多种内源激素共同调控[2]。独脚金内酯(Strigolactones,SLs)是一种新型的调控植物侧枝的激素,产生于植物根部,通常与植物中的生长素、细胞分裂素等多种植物激素联合作用直接或间接抑制植物分枝,同时还参与其他多种生长发育过程,如株高、节间伸长、枝条向重力性、茎次生加粗、叶片发育、花青素积累、根系构型及非生物胁迫等[3−4],这些功能与产量、株型、抗逆性等关键农艺性状密切相关[5], SLs已经成为植物分子育种的重要工具。MAX2 (more axillary growth 2)是 SLs 信号转导途径的关键调控基因,在多种植物侧枝调控中有重要作用。因此克隆月季RhMAX2 基因并对其结构及表达情况进行分析,可为探究月季侧枝发生机制、高效调控方式和株型调控提供重要参考依据。【前人研究进展】MAX2是SCF-E3(SKP1/Cullin1/F-box-E3)连接酶复合物的一个亚基,是一类亮氨酸含量较高的F-box蛋白[6],该蛋白调节植物胚胎发生到幼苗发育、激素信号转导和防御途径等一系列过程[7],编码该蛋白的基因是SLs信号传导途径的关键调控因子[8]。MAX2首次在拟南芥中( Arabidopsis thaliana )被研究,通过拟南芥的嫁接试验发现,其突变体表型分枝多而密,对SLs不敏感型,表型不能通过外源施加GR24(SLs人工合成类似物)被恢复[9−10]。当SLs存在时,其受体蛋白D14结合并水解SLs,将SLs水解为可以共价结合的中间分子CLIM(Covalently-linked intermediate molecule),CLIM和D14结合后与MAX2/D3和阻遏蛋白D53/SMXLs形成SCFMAX2-D14-D53蛋白复合体,MAX2可以采用两种构象调控D14水解活性从而促使D53/SMXLs等转录抑制因子进入26 S蛋白酶体调节途径,消除对分枝调控基因TEOSINTE BRANCHED1(TB1)、CYCLOIDEA(CYC)及BRANCHED1(BRC1)等的抑制,激发下游分枝调节基因的表达[11−13],抑制植物分枝或分蘖。除模式植物拟南芥、水稻(Oryza sativa)外,许多草本植物如菊花( Chrysanthemum morifolium )[14]、棉花( Gossypium hirsutum )[15]、紫花苜蓿( Medicago sativa )[16]中,过表达MAX2可互补其突变体的多分枝表型。此外,列当( Orobanche coerulescens )PaMAX2基因转入列当愈伤组织后,可通过对SLs的感知,对列当的寄生率造成影响[17]。GhMAX2基因在棉花中敲除后,植株高度显著降低,生长缓慢,节间缩短,纤维长度降低[18]。但是关于MAX2基因在木本植物侧枝发育过程中的功能研究仍较少,如在拟南芥中过表达杨树( Populus )MAX2基因,其表达量显著增加,但并未观察到拟南芥分枝被抑制的表型[19];苹果( Malus pumila )MAX2 基因具有介导SL信号抑制分枝的功能[20],以上研究也进一步证明MAX2基因在调控植物生长发育方面及侧枝发生方面具有重要作用。朱思雅等[21]通过对去顶处理后的少侧枝月季品种滇红腋芽中内源激素含量分析结果发现,第1腋芽中SLs含量显著降低,而外源SLs施用抑制去顶诱导的第1腋芽萌发,表明SLs对腋芽萌发的抑制作用;滇红去顶前后腋芽转录组数据分析发现,差异基因中富集通路最多的是植物激素信号转导、淀粉和蔗糖代谢;鉴定出13个SLs合成和信号转导途径相关基因,其中MAX2A基因在去顶后第1腋芽中显著上调表达[22],推测该基因在SLs调控滇红腋芽萌发中起重要作用。杜高齐等[5]克隆了滇红RhD14基因,研究发现RhD14在细胞核和细胞膜上发挥作用,具有组织特异性,受去顶诱导,参与月季侧枝发育过程。【本研究切入点】目前鲜见有关月季MAX2基因克隆、基因序列和蛋白结构分析、亚细胞定位及在不同组织中和去顶后的表达分析的研究报道。【拟解决的关键问题】克隆滇红RhMAX2A基因cDNA序列,对其进行生物信息学分析,通过荧光定量PCR检测RhMAX2A基因的表达情况,旨在为进一步解析RhMAX2A基因在滇红侧枝调控中的生物学功能奠定基础,并为月季优良株型新品种选育和木本植物株型调控提供重要参考依据。
1. 材料与方法
1.1 材料
供试材料为半年生滇红扦插植株,购自云南鑫海汇花卉有限公司,盆栽置于云南农业大学园林园艺学院后山温室大棚。
植物总RNA提取试剂盒(R4165-02)购自美基生物科技(广州)有限公司;反转录试剂盒(A224-10)和2×RealStar Green Fast Mixture with ROX Ⅱ荧光染料(A304-05)购自康润诚业生物科技(北京)有限公司;KOD DNA聚合酶购自泽叶生物科技(上海)有限公司;纯化试剂盒(D6492-02)购自OMEGA公司;琼脂糖凝胶DNA回收试剂盒(DP209-03)购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 样品处理与采集
选取半年生的滇红扦插苗,分别对植株根、茎、叶、腋芽、节、节间和顶芽进行取样,每组织设置3 个重复,每个重复 3 株。同时,为研究去顶处理对MAX2A基因表达的影响,从上往下在植株第一个具五小叶节位处进行去顶处理,分别于处理后第0、6、12、24、48 h进行根和腋芽的取样,以相同时间点未去顶植株为对照,每个时间点设置3 个重复,每个重复3 株。各组织取样标准如下:
1)根:取当年生白色根尖并向内1 cm;2)茎:取植株中部1~2 cm的茎段;3)叶:取植株上部第1、2 节叶片;4)腋芽:植株上部第1、2 腋芽上方和下方约0.3 cm处剪下;5)节:去除第2、3 节处叶片和腋芽后将其上下方约0.3 cm剪下;6)节间:两个相邻的节之间的部分;7)顶芽:取植株顶端的芽。
1.2.2 总RNA提取和cDNA合成
使用植物总 RNA 试剂盒 HiPure HP Plant RNA Mini Kit 按说明书提取滇红不同组织的总RNA。根据反转录试剂盒 StarScript Ⅲ All-in-one Mix With gDNA Remover 说明书对叶片总RNA进行反转录合成cDNA第一链用于逆转录PCR(RT-PCR)。总RNA在1.0%琼脂糖凝胶电泳中检测,采用NanoDrop 2000 超微量分光光度计检测总RNA浓度和纯度。计算后取总RNA 1000 ng反转录合成cDNA第一链用于后续试验。
1.2.3 RhMAX2A基因克隆
参考试验室前期滇红转录组测序结果筛选到滇红RhMAX2A 基因的编码区序列,利用premier 5.0软件设计克隆基因ORF(Open Reading Frame)开放阅读框特异性引物RhMAX2A-F/RhMAX2A-R。以滇红叶片总RNA反转录所得到的cDNA为模板,按照KOD DNA聚合酶说明书通过PCR扩增目的基因片段。反应体系:5.0 μL 10×Buffer,10 μmol·L−1上游1.0 μL、10 μmol下游引物1.0 μL,10 mmol·L−1 dNTP Mixture1.0 μL,1 μg cDNA模板1.0 μL,1 U·μL−1 KOD DNA聚合酶1.0 μL,ddH2O补足至50.0 μL。扩增程序:94 ℃预变性5 min;98 ℃变性30 s,56 ℃退火30 s,68 ℃延伸2 min,设置32 个循环;68 ℃延伸5 min,10 ℃保存。
1.2.4 RhMAX2A基因生物信息学分析
利用NCBI Conserved Domains(www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)工具搜索氨基酸保守结构域以及ORF finder分析RhMAX2A基因的ORF和其编码的氨基酸序列;用Expasy ProtParam(web.expasy.org/protparam/)工具分析RhMAX2A蛋白质氨基酸组成、分子量、理论等电点;利用SignalP 5.0 Sever(services.healthtech.dtu.dk/service.php?SignalP-5.0)、TMHMM-2.0(services.healthtech.dtu.dk/service.php?TMHMM-2.0)、NetPhos-3.1 Server(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)、SOPMA( npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html)、Swiss-model(swissmodel.expasy.org/interactive)、STRING(https://string-db.org)和WOLF PSORT(https://string-db.org)等在线工具对蛋白质的信号肽、跨膜结构、磷酸化位点、二级结构、三级结构、蛋白互作网络进行分析。利用DNAMAN软件对RhMAX2A蛋白进行同源序列比对,最后使用MEGA7.0的邻接法(Neighbor-joining method)构建系统进化树分析亲缘关系。
1.2.5 RhMAX2A基因表达载体构建及亚细胞定位分析
构建RhMAX2A融合绿色荧光蛋白(GFP)的表达载体,依据滇红RhMAX2A基因ORF序列,利用Primer premie 5.0设计扩增ORF片段(不包含终止密码子)的特异引物RhMAX2A-GFP-F/RhMAX2A-GFP-R(表1)。利用KOD DNA聚合酶对RhMAX2A基因ORF片段进行扩增。凝胶电泳检测后,进行胶回收,参照赛默飞公司的内切酶Sac I与Bam HI说明书体系将PC1300s-GFP进行双酶切处理,对目的条带进行胶回收和纯化,之后用T4 DNA连接酶将其与目的片段进行连接,获得重组表达载体PC1300s-RhMAX2A-GFP。将获得的载体产物转化到大肠杆菌DH5α感受态细胞中,挑取阳性单克隆菌进行测序验证。
表 1 引物序列Table 1. Primer sequences引物名称 Primer 引物序列 Primer sequence 引物用途 Primer application RhMAX2A-F 5′-TCTCTCTCGAGCTTTCGCGAGCTCATGCAATCGCGTTCACGTG-3′ 基因克隆 Gene cloning RhMAX2A-R 5′-TCGCCCTTGCTCACCATGGATCCATCAAGGATTGTGCGCCTGT-3′ 基因克隆 Gene cloning 18S rRNA-F 5′-CCTGAGAAACGGCTACCACAT-3′ 内参基因 Endogenous gene 18S rRNA-R 5′-CACCAGACTTGCCCTCCA-3′ 内参基因 Endogenous gene UBC-F 5′-GCCAGAGATTGCCCATATGTGTA-3′ 内参基因 Endogenous gene UBC-R 5′-TCACAGAGTCCTAGCAGCACA-3′ 内参基因 Endogenous gene RhMAX2A-qRT-F 5′-GATCGACTTCTTCTCCGGGCTT-3′ 荧光定量引物 qRT-PCR RhMAX2A-qRT-R 5′-CCAATCCACTGTCCCTCACGTT-3′ 荧光定量引物 qRT-PCR RhMAX2A-GFP-F 5′-TCTCTCTCGAGCTTTCGCGAGCTCATGCAATCGCGTTCACGTG-3′ 载体引物 Vector primer RhMAX2A-GFP-R 5′-TCGCCCTTGCTCACCATGGATCCATCAAGGATTGTGCGCCTGT-3′ 载体引物 Vector primer RhMAX2A蛋白亚细胞定位通过烟草叶片表皮细胞瞬时表达进行分析。将测序正确的 PC1300s-RhMAX2A-GFP 重组表达载体和空载体 PC1300s-GFP 分别通过电击转化农杆菌GV3101,电击后在培养箱中30 ℃培养2 d;之后用接种环将农杆菌从固体培养皿上轻轻刮下,将其接种在10 mL YEB液体培养基中,在摇床中170 r·min−1 培养1 h,之后取出将其4 000 r·min−1离心4 min,将底部菌体收集;用10 mmol·L−1 MgCl2(含120 μmol·L−1乙酰丁香酮)悬浮液重悬菌体,调节OD600至0.6左右;用去枪头的1 mL注射器对生长30 d的烟草叶片进行下表皮注射后弱光培养2 d,取被注射的烟草叶片制作成玻片,在激光共聚焦显微镜下观察GFP荧光信号。
1.2.6 RhMAX2A基因表达分析
通过qRT-PCR检测RhMAX2A基因在滇红不同组织及去顶处理下根和腋芽中的表达情况,分别以月季18S rRNA 基因和 UBC 为内参基因(表1)。参照 GenStar的2×RealStar Green Fast Mixture with ROX Ⅱ配置反应体系(20.0 μL),反应体系: 2×RealStar Green Fast Mixture with ROX Ⅱ 10.0 μL,cDNA 1.0 μL,10 μmol·L−1正、反游引物各0.5 μL,RNase-free H2O 8.0 μL。qRT-PCR扩增程序为:94 ℃预变性2 min ;94 ℃ 15 s,60 ℃ 30 s,进行40 个循环。采用 2−△△ct公式计算基因表达变化情况,采用 Graphpad prism软件进行数据分析。
2. 结果与分析
2.1 RhMAX2A基因扩增与克隆
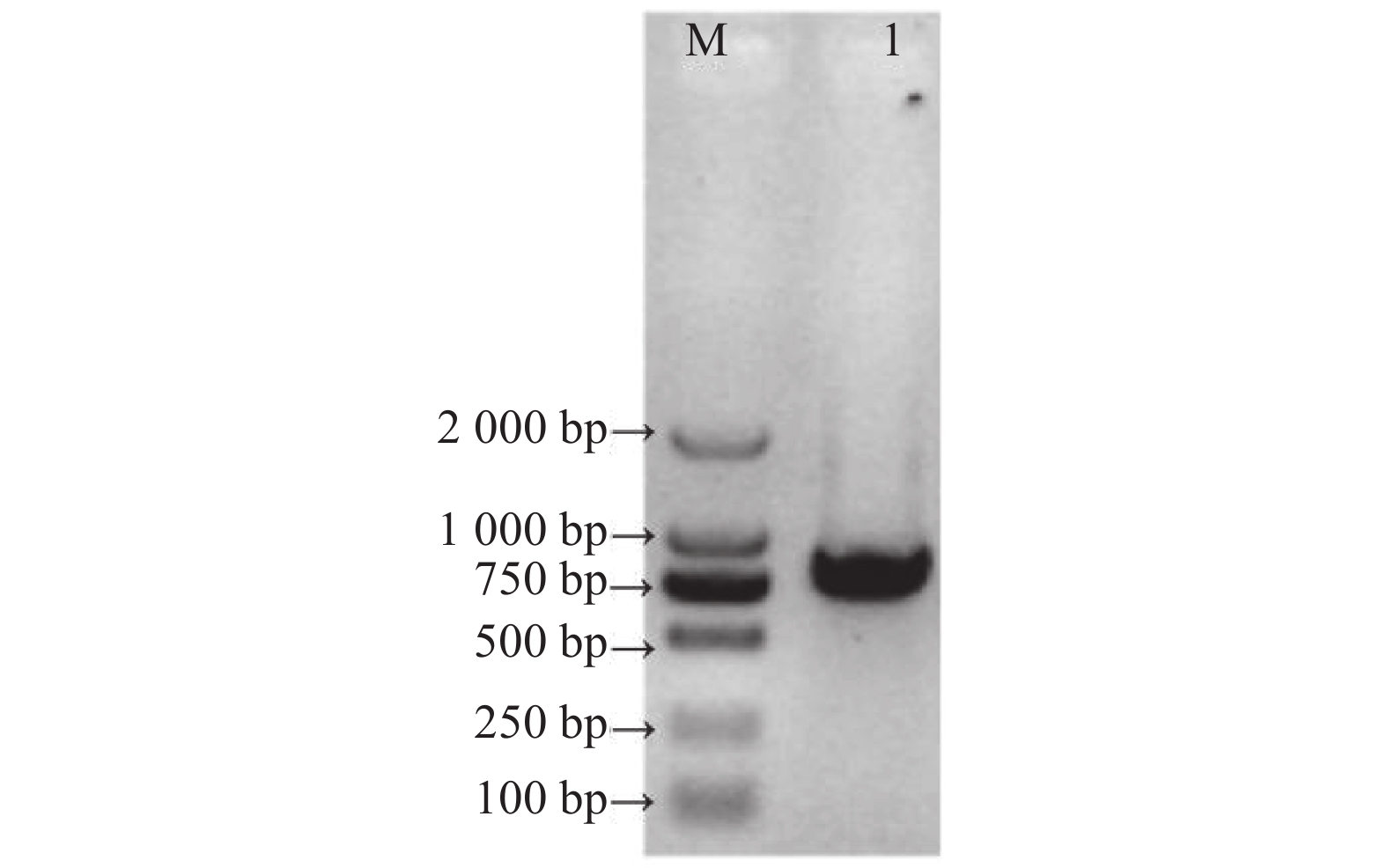
以滇红叶片cDNA为模板,PCR 扩增后在1.0%琼脂糖凝胶电泳中检测,出现1条约为1 000 bp 的条带(图1)。经测序验证得知滇红的RhMAX2A基因cDNA序列长1 030 bp,编码246 个氨基酸(图2),将RhMAX2A基因序列上传至NCBI数据库,获得GenBank登录号为OP055810。
2.2 RhMAX2A基因编码蛋白理化性质分析
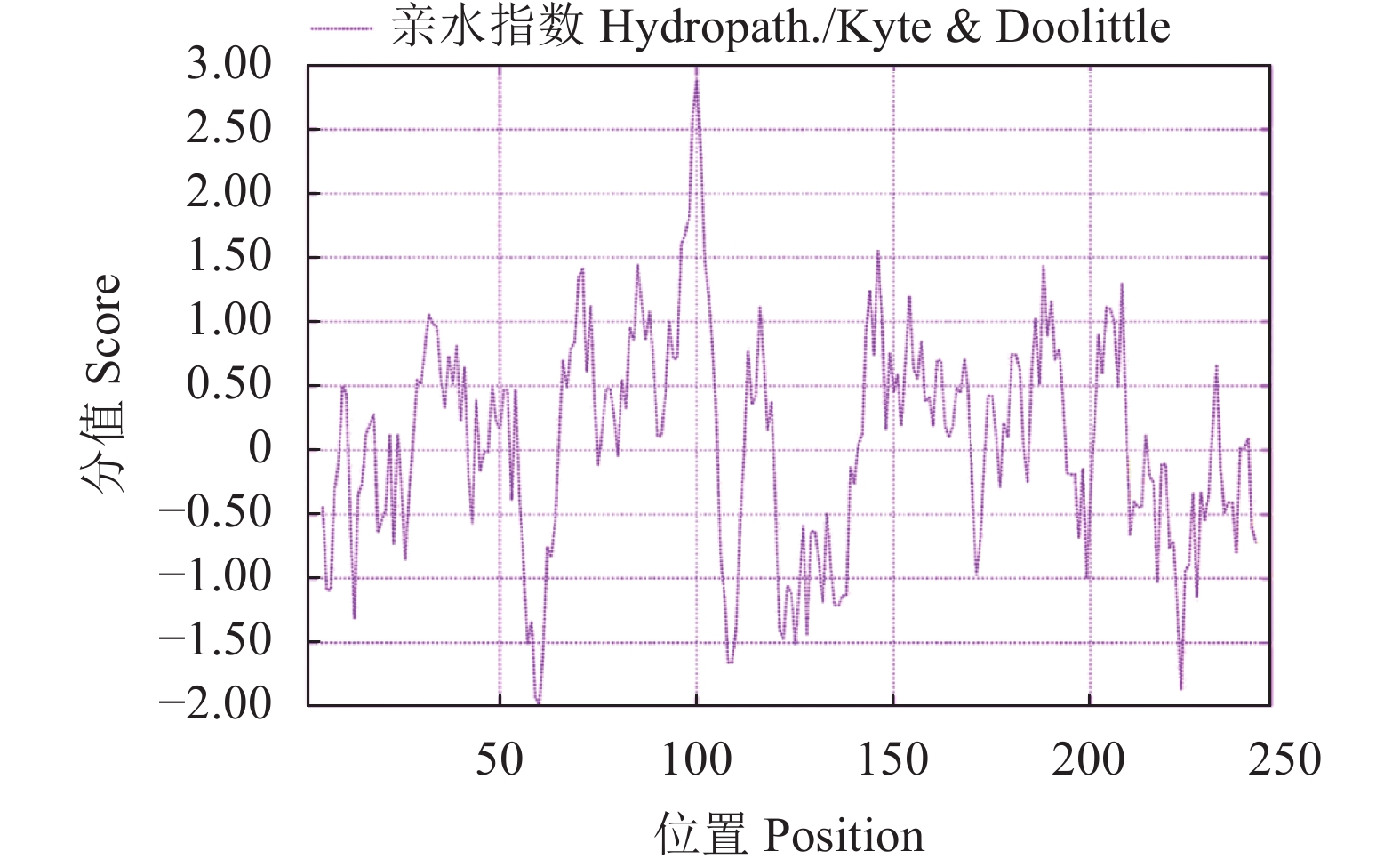
利用ProParam在线软件对RhMAX2A蛋白的理化性质进行分析,结果显示,该蛋白的分子式为 C2910H4793N1029O1244S210,相对分子质量为27.35 kDa,总原子量为3 909;不稳定系数为53.07,脂肪系数为106.30,GRAVY 值为0.049,因此推测该蛋白是一类不稳定蛋白。在Expasy在线软件上分析发现RhMAX2A编码蛋白在氨基酸序列第60 个位点数值最低,为−1.989,其亲水性最高;在氨基酸序列第100 个位点数值最大,为2.889,其疏水性最高,由此可知该蛋白为亲水性蛋白(图3)。
2.3 RhMAX2A蛋白保守结构域、二、三级结构及蛋白互作预测
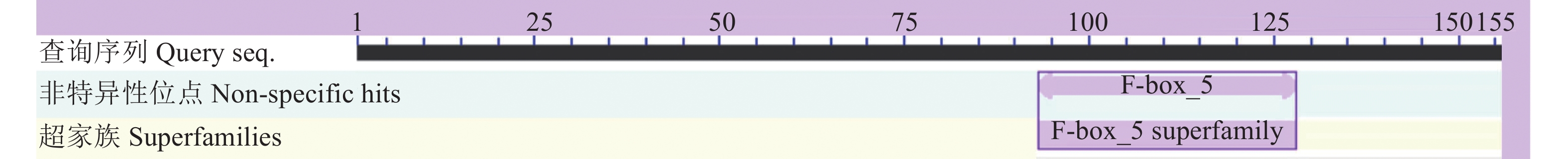
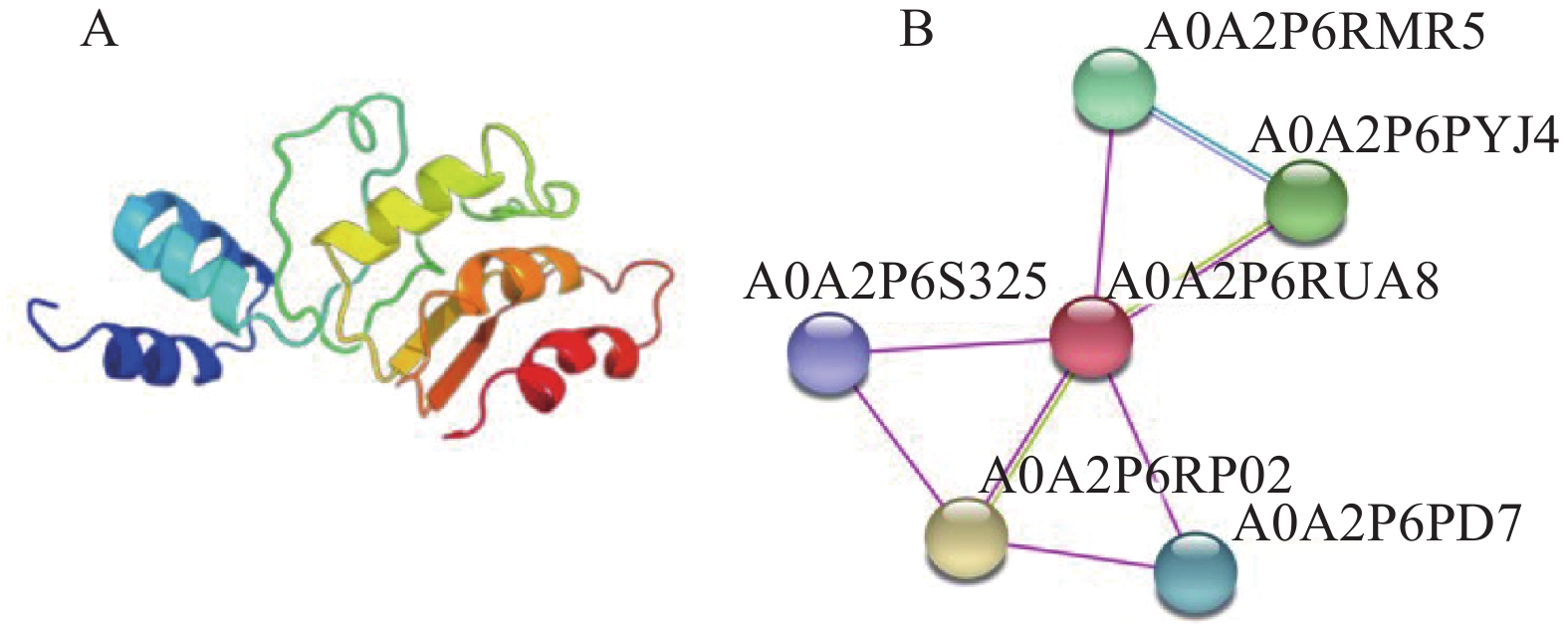
在 NCBI conserved domain 网站中对对RhMAX2A蛋白进行保守结构域预测分析,发现该蛋白含有一个典型的F-box_5(F-box_5super family)保守结构域(图4)。利用SOPM软件分析结果表明,RhMAX2A蛋白二级结构中包含α螺旋(Hh)129 个(占52.44%);β折叠(Tt)6 个(占2.44%);延伸链(Ee)31 个(占12.60%);无规则(Cc)为80个(占32.53%),属于无规则结构。因此RhMAX2A蛋白二级结构主要由α-螺旋和无规则卷曲构成(图5)。利用Swiss-model预测该蛋白三级结构,结果表明该模型的GMQE为0.42,QMEAN为0.59,且RhMAX2A蛋白与独脚金内酯诱导的AtD14-D3-ASK1复合物的晶体结构等其他同源模型的相似性为45.51%,包含F-box/LRR、MAX2同源物、独脚金内酯酶D14、SKP1样蛋白,因此推测RhMAX2A蛋白属于F-box基因家族(图6A)。利用STRING软件中对RhMAX2A蛋白互作进行分析,预测结果(图6B)显示,该基因的编码蛋白与5 个蛋白间存在相互作用,均为推定的F-box结构域、富含亮氨酸的重复结构域以及α/β水解酶家族。
2.4 RhMAX2A蛋白信号肽、跨膜结构分析、磷酸化位点
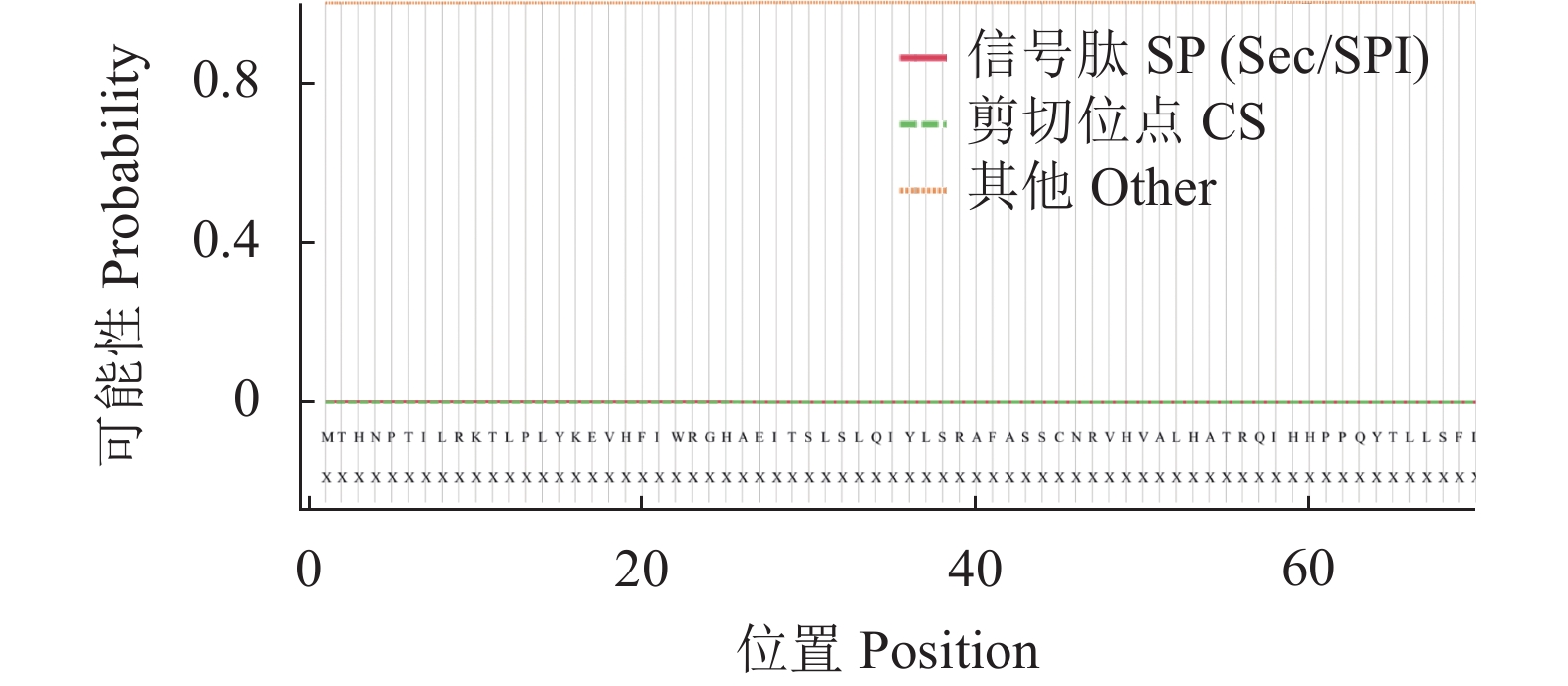
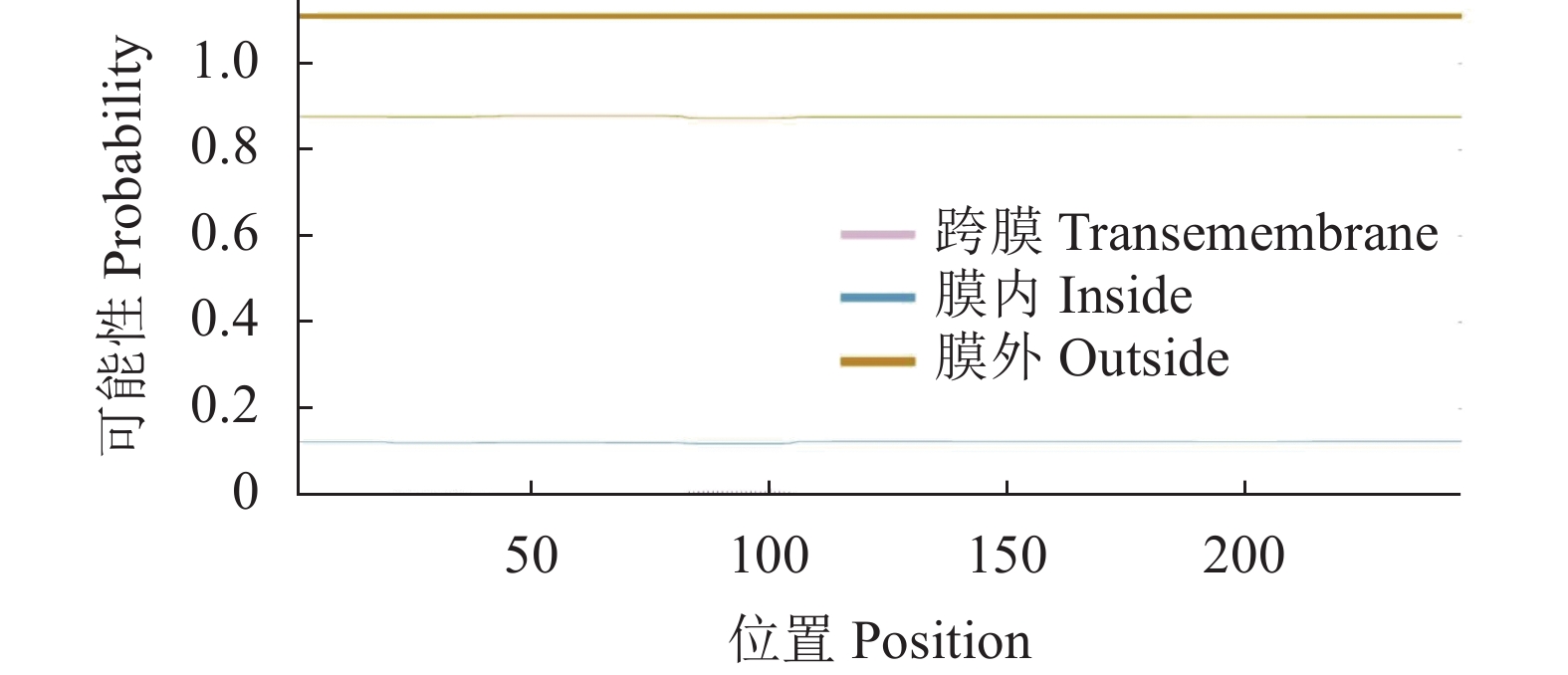
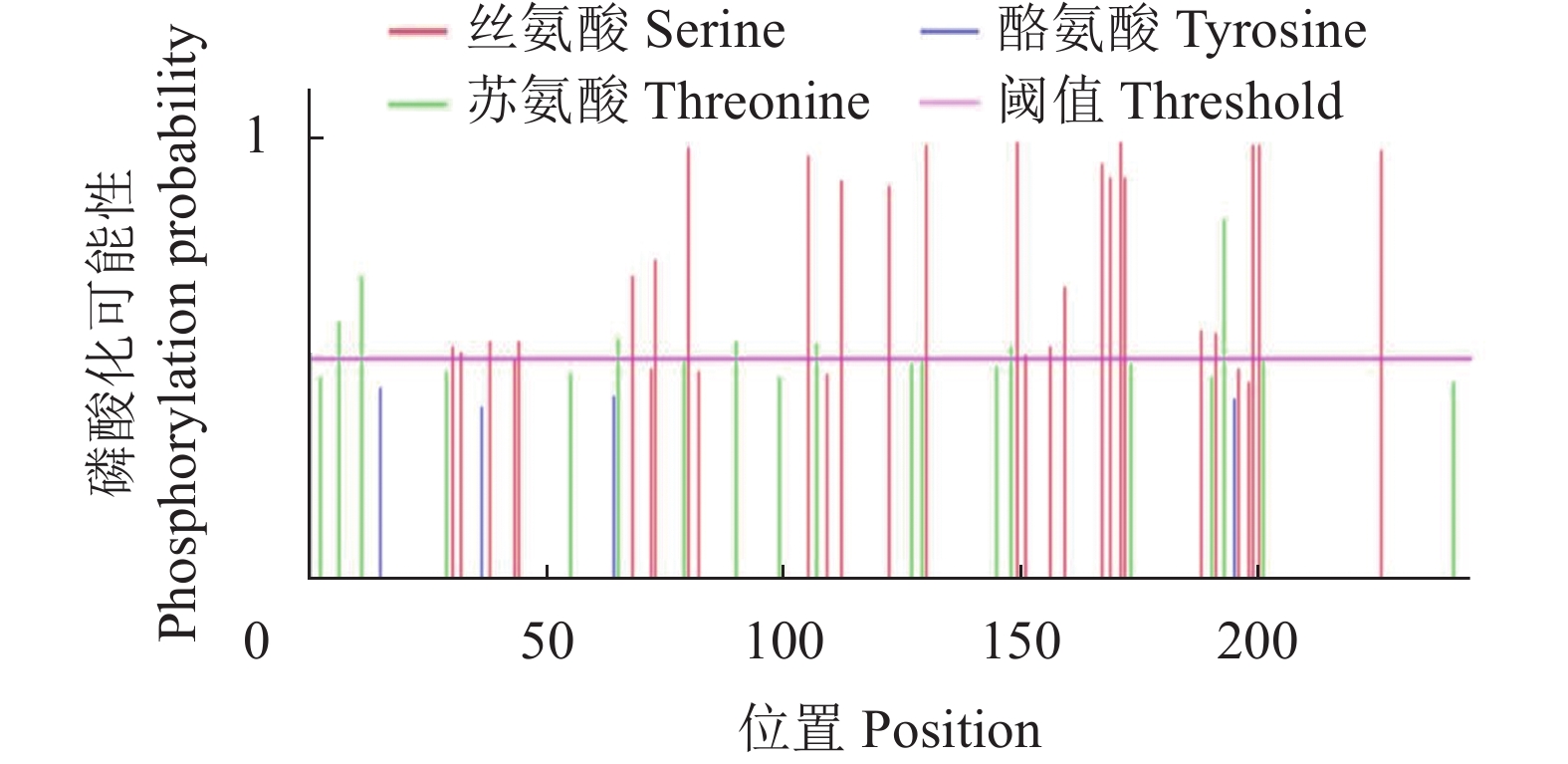
使用SignalP 5.0 Sever和TMHMM-2.0在线网站对RhMAX2A蛋白进行信号肽和跨膜结构结构预测,结果显示RhMAX2A蛋白不具有信号肽也没有跨膜结构(图7、图8)。使用NetPhos 3.1 Serve对RhMAX2A基因蛋白序列进行磷酸化位点预测分析(图9)。结果表明,该蛋白含有丝氨酸、苏氨酸和酪氨酸3 种磷酸化位点,共53 个,包括丝氨酸(Serine)的30 个,苏氨酸(Threonine)19 个,酪氨酸(P-hydroxyphenylalanine)4 个,潜在磷酸化位点可能性最高的是第149 位丝氨酸位点,其值达到0.987,超过标准值0.5。
2.5 RhMAX2A蛋白同源比对及系统进化树分析
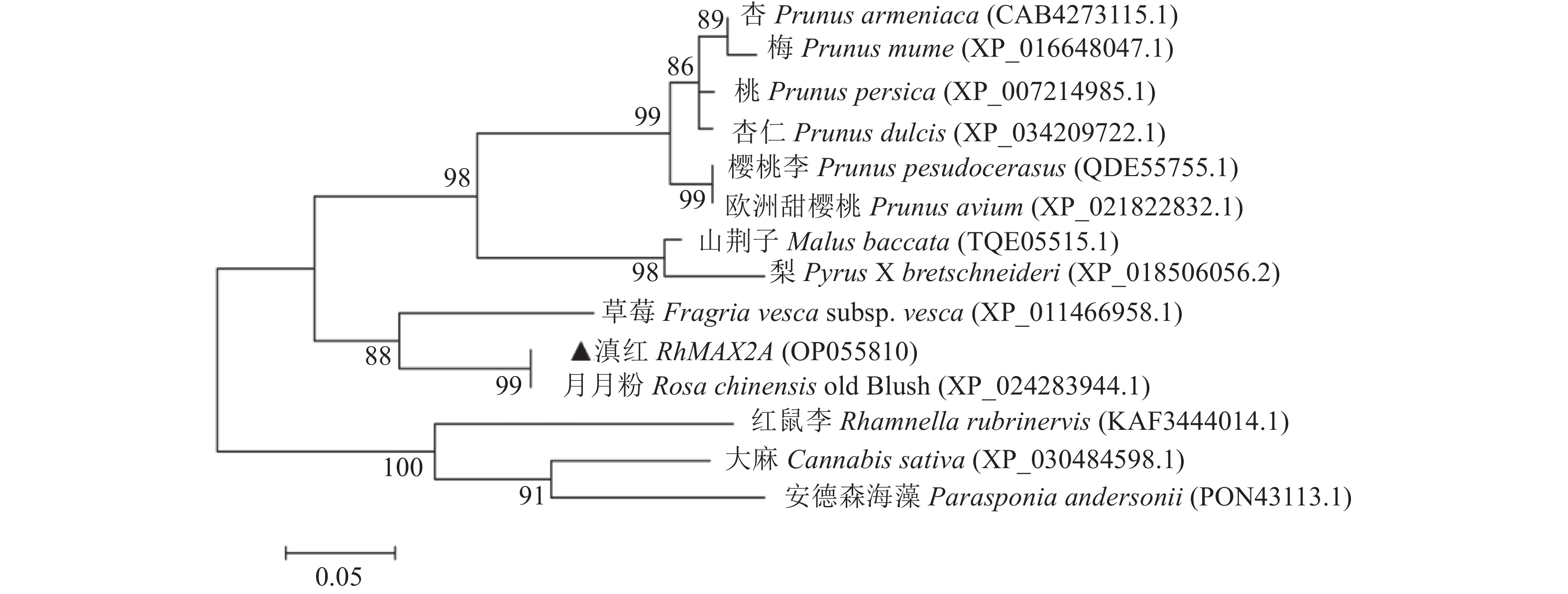
使用NCBI的BLASTp功能对RhMAX2A基因编码蛋白进行同源性检测,筛选出与RhMAX2A氨基酸序列相似度较高的13 个物种的MAX2A蛋白序列,古老月季品种月月粉( Rosa chinensis ‘Old Blush’)(98.37%)、草莓( Fragria vesca subsp. vesca )(86.71%)、山荆子(Malus baccata)(78.34%)、梨(Pyrus x bretschneideri)(76.43%)、杏(Prunus armeniaca)(75.00%)、樱桃李(Prunus pseudocerasus)(75.47%)、欧洲甜樱桃(Prunus avium)(75.47%)、桃(Prunus persica)(74.84%)、杏仁(Prunus dulcis)(74.84%)、梅(Prunus mume)(74.21%)、红鼠李(Rhamnella rubrinervis)(72.96%)、大麻(Cannabis sativa)(72.96%)和安德森海藻(Parasponia andersonii)(71.97%),利用DNAMAN进行同源比对(图10)。通过MEGA7.0软件构建进化树(图11),结果显示,滇红与蔷薇科的所有10 种植物聚为一大支,与同亚科的草莓、月月粉聚为一支,说明同为蔷薇科植物的MAX2A基因的亲缘性更近并具有较高的保守性;RhMAX2A与同属的月月粉RcMAX2A亲缘关系最近。
2.6 RhMAX2A蛋白的亚细胞定位分析
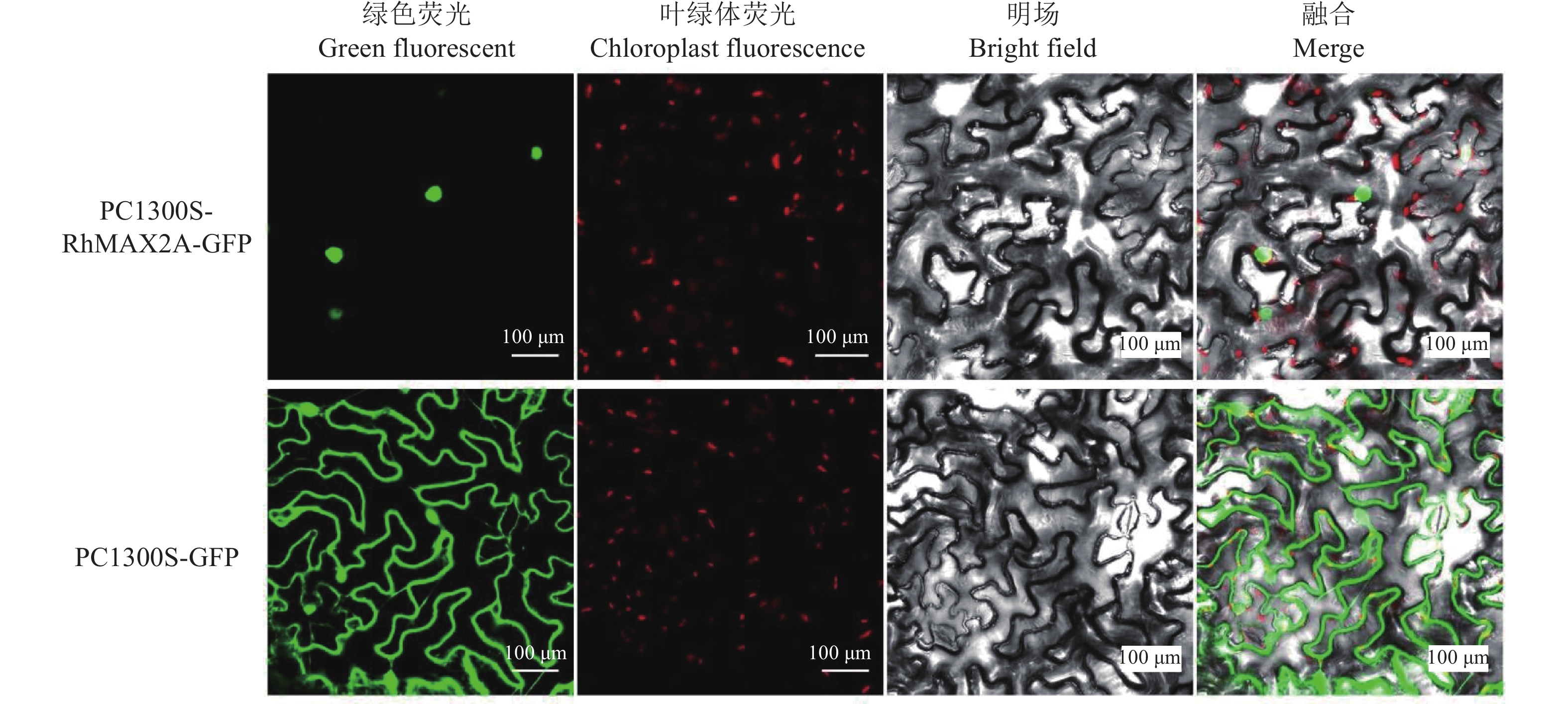
由图12可以看出,在瞬时转化1300S-GFP空载体的烟草叶片中,GFP基因大量表达,在整个细胞都有较强的绿色荧光,而在瞬时转化1300S-RhMAX2A-GFP的烟草叶片中,绿色荧光主要分布在细胞核中,以上结果表明RhMAX2A蛋白主要定位在细胞核。
2.7 RhMAX2A基因表达特性分析
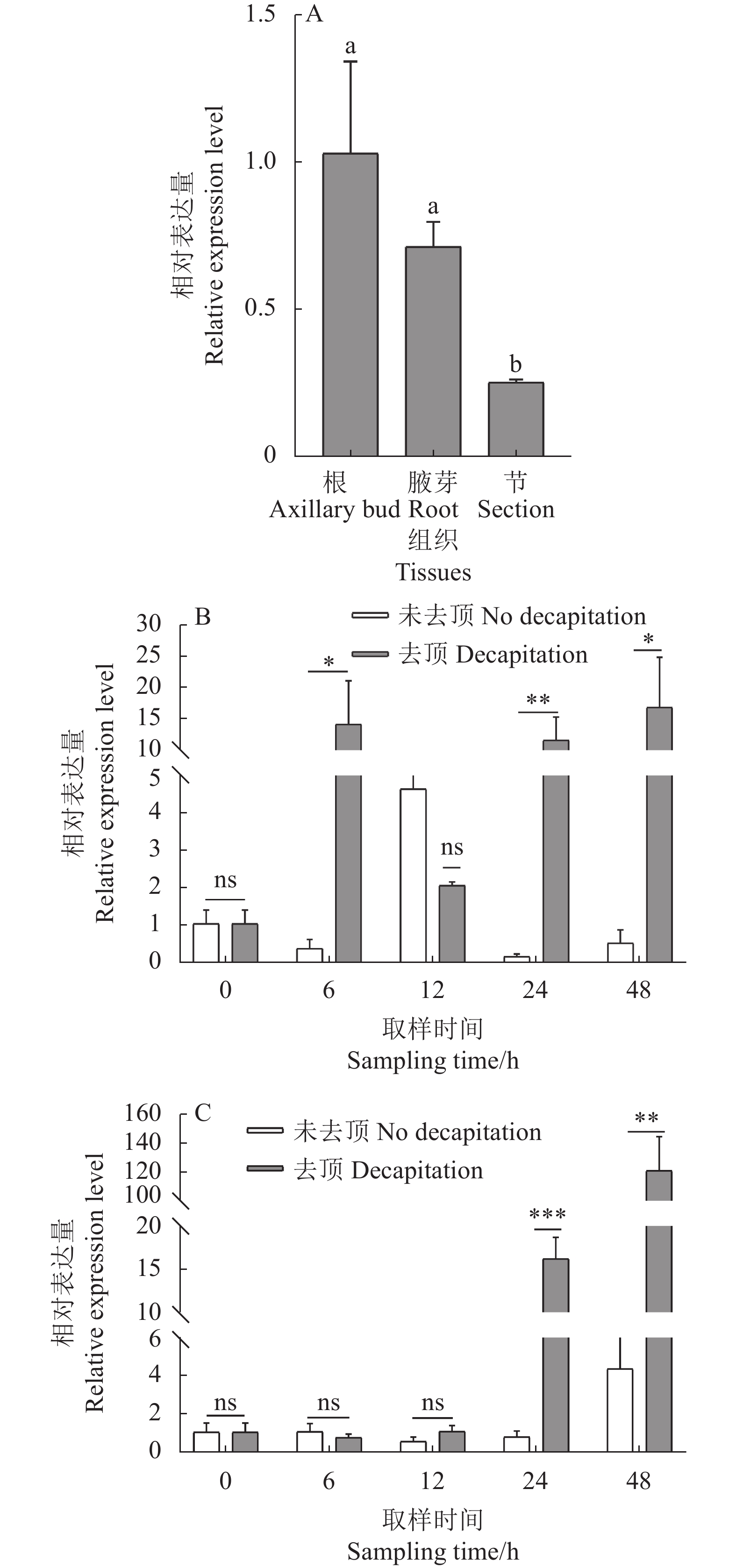
为了检测滇红RhMAX2A基因表达的组织特异性,采用qRT-PCR分析了该基因在不同组织中的表达情况(图13-A)。结果表明RhMAX2A基因仅在滇红根、腋芽和节中有表达,在叶、顶芽、节间、茎中未检测到表达;不同组织表达量排序为根>腋芽>节。RhMAX2A基因在根中的表达量与在腋芽中的表达量无显著性差异,为节中的4 倍,差异极显著(P < 0.05)。
![]() 图 13 RhMAX2A基因在不同组织及去顶处理下的表达模式A. 不同组织,B. 根,C. 腋芽; ns表示无显著差异(P > 0.05),*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),***表示差异极显著(P < 0.001)。Figure 13. Expressions of RhMAX2A in tissues after decapitation on plantA: Different tissues; B: roots; C: axillary buds; ns: no significance at P˃0.05; *: significant difference at P<0.05; **: extremely significant difference at P<0.01; ***: extremely significant difference at P<0.001.
图 13 RhMAX2A基因在不同组织及去顶处理下的表达模式A. 不同组织,B. 根,C. 腋芽; ns表示无显著差异(P > 0.05),*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),***表示差异极显著(P < 0.001)。Figure 13. Expressions of RhMAX2A in tissues after decapitation on plantA: Different tissues; B: roots; C: axillary buds; ns: no significance at P˃0.05; *: significant difference at P<0.05; **: extremely significant difference at P<0.01; ***: extremely significant difference at P<0.001.去顶处理后RhMAX2A基因在根中的表达量呈现上升-下降-上升的趋势,于去顶处理后48 h达到峰值;根中的表达量在6、24、48 h分别为相同时间点未去顶处理的36.63 倍,67.81 倍和31.83 倍,在6 h和48 h差异显著(P <0.05),在24 h差异极显著(P < 0.01)(图13-B)。去顶处理后的RhMAX2A基因在腋芽中表达量呈现先下降后上升的趋势,在6 h和12 h差异不显著(P > 0.05);在24 h时该基因表达量分别为相同时间点未去顶处理的19.94 倍,差异极显著(P < 0.01),在48 h为相同时间点未去顶处理的和27.68 倍,差异极显著(P < 0.001)(图13-C)。推测MAX2A基因受去顶处理诱导,在滇红腋芽萌发中具有重要作用。
3. 讨论与结论
SLs在植物根部合成并向顶部运输,从而抑制植株侧枝的生长。SLs生物合成和信号转导基因突变体常表现出腋芽生长量增加,顶端优势下降和高分蘖矮化的性状[23−24]。作为SLs信号转导途径关键基因,MAX2基因在进化过程中非常保守,在调控叶片面积、叶片衰老时间和根的生长发育等功能上均具有保守性[25],其编码的F-box蛋白广泛参与植物对各种生物及非生物逆境胁迫的应答过程[26],且属于α/β水解酶家族,该家族成员在调控侧枝发生方面发挥重要作用[27]。本研究克隆月季少侧枝品种滇红的RhMAX2A基因,利用生物信息学分析获得其基本理化信息;分析发现RhMAX2A蛋白的不稳定系数为53.07(> 40.00),推测其为不稳定蛋白,没有明显的跨膜螺旋和信号肽,含有一个典型的F-box结构域,表明该蛋白不会进行跨膜转移,与苏倩[16]、董雪[17] 袁飞荣[28]等对MAX2蛋白的研究结果一致。使用NCBI数据库将RhMAX2A蛋白与其他物种同源蛋白进行BLAST比对分析,发现其与蔷薇科植物 MAX2A蛋白的氨基酸序列相似性较高,且系统发育进化树也显示RhMAX2A蛋白与同为蔷薇亚科的月月粉和草莓的亲缘关系最近,说明MAX2A蛋白的进化关系稳定,具有一定的保守性。亚细胞定位结果显示,该蛋白定位在细胞核,与苹果[20]、棉花[15]的MAX2蛋白定位于细胞核的研究结果一致,因此推测MAX2可能在月季SLs信号转导中靶向转录调节因子的降解中发挥中心作用。
此外,本研究通过qRT-PCR检测RhMAX2A基因的组织表达特性,发现它仅在根、腋芽和节中表达,在根中表达量最高,与大豆( Glycine max )中MAX2基因在根中表达量最高[29]的研究结果一致,同时也验证了前人研究发现MXA2基因在调控根的生长发育等功能上均具有保守性的研究结果一致[25],但本研究中MAX2A基因在其他组织中几乎检测不到表达,无显著的组织特异性,这与苹果中MAX2基因的表达没有显著的组织表达特异性[17]的研究结果一致;但与紫花苜蓿[16]、列当[17]、黄瓜( Cucumis sativus )[26]等植物的MAX2基因在不同组织中都普遍表达的研究结果不一致。分析原因可能是不同植物的遗传差异以及因激素互作造成的反馈差异。去顶可打破植物顶端优势,导致腋芽中内源激素含量发生变化,从而促使腋芽萌发和生长[30]。本试验对滇红进行去顶处理,发现去顶后RhMAX2A 基因显著上调表达,于去顶处理后48 h达到峰值;其在腋芽中表达量呈现先下降后上升的趋势,与苹果中MdMAX2A基因在去顶后表达量先下降后上升,在48 h表达量最高的研究结果一致[31];而去顶后在根中的表达量呈现上升-下降-上升的趋势,与苹果中MdMAX2A 基因在去顶后在8 h、24 h表达量下降,48 h表达量上升的变化趋势不一致[31],并且去顶后12 h MAX2A基因在根中的表达量显著高于对照,分析原因可能是滇红为少侧枝品种,去顶后其地下部的根部的响应机制与地上部腋芽不同,也可能是去顶后数据采集的时间点和植物材料之间的遗传差异性。
滇红RhMAX2 基因的表达受去顶诱导,但其具体的分子作用机制尚不清楚,后续可通过基因沉默、遗传转化等手段进行进一步研究,为明确RhMAX2A调控月季侧枝发育的分子机制奠定基础。
-
图 13 RhMAX2A基因在不同组织及去顶处理下的表达模式
A. 不同组织,B. 根,C. 腋芽; ns表示无显著差异(P > 0.05),*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),***表示差异极显著(P < 0.001)。
Figure 13. Expressions of RhMAX2A in tissues after decapitation on plant
A: Different tissues; B: roots; C: axillary buds; ns: no significance at P˃0.05; *: significant difference at P<0.05; **: extremely significant difference at P<0.01; ***: extremely significant difference at P<0.001.
表 1 引物序列
Table 1 Primer sequences
引物名称 Primer 引物序列 Primer sequence 引物用途 Primer application RhMAX2A-F 5′-TCTCTCTCGAGCTTTCGCGAGCTCATGCAATCGCGTTCACGTG-3′ 基因克隆 Gene cloning RhMAX2A-R 5′-TCGCCCTTGCTCACCATGGATCCATCAAGGATTGTGCGCCTGT-3′ 基因克隆 Gene cloning 18S rRNA-F 5′-CCTGAGAAACGGCTACCACAT-3′ 内参基因 Endogenous gene 18S rRNA-R 5′-CACCAGACTTGCCCTCCA-3′ 内参基因 Endogenous gene UBC-F 5′-GCCAGAGATTGCCCATATGTGTA-3′ 内参基因 Endogenous gene UBC-R 5′-TCACAGAGTCCTAGCAGCACA-3′ 内参基因 Endogenous gene RhMAX2A-qRT-F 5′-GATCGACTTCTTCTCCGGGCTT-3′ 荧光定量引物 qRT-PCR RhMAX2A-qRT-R 5′-CCAATCCACTGTCCCTCACGTT-3′ 荧光定量引物 qRT-PCR RhMAX2A-GFP-F 5′-TCTCTCTCGAGCTTTCGCGAGCTCATGCAATCGCGTTCACGTG-3′ 载体引物 Vector primer RhMAX2A-GFP-R 5′-TCGCCCTTGCTCACCATGGATCCATCAAGGATTGTGCGCCTGT-3′ 载体引物 Vector primer -
[1] 王榕, 牛晓茹, 陈己任. 月季RcTCP20基因的克隆及在拟南芥中的功能分析 [J]. 植物生理学报, 2022, 58(10):1907−1918. WANG R, NIU X R, CHEN J R. Cloning of RcTCP20 of rose and function analysis in Arabidopsis thaliana [J]. Plant Physiology Journal, 2022, 58(10): 1907−1918.
[2] YOUNG E L, WU X, LIANG S, et al. Heritability of plant architecture in diploid roses [J]. Acta Horticulturae, 2019(1232): 15−18.
[3] KAWAMURA K, HIBRAND-SAINT OYANT L, CRESPEL L, et al. Quantitative trait loci for flowering time and inflorescence architecture in rose [J]. Theoretical and Applied Genetics, 2011, 122(4): 661−675. DOI: 10.1007/s00122-010-1476-5
[4] AL-BABILI S, BOUWMEESTER H J. Strigolactones, a novel carotenoid-derived plant hormone [J]. Annual Review of Plant Biology, 2015, 66: 161−186. DOI: 10.1146/annurev-arplant-043014-114759
[5] 杜高齐, 李雪娇, 许彬, 等. 月季RhD14基因克隆、亚细胞定位及表达分析 [J]. 南方农业学报, 2023, 54(1):34−45. DU G Q, LI X J, XU B, et al. Cloning, subcellular localization and expression analysis of RhD14 gene in rose [J]. Journal of Southern Agriculture, 2023, 54(1): 34−45.
[6] KONG X P, ZHANG M L, DING Z J. D53: The missing link in strigolactone signaling [J]. Molecular Plant, 2014, 7(5): 761−763. DOI: 10.1093/mp/ssu016
[7] STRUK S, DE CUYPER C, JACOBS A, et al. Unraveling the MAX2 protein network in Arabidopsis thaliana: Identification of the protein phosphatase PAPP5 as a novel MAX2 interactor [J]. Molecular & Cellular Proteomics:MCP, 2021, 20: 100040.
[8] WATERS M T, GUTJAHR C, BENNETT T, et al. Strigolactone signaling and evolution [J]. Annual Review of Plant Biology, 2017, 68: 291−322. DOI: 10.1146/annurev-arplant-042916-040925
[9] SHEN H, LUONG P, HUQ E. The F-box protein MAX2 functions as a positive regulator of photomorphogenesis in Arabidopsis [J]. Plant Physiology, 2007, 145(4): 1471−1483. DOI: 10.1104/pp.107.107227
[10] YAO R F, MING Z H, YAN L M, et al. DWARF14 is a non-canonical hormone receptor for strigolactone [J]. Nature, 2016, 536: 469−473. DOI: 10.1038/nature19073
[11] WANG Y, SUN S Y, ZHU W J, et al. Strigolactone/MAX2-induced degradation of brassinosteroid transcriptional effector BES1 regulates shoot branching [J]. Developmental Cell, 2013, 27(6): 681−688. DOI: 10.1016/j.devcel.2013.11.010
[12] WANG L, WANG B, JIANG L, et al. Strigolactone signaling in Arabidopsis regulates shoot development by targeting D53-like SMXL repressor proteins for ubiquitination and degradation [J]. The Plant Cell, 2015, 27(11): 3128−3142. DOI: 10.1105/tpc.15.00605
[13] ZHOU F, LIN Q B, ZHU L H, et al. D14–SCFD3-dependent degradation of D53 regulates strigolactone signalling [J]. Nature, 2013, 504: 406−410. DOI: 10.1038/nature12878
[14] DONG L L, ISHAK A, YU J, et al. Identification and functional analysis of three MAX2 orthologs in chrysanthemum [J]. Journal of Integrative Plant Biology, 2013, 55(5): 434−442. DOI: 10.1111/jipb.12028
[15] ZHAO L L, FANG J J, XING J, et al. Identification and functional analysis of two cotton orthologs of MAX2 which control shoot lateral branching [J]. Plant Molecular Biology Reporter, 2017, 35(5): 480−490. DOI: 10.1007/s11105-017-1040-4
[16] 苏倩, 杜文宣, 马琳, 等. 紫花苜蓿MsCIPK2的克隆及功能分析 [J]. 中国农业科学, 2022, 55(19):3697−3709. DOI: 10.3864/j.issn.0578-1752.2022.19.002 SU Q, DU W X, MA L, et al. Cloning and functional analyses of MsCIPK2 in Medicago sativa [J]. Scientia Agricultura Sinica, 2022, 55(19): 3697−3709. (in Chinese) DOI: 10.3864/j.issn.0578-1752.2022.19.002
[17] 董雪. 瓜列当独脚金内酯感知基因PaMAX2克隆及其功能研究[D]. 石河子: 石河子大学, 2021. DONG X. Cloning and functional study of strigolactone perception gene PaMAX2 in guadalajaran[D]. Shihezi: Shihezi University, 2021. (in Chinese)
[18] HE P, ZHANG H Z, ZHANG L, et al. The GhMAX2 gene regulates plant growth and fiber development in cotton [J]. Journal of Integrative Agriculture, 2022, 21(6): 1563−1575. DOI: 10.1016/S2095-3119(21)63603-1
[19] 姜思思. 杨树中MAX2同源基因的克隆[D]. 武汉: 华中农业大学, 2016. JIANG S S. Cloning of MAX2 homologous genes in Populus[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[20] 李国防. 苹果MAX2基因介导独脚金内酯信号调控腋芽萌发的功能研究[D]. 杨凌: 西北农林科技大学, 2018. LI G F. Functional study of MAX2 gene on the regulation of axillary bud outgrowth by mediating strigolactone signaling in Malus[D]. Yangling: Northwest A & F University, 2018. (in Chinese)
[21] 朱思雅, 李雪娇, 赵雁, 等. 去顶诱导的食用玫瑰‘滇红’腋芽萌发及内源激素含量变化[J/OL]. 分子植物育种, 1-12[2024-02-29]. http://kns.cnki.net/kcms/detail/46.1068.S.20220804.1416.006.html. ZHU S Y, LI X J, ZHAO Y, et al. Changes of axillary bud outgrowth and endogenous hormone contents of edible rose, R. chinensis Dianhong, induced by decapitation[J]. Molecular Plant Breeding, 1-12[2024-02-29]. http://kns.cnki.net/kcms/detail/46.1068.S.20220804.1416.006.html.
[22] 朱思雅. 去顶诱导的月季腋芽形态、内源激素变化及转录组分析[D]. 昆明: 云南农业大学, 2021. ZHU S Y. Axillary bud morphology, endogenous hormone changes and transcriptome analysis of Rose axillary buds induced by topping[D]. Kunming: Yunnan Agricultural University, 2021. (in Chinese)
[23] DUN E A, DE SAINT GERMAIN A, RAMEAU C, et al. Dynamics of strigolactone function and shoot branching responses in Pisum sativum [J]. Molecular Plant, 2013, 6(1): 128−140. DOI: 10.1093/mp/sss131
[24] TANG Y J, LIESCHE J. The molecular mechanism of shade avoidance in crops–How data from Arabidopsis can help to identify targets for increasing yield and biomass production [J]. Journal of Integrative Agriculture, 2017, 16(6): 1244−1255. DOI: 10.1016/S2095-3119(16)61434-X
[25] 程亭亭. 柳枝稷分蘖调控基因PvMAX2的功能研究[D]. 杨凌: 西北农林科技大学, 2018. CHENG T T. Functional analysis of tillering-related gene PvMAX2 in switchgrass[D]. Yangling: Northwest A & F University, 2018. (in Chinese)
[26] 任广悦, 金晓霞, 陈超, 等. 黄瓜独脚金内酯信号转导基因CsMAX2的克隆与表达分析 [J]. 分子植物育种, 2020, 18(16):5237−5246. REN G Y, JIN X X, CHEN C, et al. Cloning and expression analysis of strigolactone signal transduction gene CsMAX2 in cucumber (Cucumis sativus) [J]. Molecular Plant Breeding, 2020, 18(16): 5237−5246. (in Chinese)
[27] FIORILLI V, FORGIA M, DE SAINT GERMAIN A, et al. A structural homologue of the plant receptor D14 mediates responses to strigolactones in the fungal phytopathogen Cryphonectria parasitica [J]. The New Phytologist, 2022, 234(3): 1003−1017. DOI: 10.1111/nph.18013
[28] 袁飞荣, 袁耀明, 李智鑫, 等. 枳橙CPMAX2基因的克隆、载体构建及其表达研究 [J]. 园艺学报, 2015, 42(12):2497−2504. YUAN F R, YUAN Y M, LI Z X, et al. Cloning, constructing the over-expression vector and expression analysis of CPMAX2 in transgenic citrange with rolABC genes [J]. Acta Horticulturae Sinica, 2015, 42(12): 2497−2504. (in Chinese)
[29] BASIR UL HAQ. MAX基因参与大豆独角金内酯合成和信号传导的功能研究[D]. 武汉: 华中农业大学, 2018: 35-45. BASIR U. Study on the function of MAX gene involved in the synthesis and signal transduction of soybean monogonolide[D]. Wuhan: Huazhong Agricultural University, 2018: 35-45. (in Chinese)
[30] DIERCK R, KEYSER E D, RIEK J D, et al. Change in auxin and cytokinin levels coincides with altered expression of branching genes during axillary bud outgrowth in Chrysanthemum [J]. PLoS One, 2016, 11(8): e0161732. DOI: 10.1371/journal.pone.0161732
[31] 程方. 苹果独脚金内酯合成基因MdMAX1调控腋芽萌发的功能研究[D]. 杨凌: 西北农林科技大学, 2020 CHENG F. Study on the function of apple strigolactone synthetic gene MdMAX1 in regulating axillary bud germination[D]. Yangling: Northwest A & F University, 2020. (in Chinese)
-
期刊类型引用(3)
1. 肖路臣, 何奕含, 刘朝中, 赵文杰, 田黔松, 柳寒烨, 赵程鹏, 肇瑾, 解婷婷. 月季RhMAX2-like基因的克隆与表达分析. 农业生物技术学报. 2025(08)  百度学术
百度学术
2. 孙翔宇, 龚诗琦, 罗玉松, 张成桃, 宋慧娟, 孙龙俊, 何长征, 汤冰倩, 孙小武, 戴思慧. 西瓜ERECTA基因克隆、生物信息学与非生物胁迫下表达分析. 中国蔬菜. 2025(07)  百度学术
百度学术
3. 管嵩,朱思雅,罗中元,贺水莲,赵雁,孟静. 去顶诱导滇红月季腋芽萌发过程中的转录组分析. 南方农业学报. 2025(02): 392-406 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: