Expression and Function of Citrate Synthase Gene in Jackfruit
-
摘要:目的 分析波罗蜜柠檬酸合酶基因(Artocarpus heterophyllus citrate synthase,AheCS)的生物学功能,研究柠檬酸含量与AheCS基因相对表达量的相关性,为探究AheCS基因在波罗蜜(Artocarpus heterophyllus Lam. , Ahe)果实有机酸代谢中的可能作用提供参考。方法 以海大2号波罗蜜果实为材料,采用0.5 mg·L−1 1-甲基环丙烯(1-Methylcyclopropene,1-MCP)和1000 mg·L−1 外源乙烯利(ethrel , ETH )(40%)处理,研究室温(22±1) ℃、相对湿度90% 条件下波罗蜜果实成熟过程中柠檬酸的动态变化,克隆获得3个波罗蜜的CS基因(AheCS1 、 AheCS2 和 AheCS3),对其进行生物信息学分析,同时分析3个AheCS基因在不同采后处理下(自然成熟、外源乙烯催熟和1-MCP延缓成熟)的相对表达情况及其与柠檬酸含量的相关性。结果 随着波罗蜜果实的自然成熟,果实中柠檬酸含量呈先上升后下降的变化趋势;外源ETH处理加速了柠檬酸的合成速率,提前了峰值出现的时间;1-MCP处理抑制了贮藏前期柠檬酸含量下降速率,推迟了高峰出现时间。生物信息学分析发现,AheCS1/2/3基因的开放阅读框(ORF)长1422~1827 bp,编码蛋白都含有柠檬酸合酶保守结构域WPNVDAHS,属于柠檬酸合酶家族成员。AheCS1/2/3蛋白氨基酸序列分别与柑橘(Citrus reticulata Blanco.)CsCS(MH_048698.1)、川桑(Morus notabilis C. K. Schneid.)MnCs(XP010087965.1) 、 红掌(Anthurium andraeanum Linden.)AaCS(JAT55223.1)亲缘关系最近,相似性分别达到86.49%、97.00%、86.00%。qRT-PCR结果显示: AheCS1/2/3基因在果实自然成熟(CK)前期表达量低,而后期表达量高;外源ETH处理提前了AheCS 1的表达峰值时间,整体提高了AheCS 2/3的表达量;而1-MCP处理推迟了AheCS1/2/3表达峰值出现时间,增加了AheCS1/2/3成熟后期的表达量。相关性分析发现,波罗蜜果实成熟过程中柠檬酸含量与AheCS1/2/3基因表达呈一定相关性,其中与AheCS2相关性显著。结论 AheCS2是参与调控波罗蜜成熟过程中柠檬酸积累的潜在基因,可作为进一步研究波罗蜜AheCS基因的功能及遗传改良的候选基因。Abstract:Objective The biological function of AheCS gene and the correlation between citric acid content and relative expression of AheCS gene were analyzed, and the possible role of AheCS gene in the metabolism of organic acids in jackfruit was discussed.Method AheCS1, AheCS2, and AheCS3 from fruits of A. heterophyllus Haida 2 were cloned for a bioinformatic analysis. At room temperature(22±1℃) and 90% RH, changes on the gene expression and citric acid content in the fruits under natural ripening process or exposed to either 0.5 mg·L−1 of 1-MCP or 1,000 mg·L−1 of 40% ethylene (ETH) were determined.Result The citric acid content in a naturally ripening jackfruit gradually rose and declined subsequently. It increased at an accelerated rate when exposed to ETH, but the rate was slowed down by the 1-MCP treatment. The ORFs of the three genes ranged from 1 422 bp to 1 827 bp containing conserved WPNVDAHS domain and belonging to the CS family. The amino acid sequences were phylogenetically closely related to those of CsCS (MH_048698.1) in citrus with a similarity of 86.49%, MnCS (XP010087965.1) in mulberry with a similarity of 97%, and AaCS (JAT55223.1) in anthurium with a similarity of 86%. The expressions of these genes were low in the early stage and raised subsequently during natural ripening (CK). However, the exogenous ETH hastened the increasing rate of AheCS1 expression and elevated the levels of AheCS2 and AheCS3 expressions, while 1-MCP delayed the rise but heightened the expression levels of the three genes at the stage near fruit maturity. The citric acid content of the ripening fruits generally positively correlated with the gene expressions. The correlation with AheCS2 reached a statistically significant level.Conclusion AheCS2 is a potential gene involved in the regulation of citric acid accumulation during the ripening process of jackfruit, and it can be a candidate gene for further study of the function and genetic improvement of the AheCS gene in jackfruit .
-
Keywords:
- Jackfruit /
- citrate acid /
- AheCS /
- cloning /
- gene expression
-
0. 引言
【研究意义】有机酸是果实内在品质的重要组成部分,直接影响果实口感[1]。在果实采后贮藏的过程中,有机酸作为基础代谢底物,会随着呼吸和能量代谢转化逐渐减少,而导致果实加速衰老,果实品质降低,甚至失去食用价值[2]。柠檬酸是果实中主要的有机酸之一,它的合成起源于线粒体的三羧酸循环,磷酸烯醇式丙酮酸经羧化酶催化生成草酰乙酸,进入柠檬酸循环,草酰乙酸和乙酰辅酶A缩合生成柠檬酸,形成柠檬酸合成途径[3]。参与此过程的酶有异柠檬酸脱氢酶、乌头酸酶、磷酸烯醇丙酮酸和柠檬酸合酶(Citrate synthase, CS)等。在不同种类的果实中,这些酶的作用也不尽相同,其中柠檬酸合酶和磷酸烯醇式丙酮酸是促进柠檬酸合成的关键酶,而乌头酸酶和异柠檬酸脱氢酶则负责促进柠檬酸的分解[4]。柠檬酸合酶是三羧酸循环中柠檬酸合成的关键限速酶之一,其作用是将乙酰辅酶A和草酰乙酸催化缩合生成柠檬酸,因此柠檬酸合酶的活性对整个代谢途径的速度具有重要影响[5]。CS具有多种同工酶,参与线粒体能量代谢、抗逆等多种生理过程[6,7]。柠檬酸合酶根据在真核细胞中的位置,可分为线粒体CS(mtCS)、乙醛酸循环体CS(gCS)和过氧化物酶体CS(pCS)[8],它们几乎存在于所有的生物体中,其中控制柠檬酸合成的主要酶是线粒体柠檬酸合酶(mtCS)[9]。波罗蜜(Artocarpus heterophyllus Lam.),又名木菠萝、树菠萝,是一种有名的热带水果,果实风味极佳。波罗蜜柠檬酸合酶基因(AheCS)研究,特别是果实后熟过程中柠檬酸的变化及其相关基因表达变化,对了解波罗蜜果实风味品质的形成机理具有重要意义。【前人研究进展】研究表明,CS基因是一个多家族成员基因,最早从蓖麻(Ricinus communis L.)[10]中分离得到,目前已从柑橘 [11]、柚子[Citrus maxima (Burm) Merr.][12]、草莓(Fragaria×ananassa Duch.)[13]、油茶(Camellia oleifera Abel.)[14]和甜橙[Citrus sinensis (L.) Osbeck][15]、酸橙(Citrus × aurantium Engl.)[16]、油菜(Brassica napus L.)[17]等多种植物中克隆到CS基因,证明CS基因广泛存在于植物体内,并且发现它们在柠檬酸代谢中扮演着重要角色。波罗蜜属于淀粉转化型果实,在果实后熟过程中淀粉快速降解,葡萄糖、果糖和蔗糖含量快速增加,果实风味变甜,可滴定酸含量也呈现先升后降的变化趋势[18]。分析不同株系波罗蜜果肉中有机酸发现,波罗蜜果肉中的有机酸包括草酸、酒石酸、维生素C、柠檬酸和苹果酸,其中柠檬酸是主要的有机酸之一[19]。波罗蜜属于呼吸跃变型果实,其成熟过程与乙烯代谢紧密相关。在波罗蜜果实成熟过程中,内源乙烯不断释放,并出现明显的乙烯高峰和呼吸跃变[20]。外源乙烯利可促进波罗蜜果实的成熟衰老[21],而乙烯作用抑制剂1-甲基环丙烯(1-Methylcyclopropene, 1-MCP)则抑制了波罗蜜成熟相关的变化,并且有效延缓了波罗蜜衰老,保持波罗蜜品质[22]。【本研究切入点】目前关于波罗蜜果实采后CS基因的表达还有待深入研究。【拟解决的关键问题】以海大2号波罗蜜果实为材料,对其AheCS1/2/3基因进行扩增和生物信息学分析,同时对不同处理下果实柠檬酸含量和CS基因的相对表达情况进行分析,阐述波罗蜜果实柠檬酸的变化与CS基因表达量的相关性,为有机酸积累机理的研究和波罗蜜的采后保鲜提供一定的参考。
1. 材料与方法
1.1 试验材料及其处理
于广东海洋大学种质资源圃(110°19′7.21″E,21°09′18.47″N)采集供试材料海大2号干苞型波罗蜜品种果实。在果实八分成熟时采收。果实采后立即运回实验室,选择成熟度和大小一致、无病虫伤的果实,以1000 mg·L−1 ETH(40%)溶液浸泡和0.5 mg·L−1 1-MCP熏蒸处理,密封熏蒸17 h处理,具体操作参照王俊宁等 [18]的方法,以未经处理的果作为对照(CK)。处理后将3组材料均放在 (22±1) ℃、90% 的相对湿度条件下贮藏,在相同间隔时间的取样:CK 在贮藏后 0、2、4、6、8、10、12 d 取样,外源ETH 处理在贮藏后 0、2、4、6、8 d 取样,1-MCP处理在贮藏后 0、2、4、6、8、10、12、14、16、18 d取样。每次取3~5个果,取出果肉并切成小块,混匀后用液氮速冻,存放在−80 ℃超低温冰箱中备用。
1.2 柠檬酸测定及基因表达分析
1.2.1 柠檬酸的测定
参照夏春华等[19]的方法。称取上述果肉 1.0 g 于研钵中,2 mL偏磷酸(叶源生物,中国上海)研磨匀浆,转入10 mL离心管,用超纯水清洗研钵并定容至10 mL,室温12000 r·min−1离心15 min,取1 mL 上清液于0.22 μm滤膜过滤后上机分析。采用安捷伦1260 Infinity II 超高效液相色谱仪,色谱柱为C18,流动相为0.2%偏磷酸,柱流速为 1 mL·min−1,柱温为 35 ℃,进样量10 μL,每个指标重复3次。标样为柠檬酸(TMstandard,美国)。
1.2.2 总RNA的提取和cDNA第一链的合成
使用华越洋Plant RNA Kit超快型植物RNA提取试剂盒(华越洋,中国北京)。从波罗蜜果实中成功提取总RNA。这些总RNA随后被用作模板, 通过使用PrimeScript™ IV 1st strand cDNA Synthesis Mix试剂盒(TaKaRa,中国大连)进行反转录,合成第一链cDNA。
1.2.3 PCR引物设计及合成
波罗蜜全基因组数据库中找到3个全长的CS基因(NCBI登录号:PRJNA788174),命名为AheCS1、AheCS2和AheCS3。使用Primer Premier 5.0软件,针对全长引物和qRT-PCR引物进行设计,并委托上海生工生物工程有限公司进行合成(表1)。
表 1 AheCS1、AheCS2和AheCS3基因全长引物序列Table 1. Sequences of AheCS1, AheCS2, and AheCS3 primers引物名称
Primer names引物序列(5′-3′)
Primer sequencesAheCS1-F
AheCS1-R
AheCS2-F
AheCS2-R
AheCS3-F
AheCS3-R5′-ATGGCCACCGGACAGCTATTCTCGCG-3′
5′-TCACTTGGTGTAAAGAACGTCCTCCCATG-3′
5′-ATGGTGTTCTTCAGGGGCGTGTCTGTGC-3′
5′-TCAAGACGAAGCCGCTTTCTTGCAGTAA-3′
5′-ATGGAATTGCCAGTCACGGCACGAGC-3′
5′-TTAAATGCCAGAACCCGCCAGCCGG-3′1.2.4 目的基因克隆与表达分析
以海大2号波罗蜜果实cDNA为模板,通过PCR扩增技术,成功获得目的片段。对目的片段经回收、连接转化后,阳性克隆送至上海生工生物工程有限公司进行检测测序,得到目的基因的全长序列。选择GAPDH为内参基因,并基于AheCS1/2/3基因的全长设计荧光定量引物(表2)。qPCR扩增程序如下:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,35个循环;然后72 ℃延伸10 min,16 ℃保存。基因相对表达量采用2−△△CT的方法进行计算。
表 2 基因荧光定量引物序列Table 2. Sequences of quantitative qRT-PCR primers引物名称
Primer names引物序列(5′-3′)
Primer sequencesAheCS1-F 5′-AGAATCAAGCACTAAGGGACG-3′ AheCS1-R 5′-TTCAGGAATTTGTGGAGGC-3′ AheCS2-F 5′-GCCTCCCATCCTAACAGAAA-3′ AheCS2-R 5′-CGCTCGGTCCCATACTAACT-3′ AheCS3-F 5′- CCAACCGAGTTCTTCCCTG-3′ AheCS3-R 5′- GATAATGCCGCAACCAAAC-3′ GAPDH-F 5′- TTGAAGGGTGGNGCNAARAARG -3′ GAPDH-R 5′- ATAACCCCAYTCRTTRTCRTAC-3′ 1.2.5 基因生物学功能分析
利用DNAMAN软件进行碱基序列分析,翻译成氨基酸序列。利用EXPASY(http://web.expasy.org/protparam/)进行氨基酸序列分析。采用 ProtParam tool(https://web.expasy.org/protparam/)预测AheCS1/2/3编码蛋白的基本理化性质;利用在线工具 DictyOGlyc 1.1 Server和 NetPhos 3.1 Server 对AheCS1/2/3编码蛋白糖基化和磷酸化位点预测;利用Plant-mPLoc server - SJTU (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/) 对AheCS1/2/3蛋白质进行亚细胞定位预测。利用Protscale(http://web.expasy.org/protscale/)网站的进行蛋白疏水性分析分析。用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测AheCS1/2/3编码蛋白的二级结构;使用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page)构建其AheCS1/2/3蛋白的三级结构模型;利用SMART(http://smart.embl-heidelberg.de/)基因编码的氨基酸的结构域进行分析;将AheCS1/2/3蛋白提交到Pfam 34.0 (http://pfam.xfam.org/)和NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)数据库对其保守结构区域进行验证。在NCBI-Blast与AheCS1/2/3氨基酸序列相似的物种序列及在拟南芥数据库 TAIR (https://www.arabidopsis.org/)下载拟南芥CS蛋白全长序列;使用Phytozome 13 数据库(https://phytozome-next. jgi. doe.gov) 下载其他物种的CS蛋白序列;用软件Clustalx和GENEDOC进行不同物种CS氨基酸多重匹配分析;在软件MEGA11.0上使用邻接法(Neighbor-Joining)构建系统进化树;使用iTOL(https://itol.embl.de/upload.cgi)对进化树进行美化;将AheCS1/2/3蛋白质提交到MEME (https://meme-suite.org/meme/doc/meme.html)网站对保守基序进行分析,保存xml文件并使用Tbtools软件对结果进行可视化分析。
1.3 数据统计
采用Excel 2007、SPSS25.0软件进行Duncan's方差分析以及Pearson相关性分析。图表制作软件为Origin Lab Origin 2021。
2. 结果与分析
2.1 不同处理波罗蜜果实柠檬酸含量的变化
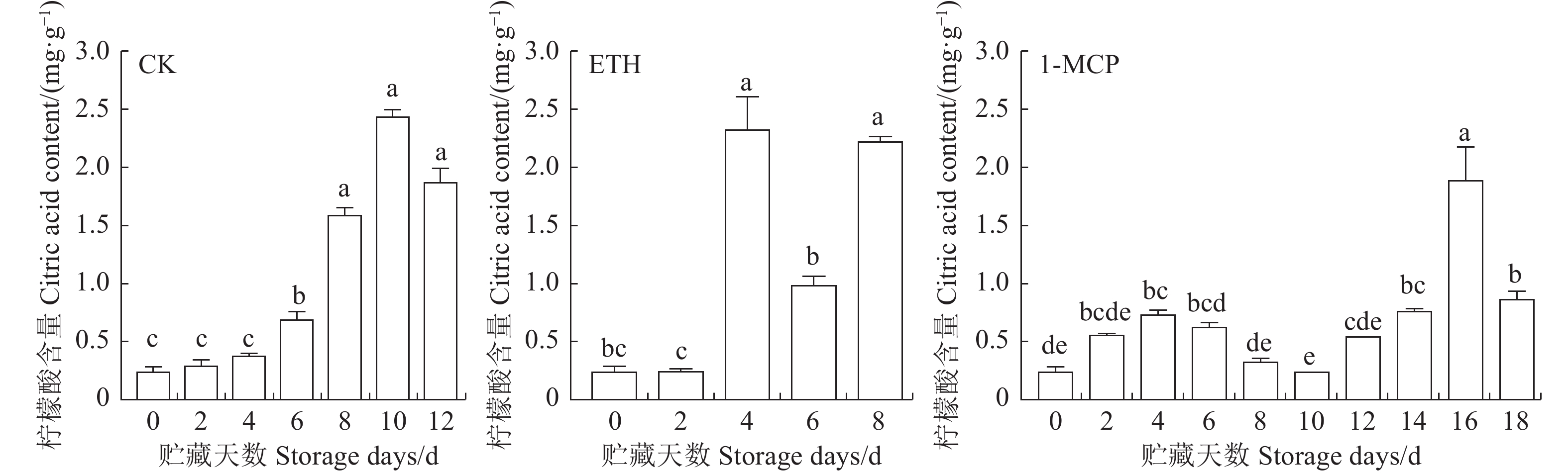
对处理和未处理果实的采样分析表明,未处理波罗蜜果实(CK)成熟过程中柠檬酸含量呈先上升后下降的变化趋势,于第10天出现峰值,为(2.43±0.06)mg·g−1,且在8~12 d极显著高于0~6 d的含量。ETH处理加速了柠檬酸的合成,于第4天出现峰值(2.32±0.28) mg·g−1后下降,在第8天又有所上升,在第4天其含量显著高于对照(CK)(P<0.05)。1-MCP处理的柠檬酸含量变化均呈“一小一大”双峰变化趋势,分别于第4天和第16天出现一小峰和一大峰,峰值分别为(0.73±0.04)mg·g−1和(1.88±0.29) mg·g−1,且第16天与第0天相比含量显著提高了8.17% (图1)。
2.2 波罗蜜AheCS1、AheCS2和AheCS3基因克隆
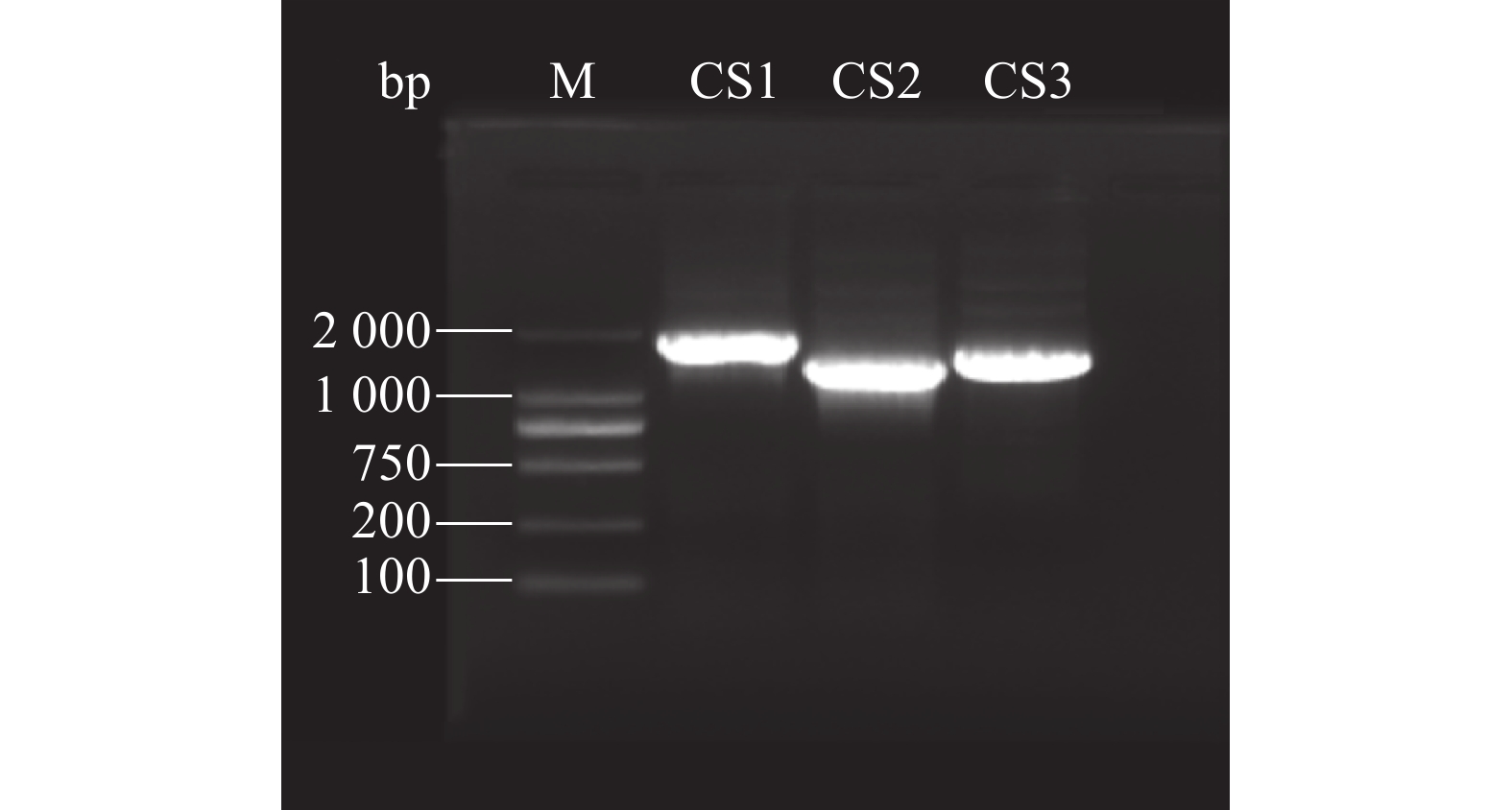
以反转录的cDNA作为模板,PCR扩增后,经1%琼脂糖凝胶电泳检测(图2),AheCS1基因长度在2000 bp左右,AheCS2和AheCS3基因的长度在1500 bp左右,经过回收、连接、转化和测序检测。最终获得它们的全长cDNA序列,长度分别为1827、1422、1539 bp,与数据库中预测的长度相符。
2.3 波罗蜜 AheCS基因的生物信息学分析
使用ProtParam tool在线预测软件对AheCS1/2/3蛋白理化性质分析发现,结果显示分别编码 608、473和513个氨基酸,分子量为151.18 、52.89、56.42 kDa;在AheCS1/2/3蛋白的氨基酸组成中,酪氨酸(Try)含量最高,其次是甘氨酸(Glu),丝氨酸(Ser)含量最低;AheCS1/2/3编码蛋白属于不稳定性的碱性蛋白,同时也是亲水性蛋白(表3)。
表 3 AheCS1/2/3 蛋白的理化性质Table 3. Physiochemical properties of AheCS1, AheCS2, and AheCS3 proteins基因名称
Gene name氨基酸数
Number of amino acids分子质量
Molecular weight/kD等电点
pI脂肪系数
Aliphatic index不稳定系数
Instability index亲水性
Grand average of
hydropathicity含量最多的 3 种氨基酸
Top 3 amino acids/%AheCS1 608 151.18 4.96 25.29 45.73 0.698 Ala 25.3
Gly25.7
Thr27.5AheCS2 473 52.89 7.20 26.37 40.34 0.652 Gly24.6
Ala26.4
Thr29.7AheCS3 513 56.42 8.15 25.02 47.61 0.748 Ala25.0
Gly25.4
Thr26.3利用SoftBerry ProtComp 9.0 软件对波罗蜜AheCS1/2/3蛋白进行亚细胞定位预测发现,AheCS1定位在细胞质的分数为8.81;而AheCS2不仅在线粒体中定位得分高达6.94,且在过氧化物酶体上有较高得分,分数为5.91;AheCS3蛋白在过氧化物酶体上有较高得分9.41(共10分)。说明AheCS1蛋白可能定位于细胞质上,AheCS2蛋白可能定位于线粒体、过氧化物酶体上;而 AheCS3蛋白定位在过氧化物酶体(9.41)、细胞质内层(0.33)、高尔基体(0.14)、叶绿体(0.12)等部位,但分值差异较大,证明它可能在上述等部位均有分布(表4)。
表 4 AheCS1/2/3 蛋白的亚细胞定位预测Table 4. Predicted subcellular localization of AheCS1, AheCS2, and AheCS3 proteins定位 Location AheCS1 AheCS2 AheCS3 细胞核 Nuclear 0.04 0.03 0.00 质膜 Plasma membrane 0.02 0.12 0.00 胞外 Extra-cellular 0.00 0.00 0.00 细胞质Cytoplasmic 8.81 0.00 0.00 线粒体 Mitochondria 0.07 6.94 0.00 细胞质内层 Endoplasm retic 0.08 0.00 0.33 过氧化物酶体Peroxisomal 0.00 5.91 9.41 高尔基体Golgi 0.00 0.01 0.14 叶绿体 Chloroplast 0.66 0.00 0.12 液泡 Vacuolar 0.31 0.00 0.00 利用DictyOGlyc 1.1 Server对波罗蜜AheCS1/2/3蛋白进行糖基化位点预测发现,AheCS1蛋白有 1个丝氨酸(Ser)的糖基化位点,而 AheCS1/2/3蛋白无糖基化位点。磷酸化位点预测显示:其中AheCS1包括59个丝氨酸(Ser)、55个苏氨酸(Thr)和24个酪氨酸(Tyr)3 种磷酸化位点;而AheCS2蛋白磷酸化位点仅有36个;AheCS3蛋白含有48个磷酸化位点(表5),其中,被磷酸化丝氨酸的位点数目在AheCS1/2/3中均为最多,而酪氨酸被磷酸化的位点均最少。
表 5 AheCS1/2/3蛋白磷酸化和糖基化位点及二级结构组分Table 5. Phosphorylation and glycosylation sites and secondary structure components of AheCS1, AheCS2, and AheCS3 proteins基因名称
Gene name糖基化位点数
Number of glycosy/个磷酸化位点数
number of phosphorylation sites/个二级结构组分
secondary structure component/%丝氨酸
Ser苏氨酸
Thr酪氨酸
Tyrα-螺旋
α-helix延长链
Extend chainβ-转角
β-turn无规则卷曲
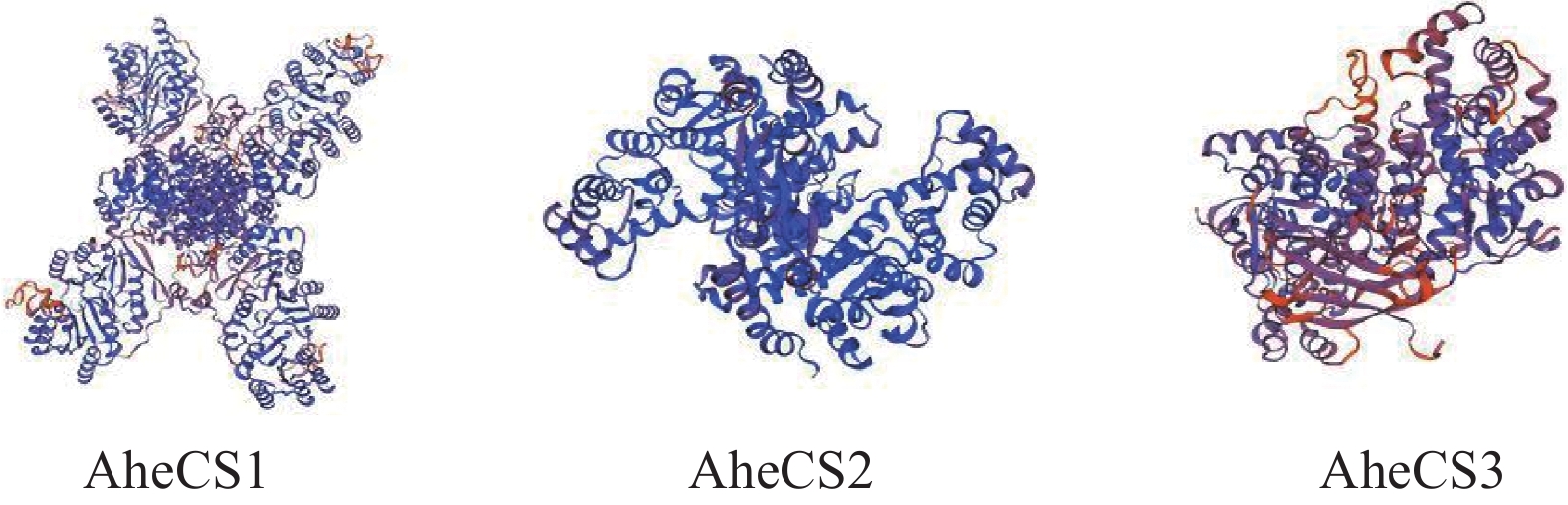
Random coilAheCS1 1 59 55 24 40.95 16.78 9.54 32.73 AheCS2 0 17 10 9 53.70 8.88 7.82 29.60 AheCS3 0 28 9 11 47.85 9.96 5.08 37.11 使用PHD 在线软件对AheCS 1/2/3蛋白进行预测发现,发现该蛋白均由 α-螺旋、延长线和β-转角、无规则卷曲结构组成,其中AheCS 1/2/3的主要组分均为α-螺旋,占比分别为40.95%、53.70%、47.85%(表5)。同时无规则卷曲和延长线结构也占比例较大,这一点在其三维结构上得到了印证(图3)。
将AheCS1/2/3基因氨基酸序列在NCBI中进行序列比对,发现AheCS1氨基酸序列与柑橘(MH_048698.1)、甘草(EF_571302.1)相似性较高,分别为 86.49%、85.95%。AheCS2与川桑(XP010087965.1)相似度最高,为97.00%;与麻风树(XP012092602.1)相似度为91.00%。AheCS3氨基酸序列与红掌(JAT55223.1)、梅(NP001313434.1)相似度最高,均为86.00%;与葫芦(D38132.1)的氨基酸序列相似性度为84.19%。
通过使用NCBI保守结构域数据库进行分析,发现 AheCS1/2/3所编码的蛋白“CS_ACL-C_CCL superfamily”是檬酸合酶超家族。对AheCS1/2/3蛋白进行多重序列比对(图4)发现共同存在PWPN-box,且含有一个柠檬酸合酶结构域WPNVDAHS,该结构域是所有柠檬酸合酶都有的一段保守序列;以及一个柠檬酸合酶家族的标签基序 “GFGHGVLRNTDP”,但AheCS1/2/3蛋白保守基序中存在个别氨基酸发生了变异,如在基序GFGHGVLRNTDP中AheCS1的 ‘F、V、L’变成‘I、I、Y’, AheCS2中‘L、N’变成‘K、K’,AheCS3中的‘L’变成‘Y’。
![]() 图 4 AheCS1/2/3 蛋白的多重序列比对Co:油菜;Jc: 麻风树;Mn:川桑;Cm:柚;Pp:桃;Ps:西伯利亚杏;Mb:山荆子;Cu:葫芦;Aa:红掌;Pm:梅;Pas:牡丹;Ahe:波罗蜜;Cs:柑橘;Gu:甘草;AT:拟南芥.Figure 4. Alignment of amino acid sequences of AheCS1, AheCS2, and AheCS3 proteinsCo: Camellia oleifera Abel.; Jc: Jatropha curcas L.; Mn: Morus notabilis C. K. Schneid.; Cm; Citrus maxima (Burm) Merr.; Pp: Prunus persica; Ps: Prunus sibirica L.; Mb: Malus baccata (L.) Borkh.; Cu: Cucurbita cv.; Aa: Anthurium andraeanum.; Pm:Armeniaca mume Sieb.; Pas: Paeonia × suffruticosa Andr.; Ahe:Artocarpus heterophyllus Lam.; Cs: Citrus reticulata Blanco.; Gu: Glycyrrhiza uralensis Fisch.; AT: Arabidopsis thaliana.
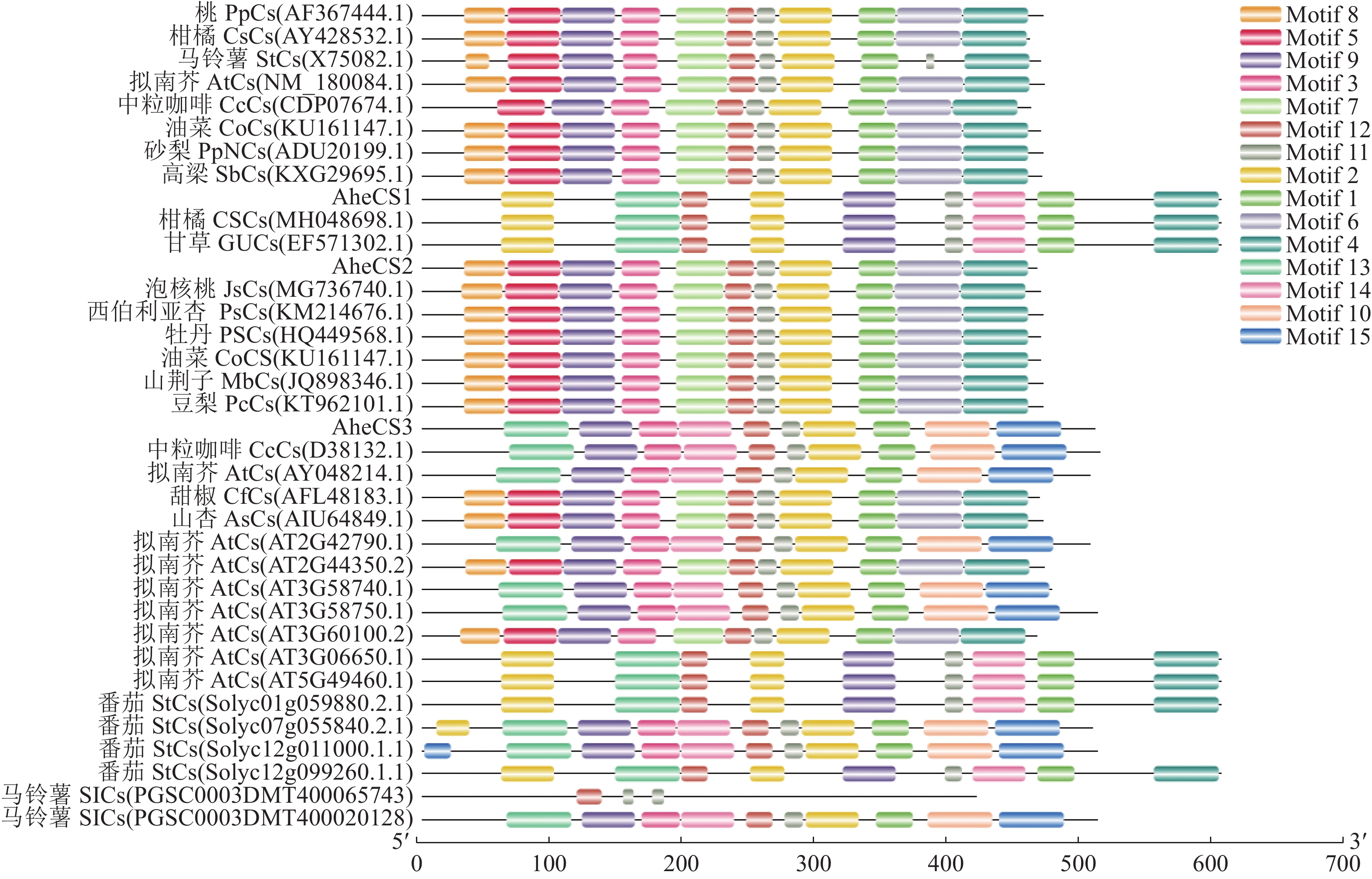
图 4 AheCS1/2/3 蛋白的多重序列比对Co:油菜;Jc: 麻风树;Mn:川桑;Cm:柚;Pp:桃;Ps:西伯利亚杏;Mb:山荆子;Cu:葫芦;Aa:红掌;Pm:梅;Pas:牡丹;Ahe:波罗蜜;Cs:柑橘;Gu:甘草;AT:拟南芥.Figure 4. Alignment of amino acid sequences of AheCS1, AheCS2, and AheCS3 proteinsCo: Camellia oleifera Abel.; Jc: Jatropha curcas L.; Mn: Morus notabilis C. K. Schneid.; Cm; Citrus maxima (Burm) Merr.; Pp: Prunus persica; Ps: Prunus sibirica L.; Mb: Malus baccata (L.) Borkh.; Cu: Cucurbita cv.; Aa: Anthurium andraeanum.; Pm:Armeniaca mume Sieb.; Pas: Paeonia × suffruticosa Andr.; Ahe:Artocarpus heterophyllus Lam.; Cs: Citrus reticulata Blanco.; Gu: Glycyrrhiza uralensis Fisch.; AT: Arabidopsis thaliana.使用MEME在线软件对AheCS1/2/3蛋白的保守基序进行预测 (图5)。发现不同物种 CS基因motif数量和分布有一定差异,每个基因均含有3~10个motif。AheCS1/2/3蛋白N端高度保守,所有CS蛋白 N 端都含有 motif 13,C端则保守性较差,不同亚族蛋白含有不同数量、不同类型的motif,但同时存在motif 1。图5可知,AheCS1 、AheCS2、 AheCS3保守基序类别相似,进一步说明系统进化分析具有准确性,但是3个基因分别与其他物种的保守基序高度相似,证明不同的3个基因可能在不同的亚族行使不同的功能。
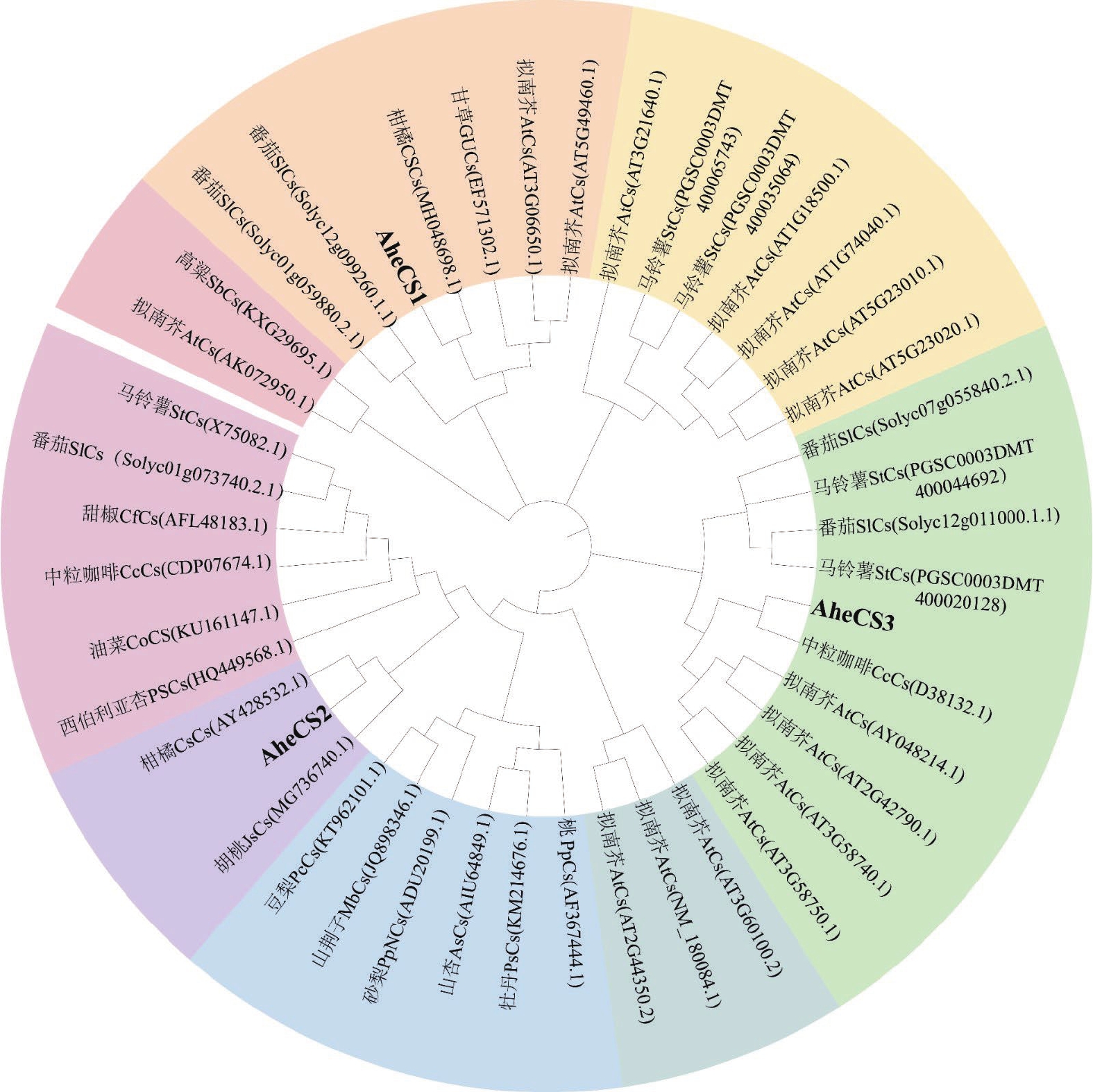
为了解波罗蜜CS基因的进化关系,将3个波罗蜜CS蛋白与其他物种CS蛋白在MEGA11.0上使用Neighbor-Joining进行构建系统发育树,在进化关系图(图6)中可以发现,根据亲缘关系可将这些CS蛋白分为 6个亚族。其中, AheCS1与柑橘、甘草(Glycyrrhiza uralensis Fisch.)、拟南芥[Arabidopsis thaliana (L.) Heynh.]、马铃薯(Solanum tuberosum L.)聚为一簇; AheCS2与柑橘、泡核桃(Juglans sigillata Dode.)、桃(Prunus persica.·)、山杏[Armeniaca sibirica (L.) Lam.]、沙梨[Pyrus pyrifolia (Burm. f.) Nakai.]、山荆子[Malus baccata (L.) Borkh.] 、豆梨(Pyrus calleryana Decne.)、马铃薯、甜椒(Capsicum frutescens L.)、中粒咖啡(Coffea canephora Pierre ex Froehn.)及牡丹(Paeonia × suffruticosa Andr.)聚为一簇; AheCS3与拟南芥4个基因、马铃薯、番茄(Solanum lycopersicum L.)聚为第一簇。基因在同一簇内,物种之间的差异性较小;随着分支不断扩大,各物种间的亲缘关系值逐渐减小,推测这些基因在发育过程中可能丢失了部分结构,表明波罗蜜CS基因在进化过程中可能遵循不同的进化方式。
![]() 图 6 不同物种CS基因的系统发育树分析St:马铃薯;Cf:甜椒;Cc:中粒咖啡;Co:油菜;As:山杏;Ps:牡丹;Js:泡核桃;Pp:桃;PpN:砂梨:Mb:山荆子;Pc:豆梨;AT:拟南芥;Os:水稻;Sb:高粱;Ahe:波罗蜜;SL:番茄。Figure 6. Phylogenetic tree of CSs in various speciesSt: Solanum tuberosum L.; Cf: Capsicum frutescens L. ; Cc: Coffea canephora Pierre ex Froehn.; Co: Camellia oleifera.; As: Armeniaca sibirica (L.) Lam.; Ps:Paeonia × suffruticosa Andr.; Js: Juglans sigillata Dode.; Pp: Prunus persica.; PpN: Pyrus pyrifolia (Burm. f.) Nakai.; Mb: Malus baccata (L.) Borkh.; Pc: Pyrus calleryana Decne.; AT: Arabidopsis thaliana (L.) Heynh.; Os: Oryza sativa L.; Sb: Sorghum 'Bicolor'(L.) Moench.; Ahe: Artocarpus heterophyllus Lam. SL: Solanum lycopersicum L.
图 6 不同物种CS基因的系统发育树分析St:马铃薯;Cf:甜椒;Cc:中粒咖啡;Co:油菜;As:山杏;Ps:牡丹;Js:泡核桃;Pp:桃;PpN:砂梨:Mb:山荆子;Pc:豆梨;AT:拟南芥;Os:水稻;Sb:高粱;Ahe:波罗蜜;SL:番茄。Figure 6. Phylogenetic tree of CSs in various speciesSt: Solanum tuberosum L.; Cf: Capsicum frutescens L. ; Cc: Coffea canephora Pierre ex Froehn.; Co: Camellia oleifera.; As: Armeniaca sibirica (L.) Lam.; Ps:Paeonia × suffruticosa Andr.; Js: Juglans sigillata Dode.; Pp: Prunus persica.; PpN: Pyrus pyrifolia (Burm. f.) Nakai.; Mb: Malus baccata (L.) Borkh.; Pc: Pyrus calleryana Decne.; AT: Arabidopsis thaliana (L.) Heynh.; Os: Oryza sativa L.; Sb: Sorghum 'Bicolor'(L.) Moench.; Ahe: Artocarpus heterophyllus Lam. SL: Solanum lycopersicum L.2.4 AheCS1、AheCS2和AheCS3的表达分析
如图7所示,波罗蜜果实后熟过程(CK)中,AheCS1的表达量在采后前2 d略有上升后开始下降,但在第8天突然上升达到最大,显著高于外源ETH和1-MCP处理( P<0.05),其相对表达量分别提高了15.39%和7.01%,随后开始下降,表明果实成熟诱导了AheCS1基因的表达。外源ETH 处理后 AheCS1 基因的相对表达量开始增加,于第4天达到峰值,显著高于CK(P<0.05),随后开始下降,说明外源ETH 处理诱导了AheCS1基因的表达。1-MCP处理在贮藏前8 d抑制了 AheCS1基因的相对表达,随后AheCS1基因的表达开始上升,于第16天达到最大峰值后迅速下降。
对照(CK)果中的AheCS2基因的相对表达量在贮藏前8 d变化不显著,在第10天骤然上升,达到最大。外源ETH 处理后提高了AheCS2 基因的表达,并于第6天达到峰值,显著高于对照和1-MCP处理( P<0.05),随后开始下降。1-MCP处理在贮藏前8天,AheCS2 基因的表达变化不大,之后开始上升,于第16天达到最大后开始下降。可见,外源ETH处理提前了AheCS2 基因的表达高峰,而1-MCP处理推迟了AheCS2基因的表达高峰。
对照处理中AheCS3基因的表达在波罗蜜果实采后前4 d变化不显著,第6天迅速增加达到最大,随后缓慢下降。外源ETH处理提高了采后前4 d的AheCS3基因的表达量,也于第6天达到最大后开始下降,基因的表达量较对照提高1.45%,较1-MCP提高了4.45%。1-MCP处理抑制了贮藏前4 d AheCS3基因的表达,随后其表达量开始上升,于第16天 达到最大后开始下降。
2.5 柠檬酸与AheCS1/2/3 基因表达的相关性分析
对自然成熟过程(CK)中波罗蜜果实中的柠檬酸含量与AheCS1/2/3 基因的相对表达水平进行相关性分析发现,柠檬酸含量与AheCS1/2/3基因的相对表达量均呈正相关,其中与AheCS2基因的相关性达到显著水平,相关系数为0.887(表6)。
表 6 柠檬酸含量与AheCS1/2/3 基因表达的相关性分析Table 6. Correlation between organic acids and AheCS1, AheCS2, and AheCS3指标
Index柠檬酸
Citrate acidAheCS1 AheCS2 AheCS3 柠檬酸 1 AheCS1 0.450 1 AheCS2 0.887* 0.088 1 AheCS3 0.766 0.339 0.521 1 * 在 0.05 级别(双尾),相关性显著。
* indicates significant correlation at 0.05 level (two-tailed).3. 讨论与结论
柠檬酸是有机酸的重要组成部分,在果实品质形成上具有重要意义[23]。一般有机酸在果实成熟过程中进行合成,同时在此过程中作为呼吸基质被消耗[24]。不同品种沙梨的柠檬酸含量在成熟过程中均呈现出先上升后下降的趋势,但上升下降的速率不同,品种间差异较大[25]。在葡萄(Vitis vinifera L.)的生长发育和脐橙(Citrus sinensis Osb. var. brasliliensis Tanaka)的成熟过程中,柠檬酸含量均呈现下降趋势[26,27]。柠檬酸是巴厘和卡因菠萝[Ananas comosus (L.) Merr.]果实的主要有机酸,在果实发育初期其含量迅速增加,到青熟期含量达到最高,进入完全成熟期柠檬酸开始降解,其含量急剧下降[28]。在脐橙果实成熟过程中,柠檬酸合酶与有机酸含量均呈现前期升高后期降低的变化趋势[29]。外源ETH和1-MCP是果实采后常用的催熟剂和保鲜剂,可以很好地促进或延缓果实成熟,调剂果实上市时间。在柠檬[Citrus × limon (Linnaeus) Osbeck][30]和猕猴桃(Actinidia chinensis Planch.)[31]果实上,柠檬酸含量呈现先升后降的变化趋势,外源ETH处理并未加速柠檬酸合成速率。郭香凤等[32]发现1-MCP处理对凯特杏(Prunus armeniaca L.)贮藏后期的柠檬酸含量的下降有显著抑制作用,并延缓了柠檬酸含量高峰的出现。在樱桃番茄(Lycopersicon esculentum var. cerasiforme A.Gray)[33]果实中,1-MCP处理延缓了后期柠檬酸含量的下降。本研究发现,在波罗蜜果实成熟过程中,柠檬酸含量呈先升后降的变化趋势,这与菠萝[28]和脐橙[29]上的研究一致。ETH处理加速了波罗蜜柠檬酸的合成速率,提前了峰值出现时间,这与柠檬[30]和猕猴桃[31]上的研究结果不同。1-MCP处理在贮藏前期出现柠檬酸含量小峰,但整体延缓了柠檬酸的变化趋势,这与樱桃番茄[33]上的研究结果类似。
CS基因是有机酸代谢的关键基因之一。CS蛋白一般都含有一个典型的保守结构域‘WPNVDAHS’和一个柠檬酸合酶家族的标签基序‘GHGVLR’[34],但在不同物种上,有些物种只含CS蛋白的保守结构域,存在缺失标签基序的现象 [14−16,34]。如在油茶上只含有‘GHGVLR’结构域,但在小金海棠(Malus xiaojinensis M. H. Cheng & N. G. Jiang)上同时存在结构域和标签基序[34]。本研究获得的AheCS1/2/3蛋白具有CS基因家族的保守结构域和标签基序,且与柑橘、川桑(Morus notabilis Schneid .)、柚子等上的CS基因编码的蛋白序列的相似性极高[14−16,34]。亚细胞定位预测发现,它们所表达的蛋白定位在细胞质、线粒体、过氧化物酶上,说明克隆得到的AheCS1/2/3基因是波罗蜜CS家族的成员。波罗蜜的3个AheCS蛋白分别和不同物种存在相同的保守基序,但是它们彼此之间相同的保守基序很少,这暗示它们可能行使不同的功能。
在果实成熟期间,柠檬酸合酶的表达与有机酸的积累密切相关[29]。馆溪蜜柚[Citrus grandis (L.)osbeck. cv. guanxi Miyou]果实贮藏过程中,可滴定酸含量下降与柠檬酸合成减少与柠檬酸合酶活性下降有关[35]。在酸枣[Ziziphus jujuba var. spinosa (Bunge) Hu ex H.F.Chow.][36]和椪柑(Citrus reticulata 'Ponkan')[37]中,ZjCS3和CitCS的高表达促进了果实柠檬酸的积累。在脐橙[38,29]、甜橙[15]、菠萝[28] 、中国樱桃(Prunus pseudocerasus Lindl.)[39]和梅(Prunus mume Siebold & Zucc.)[40] 上的研究发现,柠檬酸含量与CS基因的表达量均具有显著的正相关。上述研究表明,CS基因是调控柠檬酸含量的关键基因。本研究也得到类似的结果,即随着波罗蜜果实的成熟,CS基因的相对表达量在呈先上升后下降的趋势,这与蜀脆枣(Ziziphus jujuba cv. 'Shucuizao' )[41]的研究结果类似;此外还发现,柠檬酸的含量与AheCS1/2/3基因的相对表达水平呈正相关,其中与AheCS2的相关性达到显著水平,这与甜橙[15]、菠萝[28]、中国樱桃[39]等研究结果一致,说明AheCS1/2/3参与波罗蜜成熟过程中柠檬酸的合成,其中AheCS2可能是波罗蜜果实柠檬酸循环途径上的关键基因。
Liu[42]等发现,在香蕉(Musa nana Lour.)上,MaGCS的表达可能与乙烯代谢密切相关,可由乙烯诱导,并被1-MCP抑制。本研究发现,外源ETH诱导AheCS1提前表达;改变AheCS2基因的表达模式,极显著增加AheCS2基因的表达量;也增加AheCS3的表达量。1-MCP处理延缓AheCS1/2/3基因的表达,但提高波罗蜜果实贮藏后期的基因表达。可见,外源ETH处理诱导并增加波罗蜜果实中AheCS2/3基因的表达;而1-MCP处理则延缓它们的表达,起抑制作用。
本试验研究了波罗蜜果实中有机酸积累过程的特点,从波罗蜜果实中分离到3个CS基因,发现波罗蜜 AheCS1/2/3基因各个成员间在不同处理下的表达量差异较大,而且对柠檬酸积累响应程度不同但都受到乙烯的调控。在3个基因中,AheCS2的表达量与果实柠檬酸积累的相关性较强。但是 AheCS1/2/3基因参与调控波罗蜜酸积累过程的机制尚不清楚,有待于进一步研究。
-
图 4 AheCS1/2/3 蛋白的多重序列比对
Co:油菜;Jc: 麻风树;Mn:川桑;Cm:柚;Pp:桃;Ps:西伯利亚杏;Mb:山荆子;Cu:葫芦;Aa:红掌;Pm:梅;Pas:牡丹;Ahe:波罗蜜;Cs:柑橘;Gu:甘草;AT:拟南芥.
Figure 4. Alignment of amino acid sequences of AheCS1, AheCS2, and AheCS3 proteins
Co: Camellia oleifera Abel.; Jc: Jatropha curcas L.; Mn: Morus notabilis C. K. Schneid.; Cm; Citrus maxima (Burm) Merr.; Pp: Prunus persica; Ps: Prunus sibirica L.; Mb: Malus baccata (L.) Borkh.; Cu: Cucurbita cv.; Aa: Anthurium andraeanum.; Pm:Armeniaca mume Sieb.; Pas: Paeonia × suffruticosa Andr.; Ahe:Artocarpus heterophyllus Lam.; Cs: Citrus reticulata Blanco.; Gu: Glycyrrhiza uralensis Fisch.; AT: Arabidopsis thaliana.
图 6 不同物种CS基因的系统发育树分析
St:马铃薯;Cf:甜椒;Cc:中粒咖啡;Co:油菜;As:山杏;Ps:牡丹;Js:泡核桃;Pp:桃;PpN:砂梨:Mb:山荆子;Pc:豆梨;AT:拟南芥;Os:水稻;Sb:高粱;Ahe:波罗蜜;SL:番茄。
Figure 6. Phylogenetic tree of CSs in various species
St: Solanum tuberosum L.; Cf: Capsicum frutescens L. ; Cc: Coffea canephora Pierre ex Froehn.; Co: Camellia oleifera.; As: Armeniaca sibirica (L.) Lam.; Ps:Paeonia × suffruticosa Andr.; Js: Juglans sigillata Dode.; Pp: Prunus persica.; PpN: Pyrus pyrifolia (Burm. f.) Nakai.; Mb: Malus baccata (L.) Borkh.; Pc: Pyrus calleryana Decne.; AT: Arabidopsis thaliana (L.) Heynh.; Os: Oryza sativa L.; Sb: Sorghum 'Bicolor'(L.) Moench.; Ahe: Artocarpus heterophyllus Lam. SL: Solanum lycopersicum L.
表 1 AheCS1、AheCS2和AheCS3基因全长引物序列
Table 1 Sequences of AheCS1, AheCS2, and AheCS3 primers
引物名称
Primer names引物序列(5′-3′)
Primer sequencesAheCS1-F
AheCS1-R
AheCS2-F
AheCS2-R
AheCS3-F
AheCS3-R5′-ATGGCCACCGGACAGCTATTCTCGCG-3′
5′-TCACTTGGTGTAAAGAACGTCCTCCCATG-3′
5′-ATGGTGTTCTTCAGGGGCGTGTCTGTGC-3′
5′-TCAAGACGAAGCCGCTTTCTTGCAGTAA-3′
5′-ATGGAATTGCCAGTCACGGCACGAGC-3′
5′-TTAAATGCCAGAACCCGCCAGCCGG-3′表 2 基因荧光定量引物序列
Table 2 Sequences of quantitative qRT-PCR primers
引物名称
Primer names引物序列(5′-3′)
Primer sequencesAheCS1-F 5′-AGAATCAAGCACTAAGGGACG-3′ AheCS1-R 5′-TTCAGGAATTTGTGGAGGC-3′ AheCS2-F 5′-GCCTCCCATCCTAACAGAAA-3′ AheCS2-R 5′-CGCTCGGTCCCATACTAACT-3′ AheCS3-F 5′- CCAACCGAGTTCTTCCCTG-3′ AheCS3-R 5′- GATAATGCCGCAACCAAAC-3′ GAPDH-F 5′- TTGAAGGGTGGNGCNAARAARG -3′ GAPDH-R 5′- ATAACCCCAYTCRTTRTCRTAC-3′ 表 3 AheCS1/2/3 蛋白的理化性质
Table 3 Physiochemical properties of AheCS1, AheCS2, and AheCS3 proteins
基因名称
Gene name氨基酸数
Number of amino acids分子质量
Molecular weight/kD等电点
pI脂肪系数
Aliphatic index不稳定系数
Instability index亲水性
Grand average of
hydropathicity含量最多的 3 种氨基酸
Top 3 amino acids/%AheCS1 608 151.18 4.96 25.29 45.73 0.698 Ala 25.3
Gly25.7
Thr27.5AheCS2 473 52.89 7.20 26.37 40.34 0.652 Gly24.6
Ala26.4
Thr29.7AheCS3 513 56.42 8.15 25.02 47.61 0.748 Ala25.0
Gly25.4
Thr26.3表 4 AheCS1/2/3 蛋白的亚细胞定位预测
Table 4 Predicted subcellular localization of AheCS1, AheCS2, and AheCS3 proteins
定位 Location AheCS1 AheCS2 AheCS3 细胞核 Nuclear 0.04 0.03 0.00 质膜 Plasma membrane 0.02 0.12 0.00 胞外 Extra-cellular 0.00 0.00 0.00 细胞质Cytoplasmic 8.81 0.00 0.00 线粒体 Mitochondria 0.07 6.94 0.00 细胞质内层 Endoplasm retic 0.08 0.00 0.33 过氧化物酶体Peroxisomal 0.00 5.91 9.41 高尔基体Golgi 0.00 0.01 0.14 叶绿体 Chloroplast 0.66 0.00 0.12 液泡 Vacuolar 0.31 0.00 0.00 表 5 AheCS1/2/3蛋白磷酸化和糖基化位点及二级结构组分
Table 5 Phosphorylation and glycosylation sites and secondary structure components of AheCS1, AheCS2, and AheCS3 proteins
基因名称
Gene name糖基化位点数
Number of glycosy/个磷酸化位点数
number of phosphorylation sites/个二级结构组分
secondary structure component/%丝氨酸
Ser苏氨酸
Thr酪氨酸
Tyrα-螺旋
α-helix延长链
Extend chainβ-转角
β-turn无规则卷曲
Random coilAheCS1 1 59 55 24 40.95 16.78 9.54 32.73 AheCS2 0 17 10 9 53.70 8.88 7.82 29.60 AheCS3 0 28 9 11 47.85 9.96 5.08 37.11 表 6 柠檬酸含量与AheCS1/2/3 基因表达的相关性分析
Table 6 Correlation between organic acids and AheCS1, AheCS2, and AheCS3
指标
Index柠檬酸
Citrate acidAheCS1 AheCS2 AheCS3 柠檬酸 1 AheCS1 0.450 1 AheCS2 0.887* 0.088 1 AheCS3 0.766 0.339 0.521 1 * 在 0.05 级别(双尾),相关性显著。
* indicates significant correlation at 0.05 level (two-tailed). -
[1] LI J X, ZHANG C L, LIU H, et al. Profiles of sugar and organic acid of fruit juices: A comparative study and implication for authentication [J]. Journal of Food Quality, 2020, 2020: 7236534.
[2] 马晓倩. 柠檬酸含量对冰糖橙果实贮藏性能的影响及其代谢相关基因分析 [D]. 长沙: 湖南农业大学, 2020. MA X Q. Effect of citric acid content on storage performance of 'Bingtang' Sweet Orange and expression analysis of genes in citrate metabolism [D]. ChangSha: Hunan Agricultural University, 2020. (in Chinese)
[3] SADKA A, DAHAN E, COHEN L, et al. Aconitase activity and expression during the development of lemon fruit [J]. Physiologia Plantarum, 2000, 108(3): 255−262. DOI: 10.1034/j.1399-3054.2000.108003255.x
[4] BLANKE M M, LENZ F. Fruit photosynthesis[J]. Plant, Cell & Environment, 1989, 12(1): 31-46.
[5] KOYAMA H, TAKITA E, KAWAMURA A, et al. Over expression of mitochondrial citrate synthase gene improves the growth of carrot cells in Al-phosphate medium [J]. Plant and Cell Physiology, 1999, 40(5): 482−488. DOI: 10.1093/oxfordjournals.pcp.a029568
[6] PRACHAROENWATTANA I, CORNAH J E, SMITH S M. Arabidopsis peroxisomal citrate synthase is required for fatty acid respiration and seed germination [J]. The Plant Cell, 2005, 17(7): 2037−2048. DOI: 10.1105/tpc.105.031856
[7] OHLROGGE J, POLLARD M, BAO X, et al. Fatty acid synthesis: From CO2 to functional genomics [J]. Biochemical Society Transactions, 2000, 28(6): 567−573. DOI: 10.1042/bst0280567
[8] SCHNARRENBERGER C, MARTIN W. Evolution of the enzymes of the citric acid cycle and the glyoxylate cycle of higher plants. A case study of endosymbiotic gene transfer [J]. European Journal of Biochemistry, 2002, 269(3): 868−883. DOI: 10.1046/j.0014-2956.2001.02722.x
[9] ZHAO H N, CHEN G J, SANG L N, et al. Mitochondrial citrate synthase plays important roles in anthocyanin synthesis in petunia [J]. Plant Science:an International Journal of Experimental Plant Biology, 2021, 305: 110835.
[10] TOVAR-MÉNDEZ A, MIERNYK J A, RANDALL D D. Regulation of pyruvate dehydrogenase complex activity in plant cells [J]. European Journal of Biochemistry, 2003, 270(6): 1043−1049. DOI: 10.1046/j.1432-1033.2003.03469.x
[11] SADKA A, DAHAN E, OR E, et al. Comparative analysis of mitochondrial citrate synthase gene structure, transcript level and enzymatic activity in acidless and acid-containing Citrus varieties [J]. Functional Plant Biology, 2001, 28(5): 383. DOI: 10.1071/PP00136
[12] CANEL C, BAILEY-SERRES J N, ROOSE M L. Molecular characterization of the mitochondrial citrate synthase gene of an acidless pummelo (Citrus maxima) [J]. Plant Molecular Biology, 1996, 31(1): 143−147. DOI: 10.1007/BF00020613
[13] IANNETTA P P M, ESCOBAR N M, ROSS H A, et al. Identification, cloning and expression analysis of strawberry (Fragaria × ananassa) mitochondrial citrate synthase and mitochondrial malate dehydrogenase [J]. Physiologia Plantarum, 2004, 121(1): 15−26. DOI: 10.1111/j.0031-9317.2004.00302.x
[14] 叶思诚, 姚小华, 王开良, 等. 油茶柠檬酸合成酶(CS)基因的克隆和表达分析 [J]. 植物研究, 2016, 36(4):556−564. DOI: 10.7525/j.issn.1673-5102.2016.04.011 YE S C, YAO X H, WANG K L, et al. Cloning and expression analysis of citrate synthase(CS)gene in Camellia oleifera [J]. Bulletin of Botanical Research, 2016, 36(4): 556−564. (in Chinese) DOI: 10.7525/j.issn.1673-5102.2016.04.011
[15] 王滕旭, 李正国, 杨迎伍, 等. 甜橙柠檬酸合酶基因的克隆及其表达分析 [J]. 中国农学通报, 2010, 26(10):65−69. WANG T X, LI Z G, YANG Y W, et al. Cloning and expression analysis of citrate synthase gene in orange [J]. Chinese Agricultural Science Bulletin, 2010, 26(10): 65−69. (in Chinese)
[16] 赵宝庆, 任伟超, 王震, 等. 酸橙柠檬酸合酶基因电子克隆和生物信息学分析 [J]. 东北林业大学学报, 2019, 47(12):79−83. ZHAO B Q, REN W C, WANG Z, et al. In silico cloning and bioinformatics analysis of citrate synthase gene from Citrus aurantium [J]. Journal of Northeast Forestry University, 2019, 47(12): 79−83. (in Chinese)
[17] 童晋, 詹高淼, 王新发, 等. 油菜柠檬酸合酶基因的克隆及在逆境下的表达 [J]. 作物学报, 2009, 35(1):33−40. DOI: 10.3724/SP.J.1006.2009.00033 TONG J, ZHAN G M, WANG X F, et al. Cloning of citrate synthase gene in rapeseed (Brassica napus L. ) and its expression under stresses [J]. Acta Agronomica Sinica, 2009, 35(1): 33−40. (in Chinese) DOI: 10.3724/SP.J.1006.2009.00033
[18] 王俊宁, 刘建文, 李凤娣, 等. 菠萝蜜果实采后糖、酸、蛋白质和VC含量的变化 [J]. 西南师范大学学报(自然科学版), 2015, 40(3):80−85. WANG J N, LIU J W, LI F D, et al. On changes in starch, sugar, acids, VC and proteins contents of jackfruit during ripening process [J]. Journal of Southwest China Normal University (Natural Science Edition), 2015, 40(3): 80−85. (in Chinese)
[19] 夏春华, 杨转英, 叶春海, 等. 不同株系菠萝蜜果肉中可溶性糖和有机酸的分析 [J]. 果树学报, 2014, 31(4):648−652. XIA C H, YANG Z Y, YE C H, et al. Analysis of contents and compositions of soluble sugars and organic acids in different jackfruit(Artocarpus heterophyllus) lines [J]. Journal of Fruit Science, 2014, 31(4): 648−652. (in Chinese)
[20] 王俊宁, 吕庆芳, 丰锋, 等. 湿包类型菠萝蜜采后呼吸跃变和主要成分的变化 [J]. 园艺学报, 2014, 41(2):329−334. DOI: 10.3969/j.issn.0513-353X.2014.02.014 WANG J N, LYU Q F, FENG F, et al. Changes in respiration, ethylene and biochemical values of soft jackfruits during the ripening period [J]. Acta Horticulturae Sinica, 2014, 41(2): 329−334. (in Chinese) DOI: 10.3969/j.issn.0513-353X.2014.02.014
[21] 王俊宁, 陈文耀, 丰锋, 等. 乙烯利处理对菠萝蜜果实催熟的影响 [J]. 广东农业科学, 2014, 41(3):94−98. DOI: 10.3969/j.issn.1004-874X.2014.03.023 WANG J N, CHEN W Y, FENG F, et al. Effect of ethephon treatment on physiological index of jackfruit after harvest [J]. Guangdong Agricultural Sciences, 2014, 41(3): 94−98. (in Chinese) DOI: 10.3969/j.issn.1004-874X.2014.03.023
[22] 王俊宁, 陈俊鹏, 弓德强, 等. 1-MCP处理对菠萝蜜采后生理效应的影响 [J]. 江西农业大学学报, 2014, 36(1):56−61,96. DOI: 10.3969/j.issn.1000-2286.2014.01.009 WANG J N, CHEN J P, GONG D Q, et al. Effects of 1-MCP treatment on post-harvest physiology of jackfruit(Artocarpus heterophyllus lam. ) [J]. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(1): 56−61,96. (in Chinese) DOI: 10.3969/j.issn.1000-2286.2014.01.009
[23] GAO Y Y, YAO Y L, CHEN X, et al. Metabolomic and transcriptomic analyses reveal the mechanism of sweet-acidic taste formation during pineapple fruit development [J]. Frontiers in Plant Science, 2022, 13: 971506. DOI: 10.3389/fpls.2022.971506
[24] ZHANG X X, WEI X X, ALI M M, et al. Changes in the content of organic acids and expression analysis of citric acid accumulation-related genes during fruit development of yellow (Passiflora edulis f. flavicarpa) and purple (Passiflora edulis f. edulis) passion fruits [J]. International Journal of Molecular Sciences, 2021, 22(11): 5765. DOI: 10.3390/ijms22115765
[25] 李雪梅. 砂梨果实有机酸含量及代谢相关酶活性动态变化研究[D]. 武汉: 华中农业大学, 2008. LI X M. Studies on dynamic changes of organic acid contents and metabolizing enzyme activities in sand pear fruit[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese)
[26] 朱磊, 陈芸华, 胡禧熙, 等. 葡萄有机酸的研究进展 [J]. 中外葡萄与葡萄酒, 2022, (6):88−95. ZHU L, CHEN Y H, HU X X, et al. Research progress of organic acids in grape [J]. Sino-Overseas Grapevine & Wine, 2022(6): 88−95. (in Chinese)
[27] 杨滢滢. ‘纽荷尔’脐橙果实柠檬酸合成与降解机理的研究[D]. 南昌: 江西农业大学, 2017. YANG Y Y. Research on synthesis and degradation of citric acid in’Newhall’ navel orange fruit[D]. Nanchang: Jiangxi Agricultural University, 2017. (in Chinese)
[28] 张秀梅, 杜丽清, 孙光明, 等. 菠萝果实发育过程中有机酸含量及相关代谢酶活性的变化 [J]. 果树学报, 2007, 24(3):381−384. DOI: 10.3969/j.issn.1009-9980.2007.03.025 ZHANG X M, DU L Q, SUN G M, et al. Changes in organic acid concentrations and the relative enzyme activities during the development of Cayenne pineapple fruit [J]. Journal of Fruit Science, 2007, 24(3): 381−384. (in Chinese) DOI: 10.3969/j.issn.1009-9980.2007.03.025
[29] 文涛, 熊庆娥, 曾伟光, 等. 脐橙果实发育中有机酸合成代谢酶活性变化的研究 [J]. 四川农业大学学报, 2001, 19(1):27−30. WEN T, XIONG Q E, ZENG W G, et al. Study on the change of organic acid synthetase activity during fruit development of navel orange (Citrus sinesis osbeck) [J]. Journal of Sichuan Agricultural University, 2001, 19(1): 27−30. (in Chinese)
[30] 张沛宇. 采后乙烯利脱绿对柠檬果实色泽、风味及抗氧化能力的影响研究[D]. 重庆: 西南大学, 2019. ZHANG P Y. Effects of postharvest ethephon degreening on the color, flavor quality and antioxidant capacity of lemon (Citrus limon (L. ) burm. f. ) fruit[D]. Chongqing: Southwest University, 2019. (in Chinese)
[31] LIM S, LEE J G, LEE E J. Comparison of fruit quality and GC-MS-based metabolite profiling of kiwifruit 'Jecy green': Natural and exogenous ethylene-induced ripening [J]. Food Chemistry, 2017, 234: 81−92. DOI: 10.1016/j.foodchem.2017.04.163
[32] 郭香凤, 向进乐, 史国安, 等. 1-MCP对凯特杏果实采后糖酸组分与含量的影响 [J]. 保鲜与加工, 2008, 8(5):30−33. GUO X F, XIANG J Y, SHI G A, et al. Effects of 1-methylcydopropene on sugar and organic acid constituents in katy apricot [J]. Storage and Process, 2008, 8(5): 30−33. (in Chinese)
[33] 弓德强, 李敏, 高兆银, 等. 1-甲基环丙烯处理对樱桃番茄果实低温贮藏品质的影响 [J]. 食品与发酵工业, 2022, 48(4):116−122,129. GONG D Q, LI M, GAO Z Y, et al. Effect of 1-methylcyclopropene treatment on quality of cherry tomatoes stored at low temperature [J]. Food and Fermentation Industries, 2022, 48(4): 116−122,129. (in Chinese)
[34] 石岩. 小金海棠柠檬酸合成酶基因MxCS2的克隆与功能分析[D]. 哈尔滨: 东北农业大学, 2016. SHI Y. Cloning and functional analysis of Malus xiaojinensis citrate synthase gene MxCS2[D]. Harbin: Northeast Agricultural University, 2016. (in Chinese)
[35] 张小红. 琯溪蜜柚(Citrus grandis(L. )osbeck. cv. guanxi Miyou)果实采后酸代谢研究[D]. 福州: 福建农林大学, 2005. ZHANG X H. Studies on the metabolism of organic acids in Citrus guanxi-miyou (Citrus grandis (L. ) osbeck. cv. guanxi Miyou) fruit after harvest[D]. Fuzhou: Fujian Agriculture and Forestry University, 2005. (in Chinese)
[36] 张春梅. 枣糖酸代谢及其驯化的分子机制研究[D]. 杨凌: 西北农林科技大学, 2016. ZHANG C M. Molecular mechanism related to the metabolism of sugar, acid and domestication for Ziziphus jujuba mill[D]. Yangling: Northwest A & F University, 2016. (in Chinese)
[37] ZHANG G F, XIE S X. Influence of water stress on the citric acid metabolism related gene expression in the ponkan fruits [J]. Agricultural Sciences, 2014, 5(14): 1513−1521. DOI: 10.4236/as.2014.514162
[38] 文涛, 熊庆娥, 曾伟光, 等. 脐橙果实发育过程中有机酸合成代谢酶活性的变化 [J]. 园艺学报, 2001, 28(2):161−163. DOI: 10.3321/j.issn:0513-353X.2001.02.015 WEN T, XIONG Q E, ZENG W G, et al. Changes of organic acid synthetase activity during fruit development of navel orange(Citrus sinesis osbeck) [J]. Acta Horticulturae Sinica, 2001, 28(2): 161−163. (in Chinese) DOI: 10.3321/j.issn:0513-353X.2001.02.015
[39] 李航. 两种中国樱桃果实糖酸积累和代谢相关酶及其基因表达的研究[D]. 雅安: 四川农业大学, 2019. LI H. Study on sugar and acid accumulation, metabolism enzymes activities and gene expression of two Chinese cherry fruits[D]. Yaan: Sichuan Agricultural University, 2019. (in Chinese)
[40] 翁金洋. 梅和杏果实糖酸变化规律及有机酸代谢差异研究[D]. 南京: 南京农业大学, 2017. WENG J Y. Studies on the change regulation of sugar and acid and the metabolism of organic acids in Prunus mume and apricot fruits[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
[41] 王羊, 邓倩, 邓群仙, 等. “蜀脆枣” 果实发育过程中糖酸代谢相关基因表达分析 [J]. 西北农业学报, 2022, 31(7):876−885. DOI: 10.7606/j.issn.1004-1389.2022.07.009 WANG Y, DENG Q, DENG Q X, et al. Analysis of sugar and organic acid metabolism-related genes expression during development of Ziziphus jujuba cv. “Shucuizao” fruits [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2022, 31(7): 876−885. (in Chinese) DOI: 10.7606/j.issn.1004-1389.2022.07.009
[42] LIU J H, CHI G H, JIA C H, et al. Function of a citrate synthase gene (MaGCS) during postharvest banana fruit ripening [J]. Postharvest Biology and Technology, 2013, 84: 43−50. DOI: 10.1016/j.postharvbio.2013.04.005




 下载:
下载: