Functions of OsPtr1 in Rice
-
摘要:目的 利用T-DNA插入突变的方法揭示候选基因P0421H01.23(命名为OsPtr1,Peptite 24-48Transporter 1)的功能表达。方法 提取水稻明恢86成花后12 d的胚乳RNA,反转录成cDNA后,进行OsPtr1基因扩增,以胚乳特异表达Gt1为启动子,构建OsPtr1基因植物过表达载体,用农杆菌介导法将OsPtr1基因导入水稻品种日本晴,对其后代及突变体w9101进行氮代谢物测定分析;同时,构建绿色荧光蛋白基因GFP和OsPtr1基因融合表达载体,用基因枪转入洋葱表皮细胞,培养24~48 h后,用荧光共聚焦电子显微镜观察OsPtr1基因亚细胞定位。结果 OsPtr1基因编码蛋白定位于质膜上,该基因与氮类物质的运输有关,OsPtr1功能缺失突变体种子的氨基酸和蛋白质等含氮物质积累效率降低,过表达植株种子的氨基酸和蛋白质等含氮物质含量增加。结论 OsPtr1基因参与水稻氮类物质的跨膜运输。Abstract:Objective Functions of a peptide transporter protein gene, OsPtr1, in rice were studied by means of T-DNA insertion mutation.Method The target RNA was extracted from the endosperm of Minghui 86 rice 12 d after flowering and reverse-transcribed into cDNA. By cloning the candidate gene P0421H01.23, named OsPtr1, and constructing the plant overexpression vector using the promoter Gt1 of endosperm-specific expressing, OsPtr1 was introduced into Nipponbare rice using an agrobacterium-mediated method. Nitrogen metabolism of the offspring and mutant w9101 was analyzed. A fusion expression vector of green fluorescent protein gene, GFP, and OsPtr1 was constructed and transferred to onion epidermal cells with a gene gun. In 24–48 h afterward, subcellular localization of OsPtr1 was examined under a fluorescence confocal electron microscope.Result OsPtr1 was localized at the membrane and possibly involved in the transport of nitrogen substances. Knockout on OsPtr1 could cause a reduction on nitrogen-containing substances, such as amino acids and proteins, in the rice grains. Conversely, an overexpressed OsPtr1 would increase the accumulation.Conclusion OsPtr1 participated in the transmembrane transport of nitrogen substances in rice.
-
Keywords:
- Rice /
- endosperm-specific expressing /
- peptide transporter /
- OsPtr1 /
- nitrogen-metabolism
-
0. 引言
【研究意义】水稻(Oryza sativa L.)是我国重要的粮食作物,也是单子叶植物分子遗传研究的重要模式植物[1-2],其转化体系成熟,遗传稳定,基因组相对较小,已完成全基因组序列测序,研究水稻产量、株型等重要性状的基因功能对改良水稻分子育种具有重要意义。【前人研究进展】从遗传学的角度看,研究基因功能的方法大致可以分为正向遗传学(Forward genetics)和反向遗传学(Reverse genetics)两类,它们对功能基因研究均有效,然而各有优缺点。T-DNA插入突变是正向遗传学的一种,从T-DNA插入的元件作用看主要可分为转座子插入突变、激活标签插入突变和捕获标签插入突变。前两种T-DNA插入获得突变体的方式,不管是激活突变还是转座子突变都存在着一些问题,它们对一些冗余基因和表型致死基因很难鉴定突变体的表型。因此人们发展另外一种不依靠表型鉴定的T-DNA插入捕获标签突变系统,这系统在靠近T-DNA边界附近导入了一个报告基因,通过检测报告基因时空表达来了解功能基因的表达谱,进而研究候选基因的功能[3-4]。【本研究切入点】前期研究中,我们利用T-DNA插入捕获标签突变系统获得的籼稻明恢86突变体w9101初步分析表明,外源T-DNA的插入使得w9101中的P0421H01.23(命名为 OsPtr1, Peptite 24-48Transporter 1)基因功能缺失,生物信息学分析,该候选基因编码一个由601个氨基酸组成的疏水性肽跨膜转运蛋白,是一个胚乳特异性表达肽转蛋白[5]。然而有关该胚乳特异表达 OsPtr1 基因的生物学功能还有待深入研究。【拟解决的关键问题】本研究进一步对该胚乳特异表达OsPtr1基因深入开展生物学功能研究,以期探明水稻氮代谢、肽转运机制,并为水稻分子育种提供基因资源。
1. 材料与方法
1.1 试验材料
水稻品种日本晴作为农杆菌介导转化受体,由福建省农业科学院农业遗传工程重点实验室提供;大肠杆菌DH5α和根癌农杆菌菌株LBA4404,均由福建省农业科学院农业遗传工程重点实验室保存。
pGEM-T Easy Vector质粒购自Promega公司;pGt1CDMC203质粒含有胚乳特异表达Gt1启动子;表达载体的骨架均来自质粒pCAMBIA1300(www.cambia.org),由福建省农业科学院农业遗传工程重点实验室保存;pJIT163包含绿色荧光蛋白GFP,由瑞典农业大学孙传信教授赠与。
1.2 OsPtr1基因分离
用TIANGEN试剂盒提取水稻明恢86成花后12 d的胚乳RNA,用Ferments公司反转录试剂盒合成的cDNA为模板。
反应体系:2×GC 缓冲液25 μL,2.5 μmol·L−1 dNTP 4 μL,5 μmol·L−1上游引物2 μL,5 μmol·L−1下游引物2 μL,HSPrime Star酶0.5 μL,cDNA1 μL,无菌水补足至50 μL。
反应条件:94 ℃预变性5 min;变性98 ℃10 s,退火58 ℃、54 ℃、58 ℃ 5 s,延伸72 ℃ 2 min,1个循环;94 ℃ 变性1 min,58 ℃ 退火5 s,72 ℃延伸2 min,30个循环;72 ℃延伸5 min,补加0.4 μL的Taq酶,72 ℃ 延伸20 min。
1.3 表达载体构建及水稻转化植株获得
1.4 Southern blot分析
用CTAB法[6]提取水稻叶片基因组DNA,经酶切、电泳、印迹、预杂交、杂交、洗膜,最后用CDP-star显色剂检测杂交结果。具体按Pharmacia Amersham公司试剂盒提供方法进行。
1.5 OsPtr1基因扩增
合成的引物两头加Sal I酶切位点;反应体系:2×GC 缓冲液25 μL,2.5 μmol·L−1 dNTP 4 μL,5 μmol·L−1 上游引物 2 μL,5 μmol·L−1下游引物 2 μL,Hsprime star酶 0.5 μL,模板DNA 0.5 μL(50 ng),无菌水补至50 μL。PCR反应程序:94 ℃ 5 min;98 ℃ 1 min,58 ℃ 5 s,72 ℃ 2 min,2个循环;94 ℃ 1 min,58 ℃ 5 s,72 ℃ 2 min,34个循环;72 ℃ 10 min。
1.6 基因枪法获得OsPtr1-GFP融合蛋白的瞬时表达
微粒子弹的制备和基因枪轰击操作按Bio-Rad公司说明书进行,轰击距离7 cm,轰击压力为1100 psi,轰击后的材料于24 ℃培养24~48 h。
荧光显微成像的光源为HBO100W 汞灯,荧光在激发波长450~490 nm,检测波长505~500 nm滤光片下观察,红色荧光在激发波长510~560 nm,检测波长575 nm,590 nm滤光片下观察,紫外荧光在激发波长380~420 nm,检测波长430 nm,450 nm滤光片下观察。图像采集用Nikon Eclipse E400显微成像系统。
1.7 水稻蛋白含量及氨基酸含量分析
分别取T-DNA插入突变体w9101的阳性株系和阴性株系及转过表达OsPtr1基因水稻种子用于蛋白质 和氨基酸含量的测定。蛋白质含量按照GB/T 5009.5—2016食品中蛋白质的测定(第一法)进行。氨基酸含量的测定按照GB/T 5009.124—2016食品中氨基酸的测定进行。
1.8 数据统计分析
采用 Origin pro2017 对数据进行方差分析和绘图。
2. 结果与分析
2.1 OsPtr1基因分离
用高保真酶进行OsPtr1基因的扩增,扩增产物回收后连于T-载体测序,测序结果与OsPtr1基因比对无碱基差异,可用于载体构建。
2.2 OsPtr1-GFP融合蛋白的载体构建
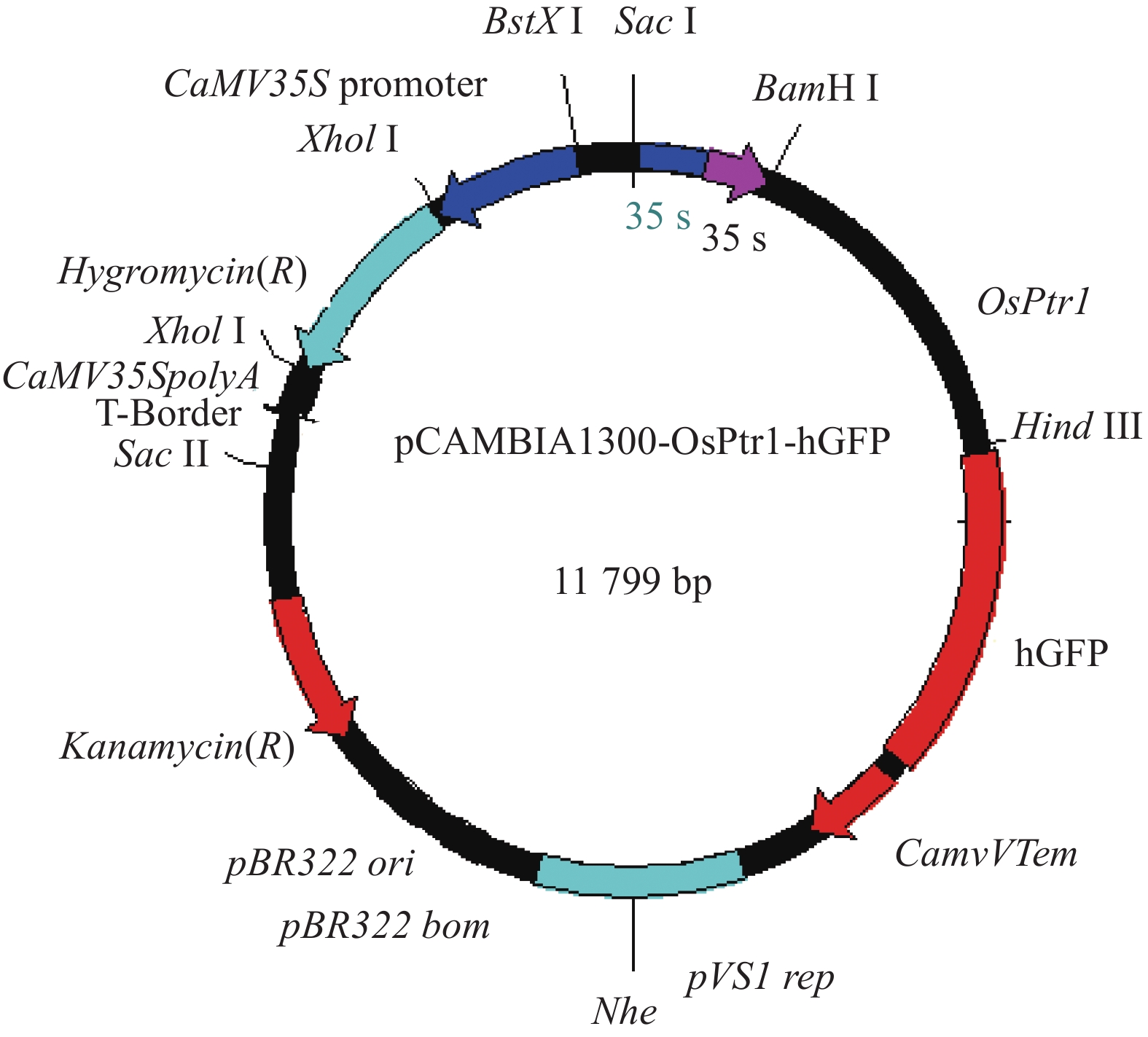
GFP连接于载体PJL163上,用Kpn I和Sph I酶切pCAMBIA1300和PJL163,构建pCAMBIA1300-hGFP;再将用高保真酶扩增获得的OsPtr1基因连接到pCAMBIA1300-hGFP的Sal I位点上,获得pCAMBIA1300-OsPtr1-hGFP融合表达载体(图1、图2)。
![]() 图 2 pCAMBIA1300-OsPtr1-hGFP载体CaMV35S promoter为花椰菜花叶病毒(Cauliflower mosaic virus)启动子;hygromycin为潮酶素抗性标记基因;OsPtr1为肽转运子1;hGFP为绿色荧光蛋白;T-border为T-DNA边界。Figure 2. Vector pCAMBIA1300-OsPtr1-hGFPCaMV35S promoter is a cauliflower mosaic virus promoter; hygromycin, hygromycin-resistant marker gene; OsPtr1, a peptide transporter; hGFP, a green fluorescent protein; and T-border, border of T-DNA.
图 2 pCAMBIA1300-OsPtr1-hGFP载体CaMV35S promoter为花椰菜花叶病毒(Cauliflower mosaic virus)启动子;hygromycin为潮酶素抗性标记基因;OsPtr1为肽转运子1;hGFP为绿色荧光蛋白;T-border为T-DNA边界。Figure 2. Vector pCAMBIA1300-OsPtr1-hGFPCaMV35S promoter is a cauliflower mosaic virus promoter; hygromycin, hygromycin-resistant marker gene; OsPtr1, a peptide transporter; hGFP, a green fluorescent protein; and T-border, border of T-DNA.2.3 OsPtr1基因的亚细胞定位
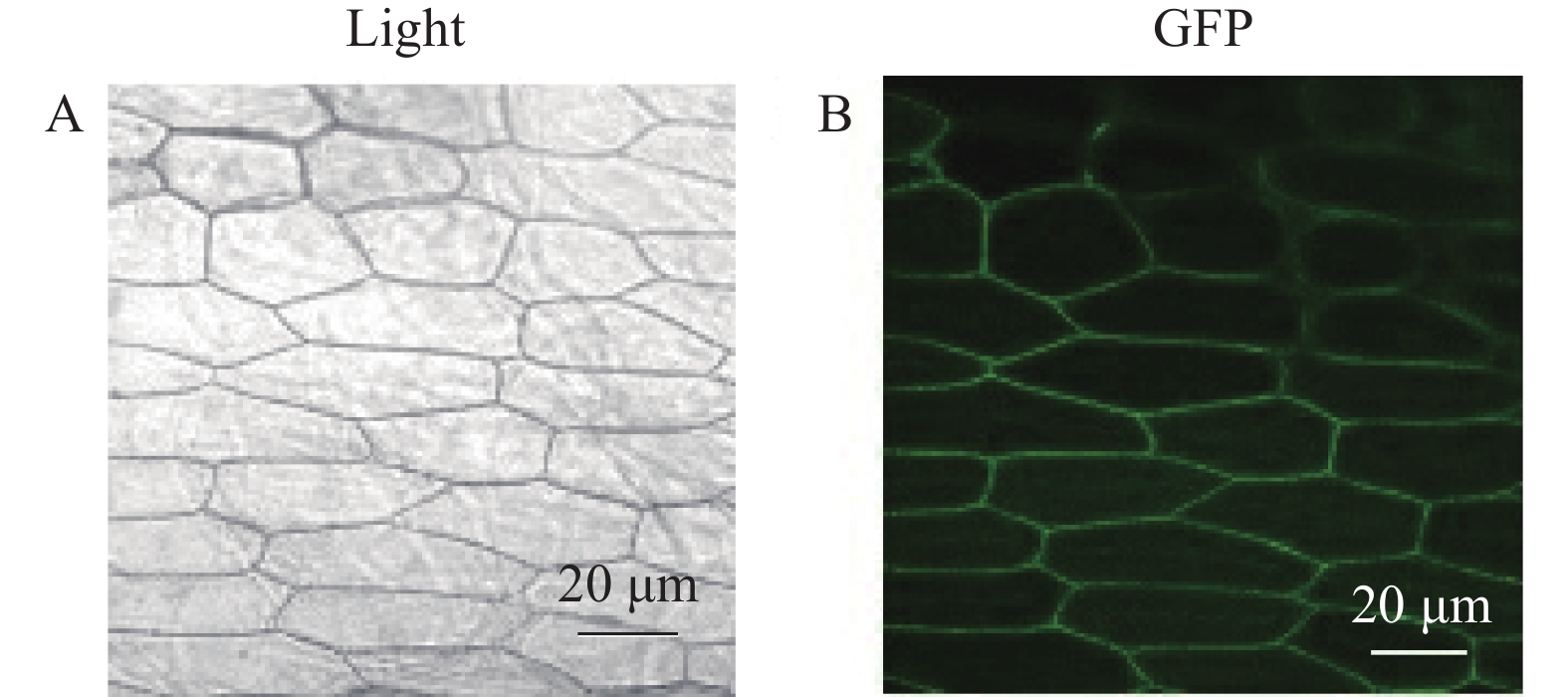
利用基因枪轰击,将包含OsPtr1-GFP融合表达载体导入洋葱内表皮细胞,然后用激光共聚焦观察OsPtr1-GFP在洋葱表皮细胞中的位置,结果显示:OsPtr1-GFP融合蛋白只在洋葱内表皮的细胞膜上表达(图3)。
2.4 OsPtr1基因过表达载体构建及水稻转化植株获得
用Bgl II和Xho I双酶切下中间载体中的Gt1-OsPtr1基因片段,连接于经Bam H I和Sal I双酶切的载体PCAMBIA1300上,获得由胚乳特异表达启动子Gt1驱动的过表达载体Gt1-OsPtr1(图4)。采用电击法将过表达载体Gt1-OsPtr1转入农杆菌,验证后,用农杆菌介导法转化获得过表达载体Gt1-OsPtr1转基因水稻植株。
2.5 过表达OsPtr1基因水稻植株Southern blot分析
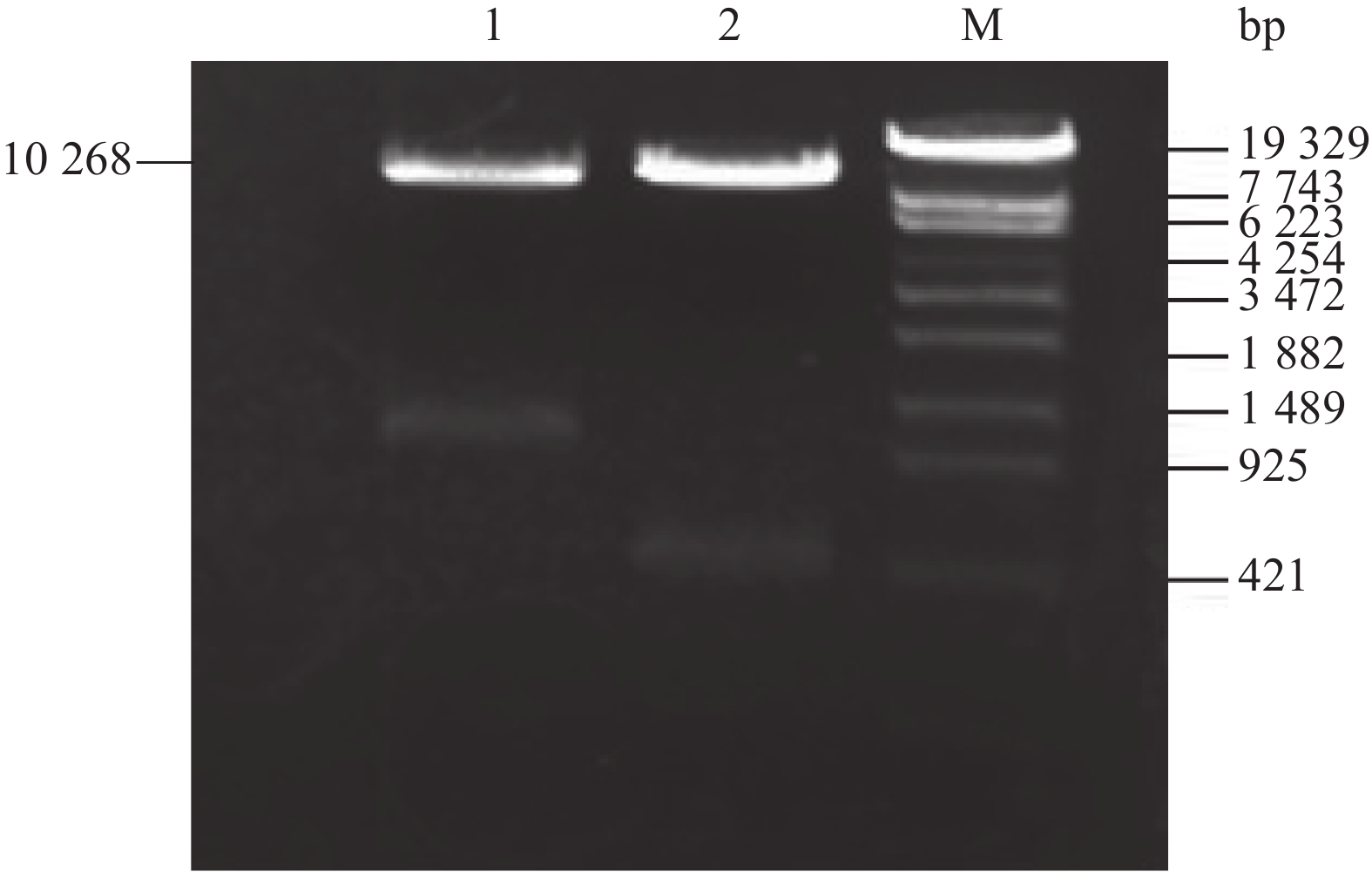
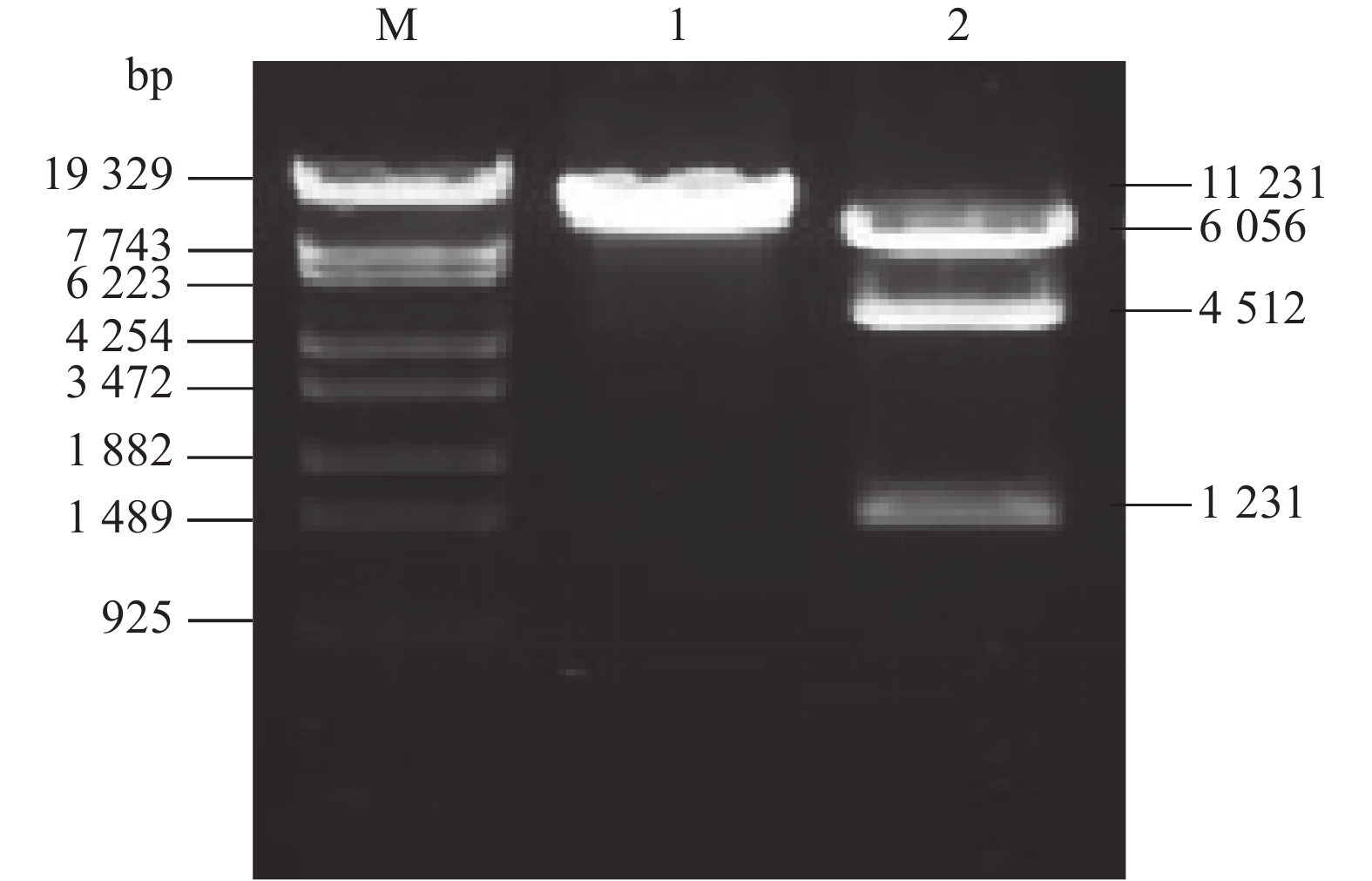
用Hind III酶切转过表达OsPtr1基因水稻植株总DNA,以hpt基因为探针,Southern blotting分析结果显示:除Ptr1g21为双拷贝外,其余5个株系均为单拷贝(图5)。
2.6 稻米含氮代谢物质分析
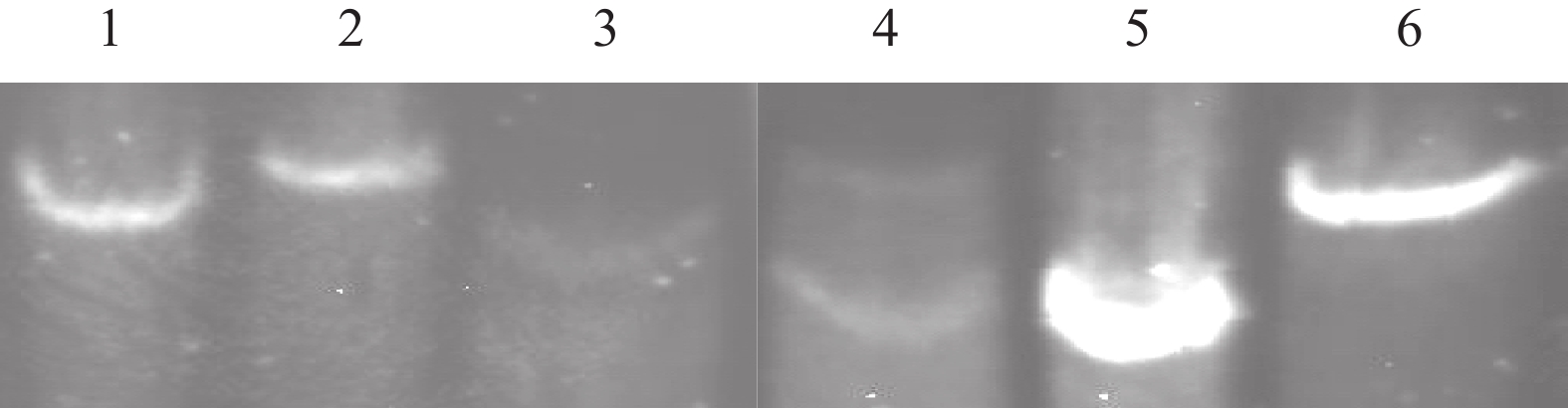
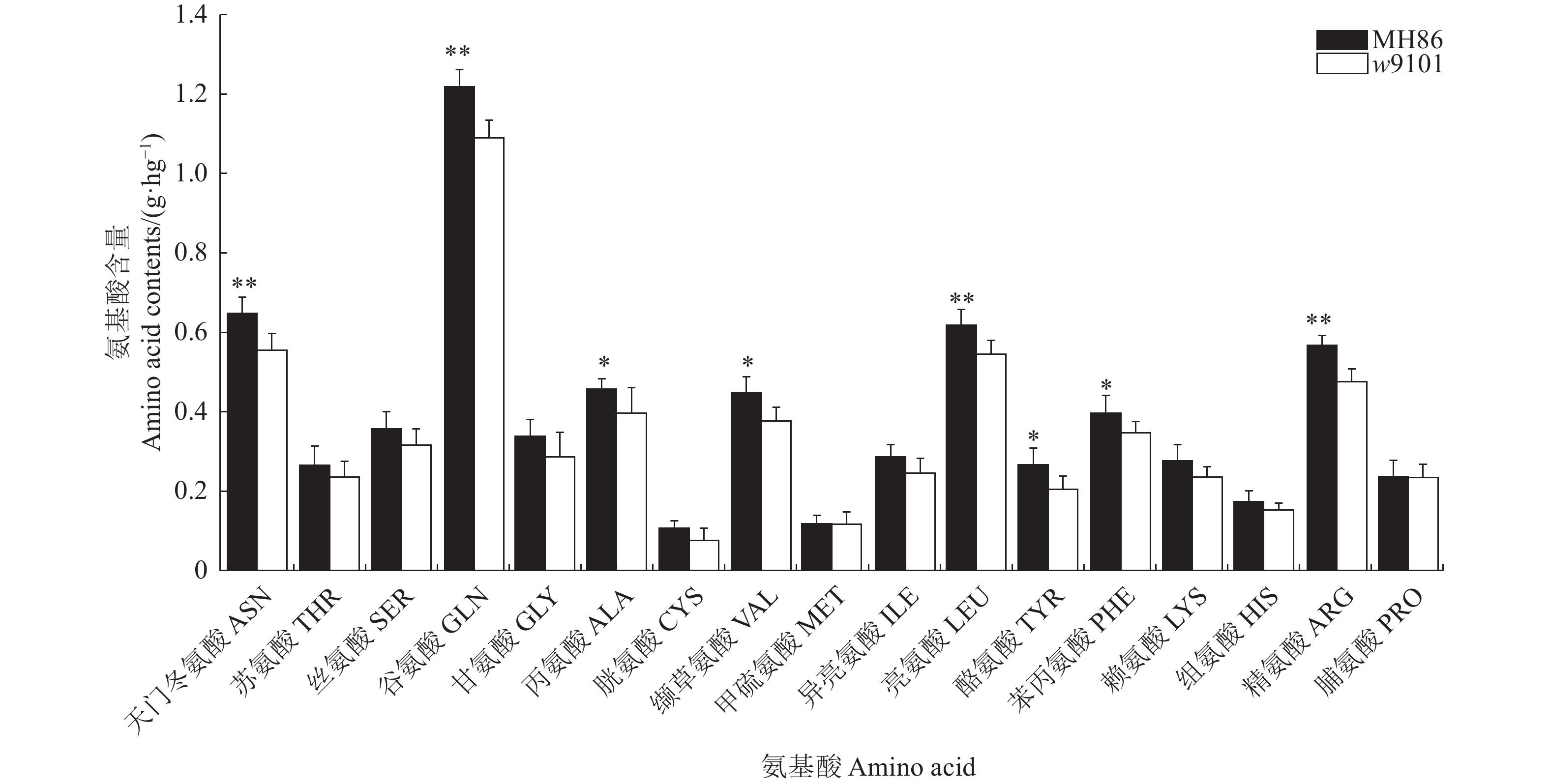
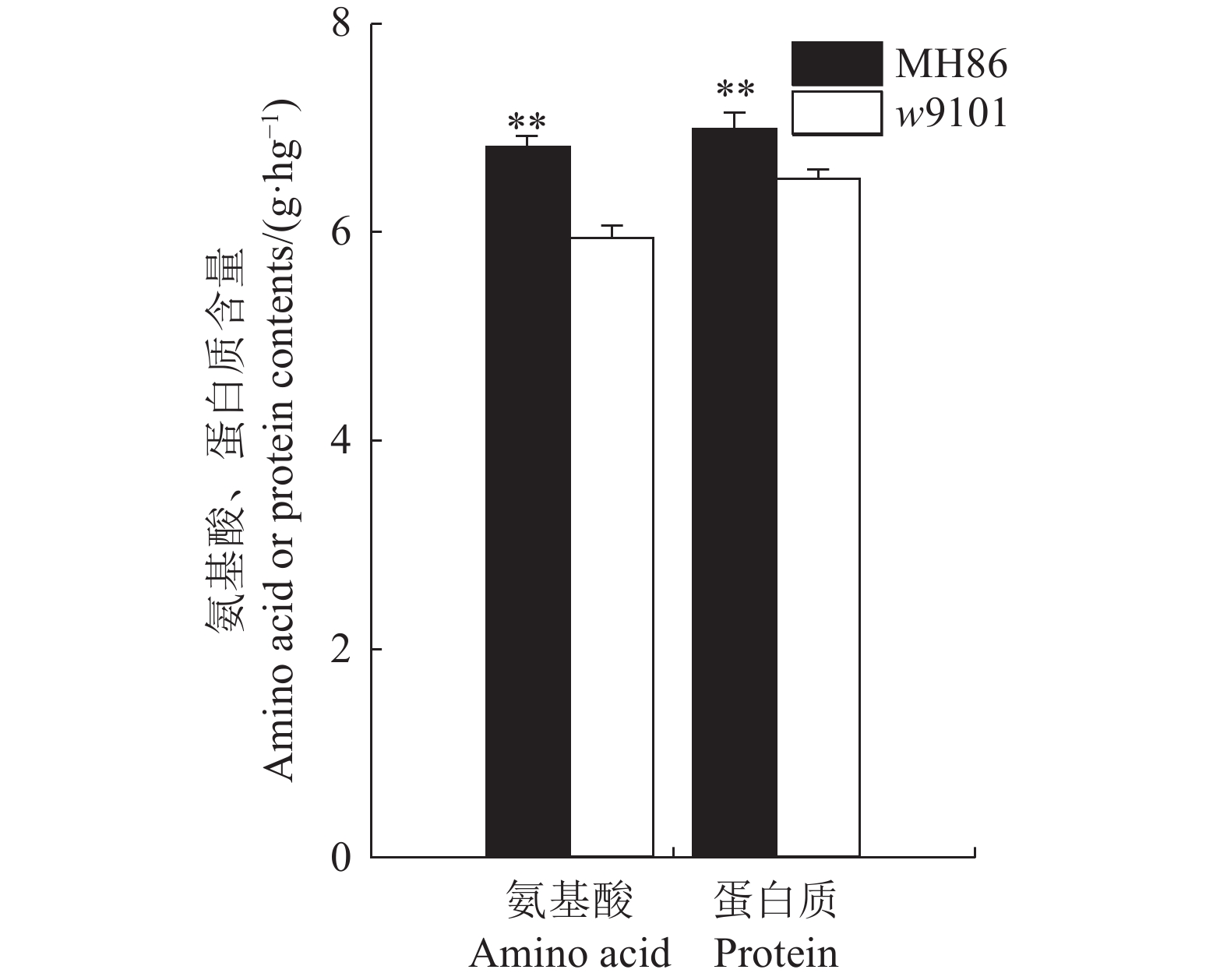
蛋白含量及氨基酸含量测定表明,T-DNA插入使得w9101的蛋白质含量及氨基酸含量有不同程度降低(图6和图7),其中,天门冬氨酸、谷氨酸、亮氨酸和精氨酸的差异达极显著,氨基酸总量和蛋白质含量的差异也达极显著,分别减少了12.7%和6.7%。
蛋白质及氨基酸含量分析表明,转过表达OsPtr1基因水稻ptr9101g15、ptr9101g21、ptr9101g29稻米中氨基酸总量、蛋白质总量、天门冬氨酸、谷氨酸精氨酸、异亮氨酸、亮氨酸、苯丙氨酸与日本晴Nipponbare(WT)的相比较达到显著水平;另外,3个转过表达OsPtr1基因水稻ptr9101g15、ptr9101g21、ptr9101g29之间因其基因表达水平差异,稻米中蛋白质及氨基酸含量也有很大的差异(表1)。
表 1 OsPtr1基因水稻植株氨基酸含量和蛋白质含量Table 1. Contents of amino acids and protein in transgenic rice plantlets of over-expressed OsPtr1 (单位:g·hg−1)指标
Indices水稻材料 Rice materials ptr9101g15 ptr9101g21 ptr9101g29 日本晴
Nipponbare(WT)天门冬氨酸 Asp 0.92±0.02 ab 0.96±0.01 a 0.87±0.01 b 0.78±0.02 c 丝氨酸 Ser 0.52±0.02 a 0.54±0.02 a 0.49±0.01 ab 0.44±0.02 b 谷氨酸 Glu 1.68±0.03 b 1.76±0.02 a 1.62±0.03 c 1.45±0.02 d 甘氨酸 Gly 0.46±0.03 a 0.47±0.02 a 0.44±0.03 ab 0.40±0.03 b 丙氨酸 Ala 0.57±0.02 a 0.58±0.02 a 0.57±0.02 a 0.51±0.02 b 胱氨酸 Cys 0.12±0.03 a 0.13±0.02 a 0.12±0.01 a 0.10±0.02 a 甲硫氨酸 Met 0.22±0.01 a 0.17±0.01 b 0.13±0.02 c 0.12±0.02 c 酪氨酸 Tyr 0.46±0.03 a 0.33±0.02 b 0.28±0.02 c 0.27±0.02 c 脯氨酸 Pro 0.36±0.02 a 0.37±0.02 a 0.34±0.03 ab 0.30±0.02 b 组氨酸 His 0.25±0.04 a 0.26±0.03 a 0.24±0.03 ab 0.21±0.04 b 精氨酸 Arg 0.98±0.02 a 0.89±0.04 b 0.77±0.03 c 0.71±0.04 d 苏氨酸 Thr 0.36±0.02 a 0.37±0.03 a 0.34±0.03 ab 0.30±0.04 b 缬草氨酸 Val 0.56±0.02 ab 0.59±0.02 a 0.55±0.02 ab 0.51±0.01 b 异亮氨酸 Ile 0.39±0.01 a 0.39±0.01 a 0.37±0.02 a 0.33±0.01 b 亮氨酸 LEeu 0.84±0.01 a 0.86±0.02 a 0.80±0.02 a 0.72±0.02 b 苯丙氨酸 Phe 0.54±0.01 a 0.57±0.02 a 0.54±0.02 a 0.47±0.01 b 赖氨酸 Lys 0.39±0.01 a 0.40±0.01 a 0.36±0.012 ab 0.31±0.01 b 氨基酸总量 Amino acid contents 9.61±0.05 a 9.55±0.05 a 8.83±0.05 b 7.95±0.04 c 蛋白质含量 Protein contents 10.10±0.40 a 9.69±0.06 bc 9.42±0.04 c 8.02±0.07 d 不同小写字母表示不同水稻材料之间差异显著(P<0.05)。
Data with different lowercase letters indicate significant difference (P<0.05).3. 讨论
肽作为植物氮源,如蔗糖一样可防止在转运过程被降解。生物中,肽被转移后,可以很快被肽酶水解成氨基酸,作为蛋白质合成的原料或者作为氮物质合成的原料。因此,肽运输在植物信号传递和生长发育过程中起着非常重要的作用[8]。
根据能量需求与否,肽转运可以分为ATP结合盒转运蛋白(ATP-Binding cassette transporter,ABC)、肽转运蛋白(Peptite trasporter,PTR)和寡肽转运蛋白(Oligopeptide transporter,OPT)3类。它们一般含有12个跨膜结构域,并含有FING、WQIPQY等保守区[9]。Komarova 等[10]利用拟南芥突变体分离到一个PTR/NRT1(Peptide transporter/Nitrate transporter 1)家族新成员AtPTR5,其亚细胞定位于质膜。Dietrich等[11]分析拟南芥中的AtPTR1基因发现,AtPTR1/GFP融合表达在质膜上表达,用它的启动子连接GUS基因只在拟南芥维管束中表达,表明AtPTR1基因在植物肽的长距离运输中起到一定的作用。PTR的作用机制经常与质子(H+)运输相偶联,因此,PTR家族也被称为质子寡肽转运蛋白(Proton oligopeptide transporter,POT),通过质子相偶联能进行跨膜运输的一系列底物包括氨基酸、肽、硝酸盐等[12]。生物体中最早发现的肽转运子CHR1(AtNTR1)是硝酸盐的转运子,尽管硝酸盐结构与肽的结构有很大的不同,但这些转运蛋白之间有着非常高的同源性[13]。目前已经发现20多种PTR肽转运家族成员,但是人们发现肽主要运输2~6个氨基酸的短肽,它与氨基酸的运输方式不一样[14]。本研究表明,OsPtr1基因亚细胞定位于细胞膜上,水稻T-DNA插入突变体w9101候选基因缺失能引起氨基酸和蛋白质等含氮物质积累效率降低,转过表达OsPtr1基因水稻稻米中蛋白质及氨基酸含量有提高趋势,说明OsPtr1基因与一些氮类物质的运输有关,它们可能既作为营养物质供给植物生长发育,又在信号传递过程中扮演重要角色。
-
图 2 pCAMBIA1300-OsPtr1-hGFP载体
CaMV35S promoter为花椰菜花叶病毒(Cauliflower mosaic virus)启动子;hygromycin为潮酶素抗性标记基因;OsPtr1为肽转运子1;hGFP为绿色荧光蛋白;T-border为T-DNA边界。
Figure 2. Vector pCAMBIA1300-OsPtr1-hGFP
CaMV35S promoter is a cauliflower mosaic virus promoter; hygromycin, hygromycin-resistant marker gene; OsPtr1, a peptide transporter; hGFP, a green fluorescent protein; and T-border, border of T-DNA.
表 1 OsPtr1基因水稻植株氨基酸含量和蛋白质含量
Table 1 Contents of amino acids and protein in transgenic rice plantlets of over-expressed OsPtr1 (单位:g·hg−1)
指标
Indices水稻材料 Rice materials ptr9101g15 ptr9101g21 ptr9101g29 日本晴
Nipponbare(WT)天门冬氨酸 Asp 0.92±0.02 ab 0.96±0.01 a 0.87±0.01 b 0.78±0.02 c 丝氨酸 Ser 0.52±0.02 a 0.54±0.02 a 0.49±0.01 ab 0.44±0.02 b 谷氨酸 Glu 1.68±0.03 b 1.76±0.02 a 1.62±0.03 c 1.45±0.02 d 甘氨酸 Gly 0.46±0.03 a 0.47±0.02 a 0.44±0.03 ab 0.40±0.03 b 丙氨酸 Ala 0.57±0.02 a 0.58±0.02 a 0.57±0.02 a 0.51±0.02 b 胱氨酸 Cys 0.12±0.03 a 0.13±0.02 a 0.12±0.01 a 0.10±0.02 a 甲硫氨酸 Met 0.22±0.01 a 0.17±0.01 b 0.13±0.02 c 0.12±0.02 c 酪氨酸 Tyr 0.46±0.03 a 0.33±0.02 b 0.28±0.02 c 0.27±0.02 c 脯氨酸 Pro 0.36±0.02 a 0.37±0.02 a 0.34±0.03 ab 0.30±0.02 b 组氨酸 His 0.25±0.04 a 0.26±0.03 a 0.24±0.03 ab 0.21±0.04 b 精氨酸 Arg 0.98±0.02 a 0.89±0.04 b 0.77±0.03 c 0.71±0.04 d 苏氨酸 Thr 0.36±0.02 a 0.37±0.03 a 0.34±0.03 ab 0.30±0.04 b 缬草氨酸 Val 0.56±0.02 ab 0.59±0.02 a 0.55±0.02 ab 0.51±0.01 b 异亮氨酸 Ile 0.39±0.01 a 0.39±0.01 a 0.37±0.02 a 0.33±0.01 b 亮氨酸 LEeu 0.84±0.01 a 0.86±0.02 a 0.80±0.02 a 0.72±0.02 b 苯丙氨酸 Phe 0.54±0.01 a 0.57±0.02 a 0.54±0.02 a 0.47±0.01 b 赖氨酸 Lys 0.39±0.01 a 0.40±0.01 a 0.36±0.012 ab 0.31±0.01 b 氨基酸总量 Amino acid contents 9.61±0.05 a 9.55±0.05 a 8.83±0.05 b 7.95±0.04 c 蛋白质含量 Protein contents 10.10±0.40 a 9.69±0.06 bc 9.42±0.04 c 8.02±0.07 d 不同小写字母表示不同水稻材料之间差异显著(P<0.05)。
Data with different lowercase letters indicate significant difference (P<0.05). -
[1] RAM H, SONI P, SALVI P, et al. Insertional mutagenesis approaches and their use in rice for functional genomics [J]. Plants, 2019, 8(9): 310. DOI: 10.3390/plants8090310
[2] ODA Y, KOBAYASHI N I, TANOI K, et al. T-DNA tagging-based gain-of-function of OsHKT1;4 reinforces Na exclusion from leaves and stems but triggers Na toxicity in roots of rice under salt stress [J]. International Journal of Molecular Sciences, 2018, 19(1): 235. DOI: 10.3390/ijms19010235
[3] WU H P, WEI F J, WU C C, et al. Large-scale phenomics analysis of a T-DNA tagged mutant population [J]. Giga Science, 2017, 6(8): 1−7.
[4] CHEN S Y, WANG A M, LI W, et al. Establishing a gene trap system mediated by T-DNA(GUS) in rice [J]. Journal of Integrative Plant Biology, 2008, 50(6): 742−751. DOI: 10.1111/j.1744-7909.2007.00611.x
[5] 张晖, 胡昌泉, 刘华清, 等. 一个水稻胚乳特异表达基因的筛选及初步分析 [J]. 福建农业学报, 2009, 24(1):6−10. DOI: 10.3969/j.issn.1008-0384.2009.01.002 ZHANG H, HU C Q, LIU H Q, et al. Screening and preliminary analysis of an endosperm-specific expression gene in rice(Oryza sativa L. ) [J]. Fujian Journal of Agricultural Sciences, 2009, 24(1): 6−10.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2009.01.002
[6] 王关林, 方宏筠. 植物基因工程[M]. 2版. 北京: 科学出版社, 2002. [7] 胡昌泉, 徐军望, 苏军, 等. 农杆菌介导法获得转可溶性淀粉合成酶基因籼稻 [J]. 福建农业学报, 2003, 18(2):65−68. DOI: 10.3969/j.issn.1008-0384.2003.02.001 HU C Q, XU J W, SU J, et al. Induction of soluble starch synthase gene into Indica Staiva L. by Agrobacterium-mediated transformation [J]. Fujian Journal of Agricultural Sciences, 2003, 18(2): 65−68.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2003.02.001
[8] YANG X H, XIA X Z, ZENG Y, et al. Genome-wide identification of the peptide transporter family in rice and analysis of the PTR expression modulation in two near-isogenic lines with different nitrogen use efficiency [J]. BMC Plant Biology, 2020, 20(1): 193. DOI: 10.1186/s12870-020-02419-y
[9] ZHAO J Z, YU N N, JU M, et al. ABC transporter OsABCG18 controls the shootward transport of cytokinins and grain yield in rice [J]. Journal of Experimental Botany, 2019, 70(21): 6277−6291. DOI: 10.1093/jxb/erz382
[10] KOMAROVA N Y, THOR K, GUBLER A, et al. AtPTR1 and AtPTR5 transport dipeptides in planta [J]. Plant Physiology, 2008, 148(2): 856−869. DOI: 10.1104/pp.108.123844
[11] DIETRICH D, HAMMES U, THOR K, et al. AtPTR1, a plasma membrane peptide transporter expressed during seed germination and in vascular tissue of Arabidopsis [J]. The Plant Journal:for Cell and Molecular Biology, 2004, 40(4): 488−499. DOI: 10.1111/j.1365-313X.2004.02224.x
[12] MARTINEZ MOLLEDO M, QUISTGAARD E M, LÖW C. Tripeptide binding in a proton-dependent oligopeptide transporter [J]. FEBS Letters, 2018, 592(19): 3239−3247. DOI: 10.1002/1873-3468.13246
[13] TSAY Y F, SCHROEDER J I, FELDMANN K A, et al. The herbicide sensitivity gene CHL1 of Arabidopsis encodes a nitrate-inducible nitrate transporter [J]. Cell, 1993, 72(5): 705−713. DOI: 10.1016/0092-8674(93)90399-B
[14] FANG Z M, XIA K F, YANG X, et al. Altered expression of the PTR/NRT1 homologue OsPTR9 affects nitrogen utilization efficiency, growth and grain yield in rice [J]. Plant Biotechnology Journal, 2013, 11(4): 446−458. DOI: 10.1111/pbi.12031




 下载:
下载: