Dual PCR Detection of Type 2 and 3 Cyprinus Herpesvirus
-
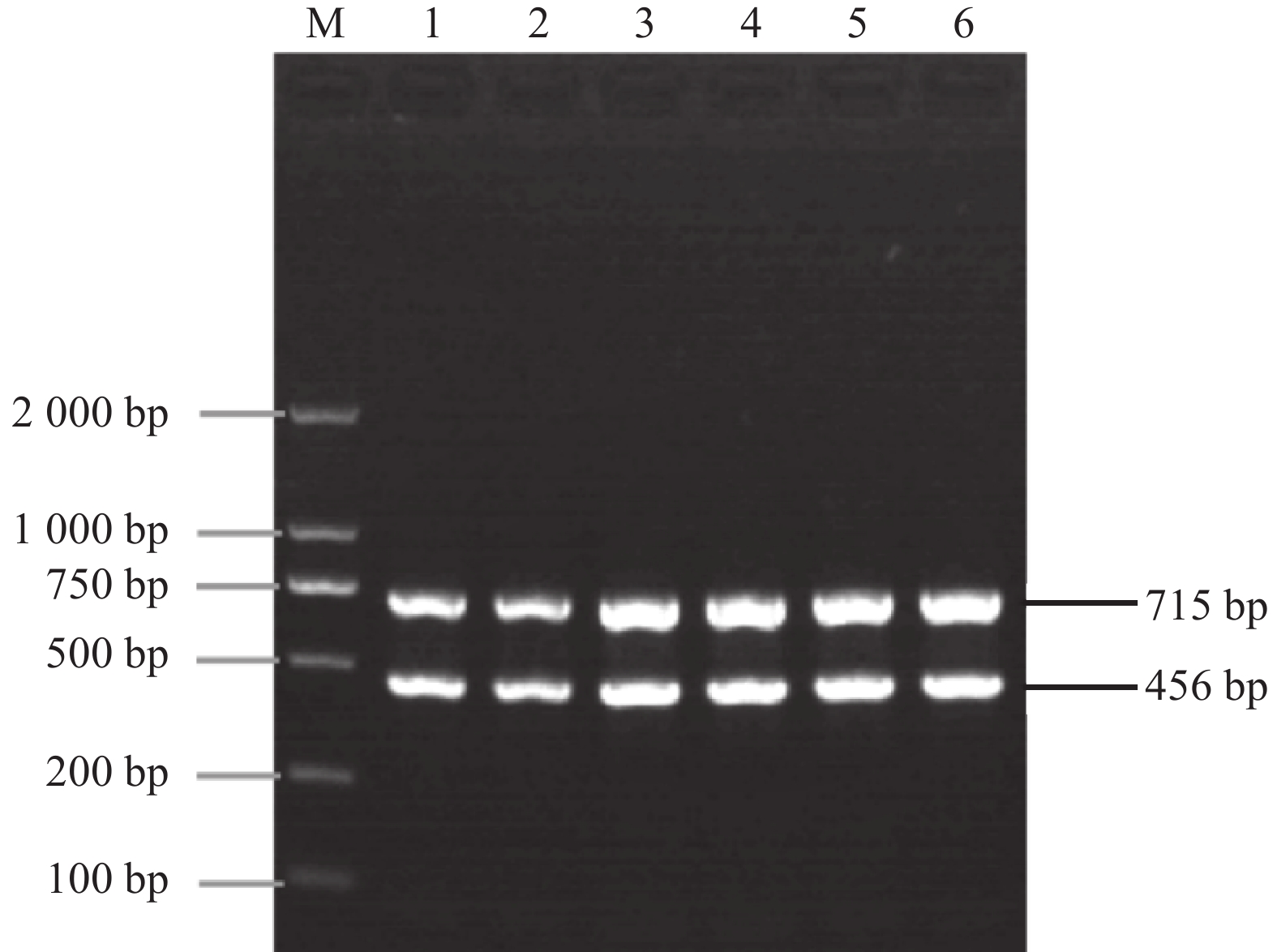
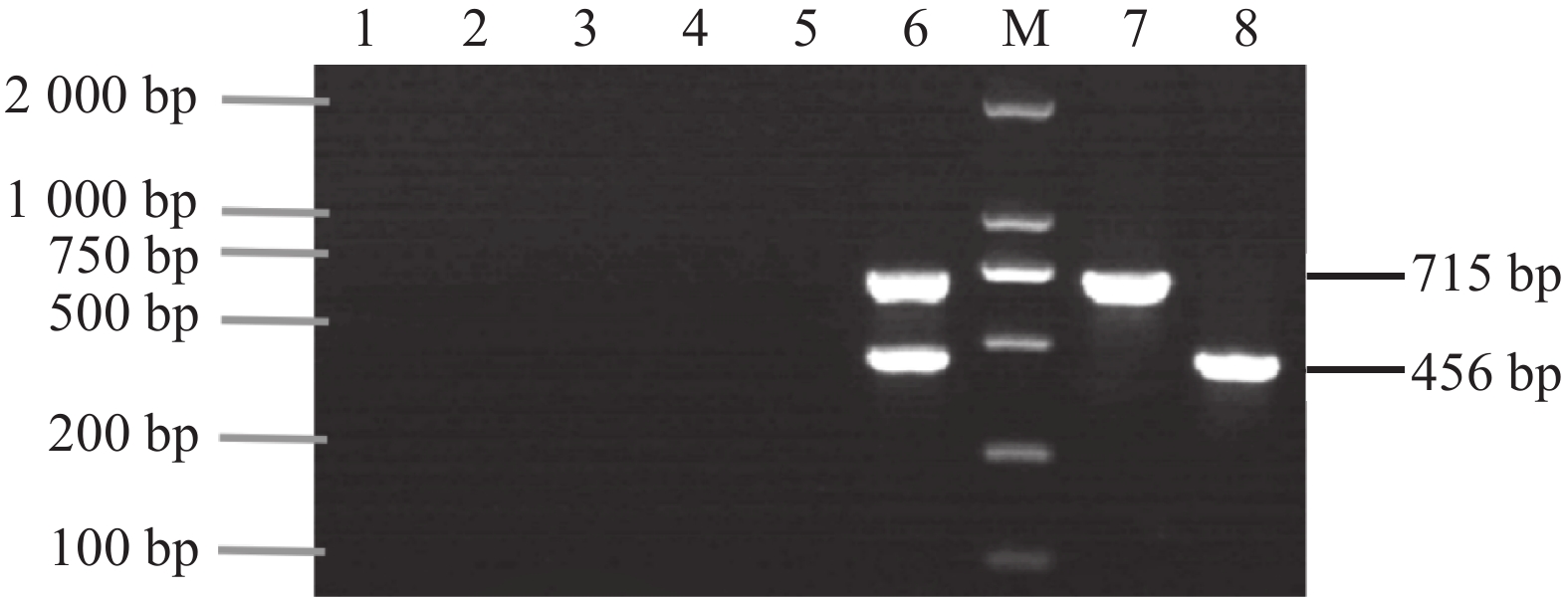
摘要:目的 鲤疱疹病毒2型和3型对鲤科鱼类危害严重,本研究旨在建立快捷、高效且能同时检测2种鲤疱疹病毒的检测技术。方法 根据鲤疱疹病毒 2 型和3型的DNA聚合酶基因保守序列,设计2对特异性引物,通过对双重PCR反应条件的优化,建立检测鲤疱疹病毒2型和3型的双重PCR方法;使用该方法对试验室保存的鲫和鲤病鱼组织样品进行检测。结果 该方法能够分别对鲤疱疹病毒2型和鲤疱疹病毒3型各扩增出715 bp和456 bp的特异性条带,表现出良好的特异性;敏感性试验结果显示,该方法的检测极限值为100 copies·μL-1,具有较高的灵敏性。使用该方法对本试验室保存的18份临床病料进行PCR检测并对PCR产物进行测序验证,结果显示CyHV-2和CyHV-3阳性的各有3份,其阳性率都为33.3%;分别对2份CyHV-2和CyHV-3阳性样品混合后进行检测,结果混合样品均为CyHV-2和CyHV-3双阳性,与常规检测方法得到的结果相同。结论 本研究建立的双重PCR检测方法特异性强、灵敏度高,可用于CyHV-2和CyHV-3的快速检测和鉴别诊断。Abstract:Objective A PCR method for simultaneously detecting Type 2 and Type 3 Cyprinid herpesvirus that cause serious diseases on Cyprinidae was developed and tested for clinical diagnosis.Methods Two pairs of specific primers were designed according to the conserved sequences of the DNA polymerase gene of the two types of virus, CyHV-2 and CyHV-3. PCR reaction conditions of the method were optimized. The assay was applied on the stored tissue samples of diseased Carassius auratus and Cyprinus carpio to verify validity of the methodology.Result The newly developed Dual PCR Assay amplified specific bands with the base numbers of 715 bp for CyHV-2 and 456 bp for CyHV-3. It exhibited high sensitivity with a detection limit of 100 copies·μL−1. On the 18 clinical samples, 3 were found to be CyHV-2 and 3 CyHV-3 with a positive detection rate of 33.3%. Furthermore, the assay successfully identified the two type viruses in a mixed sample of CyHV-2 and CyHV-3 in a challenge test.Conclusion The Dual PCR Assay demonstrated high specificity and sensitivity in simultaneously detecting CyHV-2 and CyHV-3. It could be adequately applied for rapid diagnosis of the viral diseases on carps.
-
Keywords:
- Cyprinus carpio /
- Cyprinus herpesvirus /
- Double PCR
-
0. 引言
【研究意义】褪黑素是一种具有物种多样性和功能多样性的吲哚类激素,其合成和分泌主要由光照周期来决定[1],在体内各组织中发挥广泛的生物学作用,褪黑素作用发挥需要其受体的介导,探究褪黑素受体的分布对进一步完善褪黑素的功能具有重要的意义。皖西白鹅作为安徽优良地方品种,褪黑素及其受体对其调控作用研究较少。【前人研究进展】大量研究已充分证明褪黑素通过与膜受体相互作用影响细胞生理功能,主要表现为保护配子和胚胎发育、时钟基因的调节、免疫-神经内分泌、调节免疫功能的季节变化等[2];褪黑素对癌症的抑制和心脑血管系统也有一定的保护作用[3]。在哺乳动物体内,褪黑素受体主要为Mel 1a(MT1)和Mel 1b(MT2),它们都属于G蛋白偶联受体家族。褪黑素及其膜受体在包括人(Homo sapiens)、大鼠( Rattus norvegicus)、牛(Bos taurus)和小鼠(Mus musculus)在内的几种哺乳动物的卵巢中强烈表达[4-5]。哺乳动物褪黑素受体Mel 1a主要定位于视交叉上核(SCN)、脑区、视网膜、心血管系统和包括卵巢在内的许多其他器官。但是在同一种动物的不同组织器官中褪黑素受体的表达存在差异,研究表明褪黑素受体除了在中枢神经系统中存在表达外[6],在鸡(Gallus gallus)和鸭(Anatinae)的性腺[7]、哺乳动物和鸟类的胃肠道[8]、大鼠的淋巴细胞[9]、鸡的肾脏[10]也存在褪黑素受体的表达。本课题组前期研究表明鹅(Anser cygnoides orientalis)的大脑组织中存在3种褪黑素受体,并验证了禽类特有受体Mel 1c基因在鹅的组织表达分布[11]及褪黑素受体Mel 1a、Mel 1b在鸭的不同组织的表达和分布[12-13]。【本研究切入点】褪黑素及其Mel 1a受体的相关作用目前在哺乳动物的研究中较为成熟,在非哺乳动物中主要集中在鸡、鸭、爪哇(Xenopus laevis)、鱼等动物[14]。然而关于皖西白鹅体内褪黑素及褪黑素受体Mel 1a 的相关作用还有待深入探讨。【拟解决的关键问题】以皖西白鹅为研究对象,探究褪黑素受体Mel 1a 在各组织中的表达与分布,为探明褪黑素对于皖西白鹅生理功能的调控作用奠定基础。
1. 材料与方法
1.1 试验材料
皖西白鹅由蚌埠市华信禽业有限公司提供;总RNA提取试剂盒、PCR反应试剂盒购自天根生化科技有限公司;反转录试剂盒、全蛋白提取试剂盒、BCA蛋白检测试剂盒购自赛默飞世尔科技(中国)有限公司;免疫组化试剂盒购自武汉博士德生物工程有限公司;HRP标记的鸡抗山羊二抗购自安诺伦(北京)生物科技有限公司;Mel 1a抗体购自Abcam生物技术有限公司;Marker、6×DNA Loading Buffer、RT-PCR反应试剂盒购自生工生物工程(上海)股份有限公司;相关引物合成由生工生物工程(上海)股份有限公司完成。
1.2 样本采集
试验共选取4只产蛋期的皖西白鹅,在自然环境条件下饲养,并提供充足的饲料和饮用水。采用电击法将其致晕,然后放血屠宰。分别取出大脑、小脑、心脏、肾脏、肝脏、肺脏、脾脏、胰脏、胸肌、卵巢;并分级采集完整卵泡(根据卵泡直径分级,F1:<0.5 cm,F2:0.5~1.0 cm,F3:1.0~2.0 cm,F4:2.0~3.0 cm,F5:>3.0 cm)。将样本置于液氮中冷冻24 h,然后在−80 ℃储存。同时,将用于组织染色的大脑、心脏、肾脏、肝脏、肺脏、脾脏、胰腺和肌肉用4%的多聚甲醛固定12~16 h。
1.3 RNA的提取与反转录
利用动物组织总RNA提取试剂盒分别从皖西白鹅组织器官(大脑、小脑、心脏、肾脏、肝脏、肺脏、脾脏、胰脏、肌肉、卵巢)中提取总RNA。采用RevertAid First Strand cDNA试剂盒进行反转录合成cDNA。首先,将5 μL RNA、1 μL Oligo(dT)引物、6 μL RNase-free H2O,混合后离心30s并在65 ℃下孵育5 min,然后在冰上冷却。其次,再向混合物中添加4 μL 5×Reaction Buffer、1 μL RiboLock Rnase Inhibitor、2 μL 10 mmol·L−1 dNTP Mix、1 μL RevertAid M-MuLV RT。混匀后,在42 ℃下孵育60 min,70 ℃下孵育5 min,25 ℃孵育30 min,所得产物保存于−20 ℃保存备用。
1.4 PCR扩增及鉴定
根据He等[15]设计的Mel 1a引物(表1)进行皖西白鹅各组织中Mel 1a基因扩增。PCR反应体系(25 μL):2.5 μL的10×PCR缓冲液、正反向引物(10 μmol·L−1)各1.0 μL、cDNA 1 μL、dNTP(2.5 mmol·L−1)2 μL、Taq酶(2.5 U·μL−1)0.5 μL和ddH2O 17 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s, 35个循环;72 ℃下延伸10 min,以4 ℃保持结束。PCR产物经染色后用1.5%琼脂糖凝胶检测,纯化后测序。使用NCBI的BLAST算法序列进行比较(http://www.ncbi.nlm.nih.gov/BLAST/)。
表 1 试验引物Table 1. Primers applied基因
Genes序列
Sequence引物长度
Product
size/
bp退火温度
Annealing
temperature/
℃Mel 1a 5′AATTGCAGACTTGGTCGTAGC3′ 114 63 5′CCCATCAAGAATCCACTAATCTGAC3′ GAPDH 5′GTGGTGCAAGAGGCATTGCTGAC3′ 86 60 5′GCTGATGCTCCCATGTTCGTGAT3′ 1.5 免疫组化
4%多聚甲醛中固定好的组织样本进行石蜡包埋、切片(4 μm),常规脱蜡,组织免疫组化按照武汉博士德SABC法免疫组化试剂盒说明。用3% H2O2和5%脱脂奶粉封闭30 min。用PBS洗涤3次后,在4 ℃下于兔抗Mel 1a多抗孵育过夜。PBS洗涤3次后,在25 ℃下滴加生物素化山羊抗兔二抗孵育1 h。PBS洗涤后,用辣根过氧化物酶标记链霉亲和素在25 ℃下孵育1 h。最后,封片后显微镜下观察。
1.6 Real-time PCR
以cDNA为模板,引物见表1,每个样本3次重复。采用10 μL反应体系(5.0 μL含绿色荧光的2×Mix Buffer,2 μL cDNA,各0.5 μL 10 mmol·L−1正、反引物,ddH2O补充),反应程序如表2所示。
表 2 荧光定量PCR反应程序Table 2. Reaction program of real-time PCR反应步骤
Program温度
Temperature/℃时间
Time/s循环次数
Cycles荧光信号
Fluorescence Measure预孵育 Pre-incubation 95 30 1 无 No 95 5 扩增 Amplify 63 20 45 在延伸阶段结束时 At the end of the extension phase 72 20 熔解曲线 Melting Curve 60 25 1 在温度缓慢升高过程中 During a slow rise in temperature 冷却 Cooling 40 10 1 无 No 1.7 Western blot验证
组织样本中的全蛋白提取参照全蛋白提取试剂盒说明书进行,然后用BCA蛋白质检测试剂盒分析蛋白纯度和浓度。按照课题组试验方法[13]进行SDS-PAGE电泳,约30 μg蛋白进行12%的聚丙烯酰胺凝胶电泳,然后采用湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,加入Mel 1a抗体(1∶400)于4 ℃冰箱中孵育过夜。取出膜后,用含0.1% Tween 20的Tris缓冲(TBST)洗涤3次,每次5 min。加入HRP标记的鸡抗山羊二抗37 ℃下孵育1 h,再用TBST洗涤3次,每次5 min。最后显影及定影。使用ChemiDoc XRS化学发光成像系统(Bio-Rad,美国)捕获和分析可视化蛋白印迹,采用Image J软件分析Mel 1a蛋白和内参蛋白的灰度值。根据目的蛋白和内参蛋白灰度值的比值计算Mel 1a的相对表达量。
1.8 统计分析
利用Image-pro plus 6软件分析免疫组化结果,利用LightCycler 480系统软件分析Real-time PCR数据,用2−ΔΔCT方法计算相对表达量。采用SPSS 11.5进行单因素方差分析,结果以3次测定的平均值±标准差表示(P<0.05为差异显著)。
2. 结果与分析
2.1 褪黑素受体Mel 1a mRNA在鹅组织中的分布
Real-time PCR检测皖西白鹅不同组织中Mel 1a mRNA的表达。结果显示,褪黑素受体Mel 1a mRNA在大脑、小脑、心脏、肾脏、肝脏、肺脏、脾脏、胰脏、肌肉、卵巢中均有表达(图1)。
2.2 褪黑素受体Mel 1a蛋白在鹅组织中的表达
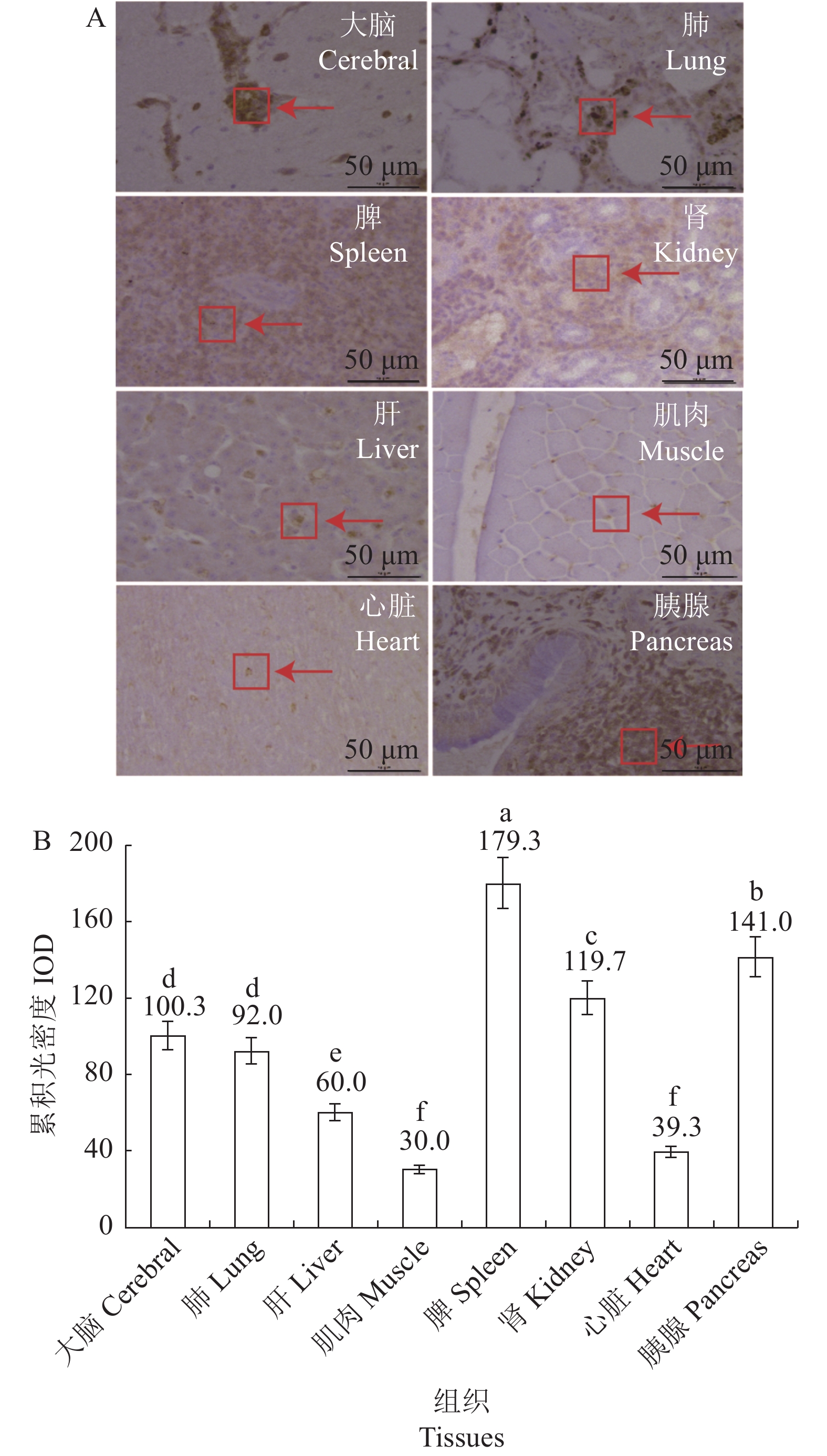
免疫组化染色结果显示,在大脑、肺脏、肝脏、肌肉、脾脏、肾脏、心脏和胰腺中具有褪黑素受体Mel 1a蛋白阳性信号(图2-A),其信号主要分布在细胞膜、细胞质和细胞核内,但信号强度及分布存在差异。利用Image-pro plus 6软件分析各组织中阳性信号IOD值,在肝脏、肌肉和心脏中偶尔可见,而在肾脏、脾脏、大脑、肺脏和胰脏组织中表达信号较强(图2-B)。
2.3 褪黑素受体Mel 1a mRNA在组织中的差异表达
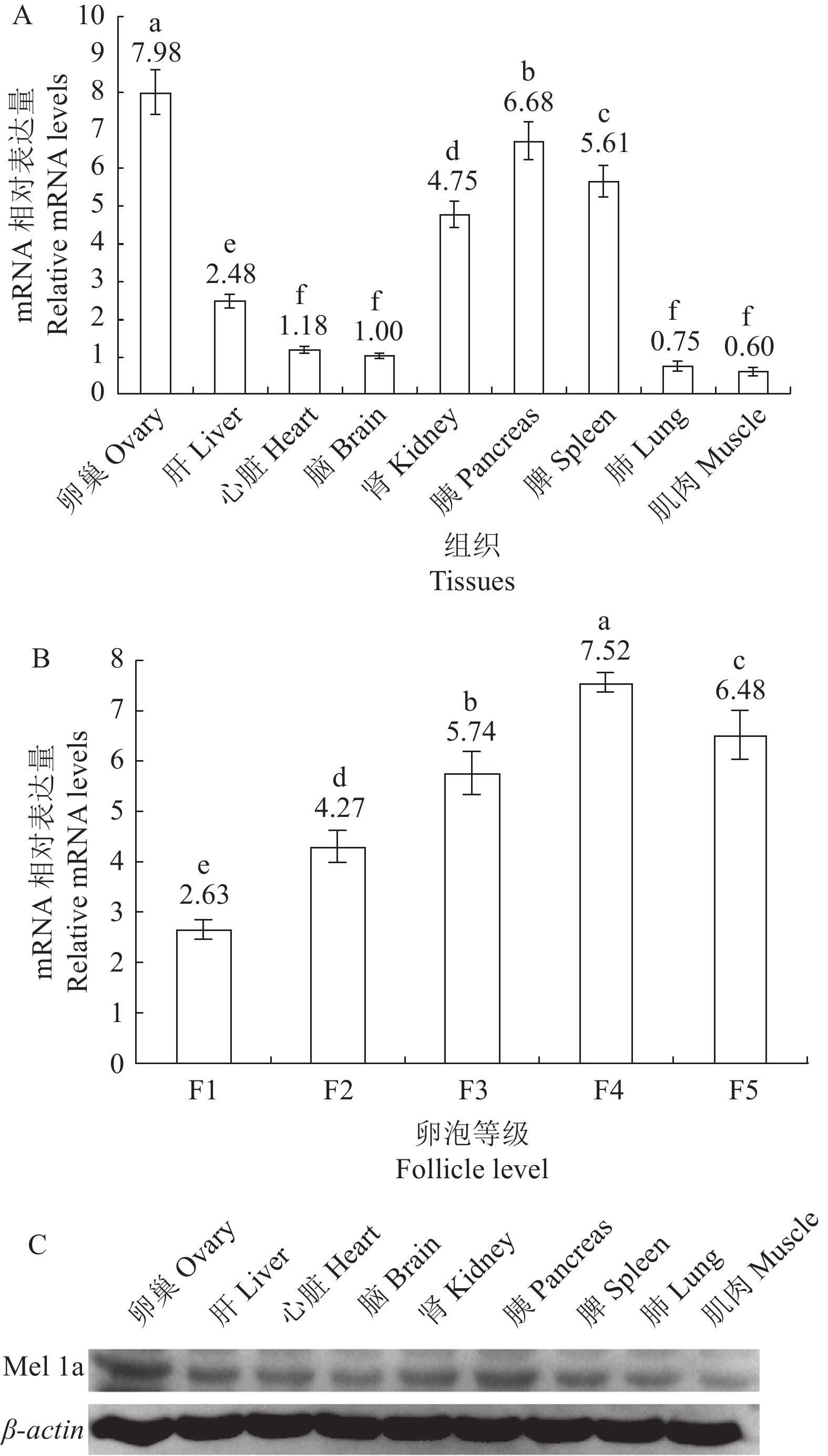
利用Real-time PCR技术测定鹅各组织中Mel 1a mRNA的相对表达量,以脑中表达量为对照,卵巢、胰腺、脾脏、肾脏和肝脏中表达水平显著高于脑内的表达量,而心脏、肺脏和肌肉中的表达量与大脑内的表达水平相当(图3-A)。然而,卵巢分级卵泡中Mel 1a mRNA的表达不同,随着卵泡直径的增加,表达量显著增加,但F5表达量显著低于F4中的表达量,显著高于其他卵泡中的表达量(图3-B)。
![]() 图 3 Mel 1a mRNA和蛋白在鹅各组织中的定量表达A:各组织Real-time PCR分析结果;B:各级卵泡Real-time PCR分析结果;C:Western blot分析结果。Figure 3. Quantitative expressions of Mel 1a mRNA and protein in goose tissuesA: Real-time PCR analysis results on each tissue; B: Real-time PCR analysis results on follicles ; C: Western blot analysis result.
图 3 Mel 1a mRNA和蛋白在鹅各组织中的定量表达A:各组织Real-time PCR分析结果;B:各级卵泡Real-time PCR分析结果;C:Western blot分析结果。Figure 3. Quantitative expressions of Mel 1a mRNA and protein in goose tissuesA: Real-time PCR analysis results on each tissue; B: Real-time PCR analysis results on follicles ; C: Western blot analysis result.Western blot技术测定鹅各组织中Mel 1a蛋白的表达量,由图3-C所示,与内参基因β-actin蛋白表达量相比,各组织间存在差异性,根据条带的亮度可见,卵巢、胰腺、脾脏和肾脏的表达量明显较高,基本与mRNA水平的表达量保持一致。
3. 讨论
褪黑素在调节生物功能,如昼夜节律、季节性繁殖、抗氧化、抗凋亡和免疫调节等方面发挥重要作用,与其受体在机体内广泛分布有着密切关系。哺乳动物中Mel 1a在SCN(视交叉上核)、脑区、视网膜、心血管系统、外分泌和内分泌胰腺、胃肠道、肝脏、肾脏、腮腺、胆囊、免疫细胞、卵巢、颗粒细胞、子宫肌层和皮肤中的表达已有报道[16],在大鼠中枢神经和外周组织如小肠、肝脏、哈氏腺、附睾、心脏中均存在Mel 1a的表达[17]。Mel 1a在金鱼(Carassius auratus)、斑马鱼(Danio rerio)、爪蟾、雏鸡、海鲈(Perca fluviatilis)和鳎鱼(Zebriaszebra)等非哺乳动物物种的中枢神经系统和外周组织中均有表达[18-23],在鱼类的鳃、顶脑、肠、肾、间脑、视前区、视乳头、小脑区以及垂体中均检测到Mel 1a的表达[24-25]。
本研究发现在皖西白鹅的心、肝、脾、肺、肾、脑、胰腺、卵巢、肌肉中均存在Mel 1a受体,且各组织中的表达存在差异性,其中卵巢中的表达水平最高。这一结果与其他动物机体内褪黑素受体的分布基本一致,充分体现了褪黑素在机体中广泛的分布。褪黑素及其受体参与动物昼夜节律、神经内分泌、抗氧化作用和抗凋亡作用等,其对皖西白鹅的调控作用研究尚不全面,本研究为进一步探究褪黑素对皖西白鹅的生产性能的研究奠定了一定的理论基础。
皖西白鹅是安徽地方优良品种,其产绒性极好,但繁殖性能差,特别是就巢性高。褪黑素对卵巢功能有着重要的调控作用,研究表明,卵巢卵泡液中存在高浓度褪黑素,其可通过受体介导作用调控卵泡发育及胚胎发育[26]。先前研究发现牛颗粒细胞、卵母细胞及卵丘卵母细胞复合体中均有Mel 1a受体,其介导褪黑素促进颗粒细胞增殖凋亡及激素分泌,增加卵母细胞成熟率和受精率,同时促进体外胚胎发育[27]。本研究中发现,在皖西白鹅卵巢中存Mel 1a受体表达分布,且在各级卵泡中均有表达,随着卵泡的发育,Mel 1a表达量逐渐增加,直到卵泡发育至直径>3.0 cm时,其表达量有所下降。Mel 1a在卵巢分级卵泡中的表达水平不同,可能是卵巢分级卵泡中雌激素调节的结果。Masana等[28]表明雌二醇对褪黑素受体Mel 1a功能和表达的影响存在差异。分级卵泡中雌激素在卵泡发育早期升高,随后降低,雌激素浓度较高的是黄色小卵泡(SYF)、F4、F3、F2和F1[13]。同时,褪黑素与受体结合可介导卵巢类固醇生成[29]。褪黑素受体亚型的表达可能受卵巢类固醇的影响,不同亚型的褪黑素受体在卵巢组织中的分布可能具有不同的下游细胞功能。由此可推测褪黑素及其受体可能参与鹅卵泡发育和卵巢功能的调节,进而可以利用褪黑素提高鹅的繁殖性能。
本研究结果表明,在皖西白鹅各组织器官中均存在Mel 1a受体的表达,且在卵巢中的表达量最高,在卵巢各级卵泡中表达量随着卵泡发育而逐渐增加,这为进一步探究褪黑素对皖西白鹅生理功能的调控作用奠定了基础。
4. 结论
Mel 1a在鹅的心脏、脾脏、大脑、小脑、肾脏、肝脏、肺脏、卵巢、胰腺、肌肉和各等级卵泡(F1、F2、F3、F4、F5)中均有表达,且表达量存在差异性,在卵巢中的表达量最高,且随着卵泡直径的增加,表达量逐渐增加,直至卵泡直径>3.0 cm,其表达量有所下降,由此可推断褪黑素可能通过Mel 1a的介导调控鹅卵泡发育。
-
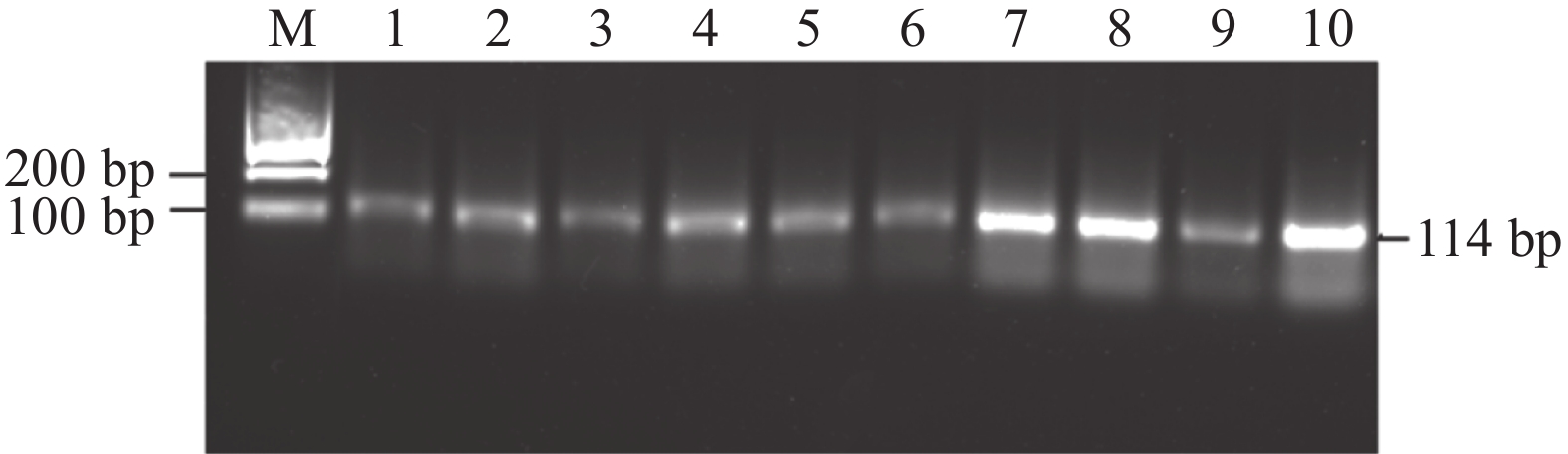
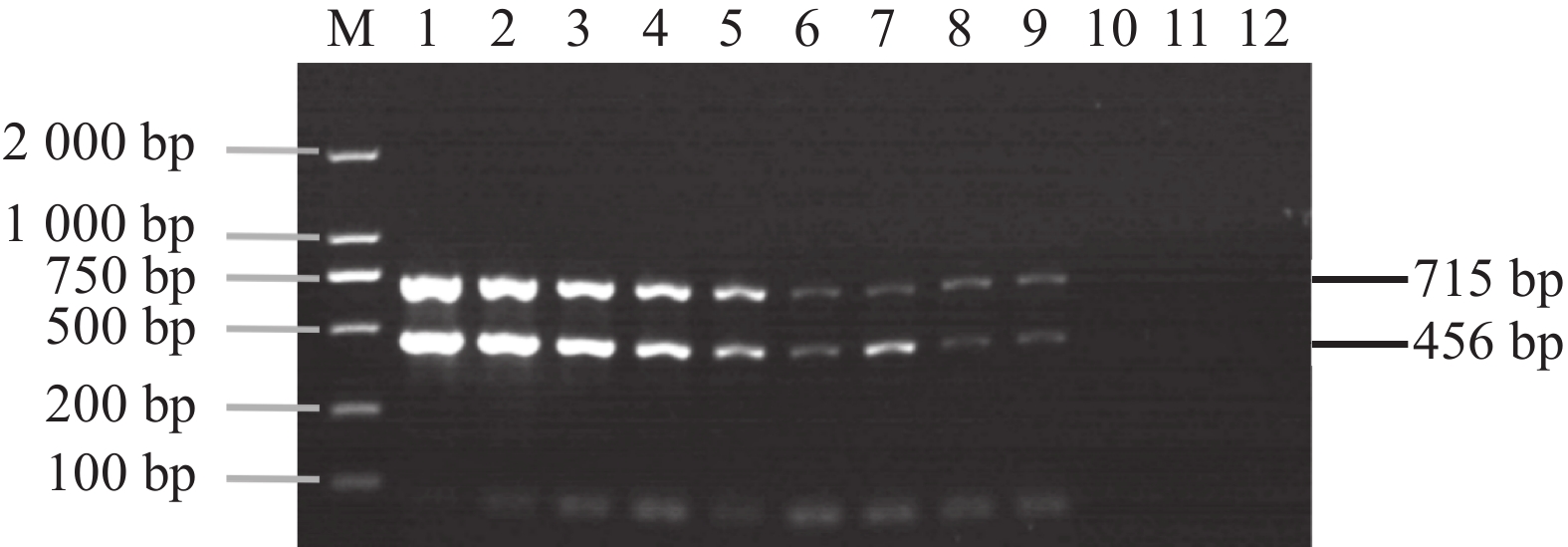
图 3 双重PCR 敏感性试验结果
M:2000 DNA Marker;1:CyHV-2 和 CyHV-3混合质粒初始含量1×1011 copies·μL−1;2~12:以10倍比稀释1×1010 ~1×100 copies·μL−1混合质粒含量。
Figure 3. Sensitivity of Dual PCR Assay
M: 2000 DNA Marker; 1: mixed plasmid of CyHV-2 and CyHV-3 as template (initial concentration 1×1011 copies·μL−1) ; 2–12: diluted at 10 times ratio 1×1010–1×100 copies·μL−1.
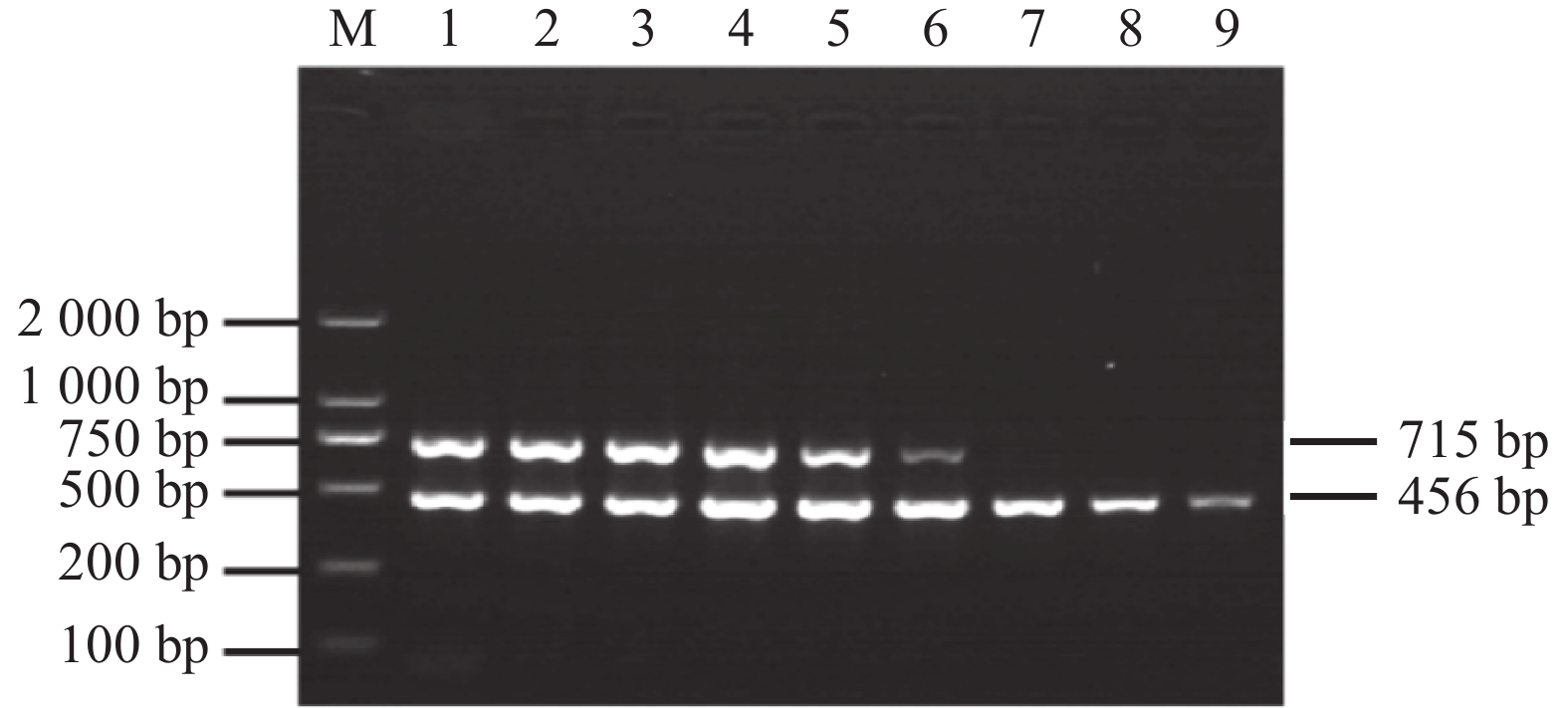
表 1 双重PCR引物序列
Table 1 Sequence of primer for Dual PCR Assay
引物名称
Primer name引物序列(5′-3′)
Primer sequence (5′-3′)片段长度
Fragment length/bpCyHV-2-F CTGATTATTACGGAGAGTATGAC 715 CyHV-2-R CTGTGAGACTTTTGTAGATTATTC CyHV-3-F CTATGCTGGAACTGGTGATC 456 CyHV-3-R GAGAGATTCTGACGGTGAAG 表 2 样品检测结果
Table 2 Detection on clinical samples by Dual PCR Assay
检测方法
Detection method鱼种
Fish species阳性样品数/样品数
Positive samples/Total samplesCyHV-2 CyHV-3 《金鱼造血器官坏死病毒检测方法》(GB/T 36194—2018)
Detection method of goldfish haemotopoietic necrosis virus金鱼 3/9 — 混合样 2/2 — 《鲤疱疹病毒检测方法第一部分:锦鲤疱疹病毒》(SC/T 7212.1—2011)
Detection methods of cyprinid herpesvirus(CyHV)Part 1: Koi herpevirus锦鲤 — 3/9 混合样 — 2/2 双重PCR方法
Double PCR detection金鱼 3/9 — 锦鲤 — 3/9 混合样 2/2 2/2 -
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022: 25. [2] BALON E K. Origin and domestication of the wild carp, Cyprinus carpio: From Roman gourmets to the swimming flowers [J]. Aquaculture, 1995, 129(1/2/3/4): 3−48.
[3] GOODWIN A E, SADLER J, MERRY G E, et al. Herpesviral haematopoietic necrosis virus (CyHV-2) infection: Case studies from commercial goldfish farms [J]. Journal of Fish Diseases, 2009, 32(3): 271−278. DOI: 10.1111/j.1365-2761.2008.00988.x
[4] HEDRICK R P, GILAD O, YUN S, et al. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp [J]. Journal of Aquatic Animal Health, 2000, 12(1): 44−57. DOI: 10.1577/1548-8667(2000)012<0044:AHAWMM>2.0.CO;2
[5] AOKI T, HIRONO I, KUROKAWA K, et al. Genome sequences of three koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide [J]. Journal of Virology, 2007, 81(10): 5058−5065. DOI: 10.1128/JVI.00146-07
[6] BECKER J A, TWEEDIE A, RIMMER A, et al. Incursions of Cyprinid herpesvirus 2 in goldfish populations in Australia despite quarantine practices [J]. Aquaculture, 2014, 432: 53−59. DOI: 10.1016/j.aquaculture.2014.04.020
[7] 李莉娟, 罗杨志, 刘学芹, 等. 金鱼鲤疱疹病毒Ⅱ型的分子诊断 [J]. 华中农业大学学报, 2013, 32(1):92−96. DOI: 10.3969/j.issn.1000-2421.2013.01.018 LI L J, LUO Y Z, LIU X Q, et al. Molecular surveillance of Cyprinid herpesvirus 2 in goldfish cultured in China [J]. Journal of Huazhong Agricultural University, 2013, 32(1): 92−96.(in Chinese) DOI: 10.3969/j.issn.1000-2421.2013.01.018
[8] XU J R, BENTLY J, BECK L, et al. Analysis of koi herpesvirus latency in wild common carp and ornamental koi in Oregon, USA [J]. Journal of Virological Methods, 2013, 187(2): 372−379. DOI: 10.1016/j.jviromet.2012.11.015
[9] GOODWIN A E, KHOO L, LAPATRA S E, et al. Goldfish hematopoietic necrosis herpesvirus (cyprinid herpesvirus 2) in the USA: Molecular confirmation of isolates from diseased fish [J]. Journal of Aquatic Animal Health, 2006, 18(1): 11−18. DOI: 10.1577/H05-007.1
[10] WALTZEK T B, KUROBE T, GOODWIN A E, et al. Development of a polymerase chain reaction assay to detect cyprinid herpesvirus 2 in goldfish [J]. Journal of Aquatic Animal Health, 2009, 21(1): 60−67. DOI: 10.1577/H08-045.1
[11] BERCOVIER H, FISHMAN Y, NAHARY R, et al. Cloning of the koi herpesvirus (KHV) gene encoding thymidine kinase and its use for a highly sensitive PCR based diagnosis [J]. BMC Microbiology, 2005, 5: 13. DOI: 10.1186/1471-2180-5-13
[12] 张文, 徐立蒲, 吕晓楠, 等. 鲤浮肿病毒和锦鲤疱疹病毒三重PCR检测方法的建立及初步应用 [J]. 检验检疫学刊, 2019, 29(1):1−5. ZHANG W, XU L P, LV X N, et al. Establishment and preliminary application of triplex PCR detection method for carp edema virus and koi herpesvirus [J]. Journal of Inspection and Quarantine, 2019, 29(1): 1−5.(in Chinese)
[13] 徐晔, 段宏安, 周毅, 等. 鲤科疱疹病毒2型TaqMan荧光定量PCR检测方法的建立 [J]. 中国预防兽医学报, 2014, 36(12):952−956. DOI: 10.3969/j.issn.1008-0589.2014.12.09 XU Y, DUAN H A, ZHOU Y, et al. Establishment of real-time PCR assay for detection of Cyprinid herpesvirus 2 [J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(12): 952−956.(in Chinese) DOI: 10.3969/j.issn.1008-0589.2014.12.09
[14] 彭军辉, 安伟, 张明辉. 鲤疱疹病毒2型和3型三重PCR检测方法的建立与应用 [J]. 渔业科学进展, 2021, 42(6):158−164. DOI: 10.19663/j.issn2095-9869.20201124002 PENG J H, AN W, ZHANG M H. Establishment and application of the triplex PCR method for simultaneous detection of cyprinid herpesvirus 2 and cyprinid herpesvirus 3 [J]. Progress in Fishery Sciences, 2021, 42(6): 158−164.(in Chinese) DOI: 10.19663/j.issn2095-9869.20201124002




 下载:
下载: