Codominance Functional Marker of Bacterial Blight Resistant Xa7 in Rice
-
摘要:目的 对水稻白叶枯病广谱抗性基因Xa7进行精准检测和世代跟踪,通过分子标记检测Xa7基因材料的纯合或杂合型。方法 根据Xa7、xa7和无等位基因型序列的差异,通过Premier 5软件设计了含4条引物Xa7-F、Xa7-R、Xa7null-F、Xa7null-R的功能标记Xa7fun,且采用PCR方法分别对不同遗传资源材料进行分子标记特异性检测和验证,自然高温下于孕穗期对含Xa7基因的3份杂交改良系及亲本采用剪叶接种法接种7个白叶枯病菌菌株进行抗性鉴定,并于成熟期考察记录其农艺性状。结果 分子标记特异性检测结果表明,Xa7基因纯合型材料R084可扩增出大小为91 bp的条带,无等位基因型材料Nip可扩增出大小为153 bp的条带,杂合体Nip/R084可扩增出大小为91 bp、153 bp的条带,共显性标记Xa7fun得到的电泳条带与引物设计时预测的目标片段完全吻合;18份不同类型的种质资源均未扩增出91 bp大小的功能条带,说明这些材料均不含Xa7基因;杂交改良系Ry-1、Ry-2、Ry-3均仅含有91 bp大小的功能条带,表明Xa7基因纯合;在高温下,华占对7个菌株表现为高感、中感或感病,R084除对菌株PX099感病外,对其余6菌株均为高抗、中抗或抗病,Ry-1对GDA2、HNA1-4、FuJ、GD1358、YN24等5个菌株为高抗或中抗,Ry-2对GDA2、GD1358、HNA1-4、PXO86、YN24等5个菌株为高抗或抗病,Ry-3对HNA1-4、FuJ、GDA2、GD1358、PXO86、YN24 等6个菌株均为高抗或中抗。因此,Xa7基因的渗入对华占改良系Ry-1、Ry-2、Ry-3的白叶枯病抗性有大幅度的提高;通过对3个改良系和亲本等农艺性状分析表明,3个改良系的生育期、株高、穗长、单株总粒数、结实率、千粒重介于R084和华占之间,Ry-1和Ry-3单株有效穗数显著高于华占和R084,Ry-2与华占、R084差异不显著,单株产量与华占或R084相比差异不显著。结论 本研究开发的功能标记Xa7fun能够准确、高效地识别水稻Xa7基因纯合型、杂合型等,而且Xa7基因的渗入不会造成杂交改良系重要农艺性状变差,可在水稻白叶枯病抗性分子育种中推广应用。Abstract:Objective A codominance functional marker of the broad-spectrum bacterial blight resistance gene,Xa7, of rice was identified for accurate detection, generation tracking, and differentiation between homozygous and hemizygous genotypes of the gene.Methods A potential functional marker containing 4 primers was designed using Premier 5 software and based on the differences on the sequences of Xa7, xa7, and allele-free genome.The molecular distinctness of the marker in different materials was verified by PCR.Three crossbreed lines of Xa7 and their parents were inoculated with 7 bacterial blight pathogens at booting stage to examine the affected agronomic traits at maturation.Results The homozygous R084 of Xa7 could be amplified into a 91 bp band and the Nip free of allele with a 153 bp band; while the heterozygote Nip/R084, 91 bp and 153 bp bands.The candidate codominance marker, Xa7fun, amplified fragments that matched the predicted target bands.No 91 bp fragment was amplified from 18 germplasms of varied types indicating a lack of Xa7 in them.Whereas Ry1, Ry2, and Ry3 had 91 bp band suggesting the inclusion of homozygous Xa7.Under an elevated temperature, Huazhan responded to the 7 bacterial blight pathogens as highly sensitive (HS), intermediate sensitive (MS), or sensitive (S); R084 to 6 of the 7 pathogens (HNA1-4, FuJ, GDA2, GD1358, PX086, and YN24) as highly resistant (HR), intermediate resistant (MR) or resistant (R); Ry-1 to 5 pathogens (GDA2, HNA1-4, FuJ, GD1358, and YN24) as HR or MR; Ry-2 to 5 pathogens (GDA2, GD1358, HNA1-4, PXO86, and YN24) as HR or R; and Ry-3 to 6 pathogens (HNA1-4, FuJ, GDA2, GD1358, PXO86, and YN24) as HR or MR.Therefore, the infiltration of Xa7 in the crossbred and improved lines RY-1, RY-2, and RY-3 significantly accentuated the blight resistance of Huazhan.Conclusion The homozygous or hemizygous Xa7 could be accurately differentiated by the currently identified codominance functional marker Xa7fun.The Xa7 introgression did not significantly alter the critical agronomic traits in the hybridization from generation to generation and could be safely applied in breeding bacterial leaf blight resistant rice varieties.
-
Keywords:
- Rice /
- bacterial blight /
- Xa7 gene /
- molecular maker /
- resistance
-
0. 引言
【研究意义】水稻(Oryza sativa L.)是全球近半数人口的主要粮食作物,是我国仅次于玉米的主要口粮,且广泛分布于六大稻区[1]。水稻种植生产一直受到多种病害的影响,由革兰氏阴性菌稻黄单胞菌(Xanthomonas oryzae pv. oryzae,Xoo)引起的白叶枯病是一种世界性的细菌病害,特别是中国、日本和印度等亚洲地区发病较为严重,中国长江以南稻区是水稻白叶枯病的病害流行高发区,发生范围广、流行速度快、危害大、突变性高,发病稻田一般造成20%~40%的产量损失,重者损失更高或绝收[2-5]。长期实践证明化学农药虽可以有效控制白叶枯病的发生,但因为该病是一种细菌性维管束病害,农药不能直接接触病灶,导致防治效果不佳、增加种植成本,造成环境污染,破坏生态平衡[6, 7]。因此,利用抗性(R)基因选育具有遗传抗性的水稻品种是防治白叶枯病最经济、有效、环保的方法[8, 9]。【前人研究进展】截至目前,至少已有47个白叶枯病抗性基因被研究报道[10, 11],Xa1、Xa2、Xa14、Xa31(t)、Xa45(t)、Xa3/Xa26、Xa4、xa5、Xa7、Xa10、xa13、Xa21、Xa23、xa25、Xa27和xa41(t)等16个基因已被克隆,为培育抗病品种提供了广泛的遗传资源[6, 11]。其中Xa7是位于水稻6号染色体的显性R基因,表现为成株期抗性,具有抗性广谱性和持久性,而且在高温环境下,Xa7基因受诱导产生防卫反应阻止病菌入侵的表现更为突出[11, 12]。自20世纪70年代从孟加拉国籼稻品种DV85中鉴定出Xa7基因以来,它一直备受关注、应用或研究[13-19]。直到2021年,Chen等[11]才成功地从水稻品种R084(镇恢084)中克隆出了该基因。研究表明由无毒基因AvrXa7编码的TALE AvrXa7在水稻中引发Xa7基因的抗性,AvrXa7基因在各种白叶枯病菌株中均有发现,赋予了Xa7基因广谱抗病的特点,对来自中国和日本的52种不同的白叶枯病菌株表现出抗性,并且在高温下诱导更快、更高[11, 14]。在Xa7基因克隆之前,很多与Xa7基因连锁标记被开发用于水稻白叶枯病抗性育种,如连锁标记G1091(与Xa7的遗传距离为6.0 cM)、AFLP- 31-10 (3 cM)、STSP3(0.9 cM)、M3(0.5 cM)、M4(1.8 cM)、M5(0.5 cM)、GDSSR02~RM20593(0.21 cM)、RM20582(0.14 cM)以及荧光分子标记PM-Xa7等[15-19]。研究表明,连锁标记与目的基因之间可能发生重组交换,因假阳性导致目的基因丢失,而目的基因自身的功能标记与其完全耦合,避免了连锁标记存在的遗传冗余和重组问题,提高了MAS选择的效率和准确性[1, 20]。2021年Xa7基因被克隆后,Liu等[21]设计了与Xa7基因紧密连锁的共显性标记M6和根据Xa7基因启动子区及CDS区序列设计的功能显性标记MX7,M6用于低世代Xa7和xa7基因的检测跟踪,可有效区分Xa7或xa7基因的纯合或杂合型,MX7用于高世代Xa7和xa7基因型的区分。【本研究切入点】因MX7为显性标记,检测低世代材料时无法确认Xa7或xa7杂合或纯合型,M6虽可直接辨认纯杂合,但无法区分Xa7或xa7基因型,而且为连锁标记。关于利用1套功能标记直接检测Xa7基因的杂合或纯合型的研究还有待深入探讨。【拟解决的关键问题】本研究根据Xa7和xa7基因的DNA序列差异在启动子区设计了1对引物的功能标记,用于区分Xa7或xa7基因型,在距离Xa7基因下游大约202 kb设计了1对引物的连锁标记,用于区分Xa7/xa7基因型和非等位基因型,4条引物在1个PCR管同时进行,通过单次PCR扩增就可将Xa7或xa7基因纯合型、杂合型或无等位基因型有效区分,并且用于辨认Xa7和xa7基因的电泳条带为功能条带,以期开发为水稻白叶枯病抗性育种材料的MAS选育提供技术支持的功能标记。
1. 材料与方法
1.1 供试材料
功能标记验证材料:Xa7基因供体R084(镇恢084),日本晴(Nip),Nip(母本)/R084(父本) F1材料;不同水稻种质资源验证材料:18份水稻种质资源(6份粳稻、4份籼型野败保持系、8份籼稻);以R084为供体通过杂交、复交等选育的2个F3品系Y629、Y192;高世代杂交选育及抗性鉴定材料:含Xa7基因改造品系Ry1、Ry2和Ry3,来源于华占(母本)//华占/R084(父本) BC1F8代的3个株系,受体材料华占,供体材料R084。上述材料均为常德市农林科学院水稻研究所保存或选育。试验于2021年在常德市农林科学院水稻育种基地进行。
1.2 Xa7fun功能标记的设计与合成
利用Xa7基因连锁标记M5对华占//华占/R084的杂交和回交后代逐代检测Xa7基因,M5正、反向引物分别为(5′-3′):CGATCTTACTGGCTCTGCAACTCTGT和GCATGTCTGTGTCGATTCGTCCGTACGA[15]。根据水稻品种R084中Xa7基因和laozaogu中xa7基因序列的差异[11, 21],通过Premier 5软件设计了2条引物,分别为Xa7-F、Xa7-R;根据R084中距离Xa7基因约202464 bp处和日本晴序列比对1段DNA序列的缺失,通过Premier 5软件设计了2条引物,分别为Xa7null-R、Xa7null-F;由4条引物设计的新的功能标记定名为Xa7fun(表1)。引物由北京擎科新业生物技术有限公司合成。
表 1 Xa7fun标记引物序列Table 1. Sequences of Xa7fun primers引物名称
Primer name引物序列
Primer sequence(5′-3′)碱基数
Base number/bpXa7-R GCTCTTCAAGTGTGCGATGC 20 Xa7-F AGCCCTGACTGCTAAAACCA 20 Xa7null-R GTACATCATTGTCCCCACGG 20 Xa7null-F AACCGAGGGAGGTGATTTGC 20 1.3 Xa7fun功能标记的验证
在水稻分蘖期取供试材料的单株叶片,采用CTAB法提取DNA。PCR扩增体系(10 μL)对检测材料目的DNA片段进行扩增,体系组成:2×Rapid Taq Master Mix 5 μL,100 μmol·L−1引物0.1 μL(Xa7fun的4条引物等量混合,M5的 2条引物等量混合),DNA模板1 μL,ddH2O 3.9 μL。Xa7fun反应程序:94 ℃预变性5 min;94 ℃变性30 s,56~63 ℃退火15 s,进行最适退火温度探索,经检测确定最适退火温度为59.0~61.0 ℃,72 ℃延伸15 s,30个循环;72 ℃延伸1 min。PCR扩增产物用3.0%琼脂糖凝胶电泳检测。同时,利用设计的Xa7fun功能标记对不同来源的6份粳稻、4份籼型野败保持系、8份籼稻、改良品系Y629和Y192等种质资源进行验证;对Xa7基因高世代杂交后代品系Ry-1、Ry-2、Ry-3分别利用Xa7基因连锁标记M5和功能标记Xa7fun进行电泳条带的特异性检测验证。
1.4 Xa7基因高世代杂交后代品系白叶枯病抗性鉴定
接种品系Ry1、Ry2、Ry3、华占和R084于5月15日播种,6月13日人工单本移栽,株行距为16.5 cm×26.4 cm,各品系栽插100株。按常规栽培方式进行田间管理。
本试验由湖南省植保所稻瘟病鉴定中心提供用于接种鉴定的白叶枯病菌株7个,分别为FuJ、YN24、HNA1-4、GDA2、PXO86、PXO99、GD1358,其中PXO86、PXO99分别为菲律宾2、6号小种,其他为我国南方稻区代表性菌株[22]。试验采用剪叶接种的方法进行鉴定[5, 22],3次重复,即孕穗期用7株白叶枯病菌株接种金刚30(感病对照)、R084、华占、Ry1、Ry2和Ry3,每菌株每个材料接种3株,每株植株接种5片叶片,接种21 d后,当接种材料的病情趋于稳定时,量取病斑长度,调查发病情况,鉴定供试植株的抗病性。同时用ZDR-20型温湿度连续记录仪记载发病期间田间自然温度。
1.5 Xa7基因渗入高世代杂交后代农艺性状的调查
记载R084、华占、Ry1、Ry2和Ry3始穗期,计算播始历期。成熟后R084、华占、Ry1、Ry2和Ry3中间行连续量取5株植株株高,每品系中间行连续取3株混合后统计农艺性状,分别求取单株穗长、单株有效穗数、单株总粒数、单株实粒数、千粒重和单株产量,计算结实率,3次重复。
1.6 数据处理
分析供试材料不同单株和不同菌株病斑长度数据,根据感病对照材料金刚30的发病情况和等级,分析7种白叶枯病菌对不同水稻品系的致病能力,按照抗性分级标准进行抗感分级。抗性分级标准[5]:平均病斑长度小于1 cm为高抗(HR),1.1~3.0 cm为抗(R),3.1~5.0 cm为中抗(MR),5.1~12.0 cm为中感(MS),12.1~20.0 cm 为感(S),大于20.1 cm高感(HS)。
利用Microsoft Excel 2020进行数据统计,采用DPS 15.10对各材料的农艺性状进行差异显著性分析。
2. 结果与分析
2.1 Xa7基因共显性功能标记的设计和开发
基于已克隆Xa7(R084)和xa7(Laozaogu)基因组序列[11, 21],Xa7基因在EBEAvrXa7中一个由11 bp碱基插入和SNP碱基替换(G→T)组成的变异,导致了Xa7抗性的丧失,即为xa7基因,而无等位基因型的日本晴Nip缺失Xa7或xa7基因的CDS及启动子区。因此,在Xa7基因启动子上游设计了正向引物Xa7-F,下游设计了负向引物Xa7-R,依据图1-A引物设计策略含Xa7基因的R084可以扩增出91 bp的条带,含xa7基因的Laozaogu可以扩增出102 bp的条带,无等位基因型的Nip扩增不出条带。利用GenBank对R084和Nip进行序列比对,在距离Xa7基因启动子区约202 444 bp处R084有133 bp的碱基缺失,设计了1对引物用于区分R084和Nip,正向引物为Xa7nullf,负向引物为Xa7nullr,依据图1-B引物设计策略不含Xa7或xa7基因的Nip可以扩增出153 bp的条带,含Xa7基因的R084扩增不出条带。由此可见,依据4条引物设计策略,含Xa7基因的R084只可以扩增出91 bp的条带,含xa7基因的Laozaogu 只可以扩增出102 bp的条带,无等位基因Xa7或xa7的Nip(Xa7null)可扩增出153 bp的条带,而基因类型为Xa7/Xa7null杂合体可以扩增出91 bp和153 bp的2个条带,基因类型为xa7/Xa7null杂合体可以扩增出102 bp和153 bp的2个条带。因此,本标记通过1次PCR就能鉴定出Xa7基因纯合、杂合和无等位基因类型,可以提高Xa7基因聚合育种或品种改良的效率。
2.2 Xa7fun功能标记的验证
2.2.1 Xa7fun功能标记条带大小的验证
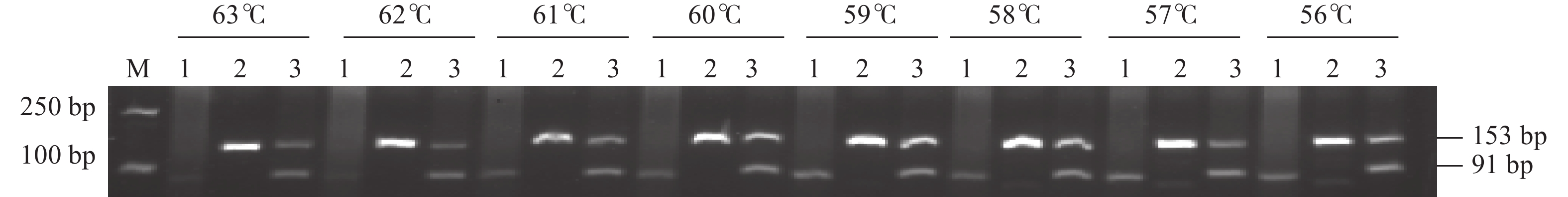
研究结果表明(图2),退火温度在56.0~63.0 ℃时,Nip和Nip/R084利用引物Xa7null-R/Xa7null-F均能扩增出153 bp的条带,Nip/R084利用引物Xa7-F/Xa7-R均可扩增出91 bp的条带;而R084利用引物Xa7null-R/Xa7null-F扩增不出条带,利用引物Xa7-F/Xa7-R在56.0~61.0 ℃均可扩增出91 bp的条带,而在62.0和63 ℃时条带较淡,扩增效率较低。因此,Xa7fun功能标记在退火温度为59.0~61.0 ℃时扩增效率最佳。因为本试验中无含有xa7基因的感病材料,故而xa7基因特有的102 bp的条带序列无法得到验证,但不影响抗性基因Xa7的鉴定。根据Xa7fun 4引物PCR和琼脂糖电泳结果可知,含Xa7基因纯合的R084扩增出了91 bp的条带,不含Xa7基因的Nip扩增出了153 bp的条带,杂合体Nip/R084扩增出了91和153 bp的条带。共显性标记与引物设计时预测的目标片段大小吻合。
2.2.2 利用Xa7fun标记对不同水稻种质资源的验证
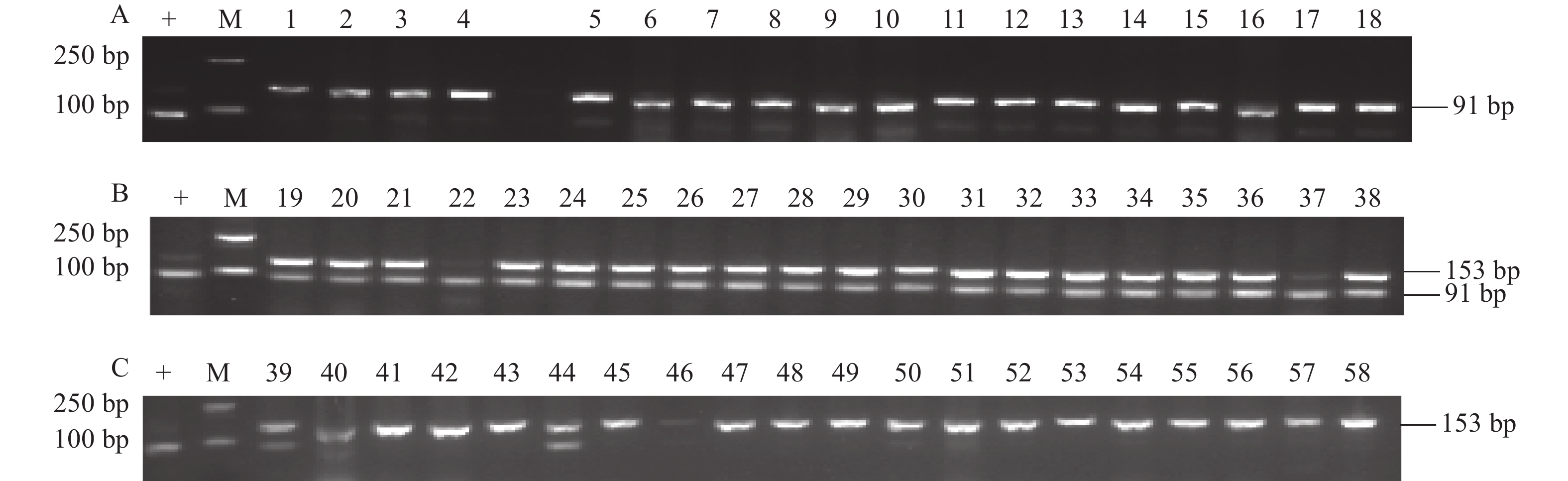
为了验证利用Xa7fun功能标记检测Xa7基因在不同水稻种质资源的分布情况,利用该标记对不同来源的6份粳稻、4份籼型野败保持系、8份籼稻种质资源进行PCR扩增和电泳检测。由图3-A可知,18份不同类型的种质资源均不能扩增出91 bp的功能条带,说明这些材料均不含Xa7基因。前人利用Xa7序列对3010份水稻品种的遗传多样性进行分析,虽然发现来自籼稻和aus亚群的493个品种含有和Xa7/xa7相同的CDS,但其中仅有27个品种在Xa7基因启动子区和R084相同,为Xa7基因型,而且对白叶枯病菌株PXO86均有抗性,表明含抗性Xa7基因的材料不多[11, 23]。引物Xa7null-R/Xa7null-F扩增18份种质资源的非功能条带显示出不同的多态性,表明在距离Xa7基因启动子区约202 kb处不同的水稻材料DNA序列有差异,但此连锁标记不影响Xa7基因功能条带的鉴定。同时,为了进一步验证Xa7fun功能标记在低世代杂交改良系中基因的分型情况,对以R084为供体通过杂交、复交等选育的2个F3品系随机抽取20个单株进行PCR扩增和电泳检测。结果表明,Y629编号为22、37的2个单株为Xa7基因纯合型,其余18个单株均为Xa7基因杂合型(图3-B);Y192编号为39和44的2单株为Xa7基因杂合型,其余18个单株为无等位基因型(图3-C)。综上所述,Xa7fun功能标记对不同水稻种质资源和杂交改良系的Xa7基因的纯、杂合分型可以有效区分。
![]() 图 3 Xa7fun功能标记对部分水稻品种的分子检测A中,M:DNA marker(DL2000),+:R084,1~18对应水稻材料为长粒香、吉粳88、中花11、越光、绥粳4号、昆明小白谷、金23B、野香B、中浙2B、荃9311B、华占、农香39、五山丝苗、广恢390、R900、望恢006、黄华占、湘早籼45号。B中19~38为Y629的20个单株,C中39~58为Y192对应20个单株。Figure 3. Molecular detection of Xa7fun in different rice varietiesIn A, M: DNA marker(DL 2000), 1–18: Changlixiang, Jijing 88, Zhonghua 11, Yueguang, Suijing 4, Kunmingxiaobaigu, Jin 23B, Yexiang B, Zhongzhe 2B, Quan 9311B, Huazhan, Nongxiang 39, Wushansimiao, Guanghui 390, R900, Wanghui 006, Huanghuazhan, and Xiangzaoxian 45, respectively (A); 19-38: 20 individual plants of Y629 (B); 39-58: 20 individual plants of Y192 (C).
图 3 Xa7fun功能标记对部分水稻品种的分子检测A中,M:DNA marker(DL2000),+:R084,1~18对应水稻材料为长粒香、吉粳88、中花11、越光、绥粳4号、昆明小白谷、金23B、野香B、中浙2B、荃9311B、华占、农香39、五山丝苗、广恢390、R900、望恢006、黄华占、湘早籼45号。B中19~38为Y629的20个单株,C中39~58为Y192对应20个单株。Figure 3. Molecular detection of Xa7fun in different rice varietiesIn A, M: DNA marker(DL 2000), 1–18: Changlixiang, Jijing 88, Zhonghua 11, Yueguang, Suijing 4, Kunmingxiaobaigu, Jin 23B, Yexiang B, Zhongzhe 2B, Quan 9311B, Huazhan, Nongxiang 39, Wushansimiao, Guanghui 390, R900, Wanghui 006, Huanghuazhan, and Xiangzaoxian 45, respectively (A); 19-38: 20 individual plants of Y629 (B); 39-58: 20 individual plants of Y192 (C).2.2.3 利用Xa7fun功能标记检测Xa7基因高世代杂交后代品系
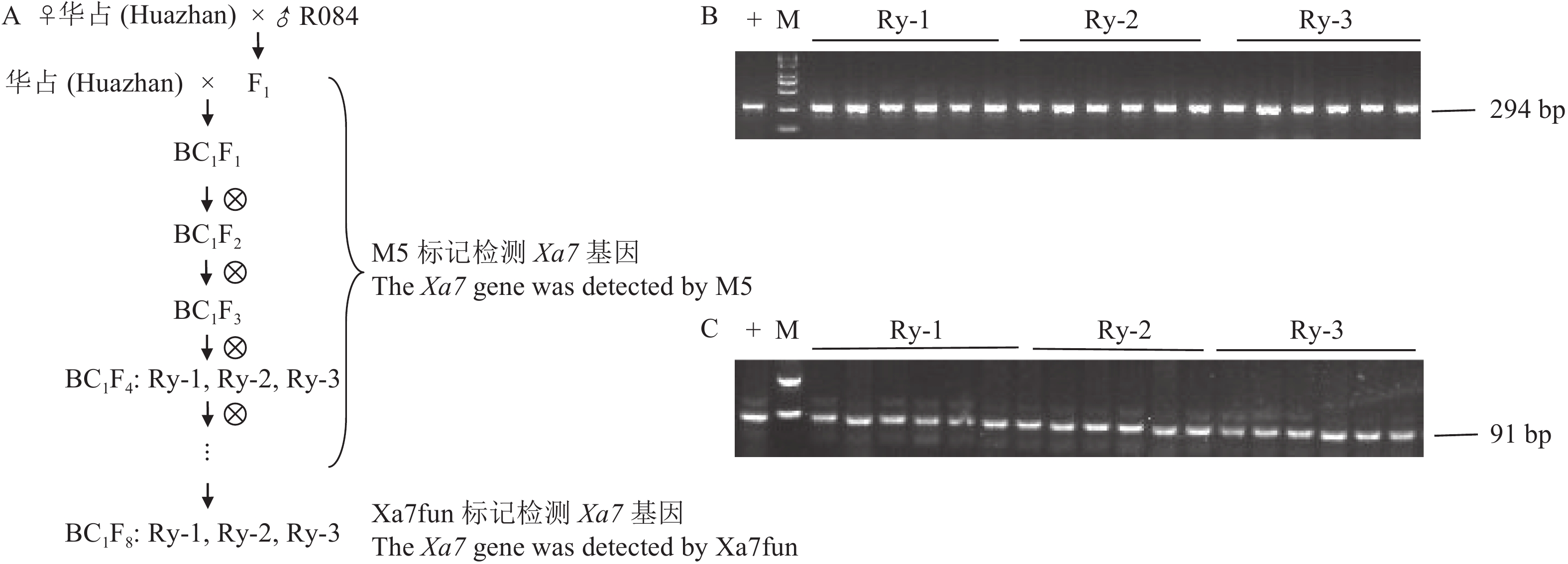
利用Xa7基因连锁标记M5对华占//华占/R084的杂交和回交后代逐代检测,从BC1F3代开始选含Xa7基因纯合且农艺性状较好的单株收种加代,直到BC1F4代保留其中3个株系,分别命名为Ry-1、Ry-2、Ry-3(图4-A)。2021年利用M5分别检测Ry-1、Ry-2、Ry-3的任意6个单株,均含有Xa7基因且纯合(图4-B),同时利用设计好的共显性功能标记Xa7fun分别检测Ry-1、Ry-2、Ry-3对应的6个单株,均仅含有91 bp的功能条带(图4-C),表明Xa7基因纯合,和利用M5检测结果一致。
![]() 图 4 含Xa7基因高世代杂交后代的选育和分子检测M:DNA marker(DL2000),+:R084。A为Ry-1、Ry-2、Ry-3选育图,B为连锁标记M5检测结果,C为共显性功能标记Xa7fun检测结果。Figure 4. Breeding of filial generations and molecule detection of Xa7M:DNA marker(DL2000), +:R084. A: Breeding diagrams on Ry-1, Ry-2, and Ry-3; B: detection of linkage marker M5; C: detection of codominance functional marker Xa7fun.
图 4 含Xa7基因高世代杂交后代的选育和分子检测M:DNA marker(DL2000),+:R084。A为Ry-1、Ry-2、Ry-3选育图,B为连锁标记M5检测结果,C为共显性功能标记Xa7fun检测结果。Figure 4. Breeding of filial generations and molecule detection of Xa7M:DNA marker(DL2000), +:R084. A: Breeding diagrams on Ry-1, Ry-2, and Ry-3; B: detection of linkage marker M5; C: detection of codominance functional marker Xa7fun.2.3 Xa7基因高世代杂交后代品系白叶枯病抗性鉴定
利用7个白叶枯病菌株分别接种均进入孕穗期(7月23日)的Ry-1、Ry-2、Ry-3、R084和华占,接种21 d后量取供试材料病斑长度。ZDR-20型温湿度连续记录仪显示期间日最高温度为31~39 ℃,平均为34.5 ℃,其中12 d超过35 ℃,日平均温度为29.5~35.7 ℃,其中19 d超过30 ℃(图5)。因此,白叶枯病接种和诱发期间受高温胁迫时间较长。
白叶枯病抗性鉴定结果表明Ry-1对菌株GDA2、HNA1-4为高抗(HR),对菌株FuJ、GD1358、YN24为中抗(MR),对菌株PXO86、PXO99分别为中感(MS)和感病(S);Ry-2对菌株GDA2、GD1358、HNA1-4为高抗,对菌株PX086、YN24为中抗,对菌株FuJ、PXO99分别为中感和感病;Ry-3对菌株HNA1-4为高抗,对菌株FuJ、GDA2、GD1358、PXO86、YN24均为中抗,仅对PXO99为感病;而受体亲本华占对7种菌株表现为高感、中感或感病,Xa7基因供体亲本R084除对菌株PXO99感病外,对其余6菌株均为高抗、中抗或抗病(表2)。以上结果表明,Xa7基因的渗入对华占改良系Ry-1、Ry-2、Ry-3的白叶枯病抗性有大幅度的提高,其中Ry-3的白叶枯病抗性最好。但含Xa7基因的Ry-1、Ry-2、Ry-3和R084对菌株PX099均为感病,表明Xa7基因对菌株PXO99无抗性,和前人的研究相印证[11, 21, 24]。
表 2 含Xa7基因高世代杂交后代对7种白叶枯病菌株的抗性Table 2. The filial generations of Xa7 gene to 7 bacterial leaf blight strains品系 Lines FuJ GDA2 GD1358 HNA1-4 PXO86 PXO99 YN24 病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
ResistanceRy-1 3.7 MR 0.5 HR 5 MR 0.9 HR 10.2 MS 13.7 S 3.6 MR Ry-2 5.9 MS 0.4 HR 0.5 HR 0.5 HR 4.7 MR 16.3 S 4.1 MR Ry-3 3.5 MR 4.8 MR 4.5 MR 0.7 HR 4.9 MR 15.2 S 4.9 MR R084 2.1 R 0.2 HR 0.2 HR 0.3 HR 4.1 MR 15.3 S 1.7 R 华占
Huazhan24.6 HS 26.6 HS 12 MS 10.8 MS 8.9 MS 9.7 MS 19 S 2.4 Xa7基因渗入对高世代杂交后代农艺性状的影响
为了进一步研究Xa7基因的渗入对水稻农艺性状的影响,本研究对3个改良系、华占、R084的农艺性状进行了分析。结果(表3)表明,Ry-1、Ry-2和华占生育期相同,Ry-3生育期长于华占但短于R084;3个改良系株高极显著高于华占(P < 0.01,下同),Ry-1和Ry-2显著低于R084(P < 0.05,下同),Ry-3和R084差异不显著;Ry-1和Ry-3单株有效穗数显著高于华占和R084,Ry-2与华占、R084差异不显著;3个改良系穗长极显著低于华占,但显著(Ry-1)或极显著(Ry-2、Ry-3)高于R084;单株总粒数介于R084和华占之间,其中Ry-3显著低于华占,和R084差异不显著,Ry-1和Ry-2与华占无显著性差异,但分别显著或极显著高于R084。前人研究表明,25~30 ℃为水稻抽穗开花期的最适温度,在日平均温度达到32 ℃以上或日最高温度达到35 ℃以上时就会对开花受精造成极为不利的影响,导致开花授粉不能正常进行而产生大量空壳,但品种间具有很大差异,在高温条件下水稻若仍能保持较高的结实率,说明其对高温的适应性强[25, 26]。本研究供试品系在7月27日至8月8日均完成了抽穗扬花,温度记录显示期间日最高温度在35.0~39.0 ℃,日平均温度在32.0~35.7 ℃(图5),表明供试品系抽穗扬花期均受到了自然高温胁迫,而含Xa7基因的3个改良系结实率均极显著高于华占,而与R084无显著性差异,Xa7基因除了在高温下对白叶枯病抗性更强外,可能还可以增强水稻材料的抽穗期耐热性,提高结实率,但需进一步验证;3个改良系的千粒重变化不一致,其中Ry-3极显著高于Ry-1、Ry-2和华占,但Ry-1、Ry-2分别极显著低于R084,Ry-3和R084间无显著性差异;3个改良系的单株产量与华占、R084间均无显著性差异。综上所述,3个改良系的生育期、株高、穗长、单株总粒数、结实率、千粒重等介于R084和华占之间,单株产量与华占或R084相比均不显著,表明Xa7基因的渗入不会造成水稻材料重要农艺性状变差,具有很好的应用前景。
表 3 Xa7基因对高世代杂交后代农艺性状的影响Table 3. Effects of Xa7 on agronomic traits of filial generation hybrids品系
Lines播始历期
Days to flower/d株高
Plant height/cm单株有效穗数
Panicles per plant穗长
Panicle length/cm单株总粒数
Grains per plan结实率
Seed set/%千粒重
1000-grain weight/g单株产量
Yield per plant/gRy-1 73 117.3±2.08 Bc 15.5 ±1.00 Aa 22.2±0.05 BCb 1820.3±108.55 ABCbc 90.7±0.28 Aa 22.6±0.34 Bb 37.3±2.70 Aa Ry-2 73 119.3±2.52 ABbc 11.3 ±0.58 Bb 22.8±0.72 Bb 2336.0±321.38 Aa 89.1±0.79Aa 21.5±0.28 Bb 39.6±0.68 Aa Ry-3 77 123.0±2.65 Aab 15.3 ±0.50 Aa 23.0±0.15 Bb 1675.3±264.06 BCcd 90.2±0.40Aa 27.5±1.32 Aa 41.8±6.95 Aa R084 79 124.7±1.53 Aa 11.0 ±1.41 Bb 21.2±0.54 Cc 1312.3±128.39 Cd 90.0±1.63Aa 27.8±1.76 Aa 38.4±1.58 Aa 华占
Huazhan73 98.2±1.30 Cd 13.0 ±2.45 ABb 26.0±0.50 Aa 2208.0±146.08 ABab 84.2±1.05 Bb 20.1±0.28 Bb 39.7±1.37 Aa 不同大、小写字母分别表示同一品种在不同氮素水平下差异极显著(P<0.01)或显著(P<0.05)。
Data with different uppercase letters represent extremely significant differences (P<0.01); those with different lowercase letters, significant differences (P<0.05).3. 讨论和结论
前人利用与Xa7基因紧密连锁的共显性标记M6进行低世代改良系Xa7及xa7基因与无等位基因型纯杂合的鉴别,或Xa7及xa7基因型纯合体的选择,但M6标记无法区分Xa7和xa7基因型,Xa7和xa7基因型是通过显性功能标记MX7区分的,但MX7对于Xa7与无等位基因型的纯或杂合型材料无法分辨。因此,利用2套标记M6和MX7分别PCR才可准确选育出Xa7基因纯合改良系[21]。本研究基于Xa7基因连锁标记M6和功能标记MX7的综合开发策略,设计的功能标记Xa7fun可用于鉴定Xa7基因型的功能引物,也可用于鉴定不含等位基因型的连锁引物。利用功能引物通过电泳得到的条带为Xa7基因91 bp的功能条带,检测效率高、结果准确,避免了连锁标记与目的基因之间可能发生重组交换导致的目的基因丢失而造成的假阳性;连锁引物的条带类型为距离Xa7基因约202 kb的连锁标记,无等位基因型的日本晴(Nip)可扩增出153 bp的条带,Nip/R084杂合F1可扩增出91 bp、153 bp的条带,因此主要用于鉴定非等位基因型和Xa7基因杂合型。Xa7fun在1套标记里同时融合了功能标记和连锁标记,对杂交每个世代单次PCR即可有效区分Xa7基因纯合或杂合型,使选育工作更加高效和实用。
本试验中由于缺乏xa7基因的供体材料,因此Xa7fun标记在PCR时未对xa7基因型进行验证,但含xa7基因型材料一般用于Xa7及xa7基因的克隆或功能研究,以及Xa7和xa7功能标记的设计与验证等[11, 21]。利用MAS对目标基因进行聚合时,供体和受体的背景选择较重要,往往是通过2个具有优良性状的材料杂交聚合进一步选择性状互补的杂交改良后代,因此感病隐性基因xa7对品种改良无聚合意义。R084具有白叶枯病广谱抗性基因Xa7,而且农艺性状良,本研究利用优质广推恢复系华占为受体和抗白叶枯病材料R084为供体通过杂交、回交及MAS选育的Ry-1、Ry-2、Ry-3,白叶枯病抗性较受体亲本华占有大幅度的提高,重要农艺性状介于或高于华占和R084,兼具了华占和R084的优势。
研究表明含Xa7基因的R084和Zhe-kang 1等对菲律宾白叶枯病菌生理小种PX099无抗性[11, 21, 24]。本研究表明,含Xa7基因的3个杂交改良系Ry-1、Ry-2、Ry-3和R084对菌株PXO99均无抗性,和前人的研究相印证。此外,可能来自受体亲本华占某些基因的表达或调控等对Xa7基因的抗性有影响,导致Ry-1对菌株PXO86、Ry-2对菌株FuJ均无抗性,因此杂交改良系所有后代抗普并非如供体材料具有同样的抗性,和材料背景关系较大,需要在杂交后代多品系中做进一步筛选。如Xa23基因具有抗谱广、抗性强、完全显性和全生育期抗病等特点,其杂交改良系并非全部抗病,均需通过接种白叶枯病菌株作进一步抗性筛选[27-30]。目前广泛应用的Xa21基因虽然抗性强,但对我国浙江、云南等地及韩国96%的白叶枯病菌菌株无抗性,对菌株FuJ所诱发的白叶枯病基本无抗病能力[5, 14, 31, 32]。因此,在全球气温变暖的大背景下,成株期抗性且高温能增强抗性的Xa7基因与全生育期抗性基因Xa23、Xa21 的3个显性基因的聚合对我国南方稻区白叶枯病抗性育种具有重大意义。笔者认为常规稻的选育可聚合其中2个(Xa7+Xa23或Xa7+Xa21)或3个(Xa7+Xa23+Xa21)基因,但过多基因的聚合提高了选育难度或材料稳定的时间,而杂交稻的选育可以根据杂种F1的特点父母本分别渗入不同的抗性基因,进而选育杂交稻父母本白叶枯病抗性基因互补的新组合。关于Xa7基因和其他白叶枯病抗性基因的聚合育种,前人进行大量的研究,且聚合后抗性效果良好。Huang等[32]利用MAS法将Xa7、Xa21、Xa22 和Xa23等4个基因聚合到杂交水稻恢复系华恢1035中,后代材料对我国的11个白叶枯病代表菌系表现出不同程度的抗性;刘峰等[14]研究表明,携带Xa7和Xa23基因的白香占对Ⅳ型病菌达到高抗,而仅携带Xa7的IRBB7对Ⅳ型病菌为抗,携带Xa23的新黄占、聚合占和H120-2-9对Ⅳ型病菌为抗,其他携带Xa23的鹏稻2号等28个资源对Ⅳ型病菌均为中抗,因此Xa7和Xa23基因聚合到同一水稻材料后,提高了该材料对Ⅳ型菌的抗性等级;兰艳荣等[24]育成的含Xa21基因的2个株系抗PXO61、PXO99、ZHE173和GD1358等4个菌株,但不抗FuJ和YN24菌株,含Xa7基因的2个株系抗PXO61、ZHE173、GD1358、FuJ和YN24等5个菌株,但不抗PXO99菌株,同时含Xa21和Xa7基因的3个株系抗全部6个菌株。因此,不同抗性基因之间的相互作用以及抗性互补可以拓宽抗谱、增强抗性水平,而且拓宽抗谱还可以进一步增加抗性持久性。
-
图 3 Xa7fun功能标记对部分水稻品种的分子检测
A中,M:DNA marker(DL2000),+:R084,1~18对应水稻材料为长粒香、吉粳88、中花11、越光、绥粳4号、昆明小白谷、金23B、野香B、中浙2B、荃9311B、华占、农香39、五山丝苗、广恢390、R900、望恢006、黄华占、湘早籼45号。B中19~38为Y629的20个单株,C中39~58为Y192对应20个单株。
Figure 3. Molecular detection of Xa7fun in different rice varieties
In A, M: DNA marker(DL 2000), 1–18: Changlixiang, Jijing 88, Zhonghua 11, Yueguang, Suijing 4, Kunmingxiaobaigu, Jin 23B, Yexiang B, Zhongzhe 2B, Quan 9311B, Huazhan, Nongxiang 39, Wushansimiao, Guanghui 390, R900, Wanghui 006, Huanghuazhan, and Xiangzaoxian 45, respectively (A); 19-38: 20 individual plants of Y629 (B); 39-58: 20 individual plants of Y192 (C).
图 4 含Xa7基因高世代杂交后代的选育和分子检测
M:DNA marker(DL2000),+:R084。A为Ry-1、Ry-2、Ry-3选育图,B为连锁标记M5检测结果,C为共显性功能标记Xa7fun检测结果。
Figure 4. Breeding of filial generations and molecule detection of Xa7
M:DNA marker(DL2000), +:R084. A: Breeding diagrams on Ry-1, Ry-2, and Ry-3; B: detection of linkage marker M5; C: detection of codominance functional marker Xa7fun.
表 1 Xa7fun标记引物序列
Table 1 Sequences of Xa7fun primers
引物名称
Primer name引物序列
Primer sequence(5′-3′)碱基数
Base number/bpXa7-R GCTCTTCAAGTGTGCGATGC 20 Xa7-F AGCCCTGACTGCTAAAACCA 20 Xa7null-R GTACATCATTGTCCCCACGG 20 Xa7null-F AACCGAGGGAGGTGATTTGC 20 表 2 含Xa7基因高世代杂交后代对7种白叶枯病菌株的抗性
Table 2 The filial generations of Xa7 gene to 7 bacterial leaf blight strains
品系 Lines FuJ GDA2 GD1358 HNA1-4 PXO86 PXO99 YN24 病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
Resistance病斑长度
Lesion
length/
cm抗性
ResistanceRy-1 3.7 MR 0.5 HR 5 MR 0.9 HR 10.2 MS 13.7 S 3.6 MR Ry-2 5.9 MS 0.4 HR 0.5 HR 0.5 HR 4.7 MR 16.3 S 4.1 MR Ry-3 3.5 MR 4.8 MR 4.5 MR 0.7 HR 4.9 MR 15.2 S 4.9 MR R084 2.1 R 0.2 HR 0.2 HR 0.3 HR 4.1 MR 15.3 S 1.7 R 华占
Huazhan24.6 HS 26.6 HS 12 MS 10.8 MS 8.9 MS 9.7 MS 19 S 表 3 Xa7基因对高世代杂交后代农艺性状的影响
Table 3 Effects of Xa7 on agronomic traits of filial generation hybrids
品系
Lines播始历期
Days to flower/d株高
Plant height/cm单株有效穗数
Panicles per plant穗长
Panicle length/cm单株总粒数
Grains per plan结实率
Seed set/%千粒重
1000-grain weight/g单株产量
Yield per plant/gRy-1 73 117.3±2.08 Bc 15.5 ±1.00 Aa 22.2±0.05 BCb 1820.3±108.55 ABCbc 90.7±0.28 Aa 22.6±0.34 Bb 37.3±2.70 Aa Ry-2 73 119.3±2.52 ABbc 11.3 ±0.58 Bb 22.8±0.72 Bb 2336.0±321.38 Aa 89.1±0.79Aa 21.5±0.28 Bb 39.6±0.68 Aa Ry-3 77 123.0±2.65 Aab 15.3 ±0.50 Aa 23.0±0.15 Bb 1675.3±264.06 BCcd 90.2±0.40Aa 27.5±1.32 Aa 41.8±6.95 Aa R084 79 124.7±1.53 Aa 11.0 ±1.41 Bb 21.2±0.54 Cc 1312.3±128.39 Cd 90.0±1.63Aa 27.8±1.76 Aa 38.4±1.58 Aa 华占
Huazhan73 98.2±1.30 Cd 13.0 ±2.45 ABb 26.0±0.50 Aa 2208.0±146.08 ABab 84.2±1.05 Bb 20.1±0.28 Bb 39.7±1.37 Aa 不同大、小写字母分别表示同一品种在不同氮素水平下差异极显著(P<0.01)或显著(P<0.05)。
Data with different uppercase letters represent extremely significant differences (P<0.01); those with different lowercase letters, significant differences (P<0.05). -
[1] 于江辉, 李焱瑶, 秦冠男, 等. 水稻OsNRAMP5基因低镉积累突变位点功能标记的开发与验证 [J]. 江苏农业学报, 2022, 38(2):289−295. YU J H, LI Y Y, QIN G N, et al. Development and validation of functional markers of low-cadmium accumulation mutation sites in rice OsNRAMP5 gene [J]. Jiangsu Journal of Agricultural Sciences, 2022, 38(2): 289−295.(in Chinese)
[2] 陈复旦, 颜丙霄, 何祖华. 水稻白叶枯病抗病机制与抗病育种展望 [J]. 植物生理学报, 2020, 56(12):2533−2542. CHEN F D, YAN B X, HE Z H. Mechanisms of disease resistance to bacterial blight and perspectives of molecular breeding in rice [J]. China Industrial Economics, 2020, 56(12): 2533−2542.(in Chinese)
[3] LIU W D, LIU J L, TRIPLETT L, et al. Novel insights into rice innate immunity against bacterial and fungal pathogens [J]. Annual Review of Phytopathology, 2014, 52: 213−241. DOI: 10.1146/annurev-phyto-102313-045926
[4] 闫成业, 刘艳, 牟同敏. 分子标记辅助选择改良杂交水稻金优207的白叶枯病抗性 [J]. 中国水稻科学, 2013, 27(4):365−372. YAN C Y, LIU Y, MOU T T M. Improvement of rice bacterial blight resistance of hybrid rice jinyou 207 by molecular marker-assisted selection [J]. Chinese Journal of Rice Science, 2013, 27(4): 365−372.(in Chinese)
[5] 于江辉, 刘廷昌, 翁绿水, 等. 不同遗传背景籼稻白叶枯病抗性基因Xa21、Xa23品系的抗性评价 [J]. 热带作物学报, 2021, 42(12):3433−3442. YU J H, LIU T C, WENG L S, et al. Analysis of Xa21 and Xa23 of indica rice varieties in different genetic background to broad spectrum bacterial blight pathogens [J]. Chinese Journal of Tropical Crops, 2021, 42(12): 3433−3442.(in Chinese)
[6] 陈析丰, 梅乐, 冀占东, 等. 中国稻种资源中新抗白叶枯病基因的发掘 [J]. 浙江师范大学学报(自然科学版), 2020, 43(1):8−12. CHEN X F, MEI L, JI Z D, et al. Exploration of new bacterial-blight resistance genes from rice Landrace resources in China [J]. Journal of Zhejiang Normal University (Natural Sciences), 2020, 43(1): 8−12.(in Chinese)
[7] 向贤, 陈露露, 张丹丹, 等. 水稻白叶枯病抗性基因物理图谱定位与功能标记 [J]. 分子植物育种, 2019, 17(2):509−516. XIANG X, CHEN L L, ZHANG D D, et al. Physical mapping and functional markers of bacterial blight resistance genes in rice [J]. Molecular Plant Breeding, 2019, 17(2): 509−516.(in Chinese)
[8] RAO K K, LAKSHMINARASU M, JENA K K. DNA markers and marker-assisted breeding for durable resistance to bacterial blight disease in rice [J]. Biotechnology Advances, 2002, 20(1): 33−47. DOI: 10.1016/S0734-9750(02)00002-2
[9] JIANG N, YAN J, LIANG Y, et al. Resistance genes and their interactions with bacterial blight/leaf streak pathogens (Xanthomonas oryzae) in rice (Oryza sativa L. )-an updated review [J]. Rice (New York, N Y), 2020, 13(1): 3.
[10] CHEN S, WANG C Y, YANG J Y, et al. Identification of the novel bacterial blight resistance gene Xa46(t) by mapping and expression analysis of the rice mutant H120 [J]. Scientific Reports, 2020, 10(1): 1−11. DOI: 10.1038/s41598-019-56847-4
[11] CHEN X F, LIU P C, MEI L, et al. Xa7, a new executor R gene that confers durable and broad-spectrum resistance to bacterial blight disease in rice [J]. Plant Communications, 2021, 5(10): 1−14.
[12] ZHOU J H, PENG Z, LONG J Y, et al. Gene targeting by the TAL effector PthXo2 reveals cryptic resistance gene for bacterial blight of rice [J]. The Plant Journal:for Cell and Molecular Biology, 2015, 82(4): 632−643. DOI: 10.1111/tpj.12838
[13] SIDHU G S, KHUSH G S, MEW T W. Genetic analysis of bacterial blight resistance in seventy-four cultivars of rice, Oryza sativa L [J]. Theoretical and Applied Genetics, 1978, 53(3): 105−111. DOI: 10.1007/BF00272687
[14] 刘峰, 梁青, 陈伟雄, 等. 水稻白叶枯病抗性基因Xa7和Xa23资源的分子标记分析 [J]. 分子植物育种, 2016, 14(4):935−940. LIU F, LIANG Q, CHEN W X, et al. Analysis of molecular marker on rice germplasms of bacterial blight resistant gene Xa7 and Xa23 [J]. Molecular Plant Breeding, 2016, 14(4): 935−940.(in Chinese)
[15] PORTER B W. CHITTOOR J, M. YANO M, et al. Development and mapping of markers linked to the rice bacterial blight resistance gene Xa7 [J]. Crop Science, 2003, 43(4): 1484−1492. DOI: 10.2135/cropsci2003.1484
[16] HE Y Q, LI X, ZHANG J F, et al. Gene pyramiding to improve hybrid rice by molecular marker techniques[A]. Brisbans, Queensland, Augstralia: 4th International Crop Science Congress, 2004.
[17] CHEN S, HUANG Z H, ZENG L X, et al. High-resolution mapping and gene prediction of Xanthomonas Oryzae pv. Oryzae resistance gene Xa7 [J]. Molecular Breeding, 2008, 22(3): 433−441. DOI: 10.1007/s11032-008-9187-1
[18] 李定琴, 钟巧芳, 曾民, 等. 水稻抗白叶枯病基因定位、克隆及利用研究进展 [J]. 中国稻米, 2017, 23(5):19−27. LI D Q, ZHONG Q F, ZENG M, et al. Progress in mapping, cloning and application of resistance genes to bacterial blight dis-ease in rice [J]. China Rice, 2017, 23(5): 19−27.(in Chinese)
[19] 伍豪, 邓国富, 高利军, 等. 水稻抗白叶枯病基因Xa7荧光分子标记开发与育种应用 [J]. 分子植物育种, 2021, 19(12):4024−4031. WU H, DENG G F, GAO L J, et al. Development and breeding application of the fluorescence molecular marker of rice bacterial blight resistance gene Xa7 [J]. Molecular Plant Breeding, 2021, 19(12): 4024−4031.(in Chinese)
[20] 孙平勇, 张武汉, 张莉, 等. 水稻氮高效、耐冷基因OsGRF4功能标记的开发及其利用 [J]. 作物学报, 2021, 47(4):684−690. DOI: 10.3724/SP.J.1006.2021.02035 SUN P Y, ZHANG W H, ZHANG L, et al. Development and application of functional marker for high nitrogen use efficiency and chilling tolerance gene OsGRF4 in rice [J]. Acta Agronomica Sinica, 2021, 47(4): 684−690.(in Chinese) DOI: 10.3724/SP.J.1006.2021.02035
[21] LIU P C, MEI L, HE L M, XU Y L, et al. Development of markers for identifification and makerassisted breeding of Xa7 gene in rice (Oryza sativa L. ) [J]. Euphytica, 2021, 217: 134. DOI: 10.1007/s10681-021-02869-x
[22] XIAO Y L, LI J J, YU J H, et al. Improvement of bacterial blight and brown planthopper resistance in an elite restorer line Huazhan of Oryza [J]. Field Crops Research, 2016, 186: 47−57. DOI: 10.1016/j.fcr.2015.11.009
[23] WANG W S, MAULEON R, HU Z Q, et al. Genomic variation in 3, 010 diverse accessions of Asian cultivated rice [J]. Nature, 2018, 557(7703): 43−49. DOI: 10.1038/s41586-018-0063-9
[24] 兰艳荣, 王俊义, 王弋, 等. 分子标记辅助选择改良水稻光温敏核不育系华201S的白叶枯病抗性 [J]. 中国水稻科学, 2011, 25(2):169−174. LAN Y R, WANG J Y, WANG Y, et al. Improvement of rice bacterial blight resistance of Hua 201S, an elite photo-thermo sensitive genic male sterile line, by molecular marker-assisted selection [J]. Chinese Journal of Rice Science, 2011, 25(2): 169−174.(in Chinese)
[25] 奎丽梅, 谭禄宾, 涂建, 等. 云南元江野生稻抽穗开花期耐热QTL定位 [J]. 农业生物技术学报, 2008, 16(3):461−464. DOI: 10.3969/j.issn.1674-7968.2008.03.018 KUI L M, TAN L B, TU J, et al. Identification of QTLs associated with heat tolerance of Yuanjiang common wild rice (Oryza rufipogon Griff. ) at flowering stage [J]. Journal of Agricultural Biotechnology, 2008, 16(3): 461−464.(in Chinese) DOI: 10.3969/j.issn.1674-7968.2008.03.018
[26] 于江辉, 赵森, 周浩, 等. 分期播种对耐高温东北粳稻农艺性状的影响及耐热性评价 [J]. 中国生态农业学报, 2012, 20(8):1037−1042. DOI: 10.3724/SP.J.1011.2012.01037 YU J H, ZHAO S, ZHOU H, et al. Effect of interval sowing on agronomic traits and thermo-tolerance of japonica rice from Northeast China [J]. Chinese Journal of Eco-Agriculture, 2012, 20(8): 1037−1042.(in Chinese) DOI: 10.3724/SP.J.1011.2012.01037
[27] 杨德卫, 叶宁, 叶新福, 等. 分子标记辅助选择Xa23基因改良早稻恢复系白叶枯病抗性研究 [J]. 福建农业学报, 2015, 30(4):351−356. YANG D W, YE N, YE X F, et al. Study on enhancing bacterial blight resistance of hybrid rice restorer lines through marker assisted selection of the Xa23 gene [J]. Fujian Journal of Agricultural Sciences, 2015, 30(4): 351−356.(in Chinese)
[28] 于洁, 王耀雯, 马文清, 等. 水稻抗白叶枯病基因Xa23群体的MAS育种研究 [J]. 华南农业大学学报, 2010, 31(4):1−5. DOI: 10.3969/j.issn.1001-411X.2010.04.001 YU J, WANG Y W, MA W Q, et al. The MAS research in the population of bacterial blight resistance gene Xa23 in rice [J]. Journal of South China Agricultural University, 2010, 31(4): 1−5.(in Chinese) DOI: 10.3969/j.issn.1001-411X.2010.04.001
[29] 范宏环, 王林友, 张礼霞, 等. 通过分子标记辅助选择技术选育携有水稻白叶枯病抗性基因Xa23的水稻株系 [J]. 中国水稻科学, 2011, 25(3):331−334. FAN H H, WANG L Y, ZHANG L X, et al. Breeding of rice lines with bacterial blight resistance gene Xa23 by using marker-assisted selection [J]. Chinese Journal of Rice Science, 2011, 25(3): 331−334.(in Chinese)
[30] 郑康乐, 庄杰云, 王汉荣. 基因聚合提高了水稻对白叶枯病的抗性 [J]. 遗传, 1998, 20(4):4−6. ZHENG K L, ZHUANG J Y, WANG H R. Performance of resistance gene pyramids to races of rice bacterial blight in Zhejiang Province [J]. Hereditas, 1998, 20(4): 4−6.(in Chinese)
[31] LEE S W, CHOI S H, HAN S S, et al. Distribution of Xanthomonas oryzae pv. oryzae strains virulent to Xa21 in Korea [J]. Phytopathology, 1999, 89(10): 928−933. DOI: 10.1094/PHYTO.1999.89.10.928
[32] HUANG B, XU J Y, HOU M S, et al. Introgression of bacterial blight resistance genes Xa7, Xa21, Xa22 and Xa23 into hybrid rice restorer lines by molecular marker-assisted selection [J]. Euphytica, 2012, 187(3): 449−459. DOI: 10.1007/s10681-012-0758-1
-
期刊类型引用(0)
其他类型引用(2)




 下载:
下载: