Candidate Genes Selection in Powdery Mildew-induced Resistance of Rose Plant to Beet Armyworms and the Bioinformatics Analysis on CYP71
-
摘要:目的 通过检测白粉菌侵染月季后转录组基因的表达量变化,筛选白粉菌诱导月季产生对甜菜夜蛾抗性的关键候选基因,为月季抗虫基因的功能研究及抗虫品种的培育提供参考。方法 以月季品种艳粉(Rosa chinensis Jacq.)为研究材料,利用二代测序技术对白粉菌侵染月季前后基因的表达量进行转录组测序。利用RSEM对基因的表达水平进行定量分析,DESeq2软件进行表达差异分析,利用KOBAS将得到的差异表达基因进行KEGG富集分析。对筛选出的可能参与三萜类物质生物合成的CYP71D差异表达基因(Differentially expressed genes,DEGs)进行生物信息学分析,并分析了CYP71D蛋白与抗虫性的关系。结果 转录组测序共检测到差异表达基因1 646个,共643个差异表达基因被富集到81条KEGG通路中,其中31个差异表达基因与萜类合成相关。生物信息学分析结果表明了CYP71D亚家族的物种特异性。在植物中CYP71A主要参与类单萜的生物合成,CYP71D主要参与单萜类、倍半萜类、二萜类、三萜类等与抗病、虫有关的次生代谢物的生物合成。结论 月季细胞色素P450超家族蛋白酶中CYP71簇的CYP71A、CYP71D亚家族可能与三萜化合物Dehydro (11,12) ursolic acid lactone(DUA)的生物合成有关,表明CYP71D家族蛋白参与修饰三萜化合物的底物识别位点,本研究为探索寄主植物介导的间接的病虫互作机理的研究提供了一定的思路。Abstract:Objective The transcriptomes of rose plants artificially infected by powdery mildew were obtained to identify the genes responsible for the resistance to infestation by beet armyworms.Method Transcriptomes of Yanfen rose (Rosa chinensis Jacq.) before and after being infected by powdery mildew were obtained using the second-generation sequencing technology. RSEM was used to quantitatively analyze the gene expressions, DESeq2 software for the expression differences, and KOBAS for the KEGG enrichment analysis on the differentially expressed genes (DEGs). Bioinformatics of the DEGs of CYP71D susceptible of associating with triterpenoids biosynthesis was secured to study the relationship between the CYP71D and the insect resistance.Result A total of 1 646 DEGs were detected by the transcriptome sequencing. Of which, 643 were enriched into 81 KEGG pathways with 31 DEGs related to terpenoid synthesis. The bioinformatics on them showed a species specificity of CYP71D subfamily. In plants, CYP71A were mainly involved in the biosynthesis of monoterpenes, while CYP71D in that of the disease and insect resistance-related secondary metabolites, such as monoterpenes, sesquiterpenes, diterpenes, and triterpenoids.Conclusion The CYP71A and CYP71D subfamilies of the cytochrome P450 enzyme in the rose might relate to the synthesis of dehydro (11,12) ursolic acid lactone (DUA). It suggested a possible association of CYP71D with the formation of triterpenoids. The results provided information for the study on the relationship between the genes in host plants and infecting insects.
-
Keywords:
- Rosa chinensis Jacq. /
- powdery mildew /
- triterpenoids /
- beet armyworm /
- CYP71 /
- bioinformatics
-
0. 引言
【研究意义】荸荠(Eleocharis tuberosa)是中国特色农产品,在福建、浙江和广西等南方大部分地区均有种植。荸荠俗称马蹄,是莎草科(Cyperaceae Juss)荸荠属多年生浅水草本植物,球茎清脆多汁,富含碳水化合物、蛋白质等多种营养物质[1, 2]。荸荠碳水化合物是荸荠球茎的主要营养物质,并以淀粉的形式储存于其中,淀粉含量在不同品种以及不同膨大时期均存在明显差异。有研究发现广西平乐荸荠的淀粉含量比广西灵川荸荠等品种淀粉含量高[3];朱世东[4]发现荸荠球茎膨大阶段大致分3个时期:膨大前期(1~20 d)、膨大中期(21~40 d)、膨大后期(41~70 d)。细胞的分裂和膨大是荸荠球茎宏观上体积增大的原因,而在膨大的过程中淀粉颗粒首先从球茎的基部中间位置的薄壁细胞开始积累,慢慢扩散至球茎顶部和周围的细胞,最后充满整个球茎的薄壁细胞[5]。有研究指出,在荸荠球茎开始膨大后约50 d时,球茎干物质含量增加主要来自薄壁细胞中淀粉的积累[6]。但目前有关荸荠淀粉合成相关酶及其编码基因的研究较少,深入了解该基因的功能对促进荸荠淀粉积累、提升荸荠品质具有重要意义。【前人研究进展】植物淀粉生物合成过程较为复杂,其中至少涉及ADP-葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,AGPase)、淀粉合成酶(Starch synthase,SS)、淀粉分支酶(Starch branching enzyme,SBE)以及脱分支酶(Debranching enzyme,DBE)等4种关键酶,其中淀粉合成酶(SBE)对支链淀粉的合成起着重要作用[7]。SBE及其多种同工酶已经从拟南芥(Arabidopsis thalian)[8]、小麦(Triticum aestivum)[9]、玉米(Zea mays)[10]以及水稻(Oryza sativa)[11]等作物中得到克隆鉴定。系统发育分析表明,高等植物中SBE根据氨基酸序列相似性可以分为SBEI和SBEII两个同工型[12]。SBEI主要负责直链淀粉长链淀粉的合成,SBEII则产生短链淀粉,主要作用于支链淀粉[13]。以往研究已经表明,高等植物中SBE突变或者缺失会导致直链淀粉和支链淀粉结构的改变。例如,通过RNA干扰技术抑制水稻中SBEI基因的表达,可使直链淀粉含量提高2倍 [14]。李苗等[15]研究发现,使用CRISPR/Cas9技术敲除小麦SBEIIa基因,可促进直链淀粉合成从而增加小麦直链淀粉含量,可见SBEIIa基因在小麦支链淀粉合成过程中发挥重要作用。Schwall等[16]也在研究中发现马铃薯SBEII基因缺失的突变体植株中,含有大量的支链淀粉而且淀粉成分也发生很大的变化。由此可见,支链淀粉的合成与SBE相关基因的表达有直接关系。同时,研究发现SBEI和SBEII在甘薯(Sweet Potato)[17]、芋头(Colocasia esculenta)[18]以及木薯(Manihot esculenta Crantz)[19]中的表达具有组织和时空特异性,表明不同SBE同工酶在不同物种的淀粉合成中发挥着不同的作用。目前已在荸荠球茎中克隆得到GBSS基因、EdAGPLI以及AGPase等3个参与淀粉合成的基因[20-22]。【本研究切入点】目前仅有少量关于荸荠球茎中淀粉生物合成的研究,而关于荸荠SBEII基因的研究至今尚未见报道。【拟解决的关键问题】本研究以桂林荸荠为对象,基于已获得的荸荠转录组测序结果,利用同源克隆的方法对筛选得到的SBEII基因进行克隆与生物信息学分析,并利用荧光定量PCR技术对荸荠不同组织以及膨大过程中球茎的SBEII基因进行表达特性分析,以期为荸荠CwSBEII的基因功能深入探究以及该基因参与淀粉合成的机制提供理论参考。
1. 材料与方法
1.1 试验材料
供试材料为地方品种桂林荸荠,采自广西壮族自治区贺州市八步区荸荠种植田,选择无虫害、无机械损伤的荸荠植株,在球茎膨大后期收集根、叶片、荸荠皮和荸荠肉以及球茎不同膨大时期(S1~S4时期,球茎最宽处直径分别约为10 、20 、35和50 mm)的样本,洗净去皮。取样时每个时期选取3个块茎大小相近的荸荠混合取样后,分装液氮,速冻于−80 ℃保存备用。
1.2 试验方法
1.2.1 总RNA的提取和各样品的cDNA合成
参照华越洋生物科技(北京) 有限公司的植物RNA提取试剂盒提取各样品的总RNA。RNA的浓度通过超微量分光光度计检测分析。选择浓度合适的RNA根据PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,大连)进行单链cDNA的合成,具体操作步骤参照说明书,将合成的cDNA模板保存于−20 ℃冰箱中,用于后续试验。
1.2.2 基因克隆
根据之前从荸荠转录组数据中得到的与其他植物SBEII基因同源性较高的序列片段(转录组中编号为isoform_22367),利用primer 5.0软件设计用于扩增该基因CDS序列的引物,其引物序列见表1。以不同膨大时期的荸荠cDNA为模板进行PCR扩增,反应体系为50 μL,包含cDNA模板1 μL,上下游引物各1 μL,酶25 μL,ddH2O 22 μL。反应扩增程序:94 ℃预变性3 min,95 ℃变性15 s,55 ℃ 退火30 s,72 ℃延伸 3 min,35个循环后72 ℃终延伸10 min,产物于4 ℃保存。
表 1 荸荠SBEII基因克隆和表达所用引物Table 1. Primer used for cloning and expression analysis of SBEII in Chinese water chestnut引物名称
Primer name引物序列(5′-3′)
Sequence(5′-3′)CwSBEII (F) ATGACGTTCGCTCTATCGGGATCGG CwSBEII (R) TTACTCCTCACAGAGAGCATAGACA Q-PCR CwSBEII (F) CCTCCTGAAGAAGAAAAGTACGTC Q-PCR CwSBEII (R) AGCTAGCATAGTAAGAGTGCTCCTG 18S RNA (F) ATGATTAAGAGGGACAGTCGGGGGC 18S RNA (R) CTAGGACGGTATCTGATCGTCTTCG PCR扩增产物经过琼脂糖凝胶电泳检测后切胶回收纯化,回收方法参照DNA凝胶回收试剂盒说明书。回收纯化后的产物与PMD 18-T克隆载体连接,并通过热激法转化至DH5α感受态细胞中,涂布在含有抗性的LB固态培养基上,37 ℃培养12~16 h后挑取单克隆进行摇菌,经菌液PCR检测后,将阳性克隆菌样送至上海生工生物工程有限公司完成测序,测序正确序列用于后续生物信息学分析。
1.3 SBEII基因生物信息学分析
通过ORF finder(http://www.detaibio.com/sms2/orf_find.html)网站查找CwSBEII基因的开放阅读框(ORF);分别使用ClustaW 1.83和DNAMAN软件进行多重序列比对和同源性比对;在ExPASy(https://web.expasy.org/protparam/)网站分析蛋白分子量及理化性质;利用NPS@:SOPMA secondary structure prediction(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)网站分别预测蛋白质二级结构、三级结构;利用Mega 5软件构建系统进化树[21-22]。
1.4 SBEII基因的表达分析
通过荧光定量PCR法对目的基因相对表达量进行检测,以18S rRNA(登录号:MG742686)为内参。根据获得的SBEII基因cDNA序列设计荧光定量PCR特异引物(表1)。以荸荠根、叶片、荸荠皮、荸荠肉等组织以及不同膨大时期荸荠肉的cDNA为模板,采用PrimeScriptTM RT reagent Kit剂盒进行荧光定量PCR扩增,反应体系为25 μL,包含上下游引物各1 μL,cDNA模板2 μL,酶12.5 μL,ddH2O 8.5 μL,具体步骤参考试剂盒说明书。利用2−△△Ct方法计算荸荠SBEII基因在球茎不同膨大时期和不同组织中的相对表达量。每个样品的表达量均为3次重复的平均值。
2. 结果与分析
2.1 荸荠SBEII基因克隆
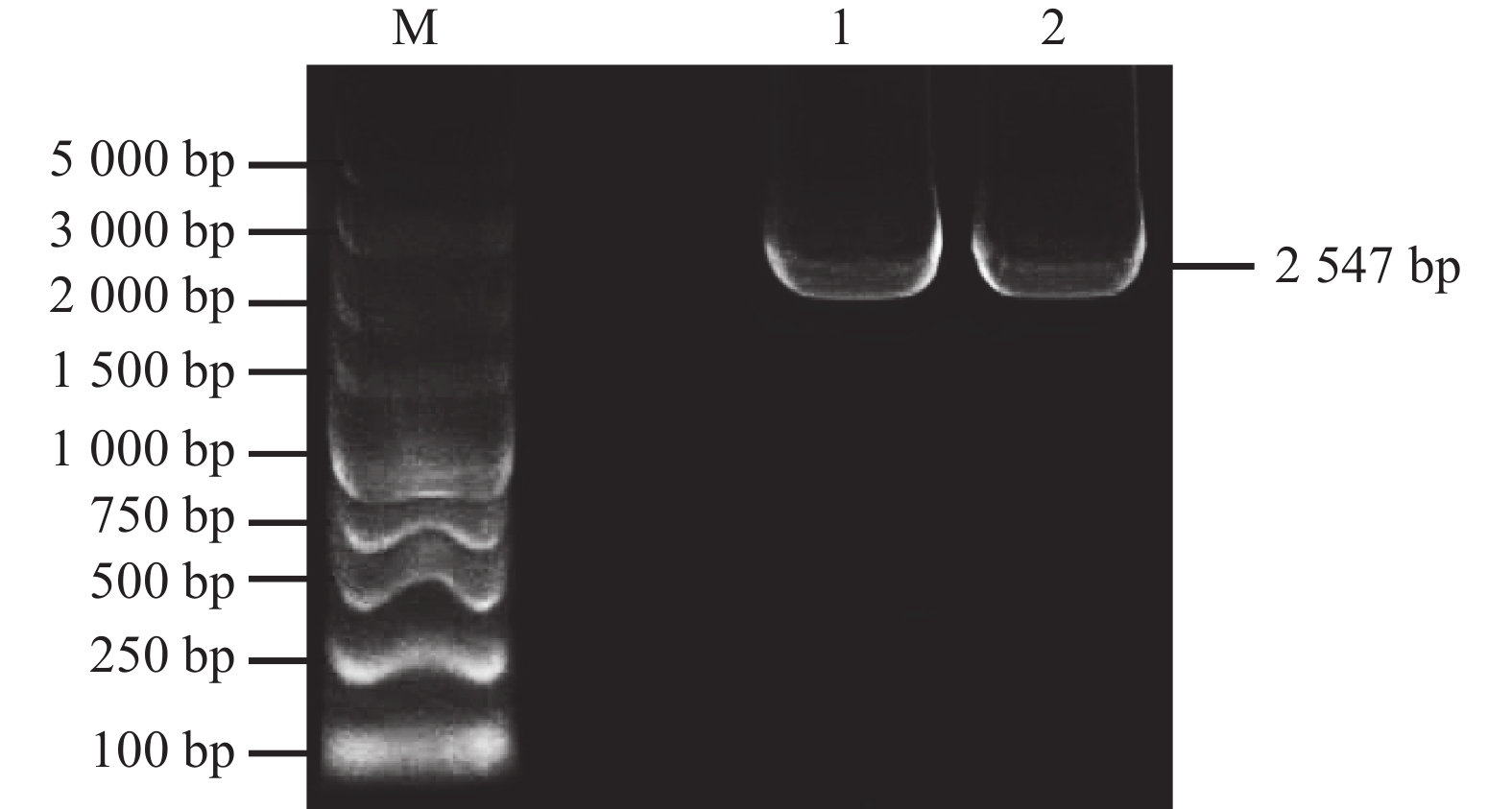
在荸荠球茎全长转录组数据中筛选出转录本isoform_22367,该转录本在各大数据库均注释为SBE,在NCBI官网上进行BLAST比对确认。该序列作为参照设计PCR特异性引物,以荸荠组织cDNA为模板进行PCR扩增,经琼脂糖凝胶电泳检测发现获得产物长度约为2500 bp(图1)。将该产物回收后与载体连接并测序,得到该基因序列,并与转录本序列进行比对,序列完全一致,最终获得该基因的开放阅读框(ORF)长为2547 bp。将该基因编码区全长序列在NCBI上进行比对,发现该序列与其他多种植物SBEII基因的同源性大于77 %。由此确定该基因为SBEII同源基因,并命名为CwSBEII。
2.2 CwSBEII基因的生物信息学分析
通过在线软件Expasy-Prot Param Tool分析CwSBEII基因的氨基酸序列,结果表明,该序列含有848个氨基酸残基,分子表达式为C4294H6447N1151O1297S36,分子量为96100.52,理论等电点pI值为5.24。不稳定指数为41.07,为不稳定蛋白。CwSBEII氨基酸组成中丝氨酸(Ser)最多,为8.7 %,其次是甘氨酸(Gly),占8.5 %,并且此蛋白质中不含吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)。其中带正电荷总数为81个,带负电荷酸性氨基酸为117个,即整个蛋白质带负电。CwSBEII蛋白的脂肪族氨基酸指数为67.37。
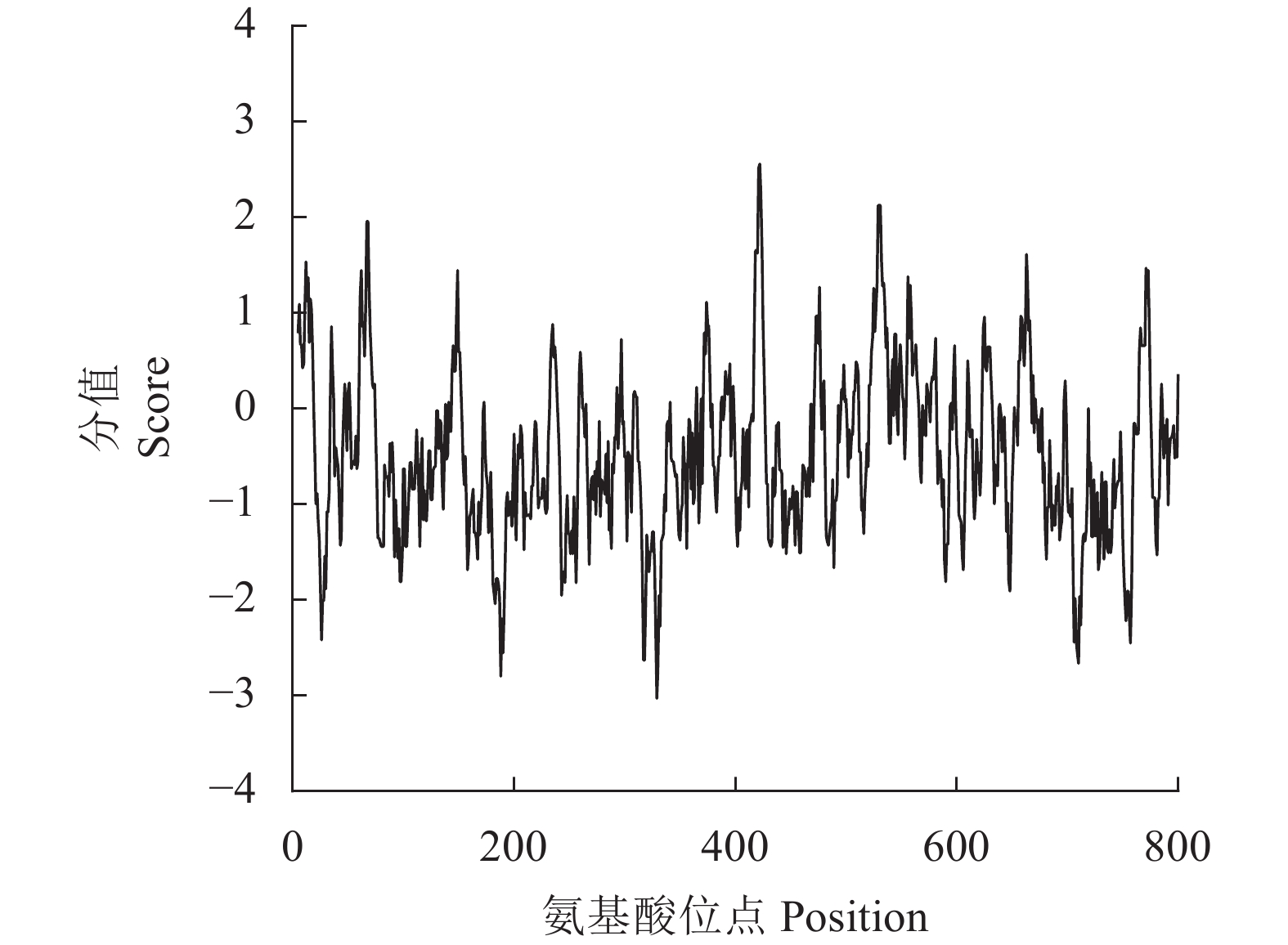
通过在线软件ProtScale对CwSBEII基因编码的蛋白质进行亲疏水性预测分析(图2),发现超过一半图像位于负坐标,通过计算亲水性总平均值(GRAVY)为−0.473,表明该CwSBEII蛋白属于亲水性蛋白。
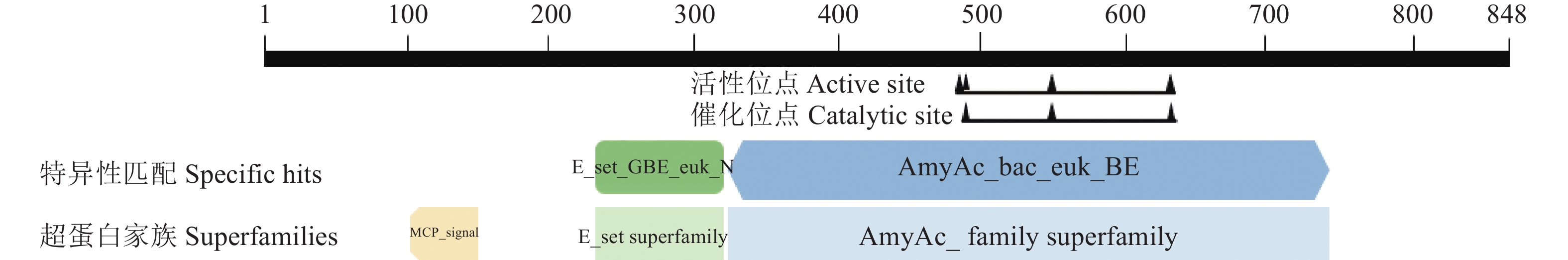
在 NCBI 的 Conserved domains 数据库预测 CwSBEII基因的蛋白保守结构域,发现CwSBEII蛋白含有AmyAc_bac_euk_BE和E_set_GBE_euk_N两个保守结构域,分别属于AmyAc_family 超家族、MCP_signal 超家族(图3)。
利用ExPaSy-SOPMA对CwSBEII蛋白进行二级结构预测(图4),结果显示该蛋白含有33.14%的α-螺旋、6.01%的β-折叠、20.40%的延伸链以及40.45%的无规则卷曲。利用Swiss-model以系统自动匹配水稻为模板对CwSBEII蛋白进行同源建模(图5),CwSBEII的三级结构中β-折叠是最明显的结构组件。另外利用Plant-mPLoc server在线软件预测得知荸荠叶绿体中存在CwSBEII基因编码的蛋白质。
2.3 SBEII氨基酸多重序列比对和系统发育进化树的构建
为进一步了解CwSBEII基因的功能和特点,使用ClustaW 1.83和Mega 5生物软件,对荸荠和其他11个物种的SBEII氨基酸序列进行系统发育进化树的构建(图6)。不同SBE主要分为两簇,其中绿豆(Vigna radiata)和菜豆(Phaseolus vulgaris)等6个物种聚为一簇,拟南芥和荸荠等5个物种聚为一簇。说明荸荠、拟南芥、小麦、水稻、玉米等5个物种的SBE蛋白之间亲缘关系较近,与绿豆、菜豆等亲缘关系较远。
将荸荠SBEII基因所编码的蛋白序列与其他5种植物的SBEII蛋白进行同源比对(图7),结果显示CwSBEII编码的氨基酸序列与拟南芥、小麦、水稻和玉米SBEII蛋白的同源性依次为68.09%、75.65%、76.84%、77.16%。表明SBEII在不同物种中具有较高的保守性,特别是7个已知的蛋白活性位点(图7)。
2.4 CwSBEII组织特异性表达分析
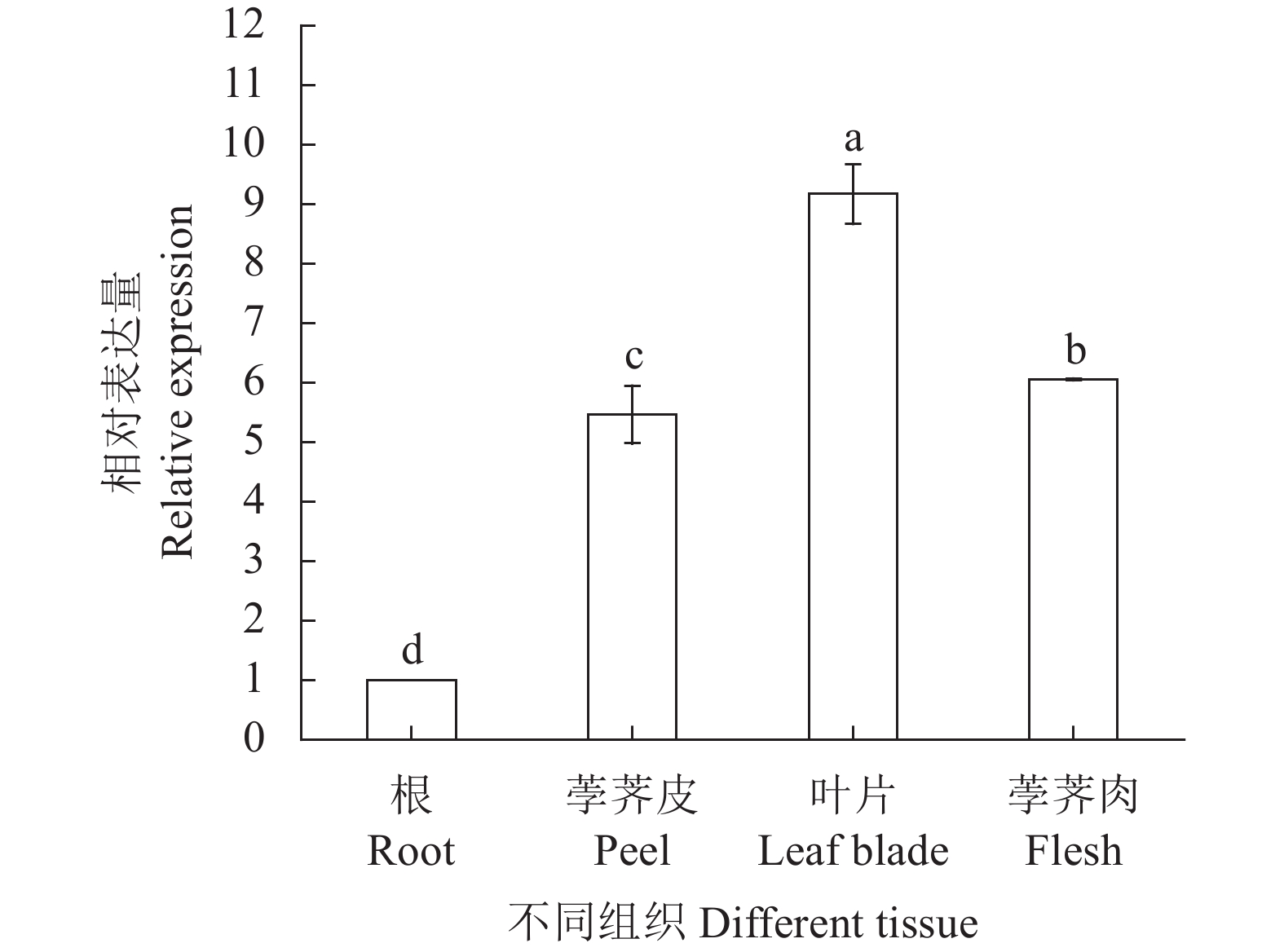
为了研究CwSBEII在荸荠不同组织器官中的作用,利用荧光定量PCR方法分析其在叶片、根、荸荠皮和荸荠肉中的表达模式。结果表明CwSBEII基因在荸荠各组织中均有表达,其中CwSBEII在叶片中表达量最高,在荸荠皮和肉中也均有较高的表达水平,而在根中的表达量最低,不同组织之间的相对表达量均差异显著(P<0.05)(图8)。
2.5 CwSBEII在球茎膨大过程中的表达水平分析
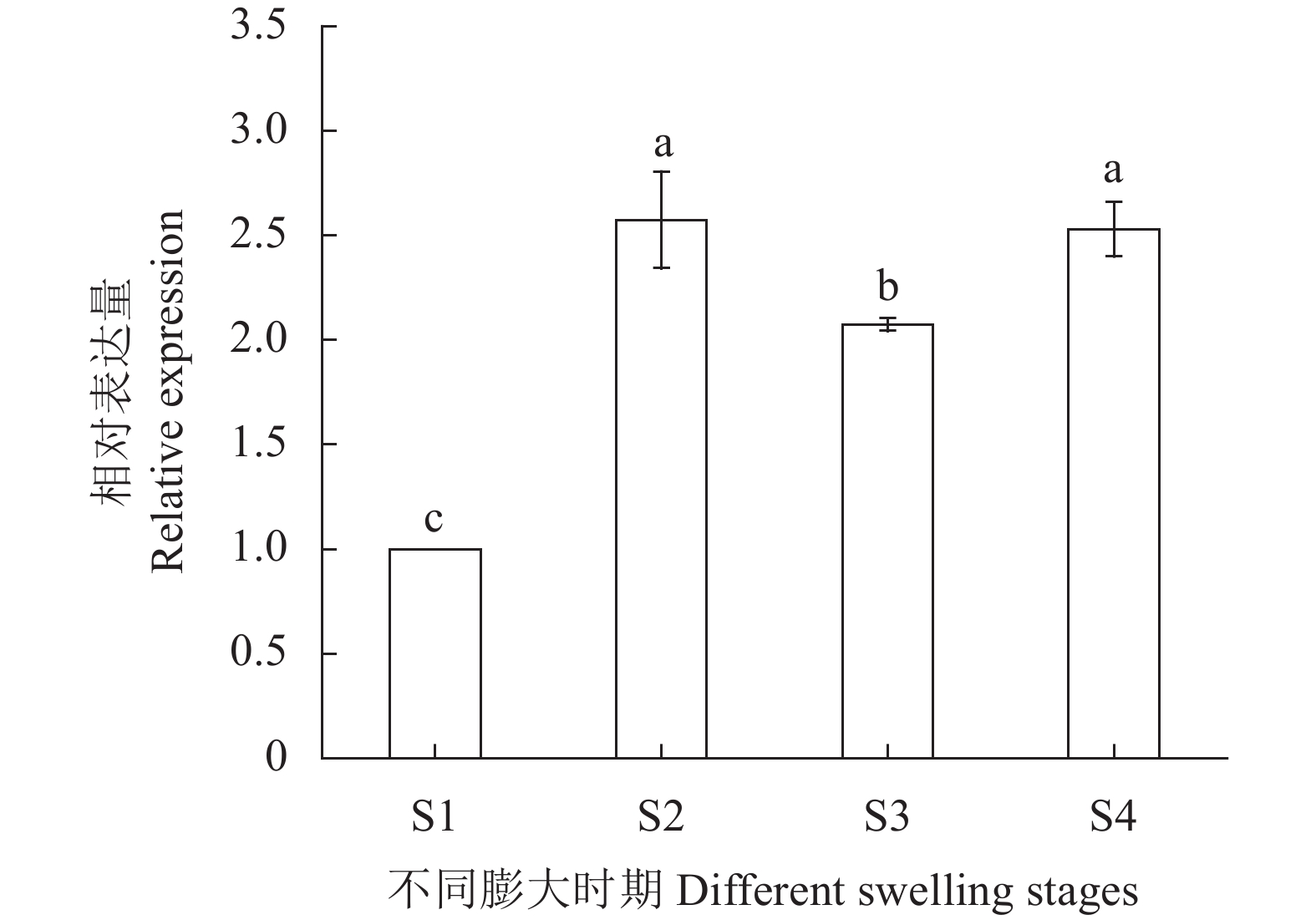
为了揭示CwSBEII在荸荠球茎膨大过程中的作用,利用荧光定量PCR方法分析其在不同膨大时期的表达模式。从图9可以看出,CwSBEII在荸荠球茎膨大的S2和S4时期相对表达量较高,并且显著高于其他时期(P<0.05),球茎膨大前期(S1时期)表达量显著低于其他3个时期(P<0.05)。
3. 讨论与结论
园艺作物的球茎、块茎和块根是重要的经济器官,积累大量的营养物质。山药块茎膨大过程中,块茎质量、还原糖和淀粉含量随着块茎的膨大呈现先逐渐增加后快速增大至趋于稳定或者缓慢下降的趋势[23]。不同葛根品种块根的淀粉含量在膨大前期和后期呈现快速增长的趋势,且在膨大后期达到最大值后趋于稳定的变化趋势[24]。慈姑球茎膨大过程中,球茎淀粉含量表现出“缓慢-快速-缓慢”增长的变化趋势,表明淀粉是慈姑球茎的主要组成物质[25]。荸荠作为典型的球茎植物,其球茎含有丰富的淀粉类碳水化合物。荸荠球茎中富含淀粉,一些“粉蹄”品种的淀粉含量更高,但荸荠球茎膨大过程中淀粉的积累规律和研究机制尚不清晰。目前,已经在莲藕[26]、马铃薯[27]、山药[23]以及芭蕉芋[28]等块茎植物和水仙[29]等球茎植物中克隆出许多编码淀粉合成的基因,如GBSS、SSS、SBE。但是,关于SBEII参与荸荠球茎淀粉合成的报道尚未报道。
本研究发现,荸荠CwSBEII的开放阅读框包含2547 bp,编码848个氨基酸,CwSBEII蛋白的长度与板栗[30]接近但短于慈姑[25]的SBEII蛋白。经预测发现,荸荠CwSBEII蛋白属于亲水性不稳定蛋白,主要分布在叶绿体中。多种植物的SBEII蛋白具有AmyAc_bac_euk_BE和E_set_GBE_euk_N两个保守结构域,其中AmyAc_bac_euk_BE是α-淀粉酶催化活性中心,可以水解淀粉中的α-1,4糖苷键[30-32]。荸荠CwSBEII蛋白也属于α-淀粉酶超家族,并具有相似的两个保守结构域,表明该蛋白具有淀粉酶催化活性。前人研究发现SBEII与SBEI相比有一个较长的N端,SBEII对支链淀粉的活性大于对直链淀粉的活性,SBEI刚好相反[33],这些均表明CwSBEII是一种典型的淀粉分支酶[25]。序列比对结果显示,荸荠SBEII编码的氨基酸序列与禾本科的其他物种SBEII有较高的序列一致性,尤其是关键酶活性位点Asp312、His317、Arg381、Asp383、Glu438、His505、Asp506的氨基酸残基完全相同[34]。经系统进化树分析发现,荸荠与水稻OsSBEII、玉米ZmSBEII等禾本科聚为一支,与其亲缘关系较近,说明该基因确实为桂林荸荠中的SBEII,并且在进化过程中具有较高的保守性。
木薯SBEII在叶片和块根中发挥功能,并具有较高的表达水平[19]。然而马铃薯SBEI专一表达于块茎中,而SBEII则相对专一表达于叶片中[35]。这表明SBEI和SBEII的表达模式具有明显的组织特异性。本研究通过荧光定量PCR技术分析了CwSBEII在荸荠各组织器官以及球茎不同膨大时期的表达模式,结果显示,CwSBEII在荸荠中表现为组织特异性表达,在荸荠叶片组织中的表达量最高,在球茎皮和球茎肉中也有较高的表达水平,推测该基因可能参与荸荠叶片和荸荠球茎发育的调控。除了组织特异性表达,SBE基因在多种植物中也呈现明显的时空特异性表达。本研究发现,CwSBEII在球茎S1~S4膨大时期表达量呈现出“上升-下降-上升”的变化趋势,特别是在S1~S2的膨大初期CwSBEII表达出现显著上调,推测该基因可能参与荸荠球茎淀粉的合成。
-
表 1 转录组测序数据
Table 1 Transcriptome sequences
样本名称
Sample总条目数
Raw reads质控总条目数
Clean reads质控总数据量
Clean data/Gb错误率
Error rate/%Q20/% Q30/% 健康样本1 CK1 46403668 46118398 6.88 0.0244 98.30 94.63 健康样本2 CK2 51906926 51578808 7.68 0.0244 98.31 94.68 健康样本3 CK3 54877772 54487558 8.12 0.0248 98.17 94.32 感病样本1 Ta1 52578650 52226040 7.78 0.0245 98.29 94.61 感病样本2 Ta2 51390748 51052798 7.59 0.0247 98.20 94.39 感病样本3 Ta3 48584868 48273580 7.18 0.0246 98.25 94.52 Q20、Q30分别指测序质量在99%和99.9%以上的碱基占总碱基的百分比。
Q20 and Q30 refer to the percentage of bases with sequencing quality above 99% and 99.9%, respectively.表 2 Reads与参考基因组的比对结果
Table 2 Comparison between Reads and reference genome
(单位:%) 样本
SampleClean reads数目总量
Total mapped编码区
CDS基因区间
Intergenic内含子区
Introns3′非编码区
3′UTR5′非编码区
5′UTR健康样本1 CK1 86.53 86.85 0.78 1.91 5.81 4.65 健康样本2 CK2 86.82 87.20 0.73 1.78 5.52 4.77 健康样本3 CK3 86.60 87.29 0.70 1.68 5.71 4.63 感病样本1 Ta1 86.74 86.90 0.74 1.91 5.88 4.56 感病样本2 Ta2 86.40 86.54 0.75 1.99 5.75 4.96 感病样本3 Ta3 86.30 85.84 0.77 2.04 6.56 4.78 表 3 CPY71蛋白的理化性质及亚细胞定位
Table 3 Physicochemical properties and subcellular localization of CPY71 protein
基因ID
Gene ID蛋白质登录号
Protein accession氨基酸长度
Amino acid
length/aa分子质量
Molecular weight /kDa理论等电点
Theoretical pI不稳定性系数
Instability index平均亲水性系数
GRAVY亚细胞定位预测
Subcellular localizationLOC112176060 XP_024169643.1 510 58.18 5.74 46.17 −0.022 内质网
Endoplasmic reticulumLOC112195754 XP_024191713.1 510 58.33 8.78 41.88 −0.139 内质网
Endoplasmic reticulumLOC112195786 XP_024191752.1 512 58.01 7.01 42.50 −0.200 内质网
Endoplasmic reticulumLOC112198434 XP_024195327.1 513 58.64 7.26 46.55 −0.166 内质网
Endoplasmic reticulumLOC112177305 XP_040369681.1 515 58.38 7.71 36.81 −0.187 内质网
Endoplasmic reticulumLOC112166540 XP_024159180.1 512 58.54 8.76 41.76 −0.212 内质网
Endoplasmic reticulum表 4 CYP71簇的亚家族分类及其功能特征
Table 4 Classification and functional characteristics of CYP71 subfamilies
亚家族
Subfamily代谢指向性
Metabolism功能/代谢产物的类别
Function/class of metabolitesCYP71A 专一 类单萜 Monoterpenoid CYP71AR 专一 类单萜 Monoterpenoid CYP71AV 专一 倍半萜 Sesquiterpenoid CYP76B 专一 环烯醚萜 Iridoid,类单萜 Monoterpenoid,解毒异生素 Xenobiotics Detoxification CYP71BA 专一 倍半萜 Sesquiterpenoid CYP71BL 专一 倍半萜 Sesquiterpenoid CYP71D 专一 类单萜 Monoterpenoid,倍半萜 Sesquiterpenoid,二萜 Diterpenoid,吲哚生物碱 Indole Alkaloid,类黄酮 Flavonoid CYP71Z 专一 二萜 Diterpenoid CYP76M 专一 二萜 Diterpenoid CYP82G 专一 萜类衍生物 Terpenoid-derived CYP93E 专一 三萜 Triterpenoid CYP99A 专一 二萜 Diterpenoid CYP701A 一般 二萜类植物激素 GA Diterpenoid Phytohormone GA CYP701A 专一 二萜 Diterpenoid CYP705A 专一 三萜 Triterpenoid CYP706B 专一 倍半萜 Sesquiterpenoid -
[1] YANG F, LI Y, YANG B. The inhibitory effects of rose powdery mildew infection on the oviposition behaviour and performance of beet armyworms [J]. Entomologia Experimentalis et Applicata, 2013, 148(1): 39−47. DOI: 10.1111/eea.12069
[2] 张怡, 沈迎春, 王宁. 设施栽培月季白粉病防治药剂筛选与应用 [J]. 江苏农业科学, 2021(4):70−73. DOI: 10.15889/j.issn.1002-1302.2021.04.013 ZHANG Y, SHEN Y C, WANG N. Screening and application of agents controlling Chinese rose powdery mildew in facility culture [J]. Jiangsu Agricultural Sciences, 2021(4): 70−73.(in Chinese) DOI: 10.15889/j.issn.1002-1302.2021.04.013
[3] HUANG J M, ZHAO Y X, SUN H, et al. Monitoring and mechanisms of insecticide resistance in Spodoptera exigua (Lepidoptera: Noctuidae), with special reference to diamides [J]. Pestic Biochem Physiol, 2021, 174: 104831. DOI: 10.1016/j.pestbp.2021.104831
[4] HU B, HUANG H, HU S, et al. Changes in both trans- and Cis-regulatory elements mediate insecticide resistance in a lepidopteron pest, Spodoptera exigua [J]. PLoS Genetics, 2021, 17(3): e1009403. DOI: 10.1371/journal.pgen.1009403
[5] KARBAN R, ADAMCHAK R, SCHNATHORST W C. Induced resistance and interspecific competition between spider mites and a vascular wilt fungus [J]. Science, 1987, 235(4789): 678−680. DOI: 10.1126/science.235.4789.678
[6] 杨发忠. 中国月季介导的植物病虫互作关系[D]. 昆明: 云南农业大学, 2015. YANG F Z. The plant-mediated interaction relationship between phytopathogenic fungi and herbivory insects on rose plants[D]. Kunming: Yunnan Agricultural University, 2015. (in Chinese)
[7] 杨发忠, 杨德强, 杨斌, 等. 中国月季感染白粉菌对甜菜夜蛾取食行为的影响及原因初探 [J]. 广东农业科学, 2015, 42(17):67−71. DOI: 10.3969/j.issn.1004-874X.2015.17.012 YANG F Z, YANG D Q, YANG B, et al. Effects of rose infected by powdery midew on feeding behaviour of beet armyworm and its mechanism [J]. Guangdong Agricultural Sciences, 2015, 42(17): 67−71.(in Chinese) DOI: 10.3969/j.issn.1004-874X.2015.17.012
[8] CHENG J, YIN L, ZHOU S, et al. The Inhibitory Effect of Powdery Mildew-Induced Volatiles from Rose on Host Selection Behavior of Beet Armyworm Moths (Lepidoptera: Noctuidae) [J]. Journal of Entomological Science, 2022, 57(1): 96−113. DOI: 10.18474/JES21-13
[9] MORTIBOYS H, AASLY J, BANDMANN O. Ursocholanic acid rescues mitochondrial function in common forms of familial Parkinson's disease [J]. Brain, 2013, 136(10): 3038−3050. DOI: 10.1093/brain/awt224
[10] 彭少麟, 南蓬, 钟扬. 高等植物中的萜类化合物及其在生态系统中的作用 [J]. 生态学杂志, 2002, 21(3):33−38. DOI: 10.3321/j.issn:1000-4890.2002.03.009 PENG S L, NAN P, ZHONG Y. Terpenoids in higher plants and their roles in ecosystems [J]. Chinese Journal of Ecology, 2002, 21(3): 33−38.(in Chinese) DOI: 10.3321/j.issn:1000-4890.2002.03.009
[11] 谭世强, 马琳, 许永华, 等. 植物三萜类物质的生态学功能研究进展 [J]. 人参研究, 2015, 27(3):36−38. DOI: 10.3969/j.issn.1671-1521.2015.03.013 TAN S Q, MA L, XU Y H, et al. Research Advances in ecological activities of Triterpenoids [J]. Ginseng Research, 2015, 27(3): 36−38.(in Chinese) DOI: 10.3969/j.issn.1671-1521.2015.03.013
[12] LAKHANPAL S, FAN J S, LUAN S, et al. Structural and functional analyses of the PPIase domain of Arabidopsis thaliana CYP71 reveal its catalytic activity toward histone H3 [J]. FEBS Letters, 2021, 595(1): 145−154. DOI: 10.1002/1873-3468.13965
[13] IRMISCH S, CLAVIJO MCCORMICK A, GÜNTHER J, et al. Herbivore-induced poplar cytochrome P450 enzymes of the CYP71 family convert aldoximes to nitriles which repel a generalist caterpillar [J]. The Plant Journal, 2014, 80(6): 1095−1107. DOI: 10.1111/tpj.12711
[14] ZHOU J H, LI Z Y, XIAO G Q, et al. CYP71D8L is a key regulator involved in growth and stress responses by mediating gibberellin homeostasis in rice [J]. Journal of Experimental Botany, 2019, 71(3): 1160−1170.
[15] MA Y, CUI G, CHEN T, et al. Expansion within the CYP71D subfamily drives the heterocyclization of tanshinones synthesis in Salvia miltiorrhiza [J]. Nature communications, 2021, 12(1): 1−11. DOI: 10.1038/s41467-020-20314-w
[16] DANIELE W R, RENE F. Cytochromes P450: A success story [J]. Genome Biology, 2000, 1(6): 1−9.
[17] 戴素明, 周程爱, 谢丙炎, 等. 细胞色素P450表达在植物防御反应中的作用 [J]. 石河子大学学报(自然科学版), 2004(S1):184−187. DOI: 10.13880/j.cnki.65-1174/n.2004.s1.060 DAI S M, ZHOU C A, XIE B Y, et al. Role of cytochromes P450 expression in plant defence responding to pathogens [J]. Journal of Shihezi University (Natural Science), 2004(S1): 184−187.(in Chinese) DOI: 10.13880/j.cnki.65-1174/n.2004.s1.060
[18] GRUNSEICH J M, THOMPSON M N, AGUIRRE N M, et al. The role of plant-associated microbes in mediating host-plant selection by insect herbivores [J]. Plants (Basel, Switzerland), 2019, 9(1): E6.
[19] BERTEA C M, CASACCI L P, BONELLI S, et al. Chemical, physiological and molecular responses of host plants to lepidopteran egg-laying [J]. Frontiers in Plant Science, 2019, 10: 1768.
[20] 凌冰, 张茂新, 王玉赞. 葫芦素的生态功能及其应用前景 [J]. 生态学报, 2010, 30(3):780−793. LING B, ZHANG M X, WANG Y Z. Ecological function and prospects for utilization of cucurbitacins [J]. Acta Ecologica Sinica, 2010, 30(3): 780−793.(in Chinese)
[21] CHANDRAVADANA M V. Identification of triterpenoid feeding deterrent of red pumpkin beetles (Aulacophora foveicollis) from Momordica charantia [J]. Journal of chemical ecology, 1987, 13(7): 1689−1694. DOI: 10.1007/BF00980210
[22] 周琼, 熊正燕, 欧晓明. 苍耳甾醇物质对菜青虫取食、血淋巴和中肠酶活性及中肠组织的影响 [J]. 昆虫学报, 2011, 49(5):1034−1041. DOI: 10.16380/j.kcxb.2011.09.012 ZHOU Q, XIONG Z Y, OU X M. Effects of sterols from Xanthium sibiricum (Compositae) on feeding, enzyme activities in the hemolymph and midgut, and midgut tissues of Pieris rapae (Lepidoptera: Pieridae) larvae [J]. Acta Entomologica Sinica, 2011, 49(5): 1034−1041.(in Chinese) DOI: 10.16380/j.kcxb.2011.09.012
[23] JING X, GREBENOK R J, BEHMER S T. Diet micronutrient balance matters: How the ratio of dietary sterols/steroids affects development, growth and reproduction in two lepidopteran insects [J]. Journal of Insect Physiology, 2014, 67: 85−96. DOI: 10.1016/j.jinsphys.2014.06.004
[24] 谭世强, 张爱华, 谢敬宇, 等. 人参总皂苷对苜蓿夜蛾幼虫的拒食作用 [J]. 中国中药杂志, 2013, 38(1):37−39. TAN S Q, ZHANG A H, XIE J Y, et al. Anti-feeding effect of total ginsenoside from Panax ginseng on Heliothis dipsacea larvae [J]. China Journal of Chinese Materia Medica, 2013, 38(1): 37−39.(in Chinese)
[25] 安素芳. 不同菊属近缘种植物叶片萜类化合物对斜纹夜蛾抗性的研究[D]. 南京: 南京农业大学, 2020. AN S F. Study on the effect of terpenoids in leaves on the defense to Spodoptera litura in different chrysanthemum species[D]. Nanjing: Nanjing Agricultural University, 2020. (in Chinese)
[26] 王蕾, 赵泽玉, 陈明丽, 等. 烟草CYP71D亚家族的生物信息学分析 [J]. 中国烟草科学, 2020, 41(2):79−85,92. DOI: 10.13496/j.issn.1007-5119.2020.02.014 WANG L, ZHAO Z Y, CHEN M L, et al. Bioinformatic analysis of CYP71D subfamily genes in tobacco(Nicotiana tabacum L. ) [J]. Chinese Tobacco Science, 2020, 41(2): 79−85,92.(in Chinese) DOI: 10.13496/j.issn.1007-5119.2020.02.014
[27] 王珺霞, 毕杰, 卢星宇, 等. 哺乳动物细胞色素P450酶中底物识别位点与功能的进化关系 [J]. 生物物理学报, 2015, 31(2):154−164. WANG J X, BI J, LU X Y, et al. Evolutionary relationship of substrate recognition sites with protein functions of mammalian cytochrome P450 enzymes [J]. Acta Biophysica Sinica, 2015, 31(2): 154−164.(in Chinese)
[28] 解敏敏, 龚达平, 李凤霞, 等. 烟草细胞色素P450的基因组学分析 [J]. 遗传, 2013, 35(3):379−387. XIE M M, GONG D P, LI F X, et al. Genome-wide analysis of cytochrome P450 monooxygenase genes in the tobacco [J]. Inheritance, 2013, 35(3): 379−387.(in Chinese)
[29] BATHE U, TISSIER A. Cytochrome P450 enzymes: A driving force of plant diterpene diversity [J]. Phytochemistry, 2019, 161: 149−162. DOI: 10.1016/j.phytochem.2018.12.003
[30] CHEN Y, KLINKHAMER P G L, MEMELINK J, et al. Diversity and evolution of cytochrome P450s of Jacobaea vulgaris and Jacobaea aquatica [J]. BMC Plant Biology, 2020, 20(1): 1−14. DOI: 10.1186/s12870-019-2170-7
[31] 芦海平, 舒庆尧, 富昊伟, 等. 水稻基因CYP71A1和5-羟色胺在调控水稻植株抗虫性中的应用: CN107217061B[P]. 2019-07-09. [32] ZHOU N, TOOTLE T L, GLAZEBROOK J. Arabidopsis PAD3, a gene required for camalexin biosynthesis, encodes a putative cytochrome P450 monooxygenase [J]. The Plant Cell, 1999, 11(12): 2419−2428. DOI: 10.1105/tpc.11.12.2419
[33] WANG E, WANG R, DEPARASIS J, et al. Suppression of a P450 hydroxylase gene in plant trichome glands enhances natural-product-based aphid resistance [J]. Nature Biotechnology, 2001, 19(4): 371−374. DOI: 10.1038/86770
[34] OH B J, KO M K, KIM Y S, et al. A cytochrome P450 gene is differentially expressed in compatible and incompatible interactions between pepper (Capsicum annuum) and the anthracnose fungus, Colletotrichum gloeosporioides [J]. Molecular Plant-Microbe Interactions, 1999, 12(12): 1044−1052. DOI: 10.1094/MPMI.1999.12.12.1044
[35] RALSTON L, KWON S T, SCHOENBECK M, et al. Cloning, heterologous expression, and functional characterization of 5-epi-aristolochene-1, 3-dihydroxylase from tobacco (Nicotiana tabacum) [J]. Archives of biochemistry and biophysics, 2001, 393(2): 222−235. DOI: 10.1006/abbi.2001.2483
-
期刊类型引用(1)
1. 宋慕波,孙翊然,刘英健,农锦仙,刘云芬,何妹英,殷菲胧,陈振林. 米糠提取物处理对鲜切荸荠黄化的影响. 广东农业科学. 2024(01): 1-9 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: