Changes of Microbial Community in Agaricus bisporus Culture Substrate during Fermentation
-
摘要:目的 了解双孢蘑菇培养料发酵过程中微生物的群落动态变化趋势及其发挥的作用。方法 以优化的复合菌渣(金针菇和杏鲍菇菌渣)作为双孢蘑菇培养料的主要成分,采用PacBio平台、高通量 16S rDNA全长测序方法,分析双孢蘑菇培养料由建堆、第一次发酵、第二次发酵过程中的7个阶段(Ag1~Ag7)的细菌群落特征。结果 在7个阶段的发酵培养料中共获得的OUT数量分别为328、340、294、377、364、166、174个,共计715个,其中有161个 OTU 存在于发酵的7个阶段,涵盖了21 门 299 属399种的细菌。Fimicutes(厚壁菌门)、Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门),Gemmatimonadetes(芽单胞菌门)在7个阶段中丰度较高。在建堆和第一次发酵过程中Ureibacillus(解脲芽孢杆菌属)为主要优势类群,在第二次发酵过程中Limnochordaceae、S0134 terrestrial group、Thermobacillus(嗜热杆菌属)、Ruminiclostridium(瘤胃梭菌属)的相对丰度更高。在种分类水平,Ureibacillus thermophilus和Ureibacillus terrenus是建堆和第一次发酵过程中的优势菌种,Limnochordaceae属的菌种在第二次发酵中相对丰度最高。上述研究结果表明:在第二次发酵之前细菌种类和丰度随着发酵过程不断升高,第一次发酵和第二次发酵样本间细菌群落结构差异较大,并在二次发酵后显著降低,而且这些优势菌群主要参与物质降解,从而提高了双孢蘑菇培养料质量。结论 通过全长测序的方法能更好地在种水平对不同发酵阶段的优势菌种进行鉴定,同时还发现了很多未分类的细菌物种,为优化发酵培养料和提高双孢蘑菇产量提供了理论依据。
-
关键词:
- 双孢蘑菇 /
- 培养料 /
- 发酵 /
- 16S全长扩增子测序 /
- 细菌群落
Abstract:Objective Changes of the microbial community in fermentation of substrates for cultivating Agaricus bisporus were investigated.Method The microbial community characteristics of a compound A. bisporus culture substrates containing spent Flammulina velutiper and Pleurotus eryngii materials were monitored during the 7 stages, Ag1 to Ag7 from pile building to 1st and 2nd fermentation, using the high throughput 16S rDNA full-length sequencing of Pacbio platform.Result A total of 715 OTUs were obtained in the fermentation process (i.e., 328, 340, 294, 377, 364, 166, and 174 for each stage) with 161 OTUs commonly found in all stage. The microbes included 21 phyla, 299 genera, and 399 species. At phylum level, Fimicutes, Proteobacteria, Bacteroidetes, and Gemmatimonadetes had higher abundance in all 7 stages. The dominant genus in the substrate during the pile building and 1st fermentation stages was Ureibacillus, while Limnochordaceae, S0134_terrestrial_group, Thermobacillu, and Ruminiclostridium stood out in the 2nd fermentation stage. At species level, Ureibacillus thermophilus and Ureibacillus terrenus were dominant in the pile building and 1st fermentation stages. In the 2nd fermentation stage, the species in the genus of Limnochordaceae were the greatest in relative abundance. It appeared that the microbial abundance and diversity increased gradually before the onset of 2nd fermentation. The community structure of the substrate varied significantly between the 1st and the 2nd fermentation, but the deviation diminished significantly after the 2nd fermentation leaving mostly the dominant species that basically functioned to degrade the waste mushroom material enriching the fertilization effect.Conclusion The full-length sequencing technology clearly identified the dominant species unveiling many previously unclassified microorganisms. The results helped to better optimize the substrate fermentation process for an improved cultivation of A. bisporus. -
0. 引言
【研究意义】双孢蘑菇(Agaricus bisporus)是一种草腐生食用菌,在分类上属于担子菌门(basidiomycete),层菌纲(Hymenomycetes),伞菌目(Agaricales),因其味道鲜美,营养丰富,深受人们的喜爱,是目前世界上人工栽培最广泛、产量最高、消费量最大的食用菌[1]。双孢蘑菇的产量和品质依赖于优质的培养料,而优质的培养料离不开高质量的堆制发酵原料和正确的堆制发酵方法。培养料通过二次发酵,质量比常规发酵明显提高[2],播种后菌丝吃料快、结菇早、转潮快、菇质好、病虫害发生轻,特别适用于老菇房或大面积的基地栽培[3]。二次发酵技术的应用,使培养料充分腐熟,改善了培养料的理化性状,为双孢蘑菇的优质、高效生产提供了有利条件[4]。其中培养料的发酵是在微生物的作用下将培养原料中各种化学物质分解转化的过程,为双孢蘑菇菌丝的生长制造出一个高度适合的选择性基质, 因此培养料中微生物类群与丰度直接决定了培养料的质量[5-6]。【前人研究进展】近年来,高通量16s rDNA测序被广泛应用于分析和鉴定微生物的种类和多样性[7]。李云福等[8]利用16S rDNA测序,对双孢蘑菇不同发酵阶段的细菌群落特征进行了分析,发现微生物种类和数量在二次发酵中最高,而且生物群落结构呈现连续变化的规律。隽加香等[9]的研究发现二次料和三次料的细菌群落的丰富度和多样性均高于一次料,其中二次料中假黄单胞菌属Pseudomonas和高温多孢菌属Thermopolyspora丰度较高。然而由于目前常用的Illumina HiSeq/MiSeqd 16S rDNA 测序读长的限制,只能对其中某几个高变区进行测序分析,在物种分类鉴定准确度上难以达到一代测序的水平[10]。三代测序技术的高通量、长读长(>10 kb)和无GC碱基偏好性等优势弥补了二代测序的不足,可以不需要分离培养,即可获得群落中所有微生物的全长16S rDNA信息,实现更精准的物种分类和鉴定,更可靠的实验重复性和更稳定的结果 [11]。【本研究切入点】目前双孢蘑菇培养料一般都是以稻草为原料,采用发酵培养料栽培技术,制作培养料时主要还是经验性管理为主,因此培养料发酵质量稳定性不足,影响栽培成功率,对生产稳定性不利。利用优化的复合菌渣作为培养料培养双孢蘑菇具有省工、省时、操作简单、降低成本、效益等优势,但其再发酵过程中微生物群落组成及变化情况有待深入探讨。【拟解决的关键问题】利用三代测序技术 PacBio 全长测序平台,并使用优化的复合菌渣(金针菇和杏鲍菇菌渣)作为培养料的主要成分,探究双孢蘑菇培养料不同发酵过程中细菌的群落组成和动态变化,明确其对培养料的发酵产生的作用,为改善培养料的发酵质量提供理论支持。
1. 材料与方法
1.1 试验材料
栽培双孢蘑菇的培养料配方:24%牛粪,49%金针菇废料,24%杏鲍菇废料,1%轻质碳酸钙,1%豆粕,1%石灰(干物质占比)。建堆发酵前,提前将牛粪、金针菇废料、杏鲍菇废料建堆预湿;将牛粪、金针菇废料、杏鲍菇废料,根据生产计划,用铲车按比例采用三明治堆叠方式投料,并根据情况判断是否需要再补水,堆积发酵5 d。用抛料机进行抛料建堆,堆高约1.5~1.8 m,堆宽约5~6 m,长约25 m,调节料堆含水量至65%~68%,让料堆室外露天自然升温发酵;根据间隔7、6、5、4 d翻堆一次,翻堆时尽量让料内外翻动均匀。在这期间,第3次翻堆时添加石灰,第4次翻堆时添加豆粕、碳酸钙,翻堆时若料堆含水量偏低,应补水至65%~68%。
1.2 样品收集
物料混匀建堆,一直到进菇床前,期间依据生产工艺添加辅料,并根据料堆情况补水,一次发酵采用自然升温发酵,二次发酵为蒸汽巴氏消毒。
取样时期:Ⅰ:培养料预发酵后;Ⅱ:培养料堆积发酵第1次翻堆后;Ⅲ:培养料堆积发酵第2次翻堆后;Ⅳ:培养料堆积发酵第3次翻堆后;Ⅴ:培养料堆积发酵第4次翻堆后;Ⅵ:培养料二次发酵蒸汽巴氏消毒后;Ⅶ:培养料二次发酵全过程结束后。
取样方法为在料堆上、中、下 3层取样,每层平均取 3 个点,每个点取样200 g,将所有样品混匀后采用四分法,分装后立即干冰存放。取样物品用前要灭菌消毒,全程带无菌手套。每个时期的样品取6次重复。用于理化指标分析的样品,需鲜样测定的如pH、水分等参数在实验室当天测定,其余参数待取样后进行样品风干处理保存(风干样1 kg)后测定(表1)。
表 1 培养料理化指标Table 1. Physiochemical indicators of substrate编号
Sample ID取样时期
Sampling period干重
Dry weight/g水分
MoisturepH Ag1 建堆 47.07 73.92% 5.16 Ag2 一次翻堆 50.00 71.85% 5.35 Ag3 二次翻堆 50.48 72.26% 5.66 Ag4 三次翻堆 34.8 71.58% 5.55 Ag5 四次翻堆 52.24 71.56% 6.71 Ag6 二次发酵巴氏消毒结束 28.42 66.50% 8.36 Ag7 二次发酵全过程结束 43.95 62.08% 7.64 1.3 DNA提取及建库测序
采用PowerSoil® DNA Isolation Kit对不同阶段的发酵料堆培养基进行总DNA提取。使用NanoDrop 微量分光光度计对DNA浓度进行检测。提取样品总 DNA 后,根据全长引物序列合成带有 Barcode 的特异引物,进行 PCR 扩增并对其产物进行纯化、定量和均一化形成测序文库(SMRT Bell),建好的文库先进行文库质检,质检合格的文库用PacBio Sequel 进行测序。通过PacBio Sequel 的CCS自我矫正模式获得高质量的测序数据。
1.4 生物信息学分析
从原始数据中导出 CCS 序列,对 CCS 序列进行 Barcode 识别,长度过滤,去除嵌合体,得到高质量的扩增子序列。使用Usearch软件[12]对序列在97.0%的相似度水平下进行聚类、获得操作分类单元(Operational taxonomic unit,OTU),并统计每个 OTU的丰度。以SILVA[13]为参考数据库使用朴素贝叶斯分类方法对特征序列进行分类学注释,得到每个特征对应的物种分类信息,进而在各水平(门phylum、属genus、种species)统计各样品群落组成,利用QIIME(v1.8.0)软件生成不同分类水平上的物种丰度表,再利用R语言工具绘制成样品各分类学水平下的群落结构图。对单个样品中物种进行 Alpha 多样性分析,包括ACE、Chao1、PD_whole_tree、Shannon及Simpson指数。ACE、Chao1指数越大,表明群落的丰富度越高;PD_whole_tree、Shannon和Simpson指数越高,表明群落多样性越高。使用QIIME软件进行 Beta 多样性(Beta diversity)分析,比较不同样品在物种多样性方面存在的相似程度。
2. 结果与分析
2.1 测序数据评估及OUT分析
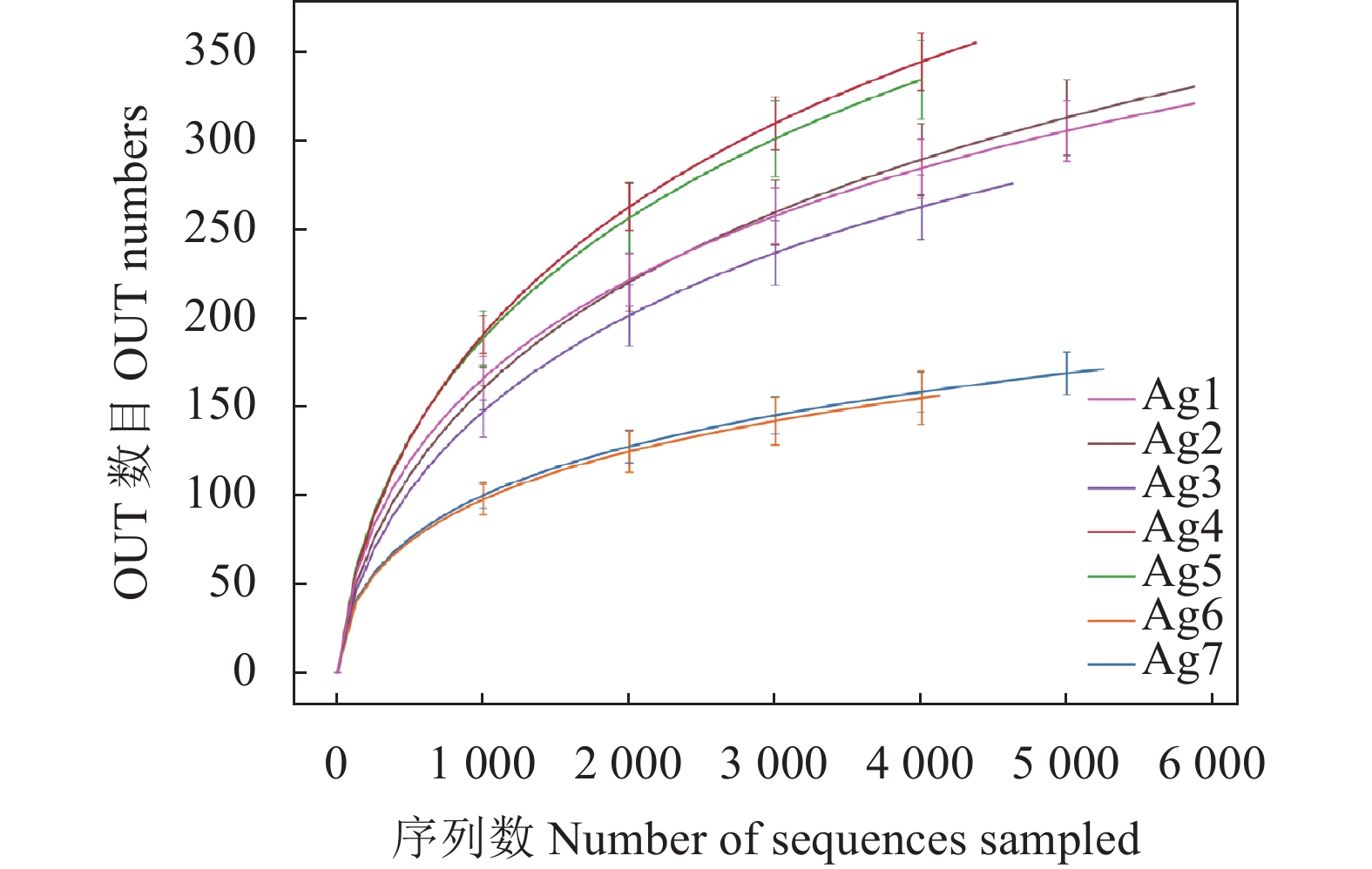
通过对不同样品的全长转录组测序,共获得314167条高质量的序列,每个样品至少产生 6 643 条序列,平均每个样品为 7 480 条序列,其中测序长度约为1.4 kb。每个时期的样本通过聚类得到OUT的平均数目分别为328、340、294、377、364、166、174个,共计715个,其中有161个 OTUs 存在于发酵的整个过程中。根据稀释曲线(Rarefaction)来评价样品的取样深度(图1),随着样品数量的增加,能检测到的物种数量逐渐增加,最后曲线末端上升趋势趋于平缓,说明样本量足够,本次测序结果可以代表不同发酵过程中细菌群落真实情况。
2.2 Alpha多样性分析
Alpha多样性指数(ACE、Chao1、PD_whole_tree、Shannon、Simpson)的统计和组间差异性统计检验表明(图2),ACE、Chao1、PD_whole_tree、Shannon指数在不同阶段的样品中存在显著性差异,其中在Ag4、Ag5阶段培养料中细菌物种的丰度和多样性显著高于其他阶段,Ag6、Ag7阶段物种的丰度和多样性较低。这些结果表明,由建堆到第一次发酵过程中细菌物种的数量和多样性在逐渐增加,而在经历了高温巴氏消毒后会明显杀死或抑制部分细菌的增殖,进而显著降低细菌物种的数量和多样性。
![]() 图 2 Alpha多样性指数组间差异柱状图A−B:不同样品的ACE和Chao1指数,纵坐标表示样品中的OUT数目;C−E: 不同样品的PD_whole_tree,Shannon和Simpson指数,纵坐标表示样品中物种多样性。*. 差异显著 (P<0.05); **. 差异极显著 (P<0.01)。Figure 2. Histogram of alpha diversity indexA-B: ACE and Chao1 indices of sample, Y-axis for number of OUT; C-E: PD_whole_tree and Shannon and Simpson indices of sample, respectively, Y-axis for species diversity; *: Significant difference at P<0.05; **: Extremely significant difference at P<0.01.
图 2 Alpha多样性指数组间差异柱状图A−B:不同样品的ACE和Chao1指数,纵坐标表示样品中的OUT数目;C−E: 不同样品的PD_whole_tree,Shannon和Simpson指数,纵坐标表示样品中物种多样性。*. 差异显著 (P<0.05); **. 差异极显著 (P<0.01)。Figure 2. Histogram of alpha diversity indexA-B: ACE and Chao1 indices of sample, Y-axis for number of OUT; C-E: PD_whole_tree and Shannon and Simpson indices of sample, respectively, Y-axis for species diversity; *: Significant difference at P<0.05; **: Extremely significant difference at P<0.01.2.3 Beta多样性分析
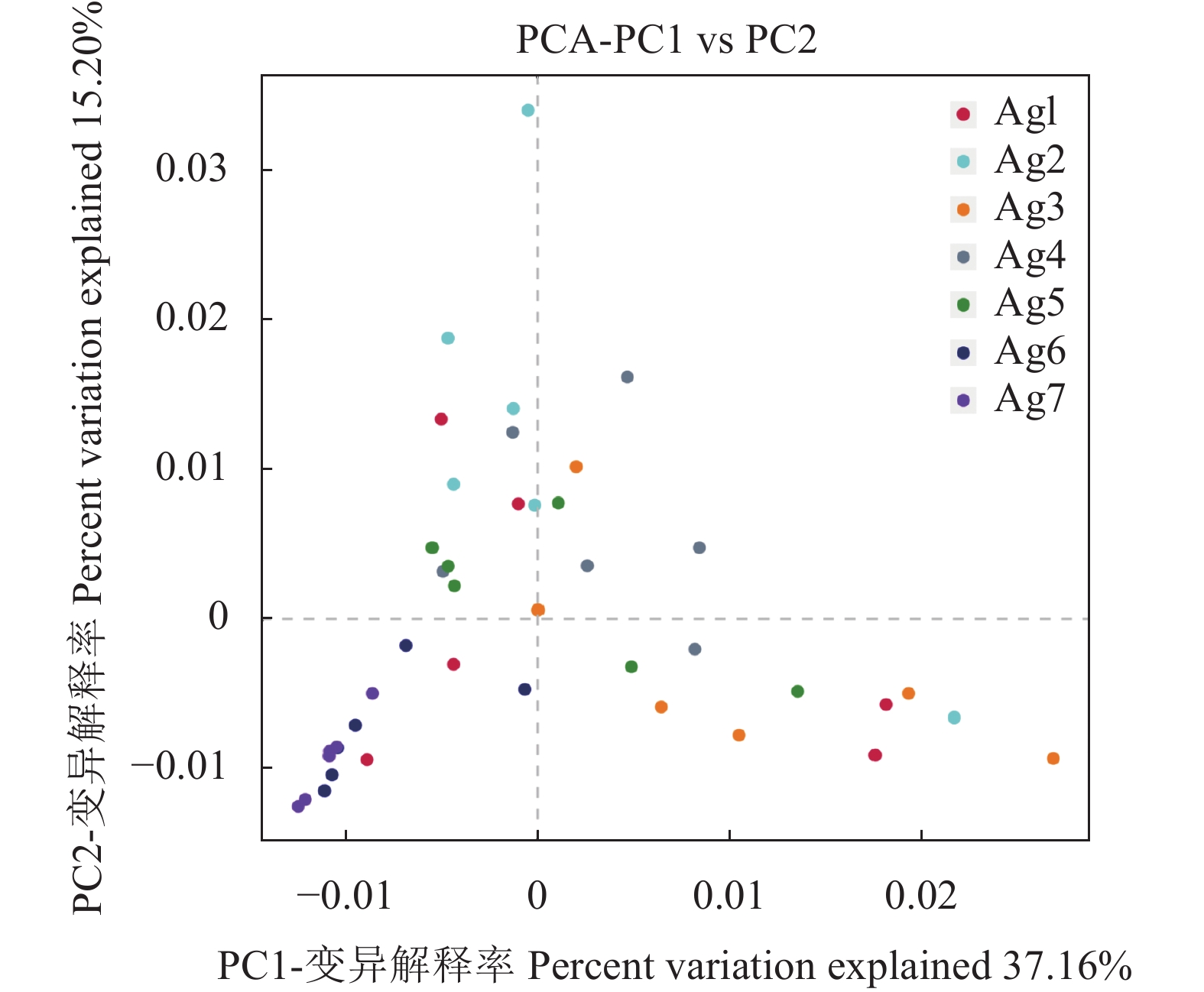
Beta多样性是比较不同样品在物种多样性方面存在的相似程度。通过PCA分析图可以看出(图3),根据 Beta 多样性的主坐标分析显示, 主成分因子 1( PC1)和主成分因子 2(PC2)的贡献率分别为37.16%和 15.20%,其中明显可以看出Ag7阶段样本间的差异较小,其次是Ag6,而在Ag1、Ag2、Ag3、Ag4、Ag5阶段的样本差异较大。这些结果表明在建堆到完成一次发酵的过程中,细菌的种类和数据会迅速增加,导致不同样品间物种多样性逐渐产生差异。随着高温巴氏消毒后,杂菌大量死亡,嗜热微生物大量繁殖消耗了易于降解的碳源,也会抑制其他细菌的增殖,进而导致Ag6和Ag7阶段细菌种类的减少以及样本间差异的缩小。
2.4 微生物门、属、种分类水平上的组成与丰度
在门水平分析双孢蘑菇培养料发酵不同阶段样品菌群的组成和结构(图4),共注释到21个细菌门类。其中,Fimicutes(厚壁菌门)、Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门),Gemmatimonadetes(芽单胞菌门)是最主要的4个门,并在不同的发酵阶段有明显的变化。厚壁菌门在各阶段都占有绝对优势,在不同发酵阶段其相对丰度分别为 72.63% 、47.21%、78.77% 、59.63%、70.16%、81.11%、49.30%。其次是变形菌门,在各阶段的平均相对丰度为17.41%、39.96%、12.68%、11.66%、10.36%、5.97%、15.03%。拟杆菌门的相对丰度为4.72%、10.83%、4.49%、24.82%、15.80%、0.41%、4.81%。芽单胞菌门的相对丰度为2.55%、0.42%、0.48%、0.90%、1.10%、9.47%、19.09%,而其他细菌种类比例相对较低。这些结果显示,培养料在不同发酵过程的菌落结构中,厚壁菌门、变形菌门、芽单胞菌门和拟杆菌门为主要优势菌群,而其他细菌类群为非优势菌群。发酵过程中的优势细菌种群存在显著演替,在第二次发酵后Ag7阶段芽单胞菌门和放线菌门相对丰度明显增加(19.09%和6.33%),同时酸杆菌门的相对丰度在二次发酵后也有较高的提升,因此这3个菌可以作为二次发酵阶段的标记菌群。
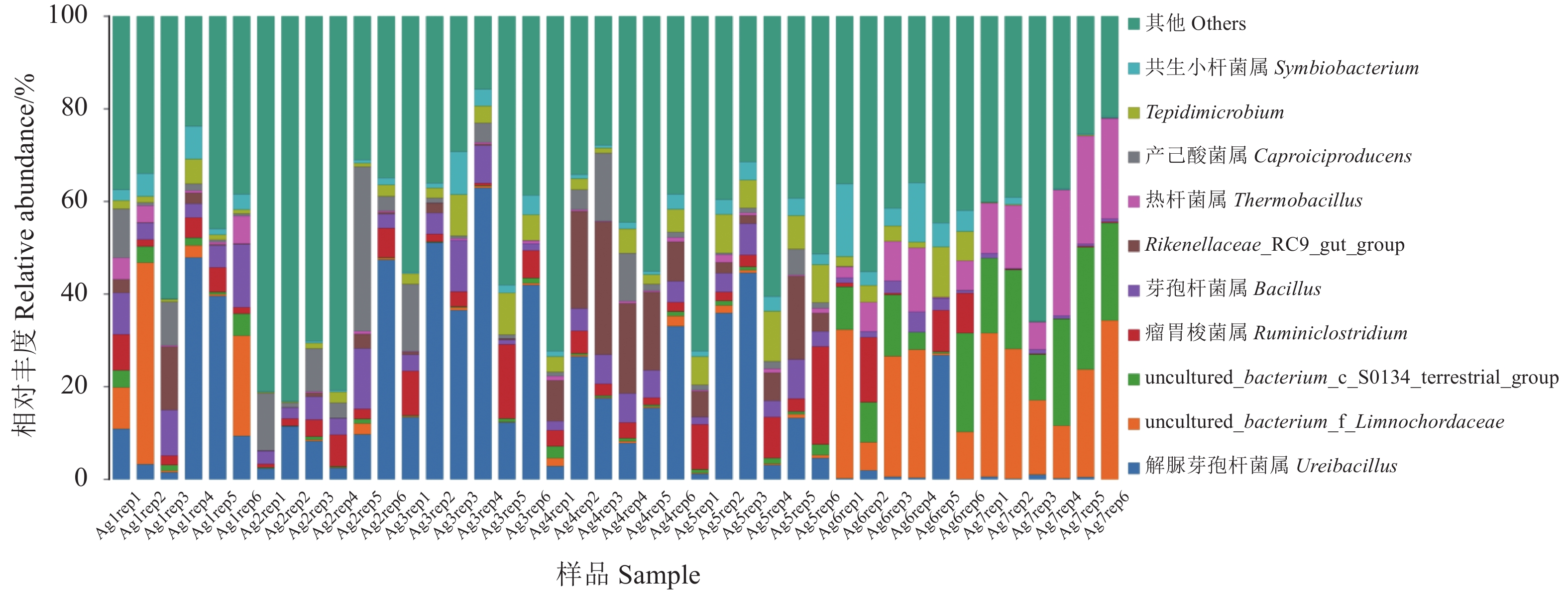
分析各样品在属分类水平上菌群的组成和结构(图5) ,共注释到299个属。Ureibacillus(解脲芽孢杆菌属) 是属水平优势菌群,在第一次发酵各阶段占比较高,相对丰度依次为18.80%,13.64%,36.40%,17.23%、17.13%,在之后的Ag6和Ag7阶段其丰度逐渐降低为5.01%、0.44%,该菌种可作为第一次发酵中后期,即Ag3和Ag4阶段的标记物种。其次是两类不能培养菌属uncultured_bacterium_f_Limnochordaceae和uncultured_bacterium_c_S0134_terrestrial_group,相对丰度为12.90%/2.54%,0.53%/0.40%、0.29%/0.43%、0.86%/0.88%、0.72%/1.07%、17.11%/9.43%、23.99%/18.96%,特别在二次发酵中其相对丰度显著升高,转变为优势类群。研究还发现Thermobacillus(嗜热杆菌属) 在二次发酵Ag6和Ag7阶段中相对丰度也会显著升高,达到了6.29%和17.08%,这可能是巴氏消毒后为嗜热微生物提供适宜的生长环境。同时在样品中还检测到其他菌属Ruminiclostridium(瘤胃梭菌属),Bacillus(芽孢杆菌属),Thermobacillus(嗜热杆菌属),Caproiciproducens,Rikenellaceae_RC9_gut_group等,均属于厚壁菌门。
分析各样品在种分类水平上菌群的组成和结构(图6) ,共注释到399个种。
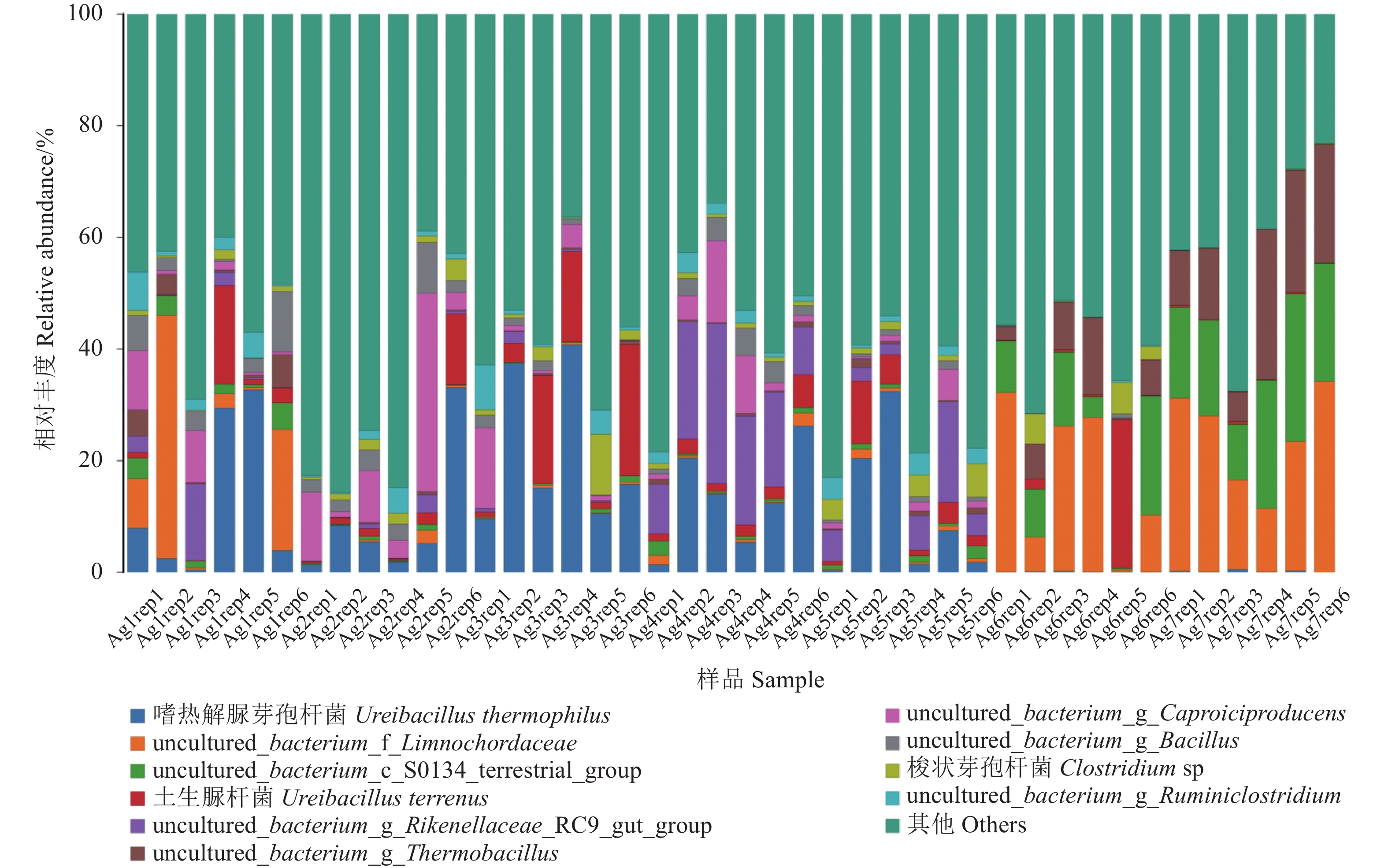
Ureibacillus thermophilus和Ureibacillus terrenus是种水平优势菌种,属于解脲芽孢杆菌属,相对丰度依次为18.80%/3.78%、13.64%/2.98%、36.40%/10.76%、17.23%/2.59%、17.13%/3.97%、5.01%/4.88%和0.44%/0.22%,在第一次发酵各阶段占比较高,而在第二次发酵过程中其丰度逐渐降低,这和属水平的结果相一致。而且uncultured_bacterium_of_Limnochordaceae、uncultured_bacterium_c_S0134_terrestrial_group和uncultured_bacteriumg_Thermbacillus在第二次发酵中相对丰度有明显升高(Ag7阶段),分别达到了23.99%,18.96%和16.34%,可以作为二次发酵阶段的标记菌种。同时还检测到了uncultured_bacterium_g_Rikenellaceae_RC9_gut_group、Clostridium_sp,uncultured_bacterium_g_Caproiciproducens、uncultured_bacterium_g_Bacillus、uncultured_bacterium_g_Ruminiclostridium等菌种。
3. 讨论与结论
本研究使用16S rDNA 全长测序技术,以复合菌渣作为培养料主要成分,检测双孢蘑菇培养料不同发酵阶段细菌群落结构的特征,共获得314 167条高质量的序列,鉴定了715个有效OTUs, 涵盖21 门299 属399种的细菌。微生物群落的动态变化与培养料中的碳水化合物降解有紧密关系,直接影响培养料的质量和产量[14]。有研究表明,随着培养料发酵的进行,微生物的数量均表现为先下降后上升的规律,其中细菌占比最高[15]。Alpha多样性指数分析结果表明在建堆后细菌物种的数量和多样性在逐渐增加,这可能是在开始阶段培养料中的营养含量丰富,导致杂菌快速增殖,细菌数量升高[16]。随着温度升高,在第二次发酵阶段嗜热微生物会大量繁殖,所以这种高温菌容易成为主导菌群进而抑制其他菌的增殖,导致细菌多样性指数下降[15]。
细菌群落结构分析结果显示,在建堆阶段厚壁菌门和变形菌门丰度最高,与之前报道的结果相一致[8]。在第一次发酵过程中,厚壁菌门丰度变化不大,变形菌门丰度降低而拟杆菌门升高,这说明发酵时间变长可以提高拟杆菌门的丰度。有研究表明,厚壁菌门和拟杆菌门可以通过分解水解酶如β-葡萄糖苷酶和木聚糖酶来降解碳源[17]。这些结果表明以复合菌渣和稻草作为培养料在发酵过程中的优势菌群组成是一致的。在属水平解脲芽孢杆菌属丰度最高,有研究报道解脲芽孢杆菌是一种产芽孢的革兰氏阴性嗜热菌,具有非常广的用途,可以产生氨基酸脱氢酶、过氧化氢酶和酯酶等重要酶类,还被用做降解木质纤维素生物质的生物催化剂[18-20],该属内的Ureibacillus thermophilus和Ureibacillus terrenus菌种在建堆和第一次发酵阶段丰度都相对较高,可能在物质降解过程中发挥重要作用。经过高温巴氏消毒后的第二次发酵阶段,芽单胞菌门的丰度变高,仅次于厚壁菌门,同时发现酸杆菌门的丰度在Ag7阶段显著提高。有研究发现,酸杆菌门的菌种会编码许多纤维素酶和半纤维素酶的基因,会对植物残体降解起到重要作用[21]。本研究发现尿素芽孢杆菌属的丰度在Ag6和Ag7阶段则降低至5.01%、0.44%。同时发现Limnochordaceae、嗜热杆菌属、Ruminiclostridium高温严格厌氧菌属的丰度均变高。高温严格厌氧菌属的菌株多发现于嗜热环境中,是发酵过程中的重要优势菌株[22-23]。有研究报道70 ℃ 以上的高温堆肥中嗜热杆菌属的菌种是主要的降解微生物[24],该结果也与之前的报道相一致[17]。相比以麦草和稻草为主进行双孢蘑菇堆肥而言,用菇渣堆肥其微生物的优势菌群组成是相似的,但在个别菌群的丰度变化却存在较大的差异[8]。
双孢蘑菇是当前发展前景最好的食用菌类之一,而培养料发酵质量的好坏对后期生产管理、产量与品质影响很大。近年来,利用菌渣替代麦草或稻草秸秆进行双孢蘑菇栽培,不仅原料来源较稻草、麦草易得,且在堆料时省工省时、易于操作。并通过条件和成分组成的优化,证明利用复合菌渣堆制发酵用于栽培双孢蘑菇,也取得了良好的效果[25-26]。而且随着测序技术的发展,通过高通量16S rDNA 全长测序技术可以更全面更准确地对样品中的微生物进行鉴定,在种水平对复合菌渣培养料中微生物的变化规律进行深入研究,推动复合菌渣培养料中有机物降解转化的理论研究,为提高双孢蘑菇培养基质发酵质量,实现双孢蘑菇的优质高产奠定基础。
-
图 2 Alpha多样性指数组间差异柱状图
A−B:不同样品的ACE和Chao1指数,纵坐标表示样品中的OUT数目;C−E: 不同样品的PD_whole_tree,Shannon和Simpson指数,纵坐标表示样品中物种多样性。*. 差异显著 (P<0.05); **. 差异极显著 (P<0.01)。
Figure 2. Histogram of alpha diversity index
A-B: ACE and Chao1 indices of sample, Y-axis for number of OUT; C-E: PD_whole_tree and Shannon and Simpson indices of sample, respectively, Y-axis for species diversity; *: Significant difference at P<0.05; **: Extremely significant difference at P<0.01.
表 1 培养料理化指标
Table 1 Physiochemical indicators of substrate
编号
Sample ID取样时期
Sampling period干重
Dry weight/g水分
MoisturepH Ag1 建堆 47.07 73.92% 5.16 Ag2 一次翻堆 50.00 71.85% 5.35 Ag3 二次翻堆 50.48 72.26% 5.66 Ag4 三次翻堆 34.8 71.58% 5.55 Ag5 四次翻堆 52.24 71.56% 6.71 Ag6 二次发酵巴氏消毒结束 28.42 66.50% 8.36 Ag7 二次发酵全过程结束 43.95 62.08% 7.64 -
[1] RAMOS M, BURGOS N, BARNARD A, et al. Agaricus bisporus and its by-products as a source of valuable extracts and bioactive compounds [J]. Food Chemistry, 2019, 292: 176−187. DOI: 10.1016/j.foodchem.2019.04.035
[2] VIEIRA F R, PECCHIA J A. An exploration into the bacterial community under different pasteurization conditions during substrate preparation (composting–phase II) for Agaricus bisporus cultivation [J]. Microbial Ecology, 2018, 75(2): 318−330. DOI: 10.1007/s00248-017-1026-7
[3] 杨立宇, 李金红. 双孢蘑菇培养料二次发酵简易技术 [J]. 现代农业科技, 2008(3):41. DOI: 10.3969/j.issn.1007-5739.2008.03.026 YANG L Y, LI J H. Simple technology of secondary fermentation of Agaricus bisporus [J]. Modern Agricultural Science and Technology, 2008(3): 41.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2008.03.026
[4] 曹海. 双孢菇高产优质高效栽培技术 [J]. 现代农业科技, 2013(17):143−144. DOI: 10.3969/j.issn.1007-5739.2013.17.086 CAO H. High yield, high quality, and high efficiency cultivation technology of Agaricus bisporus [J]. Modern Agricultural Science and Technology, 2013(17): 143−144.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2013.17.086
[5] MORETTI M M, BOCCHINI-MARTINS D A, SILVA R D, et al. Selection of thermophilic and thermotolerant fungi for the production of cellulases and xylanases under solid-state fermentation [J]. Brazilian Journal of Microbiology, 2012, 43(3): 1062−1071. DOI: 10.1590/S1517-83822012000300032
[6] SHARMA H S S, LYONS G, CHAMBERS J. Comparison of the changes in mushroom (Agaricus bisporus) compost during windrow and bunker stages of phase I and II [J]. Annals of Applied Biology, 2000, 136(1): 59−68. DOI: 10.1111/j.1744-7348.2000.tb00009.x
[7] 秦宇蒙, 周笑犁, 管庆林, 等. 基于高通量测序分析番茄自然发酵过程中的真菌多样性 [J]. 福建农业学报, 2021, 36(9):1110−1118. DOI: 10.19303/j.issn.1008-0384.2021.09.017 QIN Y M, ZHOU X L, GUAN Q L, et al. Fungal diversity in natural tomato fermentation as shown by high-throughput sequencing [J]. Fujian Journal of Agricultural Sciences, 2021, 36(9): 1110−1118.(in Chinese) DOI: 10.19303/j.issn.1008-0384.2021.09.017
[8] 李云福, 李正风, 董高峰, 等. 双孢蘑菇培养料发酵过程中细菌群落动态变化 [J]. 菌物研究, 2019, 17(2):94−102. DOI: 10.13341/j.jfr.2019.1253 LI Y F, LI Z F, DONG G F, et al. Dynamics of bacterial communities of Agaricus bisporus compost [J]. Journal of Fungal Research, 2019, 17(2): 94−102.(in Chinese) DOI: 10.13341/j.jfr.2019.1253
[9] 隽加香, 肖婷婷, 王倩, 等. 双孢蘑菇发酵培养料细菌菌群结构及其功能预测 [J]. 食用菌学报, 2019, 26(4):50−56. DOI: 10.16488/j.cnki.1005-9873.2019.04.007 JUAN J X, XIAO T T, WANG Q, et al. Microbial population during composting of Agaricus bisporus culture substrate and functional prediction thereof [J]. Acta Edulis Fungi, 2019, 26(4): 50−56.(in Chinese) DOI: 10.16488/j.cnki.1005-9873.2019.04.007
[10] MATSUMOTO T, SUGANO M. 16S rRNA gene sequence analysis for bacterial identification in the clinical laboratory [J]. Rinsho Byori the Japanese Journal of Clinical Pathology, 2013, 61(12): 1107−1115.
[11] 许亚昆, 马越, 胡小茜, 等. 基于三代测序技术的微生物组学研究进展 [J]. 生物多样性, 2019, 27(5):534−542. DOI: 10.17520/biods.2018201 XU Y K, MA Y, HU X X, et al. Analysis of prospective microbiology research using third-generation sequencing technology [J]. Biodiversity Science, 2019, 27(5): 534−542.(in Chinese) DOI: 10.17520/biods.2018201
[12] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Frontiers in Plant Science, 2013, 10(10): 996−998.
[13] PRUESSE E, QUAST C, KNITTEL K, et al. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB [J]. Nucleic Acids Research, 2007, 35(21): 7188−7196. DOI: 10.1093/nar/gkm864
[14] 高晓静, 张昊琳, 佟佳兴, 等. 不同配方双孢蘑菇培养料的细菌群落结构和理化性状 [J]. 应用与环境生物学报, 2017(3):502−510. GAO X J, ZHANG H L, TONG J X, et al. Bacterial community structure and physical-chemical properties of different formulations of cultivated mushroom(Agaricus bisporus) composts [J]. Chinese Journal of Applied and Environmental Biology, 2017(3): 502−510.(in Chinese)
[15] 刘灿, 生吉萍, 邹积华, 等. 双孢菇培养基堆制产热过程中微生物变化对其理化性质的影响 [J]. 食品科学, 2010(13):240−243. LIU C, SHENG J P, ZOU J H, et al. Effects of microbial changes on physical and chemical characteristics of Agaricus bisporus compost during fermentation [J]. Food Science, 2010(13): 240−243.(in Chinese)
[16] 侯晓伟, 王晓巍, 陈年来, 等. 双孢蘑菇培养料发酵微生物变化对其理化性质的影响研究 [J]. 中国农学通报, 2014, 30(25):111−115. DOI: 10.11924/j.issn.1000-6850.2014-0552 HOU X W, WANG X W, CHEN N L, et al. Study of the influence of microorganisms in the process of Agaricus bisporus compost fermentation on its physical and chemical properties [J]. Chinese Agricultural Science Bulletin, 2014, 30(25): 111−115.(in Chinese) DOI: 10.11924/j.issn.1000-6850.2014-0552
[17] WANG Y, LIU L, YANG J, et al. The diversity of microbial community and function varied in response to different agricultural residues composting [J]. Sci Total Environ, 2020, 715: 136983. DOI: 10.1016/j.scitotenv.2020.136983
[18] FORTINA M G, PUKALL R, SCHUMANN P, et al. Ureibacillus gen. nov., a new genus to accommodate Bacillus thermosphaericus (Andersson et al. 1995), emendation of Ureibacillus thermosphaericus and description of Ureibacillus terrenus sp. nov [J]. International journal of systematic and evolutionary microbiology, 2001, 51(2): 447−455. DOI: 10.1099/00207713-51-2-447
[19] AKITA H, FUJINO Y, DOI K, et al. Highly stable meso-diaminopimelate dehydrogenase from an Ureibacillus thermosphaericus strain A1 isolated from a Japanese compost: Purification, characterization and sequencing [J]. AMB Express, 2011, 1(1): 43. DOI: 10.1186/2191-0855-1-43
[20] ASADA C, SASAKI C, TAKAMATSU T, et al. Conversion of steam-exploded cedar into ethanol using simultaneous saccharification, fermentation and detoxification process [J]. BMC Microbiology, 2015, 176: 203−209.
[21] 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展 [J]. 生物技术通报, 2016, 32(2):14−20. DOI: 10.13560/j.cnki.biotech.bull.1985.2016.02.002 WANG G H, LIU J J, YU Z H, et al. Research Progress of Acidobacteria Ecology in Soils [J]. Biotechnology Bulletin, 2016, 32(2): 14−20.(in Chinese) DOI: 10.13560/j.cnki.biotech.bull.1985.2016.02.002
[22] SLOBODKIN A I, TOUROVA T P, KOSTRIKINA N A, et al. Tepidimicrobium ferriphilum gen. nov. , sp. nov. , a novel moderately thermophilic, Fe(III)-reducing bacterium of the order Clostridiales[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(pt 2): 369-372.
[23] WANG K, MAO H, LI X. Functional characteristics and influence factors of microbial community in sewage sludge composting with inorganic bulking agent [J]. Bioresource Technology, 2018, 249: 527−535. DOI: 10.1016/j.biortech.2017.10.034
[24] BEFFA T, BLANC M, LYON P F, et al. Isolation of Thermus strains from hot composts (60 to 80 degrees C) [J]. EBioMedicine, 1996, 62(5): 1723−1727.
[25] 袁滨, 柯丽娜, 洪丽明, 等. 双孢蘑菇新品种筛选试验与示范研究 [J]. 热带农业科学, 2018, 38(5):62−65,70. YUAN B, KE L N, HONG L M, et al. Screening trial and demonstration of new strains of Agaricus bisporus [J]. Chinese Journal of Tropical Agriculture, 2018, 38(5): 62−65,70.(in Chinese)
[26] 柯斌榕, 蔡志英, 卢政辉, 等. 杏鲍菇和金针菇菌渣堆肥的发酵特性及双孢蘑菇栽培试验 [J]. 江苏农业科学, 2018, 46(22):153−155. DOI: 10.15889/j.issn.1002-1302.2018.22.035 KE B R, CAI Z Y, LU Z H, et al. Fermentation characteristics of spent mushroom substrate of Pleurotus eryngii and Flammulina velutiper and cultivation test of Agaricus bisporus [J]. Jiangsu Agricultural Sciences, 2018, 46(22): 153−155.(in Chinese) DOI: 10.15889/j.issn.1002-1302.2018.22.035




 下载:
下载: