SYBR Green I-based RT-PCR Assay for Detecting IFN-β mRNA in Duck
-
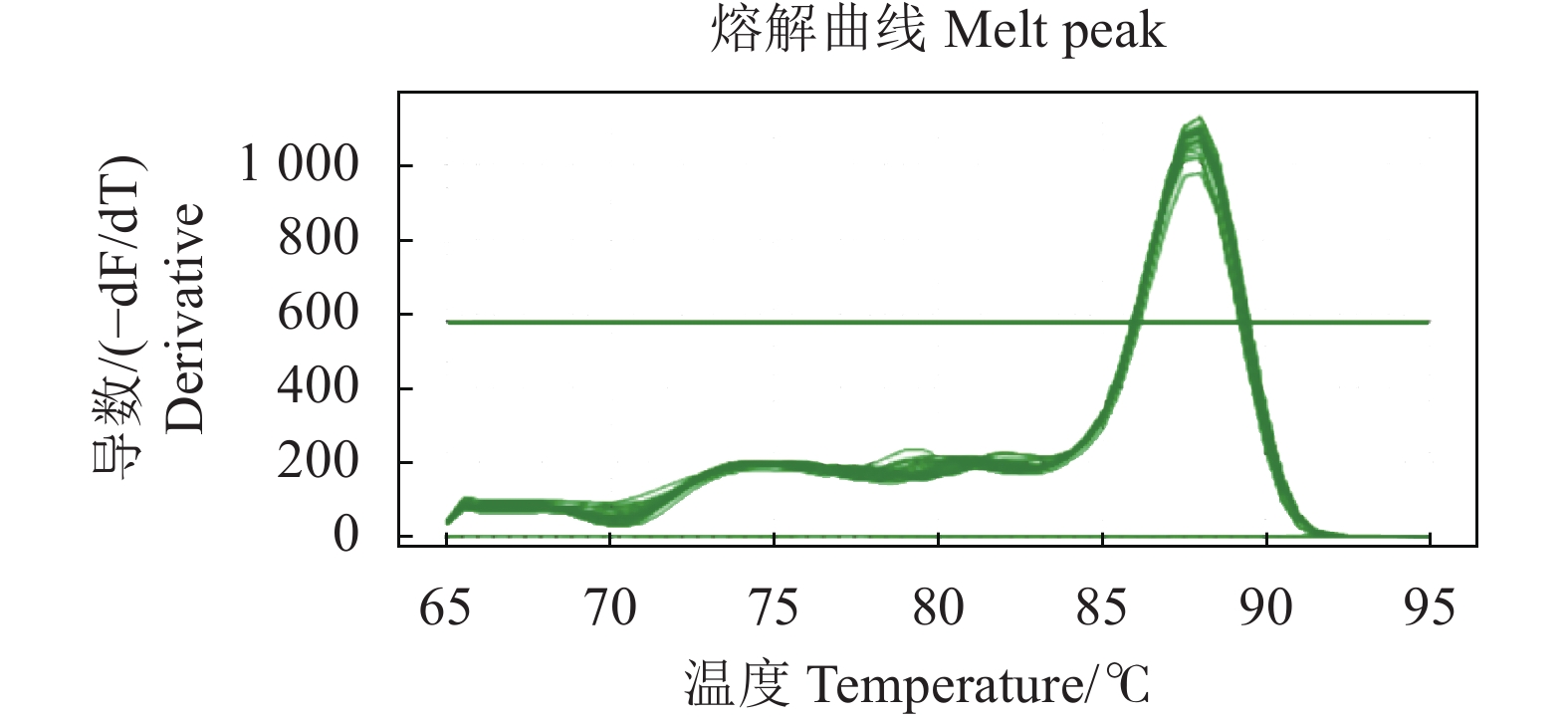
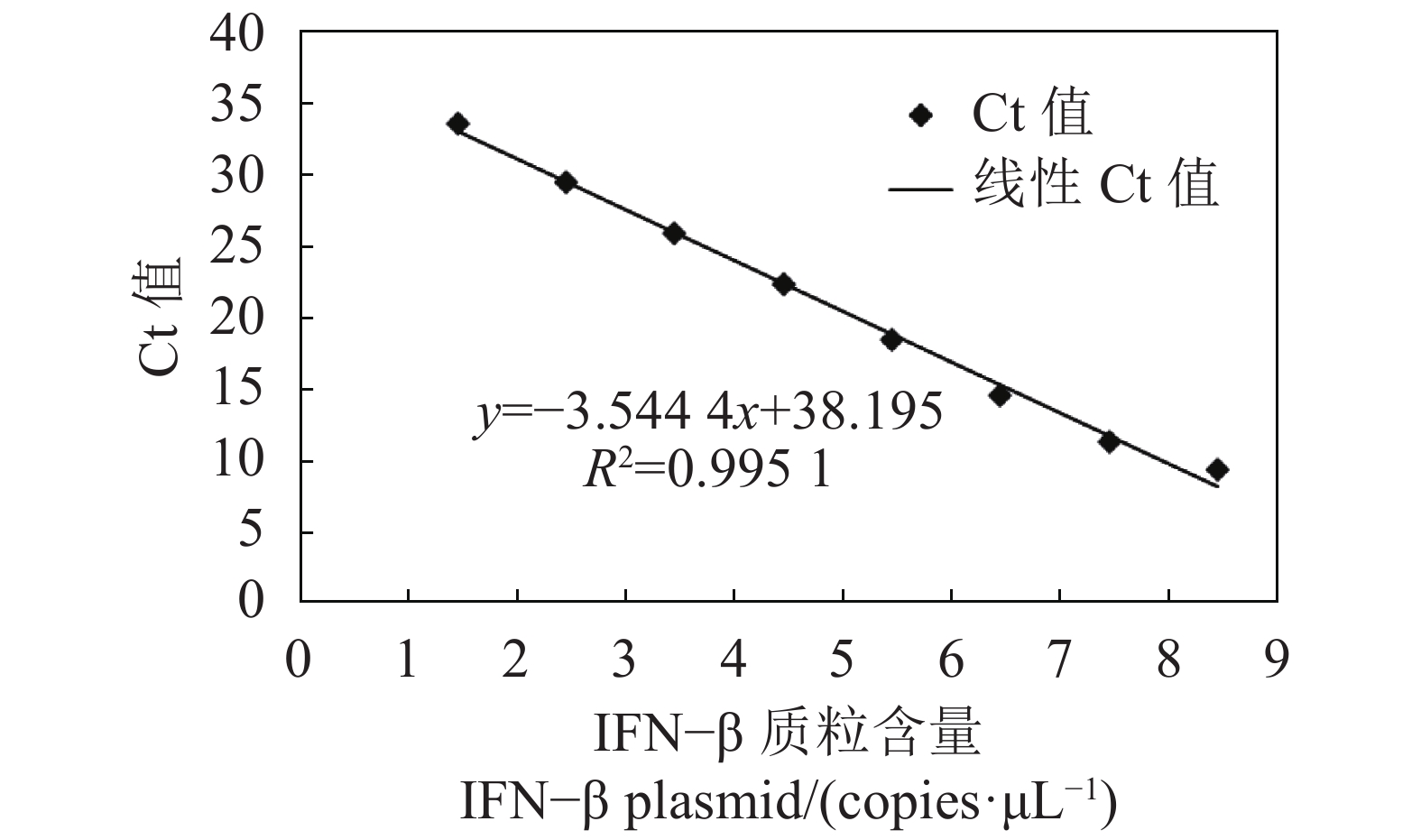
摘要:目的 建立一种检测鸭IFN-β mRNA转录水平的SYBR Green Ⅰ实时荧光定量RT-PCR检测方法。方法 根据GenBank中鸭IFN-β(KT428159)核苷酸序列设计并合成特异性引物,将鸭IFN-β基因克隆至pET-30a载体,以此构建的pET-30a-IFN-β阳性重组质粒作为阳性标准品,采用SYBR Green Ⅰ实时荧光定量PCR检测,构建标准曲线,并进行引物特异性、灵敏度及重复性试验。结果 该扩增特异性强,无引物二聚体及非特异性产物,熔解曲线单峰(Tm=87.94±0.16 ℃);Ct值在8.9~34.0线性拟合程度高,相关系数R2>99.5%;灵敏度高,最低检测限为2.84 copies·μL−1;重复性好,对来自临床的3种组织样品检测的组内变异系数小于0.13%,组间变异系数不超过1%。结论 该方法特异性强、灵敏度高、重复性好,为鸭IFN-β mRNA表达水平的定量分析提供了技术手段。
-
关键词:
- 鸭 /
- IFN-β /
- 荧光定量RT-PCR /
- SYBR Green I /
- mRNA
Abstract:Objective A method for detecting IFN-β in duck using SYBR Green I-based RT-PCR was developed.Methods A pair of specific primers was designed according to the GenBank nucleotide sequence on IFN-β of duck (KT428159). The gene was cloned into a pET-30a vector, and the recombinant plasmid pET-30a-IFN-β severed to establish a standard curve. The specificity, sensitivity, and repeatability of the new methodology were determined.Result The melting curves of measurement showed a sharp single peak at Tm=87.94±0.16 ℃ without non-specific amplification and primer dimers, indicating high specificity of the methodology. The Ct value ranged from 8.9 to 34.0 with a standard curve showing a linearity with R2>99.5%. The detection limit on IFN-β was 2.84 copies/μL. The repeatability on the Ct data for the intra- and inter-groups had coefficients of variation below 0.13% and 1%, respectively.Conclusion The newly developed assay was specific, sensitive, repeatable, and suitable for the quantitative detection of IFN-β mRNA in ducks.-
Keywords:
- Duck /
- IFN-β /
- qRT-PCR /
- SYBR Green I /
- mRNA
-
0. 引言
【研究意义】水稻是世界上最重要的农作物之一,全球种植面积达1.43亿公顷,稳定的稻田生态系统对水稻的良好生长及水稻耕种的可持续发展具有重要意义[1]。土壤作为水稻的生长基质,是地球上最为庞大的“微生物仓库”,对推动生物地球化学循化及实现社会经济可持续发展具有重要的作用[2-3]。土壤微生物对维持稻田土壤肥力、调节土壤营养物质循化以及促进水稻的养分吸收具有重要意义,是维持稻田生态系统持续发展的重要驱动者[4-7],对水稻的生长及产量有深刻的影响[8]。【前人研究进展】近年来,对稻田土壤微生物的研究陆续开展,多数研究聚焦于稻田土壤细菌群落,对稻田土壤真菌的研究相对较少,尤其是关于水稻根际土壤酵母菌尚待深入研究。吴朝晖等[9]研究显示,土壤细菌和古菌群落主要受土壤速效养分影响。理鹏等[10]研究表明,粪肥的施用增加参与稻田氮循环细菌的丰度,对稻田土壤氮平衡起正向作用,且鸡粪和猪粪的施用会增加稻田病原菌,对稻田土壤健康有一定威胁。方萍等[11]通过研究施用微生物菌肥对水稻根际细菌的影响发现,施用微生物菌肥明显增加了水稻根际土壤细菌的数量。崔月贞等[12]通过研究新型肥料对汉中盆地水稻土壤微生物的影响发现,新型肥料可提高水稻土壤微生物的数量和改善微生物的群落结构。卓晨等[13]研究表明,水稻土壤细菌、真菌及绿藻可通过降低土壤中镉的生物利用率、调控水稻对镉的吸收转运、提高水稻抗氧化能力等途径缓解重金属镉对水稻毒害作用。张奇等[14]研究显示,水稻土壤真菌与细菌的比例会影响水稻土壤微生物碳源代谢,从而影响土壤微生态环境,最终影响水稻化感抑草作用。陆红飞[15]通过枯草芽孢杆菌和酵母菌配施对再生水灌溉土壤生境和水稻生理生化影响的研究发现,施加枯草芽孢杆菌和酵母菌会使土壤理化因子发生变化,并改变水稻的生理状态,从而提高水稻的产量。【本研究切入点】酵母菌作为土壤微生物群落的重要成员,与土壤生态系统各部分存在广泛联系,是土壤细菌及原生态掠食者的重要营养来源,对增加土壤养分、优化土壤环境、促进植物生长具有重要作用[15]。酵母菌作为一类单细胞真核微生物,在多数关于土壤微生物的研究中,酵母菌由于生物量占比较小,其在土壤生态系统中的作用往往不能被很好地呈现。目前以土壤酵母菌为研究对象的报道相对较少,关于水稻根际土壤酵母菌的研究相对匮乏。林芝市察隅县作为青藏高原地区为数不多种植水稻的地区,具有独特的地理环境和气候条件。本研究基于纯培养方法,对采自林芝市察隅县的17份水稻根际土壤样品进行酵母菌的分离,采用rRNA ITS区域序列分析与经典分类法对酵母菌进行鉴定,分析土壤酵母菌种群结构组成、多样性及土壤理化因子的差异性,解析其变化特征,并运用R 3.6.1分析酵母菌多样性及不同物种对根际土壤理化因子的响应特征。【拟解决的关键问题】研究该地区水稻根际土壤酵母菌多样性以及土壤理化因子对其的影响,为深入了解稻田生态系统根际生态过程,维持和提高稻田生态系统生产力提供理论依据,并为青藏高原特殊微生物资源的开发利用提供有价值的资源。
1. 材料与方法
1.1 研究区域概况及土样采集
青藏高原平均海拔超过4 000 m,素有“世界屋脊”之称,是地球上最独特的生态地理单元[16]。本研究区域位于西藏自治区林芝市察隅县(95°41′32″~98°45′08″ E、27°44′21″~29°32′42″ N),因地形特殊的原因,该区域既受到孟加拉湾暖湿气流的影响,又受到青藏高原高寒高压系统的影响,气候发生从热带或亚热带气候到温带、寒温带和寒带气候的垂直变化,年日照时数1 615.6 h,年平均气温为12.1 ℃,3~10月为雨季,全年降水量为791.3 mm,年均无霜期达215 d[17-18]。
2019年10月在察隅县竹巴村、格拥村、慈巴村等种植水稻的村落随机选择17个样点进行水稻根际土壤样品采集(图1)。除去表面杂质后,利用土壤采集器采用多点混合法采集靠近水稻植株根系的地下0~10 cm土壤样品。土样混合后分为2份,一份用于土壤理化因子的测定,另一份带回实验室后立即进行酵母菌的分离。pH值、温度的测定直接在采样点进行。
1.2 水稻根际土壤可培养酵母菌的分离及纯化
采用稀释涂布法分离林芝市察隅县水稻根际土壤酵母菌[19]。取土样10 g,加入无菌水90 mL,充分振荡30 min制成土壤混悬液,并分别稀释至10−3、10−4,用移液器取200 μL土壤稀释液涂布于酸化的YM、YPD以及PDA培养基平板上,每个处理设置3个重复,培养3~5 d后对酵母菌进行观察计数,纯化采用平板划线法。
1.3 水稻根际土壤可培养酵母菌的分子鉴定
采用rRNA ITS序列分析进行酵母菌鉴定。
1.3.1 DNA提取及扩增
DNA提取采用成都新百基生物科技有限公司-XPure Soil DNA Extraction Kit提取试剂盒进行。引物ITS1(5′- TCCGTAGGTGAACCTGCGG -3′),ITS4(5′-TCCTCCGCTTATTGATATGC -3′)。PCR扩增反应程序为:98 ℃ 3 min;98 ℃ 10 s,退火温度10 s,72 ℃ 10 s,36个循环;72 ℃ 5 min。1%琼脂糖凝胶检测扩增目标产物后送往成都丹凤科技有限公司进行测序。
1.3.2 序列分析
供试菌株rRNA ITS测序结果经人工校对后在GenBank核酸序列数据库中进行同源搜索,与已知酵母菌序列相似度为99%以上的,确定为同一种。
1.4 水稻根际土壤理化因子的测定
pH采用pH计测定,温度采用多功能参数仪测定;全氮、全磷及全钾送往四川蓝城检测技术有限公司检测;土壤含水量采用烘干法测定,称取100 g土壤,105 ℃烘箱内烘干6~8 h至恒重,称量土壤干重并计算各样点土壤含水量。
1.5 数据处理与分析
采用Excel 2019、R 3.6.1、SPSS 20.0等软件进行数据的处理与分析。Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数及Pearson相关系数均采用R 3.6.1进行计算。差异性分析使用SPSS 20.0软件中的Duncan’s检验法进行。
2. 结果和分析
2.1 林芝市察隅县各样点水稻根际土壤可培养酵母菌群落组成特征
如表1 所示,林芝市察隅县17个不同样点水稻根际土壤中获得的352株酵母菌,分属于10个属13个种,Candida、Papiliotrema、Solicoccozyma三个属分别分离出2个种,其余7个属均只分离出一个种。分析不同种水稻根际土壤酵母菌出现频率可知,C. podzolicus出现频率最高,为0.65,C. saturnus、S. cresolica、S. aeria三个种的出现频率最低,均仅在一个样点被分离到。分析不同种水稻根际土壤酵母菌相对丰度可知,C. podzolicus相对丰度最高,为0.36,其次是C. vartiovaarae,为0.23。综合出现频率和相对丰度可知,林芝市察隅县各样点酵母菌的优势种为C. podzolicus。
表 1 林芝市察隅县各样点水稻根际土壤可培养酵母菌种水平分布情况Table 1. Distribution of culturable yeasts at sampling sites种
Species1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 出现频率
Occurrence frequency相对丰度
Relative abundance拟郎比可假丝酵母 Candida pseudolambica 6 4 0.12 0.03 变容假丝酵母 Candida vartiovaarae 53 22 4 3 0.24 0.23 Cryptococcus podzolicus 10 10 11 13 8 17 7 11 14 17 7 0.65 0.36 土星形塞伯林德纳氏酵母 Cyberlindnera saturnus 12 0.06 0.03 Goffeauzyma gastrica 3 5 2 0.18 0.03 Neoascochyta exitials 13 6 0.12 0.05 Papiliotrema aspenensis 2 2 0.12 0.01 Papiliotrema laurentii 7 1 0.12 0.02 大仁红酵母 Rhodotorula dairenensis 1 2 0.12 0.01 Saitozyma podzolica 18 4 0.12 0.06 甲酚斯鲁夫酵母 Slooffia cresolica 8 0.06 0.02 Solicoccozyma aeria 1 0.06 0.00 Solicoccozyma terricola 8 26 10 1 2 1 0.35 0.14 2.2 林芝市察隅县各样点间水稻根际土壤可培养酵母菌相似性分析
为了解林芝市察隅县各样点间水稻根际土壤可培养酵母菌种类的相似性,计算各样点间水稻根际土壤可培养酵母菌种Jaccard相似性系数(图2),林芝市察隅县各样点间水稻根际土壤可培养酵母菌的Jaccard相似性系数范围在0.00~1.00,其中86组为极度不相似(0.00~0.25),占比63%,17组为中度不相似(0.25~0.50),占比13%,22组达到中度相似水平(0.50~0.75),占比16%,11组达到极度相似水平(0.75~1.00),占比8%。各样点间酵母菌物种组成不相似比例为76%,表明林芝市察隅县各样点水稻根际土壤可培养酵母菌种类存在较大差异。
2.3 林芝市察隅县各样点水稻根际土壤可培养酵母菌多样性指数
如图3所示,2号样点分离得到的酵母菌属数和种数最多,分属于7个属8个种,其次为1号样点,分属于5个属7个种,6号、7号等9个样点均仅分离得到1个种,属数和种数最少;采用SPSS 20.0对17个样点的酵母菌总丰度进行差异性分析可知,4号样点总丰度显著高于除10号样点外的其他样点,16号样点的总丰度则相对较低;就Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数而言,三者具有相同的变化趋势,2号样点这3种多样性指数均最高,分别为1.62、0.75和0.38,说明2号样点水稻根际土壤可培养酵母菌多样性丰富且均匀,其次为1号样点,分别为1.40、0.65和0.31。
![]() 图 3 林芝市察隅县各样点水稻根际土壤可培养酵母菌多样性指数差异性分析注:A:酵母菌物种数和属数;B:酵母菌总丰度;C:酵母菌多样性指数;H’:Shannon-Wiener多样性指数;D:Simpson多样性指数;J’:Pielou均匀度指数。不同字母标记的数据表明不同样点之间的差异显著(P<0.05)。Figure 3. Diversity indices of culturable yeasts at sampling sitesNote: A: numbers of yeast species and genera; B: yeast counts; C: yeast diversity indices; H’: Shannon index; D: Simpson index; J’: Pielou evenness index; data marked with different letters indicate significant difference between sites at P<0.05.
图 3 林芝市察隅县各样点水稻根际土壤可培养酵母菌多样性指数差异性分析注:A:酵母菌物种数和属数;B:酵母菌总丰度;C:酵母菌多样性指数;H’:Shannon-Wiener多样性指数;D:Simpson多样性指数;J’:Pielou均匀度指数。不同字母标记的数据表明不同样点之间的差异显著(P<0.05)。Figure 3. Diversity indices of culturable yeasts at sampling sitesNote: A: numbers of yeast species and genera; B: yeast counts; C: yeast diversity indices; H’: Shannon index; D: Simpson index; J’: Pielou evenness index; data marked with different letters indicate significant difference between sites at P<0.05.2.4 林芝市察隅县各样点水稻根际土壤理化因子差异性分析
采用SPSS 20.0对林芝市察隅县17个样点的水稻根际土壤理化因子指标进行差异性分析,结果显示(图4),林芝市察隅县17个样点的土壤理化因子存在着不同程度的差异。土壤全氮、全钾和全磷测定结果表明,17个样点间均存在显著的差异性(P<0.05),全氮范围在0.57~3.81 g·kg−1,其中2号样点显著高于其他样点(P<0.05),8号样点显著低于其他样点(P<0.05);全钾范围在16.49~29.79 g·kg−1,其中1号样点显著高于其他样点(P<0.05),3号样点显著低于其他样点(P<0.05);全磷范围在0.14~1.66 g·kg−1,其中2号样点显著高于其他样点(P<0.05),11号样点显著低于其他样点(P<0.05);分析土壤含水量可知,土壤含水量范围在16.38%~50.34%,3号样点含水量最高,为50.34%,显著高于其他样点(P<0.05),17号样点含水量最低,为16.38%,显著低于其他样点(P<0.05);就土壤温度而言,土壤温度范围为20.07~25.10 ℃,5号样点显著高于其他样点(P<0.05),为25.10 ℃,12号样点显著低于其他样点(P<0.05),为20.07 ℃;就土壤pH而言,范围在5.88~8.05,其中9号样点最高,为8.05,显著高于其他样点(P<0.05),10号样点最低,为5.88,显著低于其他样点(P<0.05)。
2.5 林芝市察隅县各样点水稻根际土壤理化因子与可培养酵母菌多样性指数间的相关性分析
采用R 3.6.1对不同样点水稻根际土壤理化因子与可培养酵母菌多样性指数进行Pearson相关性分析并绘制成图。如图5所示,土壤酵母菌种数、属数、Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数两两之间呈极显著正相关(P<0.01),总丰度与Simpson多样性指数呈显著正相关(P<0.05)。
![]() 图 5 林芝市察隅县各样点水稻根际土壤理化因子与可培养酵母菌多样性指数Pearson相关性分析注:*:在0.05水平上显著相关;**:在0.01水平上极显著相关。Figure 5. Pearson correlation coefficients between culturable yeast diversity indices and physiochemical properties of rhizosphere soil at sampling sitesNote: * indicates significant correlation at P<0.05; ** indicates significant correlation at P<0.01.
图 5 林芝市察隅县各样点水稻根际土壤理化因子与可培养酵母菌多样性指数Pearson相关性分析注:*:在0.05水平上显著相关;**:在0.01水平上极显著相关。Figure 5. Pearson correlation coefficients between culturable yeast diversity indices and physiochemical properties of rhizosphere soil at sampling sitesNote: * indicates significant correlation at P<0.05; ** indicates significant correlation at P<0.01.水稻根际土壤理化因子间的相关性分析表明,全氮与全磷、含水量呈极显著正相关(P<0.01),含水量与全钾呈显著负相关(P<0.05),与全磷呈极显著正相关(P<0.01)。
水稻根际土壤理化因子与可培养酵母菌多样性指数相关性分析显示,酵母菌种数和属数与全氮和全磷呈极显著正相关(P<0.01);酵母菌Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数与全氮呈极显著或显著正相关(P<0.05);Shannon-Wiener多样性指数与全磷呈显著正相关(P<0.05)。综上所述,全氮和全磷是影响林芝市察隅县水稻根际土壤酵母菌多样性的主要理化因子。
2.6 林芝市察隅县各样点水稻根际土壤理化因子与可培养酵母菌物种之间的相关性分析
各样点水稻根际土壤理化因子与不同酵母菌物种间的相关性分析表明(图6),全氮与C. pseudolambica、G. gastrica、P. aspenensis以及S. terricola呈显著正相关(P<0.05);全磷与G. gastrica和S. terricola呈极显著正相关(P<0.01),与C. pseudolambica呈显著正相关(P<0.05);含水量与P. aspenensis呈极显著正相关(P<0.01)。
![]() 图 6 林芝市察隅县各样点水稻根际土壤理化因子与不同酵母菌物种Pearson相关性分析注:*:在0.05水平上显著相关;**:在0.01水平上极显著相关。Figure 6. Pearson correlation coefficients between culturable yeast species and physiochemical properties of rhizosphere soil at sampling sitesNote: * indicates significant correlation at P<0.05; ** indicates significant correlation at P<0.01.
图 6 林芝市察隅县各样点水稻根际土壤理化因子与不同酵母菌物种Pearson相关性分析注:*:在0.05水平上显著相关;**:在0.01水平上极显著相关。Figure 6. Pearson correlation coefficients between culturable yeast species and physiochemical properties of rhizosphere soil at sampling sitesNote: * indicates significant correlation at P<0.05; ** indicates significant correlation at P<0.01.3. 讨论
本研究结果表明,C. podzolicus在林芝市察隅县17份水稻根际土壤中的分布和数量都表现出明显的优势。C. podzolicus为拮抗酵母菌,营养需求简单、遗传稳定且对多种病原菌具有控制作用[20],此类酵母可以通过重寄生和诱导宿主产生抗性的方式帮助宿主抵制病原菌的侵害,在重寄生过程中,酵母菌通过分泌大量的几丁质酶以及β-1,3-葡聚糖酶等活性物质瓦解其他菌的细胞壁或菌丝体,进而占据优势[21-22]。C. podzolicus具有的较强拮抗和重寄生能力,可能在一定程度上抑制了土壤中其他种类酵母菌的生长进而使其成为研究区域土壤酵母菌优势种。鉴于C. podzolicus在察隅县水稻根际土壤中的广泛分布,猜测C. podzolicus可能在优化稻田土壤微生物群落以及提升水稻的抗病性方面发挥着一定的作用。
水稻根际土壤理化因子差异性分析结果显示,不同样点土壤的理化因子存在着不同程度的差异。例如全氮、全钾和全磷在各样点间均存在显著差异,这可能是由于不同样点稻田的施肥类型以及施肥习惯差异所造成的。理鹏等[10]研究表明,不同的粪肥处理会导致稻田土壤理化性质的改变进而导致土壤微生物群落组成发生变化,这与本研究结果一致。
从酵母菌分布来看,1号和2号样点分布着较多种类的酵母菌,结合理化因子可以发现,1号和2号样点全氮和全磷含量均较高,Pearson相关性分析结果显示,全氮和全磷是影响林芝市察隅县水稻根际土壤酵母菌多样性的主要理化因子,全氮与C. pseudolambica、G. gastrica、P. aspenensis以及S. terricola呈显著正相关(P<0.05);全磷与G. gastrica和S. terricola呈极显著正相关(P<0.01),与C. pseudolambica呈显著正相关(P<0.05),较高的全氮和全磷含量是1号和2号样点酵母菌多样性较高并且以上酵母菌种类在1号和2号样点大量分布的可能原因。
水稻根际土壤理化因子的变化影响了水稻根际土壤微生物群落结构,微生物群落结构的改变又反过来影响土壤理化因子,两者相互影响,相互作用[10]。李鸿毅等[23]研究认为,pH及土壤温度对稻田土壤菌群分布具有显著影响,而本研究则显示,土壤全氮和全磷是影响察隅县稻田土壤酵母菌群落结构的主要理化因子,造成这种差异的原因可能是察隅县较高的年均温以及较适宜的土壤pH所导致的。目前国内尚未有对水稻根际土壤酵母菌的研究报道,但存在对天然湿地土壤酵母菌的研究。郭小芳等[24]研究表明,西藏拉鲁湿地土壤酵母菌多样性与土壤理化因子之间没有显著的相关性,张爱娣等[25]对滨海湿地土壤微生物多样性与土壤理化因子相关性研究表明,土壤全氮、全磷显著影响土壤微生物的多样性,本研究结果与后者结论一致,由此可推测,天然湿地与包括稻田在内的人工湿地具有相似性,但也有一定的差异。
植物根际微生物影响宿主植物的生长发育及生态适应,通过对植物根际土壤微生物群落进行改造,可增加其对营养物质的吸收效率,减少化肥的使用,从而带来环境和经济的效益[26-27]。王孝林等[28]研究表明,水稻根际微生物可影响其对氮利用的效率。因此开展水稻根际土壤微生物群落结构多样性研究对水稻合理种植具有重要意义。陆红飞[15]研究表明,水稻土壤理化因子与水稻生理指标之间存在不同程度的相关性。本研究中分离得到的部分酵母菌与土壤全氮和全磷存在显著相关性,而土壤全氮全磷会影响水稻的生长状况,今后我们将对根际酵母菌与水稻营养元素利用的关系开展更深层次的研究。
4. 结论
采用稀释涂布法从林芝市察隅县17份水稻根际土壤样品中分离酵母菌,经典分类方法与分子鉴定技术结果表明,获得的352株酵母菌,分属于10个属13个种,其中C. podzolicus为优势种。不同样点间酵母菌Jaccard相似性系数表明,察隅县水稻根际土壤酵母菌群落结构存在明显的空间异质性。水稻根际土壤理化因子与水稻根际土壤可培养酵母菌相关性分析结果可知,酵母菌种数和属数与全氮和全磷呈极显著正相关,根际土壤酵母菌Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数与全氮呈极显著或显著正相关性,酵母菌Shannon-Wiener多样性指数与全磷呈显著正相关,综上所述,土壤全氮和全磷是影响察隅县水稻根际土壤酵母菌群落组成的主要因素。
-
图 1 鸭IFN-β全基因的PCR扩增及重组质粒的构建
注:A,鸭脾脏IFN-β基因的扩增;B,重组质粒的IFN-β基因扩增;C,重组质粒的双酶切鉴定。
Figure 1. PCR amplification of duck IFN-β and construction of recombinant plasmid
Note: A: amplification of IFN-β from duck spleen; B: IFN-β amplification from recombinant plasmid; C: identification of recombinant plasmid by double restriction enzyme digestion.
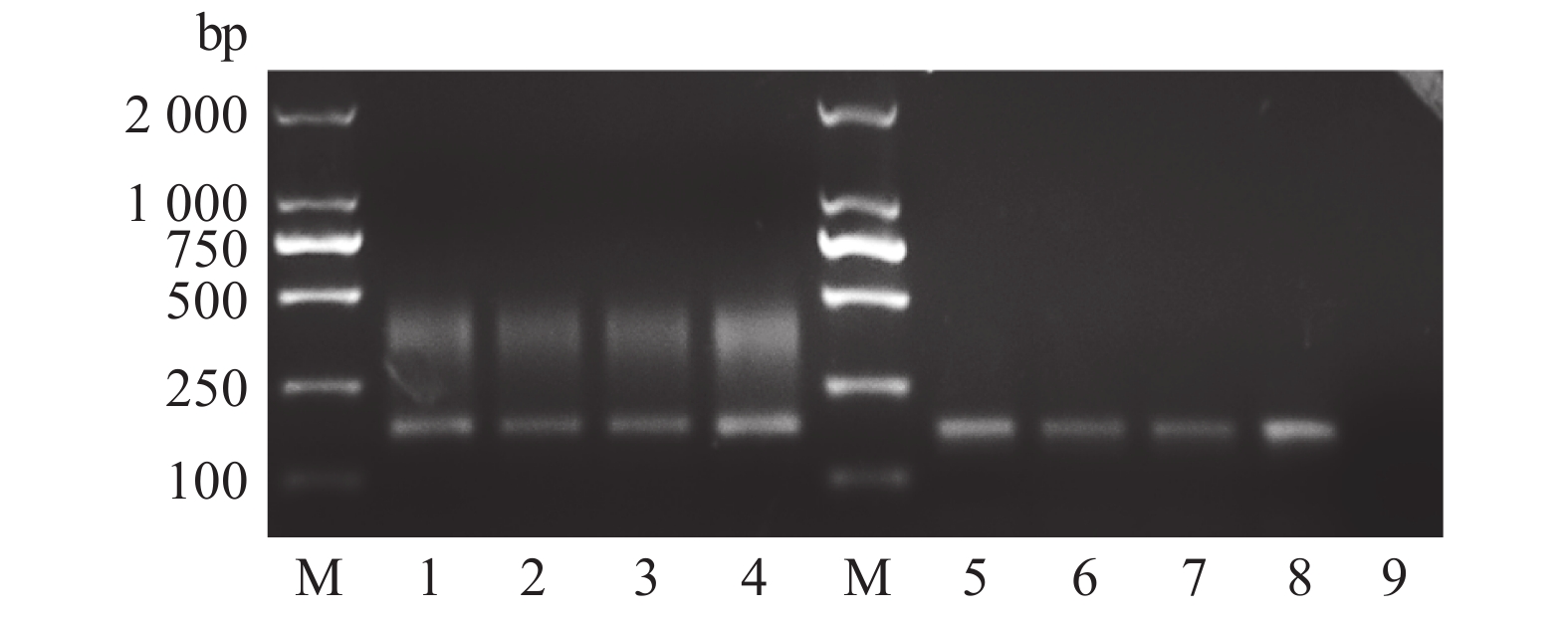
图 2 不同组织IFN-β的常规RT-PCR和荧光定量RT-PCR
注:1~4分别为脾脏、肝脏、胰腺及DEFs细胞的常规PCR扩增;M为DL 2000 DNA Marker;5~8分别为脾脏、肝脏、胰腺及DEFs细胞的qPCR扩增;9、DEPC水。
Figure 2. Conventional RT-PCR and qRT-PCR amplification of IFN-β in different tissues
Note: 1–4: conventional PCR amplification of IFN-β in spleen, liver, pancreas, and DEFs cells, respectively; M: DL 2000 DNA marker; 5–8: qPCR amplification of IFN-β in spleen, liver, pancreas, and DEFs cells, respectively; 9: DEPC water.
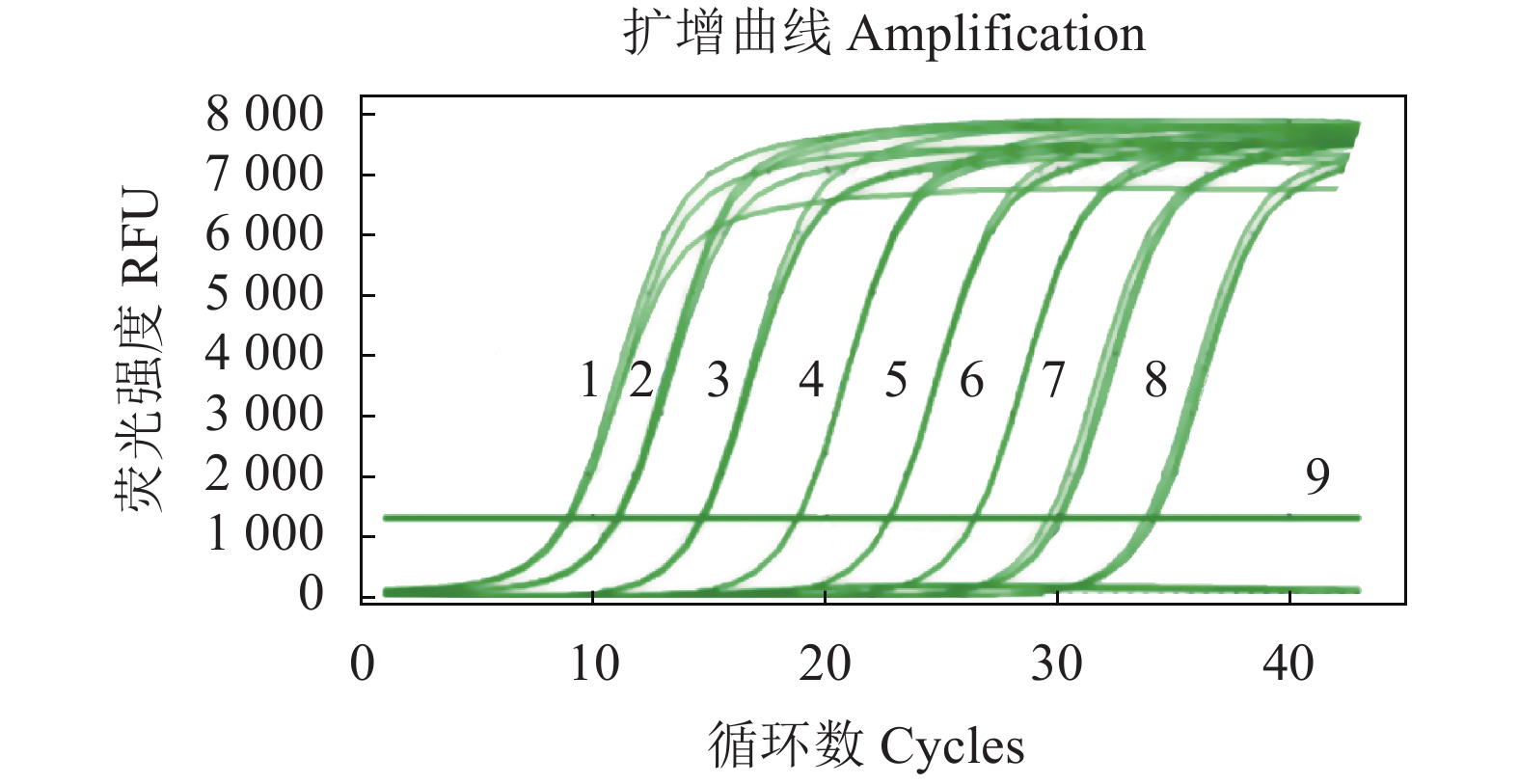
图 4 IFN-β 荧光定量RT-PCR扩增曲线
注:1~8分别为2.84×108、2.84×107、2.84×106、2.84×105、2.84×104、2.84×103、2.84×102、2.84×101 copies·μL−1;9、DEPC水。
Figure 4. Amplification curve of qRT-PCR for IFN-β
Note: 1–8: 2.84×108, 2.84×107, 2.84×106, 2.84×105, 2.84×104, 2.84×103, 2.84×102, and 2.84×101 copies·μL−1, respectively. 9: DEPC water.
表 1 引物核苷酸序列及扩增片段大小
Table 1 Primer sequences and amplified fragment sizes
引物
Primers核苷酸序列
Nucleotide sequence(5′-3′)扩增片段大小
Amplified fragment size/bpFull-IFN-β-F CGCGGATCCATGCCTGGGCCATCAGC 729 Full-IFN-β-R CCCAAGCTTTCACGCCGTGGGCTTGT qIFN-β-F GGGCTCCGCAACCTTCACC 165 qIFN-β-R TGCTTGGCTCTTCATCCGCCGTA 注:下划线区域为酶切位点序列。
Note:The underlined parts are the sequences of restriction sites.表 2 实时荧光定量RT-PCR敏感性检测
Table 2 Sensitivity of qRT-PCR assay
质粒拷贝数
Copy number
/(Copies·μL−1)2.84×103 2.84×102 2.84×101 2.84×100 2.84×10−1 Ct值(平均值±标准差)
Ct (Means±SD)26.38±0.03 29.87±0.10 33.98±0.05 36.13±1.12 − 变异系数 CV/% 0.11% 0.33% 0.15% 3.10% − 表 3 实时荧光定量PCR方法的批内与批间重复性评价结果
Table 3 Reproducibility of intra- and inter-qRT-PCR assays
组织
Tissue组内重复性试验Ct值
The Ct values of intra-assay组间重复性试验Ct值
The Ct values of inter-assay平均值±标准差
Means±SD变异系数
CV/%平均值±标准差
Means±SD变异系数
CV/%脾 Spleen 26.13±0.03 0.11 26.37±0.21 0.80 肝 Liver 32.63±0.04 0.12 32.41±0.20 0.62 胰 Pancreas 31.51±0.04 0.13 31.54±0.30 0.95 -
[1] WALTER M R. The role of structure in the biology of interferon signaling [J]. Frontiers in Immunology, 2020, 11: 606489. DOI: 10.3389/fimmu.2020.606489
[2] RAI K R, SHRESTHA P, YANG B C, et al. Acute infection of viral pathogens and their innate immune escape [J]. Frontiers in Microbiology, 2021, 12: 672026. DOI: 10.3389/fmicb.2021.672026
[3] 万春和, 朱海侠, 陈红梅, 等. 番鸭IFN-α mRNA实时荧光定量RT-PCR检测方法的建立 [J]. 中国动物传染病学报, 2012, 20(4):63−68. DOI: 10.3969/j.issn.1674-6422.2012.04.012 WAN C H, ZHU H X, CHEN H M, et al. Development of a quantitative real-time PCR for detection of IFN-α mRNA of Muscovy ducks [J]. Chinese Journal of Animal Infectious Diseases, 2012, 20(4): 63−68.(in Chinese) DOI: 10.3969/j.issn.1674-6422.2012.04.012
[4] 刘澜澜, 庄艳娜, 于晓红, 等. 绿头鸭IFN-α的可溶性表达及其活性分析 [J]. 生物技术通报, 2014(11):142−146. LIU L L, ZHUANG Y N, YU X H, et al. Soluble expression and activity analysis of mallard IFN-Α [J]. Biotechnology Bulletin, 2014(11): 142−146.(in Chinese)
[5] 杨发龙, 谢秀兰, 汤承, 等. 鸭瘟病毒疫苗株与强毒株诱导雏鸭IFN-α mRNA在肝脏中表达的动态定量研究 [J]. 中国预防兽医学报, 2008, 30(8):647−650. YANG F L, XIE X L, TANG C, et al. Dynamics of IFN-α mRNA expression in liver of ducks infected with duck plague virus of different virulence [J]. Chinese Journal of Preventive Veterinary Medicine, 2008, 30(8): 647−650.(in Chinese)
[6] 高全新, 刘云霞, 程玉强, 等. 鸭IFN-β启动子双荧光素酶报告基因系统的构建及活性检测 [J]. 上海农业学报, 2018, 34(3):66−71. GAO Q X, LIU Y X, CHENG Y Q, et al. Construction and activity detection of dual luciferase reporter gene system for duck IFN-β promoter [J]. Acta Agriculturae Shanghai, 2018, 34(3): 66−71.(in Chinese)
[7] CHEN Z L, LUO G F, WANG Q X, et al. Muscovy duck reovirus infection rapidly activates host innate immune signaling and induces an effective antiviral immune response involving critical interferons [J]. Veterinary Microbiology, 2015, 175(2/3/4): 232−243.
[8] LI N, WANG Y, LI R, et al. Immune responses of ducks infected with duck Tembusu virus [J]. Frontiers in Microbiology, 2015, 6: 425.
[9] 张盼涛, 曾显营, 杨婧, 等. 鸭IFN-γ, IL-2 mRNA荧光定量RT-PCR方法的建立及应用 [J]. 中国预防兽医学报, 2013, 35(6):472−476. DOI: 10.3969/j.issn.1008-0589.2013.06.11 ZHANG P T, ZENG X Y, YANG J, et al. Establishment and application of a real-time assay for detecting of IFN-γ and IL-2 mRNA in ducks [J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(6): 472−476.(in Chinese) DOI: 10.3969/j.issn.1008-0589.2013.06.11
[10] PIZZATO M, ERLWEIN O, BONSALL D, et al. A one-step SYBR Green I-based product-enhanced reverse transcriptase assay for the quantitation of retroviruses in cell culture supernatants [J]. Journal of Virological Methods, 2009, 156(1/2): 1−7.
[11] TAKEUCHI O, AKIRA S. Innate immunity to virus infection [J]. Immunological Reviews, 2009, 227(1): 75−86. DOI: 10.1111/j.1600-065X.2008.00737.x
[12] 陈超, 池晓娟, 白庆玲, 等. 甲型流感病毒感染过程中干扰素介导的天然免疫应答机制 [J]. 生物工程学报, 2015, 31(12):1671−1681. CHEN C, CHI X J, BAI Q L, et al. Mechanisms underlying interferon-mediated host innate immunity during influenza A virus infection [J]. Chinese Journal of Biotechnology, 2015, 31(12): 1671−1681.(in Chinese)
[13] LI N, HONG T Q, LI R, et al. Cherry valley ducks mitochondrial antiviral-signaling protein-mediated signaling pathway and antiviral activity research [J]. Frontiers in Immunology, 2016, 7: 377.
[14] ZHANG H H, SONG X D, LI T X, et al. DDX1 from Cherry valley duck mediates signaling pathways and anti-NDRV activity [J]. Veterinary Research, 2021, 52(1): 9. DOI: 10.1186/s13567-020-00889-4
[15] LI N, JIANG S N, ZHAO J, et al. Molecular identification of duck DDX3X and its potential role in response to Tembusu virus [J]. Developmental and Comparative Immunology, 2020, 106: 103599. DOI: 10.1016/j.dci.2019.103599
[16] HE T Q, WANG M S, CHENG A C, et al. Duck enteritis virus pUL47, as a late structural protein localized in the nucleus, mainly depends on residues 40 to 50 and 768 to 777 and inhibits IFN-β signalling by interacting with STAT1 [J]. Veterinary Research, 2020, 51(1): 1−12. DOI: 10.1186/s13567-019-0731-2
[17] ZHANG W, JIANG B W, ZENG M, et al. Binding of duck tembusu virus nonstructural protein 2A to duck STING disrupts induction of its signal transduction cascade to inhibit beta interferon induction[J]. Journal of Virology, 2020, 94(9). DOI: 10.1128/jvi.01850-19.
-
期刊类型引用(1)
1. 王泽,潘虹伯,孙桂鸿,郭明雄. 西藏地区水稻病毒病及其病原初步调查与分析. 生物资源. 2024(01): 69-78 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载: