-
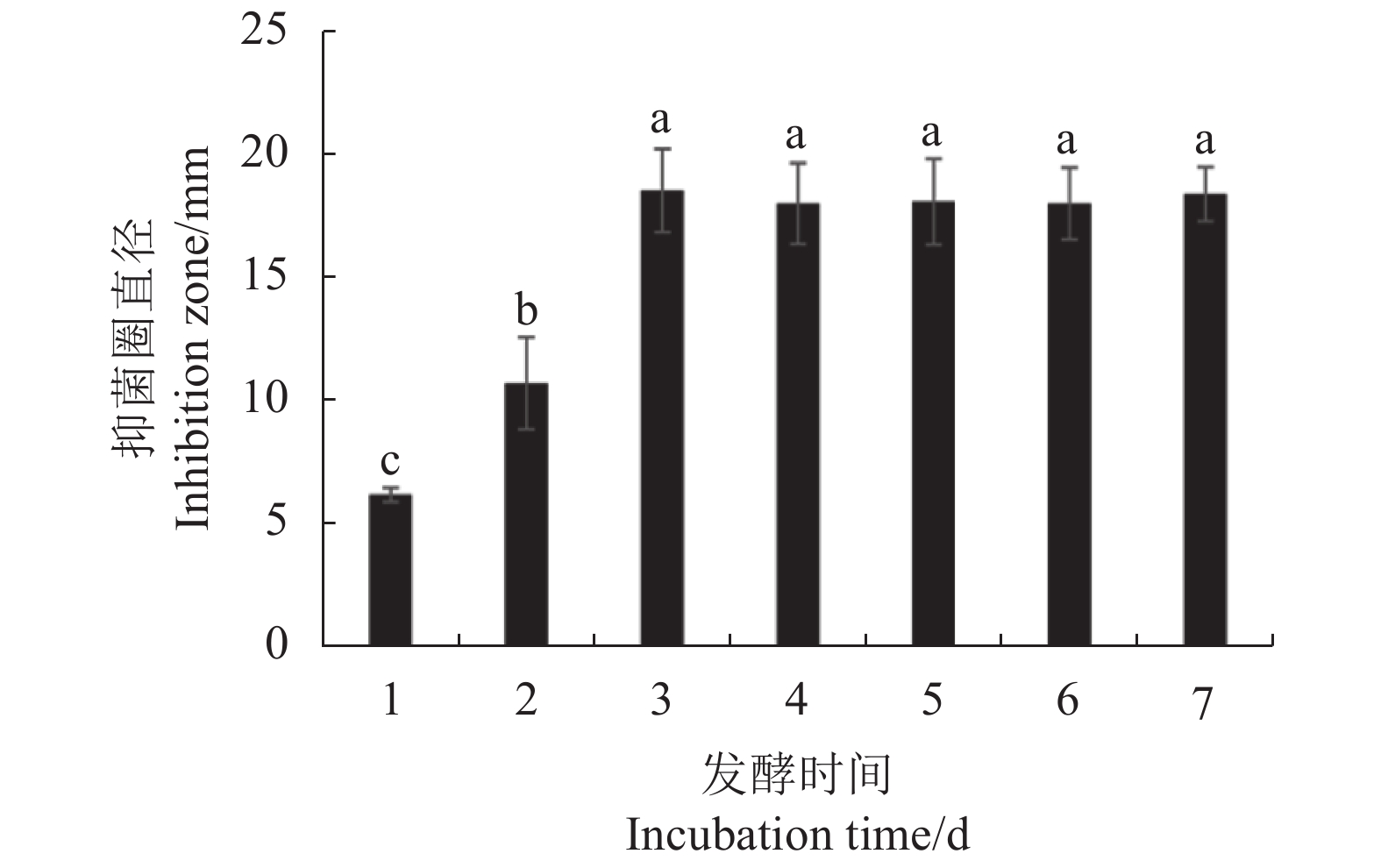
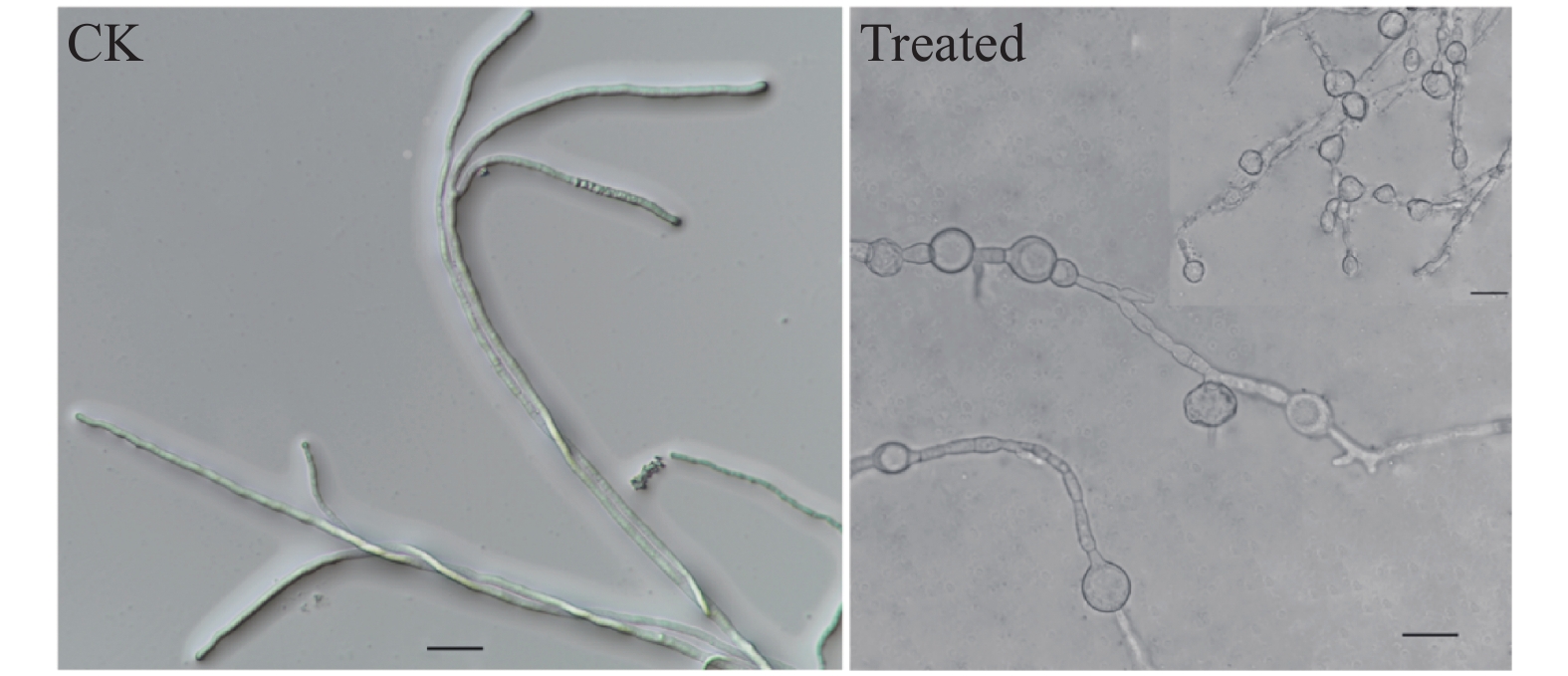
摘要:目的 杉木赤枯病是杉木的重要病害之一,严重威胁杉木苗木生产及幼树成林。为了更好保护杉木,防治杉木赤枯病,从杉木叶片分离到内生细菌SM-1,探讨其对杉木赤枯病菌(Pestalotiopsis apiculatus)的拮抗作用。方法 经形态观察、生理生化特性观察、16S rRNA及Biolog系统鉴定其种类;含毒平板及牛津杯法检测SM-1无菌发酵液对赤枯病菌的抑制率,并观察SM-1对赤枯病菌菌丝形态的影响;离体枝条的叶片接种试验检测SM-1无菌发酵液的防病效果。结果 SM-1为萎缩芽孢杆菌(Bacillus atrophaeus),其无菌发酵液对赤枯病菌的抑制率可达58.80%;显微观察显示SM-1能够使赤枯病菌菌丝生长受到抑制,细胞膨大成球形;离体枝条的叶片接种试验揭示SM-1无菌发酵液对杉木赤枯病的抑制效率达95%,能够极显著减轻叶片发病程度(P<0.01)。结论 杉木内生芽孢杆菌SM-1对杉木赤枯病具有良好的生物防治潜力。Abstract:Objective Endophytic bacteria that could effectively control the copper blight, one of the most significant diseases that seriously infects the seedlings and saplings, of Chinese fir (Cunninghamia lanceolate) were investigated.Methods Candidate endophytic bacteria were cultured and isolated from leaves of Chinese fir followed by morphological, physiological, and biochemical analyses as well as 16S rRNA sequencing for identification. Pathogen inhibition against Pestalotiopsis apiculatus by the sterile fermentation filtrate of potential specimens was tested on toxic plate and Oxford cup and observed under a microscope. Effectiveness of the disease control by the selected bacteria was further verified in vitro on fir leaves.Results The endophytic bacterium coded SM-1 showed a significant antagonistic effect against P. apiculatus. It was isolated and identified as Bacillus atrophaeus. On the toxic plate and Oxford cup tests, the SM-1 fermentation filtrate yielded a P. apiculatus inhibition rate of 58.80%. Morphologically, the bacterium inhibited the mycelial growth and caused cellular swelling that changed the cells spherical in appearance of the pathogen. The efficacy of the SM-1 filtrate on copper blight on the fir leaves was 95% with significantly reduced disease severity (P<0.01).Conclusion The SM-1, identified as B. atrophaeus, appeared to be a potential biocontrol agent to deter copper blight on Chinese fir.
-
0. 引言
【研究意义】近年来,随着社会经济发展与人们生活水平提升,心血管疾病发病率呈逐年上升趋势,已严重威胁人类健康。动脉粥样硬化是心血管系统疾病中最常见的疾病之一,也是心血管疾病共同的病理基础[1]。积极预防和控制动脉粥样硬化是预防心血管疾病、降低疾病发病率的重要手段。【前人研究进展】病理学研究结果表明,VSMC增殖是早期动脉粥样硬化形成的始动环节之一,成为心血管疾病防治研究的重要靶细胞[2]。同时,有研究发现,活性氧自由基(reactive oxygen species, ROS)与VSMC增殖相关。血管紧张素II、高糖等通过提高VSMC胞内ROS水平促进细胞增殖[3-4]。抗氧化剂调控ROS介导信号通路抑制VSMC增殖[5-6]。因此,以ROS清除剂筛选VSMC增殖抑制剂成为研究方向之一。【本研究切入点】海带是我国东南沿海常见的经济型养殖海藻,具有药食同源性,在我国多部古代医学典籍中均有记载其药学功效。多糖是海带主要的药效学活性成分,动物学试验研究结果表明,海带多糖可有效降低试验性大鼠血管脂质沉积,降低动脉粥样硬化风险[7]。本课题组前期研究发现海带多糖具有清除超氧阴离子(O2·−)活性,且抑制碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)诱导VSMC增殖[8-9]。已有研究发现H2O2通过调控O2·−介导信号通路促进VSMC增殖[10-11]。但是海带多糖对VSMC增殖抑制活性与其抗氧化活性相关性研究未见相关报道。【拟解决的关键问题】因此,本课题以氧化剂H2O2为诱导剂建立VSMC体外增殖模型,研究海带多糖对氧化剂诱导VSMC增殖及胞内过氧化物生成影响,为阐明海带多糖对VSMC的作用机制奠定基础。
1. 材料与方法
1.1 原料
海带多糖由本实验室制备,多糖含量为87.2%[8];DMEM培养基购自Gibco公司;胎牛血清(FBS)购自杭州四季青;丙二醛(MDA)检测试剂盒购自碧云天公司;二甲基亚砜(DMSO)、H2O2购自Sigma公司;动物细胞裂解液购自上海生工;MTT购自Biosharp公司;其他试剂均为国产分析纯。
1.2 主要仪器设备
BCM-1000超净工作台,苏州净化设备有限公司;HERAcell 150i CO2恒温培养箱,美国Thermo公司;TGL-16M 冷冻离心机,湖南湘仪;P10-Y超纯水系统,科尔顿有限公司;M3 酶标分析仪,美国MD公司;TS-100F 倒置显微镜,日本尼康公司;UV-2600紫外-可见光分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 细胞培养
VSMC由本实验室制备。细胞培养及传代:VSMC采用含10% FBS的DMEM培养液,于37℃、5% CO2培养箱内静置培养。待细胞生长汇合后,吸弃培养瓶内培养液,PBS缓冲液清洗细胞瓶,加入适量0.25%胰酶,37℃放置3 min,倒置显微镜下观察,待细胞呈悬浮,即加入完全培养液终止酶解反应。吸管反复轻轻吹打培养液以分散细胞团,取0.5 mL细胞悬液接种于新的培养瓶内,补加新鲜的完全培养液至3 mL。置于37℃、5% CO2培养箱静置培养。
1.3.2 H2O2诱导VSMC增殖模型构建
取浓度为1×105 个·mL−1 VSMC悬液接种96孔板,37℃、5% CO2培养箱静置培养24 h,待细胞完全贴壁后,用无血清的DMEM培养液37℃孵育8 h。加入H2O2溶液于96孔板至终浓度为设定浓度,对照组用无血清DMEM代替H2O2。孵育至12 h、24 h、36 h后加入MTT溶液(100 μg ·孔−1),孵育4 h后,弃上清液,加入DMSO(200 µL·孔−1)。振荡混匀,于578 nm下检测吸光值。每个试验组设定6孔平行孔。细胞增殖率计算公式:
增值率/%=AiAo×100 (1) 式中:Ai为H2O2模型组吸光值;Ao为对照组吸光值。
1.3.3 MTT法测定VSMC增殖
取对数生长期细胞悬液(1×105 个·mL−1)接种于96孔培养板中,200 μL·孔−1,待细胞贴壁后更换无血清培养液,37℃、5% CO2培养箱内静置过夜培养。吸弃培养液,向96孔板内分别加入0.1、0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置6个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间,加入MTT溶液(100 μg·孔−1),孵育4 h后,弃上清液,加入DMSO(200 µL·孔−1)。振荡混匀,于578 nm下检测吸光值。细胞增殖抑制率计算公式:
抑制率/%=Ao−AiAo×100 (2) 式中:A0 为H2O2模型组的吸光值;Ai为海带多糖试验组吸光值。
1.3.4 VSMC形态观察
取对数生长期细胞悬液(1×105 cells·mL−1)接种于6孔培养板中,1 mL·孔−1,待细胞贴壁后更换无血清培养液,37℃、5% CO2培养箱内静置过夜培养。吸弃培养液,向6孔板内分别加入0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置3个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间后于倒置显微镜下观察细胞形态。
1.3.5 MDA含量测定
按1.3.4方法处理细胞,待细胞经无血清培养液过夜饥饿处理后吸弃培养液,向6孔板内分别加入0.1、0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置3个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间后收集细胞,按碧云天MDA检测试剂盒说明操作,于532 nm下测定吸光值,并计算MDA含量。
1.3.6 数据分析
数据均采用SPSS 17.0软件进行统计学处理,均数±标准差表示,并对结果进行LSD-t检验。
2. 结果与分析
2.1 H2O2 诱导VSMC体外增殖模型的建立
本课题以H2O2为诱导剂建立VSMC体外增殖模型,结果如表1所示。在相同的H2O2浓度下,24 h试验组VSMC增殖率均高于12 h和48 h试验组。而在H2O2相同作用时间下,VSMC增殖率均随着H2O2浓度的增加呈先上升而后下降的趋势。在H2O2浓度为10~100 µmol·L−1时,VSMC增殖率随着H2O2浓度增高而增大。当时间为24 h,H2O2浓度为50 µmol·L−1时,VSMC增殖率达到142.54%,再增加H2O2浓度至100 µmol·L−1,其VSMC增殖率略有增加,但与50 µmol·L−1试验组相比,差异并不显著。而当H2O2浓度增加至150 µmol·L−1,其VSMC增殖率则有所下降。可见当H2O2浓度增大至150 µmol·L−1对VSMC具有细胞毒性,这与文献[12]报道一致。因此,本课题选择H2O2诱导VSMC增殖处理浓度为50 µmol·L−1,作用时间为24 h。
表 1 MTT测定VSMC增殖率Table 1. Viability of VSMCs determined by MTT assayH2O2浓度
H2O2Concentration/
(µmol·L−1)12 h 24 h 36 h 10 102.11±5.22 112.23±3.15 108.74±4.42 20 112.08±2.15 127.65±1.55 117.24±5.68 50 129.56±2.43 a 142.54±2.91 a 133.25±3.48 a 100 132.87±3.56 a 144.29±3.68 a 138.62±2.84 a 150 107.23±5.27 114.87±4.35 96.48±2.57 注:a: 与相同作用时间下H2O2浓度为10 µmol·L−1试验组比,P<0.05。
Note: a: during the same pretreatment time, indicated significant differences compared with the group of 10 µmol·L−1 H2O2, P<0.05. 2.2 海带多糖对VSMC增殖作用的影响
采用MTT法测定海带多糖对VSMC增殖影响,结果见图1所示。从图1可以看出,海带多糖预处理时间相同时,随着海带多糖预处理质量浓度的增加VSMC增殖抑制率增大,呈量效相关性。在相同海带多糖预处理时间下,与海带多糖预处理质量浓度为0.1 mg·mL−1试验组相比,海带多糖预处理质量浓度为0.5 mg·mL−1和1.0 mg·mL−1试验组VSMC增殖抑制率均显著增高(P<0.05)。当海带多糖预处理时间为12 h时,质量浓度为1.0 mg·mL−1海带多糖预处理试验组VSMC增殖抑制率为53.11%,是相同多糖预处理时间下0.1 mg·mL−1海带多糖预处理试验组的5.72倍。由此可见,海带多糖可抑制氧化剂H2O2诱导VSMC增殖。
![]() 图 1 海带多糖对H2O2诱导VSMC增殖抑制率注:a: 相同海带多糖预处理时间下,与0.1 mg·mL−1海带多糖试验组相比,P<0.05;b:相同海带多糖预处理浓度下,与预处理时间12 h海带多糖试验组相比,P<0.05。Figure 1. Effects of L. japonica polysaccharides on H2O2-induced VSMC proliferationNote: a: during the same pretreatment time of polysaccharide, indicated significant differences compared with the group of 0.1 mg·mL−1 polysaccharide, P<0.05; b: under the same concentration of polysaccharide pretreatment, indicated significant differences compared with the group of 12 h treatment with polysaccharide, P<0.05.
图 1 海带多糖对H2O2诱导VSMC增殖抑制率注:a: 相同海带多糖预处理时间下,与0.1 mg·mL−1海带多糖试验组相比,P<0.05;b:相同海带多糖预处理浓度下,与预处理时间12 h海带多糖试验组相比,P<0.05。Figure 1. Effects of L. japonica polysaccharides on H2O2-induced VSMC proliferationNote: a: during the same pretreatment time of polysaccharide, indicated significant differences compared with the group of 0.1 mg·mL−1 polysaccharide, P<0.05; b: under the same concentration of polysaccharide pretreatment, indicated significant differences compared with the group of 12 h treatment with polysaccharide, P<0.05.同时,由图1可以看出,当海带多糖预处理质量浓度高于0.5 mg·mL−1时,与多糖预处理时间12 h试验组相比,多糖预处理时间为24 h和48 h试验组VSMC增殖抑制率均显著增高(P<0.05),增殖抑制率均达到60%。其中,当海带多糖预处理质量浓度为1.0 mg·mL−1时,多糖预处理时间为24 h试验组VSMC增殖抑制率最大,达73.56%。因此,后续试验选择海带多糖预处理时间为24 h。
2.3 海带多糖对VSMC形态影响
由图2可知,H2O2模型组细胞透光性强,细胞边缘模糊,细胞呈伸展的梭状,且细胞密度大。海带多糖预处理试验组VSMC形态则出现显著变化,0.5 mg·mL−1海带多糖预处理试验组VSMC数目减少,且细胞胞质回缩,部分细胞呈圆形。1 mg·mL−1海带多糖预处理试验组VSMC密度显著降低,细胞边缘清晰,细胞胞质回缩,镜下可见大部分细胞呈圆形。由此可见,海带多糖可引起VSMC生长形态改变,随着海带多糖预处理浓度的增高,VSMC数量显著减少,且呈圆形的VSMC数量增多,表明海带多糖预处理后VSMC形态发生显著变化,使其增殖速度减慢。
![]() 图 2 VSMC形态(×100)注:A1:对照组,A2 :H2O2模型组,A3 :0.5 mg·mL−1 海带多糖+H2O2处理组,A4:1 mg ·mL−1海带多糖+H2O2处理组。Figure 2. Morphology of VSMC (×100)Note: A1: Control group; A2: H2O2 model group; A3: the group treatment with 0.5 mg·mL−1 polysaccharide and H2O2; A4: the group treatment with 1 mg·mL−1 polysaccharide and H2O2.
图 2 VSMC形态(×100)注:A1:对照组,A2 :H2O2模型组,A3 :0.5 mg·mL−1 海带多糖+H2O2处理组,A4:1 mg ·mL−1海带多糖+H2O2处理组。Figure 2. Morphology of VSMC (×100)Note: A1: Control group; A2: H2O2 model group; A3: the group treatment with 0.5 mg·mL−1 polysaccharide and H2O2; A4: the group treatment with 1 mg·mL−1 polysaccharide and H2O2.2.4 海带多糖对H2O2诱导VSMC胞 内MDA生成的影响
研究发现,H2O2诱导VSMC胞内大量累积ROS可促进VSMC胞内一系列脂质过氧化产物的生成[13-14],进而诱导细胞释放生长因子促使VSMC增殖[15-16],因此脂质过氧化物是评估VSMC胞内ROS水平的重要参数。本课题以MDA表征胞内脂质过氧化物生成量,结果如表2所示。
表 2 VSMC胞内MDA生成量Table 2. MDA concentration in VSMC样品Samples 丙二醛MDA/(µmol·L−1) 对照组 Control 1.94±0.05 H2O2模型组
H2O2 Model Group3.21±0.09 a 0.1 mg·mL−1海带多糖+H2O2
0.1 mg·mL−1Laminaria japonica polysaccharide+H2O22.91±0.04 0.5 mg·mL−1海带多糖+H2O2
0.5mg·mL−1Laminaria japonica polysaccharide+H2O21.75±0.08 b 1.0 mg·mL−1 海带多糖+H2O2
1.0 mg·mL−1Laminaria japonica polysaccharide+H2O21.27±0.05 b 注:a:与对照组相比,P<0.01;b:与H2O2模型组相比,P< 0.01。
Note: a: indicated significant differences compared with the control group, P<0.01; b: indicated significant differences compared with the H2O2 model group, P<0.01.从表2中可以看出,与对照组相比,H2O2模型组MDA含量显著提高,达到3.21 µmol·L−1,表明H2O2诱导VSMC胞内生成大量脂质过氧化物,ROS水平显著提高,这是其诱导VSMC增殖的重要因素。而采用不同质量浓度海带多糖进行预处理后,其VSMC胞内MDA生成量均有下降。当海带多糖质量浓度达到1.0 mg·mL−1时,VSMC胞内MDA生成量最低,仅为1.27 µmol·L−1,与H2O2模型组相比下降了60.44%。由此可见,VSMC胞内脂质过氧化物生成量随着海带多糖预处理浓度的增加而降低,呈量效相关性,表明海带多糖预处理后有效抑制VSMC胞内因H2O2诱导引起的ROS升高,提示海带多糖对H2O2诱导VSMC增殖的抑制机制与调控VSMC胞内ROS水平相关。因此,后续试验可进一步从分子水平探讨海带多糖对VSMC胞内ROS的调控机制,阐明海带多糖对H2O2诱导VSMC增殖抑制机制。
3. 讨论与结论
病理学研究发现,血管平滑肌细胞异常增殖是动脉粥样硬化形成的始动环节,也是动脉粥样硬化心血管疾病共同的病理基础。研究发现抗动脉粥样硬化活性物质西洛他唑通过阻断VSMC胞内ERK1/2信号通路,抑制VSMC增殖[17]。Bin等对动脉粥样硬化形成分子机制研究发现,动脉粥样硬化重要诱因氧化低密度脂蛋白(ox-LDL)诱导VSMC胞内转录因子KLF5表达,进而上调胞内微小RNA-29a表达水平,最终促进VSMC增殖而形成动脉粥样硬化斑块[18]。细胞学研究发现,ROS水平增高激活VSMC胞内MAPK信号通路并促进VSMC增殖[19]。Yang等研究结果表明高糖处理引起细胞ROS水平增高是其诱导VSMC增殖的主要因素[4]。因此,胞内ROS水平增高是VSMC增殖的促进因子。
天然产物活性研究结果表明,海藻多糖具有显著抗氧化活性,可有效降低胞内ROS水平。马军等研究发现海藻多糖具有自由基清除和抗脂质过氧化活性[20]。杨运高等用大鼠红细胞免疫功能缺陷模型研究海藻多糖对红细胞免疫功能及自由基损伤的影响。试验结果显示,海藻多糖增强超氧化物歧化酶、谷胱甘肽等还原性物质活性,并降低MDA含量,表明海藻多糖可降低大鼠体内ROS水平,是抗氧化剂的重要备选资源[21]。海带多糖是一种抗氧化活性显著的海藻多糖,其对DPPH、羟自由基、超氧阴离子等自由基的清除活性显著[22]。张晴岚等研究发现海带多糖可改善大鼠血脂水平,提高一氧化氮浓度和一氧化氮合酶活性,抑制动脉粥样硬化斑块发生和发展[23]。本课题以H2O2为诱导剂建立VSMC增殖模型,评估海带多糖作用下动脉粥样硬化始动因子VSMC生长与脂质过氧化水平的相关性。结果表明,海带多糖可抑制H2O2诱导VSMC增殖且呈量效相关性。而海带多糖浓度与VSMC胞内MDA含量呈负相关性,可见海带多糖缓解了VSMC胞内因H2O2诱导引起的ROS水平增高,表明海带多糖抑制VSMC增殖与其抗氧化活性相关。因此,后续研究需进一步从ROS调控细胞增殖的MAPK通路上进一步探讨海带多糖对VSMC增殖的抑制机制,为深度开发海带药用价值奠定基础。
-
表 1 生理生化鉴定结果
Table 1 Physiological and biochemical characteristics of SM-1
项目 Items 1 2 3 4 5 6 7 氧化酶活性 Oxidase activity − + − + − + + 糖原 Glycogen − Nd − − + + − 乳糖 Lactose − + − − + − − 蜜二糖 Melibiose − + − − − − + 甲基葡萄糖苷 Methyl α-d-glucoside − + − − + + + 杜-杜拉诺糖 d-Turanose − + − − − − + 注:① “+”表示阳性,“−”表示阴性; ②1. SM-1, 2. 解淀粉芽孢杆菌, 3.萎缩芽孢杆菌, 4.摩加夫芽孢杆菌, 5.暹罗芽胞杆菌, 6.贝莱斯芽孢杆菌, 7. B. subtilis subsp. Stercoris。
Note: ① ‘+’ means positive; ‘−’ means negative; ②1. SM-1, 2. B. amyloliquefaciens, 3. B. atrophaeus, 4. B. mojavensis, 5. B. siamensis, 6. B. velezensis, 7. B. subtilis subsp. Stercoris.表 2 与菌株SM-1最为相似的细菌种类
Table 2 Bacterial species with closest similarity to SM-1
种类 Species 菌株编号 Strain 16S 序列注册号 Accession number 相似性 Similarity/% 贝莱斯芽孢杆菌 Bacillus velezensis CR-502 AY603658 99.29 B. subtilis subsp. Stercoris D7XPN1 JHCA01000027 99.21 暹罗芽孢杆菌 B. siamensis KCTC 13613 AJVF01000043 98.97 枯草芽孢杆菌枯草亚种 B. subtilis subsp. Subtilis NCIB 3610 ABQL01000001 98.69 解淀粉芽孢杆菌 B. amyloliquefaciens DSM 7 FN597644 98.69 B. nakamurai NRRL B-41091 LSAZ01000028 98.69 B. subtilis subsp. inaquosorum KCTC 13429 AMXN01000021 98.49 耐盐短杆菌 B. halotolerans ATCC 25096 LPVF01000003 98.49 特基拉芽孢杆菌 B. tequilensis KCTC 13622 AYTO01000043 98.49 萎缩芽孢杆菌 B. atrophaeus JCM 9070 AB021181 98.49 莫海威芽孢杆菌 B. mojavensis RO-H-1 JH600280 98.42 死亡谷芽孢杆菌 B. vallismortis DV1-F-3 JH600273 98.42 枯草芽孢杆菌斯氏亚种 B. subtilis subsp. Spizizenii NRRL B-23049 CP002905 98.35 B. glycinifermentans GO-13 LECW01000063 97.45 副地衣芽孢杆菌 B. paralicheniformis KJ-16 KY694465 97.38 B. licheniformis 地衣芽孢杆菌 ATCC 14580 AE017333 97.18 B. haynesii NRRL B-41327 MRBL01000076 97.11 表 3 Biolog系统对细菌菌株SM-1的鉴定
Table 3 Identification of bacterial strain SM-1 by Biolog system
排序 Rank 相似性 Similarity 位距 Distance 种类 Species 1 0.631 5.311 萎缩芽孢杆菌 Bacillus atrophaeus 2 0.163 5.752 解淀粉芽孢杆菌 B. amyloliquefaciens 3 0.062 6.336 摩加夫芽孢杆菌 B. mojavensis 4 0.046 6.511 简单芽胞杆菌 B. simplex -
[1] 陈苏英, 马祥庆, 吴鹏飞, 等. 1.5代杉木种子园不同无性系生长和结实性状的评价 [J]. 热带亚热带植物学报, 2014, 22(3):281−291. DOI: 10.3969/j.issn.1005-3395.2014.03.010 CHEN S Y, MA X Q, WU P F, et al. Evaluation on growth and seed characters of different clones in 1.5-generation seed orchard of Chinese fir [J]. Journal of Tropical and Subtropical Botany, 2014, 22(3): 281−291.(in Chinese) DOI: 10.3969/j.issn.1005-3395.2014.03.010
[2] 詹振亮. 福建省杉木赤枯病病原菌鉴定及防治药剂筛选[D]. 福州: 福建农林大学, 2017. ZHAN Z L. Identification and Fungicides Screening of the Copper Blight pathogen of Cunninghamia Lanceolate in Fujian[D]. Fuzhou: Fujian Agriculture and Forestry University, 2017. (in Chinese)
[3] 杜静, 胡超魁, 解怀君, 等. 辽宁典型海域表层海水中在用化学农药浓度水平与潜在生态风险[J]. 环境科学, 2020-10-19. doi: 10.13227/j.hjkx.202008125. DU J, HU C K, XIE H J, et, al. Concentration Levels and Potential Ecological Risks of Current Use Pesticides in the Surface Seawater of Liaoning Typical Sea Areas[J]. Environmental Science, 2020-10-19. doi: 10.13227/j.hjkx.202008125. (in Chinese)
[4] EILENBERG J, HAJEK A, LOMER C. Suggestions for unifying the terminology in biological control [J]. BioControl, 2001, 46(4): 387−400. DOI: 10.1023/A:1014193329979
[5] ALABOUVETTE C, OLIVAIN C, MIGHELI Q, et al. Microbiological control of soil-borne phytopathogenic fungi with special emphasis on wilt-inducing Fusarium oxysporum [J]. New Phytologist, 2009, 184(3): 529−544. DOI: 10.1111/j.1469-8137.2009.03014.x
[6] HARDOIM P R, VAN OVERBEEK LS, BERG G, et al. The hidden world within plants: ecological and evolutionary considerations for defining functioning of microbial endophytes [J]. Microbiology and Molecular Biology Reviews, 2015, 79: 293−320. DOI: 10.1128/MMBR.00050-14
[7] BROOKS D S, GONZALEZ C F, APPEL D N. Evaluation of endophytic bacteria as potential biological control agents for oak wilt [J]. Biological control, 1994(4): 373−381.
[8] GUTIÉRREZ-ZAMORA M L, MARTÍNEZ-ROMERO E. Natural endophytic association between Rhizobium etli and maize (Zea mays L.) [J]. Journal of Biotechnology, 2001, 91(2/3): 117−126.
[9] MCINROY J A, KLOEPPER J W. Survey of indigenous bacterial endophytes from cotton and sweet corn [J]. Plant and Soil, 1995, 173(2): 337−342. DOI: 10.1007/BF00011472
[10] 王森胜, 何熙璞, 刘鸿杰, 等. 具抑菌活性杉木内生菌的分离、鉴定及培养条件优化 [J]. 基因组学与应用生物学, 2014, 33(6):1275−1280. WANG S S, HE X P, LIU H J, et al. Identification of an endophytic bacterium having antagonistic activity isolated from Cunninghamia lanceolata and optimization of fermentation condition [J]. Genomics and Applied Biology, 2014, 33(6): 1275−1280.(in Chinese)
[11] 汤智德, 徐彩瑶, 吴承祯, 等. 内生真菌对低磷胁迫下杉木幼苗生长及光合作用的影响 [J]. 江西农业大学学报, 2019, 41(2):281−288, 307. TANG Z D, XU C Y, WU C Z, et al. The effect of endophytic fungus on the growth and photosynthesis of Cunninghamia lanceolate under low phosphorous stress [J]. Acta Agriculturae Universitis Jiangxiensis, 2019, 41(2): 281−288, 307.(in Chinese)
[12] GOSZCZYNSKA T, SERFONTEIN J J, SERFONTEIN S. Introduction to Practical Phytobacteriology (First edition)[M]. Pretoria: ARC-Plant Protection Research Institute, 2000.
[13] BERGEY D H, JOHN G H, NOEL R K, et al. Bergey's Manual of Determinative Bacteriology[M]. (9th ed.). Lippincott Williams & Wilkins, 1994.
[14] 卢彩鸽, 张殿朋, 刘伟成, 等. 一株甘蓝枯萎病拮抗细菌的筛选、鉴定及其抑菌活性测定 [J]. 华北农学报, 2014, 29(1):195−202. DOI: 10.7668/hbnxb.2014.01.035 LU C G, ZHANG D P, LIU W C, et al. Screening, identification and activity analysis of antagonistic bacteria against cabbage wilt disease [J]. Acta Agriculturae Boreali-Sinica, 2014, 29(1): 195−202.(in Chinese) DOI: 10.7668/hbnxb.2014.01.035
[15] IDZIK D, WOJTYCZKA R, KEPA M, et al. Evaluation of methicillin-resistance in Staphylococcus aureus by the agar disk diffusion method and PCR [J]. Medycyna Doswiadczalna i Mikrobiologia, 2000, 52(4): 327−332.
[16] 杨雷鹏. 鲜姜汁对不同酵母菌抑制作用的研究 [J]. 中国果菜, 2020, 40(2):35−38. YANG L P. Study on the inhibitory effect of fresh ginger juice on different yeasts [J]. China Fruit & Vegetable, 2020, 40(2): 35−38.(in Chinese)
[17] 吕昂. 链霉菌3-10抗真菌代谢产物鉴定及防病潜力评估[D]. 武汉: 华中农业大学, 2017. LYU A. Identification of the Antifungl Metabolites from Streptomyces sp. 3-10 and Evaluation of Their Efficacy ahainst Plant Fungal Diseases[D]. Wuhan: Huazhong Agricultural University, 2017. (in Chinese)
[18] 沙月霞, 王琦, 李燕. 稻瘟病生防芽胞杆菌的筛选及防治效果 [J]. 中国生物防治学报, 2016, 32(4):474−484. SHA Y X, WANG Q, LI Y. Screening and prevention of Bacillus biocontrol against rice blast [J]. Chinese Journal of Biological Control, 2016, 32(4): 474−484.(in Chinese)
[19] ARORA N K, KIM M J, KANG S C, et al. Role of chitinase and beta-1, 3-glucanase activities produced by a fluorescent pseudomonad and in vitro inhibition of Phytophthora capsici and Rhizoctonia solani [J]. Canadian Journal of Microbiology, 2007, 53(2): 207−212. DOI: 10.1139/w06-119
[20] PICARD K, TIRILLY Y, BENHAMOU N. Cytological effects of cellulases in the parasitism of Phytophthora parasitica by Pythium oligandrum [J]. Applied and Environmental Microbiology, 2000, 66(10): 4305−4314. DOI: 10.1128/AEM.66.10.4305-4314.2000
[21] 张涛, 李雪艳, 杨红梅, 等. 新疆棉花黄萎病菌拮抗细菌的分离、筛选与鉴定 [J]. 微生物学通报, 2018, 45(11):2418−2428. ZHANG T, LI X Y, YANG H M, et al. Isolation, screening and identification of antagonistic bacteria against Verticillium dahliae Kleb. in Xinjiang [J]. Microbiology, 2018, 45(11): 2418−2428.(in Chinese)
[22] 刘伟, 何彩, 金娜, 等. 枸杞叶枯病拮抗芽孢杆菌的筛选、鉴定及防效 [J]. 北方园艺, 2019(15):23−29. LIU W, HE C, JIN N, et al. Screening, identification and control of antagonistic bacterialon leaf blight of Lycium barbarum [J]. Northern Horticulture, 2019(15): 23−29.(in Chinese)
-
期刊类型引用(0)
其他类型引用(2)






 下载:
下载: