Anti-peroxidation of Total Flavonoids from Fruits of Ligustrum obtusifolium on Lipids
-
摘要:目的 初步探究水蜡树果实总黄酮的抗脂质过氧化作用。方法 用分光光度法测定水蜡树果实总黄酮对DPPH·自由基和羟自由基(·OH)的清除率,分析其对小鼠肝匀浆中自氧化和诱导(FeSO4和H2O2)生成的丙二醛(MDA)含量、Fe2+与抗坏血酸(Vc)诱导的小鼠肝线粒体肿胀度、H2O2诱导的小鼠红细胞氧化溶血、氧化氢酶(CAT)和谷胱甘肽过氧化氢酶(GSH-Px)活性及谷胱甘肽(GSH)含量的影响。结果 水蜡树果实总黄酮对DPPH·自由基和·OH自由基具有一定的清除能力,IC50分别为(0.45±0.01) g·L−1和(1.57±0.12 )g·L−1;1.0~6.0 g·L−1水蜡树果实总黄酮能抑制自氧化体系中MDA的生成;0.5~6.0 g·L−1总黄酮可降低FeSO4诱导条件下MDA的生成;2.0~6.0 g·L−1总黄酮可抑制H2O2诱导条件下MDA的生成;0.5~10.0 g·L−1总黄酮能明显减缓Fe2+与Vc诱导的肝线粒体悬液OD520值的下降,2.0~10.0 g·L−1总黄酮可明显减弱H2O2诱导红细胞的溶血度;0.6~4.0 g·L−1总黄酮可显著提高CAT和GSH-Px的活性及GSH的含量。结论 水蜡树果实总黄酮可减弱小鼠肝组织自发性过氧化和诱导脂质过氧化,抑制小鼠肝线粒体和红细胞的氧化损伤,提高抗氧化酶的活性及非酶抗氧化物的含量。本研究对水蜡树果实天然抗氧化剂的开发有一定的借鉴意义。Abstract:Objective Anti-peroxidation effect of the flavonoids extracted from fruits of Ligustrum obtusifolium on lipids was investigated.Method Scavenging capacities of the crude extract on DPPH· and hydroxyl (·OH) free radicals were tested using spectrophotometry. Effects of the flavonoids on the malondialdehyde (MDA) content in rat liver homogenate upon spontaneous oxidation or peroxidation by either FeSO4 or H2O2 induction and the mitochondrial swelling on rat liver induced by Fe2+ and ascorbic acid (Vc) as well as the hemolysis of red blood cells (RBCs) induced by H2O2 were assessed in vitro. And the activity of the catalase (CAT) and glutathione peroxidase (GSH-Px) and the level of the glutathione (GSH) were tested in vivo.Result The flavonoid extract exhibited abilities in scavenging DPPH· and ·OH free radicals with IC50 of (0.45±0.01) g·L−1 and (1.57±0.12) g·L−1, respectively. From the concentration of 1.0 g·L−1 to 6.0 g·L−1, the extract significantly reduced the in vitro MDA in rat liver homogenate under spontaneous oxidation; from 0.5 g·L−1 to 6.0 g·L−1, under FeSO4 induction; and, from 2.0 g·L−1 to 6.0 g·L−1 under H2O2 induction. From 0.5 g·L−1 to 10.0 g·L−1, the flavonoids also suppressed the liver mitochondrial swelling induced by Fe2+ and Vc; while, from 2.0 g·L−1 to 10.0 g·L−1, the RBC hemolysis induced by H2O2, and those from 0.6 g·L−1 to 4.0 g·L−1 could enhance the level of CAT, GSH, and GSH-Px.Conclusion The crude flavonoid extract from the fruits of L. obtusifolium significantly inhibited in vitro on both spontaneous and induced lipid peroxidation reducing the oxidative damage on the mitochondria and RBCs of rat liver, and enhance the acitivity of antioxidant enzymes and the content of non-enzyme antioxidants. The results suggested a promising potential in developing a natural antioxidant from the fruits.
-
Keywords:
- Ligustrum obtusifolium fruit /
- total flavonoids /
- antioxidation /
- lipid peroxidation
-
0. 引言
【研究意义】水蜡树(Ligustrum obtusifolium Sieb. et Zuce.)是木犀科女贞属中的一种落叶灌木[1],原产于华东、华中等地区,具有较强的抗寒、抗旱能力,其生长对土壤的要求不严,在我国很多城市作为绿化植物进行栽培[2]。水蜡树被广泛种植,因此其所产果实数量甚多、资源丰富,但利用量较低。探明水蜡树果实总黄酮的抗脂质过氧化作用,可为水蜡树果实的有效利用提供理论支持,使特种资源成为经济优势,为我国丰富的水蜡树资源的开发和利用提供新途径。【前人研究进展】在南欧的传统医学中水蜡树叶片常被用于口咽部炎症和风湿的治疗[3]。有研究表明水蜡树叶片中含有大量的橄榄苦苷(oleuropein),这种物质有抗心肌缺血、抗氧化、降血脂、降血糖、抗肿瘤等作用[4-6]。Suh等[7]从水蜡树的树枝中分离到了9种对细胞无毒性的裂环烯醚萜甙类物质,发现化合物2、5、6、8和9可显著降低NO的生成,从而抑制对脂多糖刺激引起的小神经胶质细胞炎症反应;化合物2和6可上调神经生长因子的表达而起到保护神经的作用。水蜡树果实是韩国传统医学中的强心剂和强壮剂[7]。Lee等[8]认为水蜡树果实对小鼠体内由链脲霉素导致的高血糖具有抵抗作用。【本研究切入点】机体的脂质过氧化会导致如肿瘤、血管硬化等诸多疾病。抗氧化剂因其具有安全、无毒、高效等特点,是抑制机体脂质过氧化反应的理想选择。黄酮类化合物是一种在自然界广泛分布的多酚类抗氧化剂[9]。目前,国内对黄酮的提取工艺及抗氧化活性等方面的研究较多,本研究团队前期也探讨了水蜡树果实总黄酮的提取工艺[10],但尚未对水蜡树果实总黄酮的抗脂质过氧化作用作深入研究。【拟解决的关键问题】本文通过测定水蜡树果实总黄酮对DPPH·自由基和羟自由基(·OH)的清除率,分析其对小鼠肝匀浆中自氧化和诱导(FeSO4和H2O2)生成的丙二醛(MDA)含量、FeSO4和抗坏血酸(Vc)诱导小鼠肝线粒体肿胀度和H2O2诱导小鼠红细胞氧化溶血的影响,探讨其对小鼠肝组织中过氧化氢酶(CAT)和谷胱甘肽过氧化氢酶(GSH-Px)活性及谷胱甘肽(GSH)含量的影响,以明确水蜡树果实总黄酮的抗脂质过氧化作用,为水蜡树果实的深加工提供丰富的理论基础。
1. 材料与方法
1.1 材料与仪器
供试材料:水蜡树果实,2018年采自于山西省忻州市云中河公园。SPF级小鼠,雌雄对半,体重18~20 g,购自山西医科大学动物中心,动物许可证号:SCXK(晋)2009-001。在实验动物房内饲养并观察1周后进行试验,饲养环境温度为20 ℃左右,湿度为40%~60%。
供试药品:AB-8型号大孔树脂(安徽三星树脂有限公司)、硫代巴比妥酸(TBA,上海弘顺生物科技有限公司)、1,1-二苯基-2-三硝基苯肼(DPPH·,美国Sigma公司)、抗坏血酸(Vc,国药集团化学试剂有限公司)、氧化氢酶试剂盒(南京建成生物工程研究所)、谷胱甘肽试剂盒(南京建成生物工程研究所)、谷胱甘肽过氧化氢酶试剂盒(南京建成生物工程研究所)。其他药剂均为分析纯。
供试仪器:RE-52AA旋转蒸发仪(常州亚旺仪器有限公司)、UV-2102C型紫外可见分光光度计(北京亚星仪科科技发展有限公司)、HC-2062型高速离心机(上海弘顺生物科技有限公司)、YC-800型层析柜(北京亚星仪科科技发展有限公司)。
1.2 方法
1.2.1 水蜡树果实总黄酮的提取及粗纯化
将水蜡树果实洗净、干燥、粉碎,过80目筛制成粉末。称取一定量的水蜡树果实干粉,按料液比1∶11加入60%乙醇溶液,超声浸提11 min,离心,留上清液。将AB-8大孔树脂浸入95%乙醇,不断搅拌,静置24 h,用蒸馏水洗净;然后用5% HCl溶液浸泡树脂3 h,用蒸馏水冲洗至中性;最后用2% NaOH溶液浸泡树脂3 h,用蒸馏水冲洗至中性,装柱[11]。将上清液通过AB-8大孔树脂进行动态吸附,树脂吸附达到饱和时,停止上样。吸附1 h后,用蒸馏水将上样后的树脂柱洗至无色,用苯酚浓硫酸法检测至无糖,再用60%乙醇洗脱至无色[12]。收集洗脱液并在50 ℃下减压浓缩,最终制备出7.21 g浸膏,测得水蜡树果实总黄酮提取物为4.82 g,纯度为66.83%。取少许浸膏,用少许无水乙醇溶解后,用蒸馏水配制成质量浓度为10 g·L−1的母液,0.22 μm过滤除菌,待用。
1.2.2 对DPPH·和·OH清除率的测定
将母液用蒸馏水分别配制成0.2、0.4、0.6、0.8和1 g·L−1的稀释样液。取1 mL稀释样液加入2 mL 2×10−4 mol·L−1 DPPH·溶液,混匀,避光,静置30 min,测定OD517值。DPPH·清除率计算公式如下:DPPH·清除率=[(OD517空白−OD517样品+OD517对照)/D517空白]×100%,其中:OD517空白为1 mL 蒸馏水和2 mL DPPH·溶液混合液的吸光度;OD517对照为1 mL稀释液和2 mL蒸馏水混合液的吸光度。
取1 mL稀释样液加入6×10−3 mol·L−1 FeSO4 2 mL、6×10−3 mol·L−1水杨酸 2 mL、6×10−3 mol·L−1 H2O2 2 mL混合,37 ℃反应30 min,以蒸馏水为参比,测定各浓度的OD510。·OH清除率计算公式如下:·OH清除率=[(OD510空白−OD510样品+OD510对照)/OD510空白]×100%。其中:OD510空白为以1 mL蒸馏水与其余试剂混合后的吸光度,OD510对照为混合液中以2 mL蒸馏水替代 6×10−3 mol·L−1 H2O2 2 mL的吸光度。试验重复3次。
1.2.3 对小鼠肝脏体外生成MDA的影响
按照梅光明等[13]的方法制备小鼠肝匀浆:将新鲜的小鼠肝脏用冷生理盐水洗净血渍,滤纸吸干水分,称重,按1∶9的比例加入相应体积的0 ℃生理盐水,用玻璃组织匀浆器匀浆,1 360 g离心20 min,上清液即为10%肝匀浆液。无诱导组(ND):取1 mL 10%肝匀浆液若干份,分别加入用蒸馏水配置的0.5、1.0、2.0、4.0、6.0 g·L−1稀释样液和蒸馏水各l mL,混匀。FeSO4诱导组(FD)和H2O2诱导组(HD)则是将1 mmol·L−1 FeSO4 1 mL和1 mmol·L−1 H2O2 l mL分别与10%肝匀浆液 l mL和各浓度稀释样液 1 mL混合。调零均以1 mL生理盐水代替1 mL 10%肝匀浆液。
将ND、FD和HD混合液在37 ℃温育l h后,冰浴冷却,再加入0.6% TBA溶液 3 mL,混匀,沸水浴反应15 min,迅速冷却,1 360 g离心10 min,取上清液分别测定OD532、OD600和OD450值,根据公式计算MDA含量(μmol·L−1)。MDA=6.45×(OD532−OD600)−0.56×OD450。试验重复3次。
1.2.4 对小鼠肝线粒体肿胀度的影响
用pH 7.4磷酸缓冲盐(PBS)溶液制备10%肝匀浆液(方法同1.2.3),4 ℃下1 000 g离心15 min,弃沉淀。上清液以10 000 g离心20 min,收集沉淀并洗涤,最后用PBS溶液将沉淀制成肝线粒体悬液。
依次加入0.4 mL稀释样液(浓度分别为0.5、2.0和10.0 g·L−1)、3.0 mL肝线粒体悬液、0.5 mmol·L−1 FeSO4 0.4 mL和0.5 mmol·L−1 Vc溶液 0.4 mL,充分混匀。以加入相应体积的蒸馏水替代稀释样液为诱导组,以1.2 mL蒸馏水和3.0 mL肝线粒体悬液混合为对照。分别测定0、10、20、30 min时的OD520,随着时间推移,吸光度逐渐下降,用它的降低幅度来表示肝线粒体的肿胀度。试验重复3次。
1.2.5 对H2O2诱导小鼠红细胞氧化溶血的影响
从小鼠眼眶取血并离心(4 000 g 15 min),留沉淀(红细胞),冷生理盐水洗涤沉淀2次,再用生理盐水配制成0.5%小鼠红细胞悬浮液。诱导组:取1 mL红细胞悬浮液,依次加入2 mL生理盐水和100 mmol·L−1 H2O2溶液 1 mL;样品组:取1 mL红细胞悬浮液若干份,分别加入2 mL稀释样液(浓度分别为0.5、2.0和10.0 g·L−1)混匀,再加入100 mmol·L−1 H2O2 溶液 1 mL;对照组:1 mL红细胞悬浮液加入2 mL生理盐水和1 mL蒸馏水。将以上各混合液混匀,37 ℃温育1 h。1 000 g离心10 min,取上清液,以生理盐水调零,测定OD415值,根据公式计算溶血度(%)和抑制率(%)。溶血度=(样品组或对照组/诱导组)×100%。抑制率=100%−溶血度(%)。试验重复3次。
1.2.6 对小鼠肝组织中CAT、GSH和GSH-Px的影响
根据赵美莲等[10]方法将小白鼠分4组,每组10只。按低剂量(L)、中剂量(M)和高剂量(H)每天分别经口灌胃由生理盐水配置的0.6、2.0、4.0 g·L−1的稀释样液各1 mL(剂量依次为每天30、100、200 mg·kg−1),对照组(C)灌胃等体积生理盐水。按常规饲养条件喂养小鼠,并连续给药12 d,处死小鼠,取肝组织,用生理盐水制备成0.5%肝匀浆液,根据试剂盒说明书测定CAT和GSH-Px的活性、GSH的含量。
1.3 统计分析
数据均由DPS 6.0和Excel 2003分析。显著性差异采用Duncan氏新复极差法分析。
2. 结果与分析
2.1 对DPPH·和·OH清除率的测定
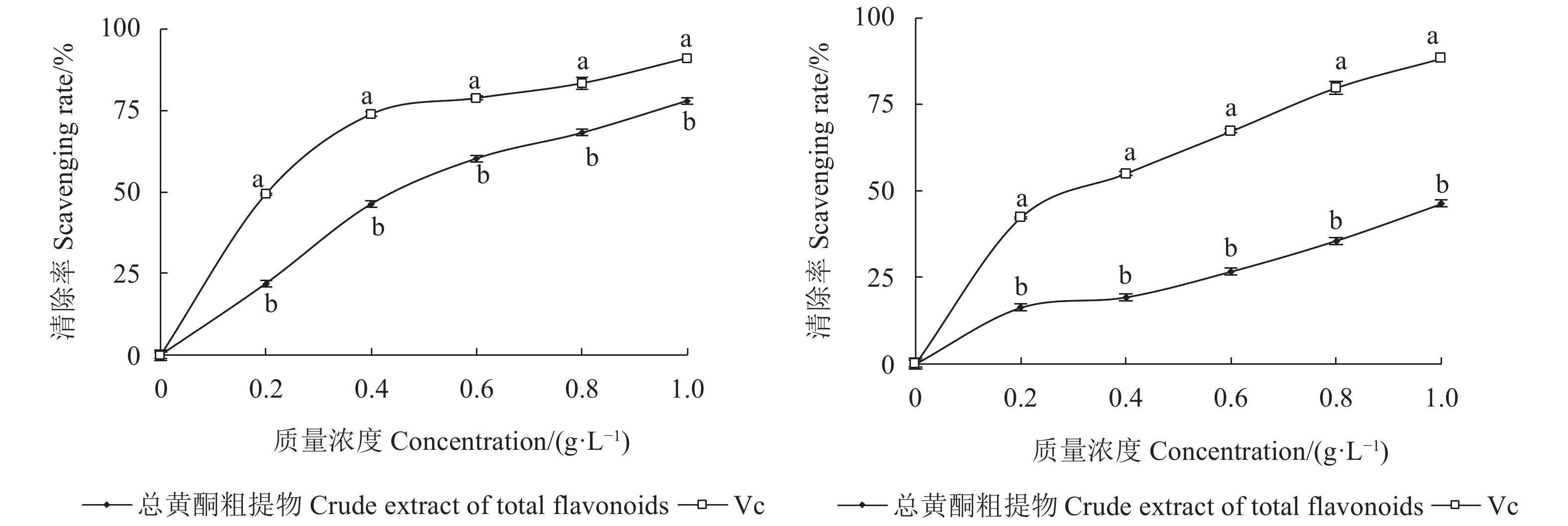
随着水蜡树果实总黄酮粗提物质量浓度的升高,其对DPPH·和·OH的清除率逐渐增强;当质量浓度达到1.0 g·L−1时,总黄酮粗提物对DPPH·和·OH的清除率均达到最大,分别为77.98%±0.72%和46.22%±2.72%(图1)。但在试验所设定的质量浓度范围内,水蜡树果实总黄酮粗提物对DPPH·和·OH的清除率始终显著低于Vc对它们的清除率(P<0.05,图1)。水蜡树果实总黄酮粗提物对DPPH·和·OH清除率的IC50分别为(0.45±0.01) g·L−1和(1.57±0.12) g·L−1,而Vc对DPPH·和·OH清除率的IC50分别为(0.20±0.00) g·L−1和(0.29±0.02)g·L−1,可见水蜡树果实总黄酮粗提物对自由基的清除具有一定的作用,但效果不及Vc对自由基的清除效果。
![]() 图 1 水蜡树果实总黄酮粗提物对DPPH·(左)和·OH(右)的清除率注:同浓度上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。Figure 1. Scavenging capacities of crude flavonoid extract from L. obtusifolium fruit on DPPH· (A) and ·OH (B)Note: Data with different letters on same concentration indicate significant difference at P<0.05 by Duncan’s new multiple range test.
图 1 水蜡树果实总黄酮粗提物对DPPH·(左)和·OH(右)的清除率注:同浓度上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。Figure 1. Scavenging capacities of crude flavonoid extract from L. obtusifolium fruit on DPPH· (A) and ·OH (B)Note: Data with different letters on same concentration indicate significant difference at P<0.05 by Duncan’s new multiple range test.2.2 对小鼠肝匀浆体外生成MDA的影响
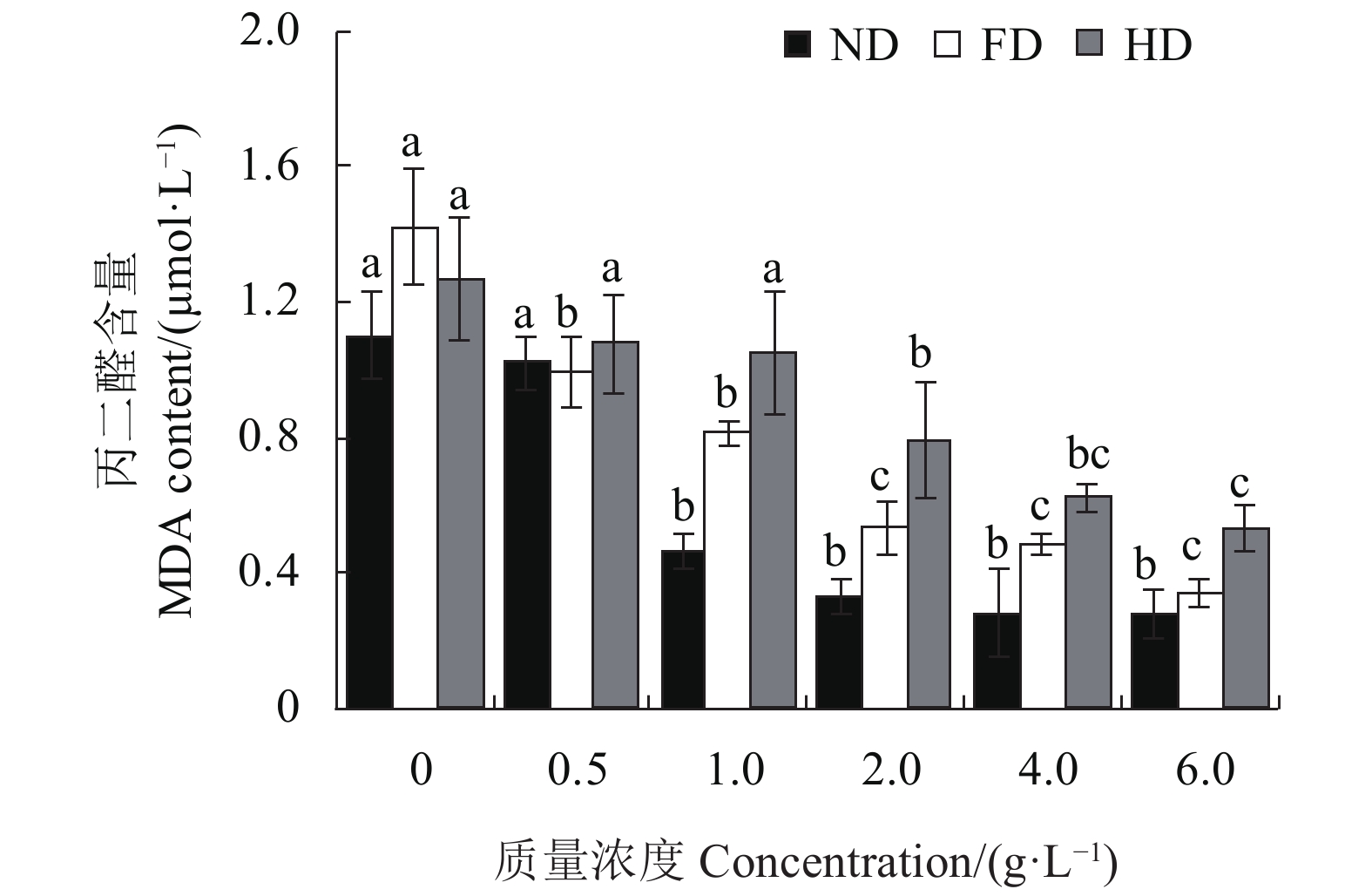
在ND、FD和HD这3种体系下,水蜡树果实总黄酮粗提物的试验浓度均可抑制小鼠肝匀浆体外MDA的生成(图2)。与0 g·L−1(对照)相比,1.0~6.0 g·L−1水蜡树果实总黄酮粗提物对自氧化体系(ND组)中体外生成的MDA有显著的抑制效果(P<0.05),0.5 g·L−1时MDA的生成也有所下降,但未达到显著水平(P>0.05);在FD体系中,0.5~6.0 g·L−1总黄酮粗提物可明显降低MDA的生成(P<0.05);在HD体系中,2.0~6.0 g·L−1的总黄酮粗提物可显著抑制MDA的生成(P<0.05,图2)。可见,水蜡树果实总黄酮粗提物对小鼠肝组织自发性过氧化和诱导脂质过氧化均都有显著的抑制作用,且在一定的浓度范围内,总黄酮粗提物对小鼠肝匀浆脂质过氧化的抑制效应会随着浓度的增加而升高。
![]() 图 2 水蜡树果实总黄酮粗提物对小鼠肝匀浆生成MDA的影响注:ND代表无诱导组,FD代表FeSO4诱导组,HD代表H2O2诱导组。同色柱上方不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。Figure 2. MDA contents in rat liver homogenate treated by flavonoid extract of L. obtusifolium fruitsNote: ND denotes no induction treatment; FD, induction by FeSO4; and, HD, induction by H2O2. Data with different letters on column of same color indicate significant difference at P<0.05 by Duncan’s new multiple range test.
图 2 水蜡树果实总黄酮粗提物对小鼠肝匀浆生成MDA的影响注:ND代表无诱导组,FD代表FeSO4诱导组,HD代表H2O2诱导组。同色柱上方不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。Figure 2. MDA contents in rat liver homogenate treated by flavonoid extract of L. obtusifolium fruitsNote: ND denotes no induction treatment; FD, induction by FeSO4; and, HD, induction by H2O2. Data with different letters on column of same color indicate significant difference at P<0.05 by Duncan’s new multiple range test.2.3 对小鼠肝线粒体肿胀度的影响
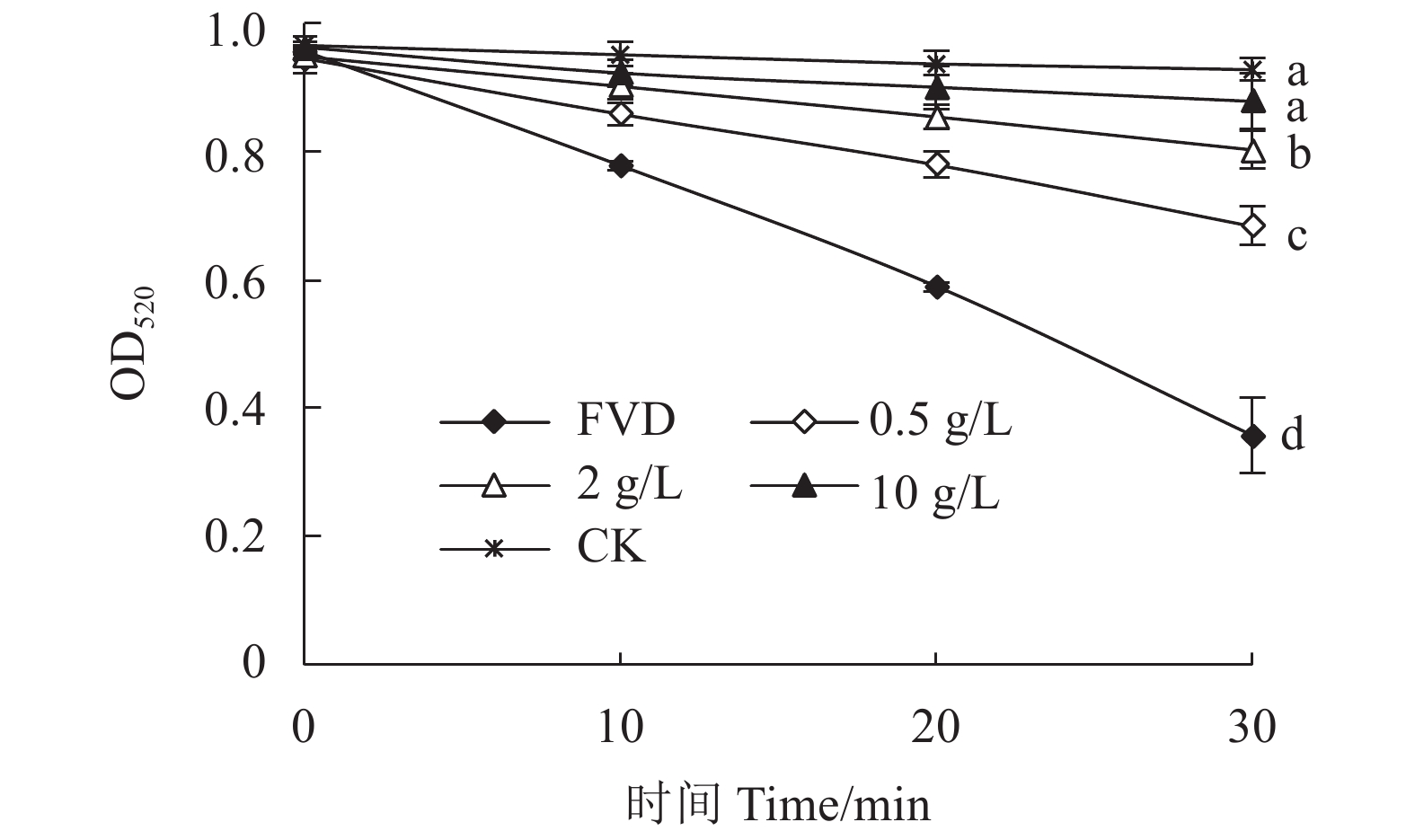
随着时间的延长,FeSO4和Vc共同作用的诱导组(FVD)OD520值下降幅度最大,而在添加0.5、2.0和10.0 g·L−1水蜡树果实总黄酮粗提物的处理组中,它们的OD520值下降趋势明显减缓(P<0.05),尤其是10.0 g·L−1总黄酮粗提物处理的肝线粒体悬液,其OD520值与没有FeSO4和Vc共同作用的对照(CK)OD520值差异不显著(P>0.05,图3),表明水蜡树果实总黄酮粗提物可减轻肿胀度,抑制小鼠肝线粒体氧化损伤程度。
![]() 图 3 水蜡树果实总黄酮粗提物对小鼠肝线粒体肿胀度的影响注:FVD代表FeSO4和Vc共同作用的诱导组,CK为对照。同一时间处理上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。Figure 3. Rat liver mitochondrial swelling induced by Fe2+ and Vc treated by flavonoid extract of L. obtusifolium fruitsNote: FVD denotes induction by FeSO4 and Vc; and, CK, control. Data with different letters on same time treatment indicate significant difference at P<0.05 by Duncan’s new multiple range test.
图 3 水蜡树果实总黄酮粗提物对小鼠肝线粒体肿胀度的影响注:FVD代表FeSO4和Vc共同作用的诱导组,CK为对照。同一时间处理上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。Figure 3. Rat liver mitochondrial swelling induced by Fe2+ and Vc treated by flavonoid extract of L. obtusifolium fruitsNote: FVD denotes induction by FeSO4 and Vc; and, CK, control. Data with different letters on same time treatment indicate significant difference at P<0.05 by Duncan’s new multiple range test.2.4 对H2O2诱导红细胞氧化溶血的影响
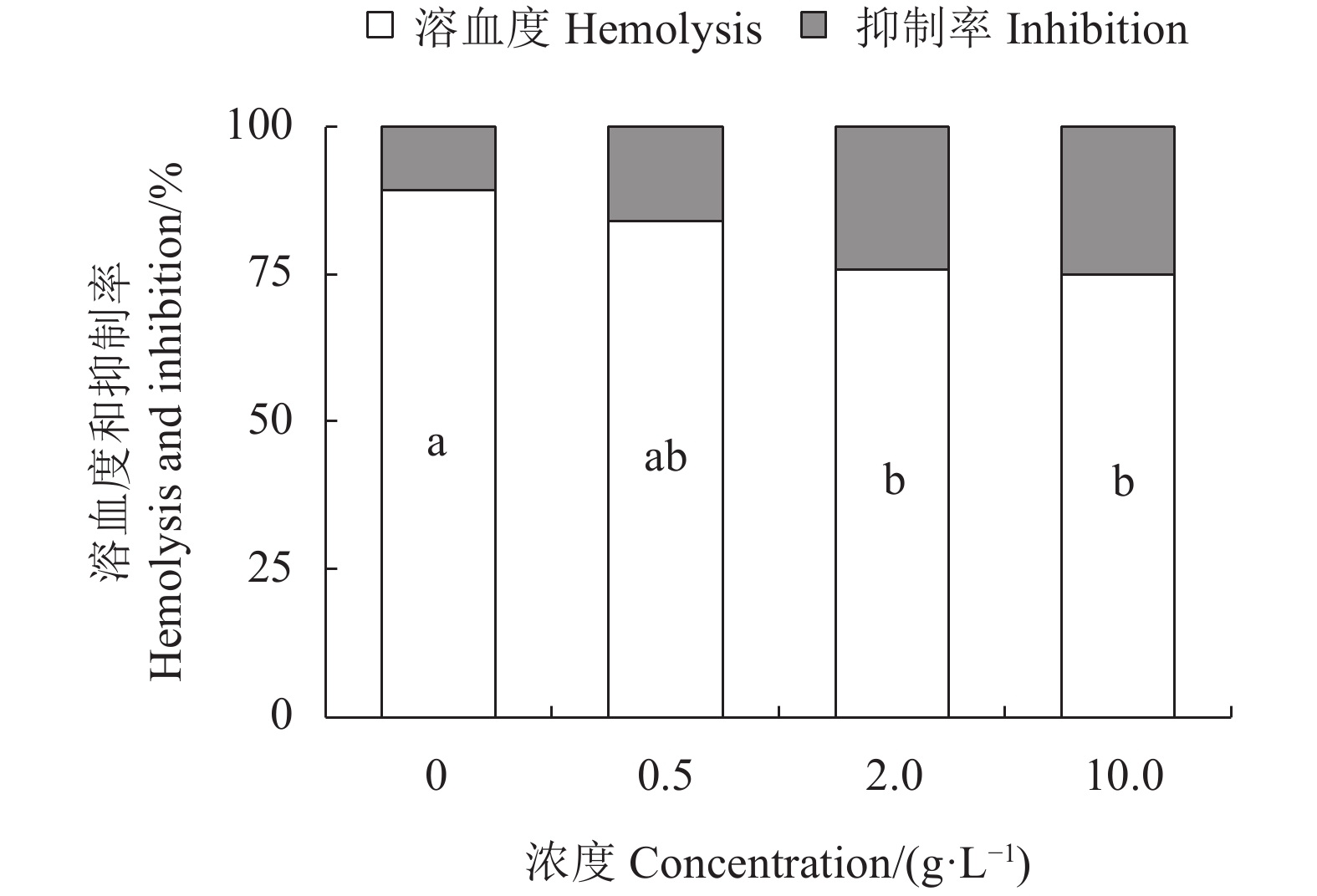
随着水蜡树果实总黄酮粗提物的浓度升高,红细胞溶血度不断下降,对H2O2诱导作用的抑制效果也逐渐增强。其中0.5 g·L−1水蜡树果实总黄酮粗提物的影响未达到显著水平(P>0.05),但2.0 g·L−1和10.0 g·L−1水蜡树果实总黄酮粗提物则有显著效果(P<0.05,图4)。可见,水蜡树果实总黄酮粗提物可保护红细胞膜,抑制红细胞的氧化损伤。
2.5 对小鼠肝组织中CAT、GSH和GSH-Px的影响
与对照组(C)相比,在灌胃水蜡树果实总黄酮粗提物12 d后,低剂量(L)、中剂量(M)和高剂量(H)小鼠肝组织中的CAT、GSH和GSH-Px水平显著升高,且随着总黄酮粗提物浓度的增加而显著增强(P<0.05,表1),其中CAT活性分别增加了29.03%、50.22%和70.04%,GSH含量分别升高了18.55%、40.72%和52.56%,GSH-Px活性分别升高了31.33%、49.55%和58.78%。可见,水蜡树果实总黄酮粗提物可显著提高小鼠体内肝组织中CAT和GSH-Px活性及GSH含量。
表 1 水蜡树果实总黄酮粗提物对小鼠肝组织中CAT、GSH和GSH-Px的影响Table 1. Effect of crude extract of total flavonoids from L. obtusifolium fruit on CAT, GSH and GSH-Px in liver tissues of rats组别 CAT/
(U·mgprot-1)GSH/
(μmol·gprot-1)GSH-Px/
(U·mgprot-1)C 20.53±0.47 d 50.78±0.99 d 82.54±0.84 d L 26.49±0.50 c 60.20±0.67 c 108.40±1.35 c M 30.84±0.95 b 71.46±1.30 b 123.44±0.90 b H 34.91±0.61 a 77.47±0.74 a 131.06±0.79 a 注:同列内不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Note: Different letters in the columns indicate significant difference at P<0.05 level by Duncan’s new multiple range test.3. 讨论与结论
人类的多种疾病,如老年痴呆[14]、心脑血管[15]等,都与氧自由基造成的损伤有关。氧自由基能使细胞中脂质、蛋白质、DNA和RNA等受到氧化损伤,从而抑制细胞的正常功能[16-17]。水蜡树果实总黄酮对·OH自由基和DPPH·自由基的清除效果弱于Vc,其清除·OH自由基的IC50为(1.57±0.12) g·L−1,稍逊于沙棘多糖的IC50(1.23 g·L−1)[18];清除DPPH·自由基的IC50为(0.45±0.01) g·L−1,优于沙棘多糖的IC50(1.55 g·L−1)[18],因此水蜡树果实总黄酮仍有较好的清除自由基的效果,是潜在的待开发的抗氧化剂。
脂质过氧化是氧自由基诱导多不饱和脂肪酸发生过氧化反应,形成的氧化产物可进一步分解形成大量的醛类、醇类和烃类物质。MDA是这一过程最具代表性的产物,其含量多少能直接反映被测体系中脂质过氧化的程度,亦可间接反映出肝细胞受自由基攻击的严重程度[19]。这其中形成的脂质过氧化物会消耗体内的抗氧化物质,并引起生物膜损害、线粒体功能紊乱等[20]。通常采用抗氧化剂来降低脂质过氧化的发生。本试验中发现水蜡树果实总黄酮对小鼠肝脏的自氧化有显著的抑制作用。由于Fe2+和H2O2都是产生自由基的诱导剂。因此,在添加Fe2+和H2O2的诱导体系中,虽然小鼠体外肝匀浆生成MDA的含量显著增高,但加入水蜡树果实总黄酮后,体外肝匀浆生成MDA的含量明显降低。说明水蜡树果实总黄酮可对肝脏起到一定的保护作用。过高浓度的Vc溶液(0.5 mmol·L−1)对Fe2+诱导的氧化损伤具有明显的增强作用[21]。在Fe2+与Vc的诱导作用下,线粒体膜发生脂质过氧化,通透性增加,从而引起膜内外的物质发生交换,最终造成线粒体的肿胀和损伤,表现为光密度值下降[12]。而本试验所用总黄酮对Fe2+与Vc诱导的小鼠肝线粒体肿胀度具有明显的抑制作用,同时,可抑制H2O2诱导的小鼠红细胞的氧化溶血。GSH是机体重要的自由基清除剂[22],而GSH-Px是一种以GSH为底物的抗氧化酶,可降低脂质过氧化程度[23]。超氧化物歧化酶SOD和CAT是生物体内重要的抗氧化酶,能消除过氧化氢及脂质过氧化物[24]。前期研究已证明小鼠在灌胃水蜡树果实总黄酮12 d后,肝组织中MDA含量显著降低,而SOD活性显著提高[10]。本研究进一步证实了水蜡树果实总黄酮可使小鼠肝组织中CAT和GSH-PX的活性及GSH的含量显著升高,说明水蜡树果实总黄酮可有效提升小鼠体内重要的抗氧化酶的活性和非酶抗氧化物的含量,具有很好的抗脂质过氧化作用。
-
图 1 水蜡树果实总黄酮粗提物对DPPH·(左)和·OH(右)的清除率
注:同浓度上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Figure 1. Scavenging capacities of crude flavonoid extract from L. obtusifolium fruit on DPPH· (A) and ·OH (B)
Note: Data with different letters on same concentration indicate significant difference at P<0.05 by Duncan’s new multiple range test.
图 2 水蜡树果实总黄酮粗提物对小鼠肝匀浆生成MDA的影响
注:ND代表无诱导组,FD代表FeSO4诱导组,HD代表H2O2诱导组。同色柱上方不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Figure 2. MDA contents in rat liver homogenate treated by flavonoid extract of L. obtusifolium fruits
Note: ND denotes no induction treatment; FD, induction by FeSO4; and, HD, induction by H2O2. Data with different letters on column of same color indicate significant difference at P<0.05 by Duncan’s new multiple range test.
图 3 水蜡树果实总黄酮粗提物对小鼠肝线粒体肿胀度的影响
注:FVD代表FeSO4和Vc共同作用的诱导组,CK为对照。同一时间处理上不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Figure 3. Rat liver mitochondrial swelling induced by Fe2+ and Vc treated by flavonoid extract of L. obtusifolium fruits
Note: FVD denotes induction by FeSO4 and Vc; and, CK, control. Data with different letters on same time treatment indicate significant difference at P<0.05 by Duncan’s new multiple range test.
表 1 水蜡树果实总黄酮粗提物对小鼠肝组织中CAT、GSH和GSH-Px的影响
Table 1 Effect of crude extract of total flavonoids from L. obtusifolium fruit on CAT, GSH and GSH-Px in liver tissues of rats
组别 CAT/
(U·mgprot-1)GSH/
(μmol·gprot-1)GSH-Px/
(U·mgprot-1)C 20.53±0.47 d 50.78±0.99 d 82.54±0.84 d L 26.49±0.50 c 60.20±0.67 c 108.40±1.35 c M 30.84±0.95 b 71.46±1.30 b 123.44±0.90 b H 34.91±0.61 a 77.47±0.74 a 131.06±0.79 a 注:同列内不同小写字母表示经Duncan氏新复极差法检验在0.05水平下差异显著。
Note: Different letters in the columns indicate significant difference at P<0.05 level by Duncan’s new multiple range test. -
[1] 余蕾. 水蜡果实色素的提取及色素性质的研究 [J]. 食品研究与开发, 2015, 36(21):72−74. DOI: 10.3969/j.issn.1005-6521.2015.21.019 YU L. Study on the properties and extraction of pigment from Ligustrum obtusifolium Sieb. et Zuce. [J]. Food Research and Development, 2015, 36(21): 72−74.(in Chinese) DOI: 10.3969/j.issn.1005-6521.2015.21.019
[2] 冯海华. 水蜡树的观赏特性及在城市绿化中的应用 [J]. 河北林业科技, 2013(4):92−93, 98. DOI: 10.3969/j.issn.1002-3356.2013.04.035 FENG H H. The ornamental characteristics of Ligustrum obtusifolium and their application in urban greening [J]. Journal of Hebei Forestry Science and Technology, 2013(4): 92−93, 98.(in Chinese) DOI: 10.3969/j.issn.1002-3356.2013.04.035
[3] CZERWIŃSKA M E, GRANICA S, KISS A K. Effects of an aqueous extract from leaves of Ligustrum vulgare on mediators of inflammation in a human neutrophils model [J]. Planta Medica, 2013, 79(11): 924−932. DOI: 10.1055/s-0032-1328718
[4] HAMDI H K, CASTELLON R. Oleuropein, a non-toxic olive iridoid, is an anti-tumor agent and cytoskeleton disruptor [J]. Biochemical and Biophysical Research Communications, 2005, 334(3): 769−778. DOI: 10.1016/j.bbrc.2005.06.161
[5] ANDREADOU I, ILIODROMITIS E K, MIKROS E, et al. The olive constituent oleuropein exhibits anti-ischemic, antioxidative, and hypolipidemic effects in anesthetized rabbits [J]. Journal of Nutrition, 2006, 136(8): 2213−2219. DOI: 10.1093/jn/136.8.2213
[6] AL-AZZAWIE H F, ALHAMDANI M S S. Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits [J]. Life Sciences, 2006, 78(12): 1371−1377. DOI: 10.1016/j.lfs.2005.07.029
[7] SUH W S, KWON O K, LEE T H, et al. Secoiridoid glycosides from the twigs of Ligustrum obtusifolium possess anti-inflammatory and neuroprotective effects [J]. Chemical and Pharmaceutical Bulletin, 2018, 66(1): 78−83.
[8] LEE S I, OH S H, PARK K Y, et al. Antihyperglycemic effects of fruits of privet (Ligustrum obtusifolium) in streptozotocin-induced diabetic rats fed a high fat diet [J]. Journal of Medicinal Food, 2009, 12(1): 109−117. DOI: 10.1089/jmf.2007.0000
[9] 何国鑫, 陈华国, 邓青芳, 等. 黄酮类化合物抗肝损伤的作用机制研究进展 [J]. 中国现代应用药学, 2019, 36(12):1583−1591. HE G X, CHEN H G, DENG Q F, et al. Research progress of hepatoprotective mechanism of flavonoids [J]. Chinese Journal of Modern Applied Pharmacy, 2019, 36(12): 1583−1591.(in Chinese)
[10] 赵美莲, 于春艳, 史晓晶. 水蜡树果实总黄酮提取工艺优化及其抗氧化活性 [J]. 福建农业学报, 2018, 33(2):206−211. ZHAO M L, YU C Y, SHI X J. Process optimization and antioxidant activity of flavonoids extracted from fruits of Ligustrum obtusifolium [J]. Fujian Journal of Agricultural Sciences, 2018, 33(2): 206−211.(in Chinese)
[11] 张素华, 王正云. 大孔树脂纯化芦笋黄酮工艺的研究 [J]. 食品科学, 2006, 27(2):182−186. DOI: 10.3321/j.issn:1002-6630.2006.02.039 ZHANG S H, WANG Z Y. Study on adsorption and separation by macroporous resin for asparagus flavonoids [J]. Food Science, 2006, 27(2): 182−186.(in Chinese) DOI: 10.3321/j.issn:1002-6630.2006.02.039
[12] 吴娜. 艾蒿黄酮的提取分离纯化、结构鉴定及其抗氧化性研究[D]. 武汉: 华中农业大学, 2008. WU N. Extraction, purification and antioxidation of flavonoids from Artemisia argyi[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese)
[13] 梅光明, 张小军, 郝强, 等. 酸提香菇多糖的抗氧化活性研究 [J]. 浙江海洋学院学报(自然科学版), 2014, 33(5):406−413. MEI G M, ZHANG X J, HAO Q, et al. Antioxidant activity of polysaccharide from Lentinus edodes extracted by acid solution [J]. Journal of Zhejiang Ocean University (Natural Science), 2014, 33(5): 406−413.(in Chinese)
[14] 冯博, 钱晔, 吴奇, 等. ABTS法研究高压脉冲电场对普洱熟茶抗氧化活性的影响 [J]. 云南农业大学学报(自然科学), 2019, 34(5):815−819. FENG B, QIAN Y, WU Q, et al. Study on effects of high voltage pulsed electric field on the activity of antioxidant of Pu'er ripe tea by ABTS assays [J]. Journal of Yunnan Agricultural University (Natural Science), 2019, 34(5): 815−819.(in Chinese)
[15] SANTOS C X C, NABEEBACCUS A A, SHAH A M, et al. Endoplasmic reticulum stress and nox-mediated reactive oxygen species signaling in the peripheral vasculature: potential role in hypertension [J]. Antioxidants and Redox Signaling, 2014, 20(1): 121−134.
[16] GÜLÇIN İ, ELIAS R, GEPDIREMEN A, et al. Antioxidant activity of bisbenzylisoquinoline alkaloids from Stephania rotunda: cepharanthine and fangchinoline [J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2010, 25(1): 44−53. DOI: 10.3109/14756360902932792
[17] GÜLÇIN İ, ELMASTAŞ M, ABOUL-ENEIN H Y. Antioxidant activity of clove oil: a powerful antioxidant source [J]. Arabian Journal of Chemistry, 2012, 5(4): 489−499. DOI: 10.1016/j.arabjc.2010.09.016
[18] 任薇, 包晓玮, 张志芳, 等. 沙棘多糖清除自由基及抗脂质过氧化作用研究 [J]. 食品工业科技, 2019, 40(8):272−277. REN W, BAO X W, ZHANG Z F, et al. Study on free radical scavenging and anti-lipid peroxidation of seabuckthorn polysaccharide [J]. Science and Technology of Food Industry, 2019, 40(8): 272−277.(in Chinese)
[19] GIL L, SIEMS W, MAZUREK B, et al. Age-associated analysis of oxidative stress parameters in human plasma and erythrocytes [J]. Free Radical Research, 2006, 40(5): 495−505. DOI: 10.1080/10715760600592962
[20] PARADIES G, PARADIES V, RUGGIERO F M, et al. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease [J]. World Journal of Gastroenterology, 2014, 20(39): 14205−14218. DOI: 10.3748/wjg.v20.i39.14205
[21] 马爱国, 刘四朝. 不同剂量维生素C对DNA氧化损伤影响的研究 [J]. 营养学报, 2001, 23(1):12−15. DOI: 10.3321/j.issn:0512-7955.2001.01.004 MA A G, LIU S C. Effect of different levels of ascorbic acid on DNA damage [J]. Acta Nutrimenta Sinica, 2001, 23(1): 12−15.(in Chinese) DOI: 10.3321/j.issn:0512-7955.2001.01.004
[22] NORDBERG J, ARNÉR E S J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system [J]. Free Radical Biology and Medicine, 2001, 31(11): 1287−1312. DOI: 10.1016/S0891-5849(01)00724-9
[23] ESPOSITO L A, KOKOSZKA J E, WAYMIRE K G, et al. Mitochondrial oxidative stress in mice lacking the glutathione peroxidase-1 gene [J]. Free Radical Biology and Medicine, 2000, 28(5): 754−766. DOI: 10.1016/S0891-5849(00)00161-1
[24] PASSARDI F, THEILER G, ZAMOCKY M, et al. PeroxiBase: the peroxidase database [J]. Phytochemistry, 2007, 68(12): 1605−1611. DOI: 10.1016/j.phytochem.2007.04.005
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载: