SNW-1 Magnetic Solid Phase Extraction for HPLC Detection of Sulfonamides Residue in Milk
-
摘要:目的 制备磁性共价有机骨架材料(Fe3O4@SNW-1)作为磁性固相萃取吸附剂,建立牛奶中磺胺类药物(SAs)的高效液相色谱(HPLC)测定方法。方法 通过水热法合成Fe3O4@SNW-1,并通过研究吸附剂用量、吸附时间、洗脱剂、洗脱时间等影响因素,优化磁性固相萃取磺胺类药物的回收率,最后通过高效液相色谱法(HPLC)检验优化后方法的效果。结果 优化后的MSPE条件:即用2.0 mL氨水-甲醇(5 ∶ 95,v/v)作为洗脱溶剂,解吸时间设为60 s,吸附剂Fe3O4@SNW-1的用量为4.0 mg,吸附时间为120 s,pH值为6.0。经优化后,5种SAs的线性范围为10~100 ng·mL−1,相关系数在0.995以上,检出限为1.7~2.7 ng·mL−1。5种SAs(每种50 ng·mL−1)的5次重复提取的日间RSDs为2.8%~4.7%。5种SAs的回收率在72.0%~95.0%结论 该方法方便快捷,选择性好,分离效果高,对牛奶中痕量磺胺类药物含量的检测效果良好。Abstract:Objective Fe3O4@SNW-1 was prepared as an adsorbent in the magnetic solid phase extraction (MSPE) to pre-treat samples for HPLC determination on sulfonamides (SAs) in milk.Method A magnetic covalent organic framework (COF) material, Fe3O4@SNW-1, was hydrothermally synthesized to serve as the adsorbent in MSPE for the sample pretreatment. Parameters for the pretreatment, including adsorbent usage, adsorption duration, eluent selection, and elution time that affected the extract recovery, were optimized. HPLC was used to evaluate and determine the validity of the methodology.Result The optimized MSPE applying 2.0 mL ammonia-methanol (5 ∶ 95, V/V) as elution solvent, 60s for desorption, 4.0 mg of Fe3O4@SNW-1 as adsorbent, 120 s for adsorption at pH 6.0 to achieve linearities in the ranges between 10 ng·mL−1 and 100 ng·mL−1 on detecting 5 different SAs with correlation coefficients greater than 0.995. The HPLC detection limit on the SAs was 1.7-2.7 ng·mL−1. The daytime RSDs of 5 extraction replicates on the SAs (50 ng·mL−1 each) were 2.8–4.7%. The recovery rates on the SAs varied from 72.0% to 95.0%.Conclusion The proposed HPLC method with the MSPE sample pretreatment was convenient, rapid, specific, and effective for the determination of trace amounts of SA residues in milk.
-
0. 引言
【研究意义】磺胺类药物(Sulfonamides, SAs)是一类用于细菌性疾病的预防与治疗的化学治疗药物[1-2]。该药物因抑菌效果好、价格低廉而被广泛应用于治疗奶牛中频发的乳房炎,故而在牛奶中被检测出的概率很高。SAs在动物性食品中容易残留,长期摄入含SAs的奶制品,将危及人体健康[3]。因此,包括中国在内的许多国家都制定了食品和饲料中SAs的最大允许残留限量和相应的检测方法[4-5]。高效液相色谱-质谱联用是检测SAs在牛奶中残留量的标准方法[6],但由于SAs在牛奶中的浓度低,且牛奶中有如脂肪、蛋白质等干扰物的影响[7],选择性分离牛奶中痕量SAs的前处理显得尤为重要。【前人研究进展】对食品中SAs提取的传统方法为液液萃取,但需消耗大量有机溶剂,共萃取杂质较多,步骤繁杂[8]。而新兴的方法,如超临界萃取[9-10],虽具有环保、快速、无副反应、选择性高等优点,但其需专门的仪器,运行和维护费用昂贵。固相微萃取[11-12]相比于其他萃取方法,操作简便,有机溶剂用量极少,但检测结果相对标准偏差较大。磁性固相萃取[13](Magnetic solid phase extraction, MSPE)是以磁性或可磁化的材料作为吸附剂的一种分散固相萃取技术,具有萃取面积更大、简单便捷、可重复使用且能避免杂质干扰等诸多优点[14-16]。王露等[17]和Tolmacheva等[18]用MSPE对牛乳中的4种SAs进行富集萃取后用HPLC检测其残留量,均取得较为理想的效果。MSPE的核心在于磁性吸附剂,设计并合成具有高效吸附性能的磁性吸附剂是MSPE的关键所在。【本研究切入点】共价有机骨架(Covalent organic frameworks, COFs)[19-20]是一类由有机单体通过共价键形成有周期性网络结构的晶体聚合物。COFs具有比表面积高、密度轻、易修饰及结构稳定等优点。COFs广泛应用于样品前处理中,包含固相萃取、固相微萃取及磁性固相萃取等[21-23]。SNW-1是由三聚氰胺和对苯二胺在一定条件下制备而成的一种席夫碱型COFs[24]。相比其他COFs,SNW-1的合成原料便宜、易得,而且SNW-1具有较高的比表面积。目前,磁性SNW-1的制备及其在样品前处理中的应用还未见相关报道。【拟解决的关键问题】本文通过水热合成法制备磁性SNW-1(Fe3O4@SNW-1),将其作为磁性固相萃取的吸附剂,在萃取与洗脱效果的关键参数上进行优化,结合高效液相色谱,为牛奶中5种痕量磺胺类药物的残留检测提供便捷快速的分析方法。
1. 材料与方法
1.1 仪器与设备
透射电子显微镜(FEI Tecnai G20,美国FEI公司);扫描电子显微镜(FEI Inspect F50,美国FEI公司);冰箱(KG20V31T1,博西家电销售公司);氮吹仪(MG-2200,上海虔钧科学仪器有限公司) ;电子天平(ME204E/02,梅特勒-托利多仪器上海有限公司);超声波清洗器(KQ5200E,昆明市超声仪器有限公司);循环水式真空泵(SHB-III,郑州紫拓仪器设备有限公司);Eclipse XDB-C18(150 mm×4.6 mm,5 μm,Agilent Technologies,USA);高效液相色谱仪[LC-20A,岛津-GL(上海)商贸有限公司];涡旋混合器(Vortex QL-902,上海之信仪器有限公司) ;高速冷冻离心机(GL-21M,长沙湘智离心机仪器有限公司)。
1.2 材料与试剂
六水三氯化铁(FeCl3·6H2O)、醋酸钠、柠檬酸钠二水(Na3Cit·2H2O)、磺胺二甲基嘧啶(Sulfamethazine, SMZ)、磺胺甲基嘧啶(Sulfamerazine, SMR)、磺胺甲噁唑(Sulfamethoxazole, SMX)标准品:上海源叶生物科技有限公司;磺胺嘧啶(Sulfadiazine, SDZ)、磺胺间甲基嘧啶(sulfamonomethoxine, SMM)标准品:上海阿拉丁生化科技股份有限公司;甲醇、乙腈、醋酸铅:国药集团化学试剂有限公司;氨水、乙酸:西陇科技股份有限公司;伊利牛奶:内蒙古伊利实业集团股份有限公司。
1.3 试验方法
1.3.1 Fe3O4的制备
将FeCl3·6H2O(6.8 g)、醋酸钠(12.0 g)和Na3Cit·2H2O(2.0 g)溶解在200 mL乙二醇中,将所得黄色的均相溶液放进高压反应釜中加热(200 ℃,10 h)。反应结束后,用磁铁将Fe3O4从产品中分离出来后用清水和乙醇反复清洗干净,真空环境下80 ℃干燥12 h。
1.3.2 磁性共价有机骨架材料的制备
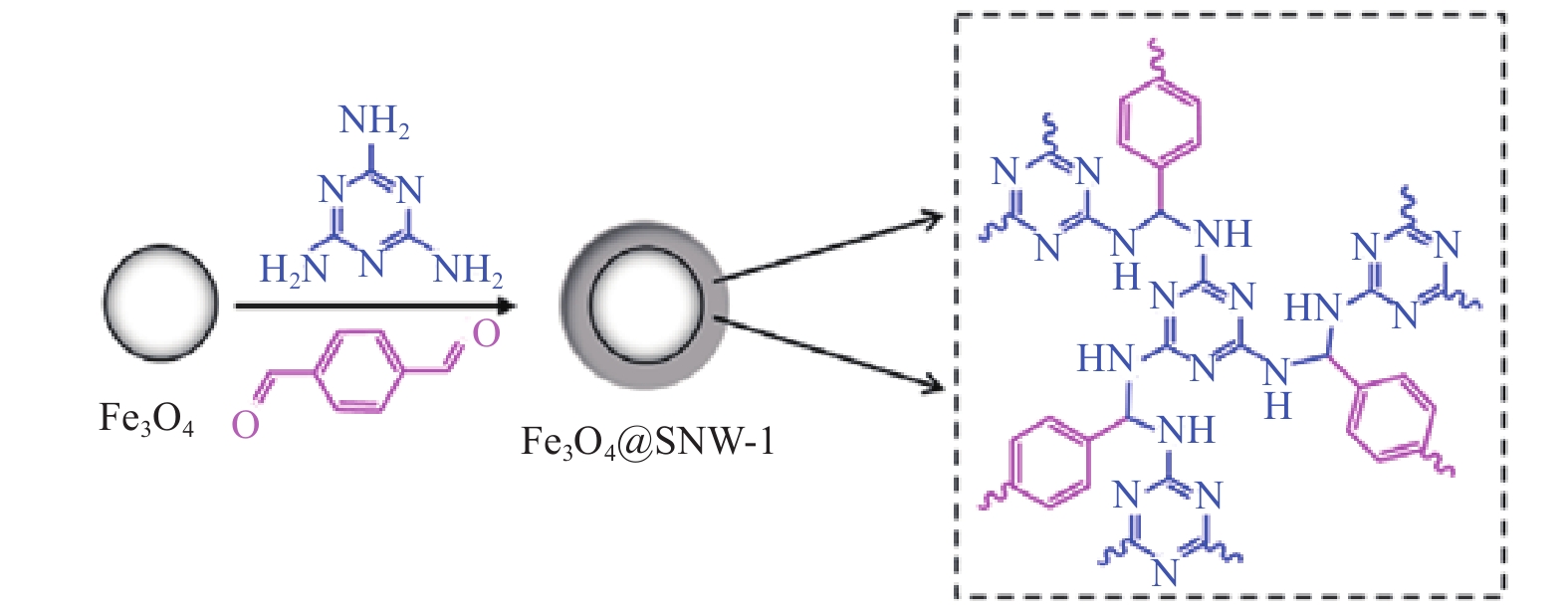
将2.0 g三聚氰胺溶解于62 mL二甲基亚砜(DMSO)中,其次将0.3 g Fe3O4分散于上述溶液并超声分散10 min,最后加入1.26 g对苯二甲醛,在180 ℃条件下机械搅拌6 h。反应结束后,依次使用丙酮、二氯甲烷和三氟乙酸将磁性材料清洗干净,并在80 ℃的真空条件下过夜干燥,得到磁性复合物Fe3O4@SNW-1,其结构示意图如图1。
1.3.3 磁性固相萃取(MSPE)条件的优化
(1)MSPE温度和时间的优化
保持其他磁性固相萃取条件不变,测定不同吸附剂用量(1.0~6.0 mg)和在不同水浴吸附时间(15、60、120和150 s)下SAs的回收率。
(2)溶液pH和离子强度的优化
保持其他磁性固相萃取条件不变,测定不同样品溶液pH值(2、4、6、7、8、10)以及NaCl剂量(0、0.01、0.02、0.04、0.06、0.08、0.10 mol·L−1)下SAs的回收率。
(3)洗脱剂种类的选择
保持其他磁性固相萃取条件不变,测定不同洗脱溶剂[v(氨水)∶v(甲醇)= 5∶95, v(乙酸)∶v(甲醇)=5∶95, v(氨水)∶ v(乙腈)= 5∶95, v(乙酸)∶v(乙腈)=5∶95,乙腈,甲醇]下SAs的回收率。
(4)洗脱剂用量和洗脱时间的优化
保持其他磁性固相萃取条件不变,考察洗脱剂用量变化(0.5、1、1.5、2、2.5、3 mol·L−1)以及洗脱时间变化(15、30、45、60、75、90 s)下SAs的回收率。
1.3.4 高效液相色谱检测条件
配备有2个LC-20AT溶剂输送单元和SPD-M20A PDA检测器(Shimadzu, Kyoto, Japan)的LC-20A HPLC系统,检测器的检测波长:269 nm;C18柱(Eclipse XDB-C18,150 mm×4.6 mm,5 μm,Agilent Technologies,USA);流动相:乙腈-乙酸水(含1%乙酸)(20∶80,v/v),等梯度洗脱;进样量:20 μL;流速:1.00 mL·min−1;柱温:25 ℃。
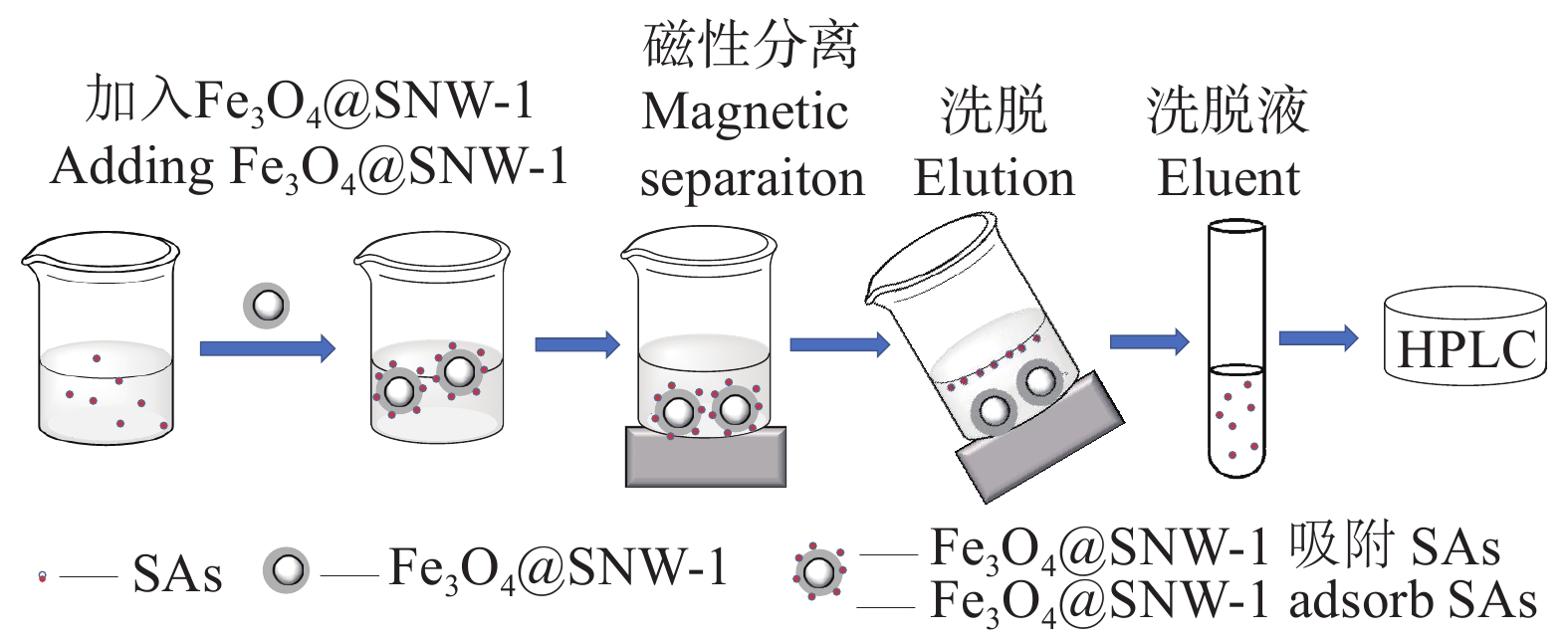
1.3.5 SAs的MSPE操作流程
SAs吸附与富集整个MSPE技术操作流程详见图2。首先,将4.0 mg Fe3O4@SNW-1加入10 mL样品溶液,涡旋2 min,用磁铁将Fe3O4@SNW-1与溶液分离并倒掉溶液。其次,加入2 mL洗脱剂,涡旋1 min,磁铁将Fe3O4@SNW-1与洗脱液分离,将收集的洗脱液在40 ℃下氮吹至干。最后,用0.5 mL乙腈-乙酸水(含1%乙酸)(20∶80,v/v)的流动相定容待测样品,用针管移至进样瓶中,待上机检测。
1.3.6 空白牛奶和加标牛奶样品前处理
准确称取250 mL的牛奶(配置100 ng·mL−1的磺胺类药物的牛奶250 mL),加入16%醋酸铅250 mL,搅拌,超声数分钟直至混匀,装入等量离心瓶中,放入高速冷冻离心机,转速为4 000 r·min−1,离心15 min,取出,收集离心瓶中的上清液备用。
2. 结果与分析
2.1 合成材料的结构表征
2.1.1 透射电镜表征
由透射电镜表征结果见图3-A,可以看出Fe3O4磁粒子是规则的圆球,粒径为200~400 nm。从图3-B中可清晰发现,在Fe3O4磁粒子的表面包裹了一层致密的纳米级颗粒构成的核壳结构的复合材料即Fe3O4@SNW-1。透射电镜结果可证实SNW-1已成功负载在Fe3O4磁粒子上,制备成具有核壳结构的Fe3O4@SNW-1复合材料。
2.1.2 X射线衍射(X-ray diffraction Analysis, XRD)表征
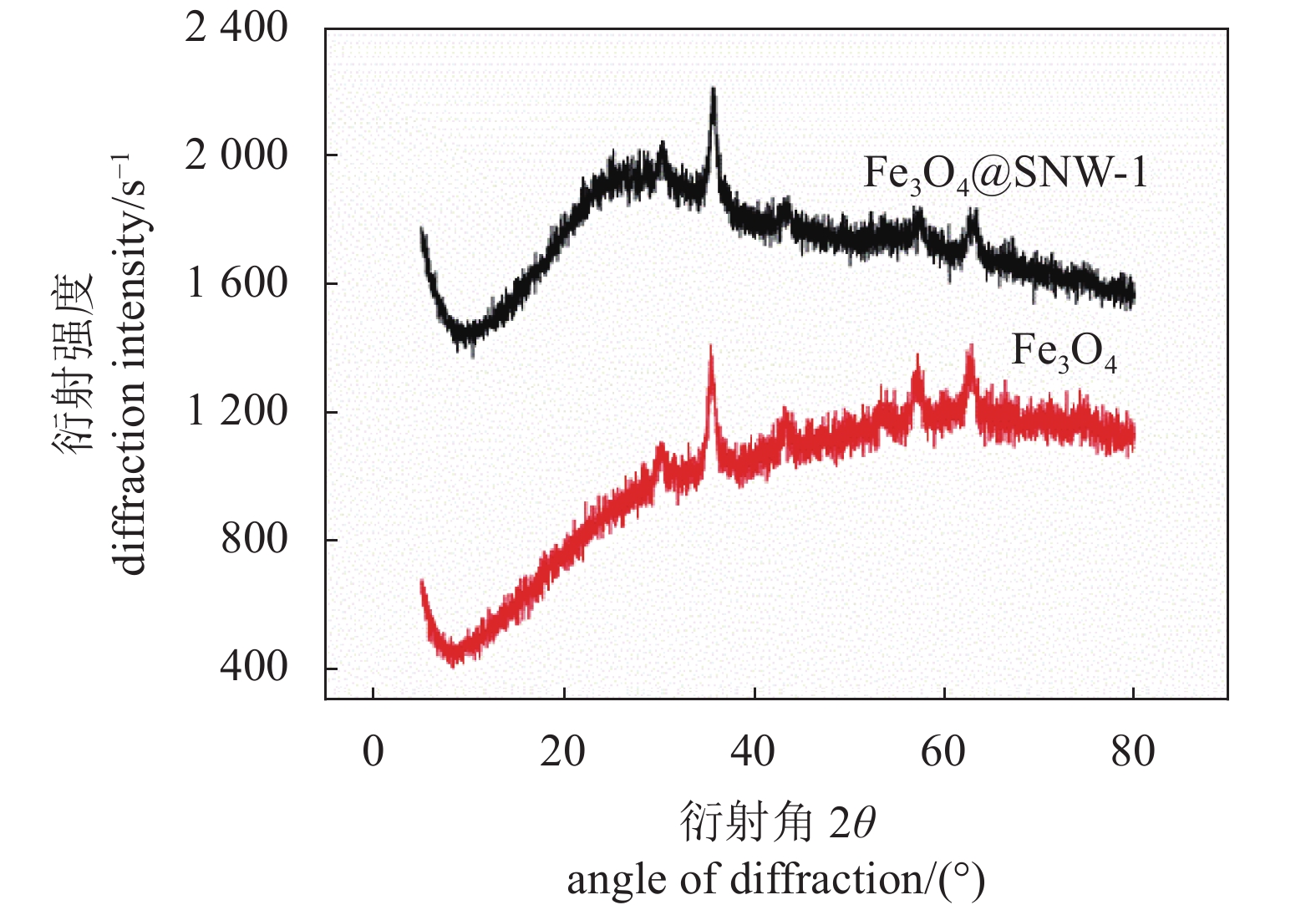
图4为Fe3O4和Fe3O4@SNW-1晶体结构的XRD衍射表征。从结果可以看出,Fe3O4@SNW-1的XRD衍射峰包含了Fe3O4所有的特征衍射峰。此外在25 °左右出现1个较宽的衍射峰,是SNW-1的特征衍射峰,说明SNW-1是一种无定型结构。XRD的结果充分说明了本试验成功制备了Fe3O4@SNW-1复合材料。
2.1.3 氮气吸附表征(Nitrogen adsorption-desorption)
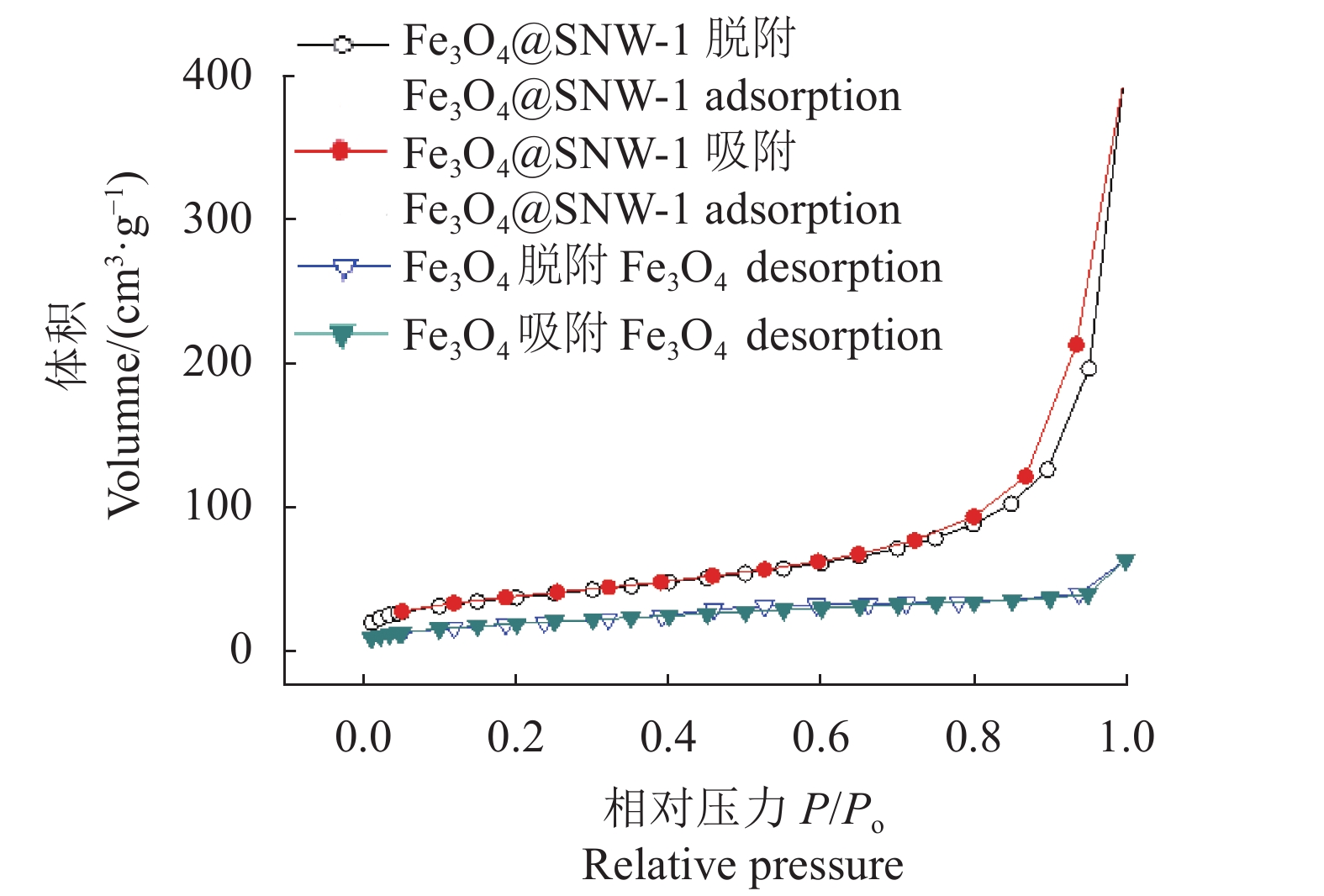
Fe3O4和Fe3O4@SNW-1的多孔特性通过氮气吸附表征,氮气吸附-脱附结果,如图5所示。Fe3O4的BET(Brunner-Emmet-Teller)比表面积为69.0 m2·g−1,孔体积为0.096 7 cm3·g−1,孔径为5.6 nm。Fe3O4@SNW-1的BET比表面积为132.7 m2·g−1,孔体积为0.44 cm3·g−1,孔径为18.6 nm。Fe3O4@SNW-1复合材料的BET比表面积、孔体积相比Fe3O4有大幅增加,这主要是因为SNW-1的多孔特性,使其与Fe3O4结合成的复合材料具有更大的比表面积和孔体积。
2.2 MSPE条件优化
2.2.1 吸附剂用量和吸附时间的影响
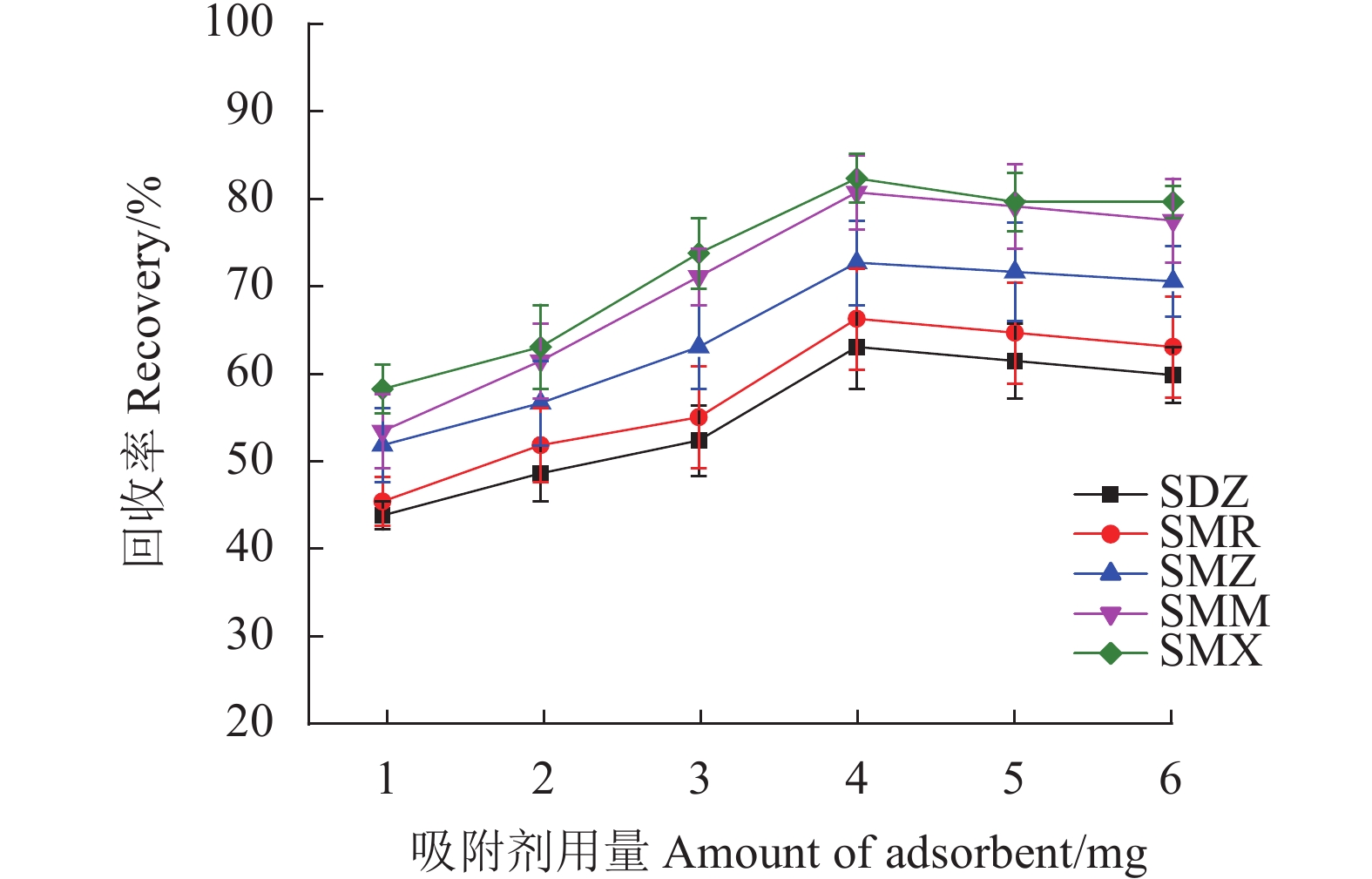
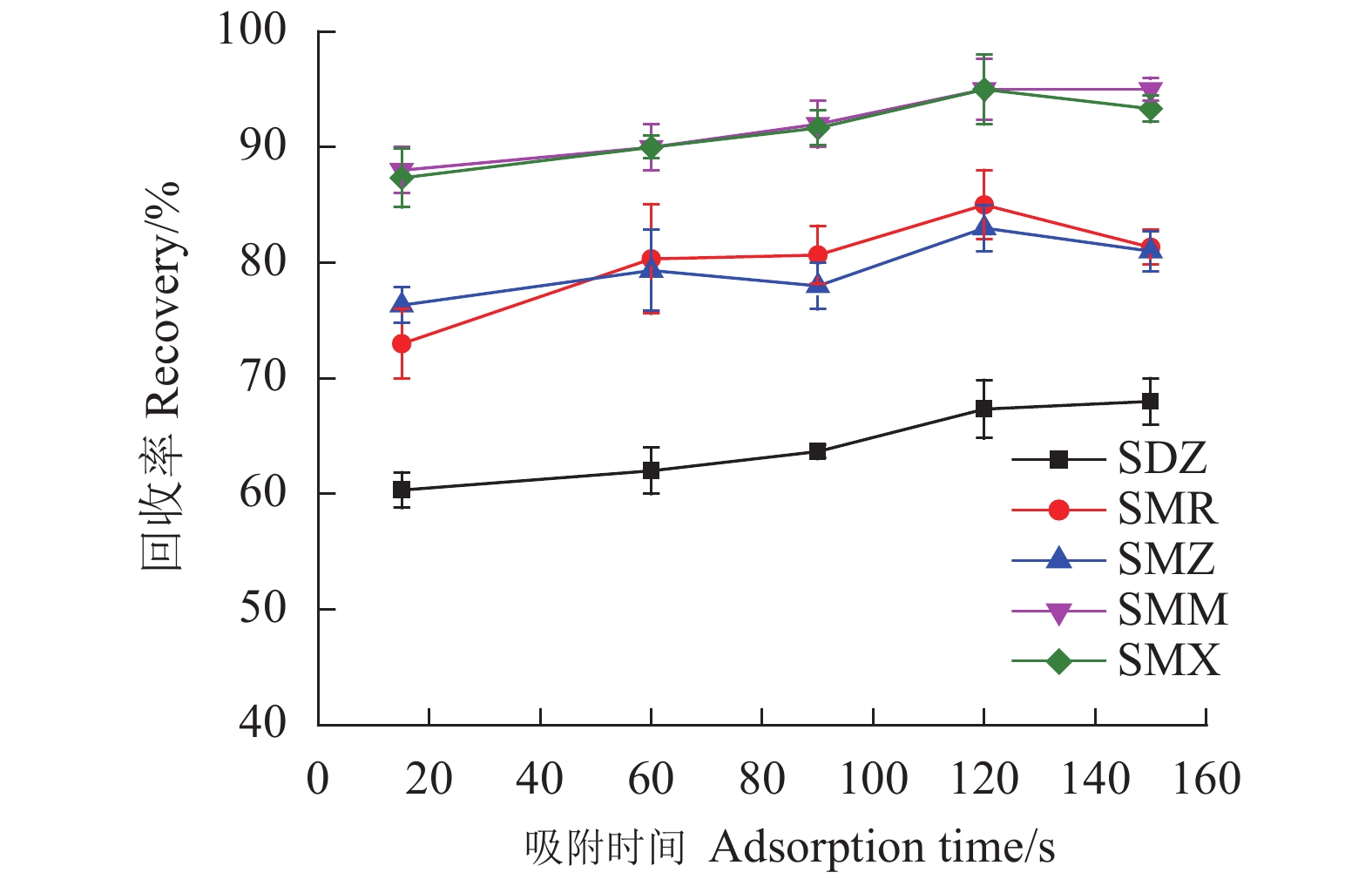
首先考察Fe3O4@SNW-1吸附剂用量在1.0~6.0 mg对样品回收率的影响。如图6所示,随着吸附剂用量从1.0 mg增加到4.0 mg,SAs的回收率增加,当吸附剂用量为4.0 mg时,SAs的回收率最高。在此之后,回收率虽有所波动,但基本趋于平稳。故选择吸附剂Fe3O4@SNW-1的用量4.0 mg用于进一步研究。
考察范围为15~150 s的吸附时间对5种SAs回收率的影响。如图7所示,在所考察的范围内,SAs的回收率较为稳定,在120 s吸附达到平衡,之后回收率基本保持不变。固吸附时间控制在120 s。
2.2.2 溶液pH和离子强度的影响
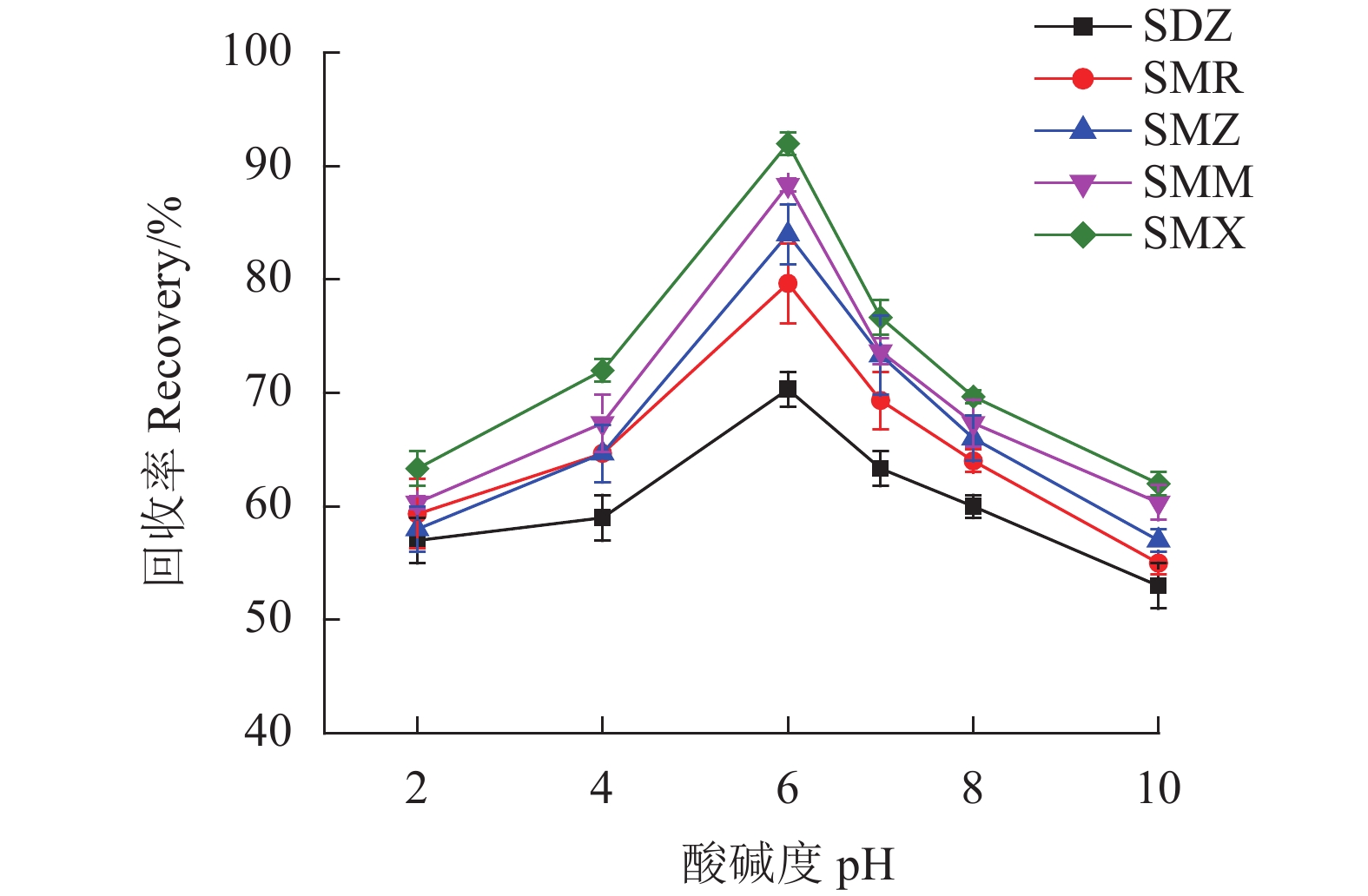
SAs为两性化合物[17],样品溶液的pH值在吸附过程中起着重要作用,因为它会影响吸附剂的表面电荷以及SAs的存在形式,从而影响SAs在MSPE上的吸附率进而影响其回收率。试验中研究了样品溶液的pH值在2.0~10.0对于回收率的影响。从图8可以看出,在pH为6.0时SAs回收率最高。pH为6.0时,大多数SAs将以中性形式存在,小部分以离子形式存在。因而,Fe3O4@SNW-1通过π-π作用力和疏水作用力吸附SAs。故选择样品溶液的pH为6.0。
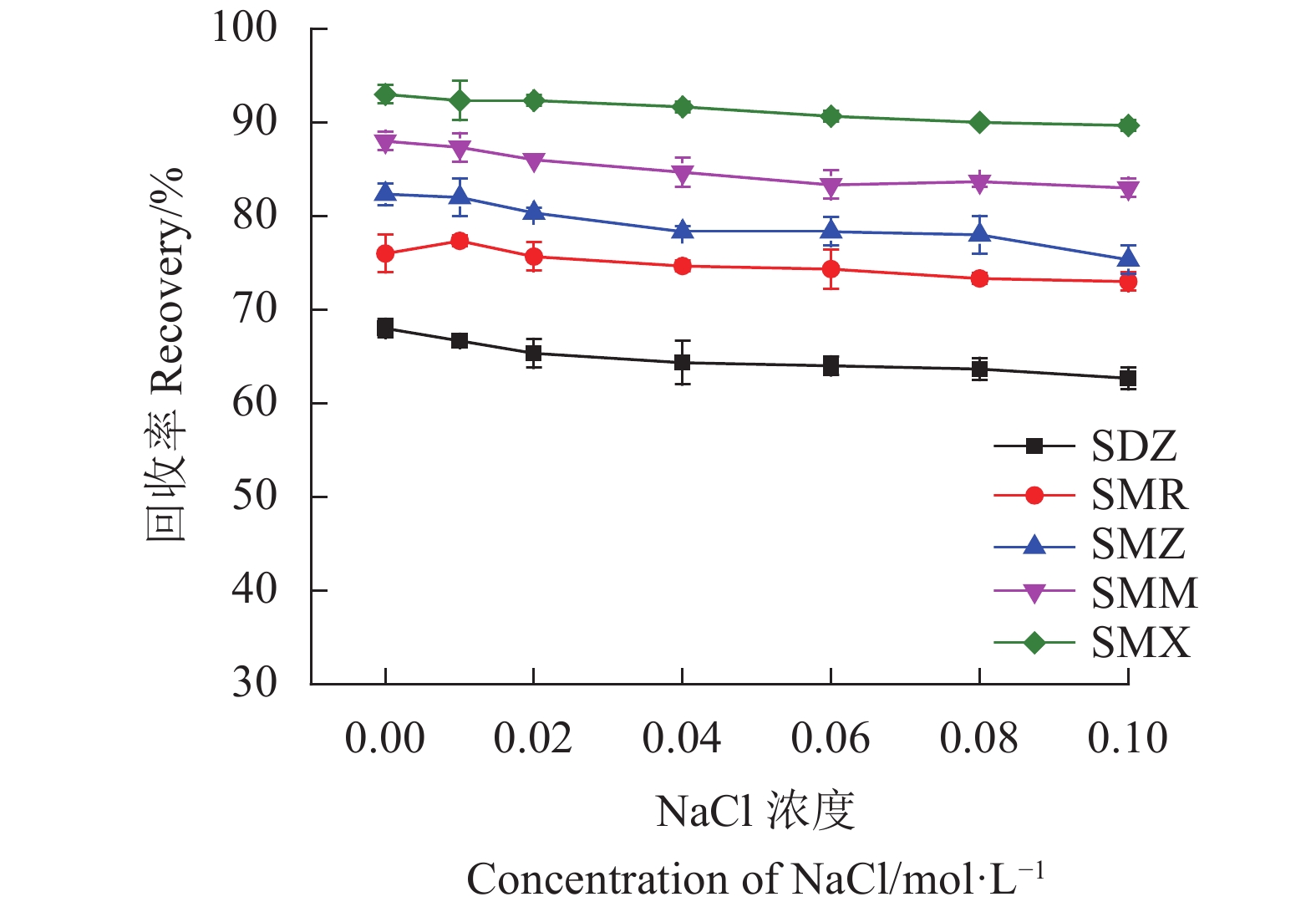
此外,离子强度对SAs回收率的影响见图9。从结果可以看出,离子强度对样品回收率的影响不大。结果说明静电作用力不是Fe3O4@SNW-1吸附SAs的主要吸附机制。相反,π-π相互作用和疏水作用才是Fe3O4@SNW-1吸附SAs的主要吸附机制。因此,在随后的实际样中没有向样品中加入NaCl。
2.2.3 洗脱剂种类的影响
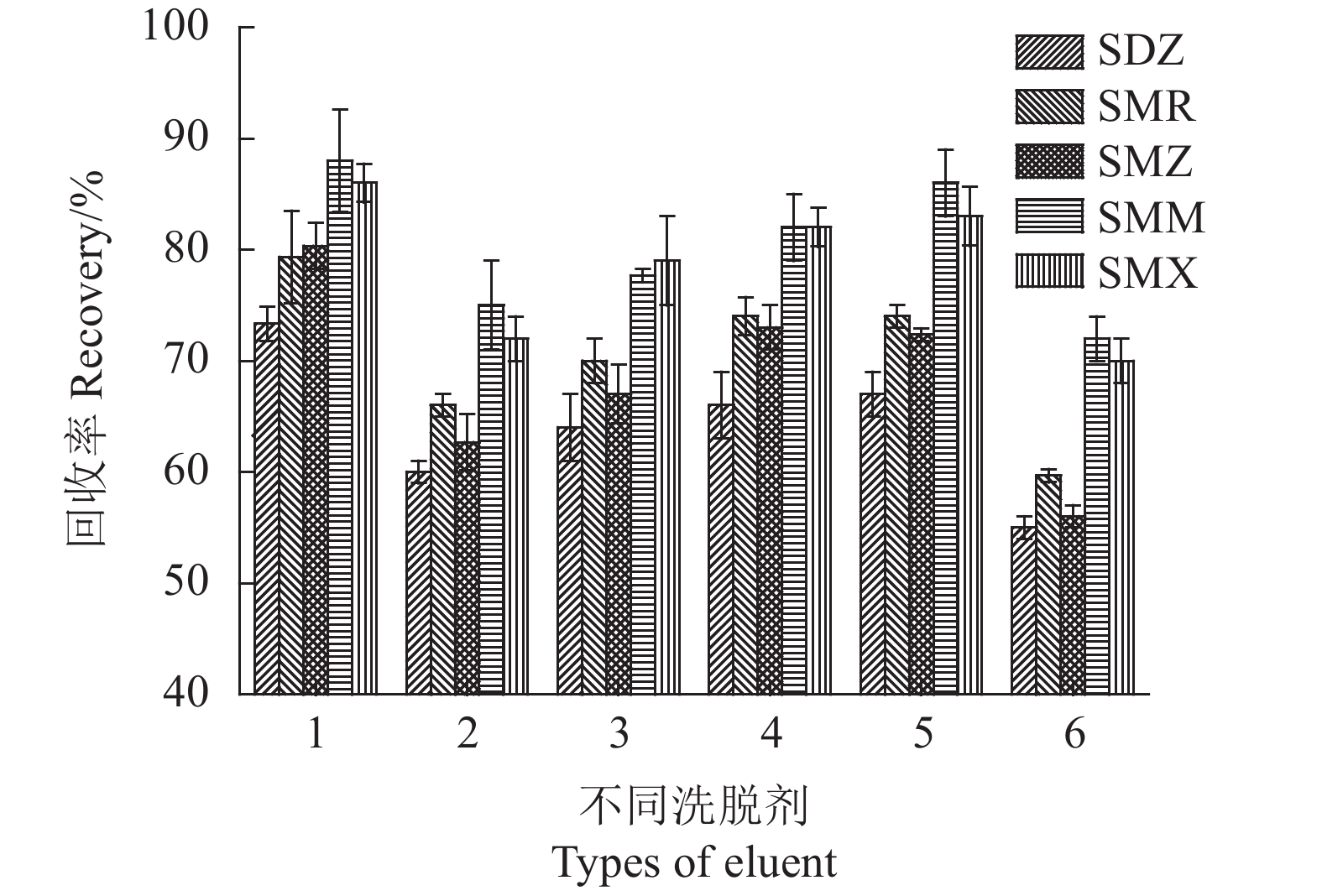
为了从磁性固相萃取中获得SAs较高的回收率,试验使用了磺胺类药物较易溶解的氨水-甲醇(5∶95,v/v)、乙酸-甲醇(5∶95, v/v)、氨水-乙腈(5∶95,v/v)、乙酸-乙腈(5∶95,v/v)、乙腈、甲醇等极性溶剂作为洗脱溶剂,考察其对SAs回收率的影响。如图10所示,氨水-甲醇(5∶95,v/v)溶液在这6种洗脱溶剂中具有最佳洗脱能力。因此,选择氨水-甲醇(5∶95,v/v)作为洗脱溶剂。
![]() 图 10 不同洗脱溶剂的影响注:1.v(氨水): v(甲醇)= 5:95, 2.v(乙酸): v(甲醇)=5:95, 3.v(氨水): v(乙腈)= 5:95, 4.v(乙酸): v(乙腈)=5:95,5.乙腈,6.甲醇。Figure 10. Effect of eluent on testingNote: 1. ammonia -methanol(5:95, v/v); 2. acetic acid - methanol(5:95, v/v); 3. ammonia - acetonitrile(5:95, v/v); 4. acetic acid - acetonitrile(5:95, v/v); 5. acetonitrile; 6. methanol.
图 10 不同洗脱溶剂的影响注:1.v(氨水): v(甲醇)= 5:95, 2.v(乙酸): v(甲醇)=5:95, 3.v(氨水): v(乙腈)= 5:95, 4.v(乙酸): v(乙腈)=5:95,5.乙腈,6.甲醇。Figure 10. Effect of eluent on testingNote: 1. ammonia -methanol(5:95, v/v); 2. acetic acid - methanol(5:95, v/v); 3. ammonia - acetonitrile(5:95, v/v); 4. acetic acid - acetonitrile(5:95, v/v); 5. acetonitrile; 6. methanol.2.2.4 洗脱剂用量及洗脱时间的影响
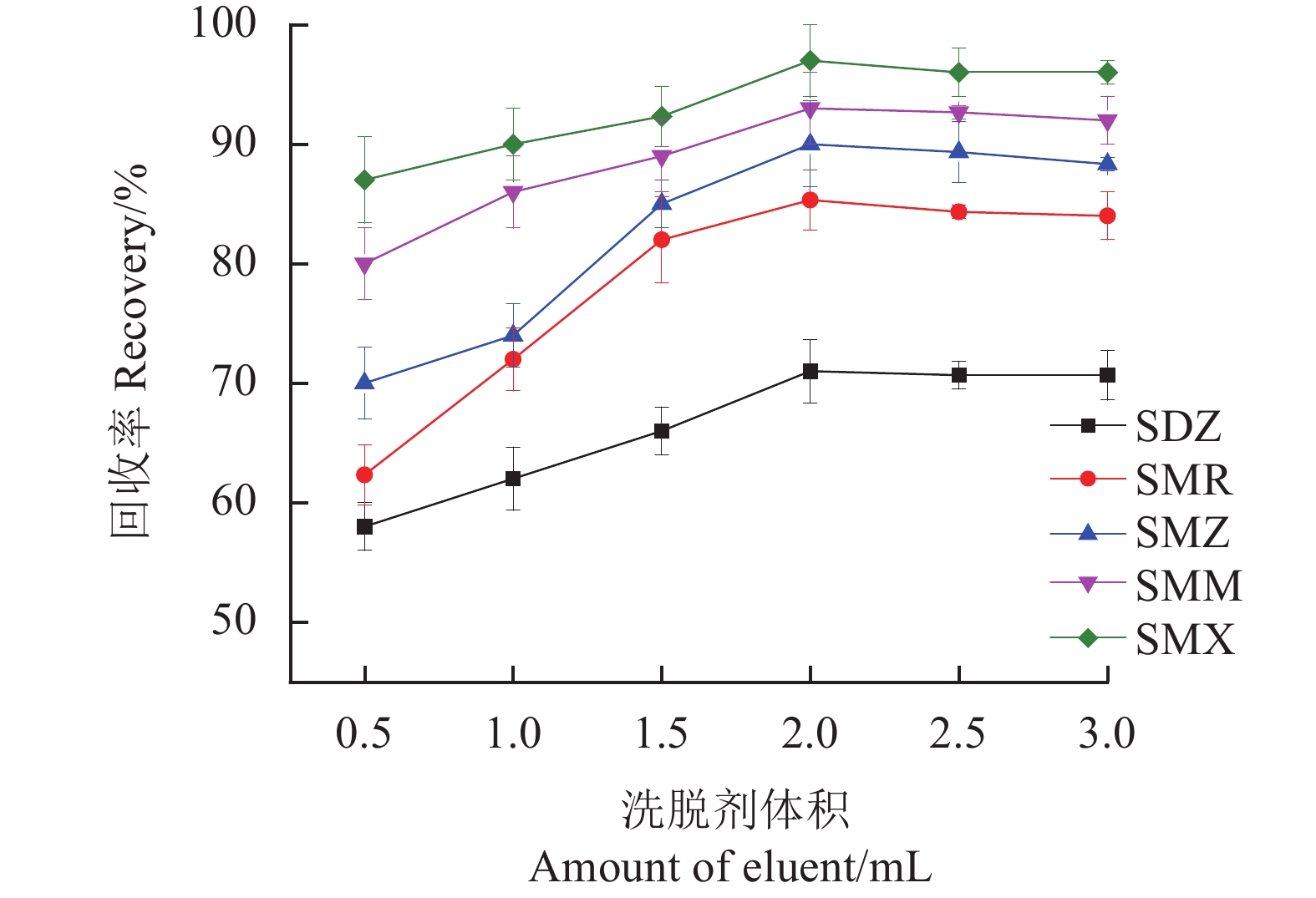
研究氨水-甲醇(5∶95,v/v)从0.5~3.0 mL的剂量范围对SAs回收率的影响。结果如图11所示,随着洗脱剂的体积从0.5 mL增加到2.0 mL,SAs的回收率呈上升趋势,当洗脱量为2.0 mL时,SAs的回收率达到最高。随后SAs的回收率趋于平稳,说明洗脱基本达到平衡,因此将氨水-甲醇(5∶95,v/v)的体积定为2.0 mL。
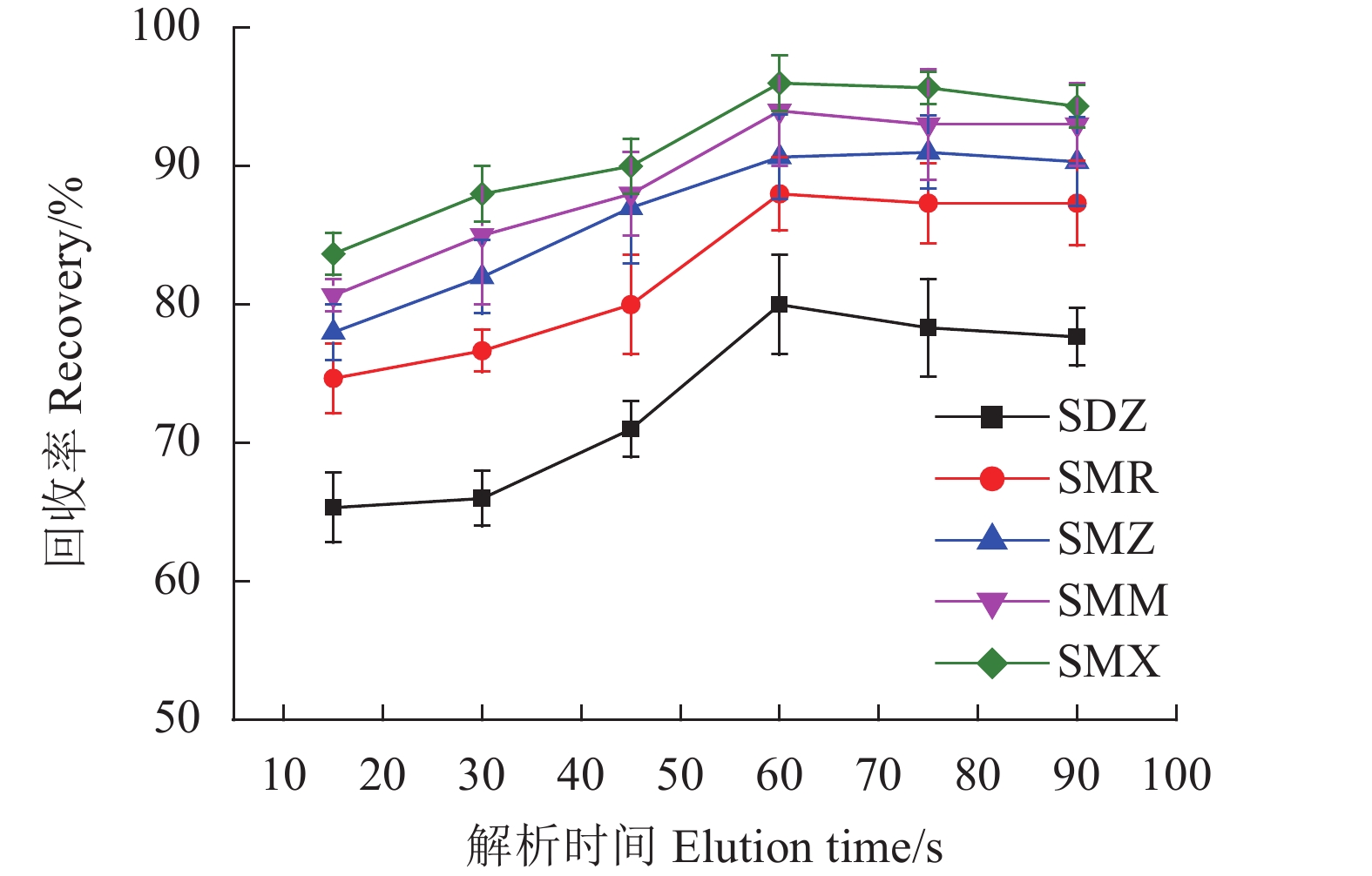
考察了洗脱时间在15~90 s对5种SAs回收率的影响。如图12所示,随着洗脱时间的增加,回收率逐渐加强,当洗脱时间为60 s,回收率达到最高,之后的回收率不再发生明显变化,因此选择洗脱时间为60 s。
2.3 标准曲线、检出限以及精密度
MSPE/HPLC方法对5种SAs混合标准溶液进行测定,并绘制标准曲线。其分析数据见表1。该方法为SAs的10~100 ng·mL−1具有良好的线性,相关系数较高(R2>0.9948)。对于质量浓度为50 ng·mL−1的工作样品的5次重复,所提出的方法的日间精密度(RSD %)为2.4%~3.4%,显示出测定SAs的高精度。
表 1 以磁性COF为吸附剂的MSPE/HPLC测定SAs的检出限及精密度Table 1. Detecting limit and precision of MSPE/HPLC method using magnetic COF as adsorbent on SA determination分析物
Analyte线性范围
Linear range/(ng·mL−1)线性方程
Regression equation相关系数
Correlation coefficient检出限
Limit of detection/(ng·mL−1)相对标准偏差
RSD/%SDZ 10~100 y=643798x−416.89 0.999 0 1.7 3.4 SMR 10~100 y=783 373x−543.79 0.998 1 1.7 2.8 SMZ 10~100 y=697 128x−256.47 0.999 6 2.0 2.4 SMM 10~100 y=754 506x−551 0.999 3 2.4 2.5 SMX 10~100 y=654 838x− 2 976.6 0.994 8 2.7 2.8 2.4 实际样品分析
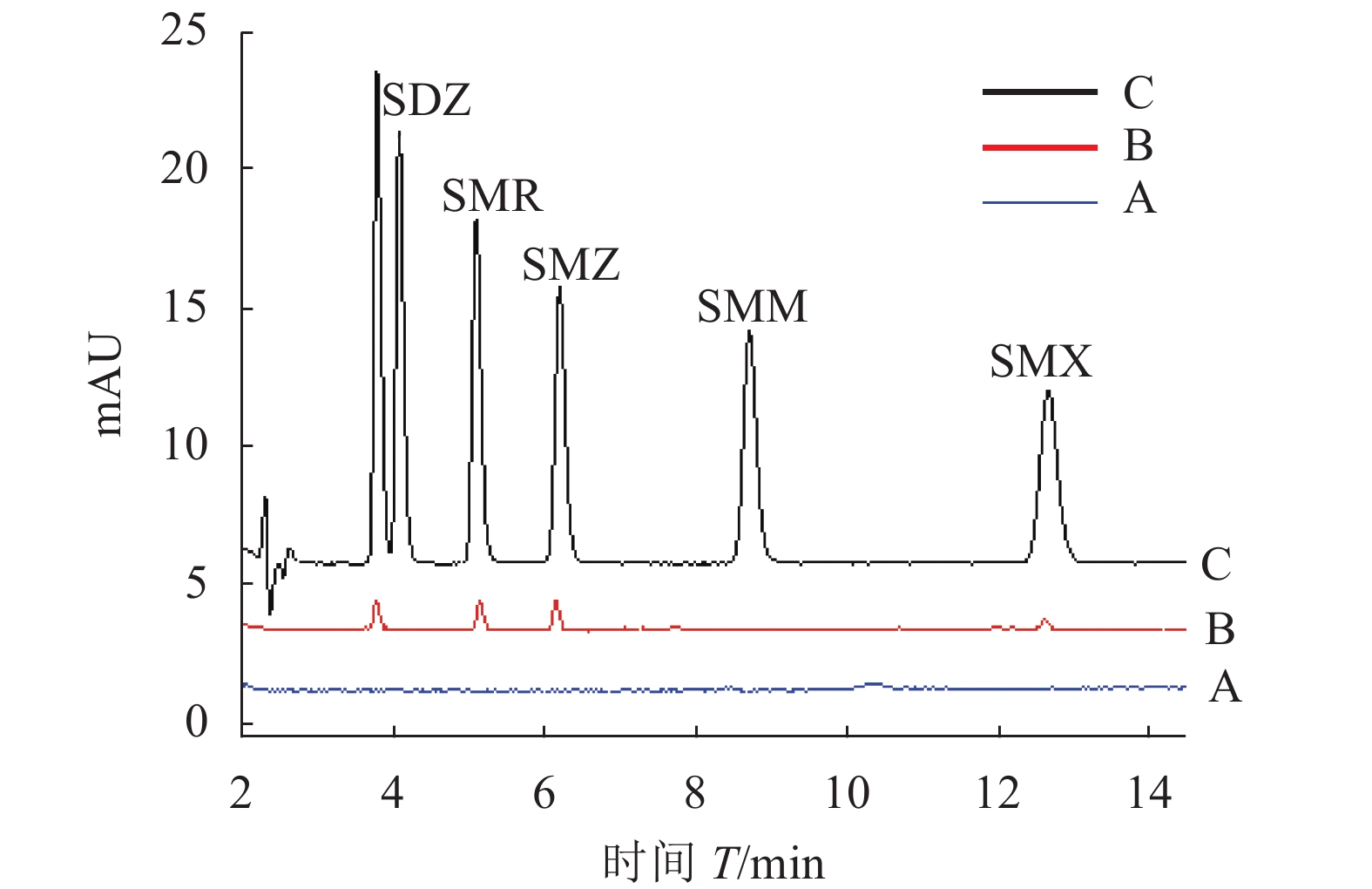
对牛奶样品进行实际分析,以证明该方法的实用性。在牛奶样品中分别加入20、50、100 ng·mL−1的SAs,采用3次重复试验的平均值,进行了加标回收试验。如表2所示,5种SAs的回收率在72%~95%。图13显示了经前处理后空白牛奶样品、添加100 ng·mL−1SAs的加标牛奶样品的色谱图以及用MSPE进行前处理的加标牛奶样品的色谱图,从图中可以看出,5种磺胺类组分峰与杂质能很好分离,且峰形好,在13 min内能完成样品的检测。以上结果表明,所建立的MSPE/HPLC方法对复杂的牛奶样品中痕量SAs的同时分离和测定是切实可行的。
表 2 牛奶样品中SAs的分析结果Table 2. Analysis of SAs in milk samples分析物
Analyte添加量
Added/(ng·g−1)牛奶 Milk 测定值
Found/(ng·g−1)回收率
Recovery/%相对标准偏差
RSD/%SDZ 0 ND – – 20 16.8 84 3.2 50 38.5 77 2.8 100 72 72 4.4 SMR 0 ND – – 20 18.6 93 6.1 50 41 82 4.6 100 79 79 5.3 SMZ 0 nd – – 20 19 95 2.3 50 41.5 83 3.5 100 81 81 5.8 SMM 0 ND – – 20 16.6 83 4.9 50 40 80 3.1 100 81 81 5.9 SMX 0 ND – – 20 17.6 88 5.7 50 44 88 4.7 100 86 86 3.4 注:ND: 未检出。
Note:ND means not detected.2.5 方法比较
为了评估Fe3O4@SNW-1作为磁性固相萃取的吸附剂的性能,从吸附剂的量、样品量、洗脱量和LODs的角度,将其与前人采用MSPE对SAs前处理的效果的测定方法进行了比较[18, 25-27]。结果表明(表3) :当前所提出的方法仅需要4 mg吸附剂,这比大多数已报道的方法要小,表明Fe3O4@SNW-1对SAs的吸附能力优异。另外,目前的方法消耗的样品和洗脱量很少,可以减少操作时间并满足实际应用,且与其他磁性固相萃取技相比,只需较短的萃取时间就能实现高效萃取。最后,与报道的方法相比,当前方法的灵敏度优于或与已报道的方法相当。因此,所提出的MSPE/HPLC方法可用于复杂基质中痕量SAs的灵敏测定。
表 3 所提方法与文献中其他方法的比较Table 3. Comparison between MSPE/HPLC and other existing methods吸附剂
Sorbent方法
Method样品
Sample吸附剂量
Amount of
Sorbent/mg样品容量
Sample volume/
mL萃取时间
Extraction time/
min洗脱剂体积
Elution volume/
mL检测限
LODs/(ng·mL−1)参考文献
ReferenceFe3O4-SiO2-phenyl MSPE/HPLC 牛奶 Milk 100 10 5 3 7~14 [25] Fe3O4-graphene oxide MSPE/HPLC 水 Water 5 1 20 1 50~100 [26] HCP-Fe3O4 MSPE/HPLC 牛奶 Milk 20 25 5 2 2.0~2.5 [18] CoFe2O4-graphene MSPE/HPLC 牛奶 Milk 15 100 20 0.5 1.16~1.59 [27] Fe3O4@SNW-1 MSPE/HPLC 牛奶 Milk 4 10 2 2.0 1.7~2.7 本研究 This work 3. 讨论与结论
MSPE技术富集的样品可以广泛运用于农药残留、食品添加剂、抗生素、激素类及重金属离子,且通过该技术所得的回收率绝大部分在80%~120%,检出限基本都能达到ng·mL−1(或ng·g−1)数量级,加之涵盖了食品分析领域的大部分区域,因此有着极为理想的应用前景[28]。
本研究通过水热法合成Fe3O4@SNW-1作为磁性吸附剂,通过透射电镜表征和X射线衍射,验证制备成具有核壳结构的Fe3O4@SNW-1复合材料,后通过氮气吸附表征,也证明复合材料的多孔性以及比表面积大的特点。该合成方法利用共价有机骨架来修饰磁性纳米颗粒,既保持共价有机骨架具有的由共轭和富含氮的、结构单元构成的微孔网络结构所表现出的吸附富集性能,又缩短萃取材料和溶液的分离时间[25],所用到的磁性吸附剂在目前MSPE当中鲜有报道。
在MSPE吸附过程中Fe3O4@SNW-1可通过π-π作用力和疏水作用力吸附SAs。通过MSPE与HPLC联用,在对吸附剂用量、吸附时间、溶液pH、洗脱剂种类、洗脱剂用量和洗脱时间等参数优化后,可高效检测出牛奶中5种痕量磺胺类药物。本研究所建立方法的检测限在1.7~2.7 ng·mL−1,5种SAs(每种50 ng·mL−1)的5次重复提取的日间RSDs为2.8%~4.7%,样品回收率在72%~95%,标准偏差小于6.1%。整个处理过程中,吸附剂用量为4 mg,吸附时间为120 s,洗脱时间为60 s,相比其他方法在吸附剂用量和前处理时间上明显下降,大幅提高了样品前处理效率。
本试验方法简便、经济,回收率较高、检出限低、精密度高,说明磁性纳米粒子Fe3O4@SNW-1复合物对磺胺类化合物具有较好的吸附能力,有望推广到除牛奶以外的其他SAs的分析检测方法当中。
-
图 10 不同洗脱溶剂的影响
注:1.v(氨水): v(甲醇)= 5:95, 2.v(乙酸): v(甲醇)=5:95, 3.v(氨水): v(乙腈)= 5:95, 4.v(乙酸): v(乙腈)=5:95,5.乙腈,6.甲醇。
Figure 10. Effect of eluent on testing
Note: 1. ammonia -methanol(5:95, v/v); 2. acetic acid - methanol(5:95, v/v); 3. ammonia - acetonitrile(5:95, v/v); 4. acetic acid - acetonitrile(5:95, v/v); 5. acetonitrile; 6. methanol.
表 1 以磁性COF为吸附剂的MSPE/HPLC测定SAs的检出限及精密度
Table 1 Detecting limit and precision of MSPE/HPLC method using magnetic COF as adsorbent on SA determination
分析物
Analyte线性范围
Linear range/(ng·mL−1)线性方程
Regression equation相关系数
Correlation coefficient检出限
Limit of detection/(ng·mL−1)相对标准偏差
RSD/%SDZ 10~100 y=643798x−416.89 0.999 0 1.7 3.4 SMR 10~100 y=783 373x−543.79 0.998 1 1.7 2.8 SMZ 10~100 y=697 128x−256.47 0.999 6 2.0 2.4 SMM 10~100 y=754 506x−551 0.999 3 2.4 2.5 SMX 10~100 y=654 838x− 2 976.6 0.994 8 2.7 2.8 表 2 牛奶样品中SAs的分析结果
Table 2 Analysis of SAs in milk samples
分析物
Analyte添加量
Added/(ng·g−1)牛奶 Milk 测定值
Found/(ng·g−1)回收率
Recovery/%相对标准偏差
RSD/%SDZ 0 ND – – 20 16.8 84 3.2 50 38.5 77 2.8 100 72 72 4.4 SMR 0 ND – – 20 18.6 93 6.1 50 41 82 4.6 100 79 79 5.3 SMZ 0 nd – – 20 19 95 2.3 50 41.5 83 3.5 100 81 81 5.8 SMM 0 ND – – 20 16.6 83 4.9 50 40 80 3.1 100 81 81 5.9 SMX 0 ND – – 20 17.6 88 5.7 50 44 88 4.7 100 86 86 3.4 注:ND: 未检出。
Note:ND means not detected.表 3 所提方法与文献中其他方法的比较
Table 3 Comparison between MSPE/HPLC and other existing methods
吸附剂
Sorbent方法
Method样品
Sample吸附剂量
Amount of
Sorbent/mg样品容量
Sample volume/
mL萃取时间
Extraction time/
min洗脱剂体积
Elution volume/
mL检测限
LODs/(ng·mL−1)参考文献
ReferenceFe3O4-SiO2-phenyl MSPE/HPLC 牛奶 Milk 100 10 5 3 7~14 [25] Fe3O4-graphene oxide MSPE/HPLC 水 Water 5 1 20 1 50~100 [26] HCP-Fe3O4 MSPE/HPLC 牛奶 Milk 20 25 5 2 2.0~2.5 [18] CoFe2O4-graphene MSPE/HPLC 牛奶 Milk 15 100 20 0.5 1.16~1.59 [27] Fe3O4@SNW-1 MSPE/HPLC 牛奶 Milk 4 10 2 2.0 1.7~2.7 本研究 This work -
[1] 赵超敏, 岳振峰, 吴晖, 等. 液相色谱-串联质谱法测定牛奶中4种雌激素残留 [J]. 现代食品科技, 2014, 30(6):244−249. ZHAO C M, YUE Z F, WU H, et al. Determination of four estrogens residues in milk samples by liquid chromatography-tandem mass spectrometry [J]. Modern Food Science & Technology, 2014, 30(6): 244−249.(in Chinese)
[2] 晏利芝, 赵永彪, 富玉, 等. 超高效液相色谱-串联质谱法同时测定猪肉中β-受体激动剂、喹诺酮类和磺胺类兽药残留量 [J]. 分析试验室, 2011, 30(1):84−86. DOI: 10.3969/j.issn.1000-0720.2011.01.024 YAN L Z, ZHAO Y B, FU Y, et al. Simultaneous determination of β-agonist, quinolones and sulfonamides residues in pork by ultra performance liquid chromatography-electrosp ray ionization tandem mass spectrometry [J]. Chinese Journal of Analysis Laboratory, 2011, 30(1): 84−86.(in Chinese) DOI: 10.3969/j.issn.1000-0720.2011.01.024
[3] 王泽岚, 周艳芬, 孟哲, 等. 核壳聚苯胺选择性磁性固相萃取-高效液相色谱-质谱法测定牛奶中痕量磺胺类药物 [J]. 分析化学, 2019, 47(1):119−128. WANG Z L, ZHOU Y F, MENG Z, et al. Determination of trace sulfonamides antibiotics in milk using polyaniline silicon magnetic composite selective magnetic solid phase extraction combined with high performance liquid chromatography-mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2019, 47(1): 119−128.(in Chinese)
[4] 中华人民共和国国家标准. 食品卫生微生物学检验鲜乳中抗生素残留量检测: GB/T 32738-2016 [S]. 北京: 中国标准出版社, 2008. [5] 吴瑕, 张兰威. 牛乳中抗生素残留及其检测方法的研究进展 [J]. 食品与发酵工业, 2004, 30(7):112−116. DOI: 10.3321/j.issn:0253-990X.2004.07.027 WU X, ZHANG L W. Development of methods for detection of antibiotics residues in milk [J]. Food and Fermentation Industries, 2004, 30(7): 112−116.(in Chinese) DOI: 10.3321/j.issn:0253-990X.2004.07.027
[6] 段婕, 李兴华, 刘坤, 等. 高效液相色谱-化学发光法检测牛奶中磺胺类药物残留 [J]. 分析化学, 2017, 45(7):1012−1018. DOI: 10.11895/j.issn.0253-3820.170110 DUAN J, LI X H, LIU K, et al. Determination of sulfonamide residues in milk by high performance liquid chromatography-chemiluminescence method [J]. Chinese Journal of Analytical Chemistry, 2017, 45(7): 1012−1018.(in Chinese) DOI: 10.11895/j.issn.0253-3820.170110
[7] 李龙飞, 苏敏, 石晓蕾, 等. 磁性固相萃取技术在牛奶中兽药残留检测的应用发展现状 [J]. 乳业科学与技术, 2013, 36(5):35−38. LI L F, SU M, SHI X L, et al. Progress in applications of magnetic solid phase extraction in detection of veterinary drugs residuals in milk [J]. Journal of Dairy Science and Technology, 2013, 36(5): 35−38.(in Chinese)
[8] 王翔, 邓晓军, 宋国新, 等. 食品中磺胺类兽药残留前处理技术的研究进展 [J]. 食品科学, 2009, 30(7):254−257. DOI: 10.3321/j.issn:1002-6630.2009.07.059 WANG X, DENG X J, SONG G X, et al. Research progress on pretreatment technologies of sulfonamides residues in food for their determination [J]. Food Science, 2009, 30(7): 254−257.(in Chinese) DOI: 10.3321/j.issn:1002-6630.2009.07.059
[9] COMBS M T, ASHRAF-KHORASSANI M, TAYLOR L T. Comparison of supercritical CHF3 and CO2 for extraction of sulfonamides from various food matrices [J]. Analytical Chemistry, 1996, 68(24): 4507−4511. DOI: 10.1021/ac960643q
[10] ARANCIBIA V, VALDERRAMA M, RODRIGUEZ P, et al. Quantitative extraction of sulfonamides in meats by supercritical methanol-modified carbon dioxide: A foray into real-world sampling [J]. Journal of Separation Science, 2003, 26(18): 1710−1716. DOI: 10.1002/jssc.200301501
[11] LU K H, CHEN C Y, LEE M R. Trace determination of sulfonamides residues in meat with a combination of solid-phase microextraction and liquid chromatography-mass spectrometry [J]. Talanta, 2007, 72(3): 1082−1087. DOI: 10.1016/j.talanta.2007.01.022
[12] BALAKRISHNAN V K, TERRY K A, TOITO J. Determination of sulfonamide antibiotics in wastewater: A comparison of solid phase microextraction and solid phase extraction methods [J]. Journal of Chromatography A, 2006, 1131(1/2): 1−10.
[13] XUE R, GUO H, WANG T, et al. Fluorescence properties and analytical applications of covalent organic frameworks [J]. Analytical Methods, 2017, 9(25): 3737−3750. DOI: 10.1039/C7AY01261F
[14] QI F F, QIAN L L, LIU J J, et al. A high-throughput nanofibers mat-based micro-solid phase extraction for the determination of cationic dyes in wastewater [J]. Journal of Chromatography. A, 2016, 1460: 24−32. DOI: 10.1016/j.chroma.2016.07.020
[15] 魏文英, 方键, 孔海宁, 等. 金属有机骨架材料的合成及应用 [J]. 化学进展, 2005, 17(6):1110−1115. DOI: 10.3321/j.issn:1005-281X.2005.06.023 WEI W Y, FANG J, KONG H N, et al. Synthesis and applications for materials of metallorganic frameworks [J]. Progress in Chemistry, 2005, 17(6): 1110−1115.(in Chinese) DOI: 10.3321/j.issn:1005-281X.2005.06.023
[16] 吴科盛, 许恒毅, 郭亮, 等. 磁性固相萃取在检测分析中的应用研究进展 [J]. 食品科学, 2011, 32(23):317−320. WU K S, XU H Y, GUO L, et al. Progress in applications of magnetic solid phase extraction in detection and analysis [J]. Food Science, 2011, 32(23): 317−320.(in Chinese)
[17] 王露, 汪怡, 杭学宇, 等. 磁性高交联聚苯乙烯-纳米Fe3O4的制备及其在牛奶中磺胺类药物检测中的应用 [J]. 分析试验室, 2016, 35(9):1052−1055. WANG L, WANG Y, HANG X Y, et al. Magnetic solid phase extraction based on magnetic hypercross linked polystyrene for determination of sulfonamides in milk samples [J]. Chinese Journal of Analysis Laboratory, 2016, 35(9): 1052−1055.(in Chinese)
[18] TOLMACHEVA V V, APYARI V V, FURLETOV A A, et al. Facile synthesis of magnetic hypercrosslinked polystyrene and its application in the magnetic solid-phase extraction of sulfonamides from water and milk samples before their HPLC determination [J]. Talanta, 2016, 152: 203−210. DOI: 10.1016/j.talanta.2016.02.010
[19] 李路路, 刘帅, 章琴, 等. 共价有机框架材料研究进展 [J]. 物理化学学报, 2017, 33(10):1960−1977. DOI: 10.3866/PKU.WHXB201705191 LI L L, LIU S, ZHANG Q, et al. Advances in covalent organic frameworks [J]. Acta Physico-Chimica Sinica, 2017, 33(10): 1960−1977.(in Chinese) DOI: 10.3866/PKU.WHXB201705191
[20] 李文超, 王永花, 孙成, 等. 分子印迹技术与固相微萃取技术联用的研究进展 [J]. 环境化学, 2011, 30(9):1663−1671. LI W C, WANG Y H, SUN C, et al. The development of molecularly imprinted technique coupled with solid phase microextraction [J]. Environmental Chemistry, 2011, 30(9): 1663−1671.(in Chinese)
[21] GUO J X, QIAN H L, ZHAO X, et al. In situ room-temperature fabrication of a covalent organic framework and its bonded fiber for solid-phase microextraction of polychlorinated biphenyls in aquatic products [J]. Journal of Materials Chemistry A, 2019, 7(21): 13249−13255. DOI: 10.1039/C9TA02974E
[22] LIU L, MENG W K, ZHOU Y S, et al. β-Ketoenamine-linked covalent organic framework coating for ultra-high-performance solid-phase microextraction of polybrominated diphenyl ethers from environmental samples [J]. Chemical Engineering Journal, 2019, 356: 926−933. DOI: 10.1016/j.cej.2018.09.081
[23] QIAN H L, YANG C X, WANG W L, et al. Advances in covalent organic frameworks in separation science [J]. Journal of Chromatography. A, 2018, 1542: 1−18. DOI: 10.1016/j.chroma.2018.02.023
[24] OLGUN C E, MUYAN M. SNW1 (SNW domain containing 1) [J]. Atlas of Genetics and Cytogenetics in Oncology and Haematology, 2018(6): 233−235. DOI: 10.4267/2042/68909
[25] IBARRA I S, MIRANDA J M, RODRIGUEZ J A, et al. Magnetic solid phase extraction followed by high-performance liquid chromatography for the determination of sulphonamides in milk samples [J]. Food Chemistry, 2014, 157: 511−517. DOI: 10.1016/j.foodchem.2014.02.069
[26] SHI P Z, YE N S. Magnetite–graphene oxide composites as a magnetic solid-phase extraction adsorbent for the determination of trace sulfonamides in water samples [J]. Analytical Methods, 2014, 6(24): 9725−9730. DOI: 10.1039/C4AY02027H
[27] LI Y Z, WU X W, LI Z Q, et al. Fabrication of CoFe2O4-graphene nanocomposite and its application in the magnetic solid phase extraction of sulfonamides from milk samples [J]. Talanta, 2015, 144: 1279−1286. DOI: 10.1016/j.talanta.2015.08.006
[28] FU L, ZHOU H, MIAO E M, et al. Functionalization of amino terminated carbon nanotubes with isocyanates for magnetic solid phase extraction of sulfonamides from milk and their subsequent determination by liquid chromatography-high resolution mass spectrometry [J]. Food Chemistry, 2019, 289: 701−707. DOI: 10.1016/j.foodchem.2019.03.097
-
期刊类型引用(2)
1. 颜少宾,郭瑞,周平,周丹蓉,金光. 不同套袋处理对桃果实品质的影响. 食品安全质量检测学报. 2024(21): 115-123 .  百度学术
百度学术
2. 颜少宾,周平,张妤艳,马瑞娟,俞明亮,金光,郭瑞. 光质对红肉桃果肉色泽、类胡萝卜素组分含量的影响. 江苏农业科学. 2021(20): 143-147 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: