Effects of Lactobacillus Addition on Fermentation and Quality of Animal Feed Made with Spent Substrate from Oyster Mushroom Cultivation
-
摘要:目的 探明乳酸菌对平菇菌糠发酵饲料品质和发酵进程的影响,以期提升发酵工艺水平,提高平菇菌糠作为畜禽饲料的利用价值。方法 将2种乳酸菌(CCZZ1和HT1)单独及复合加入平菇菌糠中,并设置空白对照(CK),对4个试验处理进行室温下发酵效果的对比试验。4个处理的起始重复数均为18个,分别对每一处理发酵1、3、7、15、30、60 d时的发酵饲料进行化学成分和发酵品质的3个重复测定。结果 发酵到7 d时,3个乳酸菌添加组CCZZ1、HT1和MIX组的pH值均显著低于CK组(P<0.05),并比CK组提前23 d下降到4.2以下;CCZZ1、HT1和MIX组的乙酸和干物质含量均显著高于CK组(P<0.05);CCZZ1、HT1和MIX组在发酵过程中提高了乳酸含量,降低了粗蛋白含量;CCZZ1、HT1和MIX组的氨态氮、粗灰分、可溶性碳水化合物、酸性洗涤纤维、中性洗涤纤维、半纤维素、丙酸和丁酸的含量与CK组相比差异不显著。结论 单独或复合添加乳酸菌不仅能改善平菇菌糠发酵饲料的品质,也能使平菇菌糠发酵饲料的发酵过程提前结束。Abstract:Objective Effects of addition of lactic acid bacteria to the spent substrate of Pleurotus ostreatus cultivation on the fermentation and quality of the feed material for livestock and poultry industry were analyzed.Method Lactic acid bacteria CCZZ1 and HT1 were added alone or in combination (MIX) to the spent culture substrate prior to fermentation. A blank control (CK) was included in the 3-treatment experimentation. Initially, 18 replicates for each testing group were conducted at room temperature. Triplicated analytical data and fermentation process evaluation criteria on the 1st, 3rd, 7th, 15th, 30th, and 60th day were collected for the study. [Result] During the fermentation, the contents of lactic acid, acetic acid, propionic acid, and dry matters increased, while those of hemicellulose, butyric acid, and crude protein declined. And, ammonia nitrogen was significantly lower in MIX than in control (P<0.05). After fermented for 7 d, the pH of the treatment groups were significantly lower than those of CK (P<0.05), and reached below 4.2 in 23 d less than it took CK. The acetic acid and dry matter contents in the treatment groups were significantly higher than those in CK (P<0.05), while lactic acid increased, and crude protein reduced as compared with CK. On the other hand, the contents of ammonia nitrogen, crude ash, soluble carbohydrate, acid washed fiber, neutral water washed fiber, hemicellulose, propionic acid, and butyric acid in the treatment groups did not significantly differ from those in CK.Conclusion The addition of lactic acid bacteria CCZZ1 and HT1 alone or in combination not only improved the quality of the fermented feed made from the spent mushroom culture substrate but also facilitated the fermentation process.
-
0. 引言
【研究意义】磺胺类药物(Sulfonamides, SAs)是一类用于细菌性疾病的预防与治疗的化学治疗药物[1-2]。该药物因抑菌效果好、价格低廉而被广泛应用于治疗奶牛中频发的乳房炎,故而在牛奶中被检测出的概率很高。SAs在动物性食品中容易残留,长期摄入含SAs的奶制品,将危及人体健康[3]。因此,包括中国在内的许多国家都制定了食品和饲料中SAs的最大允许残留限量和相应的检测方法[4-5]。高效液相色谱-质谱联用是检测SAs在牛奶中残留量的标准方法[6],但由于SAs在牛奶中的浓度低,且牛奶中有如脂肪、蛋白质等干扰物的影响[7],选择性分离牛奶中痕量SAs的前处理显得尤为重要。【前人研究进展】对食品中SAs提取的传统方法为液液萃取,但需消耗大量有机溶剂,共萃取杂质较多,步骤繁杂[8]。而新兴的方法,如超临界萃取[9-10],虽具有环保、快速、无副反应、选择性高等优点,但其需专门的仪器,运行和维护费用昂贵。固相微萃取[11-12]相比于其他萃取方法,操作简便,有机溶剂用量极少,但检测结果相对标准偏差较大。磁性固相萃取[13](Magnetic solid phase extraction, MSPE)是以磁性或可磁化的材料作为吸附剂的一种分散固相萃取技术,具有萃取面积更大、简单便捷、可重复使用且能避免杂质干扰等诸多优点[14-16]。王露等[17]和Tolmacheva等[18]用MSPE对牛乳中的4种SAs进行富集萃取后用HPLC检测其残留量,均取得较为理想的效果。MSPE的核心在于磁性吸附剂,设计并合成具有高效吸附性能的磁性吸附剂是MSPE的关键所在。【本研究切入点】共价有机骨架(Covalent organic frameworks, COFs)[19-20]是一类由有机单体通过共价键形成有周期性网络结构的晶体聚合物。COFs具有比表面积高、密度轻、易修饰及结构稳定等优点。COFs广泛应用于样品前处理中,包含固相萃取、固相微萃取及磁性固相萃取等[21-23]。SNW-1是由三聚氰胺和对苯二胺在一定条件下制备而成的一种席夫碱型COFs[24]。相比其他COFs,SNW-1的合成原料便宜、易得,而且SNW-1具有较高的比表面积。目前,磁性SNW-1的制备及其在样品前处理中的应用还未见相关报道。【拟解决的关键问题】本文通过水热合成法制备磁性SNW-1(Fe3O4@SNW-1),将其作为磁性固相萃取的吸附剂,在萃取与洗脱效果的关键参数上进行优化,结合高效液相色谱,为牛奶中5种痕量磺胺类药物的残留检测提供便捷快速的分析方法。
1. 材料与方法
1.1 仪器与设备
透射电子显微镜(FEI Tecnai G20,美国FEI公司);扫描电子显微镜(FEI Inspect F50,美国FEI公司);冰箱(KG20V31T1,博西家电销售公司);氮吹仪(MG-2200,上海虔钧科学仪器有限公司) ;电子天平(ME204E/02,梅特勒-托利多仪器上海有限公司);超声波清洗器(KQ5200E,昆明市超声仪器有限公司);循环水式真空泵(SHB-III,郑州紫拓仪器设备有限公司);Eclipse XDB-C18(150 mm×4.6 mm,5 μm,Agilent Technologies,USA);高效液相色谱仪[LC-20A,岛津-GL(上海)商贸有限公司];涡旋混合器(Vortex QL-902,上海之信仪器有限公司) ;高速冷冻离心机(GL-21M,长沙湘智离心机仪器有限公司)。
1.2 材料与试剂
六水三氯化铁(FeCl3·6H2O)、醋酸钠、柠檬酸钠二水(Na3Cit·2H2O)、磺胺二甲基嘧啶(Sulfamethazine, SMZ)、磺胺甲基嘧啶(Sulfamerazine, SMR)、磺胺甲噁唑(Sulfamethoxazole, SMX)标准品:上海源叶生物科技有限公司;磺胺嘧啶(Sulfadiazine, SDZ)、磺胺间甲基嘧啶(sulfamonomethoxine, SMM)标准品:上海阿拉丁生化科技股份有限公司;甲醇、乙腈、醋酸铅:国药集团化学试剂有限公司;氨水、乙酸:西陇科技股份有限公司;伊利牛奶:内蒙古伊利实业集团股份有限公司。
1.3 试验方法
1.3.1 Fe3O4的制备
将FeCl3·6H2O(6.8 g)、醋酸钠(12.0 g)和Na3Cit·2H2O(2.0 g)溶解在200 mL乙二醇中,将所得黄色的均相溶液放进高压反应釜中加热(200 ℃,10 h)。反应结束后,用磁铁将Fe3O4从产品中分离出来后用清水和乙醇反复清洗干净,真空环境下80 ℃干燥12 h。
1.3.2 磁性共价有机骨架材料的制备
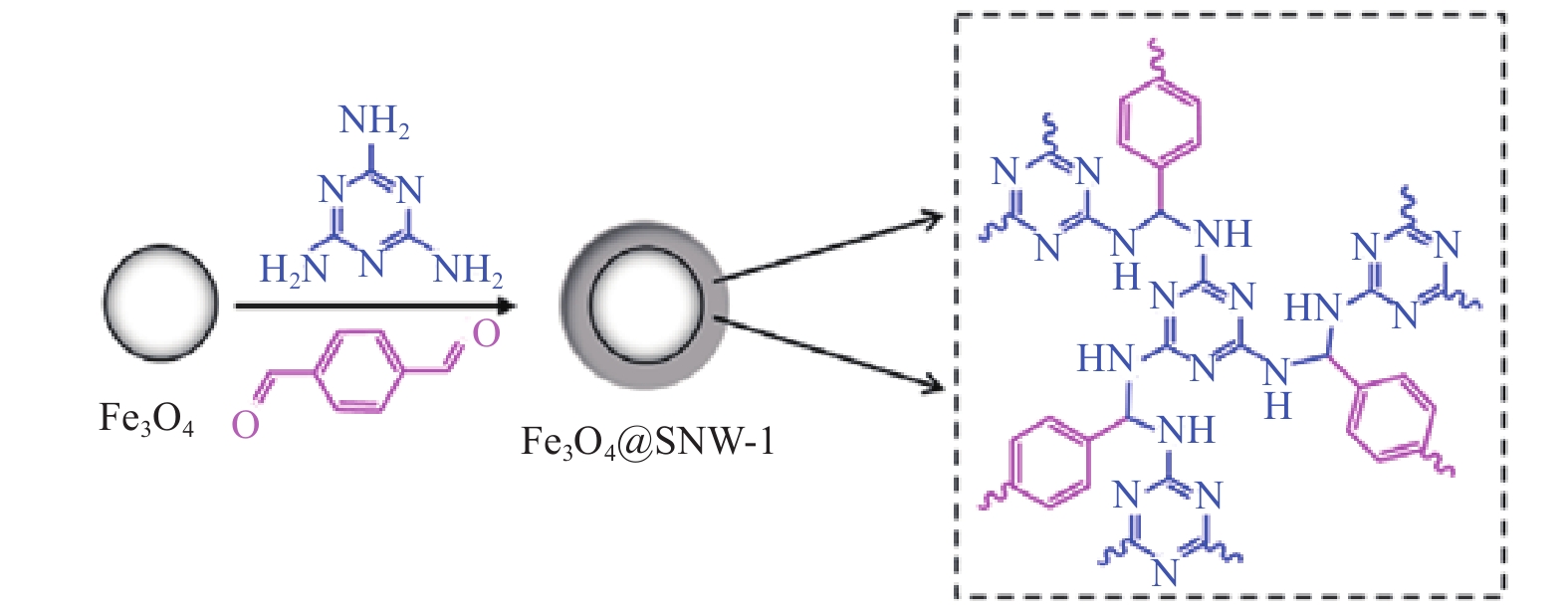
将2.0 g三聚氰胺溶解于62 mL二甲基亚砜(DMSO)中,其次将0.3 g Fe3O4分散于上述溶液并超声分散10 min,最后加入1.26 g对苯二甲醛,在180 ℃条件下机械搅拌6 h。反应结束后,依次使用丙酮、二氯甲烷和三氟乙酸将磁性材料清洗干净,并在80 ℃的真空条件下过夜干燥,得到磁性复合物Fe3O4@SNW-1,其结构示意图如图1。
1.3.3 磁性固相萃取(MSPE)条件的优化
(1)MSPE温度和时间的优化
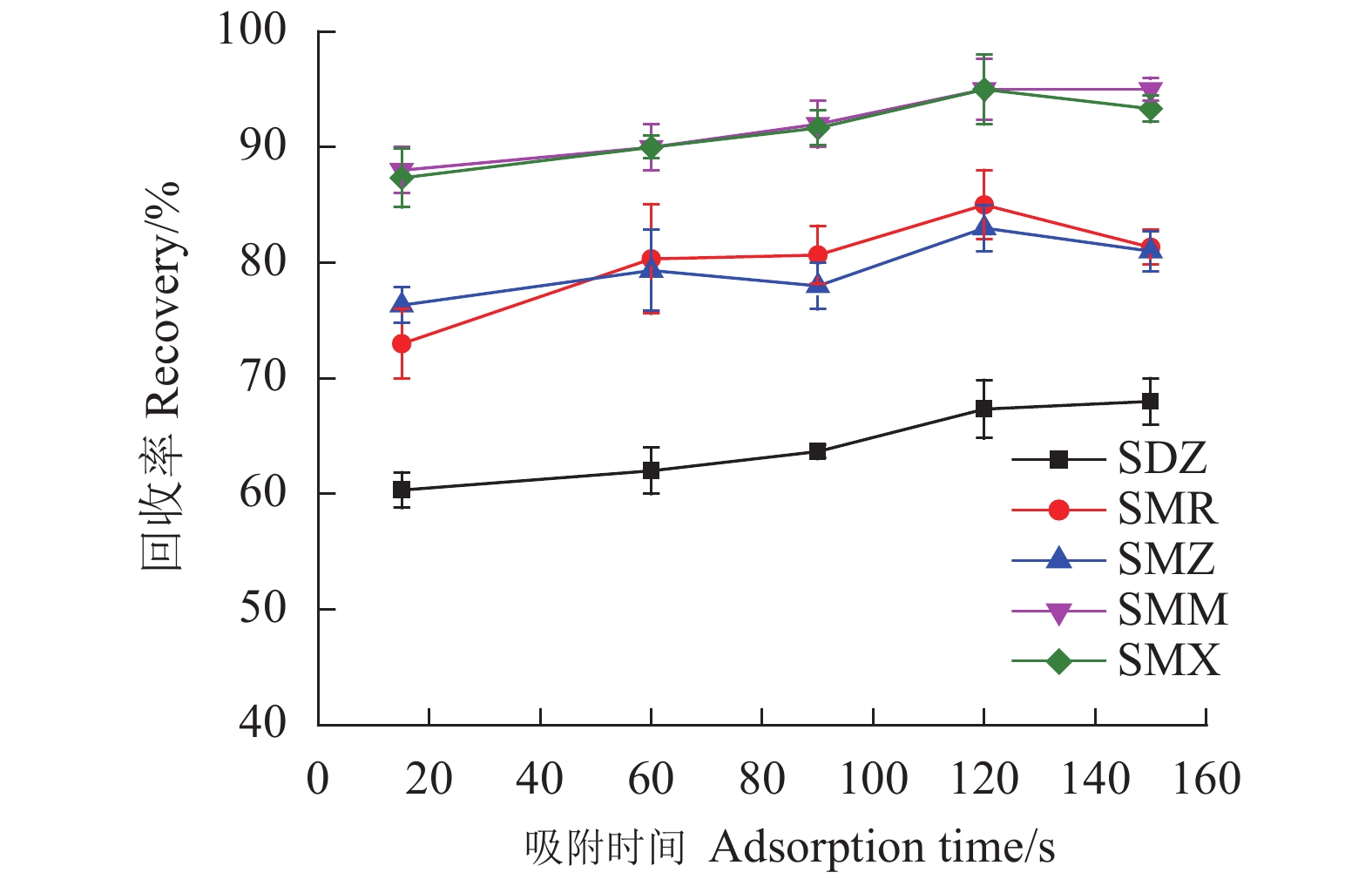
保持其他磁性固相萃取条件不变,测定不同吸附剂用量(1.0~6.0 mg)和在不同水浴吸附时间(15、60、120和150 s)下SAs的回收率。
(2)溶液pH和离子强度的优化
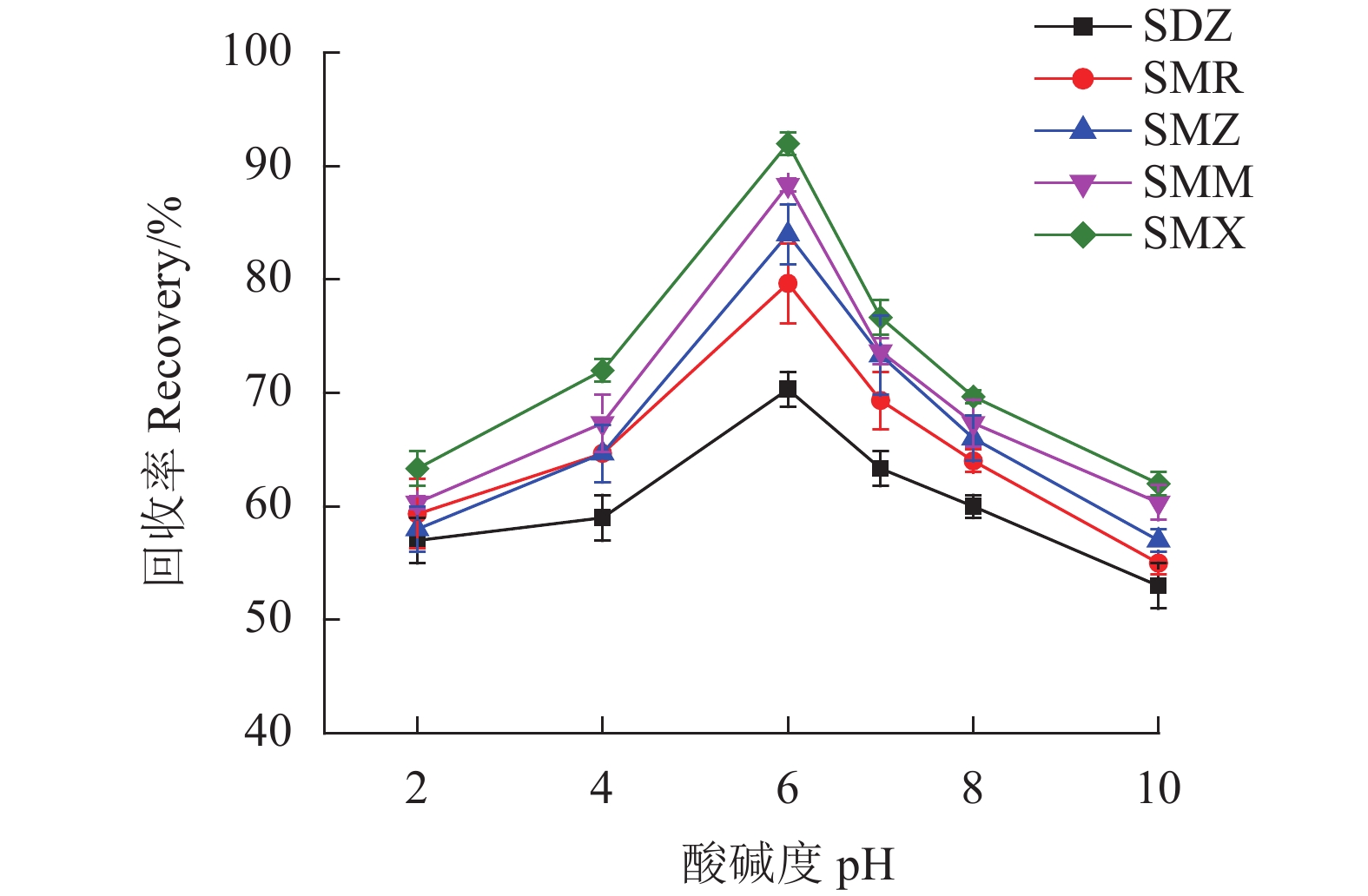
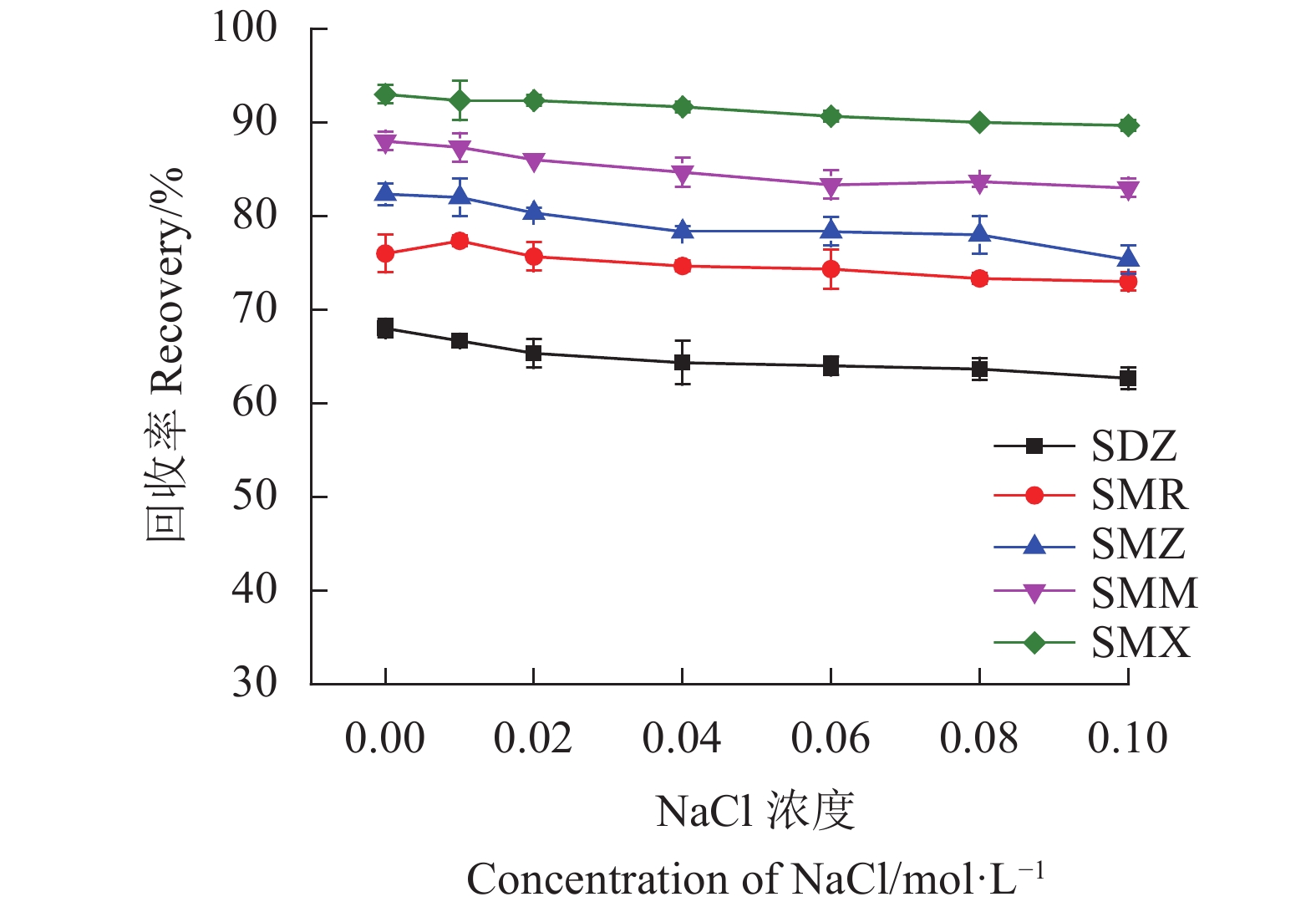
保持其他磁性固相萃取条件不变,测定不同样品溶液pH值(2、4、6、7、8、10)以及NaCl剂量(0、0.01、0.02、0.04、0.06、0.08、0.10 mol·L−1)下SAs的回收率。
(3)洗脱剂种类的选择
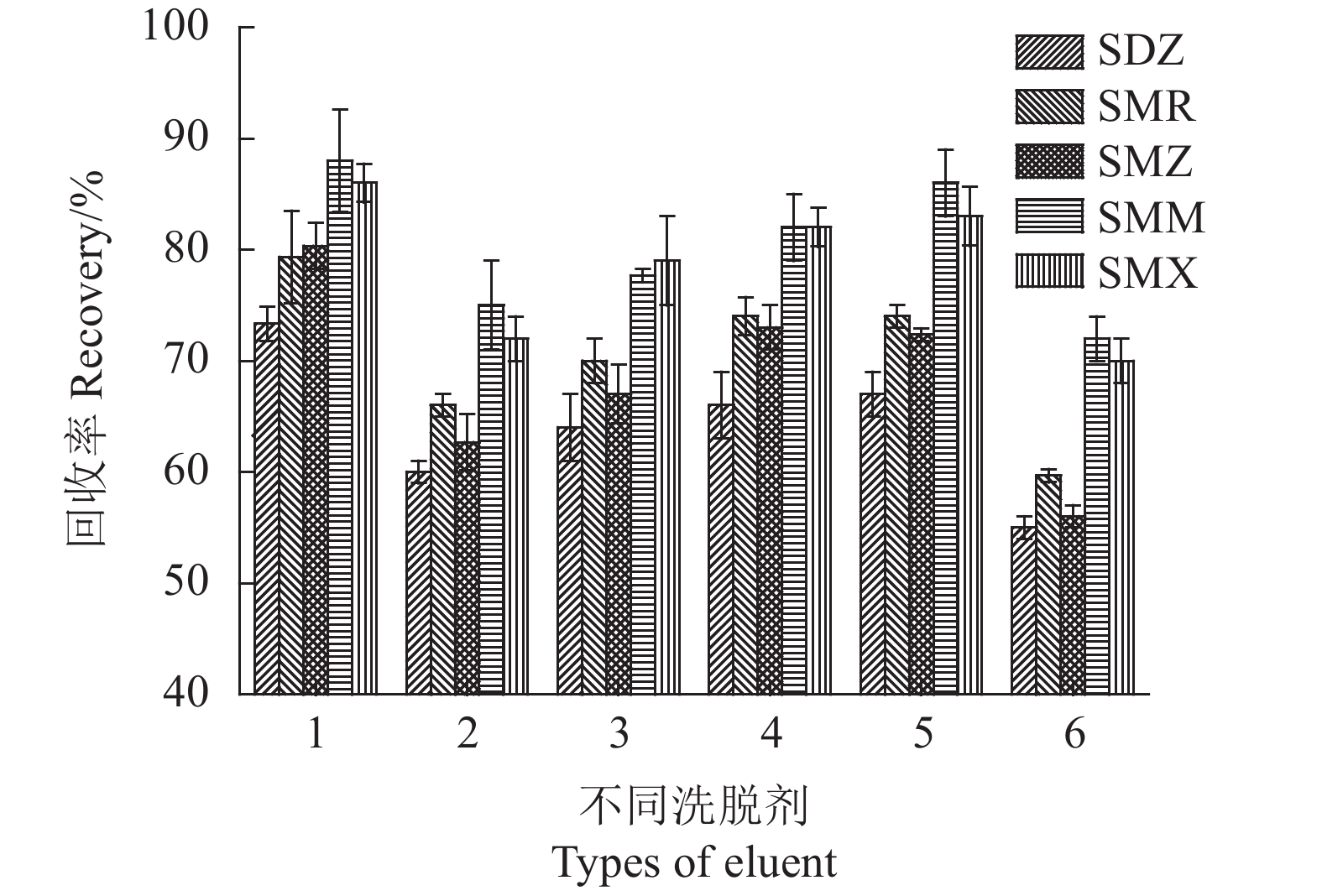
保持其他磁性固相萃取条件不变,测定不同洗脱溶剂[v(氨水)∶v(甲醇)= 5∶95, v(乙酸)∶v(甲醇)=5∶95, v(氨水)∶ v(乙腈)= 5∶95, v(乙酸)∶v(乙腈)=5∶95,乙腈,甲醇]下SAs的回收率。
(4)洗脱剂用量和洗脱时间的优化
保持其他磁性固相萃取条件不变,考察洗脱剂用量变化(0.5、1、1.5、2、2.5、3 mol·L−1)以及洗脱时间变化(15、30、45、60、75、90 s)下SAs的回收率。
1.3.4 高效液相色谱检测条件
配备有2个LC-20AT溶剂输送单元和SPD-M20A PDA检测器(Shimadzu, Kyoto, Japan)的LC-20A HPLC系统,检测器的检测波长:269 nm;C18柱(Eclipse XDB-C18,150 mm×4.6 mm,5 μm,Agilent Technologies,USA);流动相:乙腈-乙酸水(含1%乙酸)(20∶80,v/v),等梯度洗脱;进样量:20 μL;流速:1.00 mL·min−1;柱温:25 ℃。
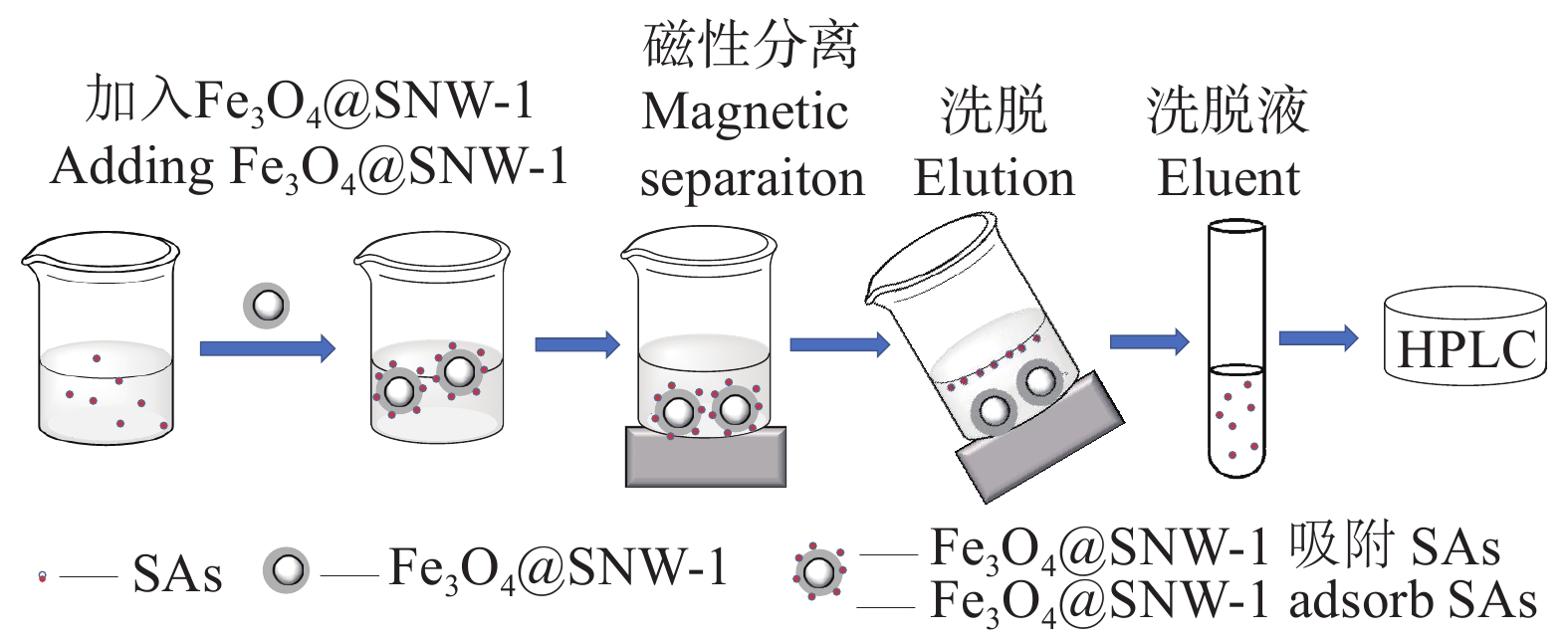
1.3.5 SAs的MSPE操作流程
SAs吸附与富集整个MSPE技术操作流程详见图2。首先,将4.0 mg Fe3O4@SNW-1加入10 mL样品溶液,涡旋2 min,用磁铁将Fe3O4@SNW-1与溶液分离并倒掉溶液。其次,加入2 mL洗脱剂,涡旋1 min,磁铁将Fe3O4@SNW-1与洗脱液分离,将收集的洗脱液在40 ℃下氮吹至干。最后,用0.5 mL乙腈-乙酸水(含1%乙酸)(20∶80,v/v)的流动相定容待测样品,用针管移至进样瓶中,待上机检测。
1.3.6 空白牛奶和加标牛奶样品前处理
准确称取250 mL的牛奶(配置100 ng·mL−1的磺胺类药物的牛奶250 mL),加入16%醋酸铅250 mL,搅拌,超声数分钟直至混匀,装入等量离心瓶中,放入高速冷冻离心机,转速为4 000 r·min−1,离心15 min,取出,收集离心瓶中的上清液备用。
2. 结果与分析
2.1 合成材料的结构表征
2.1.1 透射电镜表征
由透射电镜表征结果见图3-A,可以看出Fe3O4磁粒子是规则的圆球,粒径为200~400 nm。从图3-B中可清晰发现,在Fe3O4磁粒子的表面包裹了一层致密的纳米级颗粒构成的核壳结构的复合材料即Fe3O4@SNW-1。透射电镜结果可证实SNW-1已成功负载在Fe3O4磁粒子上,制备成具有核壳结构的Fe3O4@SNW-1复合材料。
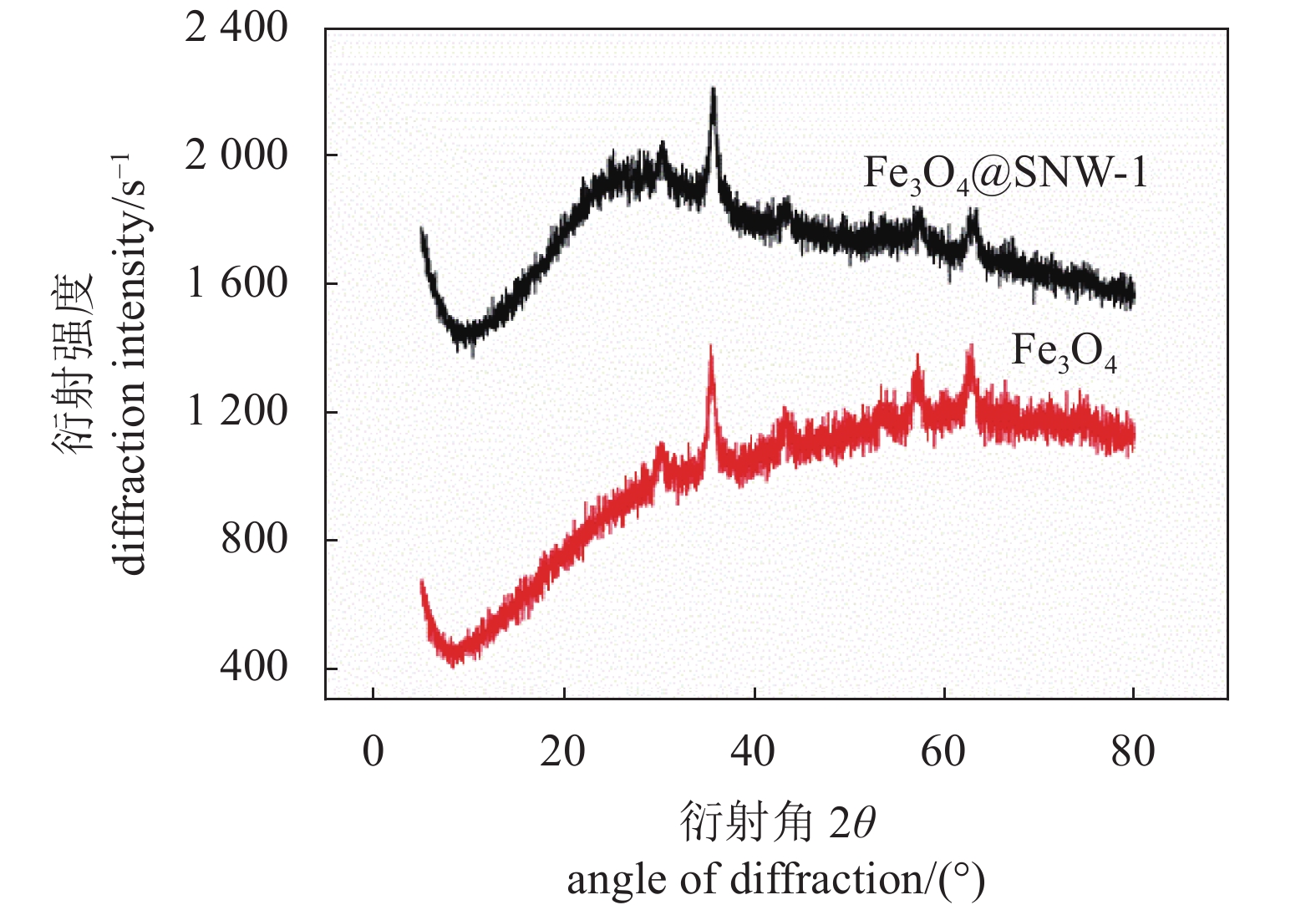
2.1.2 X射线衍射(X-ray diffraction Analysis, XRD)表征
图4为Fe3O4和Fe3O4@SNW-1晶体结构的XRD衍射表征。从结果可以看出,Fe3O4@SNW-1的XRD衍射峰包含了Fe3O4所有的特征衍射峰。此外在25 °左右出现1个较宽的衍射峰,是SNW-1的特征衍射峰,说明SNW-1是一种无定型结构。XRD的结果充分说明了本试验成功制备了Fe3O4@SNW-1复合材料。
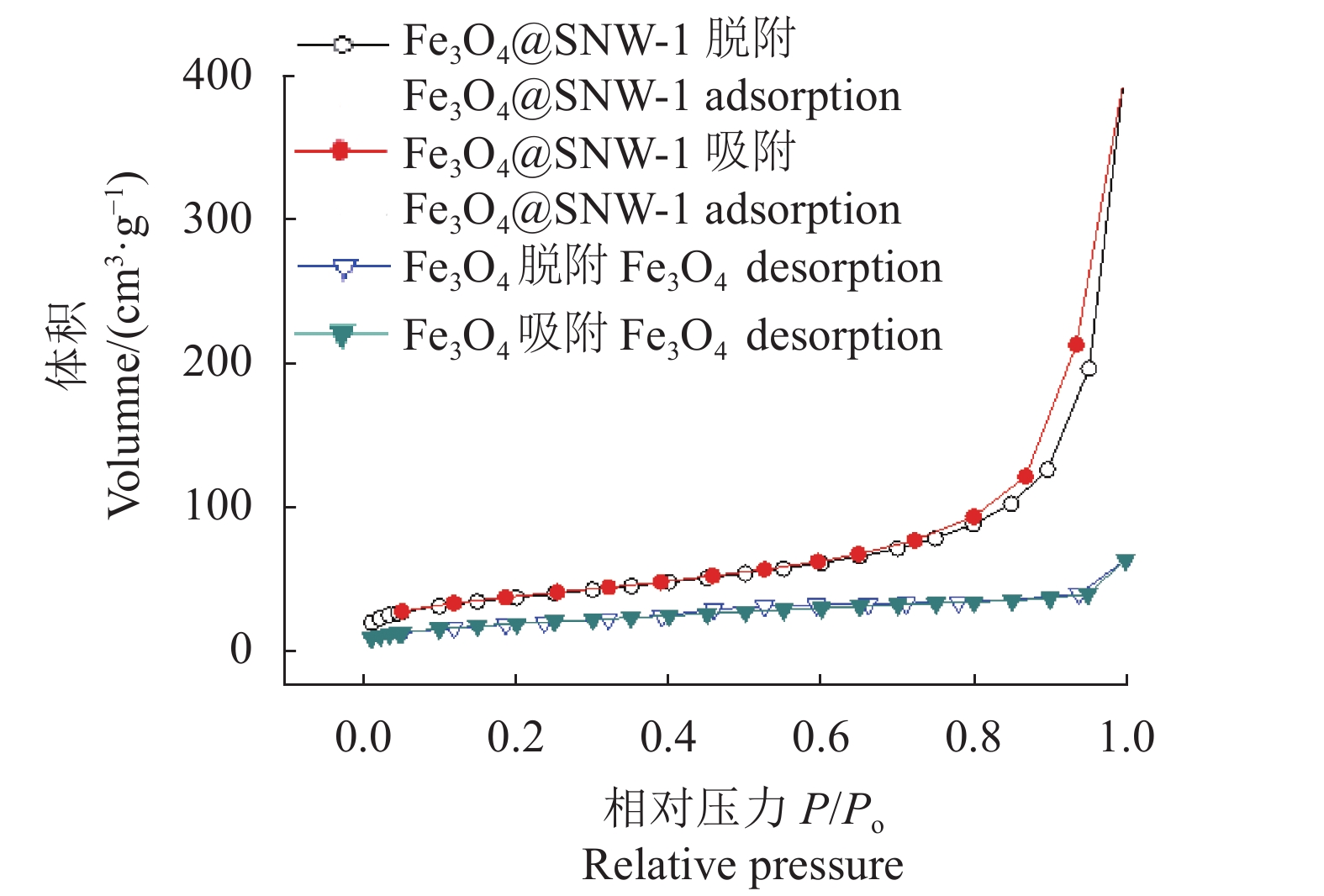
2.1.3 氮气吸附表征(Nitrogen adsorption-desorption)
Fe3O4和Fe3O4@SNW-1的多孔特性通过氮气吸附表征,氮气吸附-脱附结果,如图5所示。Fe3O4的BET(Brunner-Emmet-Teller)比表面积为69.0 m2·g−1,孔体积为0.096 7 cm3·g−1,孔径为5.6 nm。Fe3O4@SNW-1的BET比表面积为132.7 m2·g−1,孔体积为0.44 cm3·g−1,孔径为18.6 nm。Fe3O4@SNW-1复合材料的BET比表面积、孔体积相比Fe3O4有大幅增加,这主要是因为SNW-1的多孔特性,使其与Fe3O4结合成的复合材料具有更大的比表面积和孔体积。
2.2 MSPE条件优化
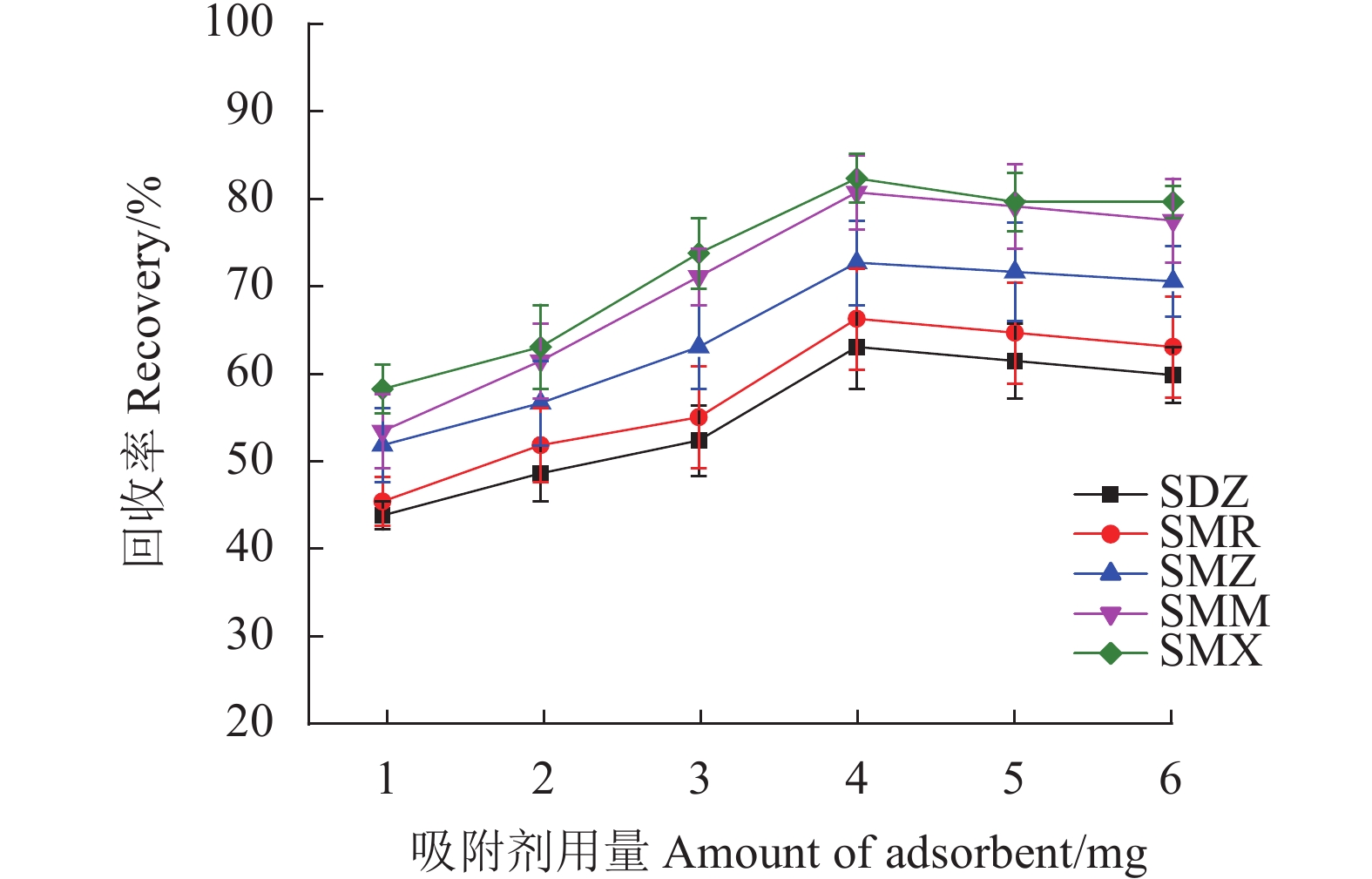
2.2.1 吸附剂用量和吸附时间的影响
首先考察Fe3O4@SNW-1吸附剂用量在1.0~6.0 mg对样品回收率的影响。如图6所示,随着吸附剂用量从1.0 mg增加到4.0 mg,SAs的回收率增加,当吸附剂用量为4.0 mg时,SAs的回收率最高。在此之后,回收率虽有所波动,但基本趋于平稳。故选择吸附剂Fe3O4@SNW-1的用量4.0 mg用于进一步研究。
考察范围为15~150 s的吸附时间对5种SAs回收率的影响。如图7所示,在所考察的范围内,SAs的回收率较为稳定,在120 s吸附达到平衡,之后回收率基本保持不变。固吸附时间控制在120 s。
2.2.2 溶液pH和离子强度的影响
SAs为两性化合物[17],样品溶液的pH值在吸附过程中起着重要作用,因为它会影响吸附剂的表面电荷以及SAs的存在形式,从而影响SAs在MSPE上的吸附率进而影响其回收率。试验中研究了样品溶液的pH值在2.0~10.0对于回收率的影响。从图8可以看出,在pH为6.0时SAs回收率最高。pH为6.0时,大多数SAs将以中性形式存在,小部分以离子形式存在。因而,Fe3O4@SNW-1通过π-π作用力和疏水作用力吸附SAs。故选择样品溶液的pH为6.0。
此外,离子强度对SAs回收率的影响见图9。从结果可以看出,离子强度对样品回收率的影响不大。结果说明静电作用力不是Fe3O4@SNW-1吸附SAs的主要吸附机制。相反,π-π相互作用和疏水作用才是Fe3O4@SNW-1吸附SAs的主要吸附机制。因此,在随后的实际样中没有向样品中加入NaCl。
2.2.3 洗脱剂种类的影响
为了从磁性固相萃取中获得SAs较高的回收率,试验使用了磺胺类药物较易溶解的氨水-甲醇(5∶95,v/v)、乙酸-甲醇(5∶95, v/v)、氨水-乙腈(5∶95,v/v)、乙酸-乙腈(5∶95,v/v)、乙腈、甲醇等极性溶剂作为洗脱溶剂,考察其对SAs回收率的影响。如图10所示,氨水-甲醇(5∶95,v/v)溶液在这6种洗脱溶剂中具有最佳洗脱能力。因此,选择氨水-甲醇(5∶95,v/v)作为洗脱溶剂。
![]() 图 10 不同洗脱溶剂的影响注:1.v(氨水): v(甲醇)= 5:95, 2.v(乙酸): v(甲醇)=5:95, 3.v(氨水): v(乙腈)= 5:95, 4.v(乙酸): v(乙腈)=5:95,5.乙腈,6.甲醇。Figure 10. Effect of eluent on testingNote: 1. ammonia -methanol(5:95, v/v); 2. acetic acid - methanol(5:95, v/v); 3. ammonia - acetonitrile(5:95, v/v); 4. acetic acid - acetonitrile(5:95, v/v); 5. acetonitrile; 6. methanol.
图 10 不同洗脱溶剂的影响注:1.v(氨水): v(甲醇)= 5:95, 2.v(乙酸): v(甲醇)=5:95, 3.v(氨水): v(乙腈)= 5:95, 4.v(乙酸): v(乙腈)=5:95,5.乙腈,6.甲醇。Figure 10. Effect of eluent on testingNote: 1. ammonia -methanol(5:95, v/v); 2. acetic acid - methanol(5:95, v/v); 3. ammonia - acetonitrile(5:95, v/v); 4. acetic acid - acetonitrile(5:95, v/v); 5. acetonitrile; 6. methanol.2.2.4 洗脱剂用量及洗脱时间的影响
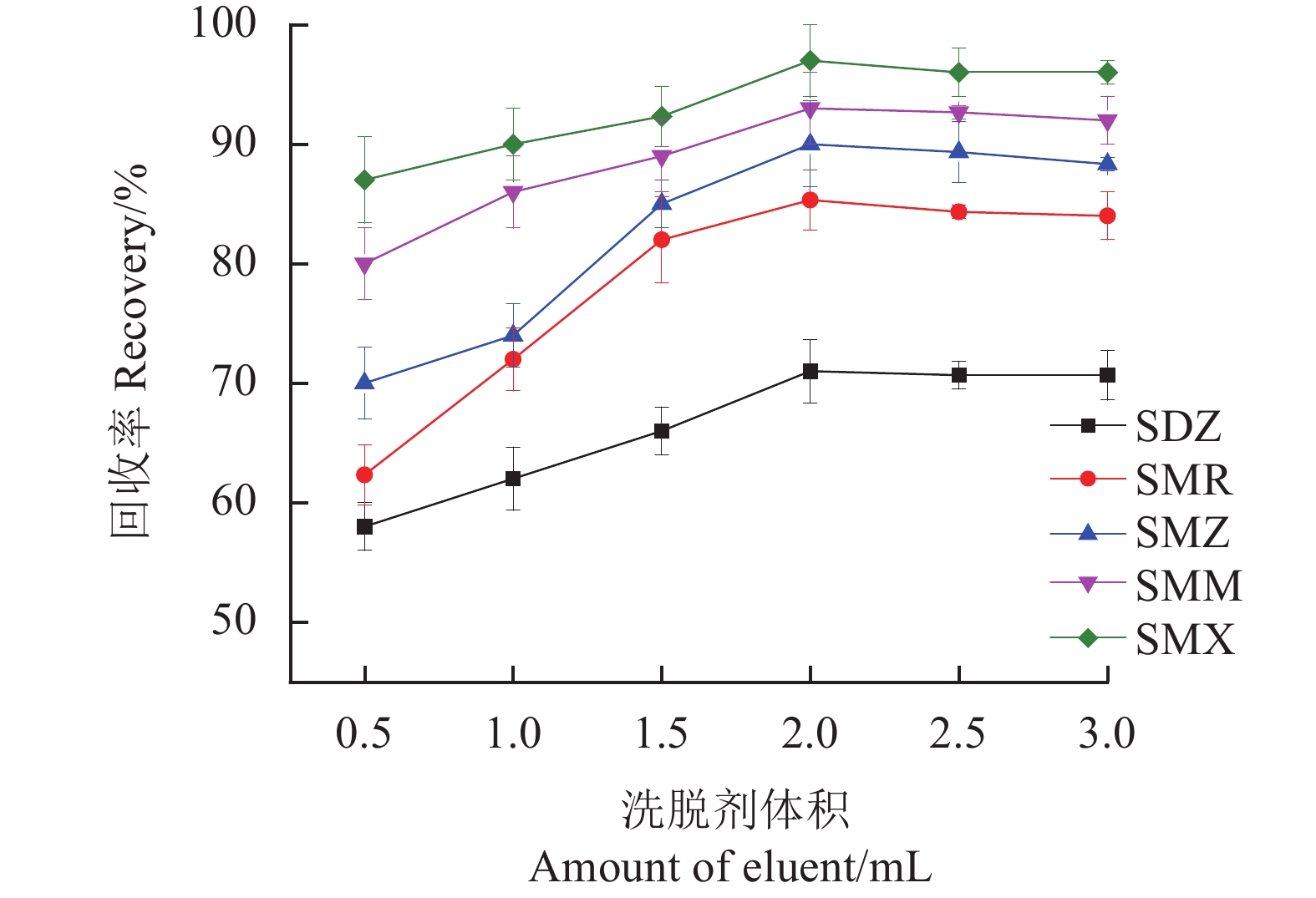
研究氨水-甲醇(5∶95,v/v)从0.5~3.0 mL的剂量范围对SAs回收率的影响。结果如图11所示,随着洗脱剂的体积从0.5 mL增加到2.0 mL,SAs的回收率呈上升趋势,当洗脱量为2.0 mL时,SAs的回收率达到最高。随后SAs的回收率趋于平稳,说明洗脱基本达到平衡,因此将氨水-甲醇(5∶95,v/v)的体积定为2.0 mL。
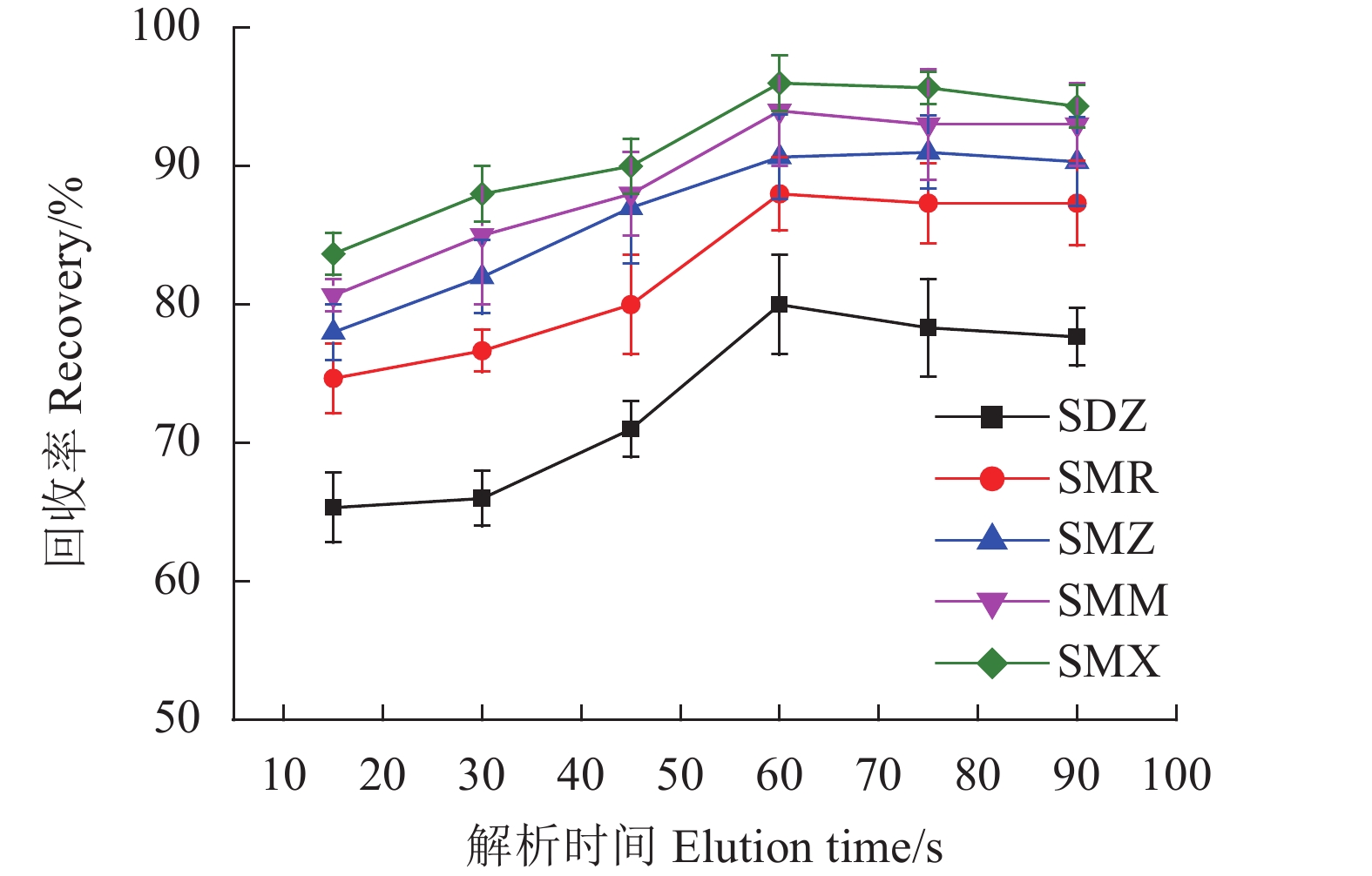
考察了洗脱时间在15~90 s对5种SAs回收率的影响。如图12所示,随着洗脱时间的增加,回收率逐渐加强,当洗脱时间为60 s,回收率达到最高,之后的回收率不再发生明显变化,因此选择洗脱时间为60 s。
2.3 标准曲线、检出限以及精密度
MSPE/HPLC方法对5种SAs混合标准溶液进行测定,并绘制标准曲线。其分析数据见表1。该方法为SAs的10~100 ng·mL−1具有良好的线性,相关系数较高(R2>0.9948)。对于质量浓度为50 ng·mL−1的工作样品的5次重复,所提出的方法的日间精密度(RSD %)为2.4%~3.4%,显示出测定SAs的高精度。
表 1 以磁性COF为吸附剂的MSPE/HPLC测定SAs的检出限及精密度Table 1. Detecting limit and precision of MSPE/HPLC method using magnetic COF as adsorbent on SA determination分析物
Analyte线性范围
Linear range/(ng·mL−1)线性方程
Regression equation相关系数
Correlation coefficient检出限
Limit of detection/(ng·mL−1)相对标准偏差
RSD/%SDZ 10~100 y=643798x−416.89 0.999 0 1.7 3.4 SMR 10~100 y=783 373x−543.79 0.998 1 1.7 2.8 SMZ 10~100 y=697 128x−256.47 0.999 6 2.0 2.4 SMM 10~100 y=754 506x−551 0.999 3 2.4 2.5 SMX 10~100 y=654 838x− 2 976.6 0.994 8 2.7 2.8 2.4 实际样品分析
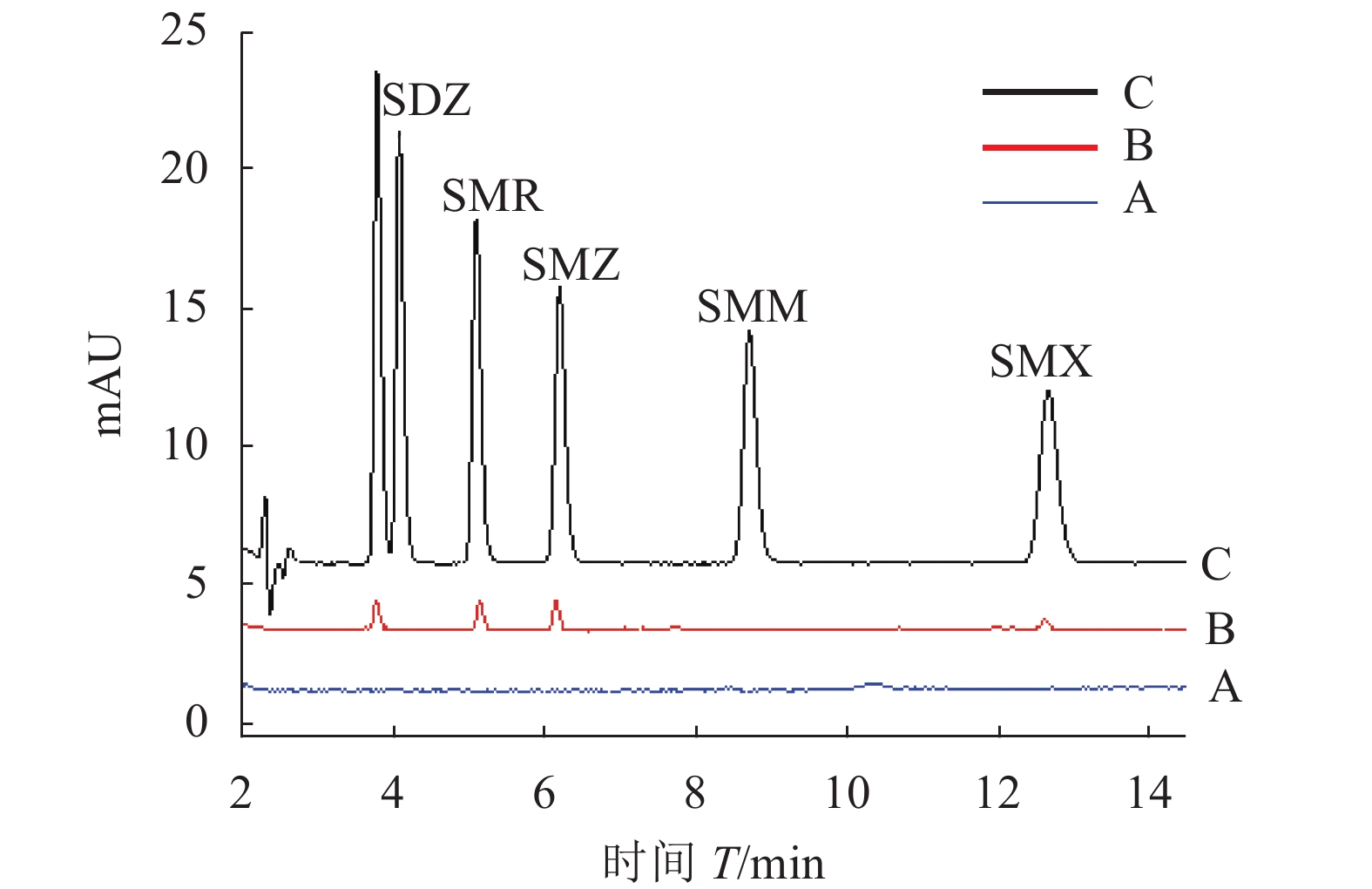
对牛奶样品进行实际分析,以证明该方法的实用性。在牛奶样品中分别加入20、50、100 ng·mL−1的SAs,采用3次重复试验的平均值,进行了加标回收试验。如表2所示,5种SAs的回收率在72%~95%。图13显示了经前处理后空白牛奶样品、添加100 ng·mL−1SAs的加标牛奶样品的色谱图以及用MSPE进行前处理的加标牛奶样品的色谱图,从图中可以看出,5种磺胺类组分峰与杂质能很好分离,且峰形好,在13 min内能完成样品的检测。以上结果表明,所建立的MSPE/HPLC方法对复杂的牛奶样品中痕量SAs的同时分离和测定是切实可行的。
表 2 牛奶样品中SAs的分析结果Table 2. Analysis of SAs in milk samples分析物
Analyte添加量
Added/(ng·g−1)牛奶 Milk 测定值
Found/(ng·g−1)回收率
Recovery/%相对标准偏差
RSD/%SDZ 0 ND – – 20 16.8 84 3.2 50 38.5 77 2.8 100 72 72 4.4 SMR 0 ND – – 20 18.6 93 6.1 50 41 82 4.6 100 79 79 5.3 SMZ 0 nd – – 20 19 95 2.3 50 41.5 83 3.5 100 81 81 5.8 SMM 0 ND – – 20 16.6 83 4.9 50 40 80 3.1 100 81 81 5.9 SMX 0 ND – – 20 17.6 88 5.7 50 44 88 4.7 100 86 86 3.4 注:ND: 未检出。
Note:ND means not detected.2.5 方法比较
为了评估Fe3O4@SNW-1作为磁性固相萃取的吸附剂的性能,从吸附剂的量、样品量、洗脱量和LODs的角度,将其与前人采用MSPE对SAs前处理的效果的测定方法进行了比较[18, 25-27]。结果表明(表3) :当前所提出的方法仅需要4 mg吸附剂,这比大多数已报道的方法要小,表明Fe3O4@SNW-1对SAs的吸附能力优异。另外,目前的方法消耗的样品和洗脱量很少,可以减少操作时间并满足实际应用,且与其他磁性固相萃取技相比,只需较短的萃取时间就能实现高效萃取。最后,与报道的方法相比,当前方法的灵敏度优于或与已报道的方法相当。因此,所提出的MSPE/HPLC方法可用于复杂基质中痕量SAs的灵敏测定。
表 3 所提方法与文献中其他方法的比较Table 3. Comparison between MSPE/HPLC and other existing methods吸附剂
Sorbent方法
Method样品
Sample吸附剂量
Amount of
Sorbent/mg样品容量
Sample volume/
mL萃取时间
Extraction time/
min洗脱剂体积
Elution volume/
mL检测限
LODs/(ng·mL−1)参考文献
ReferenceFe3O4-SiO2-phenyl MSPE/HPLC 牛奶 Milk 100 10 5 3 7~14 [25] Fe3O4-graphene oxide MSPE/HPLC 水 Water 5 1 20 1 50~100 [26] HCP-Fe3O4 MSPE/HPLC 牛奶 Milk 20 25 5 2 2.0~2.5 [18] CoFe2O4-graphene MSPE/HPLC 牛奶 Milk 15 100 20 0.5 1.16~1.59 [27] Fe3O4@SNW-1 MSPE/HPLC 牛奶 Milk 4 10 2 2.0 1.7~2.7 本研究 This work 3. 讨论与结论
MSPE技术富集的样品可以广泛运用于农药残留、食品添加剂、抗生素、激素类及重金属离子,且通过该技术所得的回收率绝大部分在80%~120%,检出限基本都能达到ng·mL−1(或ng·g−1)数量级,加之涵盖了食品分析领域的大部分区域,因此有着极为理想的应用前景[28]。
本研究通过水热法合成Fe3O4@SNW-1作为磁性吸附剂,通过透射电镜表征和X射线衍射,验证制备成具有核壳结构的Fe3O4@SNW-1复合材料,后通过氮气吸附表征,也证明复合材料的多孔性以及比表面积大的特点。该合成方法利用共价有机骨架来修饰磁性纳米颗粒,既保持共价有机骨架具有的由共轭和富含氮的、结构单元构成的微孔网络结构所表现出的吸附富集性能,又缩短萃取材料和溶液的分离时间[25],所用到的磁性吸附剂在目前MSPE当中鲜有报道。
在MSPE吸附过程中Fe3O4@SNW-1可通过π-π作用力和疏水作用力吸附SAs。通过MSPE与HPLC联用,在对吸附剂用量、吸附时间、溶液pH、洗脱剂种类、洗脱剂用量和洗脱时间等参数优化后,可高效检测出牛奶中5种痕量磺胺类药物。本研究所建立方法的检测限在1.7~2.7 ng·mL−1,5种SAs(每种50 ng·mL−1)的5次重复提取的日间RSDs为2.8%~4.7%,样品回收率在72%~95%,标准偏差小于6.1%。整个处理过程中,吸附剂用量为4 mg,吸附时间为120 s,洗脱时间为60 s,相比其他方法在吸附剂用量和前处理时间上明显下降,大幅提高了样品前处理效率。
本试验方法简便、经济,回收率较高、检出限低、精密度高,说明磁性纳米粒子Fe3O4@SNW-1复合物对磺胺类化合物具有较好的吸附能力,有望推广到除牛奶以外的其他SAs的分析检测方法当中。
-
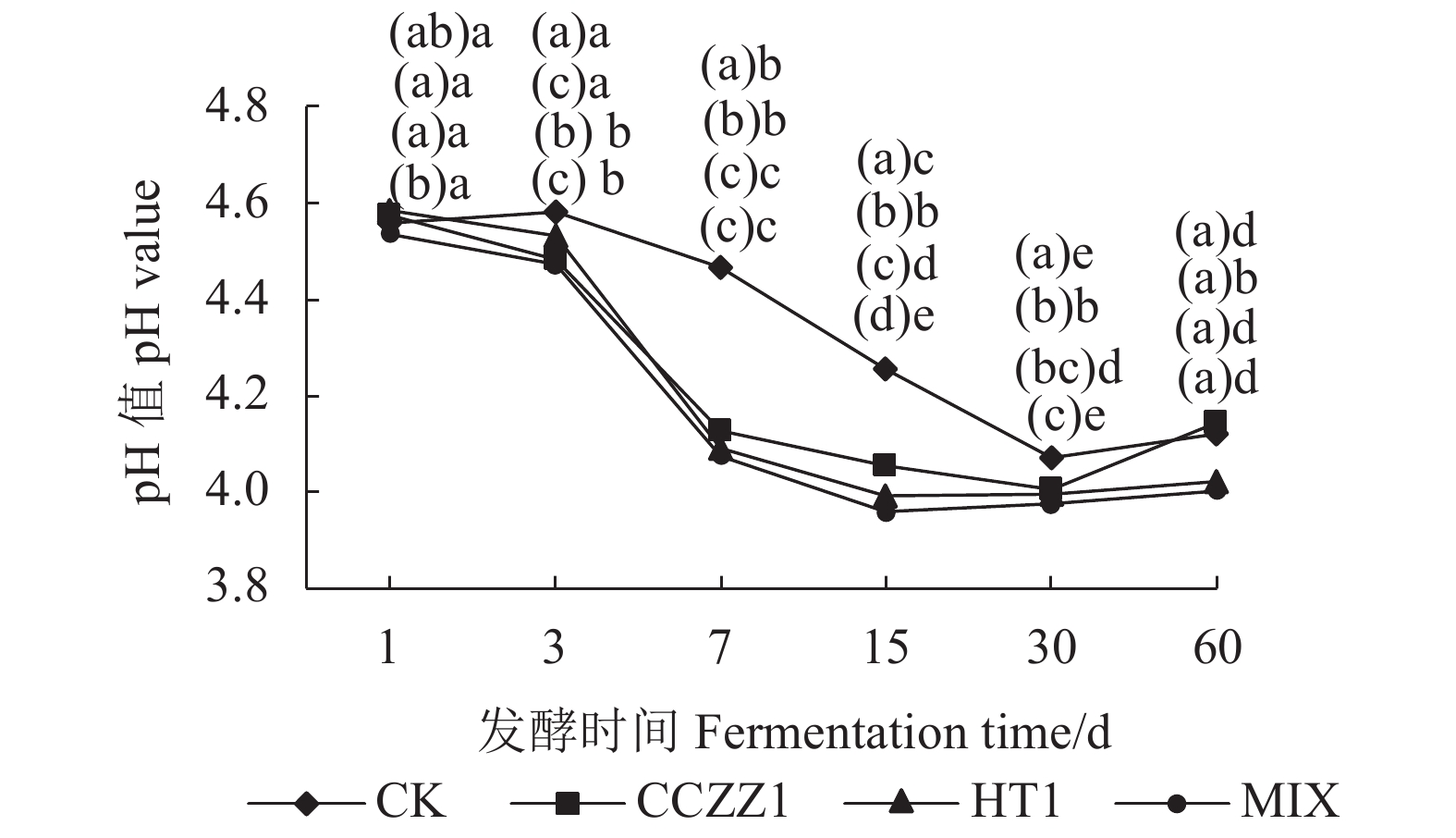
图 1 不同处理、不同发酵时间的菌糠发酵饲料pH值
注:①图中每个时间点不同处理差异显著性标注从上到下依次是CK、CCZZI、HT1、MIX处理组;②( )内无相同字母表示同一时间点不同处理组间差异显著(P<0.05),有相同字母者表示差异不显著(P>0.05);( )外无相同字母表示同一处理组不同时间点间差异显著(P<0.05),有相同字母者表示差异不显著(P>0.05)。图2~3、表3~12同。
Figure 1. Effect of treatments on pH of fermented feed material
Note:①The significant markers of different treatments at each time point in the figure from top to bottom are CK, CCZZI, HT1 and MIX treatment groups.(same as Figure1-3)②Different letters in "( )" indicate that there are significant differences among different treatment groups at the same time(P<0.05), the same letters or not marked letters show no significant difference(P>0.05).The different letters outside "( )" indicated that there were significant differences at different time points in the same treatment group(P<0.05), the same letters or not marked letters show no significant difference(P>0.05). Figure 2-3 and table 3-12 are the same.
表 1 菌糠的化学成分
Table 1 Chemical composition of spent mushroom culture substrate
pH DM/ % WSC/% CP /% NDF/% ADF/% HC/% 5.42 39.89 3.63 9.62 76.03 64.01 12.02 注:(1)表中营养成分均为菌糠干物质(DM)测定值;(2)WSC:可溶性碳水化合物,CP:粗蛋白,NDF:中性洗涤纤维,ADF:酸性洗涤纤维,HC:半纤维素。
Note:(1)all nutrients in the table are measured by bacterial bran dry matter(DM).(2)WSC: Soluble carbohydrate, CP: Crude protein, NDF: Neutral detergent fiber, ADF: Acid detergent fiber, HC:Hemicellulose.表 2 菌糠的微生物组成及数量
Table 2 Microorganisms and microbial counts in spent mushroom culture substrate
[单位:lg(cfu·g−1)] 乳酸菌
Lactic acid bacteria好气性细菌
Aerobic bacteria酵母菌
Yeast霉菌
Mold2.23 4.98 2.35 1.23 表 3 不同处理、不同发酵时间的菌糠发酵饲料氨态氮AN(AN/TN)含量
Table 3 Effect of treatments on ammonia nitrogen AN (AN/TN) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.08±0.01(a)b 0.07±0.01(a)b 0.08±0.00(a)b 0.04±0.00(b)c 3 0.03±0.00(b)f 0.04±0.00(a)e 0.03±0.00(b)f 0.04±0.00(a)c 7 0.04±0.00(a)e 0.04±0.00(a)e 0.04±0.00(a)e 0.04±0.00(a)c 15 0.06±0.01(a)d 0.05±0.00(ab)d 0.05±0.01(ab)d 0.04±0.00(b)c 30 0.07±0.00(a)c 0.06±0.00(ab)c 0.06±0.00(ab)c 0.05±0.01(b)b 60 0.14±0.03(a)a 0.08±0.00(b)a 0.09±0.01(b)a 0.10±0.01(b)a 表 4 不同处理、不同发酵时间的菌糠发酵饲料丙酸PA(FM)含量
Table 4 Effect of treatments on propionic acid PA (FM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.02±0.00(a)a 0.02±0.00(a)b 0.02±0.00(a)b 0.02±0.01(a)b 3 0.01±0.01(a)a 0.02±0.01(a)b 0.02±0.00(a)b 0.02±0.01(a)b 7 0.02±0.00(a)a 0.02±0.00(a)b 0.01±0.01(a)b 0.02±0.01(a)b 15 0.02±0.00(a)a 0.02±0.01(a)b 0.01±0.01(a)b 0.02±0.00(a)b 30 0.03±0.00(b)a 0.04±0.00(a)a 0.04±0.01(a)a 0.04±0.01(a)a 60 0.04±0.04(a)a 0.04±0.01(a)a 0.04±0.01(a)a 0.04±0.02(a)a 表 5 不同处理、不同发酵时间的菌糠发酵饲料丁酸BA(FM)含量
Table 5 Effect of treatments on butyric acid BA (FM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.04±0.01(a)a 0.04±0.01(a)a 0.03±0.02(a)a 0.03±0.00(a)a 3 0.03±0.01(a)a 0.01±0.01(b)b 0.02±0.00(ab)a 0.03±0.01(a)a 7 0.01±0.00(a)b 0.01±0.01(a)b 0.02±0.02(a)a 0.03±0.02(a)a 15 0.01±0.01(a)b 0.03±0.02(a)ab 0.02±0.01(a)a 0.01±0.00(a)b 30 0.01±0.00(a)b 0.01±0.01(a)b 0.01±0.01(a)a 0.01±0.01(a)b 60 0.01±0.01(b)b 0.03±0.01(a)ab 0.02±0.01(ab)a 0.01±0.01(b)b 表 6 不同处理、不同发酵时间的菌糠发酵饲料干物质DM含量
Table 6 Effect of treatments on dry matters (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 36.09±0.72(a)c 36.18±0.61(a)b 36.10±0.32(a)bc 36.47±0.18(a)bc 3 35.91±0.35(a)c 35.34±0.25(a)c 36.04±0.76(a)c 36.32±0.21(a)cd 7 34.96±0.24(b)d 35.67±0.28(a)bc 35.96±0.44(a)c 35.69±0.44(a)d 15 37.05±0.21(a)b 37.39±0.71(a)a 37.38±1.39(a)ab 37.15±0.56(a)a 30 37.09±0.15(a)b 36.12±0.20(bc)b 36.39±0.23(b)bc 35.87±0.03(c)cd 60 40.25±0.66(a)a 38.06±0.15(b)a 38.20±0.02(b)a 37.04±0.33(c)ab 表 7 不同处理、不同发酵时间的菌糠发酵饲料粗灰分Ash含量
Table 7 Effect of treatments on ash (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 11.87±0.07(b)b 12.08±0.16(ab)b 12.35±0.23(a)a 11.98±0.16(b)a 3 11.72±0.11(b)b 12.22±0.24(a)ab 12.69±0.08(a)a 11.85±0.05(b)a 7 11.78±0.29(c)b 12.31±0.06(b)ab 12.66±0.19(a)a 11.78±0.07(c)a 15 11.89±0.56(b)b 12.36±0.24(a)ab 12.56±0.14(a)a 11.76±0.30(b)a 30 12.30±0.38(ab)b 12.46±0.12(ab)a 12.70±0.30(a)a 11.98±0.28(b)a 60 14.02±0.70(a)a 10.94±0.08(b)c 10.52±0.19(b)b 11.23±0.19(b)b 表 8 不同处理、不同发酵时间的菌糠发酵饲料粗蛋白CP含量
Table 8 Effect of treatments on crude protein CP (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 7.01±0.09(a)ab 7.08±0.08(a)b 6.90±0.13(a)b 6.98±0.10b(a)b 3 6.81±0.11(a)bc 7.05±0.14(a)b 6.90±0.10(a)b 6.97±0.60(a)b 7 7.12±0.11(b)a 7.34±0.10(a)a 7.13±0.14(b)a 7.02±0.07(b)b 15 6.98±0.05(b)abc 7.17±0.07(a)b 7.15±0.08(a)a 7.27±0.03(a)a 30 6.79±0.11(a)c 6.86±0.07(a)c 6.80±0.14(a)b 6.81±0.11(a)c 60 6.79±0.19(a)c 6.37±0.11(b)d 6.38±0.08(b)c 6.20±0.01(b)d 表 9 不同处理、不同发酵时间的菌糠发酵饲料可溶性碳水化合物WSC含量
Table 9 Effect of treatments on water soluble carbohydrate WSC (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 0.60±0.14(a)ab 0.48±0.04(a)b 0.49±0.05(a)bc 0.56±0.14(a)ab 3 0.68±0.12(a)a 0.67±0.18(a)a 0.69±0.32(a)a 0.66±0.07(a)a 7 0.53±0.06(a)ab 0.48±0.04(a)b 0.61±0.17(a)ab 0.48±0.02(a)bc 15 0.46±0.04(b)b 0.47±0.01(b)b 0.42±0.04(c)c 0.51±0.03(a)bc 30 0.58±0.04(a)ab 0.63±0.08(a)ab 0.60±0.02(a)ab 0.48±0.05(b)bc 60 0.57±0.11(a)ab 0.66±0.04(a)a 0.55±0.08(a)abc 0.38±0.01(b)c 表 10 不同处理、不同发酵时间的菌糠发酵饲料酸性洗涤纤维ADF含量
Table 10 Effect of treatments on acid washing fiber ADF (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 49.30±1.67(b)b 49.97±3.33(b)e 55.53±2.23(a)cd 56.65±1.76(a)d 3 51.35±7.27(a)b 56.48±0.82(a)d 51.89±3.44(a)d 54.50±2.53(a)d 7 59.32±3.31(a)a 62.66±2.48(a)bc 60.36±4.26(a)bc 61.25±1.48(a)bc 15 61.12±2.06(a)a 58.94±1.64(a)cd 58.53±3.16(a)bc 59.71±0.82(a)c 30 63.34±0.77(b)a 64.70±2.02(ab)ab 66.59±1.16(a)a 62.92±1.67(b)ab 60 64.19±0.91(ab)a 66.84±1.69(a)a 63.77±1.92(b)ab 65.55±1.20(ab)a 表 11 不同处理、不同发酵时间菌糠发酵饲料的中性洗涤纤维NDF含量
Table 11 Effect of treatments on neutral washing fiber NDF (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 60.56±4.86(a)c 61.05±4.11(a)c 66.96±4.26(a)c 62.37±0.92(a)d 3 67.00±3.47(a)b 71.17±1.18(a)b 67.18±5.35(a)c 67.50±2.44(a)c 7 76.61±0.85(a)a 78.25±2.12(a)a 74.95±2.93(a)ab 74.88±2.35(a)ab 15 75.10±2.13(a)a 70.88±3.98(a)b 72.22±3.51(a)bc 75.25±5.35(a)ab 30 75.47±1.58(b)a 75.64±2.05(b)ab 79.43±0.60(a)a 76.85±1.50(ab)a 60 69.93±1.59(b)b 72.95±1.43(a)b 69.44±1.28(b)bc 71.27±1.55(ab)bc 表 12 不同处理、不同发酵时间的菌糠发酵饲料半纤维素HC含量
Table 12 Effect of treatments on hemicellulose HC (DM) in fermented feed material
(单位:%) 发酵时间 Fermentation Time/d CK CCZZ1 HT1 MIX 1 11.26±3.22(a)b 11.08±0.93(a)c 11.43±2.50(a)a 5.72±0.85(b)b 3 15.65±3.99(a)ab 14.68±0.59(a)ab 15.29±4.56(a)a 13.00±0.22(a)a 7 17.29±3.29(a)a 15.59±0.66(a)a 14.60±1.34(a)a 13.63±2.37(a)a 15 13.98±1.95(a)ab 11.93±3.00(a)bc 13.68±0.43(a)a 15.55±4.79(a)a 30 12.12±0.84(a)b 10.95±2.33(a)c 12.84±0.58(a)a 13.93±3.16(a)a 60 5.74±1.39(a)c 6.12±0.40(a)d 5.67±0.84(a)b 5.72±0.46(a)b -
[1] 于磊, 姜明, 徐丽萍, 等. 食用菌菌糠的研究及其再利用 [J]. 黑龙江科技信息, 2014(29):73. YU L, JIANG M, XU L P, et al. Study and reuse of edible fungus chaff [J]. Heilongjiang Science and Technology Information, 2014(29): 73.(in Chinese)
[2] 陈锡, 姜明, 李双双, 等. 菌糠的综合利用研究进展 [J]. 中国园艺文摘, 2017, 33(8):43−44. DOI: 10.3969/j.issn.1672-0873.2017.08.019 CHEN X, JIANG M, LI S S, et al. Research progress on comprehensive utilization of fungus chaff [J]. Zhongguo Yuanyi Wenzhai, 2017, 33(8): 43−44.(in Chinese) DOI: 10.3969/j.issn.1672-0873.2017.08.019
[3] 卫智涛, 周国英, 胡清秀. 食用菌菌渣利用研究现状 [J]. 中国食用菌, 2010, 29(5):3−6, 11. DOI: 10.3969/j.issn.1003-8310.2010.05.001 WEI Z T, ZHOU G Y, HU Q X. Research and utilization of edible fungi residue [J]. Edible Fungi of China, 2010, 29(5): 3−6, 11.(in Chinese) DOI: 10.3969/j.issn.1003-8310.2010.05.001
[4] MA B. Conversion of Masonia tree sawdust and cotton plant by product into feed by white rot fungus (Pleurotus sajor caju) [J]. African Journal of Biotechnology, 2006, 5(19): 503−504.
[5] 张丽影, 潘婷, 苏宇, 等. 平菇和杏鲍菇两种菌糠的营养价值分析 [J]. 广东微量元素科学, 2015, 22(5):24−28. ZHANG L Y, PAN T, SU Y, et al. Nutrition analysis of Pleurotus ostreatus and Pleurotus eryngii spent mushroom substrate [J]. Guangdong Trace Elements Science, 2015, 22(5): 24−28.(in Chinese)
[6] 李志香, 蔡元丽. 菌糠发酵饲料的研究 [J]. 中国畜牧兽医, 2003, 30(5):8−9. DOI: 10.3969/j.issn.1671-7236.2003.05.003 LI Z X, CAI Y L. Study on fermentation feed of fungus chaff [J]. China Animal Husbandry & Veterinary Medicine, 2003, 30(5): 8−9.(in Chinese) DOI: 10.3969/j.issn.1671-7236.2003.05.003
[7] 曹启民, 张永北, 宋绍红, 等. 灵芝菌糠发酵饲料对育肥猪生产性能的影响 [J]. 中国饲料, 2013(9):39−41. CAO Q M, ZHANG Y B, SONG S H, et al. Effects of Ganoderma WMLE feed on production performance of finishing pigs [J]. China Feed, 2013(9): 39−41.(in Chinese)
[8] 罗茂春, 柯志君, 邱丰艳, 等. 白玉菇菌糠分析及其发酵饲料制备工艺优化 [J]. 东北农业大学学报, 2014, 45(9):84−88, 94. DOI: 10.3969/j.issn.1005-9369.2014.09.013 LUO M C, KE Z J, QIU F Y, et al. Nutritional composition analysis of spent white Hypsizygus marmoreus substrate and technological conditions optimization for fermentation feed preparation [J]. Journal of Northeast Agricultural University, 2014, 45(9): 84−88, 94.(in Chinese) DOI: 10.3969/j.issn.1005-9369.2014.09.013
[9] 刘伯实. 纤维素酶产生菌的筛选及其在菌糠开发中的利用[D]. 天津: 天津大学, 2008. LIU B S. Screening of cellulase-producing bacteria and its utilization in the development of fungus residue[D]. Tianjin: Tianjin University, 2008.
[10] 郑有坤, 易敏, 陈建州, 等. 微生物发酵对香菇菌糠饲料品质的影响 [J]. 西南农业学报, 2013, 26(3):1143−1147. ZHENG Y K, YI M, CHEN J Z, et al. Influence of microorganism fermentation on feed quality of spent mushroom compost of Lentinula edodes [J]. Southwest China Journal of Agricultural Sciences, 2013, 26(3): 1143−1147.(in Chinese)
[11] 李志涛, 林冬梅. 菌糠发酵饲料开发应用研究 [J]. 畜牧与兽医, 2015, 47(9):119−121. LI Z T, LIN D M. Study on the Development and Application of fungus chaff fermented Feed [J]. Animal Husbandry & Veterinary Medicine, 2015, 47(9): 119−121.(in Chinese)
[12] 李向林. 饲草饲料的利用与发展对策 [J]. 饲料与畜牧(新饲料), 2000(3):33−35. LI X L. Utilization and Development Countermeasures of forage Feed [J]. Feed and Animal Husbandry (new feed), 2000(3): 33−35.(in Chinese)
[13] BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media [J]. Journal of Dairy Science, 1980, 63(1): 64−75. DOI: 10.3168/jds.S0022-0302(80)82888-8
[14] HAN K, COLLINS M, VANZANT E S, et al. Bale density and moisture effects on alfalfa round bale silage [J]. Crop Science, 2004, 44(3): 914−919. DOI: 10.2135/cropsci2004.9140
[15] 杨胜. 饲料分析及饲料质量检测技术[M]. 北京: 北京农业大学出版社, 1993: 19–33. [16] 森本宏. 家畜栄養実験法[M]. 東京: 養賢堂発行, 1971: 1–149. [17] 张丽英. 饲料分析及饲料质量检测技术[M]. 北京: 中国农业大学出版社, 2007. [18] 傅彤. 微生物接种剂对玉米青贮饲料发酵进程及其品质的影响[D]. 北京: 中国农业科学院, 2005. FU T. Effects of microbial inoculants on fermentation process and quality of corn silage[D]. Beijing: Chinese Academy of Agricultural Sciences, 2005.
[19] 陆亚珍, 王恒昌, 申远航, 等. 杏鲍菇菌糠的营养价值评价及其在羊日粮中的应用效果 [J]. 安徽农业科学, 2017, 45(3):117−118, 166. DOI: 10.3969/j.issn.0517-6611.2017.03.040 LU Y Z, WANG H C, SHEN Y H, et al. Nutritional value evaluation of Pleurotus eryngii bran and its application effects in the diet of goat and sheep [J]. Journal of Anhui Agricultural Sciences, 2017, 45(3): 117−118, 166.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2017.03.040
[20] 白全亮. 菌糠的化学营养价值及其在饲料中的应用 [J]. 科技资讯, 2016, 14(29):62−63. BAI Q L. The chemical and nutritional value of fungus chaff and its application in feed [J]. Science & Technology Information, 2016, 14(29): 62−63.(in Chinese)
[21] 秦翠静, 程书梅, 陈宝江, 等. 菌糠在饲料中的应用研究 [J]. 食用菌, 2016, 38(2):5−6. DOI: 10.3969/j.issn.1000-8357.2016.02.002 QIN C J, CHENG S M, CHEN B J, et al. Study on the application of fungus chaff in feed [J]. Edible Fungi, 2016, 38(2): 5−6.(in Chinese) DOI: 10.3969/j.issn.1000-8357.2016.02.002
[22] 王英超, 潘亮, 高艳萍. 菌糠发酵过程中的生化指标动态变化 [J]. 贵州农业科学, 2013, 41(1):143−145. DOI: 10.3969/j.issn.1001-3601.2013.01.043 WANG Y C, PAN L, GAO Y P. Dynamic changes of biochemical indicators during mushroom dregs fermentation process [J]. Guizhou Agricultural Sciences, 2013, 41(1): 143−145.(in Chinese) DOI: 10.3969/j.issn.1001-3601.2013.01.043
[23] MCDONALD P, HENDERSON A R, HERLOW S J E. The Biochemistry of Silage(Second Edition)[M]. Southampton: Chalcombe Publications, 1991.
[24] 陈鑫珠, 李文杨, 刘远, 等. 发酵时间对菌糠青贮饲料发酵品质的影响 [J]. 草学, 2018(1):28−32. DOI: 10.3969/j.issn.2096-3971.2018.01.006 CHEN X Z, LI W Y, LIU Y, et al. The effect of fermentation time on fermentation quality of fungus chaff silage [J]. Pruataculture & Animal Husbandry, 2018(1): 28−32.(in Chinese) DOI: 10.3969/j.issn.2096-3971.2018.01.006
[25] 陈鑫珠, 李文杨, 刘远, 等. 菌糠发酵饲料品质的动态变化 [J]. 中国草食动物科学, 2018, 38(3):76−78. DOI: 10.3969/j.issn.2095-3887.2018.03.020 CHEN X Z, LI W Y, LIU Y, et al. Dynamic changes of fermentation feed quality of fungus chaff [J]. China Herbivore Science, 2018, 38(3): 76−78.(in Chinese) DOI: 10.3969/j.issn.2095-3887.2018.03.020
[26] 侯建建, 白春生, 张庆, 等. 单一和复合乳酸菌添加水平对苜蓿青贮营养品质及蛋白组分的影响 [J]. 草业科学, 2016, 33(10):2119−2125. DOI: 10.11829/j.issn.1001-0629.2015-0752 HOU J J, BAI C S, ZHANG Q, et al. Effects of different additive amount of single and multiple lactic acid bacteria on the silage quality and protein fractions of alfalfa [J]. Pratacultural Science, 2016, 33(10): 2119−2125.(in Chinese) DOI: 10.11829/j.issn.1001-0629.2015-0752
-
期刊类型引用(2)
1. 颜少宾,郭瑞,周平,周丹蓉,金光. 不同套袋处理对桃果实品质的影响. 食品安全质量检测学报. 2024(21): 115-123 .  百度学术
百度学术
2. 颜少宾,周平,张妤艳,马瑞娟,俞明亮,金光,郭瑞. 光质对红肉桃果肉色泽、类胡萝卜素组分含量的影响. 江苏农业科学. 2021(20): 143-147 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: