Cloning and Expressions of LIS in Dendrobium officinale
-
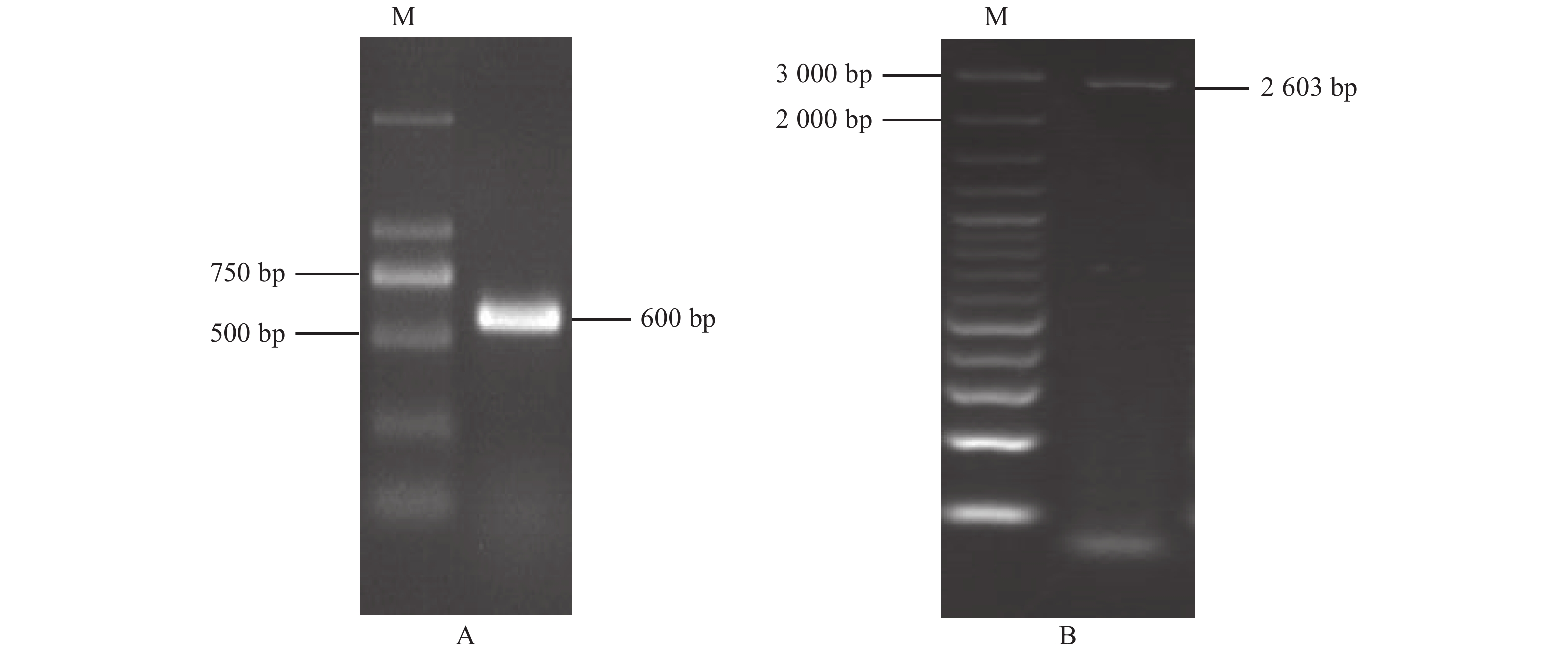
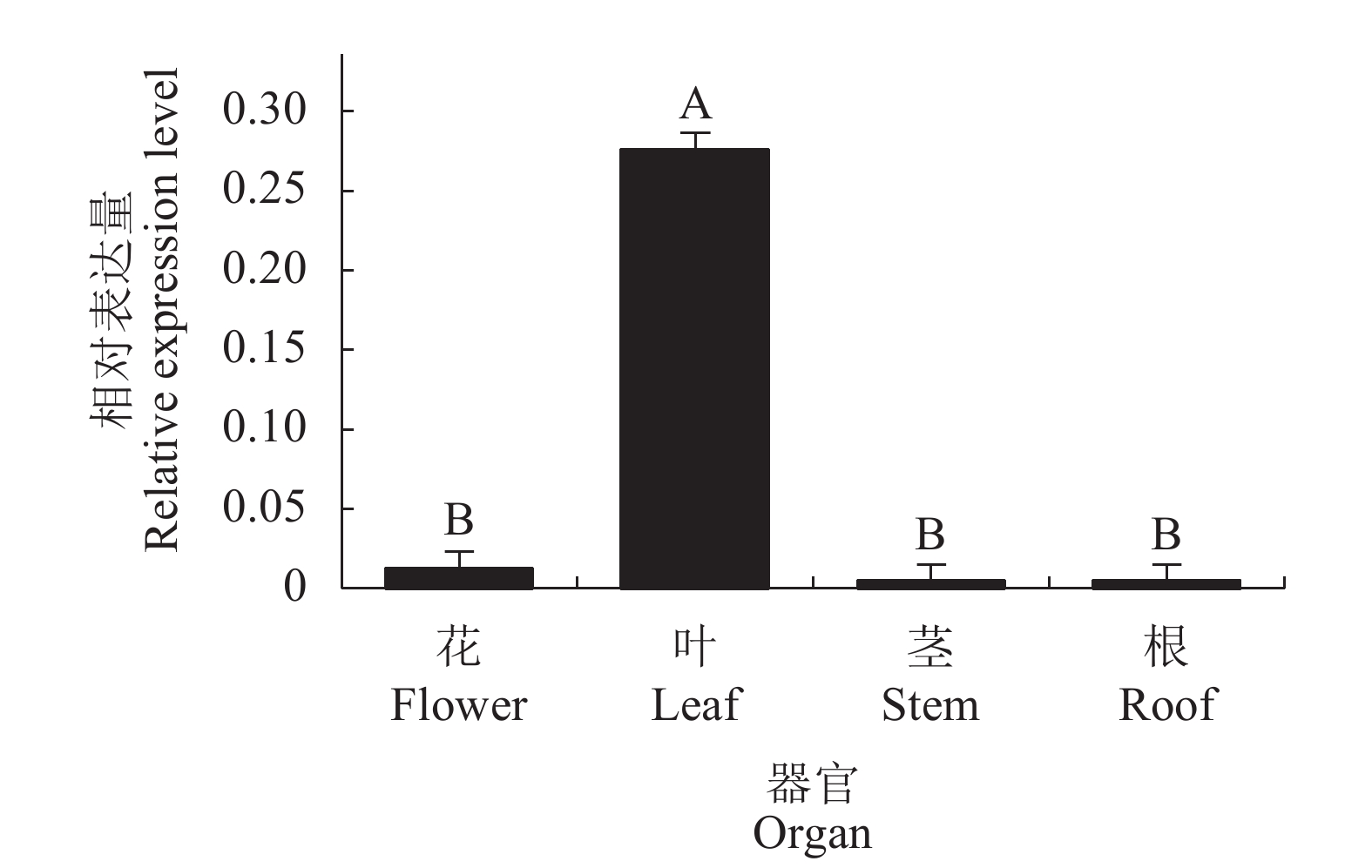
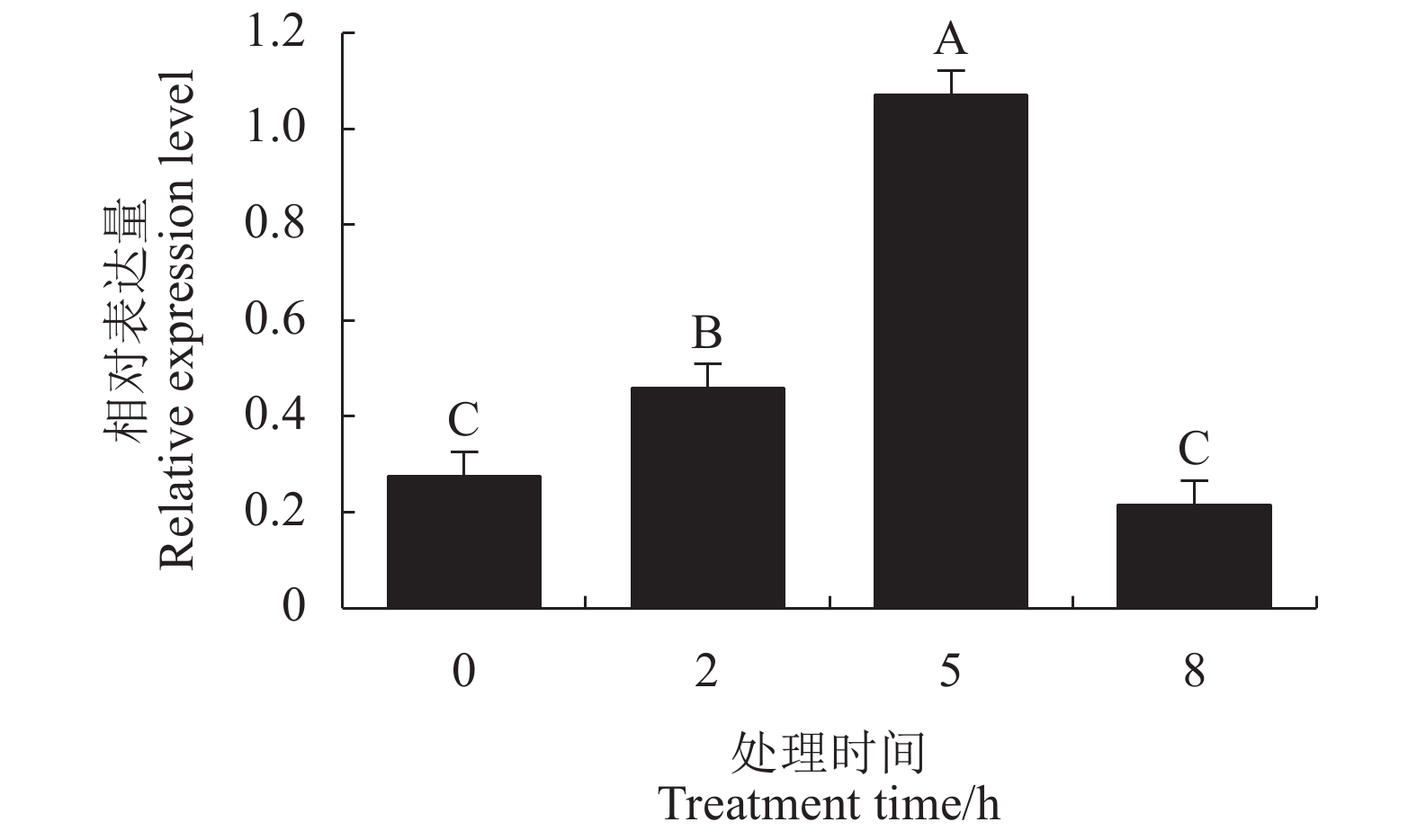
摘要:目的 克隆铁皮石斛(Dendrobium officinale)芳樟醇合酶(linalool synthase, LIS)基因,分析该基因在铁皮石斛开花期花、叶、茎和根中的表达及茉莉酸甲酯(Methyl Jasmonate, MeJA)诱导表达模式,以期为进一步鉴定其功能及分析铁皮石斛单萜类代谢机制奠定基础。方法 利用RACE-PCR和RT-PCR技术克隆DoLIS基因全长cDNA序列和开放阅读框(open reading frame, ORF),利用ProtParam和BLAST P在线软件进行理化性质分析和氨基酸同源性比对,采用MEGA 6.0构建系统进化树。利用qPCR方法分析DoLIS基因在开花期铁皮石斛花、叶、茎和根中的表达及MeJA处理后叶片中的表达模式。结果 DoLIS基因cDNA序列全长2 844 bp,含有1个2 538 bp的ORF,编码845个氨基酸。分子量为98.298 kD,理论等电点为7.04,不稳定系数是46.29,属不稳定蛋白。DoLIS蛋白具有Terpene_cyclase_plant_C1保守结构域。系统进化分析表明,DoLIS与其他物种的(S)-(+)-LIS聚在同一支,与姬蝴蝶兰(XP_020576697)的LIS亲缘关系最近。qPCR分析结果显示,DoLIS基因在铁皮石斛开花期叶片中的相对表达量最高,在MeJA处理后相对表达量呈先上升后下降的趋势,处理后5 h相对表达量达到最高,是诱导前的3.88倍。结论 本研究克隆了铁皮石斛DoLIS基因cDNA全长,该基因在叶片中的相对表达量极显著高于花、茎和根中的表达量。MeJA处理能显著诱导DoLIS基因的表达。Abstract:Objective Linalool synthase gene, LIS, of Dendrobium officinale was cloned. Expression patterns of the gene in flower, leaf, stem, and root at flowering stage as well as those in leaf induced by methyl jasmonate (MeJA) were determined to help decipher the monoterpene metabolism mechanism involved.Method Full-length cDNA of D. officinale LIS (DoLIS) was cloned using RACE-PCR and RT-PCR. Physiochemical properties and amino acid homology were analyzed by ProtParam and BLAST P, and phylogenetic tree constructed by MEGA 6.0. Expressions of DoLIS in the flowers, leaves, stems, and roots of D. officinale at flowering stage, as well as those in the MeJA-treated leaves were determined by quantitative real time PCR.Result The full-length of DoLIS was 2 844 bp with a 2 538 bp ORF encoding 845 amino acids. The protein had a molecular weight of 98.298 KD, a theoretical isoelectric point of 7.04, and an instability coefficient of 46.29. An unstable protein, DoLIS contained a conservative domain of Terpene_cyclase_plant_C1. The phylogenetic analysis showed that DoLIS was closely related to Phalaenopsis equestris (XP_02057697) and clustered in the same branch with the (s)-(+)-LIS of other species. The qPCR results on relative expression of DoLIS indicated that the highest level at flowering stage was found in the leaves. The MeJA induction produced the peak DoLIS expression, which was 3.88-fold of the original, in 5h after the treatment.Conclusion This study cloned the full-length cDNA of DoLIS and discovered the relative expression of the gene to be significantly higher in the leaves than the flowers, stems or roots of a D. officinale plant at the flowering stage. In addition, the expression could be upregulated by MeJA induction.
-
Keywords:
- Dendrobium officinale /
- linalool synthase /
- gene cloning /
- expression analysis /
- methyl jasmonate
-
0. 引 言
【研究意义】白茶是我国传统六大茶类之一,主产于福建省的政和、福鼎、建阳、松溪等地,福建白茶产量占全国白茶总产量的90%以上[1]。白茶由鲜叶经萎凋、干燥加工而成,风味独特,保健功效明显。近年来,白茶逐步为广大消费者所喜爱和关注,同时有关白茶风味成分、品质和保健功效的研究不断推进[2]。因此,探究白茶不同类型、不同泡次内含物溶释变化动态,可为白茶风味、保健功效提供茶汤层面的化学认知,对于白茶工艺、品质改进及科学饮茶具有重要意义。【前人研究进展】现有茶叶成分的研究,主要集中在干茶,包括存贮[3-4]、类型等级[5]、茶汤滋味[1-2],以及不同冲泡时间、水温、水质等条件下[6-9]茶叶成分的溶释,表明存贮年份和冲泡水质、水温、时间、茶水比、器具等都不同程度影响茶汤的化学组成。茶叶冲泡过程中内含物的溶出量与茶汤风味关系密切[10-11],不同茶类的内含物总量、溶释有其自身特点,因此适宜的冲泡次数和条件不尽相同。【本研究切入点】白茶含有多种风味物质[12-13],这些物质溶出的快慢、多少及不同泡次的溶出量分布如何,都直接关系到茶汤的感官体验。本课题组已对白茶不同泡次儿茶素、氨基酸组分的溶释进行了初步分析[14],但尚未全面涉及其他内含物溶释特点、规律的探讨。【拟解决的关键问题】本研究采用产地为福建政和的4种白茶样品,分别比较其3泡次茶汤中水浸出物、多酚类、儿茶素、可溶性糖、氨基酸、咖啡碱、黄酮及茶黄素、茶红素、茶褐素等的溶释变化动态,以期为揭示白茶内含物溶释特点和规律提供依据。
1. 材料与方法
1.1 供试材料
供试茶样采自福建省政和县,茶树品种、品名和等级见表1。
表 1 供试茶样及编号Table 1. Tea samples and codes茶样编号
Tea No产地
Place of origin茶树品种
Cultivar品名、等级
Product name & gradeFD1 福建 政和 Zhenghe county, Fujian province 福鼎大白茶 Fuding big & white leaf 白牡丹一级 White peony of 1st grade FD3 福建 政和 Zhenghe county, Fujian province 福鼎大白茶 Fuding big & white leaf 白牡丹三级 White peony of 3rd grade ZD1 福建 政和 Zhenghe county, Fujian province 政和大白茶 Zhenghe big & white leaf 白牡丹一级 White peony of 1st grade ZD3 福建 政和 Zhenghe county, Fujian province 政和大白茶 Zhenghe big & white leaf 白牡丹三级 White peony of 3rd grade 1.2 茶汤制备
参照GB/T 23776—2018[15]冲泡茶汤。称取3.00 g茶样,加入150 mL沸蒸馏水冲泡,重复冲泡3次,每次冲泡5 min,共得到3泡次茶汤,茶汤分别经过滤等处理,形成待测样品。
1.3 化学成分测定
茶叶水浸出物含量测定参照GB/T 8305—2013[16],茶多酚和儿茶素含量测定参照GB/T 8313—2018[17],咖啡碱含量测定参照GB/T 8312—2013[18],茶叶中茶氨酸的测定参照GB/T 23193—2017[19],茶黄素、茶红素、茶褐素测定参照系统分析法[20],可溶性糖测定参照蒽酮比色法[20],黄酮测定参照三氯化铝比色法[20]。每个样品重复3次,取平均值。
1.4 数据处理
内含物总量、溶出量以“g·hg−1”表示,即总量为100 g干茶中某内含物的总质量,溶出量为每100 g干茶溶出该内含物的总质量,溶出率为溶出量占该内含物总量的百分比(%)。
使用Microsoft Excel 2019、SPSS 2.1等软件,对数据进行方差分析、多重比较。
2. 结果与分析
2.1 不同泡次对水浸出物溶释的影响
表2显示,在同一茶样的3次冲泡中,水浸出物溶出量、溶出率均以第1泡最高,第2、第3泡逐次减少,其溶出量在各泡次之间均存在显著差异(P<0.05),表明水浸出物溶释受到泡次的严重影响。4个茶样3次冲泡中,第1、2、3泡溶出量均值分别为12.70 、8.67 、5.77 g·hg−1,溶出率均值分别为26.96%、18.40%、12.26%;3泡总溶出量均值为27.14 g·hg−1,总溶出率均值为57.62%。结果显示,水浸出物溶出量在不同茶样相同泡次之间无显著差异,但在较高等级白茶茶汤中溶出率较高。
表 2 不同泡次对水浸出物溶出量、溶出率的影响Table 2. Effects of repeated brewing on dissolved amount and rate of water extract茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 47.47±1.26 13.53±0.17 a 8.68±0.40 b 5.50±0.06 c 27.71 28.50 18.29 11.59 58.37 FD3 47.70±1.34 12.37±0.27 a 8.39±0.21 b 5.34±0.13 c 26.10 25.93 17.59 11.19 54.72 ZD1 46.18±0.36 12.67±0.55 a 8.58±0.18 b 6.20±0.60 c 27.45 27.44 18.58 13.43 59.44 ZD3 47.11±0.31 12.23±0.70 a 9.02±0.11 b 6.04±0.49 c 27.29 25.96 19.15 12.82 57.93 平均值 Mean values 47.12 12.70 8.67 5.77 27.14 26.96 18.40 12.26 57.62 注:表中溶出量数据为平均值±标准偏差,同行数据之间小写字母(括号外)不同表示泡次之间差异达到显著水平(P<0.05);同列数据之间小写字母(括号内)不同表示茶样之间差异达到显著水平(P<0.05);未标注则表示同行或同列数据之间无显著差异。表3、表5~7、表9~11同。
Note: Data are mean±standard deviation; those with different lowercase letters on same row indicate significant difference at P<0.05; those with different lowercase letters on same column (in parentheses) indicate significant difference at P<0.05; those without marked letter indicate no significant difference. Same for Table 3, 5-7, and 9-11.2.2 不同泡次对可溶性糖溶释的影响
茶叶中的可溶性糖主要是单糖和双糖,是形成茶汤甘甜滋味的主要物质之一。从表3可见,在同一茶样的3次冲泡中,可溶性糖各泡次之间的溶出量、溶出率极为接近,表明可溶性糖溶释受泡次影响小。4个茶样3次冲泡中,第1、2、3泡溶出量在1.41~1.42 g·hg−1,溶出率在17.58%~18.00%;3泡总溶出量均值为4.26 g·hg−1,总溶出率均值为53.27%。可见,可溶性糖在不同茶样相同泡次之间的溶出量、溶出率也极为接近,不存在白茶等级上的显著差异。
表 3 不同泡次对可溶性糖溶出量、溶出率的影响Table 3. Effects of repeated brewing on dissolved amount and rate of soluble sugar茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 7.89±0.01 1.42±0.00 1.42±0.00 1.41±0.00 4.25 18.00 18.00 17.87 53.87 FD3 8.07±0.01 1.42±0.00 1.42±0.00 1.42±0.00 4.26 17.60 17.60 17.60 52.79 ZD1 7.98±0.02 1.42±0.00 1.42±0.00 1.42±0.00 4.26 17.79 17.79 17.79 53.38 ZD3 8.02±0.01 1.42±0.00 1.42±0.00 1.41±0.00 4.25 17.71 17.71 17.58 52.99 平均值 Mean values 7.99 1.42 1.42 1.42 4.26 17.78 17.78 17.71 53.27 2.3 不同泡次对氨基酸及其主要组分溶释的影响
氨基酸是形成白茶鲜爽滋味的重要成分。表4显示,在同一茶样的3次冲泡中,氨基酸溶出量、溶出率均以第1泡最高,第2、第3泡逐次减少,且减幅明显。4个茶样3次冲泡中,第1、2、3泡溶出量均值分别为1.13 、0.79、0.46 g·hg−1,溶出率均值分别为31.54%、22.40%、12.75%;3泡总溶出量均值为2.38 g·hg−1,总溶出率均值为66.69%。可见,氨基酸溶出较快,3泡总溶出率也较高。此外,氨基酸在较高等级白茶中含量较多,在不同茶样相同泡次之间,其溶出量表现出明显的茶叶品种和等级差异,但其溶出率在品种和等级之间差异不明显。
表 4 不同泡次对氨基酸溶出量、溶出率的影响Table 4. Effects of repeated brewing on dissolved amount and rate of amino acid茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 4.35 1.46 1.00 0.50 2.96 33.33 22.99 11.49 67.81 FD3 3.50 1.20 0.77 0.45 2.42 34.29 22.00 12.86 69.15 ZD1 3.50 1.06 0.80 0.45 2.31 30.29 22.86 12.86 66.00 ZD3 2.76 0.78 0.60 0.38 1.76 28.26 21.74 13.77 63.77 平均值 Mean values 3.53 1.13 0.79 0.46 2.38 31.54 22.40 12.75 66.69 据本课题组测定[14],上述4个茶样以茶氨酸(The)、天冬酰胺(Asn)、谷氨酰胺(Gln)、丝氨酸(Ser)含量最高,分别占氨基酸总量的40.15%~47.09%、6.55%~11.73%、5.75%~9.98%、3.90%~4.81%。比较发现,各氨基酸组分在茶汤中的溶释存在不同程度差异,其中谷氨酸(Glu)、天冬氨酸(Asp)、丝氨酸(Ser)的3泡总溶出率高达77.89%以上,Glu经3次冲泡几乎全部溶出。The、Asn、Gln的3泡总溶出率分别在63.14%~65.26%、69.42% ~71.71%、62.92%~71.71%,其中The溶出率与其总量对比反差最为明显。3泡溶出量方面,以The、Asn、Gln、Ser最高,此外政和大白茶的主要氨基酸组分总量和溶出量总体上低于福鼎大白茶。
2.4 不同泡次对咖啡碱溶释的影响
咖啡碱占茶叶干物总量的2%~5%,是茶汤苦味的主要来源成分之一[21],并具有多种保健功效[22]。表5显示,4个茶样3次冲泡中,咖啡碱第1泡溶出率达32.18%~40.69%,从第1至第3泡,溶出率递减幅度为10%左右,3泡总溶出率均值达78.95%,从第1泡溶出率和3泡总溶出率表明,咖啡碱溶释效率高。在同一茶样3次冲泡之间,咖啡碱溶出量均存在显著差异(P<0.05);在不同茶样相同泡次之间,较高等级白茶的溶出量较多,福鼎大白茶溶出率总体高于政和大白茶,但溶出率未表现出茶叶等级之间的规律性差异。
表 5 不同泡次对咖啡碱溶出量、溶出率的影响Table 5. Effects of repeated brewing on dissolved amount and rate of caffeine茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 4.54±0.20 1.67±0.11 a(a) 1.38±0.04 b(a) 0.65±0.04 c(a) 3.70 36.78 30.4 14.32 81.50 FD3 4.08±0.09 1.66±0.03 a(a) 1.15±0.11 b(b) 0.61±0.10 c(a) 3.42 40.69 28.19 14.95 83.82 ZD1 4.09±0.08 1.59±0.07 a(a) 1.10±0.03 b(bc) 0.57±0.02 c(ab) 3.26 38.88 26.89 13.94 79.71 ZD3 3.76±0.11 1.21±0.06 a(b) 0.98±0.02 b(c) 0.47±0.06 c(b) 2.66 32.18 26.06 12.50 70.74 平均值 Mean values 4.12 1.53 1.15 0.58 3.26 37.13 27.89 13.93 78.95 表 6 不同泡次对多酚类溶出量、溶出率的影响Table 6. Effects of repeated brewing on dissolved amount and rate of polyphenol茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 17.11±1.90 4.48±0.36 a(a) 3.31±0.37 b 2.24±0.31 c 10.03 26.18 19.35 13.09 58.62 FD3 17.46±1.80 3.73±0.34 a(b) 3.05±0.21 b 2.05±0.14 c 8.83 21.36 17.47 11.74 50.57 ZD1 16.59±0.68 3.75±0.32 b(b) 3.09±0.17 c 2.41±0.21 d 9.25 22.60 18.63 14.53 55.76 ZD3 17.39±2.11 4.48±0.36 a(a) 3.30±0.37 c 2.33±0.31 d 10.11 25.76 18.98 13.40 58.14 平均值 Mean values 17.14 4.11 3.19 2.26 9.56 23.98 18.6 13.19 55.77 2.5 不同泡次对多酚类溶释的影响
多酚类是茶叶中含量最多的一类干物质,与白茶风味和保健功效密切相关[3]。表6显示,在同一茶样的3次冲泡中,多酚类溶出量、溶出率均以第1泡最高,以后逐次减少。4个茶样3次冲泡中,多酚类的总溶出量在8.83~10.11 g·hg−1,总溶出量均值为 9.56 g·hg−1;总溶出率在50.57%~58.62%,总溶出率均值为55.77%。在同一茶样3次冲泡之间,其溶出量均存在显著差异(P<0.05);在不同茶样相同泡次之间,多酚类溶出量、溶出率未表现出茶叶品种和等级上的规律性差异。
2.6 不同泡次对黄酮溶释的影响
茶叶中的黄酮以单体及其苷类形式存在,具有较强的味觉和生理活性[23]。表7表明,在同一茶样的3次冲泡中,黄酮溶出量、溶出率均以第1泡最高,溶出率均值从第1至第3泡的递减幅度约为6%,4个茶样3次冲泡的总溶出率均值为70.71%。在同一茶样3泡次之间,黄酮溶出量均存在显著差异(P<0.05);在不同茶样相同泡次之间,福鼎大白茶溶出率高于政和大白茶,一级白茶溶出率高于三级白茶。
表 7 不同泡次对黄酮溶出量、溶出率的影响Table 7. Effects of repeated brewing on dissolved amount and rate of flavone茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 0.59±0.05 0.22±0.01 a(a) 0.16±0.01 b(a) 0.12±0.00 c(a) 0.5 37.29 27.12 20.34 84.75 FD3 0.73±0.06 0.20±0.01 a(b) 0.17±0.00 b(a) 0.13±0.00 c(a) 0.49 27.40 23.29 17.81 67.12 ZD1 0.62±0.06 0.20±0.01 a(b) 0.15±0.01 b(a) 0.11±0.00 c(a) 0.46 33.33 25.00 18.33 76.67 ZD3 0.67±0.04 0.14±0.00 a(c) 0.11±0.01 b(b) 0.09±0.00 c(b) 0.34 20.90 16.42 13.43 50.75 平均值 Mean values 0.65 0.19 0.15 0.11 0.45 29.73 22.96 17.48 70.71 2.7 不同泡次对儿茶素及其主要组分溶释的影响
茶叶中的儿茶素是备受关注的风味和保健成分,其形成和转化与白茶茶汤的色、香、味密切相关[23]。从表8可见,在同一茶样的3次冲泡中,儿茶素溶出量、溶出率均呈现第1泡至第3泡逐次减少的规律,但减幅不大;4个茶样3次冲泡中,儿茶素溶出率第1泡在14.80%~17.54%,第2泡在13.16%~15.52%,第3泡在8.03%~11.21%,3泡总溶出率在36.63%~43.97%,表明儿茶素溶出慢,3泡总溶出率低。在不同茶样相同泡次之间,儿茶素溶出量、溶出率未表现出茶叶品种和等级上的规律性差异。
表 8 不同泡次对儿茶素溶出量、溶出率的影响Table 8. Effects of repeated brewing on dissolved amount and rate of catechin茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 10.80 1.70 1.60 1.10 4.40 15.74 14.81 10.19 40.74 FD3 11.60 2.00 1.80 1.30 5.10 17.24 15.52 11.21 43.97 ZD1 11.40 2.00 1.50 1.10 4.80 17.54 13.16 9.65 40.35 ZD3 13.70 2.00 1.89 1.10 4.99 14.80 13.80 8.03 36.63 平均值 Mean values 11.88 1.93 1.70 1.15 4.78 16.33 14.32 9.77 40.42 据本课题组测定[14],上述4个茶样的儿茶素总量在10.80%~13.70%,组分中以表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)和表没食子儿茶素(EGC)含量最高,分别占儿茶素总量的65.33%~67.54%、17.09%~21.08%、4.39%~7.90%。以上高含量儿茶素组分中,EGCG、ECG 三泡总溶出率分别为34.55%~47.94%、35.98%~47.94%,EGC在福鼎大白茶和政和大白茶一级白牡丹3泡茶汤中均未检出,在其三级白牡丹(FD3)3泡茶汤中的总溶出率为44.10%~51.81%,与儿茶素溶释效率整体低下的结果一致(表8)。
2.8 不同泡次对“茶三素”溶释的影响
“茶三素”即茶黄素、茶红素、茶褐素,由多酚类物质经氧化、聚合等反应形成,是白茶重要的风味成分,并具有保健开发和利用价值[23-24]。
2.8.1 茶红素
从表9可见,与其他内含物不同,在同一茶样的3次冲泡中,茶红素溶出量、溶出率为第1泡<第2泡<第3泡,其均值分别为0.80 g·hg−1和13.77%、0.96 g·hg−1和16.57%、1.83 g·hg−1和31.63%,3泡总溶出量、总溶出率均值分别为3.59 g·hg−1和61.97%。另可见,第3泡较第2泡的溶出量均值增加近1倍,溶出率均值增加约15%,显示白茶中茶红素溶释的不同特点。在同一茶样3次冲泡之间,茶红素溶出量均存在显著差异(P<0.05);在不同茶样相同泡次之间,茶红素溶出量、溶出率未表现出茶叶品种和等级上的规律性差异。
表 9 不同泡次对茶红素溶出量、溶出率的影响Table 9. Effects of repeated brewing on dissolved amount and rate of thearubigin茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 5.70±0.16 0.79±0.24 a 0.94±0.16 b 1.79±0.03 c 3.52 13.79 16.52 31.32 61.63 FD3 5.99±0.09 0.81±0.01 a 0.96±0.03 b 1.83±0.02 c 3.60 13.59 16.02 30.60 60.22 ZD1 5.82±0.25 0.79±0.01 a 0.98±0.05 b 1.89±0.03 c 3.66 13.62 16.78 32.40 62.79 ZD3 5.62±0.18 0.79±0.00 a 0.95±0.01 b 1.81±0.02 c 3.55 14.08 16.95 32.19 63.21 平均值 Mean values 5.78 0.80 0.96 1.83 3.59 13.77 16.57 31.63 61.97 表 10 不同泡次对茶黄素溶出量、溶出率的影响Table 10. Effects of repeated brewing on dissolved amount and rate of theaflavin茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 0.36±0.00 0.04±0.00 a(a) 0.04±0.00 a(a) 0.03±0.00 b 0.11 10.55 10.58 8.29 29.42 FD3 0.38±0.00 0.04±0.00 a(a) 0.04±0.00 a(a) 0.03±0.00 b 0.11 11.53 10.03 8.04 29.60 ZD1 0.34±0.00 0.04±0.00 a(a) 0.03±0.00 b(b) 0.03±0.00 b 0.1 10.60 10.21 9.41 30.22 ZD3 0.35±0.00 0.06±0.00 a(b) 0.04±0.00 b(a) 0.03±0.00 c 0.13 17.18 10.71 8.25 36.14 平均值 Mean values 0.36 0.05 0.04 0.03 0.12 12.46 10.38 8.50 31.34 2.8.2 茶黄素
表10显示,在同一茶样3次冲泡之间的茶黄素溶出量总体上变化微小,第1至第3泡茶黄素溶出率均值递减幅度也仅为2%左右,表明茶黄素在3次冲泡中的溶释较为均匀。4个茶样3次冲泡中,第1至第3泡的茶黄素溶出率均值分别为12.46%、10.38%、8.50%,3泡总溶出率均值为31.34%,表明茶黄素溶释效率低下。在不同茶样相同泡次之间,茶黄素溶出量、溶出率未表现出茶叶品种和等级上的规律性差异。
2.8.3 茶褐素
表11表明,在同一茶样3次冲泡中,茶褐素溶出量、溶出率第2泡比第1泡稍高,第3泡最低,且第3泡较第2泡减幅明显,溶出量、溶出率均值分别减少0.32 g·hg−1和5.16%。4个茶样3次冲泡中,第1至第3泡的茶褐素溶出率均值分别为22.66%、23.24%、18.08%,3泡总溶出率均值为63.98%。在不同茶样相同泡次之间,茶褐素溶出量、溶出率未表现出茶叶品种和等级上的规律性差异。
表 11 不同泡次对茶褐素溶出量、溶出率的影响Table 11. Effects of repeated brewing on dissolved amount and rate of theabrownine茶样编号
Tea No总量
Total amount/(g·hg−1)溶出量 Amount dissolved/(g·hg−1) 溶出率 Ratio to total amount/% 第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
Total第1泡
1st brew第2泡
2nd brew第3泡
3rd brew合计
TotalFD1 6.13±0.07 1.37±0.11 a 1.42±0.09 a 1.13±0.05 b 3.92 22.39 23.2 18.39 63.98 FD3 6.38±0.25 1.44±0.14 a 1.47±0.06 a 1.12±0.06 b 4.03 22.57 23.08 17.54 63.19 ZD1 6.17±0.08 1.42±0.03 a 1.43±0.09 a 1.14±0.03 b 3.99 23.04 23.16 18.46 64.66 ZD3 6.20±0.13 1.40±0.10 a 1.46±0.03 a 1.11±0.02 b 3.97 22.64 23.53 17.95 64.11 平均值 Mean values 6.20 1.41 1.45 1.13 3.98 22.66 23.24 18.08 63.98 3. 讨论与结论
本文探讨了白茶内含物在3泡次茶汤中的溶释,表明内含物之间在溶出快慢、趋势上存在差异,呈现出不同的特点。结果显示,就第1至第3泡的溶出率而言,可溶性糖、茶黄素变化不大,茶红素逐次增加,其余内含物逐次减少,其中咖啡碱、氨基酸逐次减幅明显,达9%以上;茶红素逐次增幅达10%左右。咖啡碱、氨基酸第1泡溶出率高,3泡总溶出率达到70%以上(表4~5)。由此可见,咖啡碱、氨基酸溶出较快,且较充分。结果还显示,高含量内含物中,多酚类、儿茶素溶出缓慢,尤其是儿茶素,其3泡总溶出率仅为40%左右(表8),这与高含量EGCG、ECG的溶释特点及结果一致[14]。内含物溶出的快慢,可通过溶出率来加以判断。据研究,溶出率是由物质性质决定的[6,8,10],同时也受到冲泡温度、时间、茶水比[3-6]等因素的影响。本试验显示的咖啡碱、氨基酸的溶释特点在其他茶类[25]或不同冲泡条件下[6-7,9,26]同样存在,而有关多酚类、儿茶素、茶红素等的测定结果还待进一步探讨。
干茶中风味物质的含量是茶汤品质的基础[4,11,23],这些物质在茶汤中的溶释决定了饮茶的感官体验。本试验表明,由于各内含物之间在溶释速率、特点上存在差异,茶汤较之于干茶,其内含物的含量已发生了不同程度改变。结果显示,检测的内含物在4个白茶样中的总量均值为多酚类17.14 g·hg−1、儿茶素11.88 g·hg−1、可溶性糖7.99 g·hg−1、茶褐素6.20 g·hg−1、茶红素5.78 g·hg−1、咖啡碱4.12 g·hg−1、氨基酸3.53 g·hg−1、黄酮0.65 g·hg−1、茶黄素0.36 g·hg−1,其3泡总溶出量均值分别9.56 g·hg−1、4.78 g·hg−1、4.26 g·hg−1、3.98 g·hg−1、3.59 g·hg−1、3.26 g·hg−1、2.38 g·hg−1、0.45 g·hg−1、0.12 g·hg−1,可见多酚类、儿茶素等在茶汤中的含量比例有所降低;同时,这些内含物总溶出量在3泡次茶汤中的分布也有所不同,如前所述,咖啡碱、氨基酸等在前期泡次茶汤中的含量较高(表4~5,表7),而茶红素在后期泡次茶汤中的溶出较多(表9)。据报道[9,25],在不同冲泡条件下,同一种茶叶可呈现不同的品质风味。本结果较为全面地显示了不同泡次茶汤中白茶风味物质的含量、比例,同时也为通过调整冲泡时间、泡次来改变茶汤的化学组成和品质风味提供了研究基础。
本试验显示,同一茶样3次冲泡中,水浸出物、多酚类、咖啡碱、黄酮、茶红素溶出量的增减均达到显著差异(P<0.05)水平,而咖啡碱、氨基酸溶出率逐次下降明显,降幅达9%以上;不同茶样相同泡次之间,较高等级白茶茶汤中的水浸出物、氨基酸、咖啡碱溶出量较高,而内含物溶出率总体上未表现出茶叶品种和等级之间的规律性差异,表明泡次是影响溶出量、溶出率的主要因素。
茶叶风味物质中,高含量成分一直受到关注,高含量成分对茶汤品质风味的作用因茶类特征不同而有所差别。据报道[11],氨基酸、还原性糖含量对白茶感官品质有明显正面影响,而水浸出物、多酚类含量的作用则相反。本试验显示,白茶茶汤中多酚类、儿茶素的溶出率低,氨基酸溶出率高。另据本课题组测定[14],白茶高含量儿茶素、氨基酸组分中,具有强烈涩味的EGCG、ECG的3泡总溶出率仅分别为34.55%~47.94%、35.98%~47.94%,但具有鲜甜滋味和保健功效的The在冲泡时并未充分溶出,3泡总溶出率为63.14%~65.26%。
综上,本文对白茶不同泡次内含物溶释的研究结果,有助于对这些内含物溶释特点、规律及不同泡次茶汤化学组成的认知,同时为白茶工艺、品质改进及科学饮茶提供理论依据。
-
表 1 PCR引物及其序列
Table 1 PCR primers and sequences
引物名称
Primer name引物序列(5′-3′)
Primer sequence(5′-3′)3LIS-F1 CTCAACACAGAGTCAAGAAAGG 3LIS-F2 TCATTTGACTCGCCAACCGCAC dT-adapt CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTTT adapt CTGATCTAGAGGTACCGGATCC DoLIS-F CCGGAATTCATGGAGCAGTCATTGTGGTT DoLIS-R CCGCTCGAGCTTTCTCCCTTCATTTGCTC LIS-F TGGATCATTTGGAGCACAG LIS-R CATTTGGCTGCTTCCTTTC DoACT-F AGGAAGGCGGCTTTGAATC DoACT-R CCATGCCAACCATGACACC 注:下划线碱基为酶切位点。
Note: The underlined bases were the enzyme site. -
[1] 姜冬梅, 朱源, 余江南, 等. 芳樟醇药理作用及制剂研究进展 [J]. 中国中药杂志, 2015, 40(18):3530−3533. JIANG D M, ZHU Y, YU J N, et al. Advances in research of pharmacological effects and formulation studies of linalool [J]. China Journal of Chinese Materia Medica, 2015, 40(18): 3530−3533.(in Chinese)
[2] 吴克刚, 赵欣欣, 段雪娟, 等. 芳樟醇气相抗菌活性与作用机制 [J]. 食品科学, 2020, 41(1):61−67. WU K G, ZHAO X X, DUAN X J, et al. Antibacterial activity and mechanism of action of vapor-phase linalool [J]. Food Science, 2020, 41(1): 61−67.(in Chinese)
[3] QUEIROGA C L, DUARTE M C T, RIBEIRO B B, et al. Linalool production from the leaves of Bursera aloexylon and its antimicrobial activity [J]. Fitoterapia, 2007, 78(4): 327−328. DOI: 10.1016/j.fitote.2007.03.012
[4] ALVIANO W S, MENDONÇA-FILHO R R, ALVIANO D S, et al. Antimicrobial activity of Croton cajucara Benth linalool-rich essential oil on artificial biofilms and planktonic microorganisms [J]. Oral Microbiology and Immunology, 2005, 20(2): 101−105. DOI: 10.1111/j.1399-302X.2004.00201.x
[5] PARK S N, LIM Y K, FREIRE M O, et al. Antimicrobial effect of linalool and α-terpineol against periodontopathic and cariogenic bacteria [J]. Anaerobe, 2012, 18(3): 369−372. DOI: 10.1016/j.anaerobe.2012.04.001
[6] BONNLANDER B, CAPPUCCIO R, LIVERANI F S, et al. Analysis of enantiomeric linalool ratio in green and roasted coffee [J]. Flavour and Fragrance Journal, 2006, 21(4): 637−641. DOI: 10.1002/ffj.1633
[7] CASABIANCA H, GRAFF J, FAUGIER V, et al. Enantiomeric distribution studies of linalool and linalyl acetate. A powerful tool for authenticity control of essential oils [J]. Hrc-journal of High Resolution Chromatography, 1998, 21(2): 107−112. DOI: 10.1002/(SICI)1521-4168(19980201)21:2<107::AID-JHRC107>3.0.CO;2-A
[8] CHEN X, YAUK Y, NIEUWENHUIZEN N J, et al. Characterisation of an (S)-linalool synthase from kiwifruit (Actinidia arguta) that catalyses the first committed step in the production of floral lilac compounds [J]. Functional Plant Biology, 2010, 37(3): 232−243. DOI: 10.1071/FP09179
[9] CROWELL A L, WILLIAMS D C, DAVIS E M, et al. Molecular cloning and characterization of a new linalool synthase [J]. Archives of Biochemistry and Biophysics, 2002, 405(1): 112−121. DOI: 10.1016/S0003-9861(02)00348-X
[10] 唐丽, 唐芳, 段经华, 等. 金桂芳樟醇合成酶基因的克隆与序列分析 [J]. 林业科学, 2009, 45(5):11−19. TANG L, TANG F, DUAN J H, et al. Cloning and sequence analysis of a homologous linalooi synthase gene involved in floral scents in Osmanthus fragrans var. thunbergii [J]. Scientia Silvae Sinicae, 2009, 45(5): 11−19.(in Chinese)
[11] 赵钟鑫, 王健, 李琴, 等. 阔叶薰衣草芳樟醇合成酶基因的克隆与表达载体构建 [J]. 植物研究, 2013, 33(3):308−316. ZHAO Z X, WANG J, LI Q, et al. Cloning a homologous linalool synthase gene of Lavandula latifolia and construction of plant expression vector [J]. Bulletin of Botanical Research, 2013, 33(3): 308−316.(in Chinese)
[12] 樊荣辉, 黄敏玲, 钟淮钦, 等. 小苍兰芳樟醇合酶基因的克隆及表达分析 [J]. 中国细胞生物学学报, 2016, 38(10):1185−1190. FAN R H, HUANG M L, ZHONG H Q, et al. Cloning and expression of linalool synthase gene in Freesia [J]. Chinese Journal of Cell Biology, 2016, 38(10): 1185−1190.(in Chinese)
[13] 刘偲, 席婉, 袁金梅, 等. 桂花‘莲籽丹桂’芳樟醇合酶基因OfTPS5的克隆及功能鉴定 [J]. 园艺学报, 2020, 47(2):310−320. LIU C, XI W, YUAN J M, et al. Molecular cloning and functional characterization of linalool synthase gene OfTPS5 in Osmanthus fragrans ‘Lianzi dangui' flowers [J]. Acta Horticulturae Sinica, 2020, 47(2): 310−320.(in Chinese)
[14] HO T, MURTHY H N, PARK S. Methyl jasmonate induced oxidative stress and accumulation of secondary metabolites in plant cell and organ cultures [J]. International Journal of Molecular Sciences, 2020, 21(3): 716. DOI: 10.3390/ijms21030716
[15] 韦荣昌, 覃芳, 唐美琼, 等. 茉莉酸甲酯对罗汉果SQS、CS和CAS基因表达的影响 [J]. 北方园艺, 2019(2):42−47. WEI R C, QIN F, TANG M Q, et al. Effect of methyl jasmonate on expression of SQS, CS and CAS genes in Siraitia grosvenorii [J]. Northern Horticulture, 2019(2): 42−47.(in Chinese)
[16] 王启, 刘广达, 苏蕾. 水杨酸和茉莉酸甲酯对微型月季萜类次生代谢产物相关基因表达的影响 [J]. 分子植物育种, 2020, 18(3):797−803. WANG Q, LIU G D, SU L. Effects of salicylic acid and methyl jasmonate on expression of terpenoid secondary metabolites related genes of miniature rose [J]. Molecular Plant Breeding, 2020, 18(3): 797−803.(in Chinese)
[17] 彭亮, 颜永刚, 陈莹, 等. 茉莉酸甲酯诱导下远志幼苗转录组分析及三萜类生物合成途径关键酶基因挖掘[J]. 中草药, 2020, 51(9): 2517-2529. PENG L, YAN Y G, CHEN Y, et al. Transcriptome analysis of Polygala tenuifolia seedlings induced by methyl jasmonate and key genes mining for triterpenoid biosynthetic pathway[J]. Chinese Traditional and Herbal Drugs, 2020, 51(9): 2517-2529. (in Chinese).
[18] 霍昕, 周建华, 刘文炜, 等. 铁皮石斛茎、叶挥发性成分研究 [J]. 天然产物研究与开发, 2010, 22(B08):43−45. HUO X, ZHOU J H, LIU W W, et al. Determination of chemical constituents of the volatile oil from stem and leaf of Dendrobium candidum Wall. Ex Lindl [J]. Natural Product Research and Development, 2010, 22(B08): 43−45.(in Chinese)
[19] 付涛, 王志龙, 林立, 等. GC-MS法比较铁皮石斛试管苗不同部位中挥发油的成分 [J]. 中成药, 2015, 37(10):2233−2238. FU T, WANG Z L, LIN L, et al. Comparison of volatile oils in different parts of Dendrobium officinale tube seedlings by GC-MS [J]. Chinese Traditional Patent Medicine, 2015, 37(10): 2233−2238.(in Chinese)
[20] 邹晖, 王伟英, 戴艺民, 等. GC-MS法比较分析铁皮石斛原球茎和花的挥发性成分 [J]. 福建农业科技, 2019(9):50−56. ZOU H, WANG W Y, DAI Y M, et al. Comparative analysis of volatile components of Dendrobium officinale protocorm and flower by GC-MS [J]. Fujian Agricultural Science and Technology, 2019(9): 50−56.(in Chinese)
[21] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0 [J]. Molecular Biology and Evolution, 2013, 30(12): 2725−2729. DOI: 10.1093/molbev/mst197
[22] PULIDO P, PERELLO C, RODRIGUEZ-CONCEPCION M. New insights into plant isoprenoid metabolism [J]. Molecular Plant, 2012, 5(5): 964−967. DOI: 10.1093/mp/sss088
[23] DUDAREVA N, KLEMPIEN A, MUHLEMANN J K, et al. Biosynthesis, function and metabolic engineering of plant volatile organic compounds [J]. The New Phytologist, 2013, 198(1): 16−32. DOI: 10.1111/nph.12145
[24] YUE Y C, YU R C, FAN Y P. Characterization of two monoterpene synthases involved in floral scent formation in Hedychium coronarium [J]. Planta, 2014, 240(4): 745−762. DOI: 10.1007/s00425-014-2127-x
[25] GREEN S A, CHEN X Y, NIEUWENHUIZEN N J, et al. Identification, functional characterization, and regulation of the enzyme responsible for floral (E)-nerolidol biosynthesis in kiwifruit (Actinidia chinensis) [J]. Journal of Experimental Botany, 2012, 63(5): 1951−1967. DOI: 10.1093/jxb/err393
[26] DUDAREVA N, CSEKE L, BLANC V M, et al. Evolution of floral scent in Clarkia: Novel patterns of S-linalool synthase gene expression in the C. breweri flower [J]. The Plant Cell, 1996, 8(7): 1137−1148.
[27] 张文娟, 曹小迎, 蒋继宏. 茉莉酸甲酯诱导大戟三萜类代谢的研究 [J]. 广西植物, 2015, 35(4):591−597. ZHANG W J, CAO X Y, JIANG J. Triterpene biosynthesis in Euphorbia pekinensis induced by methyl jasmonate [J]. Guihaia, 2015, 35(4): 591−597.(in Chinese)
-
期刊类型引用(3)
1. 李娜,胡斌,周希成,吴双,雷该翔. 绿茶型花椒叶茶加工技术研究. 食品安全质量检测学报. 2024(22): 155-162 .  百度学术
百度学术
2. 陈林,陈键,宋振硕,王丽丽,张应根,项丽慧,林清霞. 白茶风味品质形成与调控技术研究进展. 中国茶叶加工. 2023(04): 22-35 .  百度学术
百度学术
3. 郑淑琳,林洪竟,吴邦强,石玉涛. 不同冲泡方法对白牡丹茶饼主要品质成分溶释的影响. 现代农业科技. 2022(11): 171-174 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: