Cloning and Expressions of LIS in Dendrobium officinale
-
摘要:目的 克隆铁皮石斛(Dendrobium officinale)芳樟醇合酶(linalool synthase, LIS)基因,分析该基因在铁皮石斛开花期花、叶、茎和根中的表达及茉莉酸甲酯(Methyl Jasmonate, MeJA)诱导表达模式,以期为进一步鉴定其功能及分析铁皮石斛单萜类代谢机制奠定基础。方法 利用RACE-PCR和RT-PCR技术克隆DoLIS基因全长cDNA序列和开放阅读框(open reading frame, ORF),利用ProtParam和BLAST P在线软件进行理化性质分析和氨基酸同源性比对,采用MEGA 6.0构建系统进化树。利用qPCR方法分析DoLIS基因在开花期铁皮石斛花、叶、茎和根中的表达及MeJA处理后叶片中的表达模式。结果 DoLIS基因cDNA序列全长2 844 bp,含有1个2 538 bp的ORF,编码845个氨基酸。分子量为98.298 kD,理论等电点为7.04,不稳定系数是46.29,属不稳定蛋白。DoLIS蛋白具有Terpene_cyclase_plant_C1保守结构域。系统进化分析表明,DoLIS与其他物种的(S)-(+)-LIS聚在同一支,与姬蝴蝶兰(XP_020576697)的LIS亲缘关系最近。qPCR分析结果显示,DoLIS基因在铁皮石斛开花期叶片中的相对表达量最高,在MeJA处理后相对表达量呈先上升后下降的趋势,处理后5 h相对表达量达到最高,是诱导前的3.88倍。结论 本研究克隆了铁皮石斛DoLIS基因cDNA全长,该基因在叶片中的相对表达量极显著高于花、茎和根中的表达量。MeJA处理能显著诱导DoLIS基因的表达。Abstract:Objective Linalool synthase gene, LIS, of Dendrobium officinale was cloned. Expression patterns of the gene in flower, leaf, stem, and root at flowering stage as well as those in leaf induced by methyl jasmonate (MeJA) were determined to help decipher the monoterpene metabolism mechanism involved.Method Full-length cDNA of D. officinale LIS (DoLIS) was cloned using RACE-PCR and RT-PCR. Physiochemical properties and amino acid homology were analyzed by ProtParam and BLAST P, and phylogenetic tree constructed by MEGA 6.0. Expressions of DoLIS in the flowers, leaves, stems, and roots of D. officinale at flowering stage, as well as those in the MeJA-treated leaves were determined by quantitative real time PCR.Result The full-length of DoLIS was 2 844 bp with a 2 538 bp ORF encoding 845 amino acids. The protein had a molecular weight of 98.298 KD, a theoretical isoelectric point of 7.04, and an instability coefficient of 46.29. An unstable protein, DoLIS contained a conservative domain of Terpene_cyclase_plant_C1. The phylogenetic analysis showed that DoLIS was closely related to Phalaenopsis equestris (XP_02057697) and clustered in the same branch with the (s)-(+)-LIS of other species. The qPCR results on relative expression of DoLIS indicated that the highest level at flowering stage was found in the leaves. The MeJA induction produced the peak DoLIS expression, which was 3.88-fold of the original, in 5h after the treatment.Conclusion This study cloned the full-length cDNA of DoLIS and discovered the relative expression of the gene to be significantly higher in the leaves than the flowers, stems or roots of a D. officinale plant at the flowering stage. In addition, the expression could be upregulated by MeJA induction.
-
Keywords:
- Dendrobium officinale /
- linalool synthase /
- gene cloning /
- expression analysis /
- methyl jasmonate
-
0. 引言
【研究意义】芳樟醇,又称伽罗木醇、沉香油醇、沉香醇等,具有抗菌、镇静和杀虫等功效[1-5]。芳樟醇是一种单链状单萜醇,具有(R)-(−)-芳樟醇和(S)-(+)-芳樟醇2种对映异构体,两者气味有所差异[6]。不同植物两种对映异构体含有比例不同,薰衣草(Lavendula angustifolia)、依兰(Cananga odorata)、马鞭草(Verbena officinalis)等以(R)-(−)-芳樟醇为主,铃兰(Convalaria majalis)、迷迭香(Rosmarinus officinalis)和甜橙(Citrus sinensis)等以(S)-(+)-芳樟醇为主[7]。芳樟醇合成酶(linalool synthase, LIS)催化底物牻牛儿焦磷酸(GPP),转化成(R)-(−)-芳樟醇或(S)-(+)-芳樟醇[8]。【前人研究进展】目前,已经从柠檬薄荷(Mentha citrata)[9],金桂(Osmanthus fragrans)[10]、阔叶薰衣草(Lavandula latifolia)[11],小苍兰(Freesia)上[12]分离到芳樟醇合成酶基因。刘偲等[13]克隆了桂花(Osmanthus fragrans)‘莲籽丹桂’芳樟醇合酶基因OfTPS5,其表达量昼升夜降,在盛花期表达量最高。MeJA是与抗逆性相关的信号分子,通过信号转导激活或抑制植物次生代谢产物关键酶基因的表达,调控次生代谢产物的生物合成[14]。韦荣昌等[15]研究表明MeJA促进罗汉果甜苷V代谢途径关键酶基因SQS和CS的表达,抑制CAS的表达。王启等[16]等研究结果表明MeJA诱导微型月季特定萜类合成相关基因的表达。彭亮等[17]对MeJA处理后的远志幼苗进行转录组测序,获得与三萜合成相关的关键酶基因59条,其中AACT、MK、SE和β-AS等12个基因上调表达。【本研究切入点】铁皮石斛(Dendrobium officinale)是中国传统名贵中药材,霍昕[18]等在铁皮石斛茎和叶挥发油中都检测到芳樟醇,相对含量分别为1.738%和1.284%。付涛等[19]提取铁皮石斛试管苗不同部位挥发油,结果表明,芳樟醇占茎挥发油相对含量的0.77%,叶和根的挥发油没有芳樟醇。邹晖等[20]提取铁皮石斛原球茎和花的精油中都含有芳樟醇,相对含量分别为3.57%和1.21%。目前,未见铁皮石斛芳樟醇合酶基因的相关研究报道。【拟解决的关键问题】本课题组根据转录组测序获得的铁皮石斛芳樟醇合成酶带5′末端的cDNA序列设计3′RACE引物,采用RT-PCR技术克隆全长cDNA序列和ORF,分析芳樟醇合成酶基因在铁皮石斛开花期不同器官中的表达及茉莉酸甲酯(methyl jasmonate, MeJA)诱导表达模式,以期为进一步鉴定基因功能及分析铁皮石斛单萜类代谢机制奠定基础。
1. 材料与方法
1.1 试验材料和试剂
试验材料为冠豸山种源铁皮石斛,种植于福建省农业科学院亚热带农业研究所资源圃。取开花期铁皮石斛的花、叶、茎和根。用100 µg·mL−1茉莉酸甲酯(MeJA)喷雾铁皮石斛叶片,取喷雾后2、5、8 h的叶片。样品用液氮速冻后,−70 ℃保存。
Escherichia coli DH 5α由本实验室保存;SteadyPure植物RNA提取试剂盒和SYBR Green Pro Taq HS预混型qPCR试剂盒购自湖南艾科瑞生物工程有限公司;反转录试剂盒PrimeScriptTM Reverse Transcriptase和克隆载体pMD19-T购自宝日医生物技术有限公司;DiaSpin柱式质粒DNA小量抽提试剂盒、DNA胶回收试剂盒和San Taq PCR Mix预混液购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 总RNA提取和cDNA第1链合成
按照SteadyPure植物RNA提取试剂盒的操作说明书提取总RNA,参照PrimeScriptTM Reverse Transcriptase反转录试剂盒的操作说明,用随机引物逆转录合成cDNA第1链。取10 μL花、根、茎和叶的cDNA混合,用于全长cDNA和ORF的克隆。
1.2.2 DoLIS基因全长cDNA克隆
设计3′RACE引物3LIS-F1、3LIS-F2和3 ′adaptor引物dT-adapt、adapt(表1,下同)。以3LIS -F1和dT-adapt进行第一轮PCR,引物3LIS -F2和adapt进行巢式PCR,PCR程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸40 s,30个循环;72 ℃延伸10 min。PCR产物经回收、与pMD19-T连接后转化DH 5α感受态细胞,涂布于带氨苄霉素(Ampicillin)抗性平板后37 ℃培养过夜,挑取单克隆进行PCR鉴定,鉴定为阳性的克隆送去测序。引物合成和测序委托生工生物工程(上海)股份有限公司。
表 1 PCR引物及其序列Table 1. PCR primers and sequences引物名称
Primer name引物序列(5′-3′)
Primer sequence(5′-3′)3LIS-F1 CTCAACACAGAGTCAAGAAAGG 3LIS-F2 TCATTTGACTCGCCAACCGCAC dT-adapt CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTTT adapt CTGATCTAGAGGTACCGGATCC DoLIS-F CCGGAATTCATGGAGCAGTCATTGTGGTT DoLIS-R CCGCTCGAGCTTTCTCCCTTCATTTGCTC LIS-F TGGATCATTTGGAGCACAG LIS-R CATTTGGCTGCTTCCTTTC DoACT-F AGGAAGGCGGCTTTGAATC DoACT-R CCATGCCAACCATGACACC 注:下划线碱基为酶切位点。
Note: The underlined bases were the enzyme site.1.2.3 DoLIS基因ORF克隆
根据全长cDNA序列信息设计引物DoLIS-F(带EcoR I酶切位点)和DoLIS-R(带Xho I酶切位点),以2 μL混合的cDNA为模板,用引物DoLIS-F和DoLIS-R进行PCR扩增。PCR反应程序为:94 ℃预变性5 min,然后94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,30个循环,最后72 ℃延伸10 min。PCR产物经胶回收、克隆后测序。提取经DNAMAN V6.0比对正确的阳性克隆质粒pMD19-T-DoLIS,−20 ℃保存。
1.2.4 DoLIS基因生物信息学分析
利用ProtParam预测蛋白质产物的理化性质。通过NCBI的BLAST P在线比对,搜索氨基酸保守结构域和同源性较高的其他物种的氨基酸序列,采用MEGA 6.0(Neighbor Joining Tree, Bootstrap 1000)构建系统进化树[21]。
1.2.5 DoLIS基因表达分析
用超微量紫外可见光分光光度计(ND-1000)将铁皮石斛各样品cDNA第1链质量浓度定量为200 ng·μL−1。根据已经获得的DoLIS基因全长cDNA序列设计引物LIS-F和LIS-R,扩增长度为301 bp。以铁皮石斛Actin为内参基因,引物为DoACT-F和DoACT-R,产物长度为215 bp。根据SYBR Green Pro Taq HS预混型qPCR试剂盒的说明书进行实时荧光定量PCR扩增(Roche LightCycler 96)。反应体系20 μL:cDNA模板2 μL,SYBR Green Pro Taq HS 10 μL,上、下游引物各1 μL,ddH2O补至20 μL。反应程序:95 ℃预变性30 s;95 ℃变性10 s,61 ℃退火20 s,50个循环,每个处理设置3个生物学重复,3次技术性重复。
2. 结果与分析
2.1 DoLIS基因全长cDNA克隆
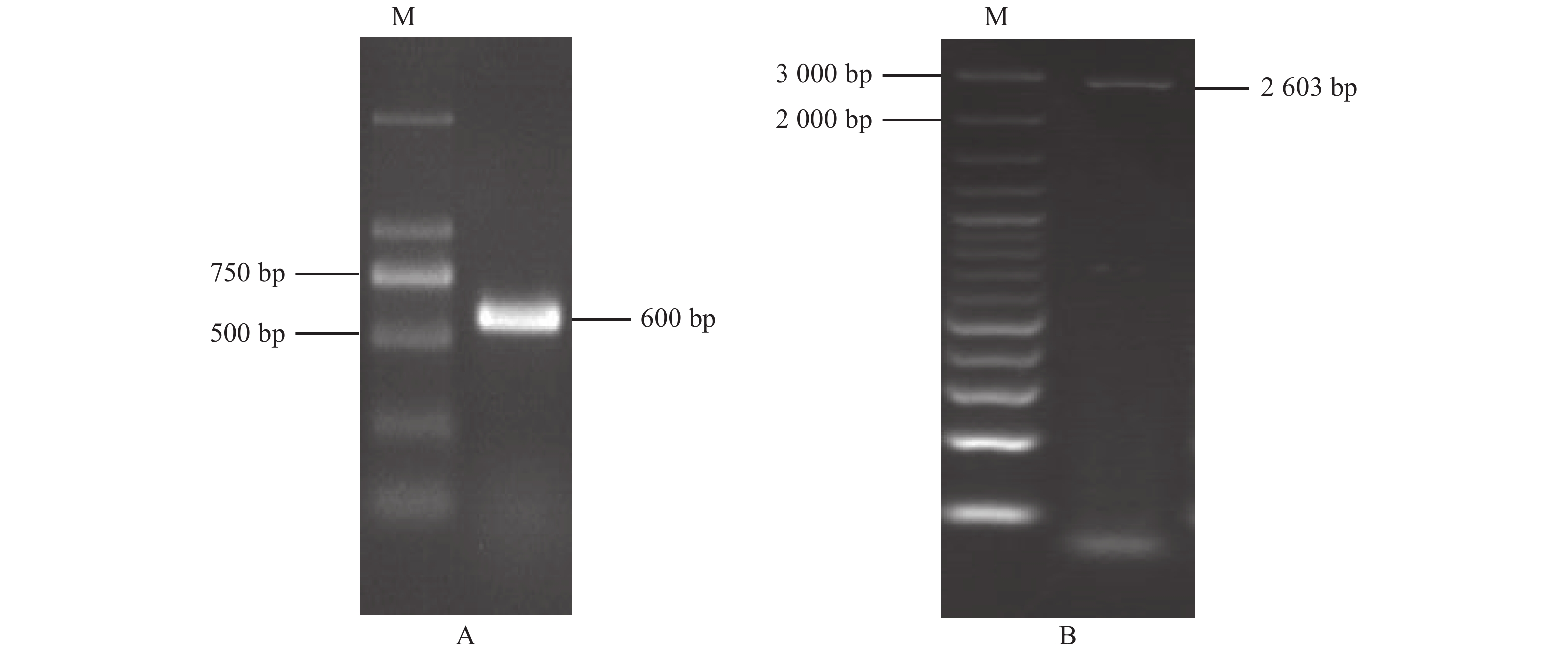
以铁皮石斛混合cDNA第1链为模板,经二轮的PCR扩增,获得1条约600 bp的清晰条带(图1-A),PCR产物经过克隆和测序,测序结果利用DNAMAN V6.0进行序列拼接,结果表明获得目的基因的3′末端,cDNA全长2 844 bp(图2),含有一个2 538 bp的ORF,编码845个氨基酸,5′末端非翻译区58 bp,3′末端非翻译区248 bp。
2.2 DoLIS基因ORF的克隆
以混合cDNA为模板,利用引物DoLIS-F和DoLIS-R进行PCR扩增,PCR产物电泳结果(图1-B)显示,在2 603 bp左右有1条亮带,大小与预测的DoLIS基因ORF一致。PCR产物经过克隆和测序,结果表明获得了带EcoR I和Xho I酶切位点的DoLIS基因ORF。提取质粒pMD19-T-DoLIS,−20 ℃保存,供进一步试验。
2.3 DoLIS的生物信息学分析
DoLIS蛋白的分子量为98.298 kD,带正电荷氨基酸(Arg、Lys)109个,带负电荷氨基酸(Asp、Glu)111个,理论等电点为7.04,不稳定系数是46.29,属不稳定蛋白。
使用BLAST P在线检索结果表明,DoLIS蛋白具有Terpene_cyclase_plant_C1保守结构域,E值为4.85×10−55,氨基酸序列与姬蝴蝶兰(Phalaenopsis equestris, XP_020576697)和非洲油棕(Elaeis guineensis, XP_019708546)的LIS氨基酸序列相似度分别为62%、46%。将DoLIS蛋白的氨基酸序列与其他13个物种的LIS氨基酸序列进行系统进化分析,结果(图3)表明,LIS分为(R)-(−)-LIS和(S)-(+)-LIS两大分支,铁皮石斛DoLIS与(S)-(+)-LIS聚在同一支,与姬蝴蝶兰(XP_020576697)的LIS亲缘关系最近,推测其属于(S)-(+)-LIS。
2.4 DoLIS基因在不同器官的表达
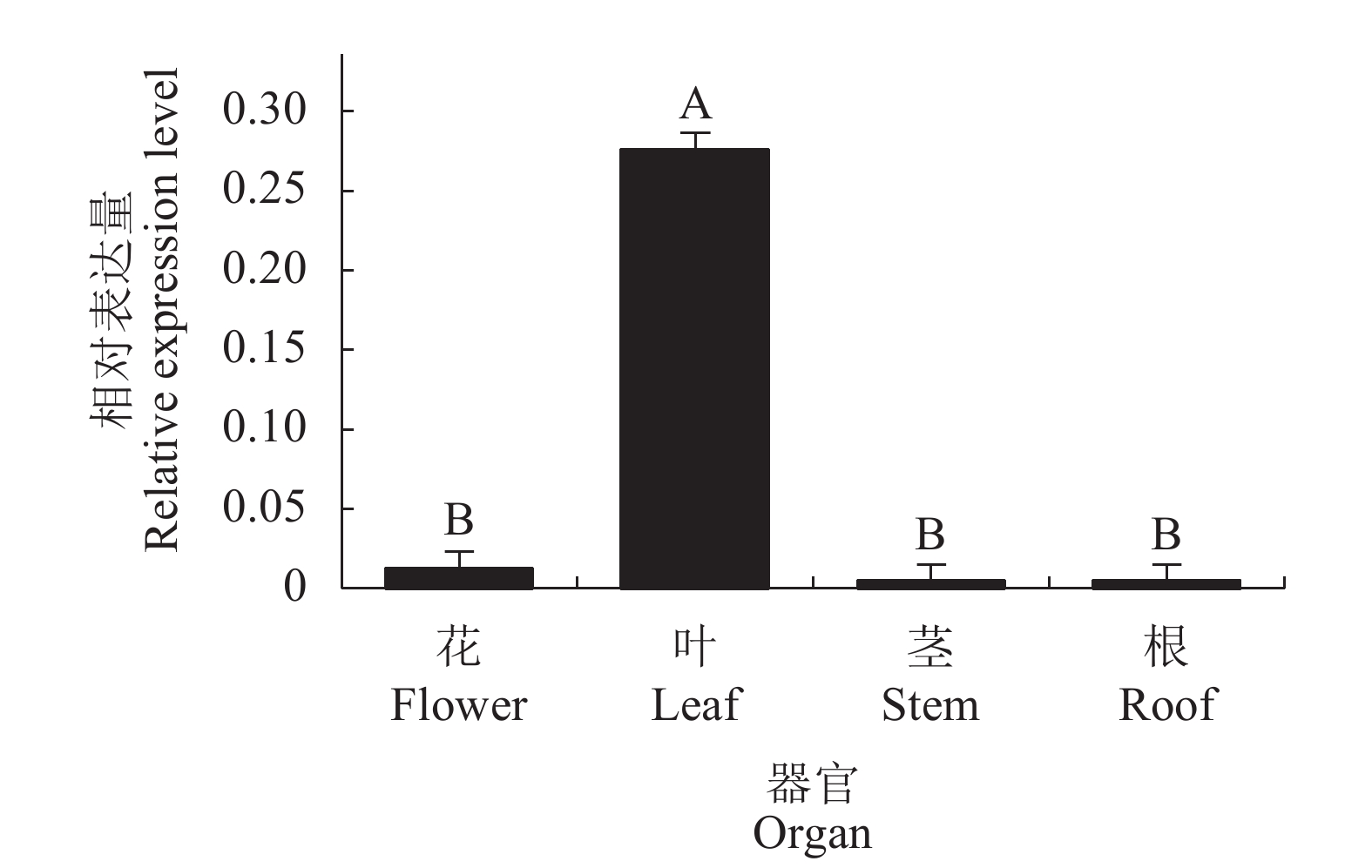
利用荧光定量PCR法检测铁皮石斛开花期的花、茎、叶和根中DoLIS基因的相对表达量,结果如图4所示,花、茎、叶和根中都能检测到DoLIS基因的表达,在叶片中的相对表达量最高,与花、茎和根的差异达到极显著,花、茎和根之间相对表达量差异不显著。
2.5 茉莉酸甲酯对DoLIS基因表达的影响
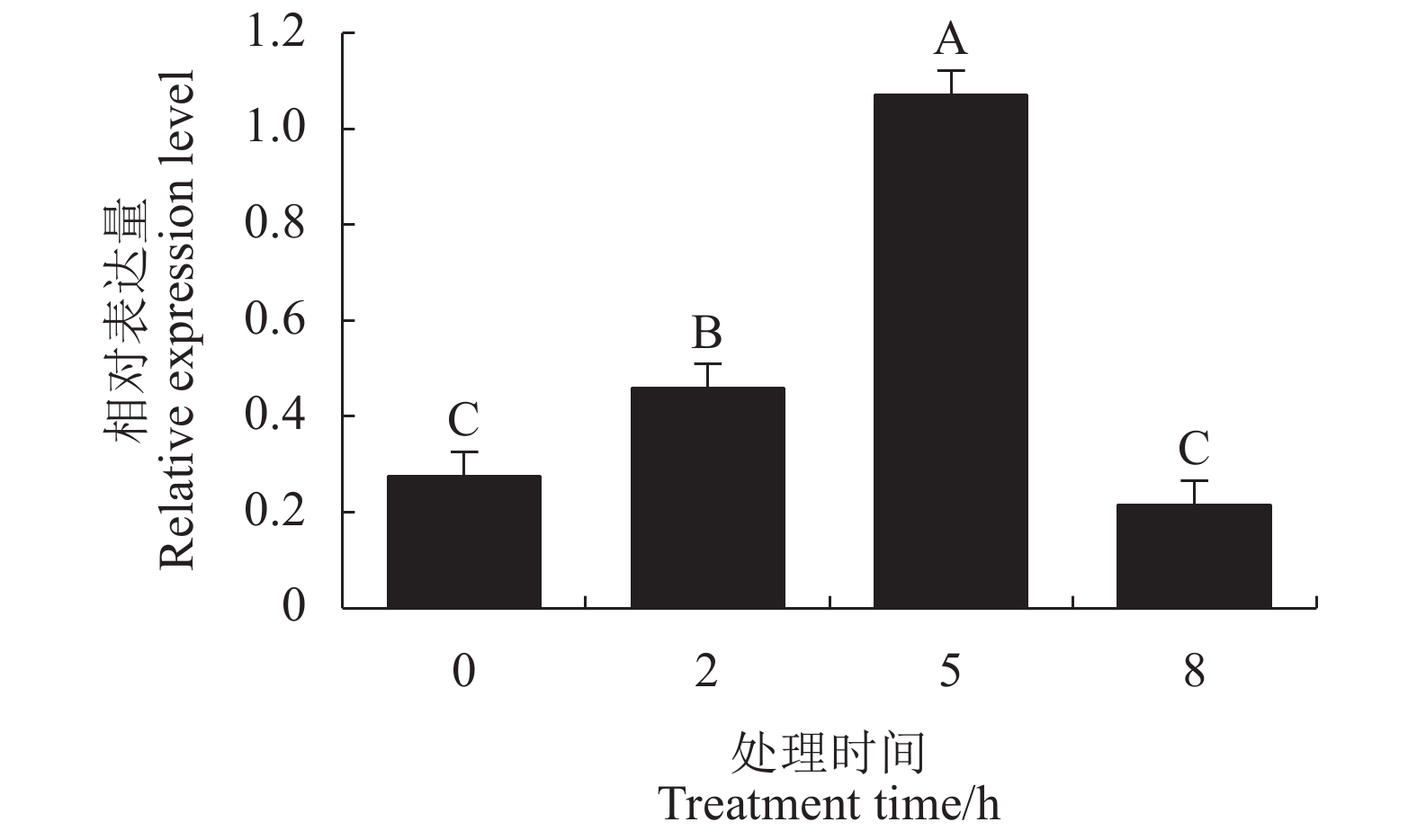
利用荧光定量PCR法检测铁皮石斛叶片经100 µg·mL−1 MeJA喷雾处理2 h、5 h、8 h后DoLIS基因的相对表达量,结果如图5所示,MeJA能诱导铁皮石斛DoLIS基因的表达,呈先上升后下降的趋势。DoLIS基因在MeJA处理后5 h的相对表达量达到最高,是诱导前的3.88倍,随后表达量开始下降,处理后8 h回落到正常水平。
3. 讨论与结论
芳樟醇主要通过甲基赤藓糖醇磷酸(Methylerythritol 4-phosphate, MEP)途径合成[22]。萜烯合酶是芳樟醇等单萜类物质合成的限速酶[23]。本研究克隆了铁皮石斛DoLIS基因,DoLIS蛋白具有Terpene_cyclase_plant_C1保守结构域,与其他物种的(S)-(+)-LIS聚在同一支,推测其属于(S)-(+)-LIS。萜烯合酶功能复杂,同一种酶可以催化相同底物形成多种产物,也可以催化不同底物形成不同产物。YUE等[24]克隆了2个姜花的萜烯合酶基因HcTPS7 and HcTPS8,HcTPS7催化GPP除了生成主要产物桧烯外,还可生成其他9种单萜副产物;HcTPS8催化GPP形成特异性产物芳樟醇,还可以催化法尼基二磷酸(FPP)合成α-香柑油烯,顺式-α-红没药烯,β-金合欢烯和其他10个倍半萜。GREEN等[25]克隆了猕猴桃萜烯合酶基因AcNES1,能够催化FPP和GPP形成倍半萜产物橙花叔醇和单萜产物芳樟醇。本研究克隆的DoLIS具有哪些催化活性还有待进一步的研究。
LIS是单萜类化合物芳樟醇合成限速酶。LIS基因在仙女扇、金桂的雌蕊、雄蕊和花瓣中都有表达,而叶片和花萼中不表达[10, 26]。小苍兰的花瓣、雌蕊、雄蕊和叶片都能检测到LIS基因的表达,花瓣中的表达量最高[12]。铁皮石斛DoLIS基因在根、茎、花和叶中都能检测到表达,叶片中的表达量最高。MeJA是植物次生代谢的重要信号分子,张文娟等[27]研究结果表明,MeJA可以上调三萜类代谢途径关键酶基因HMGR、SQS和FPS的表达,相应的总三萜含量也明显提高,但3个基因表达模式存在差异。本研究结果发现,MeJA能上调DoLIS基因在铁皮石斛叶中的表达,在100 µg·mL−1 MeJA处理后5 h的相对表达量达到最高,是诱导前的3.88倍。MeJA上调铁皮石斛DoLIS基因的表达是否促进铁皮石斛单萜类物质芳樟醇的积累有待进一步的分析。
-
表 1 PCR引物及其序列
Table 1 PCR primers and sequences
引物名称
Primer name引物序列(5′-3′)
Primer sequence(5′-3′)3LIS-F1 CTCAACACAGAGTCAAGAAAGG 3LIS-F2 TCATTTGACTCGCCAACCGCAC dT-adapt CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTTT adapt CTGATCTAGAGGTACCGGATCC DoLIS-F CCGGAATTCATGGAGCAGTCATTGTGGTT DoLIS-R CCGCTCGAGCTTTCTCCCTTCATTTGCTC LIS-F TGGATCATTTGGAGCACAG LIS-R CATTTGGCTGCTTCCTTTC DoACT-F AGGAAGGCGGCTTTGAATC DoACT-R CCATGCCAACCATGACACC 注:下划线碱基为酶切位点。
Note: The underlined bases were the enzyme site. -
[1] 姜冬梅, 朱源, 余江南, 等. 芳樟醇药理作用及制剂研究进展 [J]. 中国中药杂志, 2015, 40(18):3530−3533. JIANG D M, ZHU Y, YU J N, et al. Advances in research of pharmacological effects and formulation studies of linalool [J]. China Journal of Chinese Materia Medica, 2015, 40(18): 3530−3533.(in Chinese)
[2] 吴克刚, 赵欣欣, 段雪娟, 等. 芳樟醇气相抗菌活性与作用机制 [J]. 食品科学, 2020, 41(1):61−67. WU K G, ZHAO X X, DUAN X J, et al. Antibacterial activity and mechanism of action of vapor-phase linalool [J]. Food Science, 2020, 41(1): 61−67.(in Chinese)
[3] QUEIROGA C L, DUARTE M C T, RIBEIRO B B, et al. Linalool production from the leaves of Bursera aloexylon and its antimicrobial activity [J]. Fitoterapia, 2007, 78(4): 327−328. DOI: 10.1016/j.fitote.2007.03.012
[4] ALVIANO W S, MENDONÇA-FILHO R R, ALVIANO D S, et al. Antimicrobial activity of Croton cajucara Benth linalool-rich essential oil on artificial biofilms and planktonic microorganisms [J]. Oral Microbiology and Immunology, 2005, 20(2): 101−105. DOI: 10.1111/j.1399-302X.2004.00201.x
[5] PARK S N, LIM Y K, FREIRE M O, et al. Antimicrobial effect of linalool and α-terpineol against periodontopathic and cariogenic bacteria [J]. Anaerobe, 2012, 18(3): 369−372. DOI: 10.1016/j.anaerobe.2012.04.001
[6] BONNLANDER B, CAPPUCCIO R, LIVERANI F S, et al. Analysis of enantiomeric linalool ratio in green and roasted coffee [J]. Flavour and Fragrance Journal, 2006, 21(4): 637−641. DOI: 10.1002/ffj.1633
[7] CASABIANCA H, GRAFF J, FAUGIER V, et al. Enantiomeric distribution studies of linalool and linalyl acetate. A powerful tool for authenticity control of essential oils [J]. Hrc-journal of High Resolution Chromatography, 1998, 21(2): 107−112. DOI: 10.1002/(SICI)1521-4168(19980201)21:2<107::AID-JHRC107>3.0.CO;2-A
[8] CHEN X, YAUK Y, NIEUWENHUIZEN N J, et al. Characterisation of an (S)-linalool synthase from kiwifruit (Actinidia arguta) that catalyses the first committed step in the production of floral lilac compounds [J]. Functional Plant Biology, 2010, 37(3): 232−243. DOI: 10.1071/FP09179
[9] CROWELL A L, WILLIAMS D C, DAVIS E M, et al. Molecular cloning and characterization of a new linalool synthase [J]. Archives of Biochemistry and Biophysics, 2002, 405(1): 112−121. DOI: 10.1016/S0003-9861(02)00348-X
[10] 唐丽, 唐芳, 段经华, 等. 金桂芳樟醇合成酶基因的克隆与序列分析 [J]. 林业科学, 2009, 45(5):11−19. TANG L, TANG F, DUAN J H, et al. Cloning and sequence analysis of a homologous linalooi synthase gene involved in floral scents in Osmanthus fragrans var. thunbergii [J]. Scientia Silvae Sinicae, 2009, 45(5): 11−19.(in Chinese)
[11] 赵钟鑫, 王健, 李琴, 等. 阔叶薰衣草芳樟醇合成酶基因的克隆与表达载体构建 [J]. 植物研究, 2013, 33(3):308−316. ZHAO Z X, WANG J, LI Q, et al. Cloning a homologous linalool synthase gene of Lavandula latifolia and construction of plant expression vector [J]. Bulletin of Botanical Research, 2013, 33(3): 308−316.(in Chinese)
[12] 樊荣辉, 黄敏玲, 钟淮钦, 等. 小苍兰芳樟醇合酶基因的克隆及表达分析 [J]. 中国细胞生物学学报, 2016, 38(10):1185−1190. FAN R H, HUANG M L, ZHONG H Q, et al. Cloning and expression of linalool synthase gene in Freesia [J]. Chinese Journal of Cell Biology, 2016, 38(10): 1185−1190.(in Chinese)
[13] 刘偲, 席婉, 袁金梅, 等. 桂花‘莲籽丹桂’芳樟醇合酶基因OfTPS5的克隆及功能鉴定 [J]. 园艺学报, 2020, 47(2):310−320. LIU C, XI W, YUAN J M, et al. Molecular cloning and functional characterization of linalool synthase gene OfTPS5 in Osmanthus fragrans ‘Lianzi dangui' flowers [J]. Acta Horticulturae Sinica, 2020, 47(2): 310−320.(in Chinese)
[14] HO T, MURTHY H N, PARK S. Methyl jasmonate induced oxidative stress and accumulation of secondary metabolites in plant cell and organ cultures [J]. International Journal of Molecular Sciences, 2020, 21(3): 716. DOI: 10.3390/ijms21030716
[15] 韦荣昌, 覃芳, 唐美琼, 等. 茉莉酸甲酯对罗汉果SQS、CS和CAS基因表达的影响 [J]. 北方园艺, 2019(2):42−47. WEI R C, QIN F, TANG M Q, et al. Effect of methyl jasmonate on expression of SQS, CS and CAS genes in Siraitia grosvenorii [J]. Northern Horticulture, 2019(2): 42−47.(in Chinese)
[16] 王启, 刘广达, 苏蕾. 水杨酸和茉莉酸甲酯对微型月季萜类次生代谢产物相关基因表达的影响 [J]. 分子植物育种, 2020, 18(3):797−803. WANG Q, LIU G D, SU L. Effects of salicylic acid and methyl jasmonate on expression of terpenoid secondary metabolites related genes of miniature rose [J]. Molecular Plant Breeding, 2020, 18(3): 797−803.(in Chinese)
[17] 彭亮, 颜永刚, 陈莹, 等. 茉莉酸甲酯诱导下远志幼苗转录组分析及三萜类生物合成途径关键酶基因挖掘[J]. 中草药, 2020, 51(9): 2517-2529. PENG L, YAN Y G, CHEN Y, et al. Transcriptome analysis of Polygala tenuifolia seedlings induced by methyl jasmonate and key genes mining for triterpenoid biosynthetic pathway[J]. Chinese Traditional and Herbal Drugs, 2020, 51(9): 2517-2529. (in Chinese).
[18] 霍昕, 周建华, 刘文炜, 等. 铁皮石斛茎、叶挥发性成分研究 [J]. 天然产物研究与开发, 2010, 22(B08):43−45. HUO X, ZHOU J H, LIU W W, et al. Determination of chemical constituents of the volatile oil from stem and leaf of Dendrobium candidum Wall. Ex Lindl [J]. Natural Product Research and Development, 2010, 22(B08): 43−45.(in Chinese)
[19] 付涛, 王志龙, 林立, 等. GC-MS法比较铁皮石斛试管苗不同部位中挥发油的成分 [J]. 中成药, 2015, 37(10):2233−2238. FU T, WANG Z L, LIN L, et al. Comparison of volatile oils in different parts of Dendrobium officinale tube seedlings by GC-MS [J]. Chinese Traditional Patent Medicine, 2015, 37(10): 2233−2238.(in Chinese)
[20] 邹晖, 王伟英, 戴艺民, 等. GC-MS法比较分析铁皮石斛原球茎和花的挥发性成分 [J]. 福建农业科技, 2019(9):50−56. ZOU H, WANG W Y, DAI Y M, et al. Comparative analysis of volatile components of Dendrobium officinale protocorm and flower by GC-MS [J]. Fujian Agricultural Science and Technology, 2019(9): 50−56.(in Chinese)
[21] TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0 [J]. Molecular Biology and Evolution, 2013, 30(12): 2725−2729. DOI: 10.1093/molbev/mst197
[22] PULIDO P, PERELLO C, RODRIGUEZ-CONCEPCION M. New insights into plant isoprenoid metabolism [J]. Molecular Plant, 2012, 5(5): 964−967. DOI: 10.1093/mp/sss088
[23] DUDAREVA N, KLEMPIEN A, MUHLEMANN J K, et al. Biosynthesis, function and metabolic engineering of plant volatile organic compounds [J]. The New Phytologist, 2013, 198(1): 16−32. DOI: 10.1111/nph.12145
[24] YUE Y C, YU R C, FAN Y P. Characterization of two monoterpene synthases involved in floral scent formation in Hedychium coronarium [J]. Planta, 2014, 240(4): 745−762. DOI: 10.1007/s00425-014-2127-x
[25] GREEN S A, CHEN X Y, NIEUWENHUIZEN N J, et al. Identification, functional characterization, and regulation of the enzyme responsible for floral (E)-nerolidol biosynthesis in kiwifruit (Actinidia chinensis) [J]. Journal of Experimental Botany, 2012, 63(5): 1951−1967. DOI: 10.1093/jxb/err393
[26] DUDAREVA N, CSEKE L, BLANC V M, et al. Evolution of floral scent in Clarkia: Novel patterns of S-linalool synthase gene expression in the C. breweri flower [J]. The Plant Cell, 1996, 8(7): 1137−1148.
[27] 张文娟, 曹小迎, 蒋继宏. 茉莉酸甲酯诱导大戟三萜类代谢的研究 [J]. 广西植物, 2015, 35(4):591−597. ZHANG W J, CAO X Y, JIANG J. Triterpene biosynthesis in Euphorbia pekinensis induced by methyl jasmonate [J]. Guihaia, 2015, 35(4): 591−597.(in Chinese)
-
期刊类型引用(11)
1. 李小冬,于二汝,洪莉平,尚以顺,裴成江,罗近平,陈才俊. 玉米秸秆与金针菇菌糠不同混合比例对发酵全混合日粮营养品质和霉菌毒素含量的影响. 畜牧与饲料科学. 2024(02): 20-28+34 .  百度学术
百度学术
2. 韦带莲,李薇,王萍. 发酵平菇菌糠对羔羊生长性能、血清生化指标及瘤胃发酵参数的影响. 饲料研究. 2024(22): 17-21 .  百度学术
百度学术
3. 吕仁龙,程诚,张雨书,李茂,夏万良,周汉林. 不同水分、糖蜜添加对姬菇菌糠发酵品质及消化率的影响. 中国饲料. 2023(07): 103-108 .  百度学术
百度学术
4. 薄璇,佘波,刘瑞霞. 不同微生物二次发酵对香菇菌糠饲料的品质的影响. 中国饲料. 2023(12): 81-84 .  百度学术
百度学术
5. 袁国宏,张立东,段平平,许贵善. 食用菌菌糠作为反刍动物饲料的研究进展. 家畜生态学报. 2023(10): 1-8 .  百度学术
百度学术
6. 刘辉,季海峰,王四新,张董燕,王晶,张伟,王雅民. 复合乳酸菌发酵饲料对生长猪生长性能、粪便菌群、血清免疫和抗氧化指标的影响. 动物营养学报. 2022(02): 783-794 .  百度学术
百度学术
7. 沈城,马升,黄荫鸿,徐建雄. 固态发酵对金针菇菌糠饲用品质的影响. 饲料工业. 2022(03): 25-29 .  百度学术
百度学术
8. 王乐乐,秦荣艳,阿不夏合满·穆巴拉克,梁见弟,赵晨,王文奇,刘艳丰,张文举. 菌酶协同发酵香菇菌糠复合制剂的筛选研究. 饲料研究. 2022(17): 58-63 .  百度学术
百度学术
9. 张俊杰,李硕,崔筱,王楠,宋凯博,刘芹,孔维丽. 平菇发酵料不同发酵阶段功能菌的分离与鉴定. 河南农业科学. 2022(02): 113-119 .  百度学术
百度学术
10. 万里,冯宇哲,王磊,吴国芳,张晓卫. 微生物发酵饲料的研究进展及其应用. 饲料研究. 2021(13): 142-145 .  百度学术
百度学术
11. 齐伟彪,范阳,朱崇淼,金巍,毛胜勇. 金针菇菌渣发酵饲料制作的工艺优化. 畜牧与兽医. 2021(10): 30-34 .  百度学术
百度学术
其他类型引用(6)




 下载:
下载: