Microbial Population and Fertility of Rhizosphere Soils at Areas of Varied Tea-planting Years
-
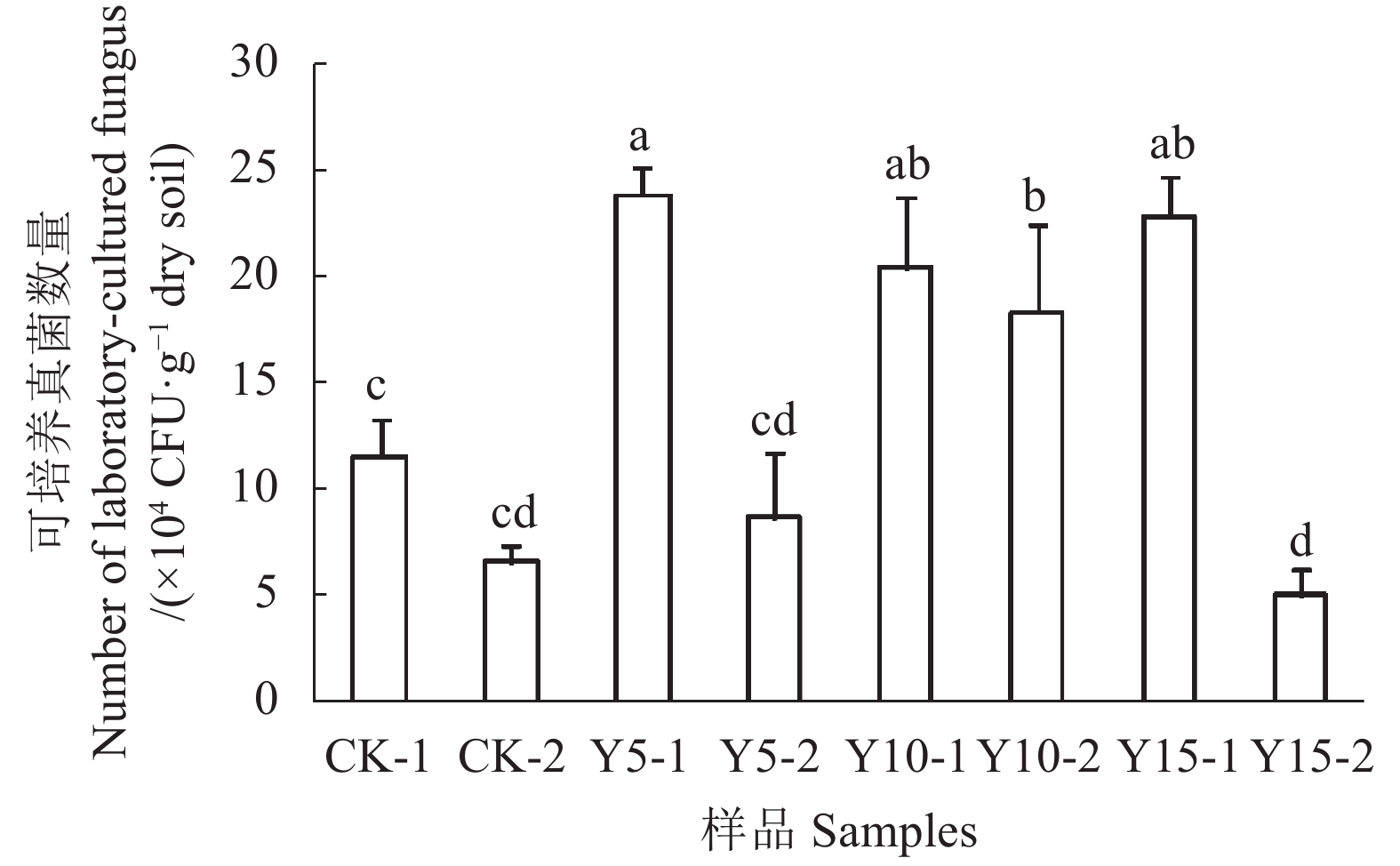
摘要:目的 了解不同种植年限茶树根际土壤微生物数量和肥力指标之间的相关性,为茶园土壤改良和稳定生产提供依据。方法 采用稀释平板法对武夷山茗上缘茶业有限公司试验茶园不同土层不同种植年限(5、10、15年)茶树根际土壤微生物数量进行研究,并与土壤肥力指标进行相关性分析。结果 可培养微生物数量随着土层加深而减少;10年生茶树根际土壤可培养细菌数量最大,不同种植年限茶树根际土壤的可培养真菌数量在不同土层表现出不一样的变化趋势。茶树根际土壤酸化严重,pH值为3.14~3.36;随着种植年限的增加,各项肥力指标的变化趋势不尽相同,0~15 cm土层的全磷和全钾含量随着种植年限的增加而降低,15~30 cm土层全氮和碱解氮的含量随着种植年限的增加而增加,其他的指标则在连续种植5年或10年的时候出现最高值或最低值。冗余分析发现,可培养细菌数量主要受速效钾和全磷含量的影响,可培养真菌数量主要受全氮和碱解氮含量的影响。结论 采样点不同种植年限茶树根际土壤微生物数量和部分肥力指标之间存在着相关性。Abstract:Objective Correlation between the microbial community and the nutrients in rhizosphere soils of varied years of tea-planting was studied to improve soil conditions and productivity at tea plantations.Method Microbial specimens collected from the rhizosphere soils at areas where tea bushes had been planted for 5, 10 and 15 years in Wuyishan city were cultured in the lab using standard dilution-plating method. A correlation analysis was conducted between the microbial count and soil fertility at corresponding sampling spots.Result The microbial population in soil layers decreased with the depth. The counts in different soil layers at areas of different planting ages did not show a consistent pattern. The 10-year-old planting area had the highest microbial count in the rhizosphere. Acidification of the rhizosphere soils was serious showing a pH ranging from 3.14 to 3.36. The fertility indices on soils of different planting ages differed. The contents of total P and total K in the 0−15 cm soil decreased with planting age, while those of total and available N in the 15−30 cm layer increased with years of planting. Other fertility indices either peaked or bottomed out when consecutively cultivated for 5 or 10-years. The redundancy analysis on the data revealed that the bacterial plate count was mainly affected by the contents of available K and total P in soil, while the fungal count by total and available N.Conclusion There was a significant correlation between the microbial population and fertility indices (e.g., available K, available P, total N, and available N ) in the rhizosphere soils of varying years of tea cultivation at the plantations.
-
Keywords:
- Tea plant /
- rhizosphere soil /
- microbial count /
- fertility /
- years of tea-planting
-
0. 引言
【研究意义】近年来,随着社会经济发展与人们生活水平提升,心血管疾病发病率呈逐年上升趋势,已严重威胁人类健康。动脉粥样硬化是心血管系统疾病中最常见的疾病之一,也是心血管疾病共同的病理基础[1]。积极预防和控制动脉粥样硬化是预防心血管疾病、降低疾病发病率的重要手段。【前人研究进展】病理学研究结果表明,VSMC增殖是早期动脉粥样硬化形成的始动环节之一,成为心血管疾病防治研究的重要靶细胞[2]。同时,有研究发现,活性氧自由基(reactive oxygen species, ROS)与VSMC增殖相关。血管紧张素II、高糖等通过提高VSMC胞内ROS水平促进细胞增殖[3-4]。抗氧化剂调控ROS介导信号通路抑制VSMC增殖[5-6]。因此,以ROS清除剂筛选VSMC增殖抑制剂成为研究方向之一。【本研究切入点】海带是我国东南沿海常见的经济型养殖海藻,具有药食同源性,在我国多部古代医学典籍中均有记载其药学功效。多糖是海带主要的药效学活性成分,动物学试验研究结果表明,海带多糖可有效降低试验性大鼠血管脂质沉积,降低动脉粥样硬化风险[7]。本课题组前期研究发现海带多糖具有清除超氧阴离子(O2·−)活性,且抑制碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)诱导VSMC增殖[8-9]。已有研究发现H2O2通过调控O2·−介导信号通路促进VSMC增殖[10-11]。但是海带多糖对VSMC增殖抑制活性与其抗氧化活性相关性研究未见相关报道。【拟解决的关键问题】因此,本课题以氧化剂H2O2为诱导剂建立VSMC体外增殖模型,研究海带多糖对氧化剂诱导VSMC增殖及胞内过氧化物生成影响,为阐明海带多糖对VSMC的作用机制奠定基础。
1. 材料与方法
1.1 原料
海带多糖由本实验室制备,多糖含量为87.2%[8];DMEM培养基购自Gibco公司;胎牛血清(FBS)购自杭州四季青;丙二醛(MDA)检测试剂盒购自碧云天公司;二甲基亚砜(DMSO)、H2O2购自Sigma公司;动物细胞裂解液购自上海生工;MTT购自Biosharp公司;其他试剂均为国产分析纯。
1.2 主要仪器设备
BCM-1000超净工作台,苏州净化设备有限公司;HERAcell 150i CO2恒温培养箱,美国Thermo公司;TGL-16M 冷冻离心机,湖南湘仪;P10-Y超纯水系统,科尔顿有限公司;M3 酶标分析仪,美国MD公司;TS-100F 倒置显微镜,日本尼康公司;UV-2600紫外-可见光分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 细胞培养
VSMC由本实验室制备。细胞培养及传代:VSMC采用含10% FBS的DMEM培养液,于37℃、5% CO2培养箱内静置培养。待细胞生长汇合后,吸弃培养瓶内培养液,PBS缓冲液清洗细胞瓶,加入适量0.25%胰酶,37℃放置3 min,倒置显微镜下观察,待细胞呈悬浮,即加入完全培养液终止酶解反应。吸管反复轻轻吹打培养液以分散细胞团,取0.5 mL细胞悬液接种于新的培养瓶内,补加新鲜的完全培养液至3 mL。置于37℃、5% CO2培养箱静置培养。
1.3.2 H2O2诱导VSMC增殖模型构建
取浓度为1×105 个·mL−1 VSMC悬液接种96孔板,37℃、5% CO2培养箱静置培养24 h,待细胞完全贴壁后,用无血清的DMEM培养液37℃孵育8 h。加入H2O2溶液于96孔板至终浓度为设定浓度,对照组用无血清DMEM代替H2O2。孵育至12 h、24 h、36 h后加入MTT溶液(100 μg ·孔−1),孵育4 h后,弃上清液,加入DMSO(200 µL·孔−1)。振荡混匀,于578 nm下检测吸光值。每个试验组设定6孔平行孔。细胞增殖率计算公式:
增值率/%=AiAo×100 (1) 式中:Ai为H2O2模型组吸光值;Ao为对照组吸光值。
1.3.3 MTT法测定VSMC增殖
取对数生长期细胞悬液(1×105 个·mL−1)接种于96孔培养板中,200 μL·孔−1,待细胞贴壁后更换无血清培养液,37℃、5% CO2培养箱内静置过夜培养。吸弃培养液,向96孔板内分别加入0.1、0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置6个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间,加入MTT溶液(100 μg·孔−1),孵育4 h后,弃上清液,加入DMSO(200 µL·孔−1)。振荡混匀,于578 nm下检测吸光值。细胞增殖抑制率计算公式:
抑制率/%=Ao−AiAo×100 (2) 式中:A0 为H2O2模型组的吸光值;Ai为海带多糖试验组吸光值。
1.3.4 VSMC形态观察
取对数生长期细胞悬液(1×105 cells·mL−1)接种于6孔培养板中,1 mL·孔−1,待细胞贴壁后更换无血清培养液,37℃、5% CO2培养箱内静置过夜培养。吸弃培养液,向6孔板内分别加入0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置3个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间后于倒置显微镜下观察细胞形态。
1.3.5 MDA含量测定
按1.3.4方法处理细胞,待细胞经无血清培养液过夜饥饿处理后吸弃培养液,向6孔板内分别加入0.1、0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置3个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间后收集细胞,按碧云天MDA检测试剂盒说明操作,于532 nm下测定吸光值,并计算MDA含量。
1.3.6 数据分析
数据均采用SPSS 17.0软件进行统计学处理,均数±标准差表示,并对结果进行LSD-t检验。
2. 结果与分析
2.1 H2O2 诱导VSMC体外增殖模型的建立
本课题以H2O2为诱导剂建立VSMC体外增殖模型,结果如表1所示。在相同的H2O2浓度下,24 h试验组VSMC增殖率均高于12 h和48 h试验组。而在H2O2相同作用时间下,VSMC增殖率均随着H2O2浓度的增加呈先上升而后下降的趋势。在H2O2浓度为10~100 µmol·L−1时,VSMC增殖率随着H2O2浓度增高而增大。当时间为24 h,H2O2浓度为50 µmol·L−1时,VSMC增殖率达到142.54%,再增加H2O2浓度至100 µmol·L−1,其VSMC增殖率略有增加,但与50 µmol·L−1试验组相比,差异并不显著。而当H2O2浓度增加至150 µmol·L−1,其VSMC增殖率则有所下降。可见当H2O2浓度增大至150 µmol·L−1对VSMC具有细胞毒性,这与文献[12]报道一致。因此,本课题选择H2O2诱导VSMC增殖处理浓度为50 µmol·L−1,作用时间为24 h。
表 1 MTT测定VSMC增殖率Table 1. Viability of VSMCs determined by MTT assayH2O2浓度
H2O2Concentration/
(µmol·L−1)12 h 24 h 36 h 10 102.11±5.22 112.23±3.15 108.74±4.42 20 112.08±2.15 127.65±1.55 117.24±5.68 50 129.56±2.43 a 142.54±2.91 a 133.25±3.48 a 100 132.87±3.56 a 144.29±3.68 a 138.62±2.84 a 150 107.23±5.27 114.87±4.35 96.48±2.57 注:a: 与相同作用时间下H2O2浓度为10 µmol·L−1试验组比,P<0.05。
Note: a: during the same pretreatment time, indicated significant differences compared with the group of 10 µmol·L−1 H2O2, P<0.05. 2.2 海带多糖对VSMC增殖作用的影响
采用MTT法测定海带多糖对VSMC增殖影响,结果见图1所示。从图1可以看出,海带多糖预处理时间相同时,随着海带多糖预处理质量浓度的增加VSMC增殖抑制率增大,呈量效相关性。在相同海带多糖预处理时间下,与海带多糖预处理质量浓度为0.1 mg·mL−1试验组相比,海带多糖预处理质量浓度为0.5 mg·mL−1和1.0 mg·mL−1试验组VSMC增殖抑制率均显著增高(P<0.05)。当海带多糖预处理时间为12 h时,质量浓度为1.0 mg·mL−1海带多糖预处理试验组VSMC增殖抑制率为53.11%,是相同多糖预处理时间下0.1 mg·mL−1海带多糖预处理试验组的5.72倍。由此可见,海带多糖可抑制氧化剂H2O2诱导VSMC增殖。
![]() 图 1 海带多糖对H2O2诱导VSMC增殖抑制率注:a: 相同海带多糖预处理时间下,与0.1 mg·mL−1海带多糖试验组相比,P<0.05;b:相同海带多糖预处理浓度下,与预处理时间12 h海带多糖试验组相比,P<0.05。Figure 1. Effects of L. japonica polysaccharides on H2O2-induced VSMC proliferationNote: a: during the same pretreatment time of polysaccharide, indicated significant differences compared with the group of 0.1 mg·mL−1 polysaccharide, P<0.05; b: under the same concentration of polysaccharide pretreatment, indicated significant differences compared with the group of 12 h treatment with polysaccharide, P<0.05.
图 1 海带多糖对H2O2诱导VSMC增殖抑制率注:a: 相同海带多糖预处理时间下,与0.1 mg·mL−1海带多糖试验组相比,P<0.05;b:相同海带多糖预处理浓度下,与预处理时间12 h海带多糖试验组相比,P<0.05。Figure 1. Effects of L. japonica polysaccharides on H2O2-induced VSMC proliferationNote: a: during the same pretreatment time of polysaccharide, indicated significant differences compared with the group of 0.1 mg·mL−1 polysaccharide, P<0.05; b: under the same concentration of polysaccharide pretreatment, indicated significant differences compared with the group of 12 h treatment with polysaccharide, P<0.05.同时,由图1可以看出,当海带多糖预处理质量浓度高于0.5 mg·mL−1时,与多糖预处理时间12 h试验组相比,多糖预处理时间为24 h和48 h试验组VSMC增殖抑制率均显著增高(P<0.05),增殖抑制率均达到60%。其中,当海带多糖预处理质量浓度为1.0 mg·mL−1时,多糖预处理时间为24 h试验组VSMC增殖抑制率最大,达73.56%。因此,后续试验选择海带多糖预处理时间为24 h。
2.3 海带多糖对VSMC形态影响
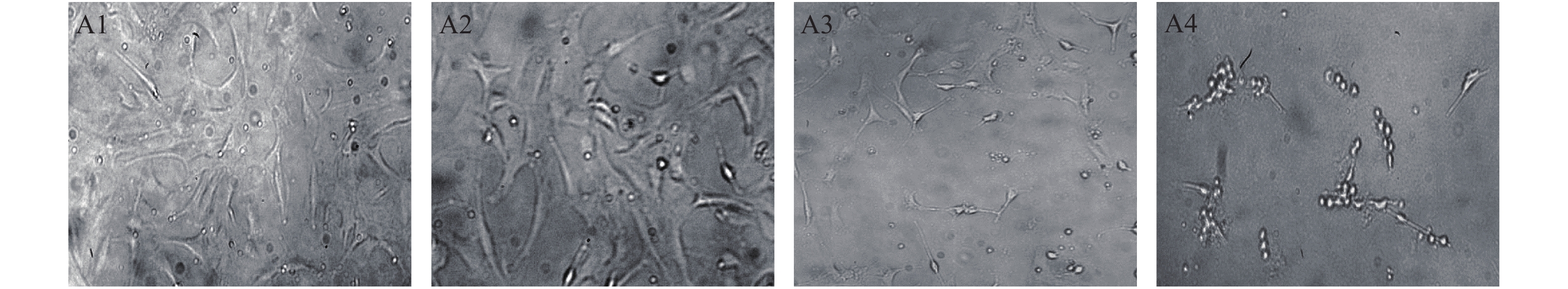
由图2可知,H2O2模型组细胞透光性强,细胞边缘模糊,细胞呈伸展的梭状,且细胞密度大。海带多糖预处理试验组VSMC形态则出现显著变化,0.5 mg·mL−1海带多糖预处理试验组VSMC数目减少,且细胞胞质回缩,部分细胞呈圆形。1 mg·mL−1海带多糖预处理试验组VSMC密度显著降低,细胞边缘清晰,细胞胞质回缩,镜下可见大部分细胞呈圆形。由此可见,海带多糖可引起VSMC生长形态改变,随着海带多糖预处理浓度的增高,VSMC数量显著减少,且呈圆形的VSMC数量增多,表明海带多糖预处理后VSMC形态发生显著变化,使其增殖速度减慢。
![]() 图 2 VSMC形态(×100)注:A1:对照组,A2 :H2O2模型组,A3 :0.5 mg·mL−1 海带多糖+H2O2处理组,A4:1 mg ·mL−1海带多糖+H2O2处理组。Figure 2. Morphology of VSMC (×100)Note: A1: Control group; A2: H2O2 model group; A3: the group treatment with 0.5 mg·mL−1 polysaccharide and H2O2; A4: the group treatment with 1 mg·mL−1 polysaccharide and H2O2.
图 2 VSMC形态(×100)注:A1:对照组,A2 :H2O2模型组,A3 :0.5 mg·mL−1 海带多糖+H2O2处理组,A4:1 mg ·mL−1海带多糖+H2O2处理组。Figure 2. Morphology of VSMC (×100)Note: A1: Control group; A2: H2O2 model group; A3: the group treatment with 0.5 mg·mL−1 polysaccharide and H2O2; A4: the group treatment with 1 mg·mL−1 polysaccharide and H2O2.2.4 海带多糖对H2O2诱导VSMC胞 内MDA生成的影响
研究发现,H2O2诱导VSMC胞内大量累积ROS可促进VSMC胞内一系列脂质过氧化产物的生成[13-14],进而诱导细胞释放生长因子促使VSMC增殖[15-16],因此脂质过氧化物是评估VSMC胞内ROS水平的重要参数。本课题以MDA表征胞内脂质过氧化物生成量,结果如表2所示。
表 2 VSMC胞内MDA生成量Table 2. MDA concentration in VSMC样品Samples 丙二醛MDA/(µmol·L−1) 对照组 Control 1.94±0.05 H2O2模型组
H2O2 Model Group3.21±0.09 a 0.1 mg·mL−1海带多糖+H2O2
0.1 mg·mL−1Laminaria japonica polysaccharide+H2O22.91±0.04 0.5 mg·mL−1海带多糖+H2O2
0.5mg·mL−1Laminaria japonica polysaccharide+H2O21.75±0.08 b 1.0 mg·mL−1 海带多糖+H2O2
1.0 mg·mL−1Laminaria japonica polysaccharide+H2O21.27±0.05 b 注:a:与对照组相比,P<0.01;b:与H2O2模型组相比,P< 0.01。
Note: a: indicated significant differences compared with the control group, P<0.01; b: indicated significant differences compared with the H2O2 model group, P<0.01.从表2中可以看出,与对照组相比,H2O2模型组MDA含量显著提高,达到3.21 µmol·L−1,表明H2O2诱导VSMC胞内生成大量脂质过氧化物,ROS水平显著提高,这是其诱导VSMC增殖的重要因素。而采用不同质量浓度海带多糖进行预处理后,其VSMC胞内MDA生成量均有下降。当海带多糖质量浓度达到1.0 mg·mL−1时,VSMC胞内MDA生成量最低,仅为1.27 µmol·L−1,与H2O2模型组相比下降了60.44%。由此可见,VSMC胞内脂质过氧化物生成量随着海带多糖预处理浓度的增加而降低,呈量效相关性,表明海带多糖预处理后有效抑制VSMC胞内因H2O2诱导引起的ROS升高,提示海带多糖对H2O2诱导VSMC增殖的抑制机制与调控VSMC胞内ROS水平相关。因此,后续试验可进一步从分子水平探讨海带多糖对VSMC胞内ROS的调控机制,阐明海带多糖对H2O2诱导VSMC增殖抑制机制。
3. 讨论与结论
病理学研究发现,血管平滑肌细胞异常增殖是动脉粥样硬化形成的始动环节,也是动脉粥样硬化心血管疾病共同的病理基础。研究发现抗动脉粥样硬化活性物质西洛他唑通过阻断VSMC胞内ERK1/2信号通路,抑制VSMC增殖[17]。Bin等对动脉粥样硬化形成分子机制研究发现,动脉粥样硬化重要诱因氧化低密度脂蛋白(ox-LDL)诱导VSMC胞内转录因子KLF5表达,进而上调胞内微小RNA-29a表达水平,最终促进VSMC增殖而形成动脉粥样硬化斑块[18]。细胞学研究发现,ROS水平增高激活VSMC胞内MAPK信号通路并促进VSMC增殖[19]。Yang等研究结果表明高糖处理引起细胞ROS水平增高是其诱导VSMC增殖的主要因素[4]。因此,胞内ROS水平增高是VSMC增殖的促进因子。
天然产物活性研究结果表明,海藻多糖具有显著抗氧化活性,可有效降低胞内ROS水平。马军等研究发现海藻多糖具有自由基清除和抗脂质过氧化活性[20]。杨运高等用大鼠红细胞免疫功能缺陷模型研究海藻多糖对红细胞免疫功能及自由基损伤的影响。试验结果显示,海藻多糖增强超氧化物歧化酶、谷胱甘肽等还原性物质活性,并降低MDA含量,表明海藻多糖可降低大鼠体内ROS水平,是抗氧化剂的重要备选资源[21]。海带多糖是一种抗氧化活性显著的海藻多糖,其对DPPH、羟自由基、超氧阴离子等自由基的清除活性显著[22]。张晴岚等研究发现海带多糖可改善大鼠血脂水平,提高一氧化氮浓度和一氧化氮合酶活性,抑制动脉粥样硬化斑块发生和发展[23]。本课题以H2O2为诱导剂建立VSMC增殖模型,评估海带多糖作用下动脉粥样硬化始动因子VSMC生长与脂质过氧化水平的相关性。结果表明,海带多糖可抑制H2O2诱导VSMC增殖且呈量效相关性。而海带多糖浓度与VSMC胞内MDA含量呈负相关性,可见海带多糖缓解了VSMC胞内因H2O2诱导引起的ROS水平增高,表明海带多糖抑制VSMC增殖与其抗氧化活性相关。因此,后续研究需进一步从ROS调控细胞增殖的MAPK通路上进一步探讨海带多糖对VSMC增殖的抑制机制,为深度开发海带药用价值奠定基础。
-
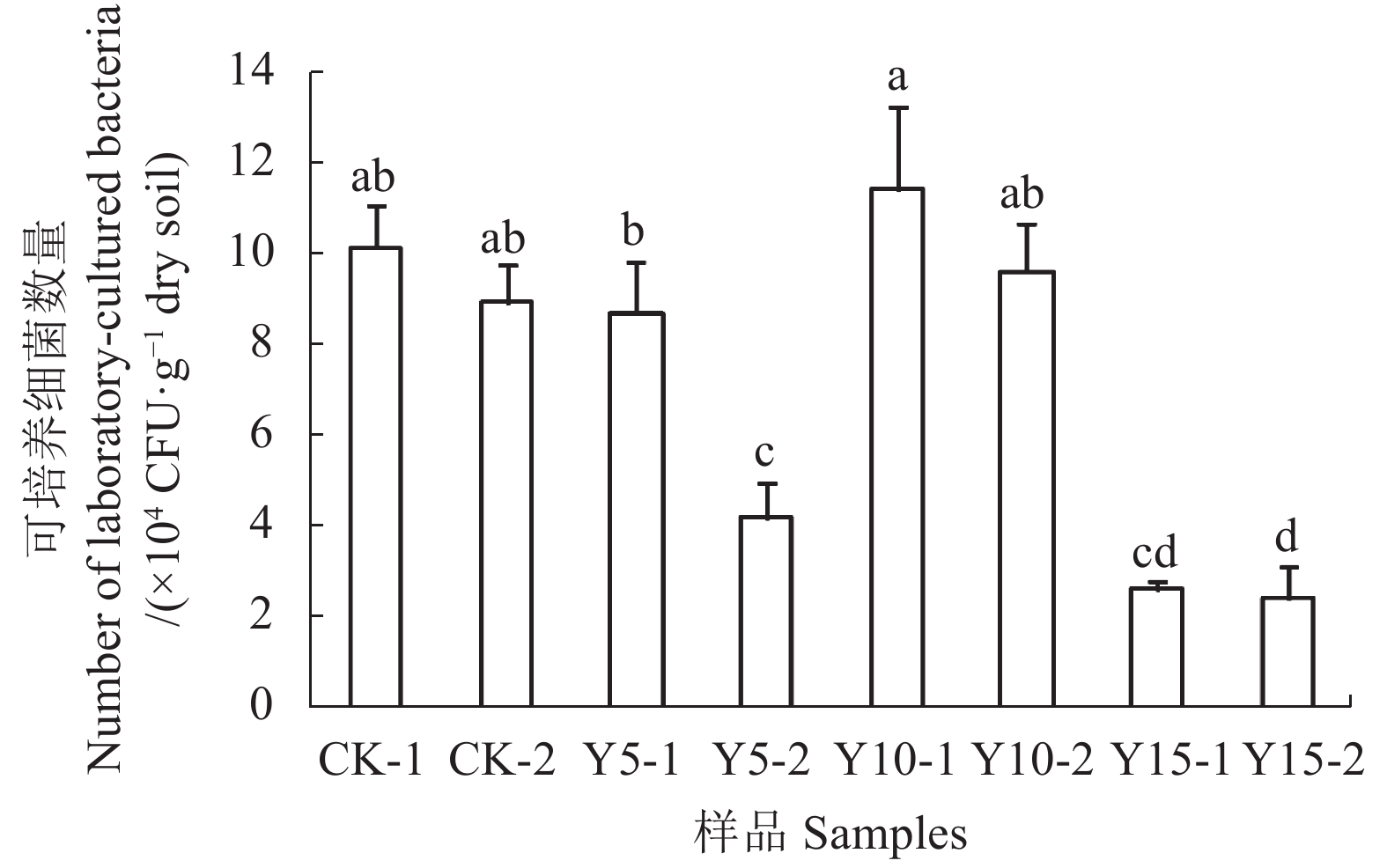
图 1 不同种植年限茶树根际土壤的可培养细菌数量变化
注:图中样品名称后面的“-1”和“-2”表示不同采样深度的土壤样品。“-1”代表采样深度为0~15 cm的土壤样品;“-2”代表采样深度为15~30 cm的土壤样品。图中不同小写字母表示样品间差异显著( P <0.05)。下同。
Figure 1. Bacterial plate count of soil specimens from areas of different tea-planting years
Note: The "-1" and "-2" following the sample name indicate soil samples with different sampling depths. “-1” means the soil sampling depth is from 0 to 15 cm; “-2” means the soil sampling depth is from 15 to 30 cm. Different lowercases in the picture indicate significant difference at 0.05 level among different samples. The same below.
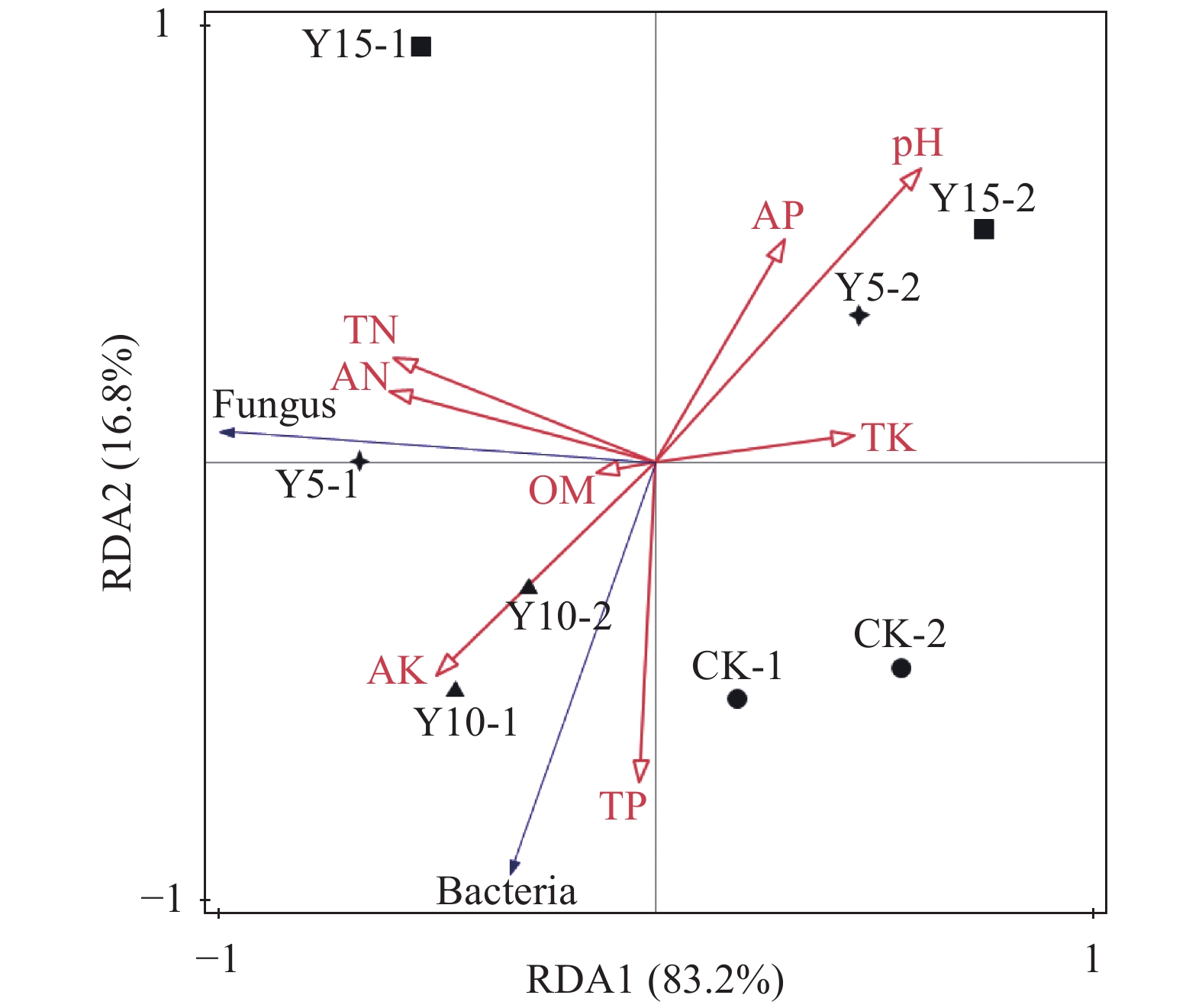
图 3 不同种植年限茶树根际土壤的可培养微生物数量与肥力指标的冗余分析
注:图中Bacteria代表可培养细菌数量,Fungus代表可培养真菌数量,TN、TP和TK分别代表总氮、总磷和总钾,AN、AP和AK分别代表碱解氮、速效磷和速效钾,OM代表有机质,pH即pH值。
Figure 3. RDA analysis on microbial counts and fertility indices in soils from areas of different tea-planting years
Note: Bacteria means number of laboratory-cultured bacteria; Fungus means number of laboratory-cultured fungus; TN, TP and TK mean total nitrogen, total phosphorus and total potassium respectively; AN, AP and AK mean available nitrogen, available phosphorus and available potassium respectively; OM means organic matter; and pH means the value of pH.
表 1 不同种植年限茶树根际土壤理化性质
Table 1 Physiochemical properties of soils from areas of different tea-planting years
样品
samples全氮 Total
N/(g·kg−1)全磷 Total
P/(g·kg−1)全钾 Total
K/(g·kg−1)碱解氮 Available
N/(mg·kg−1)速效磷 Available
P/(mg·kg−1)速效钾 Available
K/(mg·kg−1)有机质 Organic
matter/(g·kg−1)pH CK-1 1.30±0.00 c 0.98±0.01 a 20.64±0.15 b 104.16±0.95 b 60.00±4.04 ab 102.96±0.44 d 26.15±0.40 b 3.21±0.00 d CK-2 0.69±0.01 f 0.82±0.05 bc 15.20±0.35 c 84.17±0.24 d 57.25±0.62 bc 85.94±1.20 de 25.37±1.16 bc 3.30±0.00 b Y5-1 1.40±0.00 a 0.84±0.03 b 14.03±0.09 d 102.98±0.24 bc 50.50±1.32 d 149.70±7.68 c 30.00±0.00 a 3.25±0.01 c Y5-2 0.88±0.04 e 0.61±0.02 d 33.07±0.18 a 85.18±1.66 d 58.17±0.97 abc 145.11±4.42 c 20.31±0.44 d 3.35±0.00 a Y10-1 1.31±0.01 c 0.74±0.05 c 12.25±0.13 g 110.38±0.24 a 52.67±0.33 cd 273.15±22.48 a 18.34±0.00 e 3.14±0.00 e Y10-2 1.12±0.00 d 0.65±0.03 d 12.67±0.00 f 101.47±0.48 c 56.47±0.48 bcd 222.57±0.00 b 28.82±1.55 a 3.14±0.01 e Y15-1 1.35±0.00 b 0.59±0.00 d 12.20±0.10 g 110.04±1.19 a 63.99±6.09 a 79.16±3.22 e 24.14±0.00 c 3.30±0.00 b Y15-2 1.29±0.00 c 0.62±0.03 d 13.65±0.06 e 104.66±0.24 b 58.04±0.16 abc 77.87±0.00 e 25.77±0.75 bc 3.36±0.01 a 注:表中同列不同小写字母表示样品间在P<0.05水平上差异显著。
Note: Different lowercases in the same column indicate significant difference at 0.05 level among different samples.表 2 茶园土壤肥力评价标准
Table 2 Evaluation standards on soil fertility at tea plantations
划分等级
Classification评价指标 Evaluation indexes 全氮 Total
N/(g·kg−1)全磷 Total
P/(g·kg−1)全钾 Total
K/(g·kg−1)碱解氮 Available
N/(mg·kg−1)速效磷 Available
P/(mg·kg−1)速效钾 Available
K/(mg·kg−1)有机质 Organic
matter/(g·kg−1)pH Ⅰ级 >1.0 >0.6 >10 >100 >10 >120 >15 <4.5 Ⅱ级 0.8~1.0 0.4~0.6 5~10 50~100 5~10 80~120 10~15 4.5~5.5 Ⅲ级 <0.8 <0.4 <5 <50 <5 <80 <10 >5.5 表 3 不同种植年限茶树根际土壤肥力情况
Table 3 Fertility of soils from areas of different tea-planting years
样品 Samples 全氮 Total N 全磷Total P 全钾 Total K 碱解氮 Available N 速效磷 Available P 速效钾 Available K 有机质 Organic matter pH CK-1 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅱ级 Ⅰ级 Ⅰ级 CK-2 Ⅲ级 Ⅰ级 Ⅰ级 Ⅱ级 Ⅰ级 Ⅱ级 Ⅰ级 Ⅰ级 Y5-1 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Y5-2 Ⅱ级 Ⅰ级 Ⅰ级 Ⅱ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Y10-1 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Y10-2 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Y15-1 Ⅰ级 Ⅱ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅲ级 Ⅰ级 Ⅰ级 Y15-2 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅰ级 Ⅲ级 Ⅰ级 Ⅰ级 -
[1] 林生, 庄家强, 陈婷, 等. 不同年限茶树根际土壤微生物群落PLFA生物标记多样性分析 [J]. 生态学杂志, 2013, 32(1):64−71. LIN S, ZHUANG J Q, CHEN T, et al. Microbial diversity in rhizosphere soils of different planting year tea trees: An analysis with phospholipid fatty acid biomarkers [J]. Chinese Journal of Ecology, 2013, 32(1): 64−71.(in Chinese)
[2] COLEMAN D C, CROSSLEY D A, HENDRIX P F. Fundamentals of Soil Ecology[M]. London: Academic Press, 1996: 48-77.
[3] LOVELL R D, JARVIS S C, BARDGETT R D. Soil microbial biomass and activity in long-term grassland: effects of management changes [J]. Soil Biology and Biochemistry, 1995, 27(7): 969−975. DOI: 10.1016/0038-0717(94)00241-R
[4] STEENWERTH K L, JACKSON L E, CALDERÓN F J, et a1. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California [J]. Soil Biology and Biochemistry, 2002, 34(11): 1599−1611. DOI: 10.1016/S0038-0717(02)00144-X
[5] 李俊强, 林利华, 张帆, 等. 施肥模式对茶树根际土壤微生物数量及酶活性的影响 [J]. 水土保持研究, 2019, 26(3):22−28. LI J Q, LIN L H, ZHANG F, et al. Effect of fertilization regime on soil microbial quantity and enzyme activity in rhizosphere of tea [J]. Research of Soil and Water Conservation, 2019, 26(3): 22−28.(in Chinese)
[6] 王秀青, 李永梅, 谢瑾, 等. 古茶园和现代茶园土壤养分与微生物数量的研究 [J]. 西南大学学报(自然科学版), 2015, 37(10):43−50. WANG X Q, LI Y M, XIE J, et al. Study on soil nutrients and quantity of microbial community of ancient tea arboretums and modern tea gardens [J]. Journal of Southwest University (Natural Science Edition), 2015, 37(10): 43−50.(in Chinese)
[7] 林生, 庄家强, 陈婷等. 福建安溪不同年限茶树土壤养分与微生物Biolog功能多样性的差异分析 [J]. 中国生态农业学报, 2012, 20(11):1471−1477. LIN S, ZHUANG J Q, CHEN T, et al. Analysis of nutrient and microbial Biolog function diversity in tea soils with different planting years in Fujian Anxi [J]. Chinese Journal of Eco-Agriculture, 2012, 20(11): 1471−1477.(in Chinese)
[8] 李灵, 张玉, 卢晓燕, 等. 武夷山市茶园土壤有机质的空间分布特征 [J]. 长江大学学报(自然科学版), 2019, 16(11):60−65. LI L, ZHANG Y, LU X Y, et al. Spatial Distribution of Soil Organic Matter in Tea Gardens of Wuyishan City [J]. Journal of Yangtze University (Natural Science Edition), 2019, 16(11): 60−65.(in Chinese)
[9] 吴志丹, 江福英, 尤志明, 等. 亚热带茶园土壤酸度特征研究-以福建省武夷山市为例 [J]. 中国环境科学, 2016, 36(1):181−189. DOI: 10.3969/j.issn.1000-6923.2016.01.030 WU Z D, JIANG F Y, YOU Z M, et al. Acidic characteristics of subtropical tea garden soil: A case study in Wuyishan city, Fujian province, Southeast China [J]. China Environmental Science, 2016, 36(1): 181−189.(in Chinese) DOI: 10.3969/j.issn.1000-6923.2016.01.030
[10] 陈玉真, 王峰, 吴志丹, 等. 武夷山市5种类型茶园土壤重金属剖面分布特征 [J]. 茶叶学报, 2015, 56(3):159−164. DOI: 10.3969/j.issn.1007-4872.2015.03.006 CHEN Y Z, WANG F, WU Z D, et al. Vertical distribution of heavy metals in five types of soils from tea plantations at Wuyishan [J]. Acta Tea Sinica, 2015, 56(3): 159−164.(in Chinese) DOI: 10.3969/j.issn.1007-4872.2015.03.006
[11] 李渝, 刘彦伶, 黄兴成, 等. 贵州不同茶区土壤养分及微生物量分析评价 [J]. 灌溉排水学报, 2018, 37(8):98−105. LI Y, LIU Y L, HUANG X C, et al. Assessing soil nutrient and microbial biomass in tea plantation regions of Guizhou Province [J]. Journal of Irrigation and Drainage, 2018, 37(8): 98−105.(in Chinese)
[12] 王海斌, 陈晓婷, 丁力, 等. 福建省安溪县茶园土壤酸化对茶树产量及品质的影响 [J]. 应用与环境生物学报, 2018, 24(6):1398−1403. WANG H B, CHEN X T, DING L, et al. Effect of soil acidification on yield and quality of tea tree in tea plantations from Anxi county, Fujian Province [J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(6): 1398−1403.(in Chinese)
[13] 李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008: 90-92. [14] 国家林业局. 森林土壤pH值的测定: LY/T 1239-1999[S]. 北京: 中国标准出版社, 1999. [15] 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2005: 30-86, 106-163. BAO S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2005: 30-86, 106-163. (in Chinese)
[16] 中华人民共和国农业部. 茶叶产地环境技术条件: NY/T853-2004[S]. 北京: 中国农业出版社, 2005. [17] 尹杰. 高产优质茶园施肥原理与技术应用 [J]. 耕作与栽培, 2007(6):52−54. DOI: 10.3969/j.issn.1008-2239.2007.06.025 YIN J. Fertilization principle and technology application in high yield and high quality tea garden [J]. Tillage and Cultivation, 2007(6): 52−54.(in Chinese) DOI: 10.3969/j.issn.1008-2239.2007.06.025
[18] 周才碧, 陈文品. 茶园土壤微生物的研究进展 [J]. 中国茶叶, 2014, 36(3):14−15. DOI: 10.3969/j.issn.1000-3150.2014.03.005 ZHOU C B, CHEN W P. Research progress of soil microorganism in tea garden [J]. China Tea, 2014, 36(3): 14−15.(in Chinese) DOI: 10.3969/j.issn.1000-3150.2014.03.005
[19] 张仕颖, 张乃明, 王瑾. 不同种植年限葡萄根际微生物区系及其与肥力因子的相关分析 [J]. 云南农业大学学报(自然科学版), 2015, 30(1):101−106. ZHANG S Y, ZHANG N M, WANG J. Soil microbial community of vineyard with different planting years and correlation analysis with fertility factors [J]. Journal of Yunnan Agricultural University(Natural Science Edition), 2015, 30(1): 101−106.(in Chinese)
[20] 王世强, 胡长玉, 程东华, 等. 调节茶园土壤pH对其土著微生物区系及生理群的影响 [J]. 土壤, 2011, 43(1):76−80. WANG S Q, HU C Y, CHENG D H, et al. Effects of adjusting pH of tea plantation soil on indigenous microbial fauna and physiological group [J]. Soils, 2011, 43(1): 76−80.(in Chinese)
-
期刊类型引用(0)
其他类型引用(2)




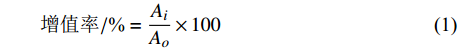
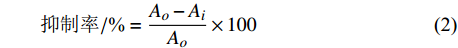
 下载:
下载: