Effects of Starvation and Starting Forages on Growth of Mastacembelue armatus Larvae
-
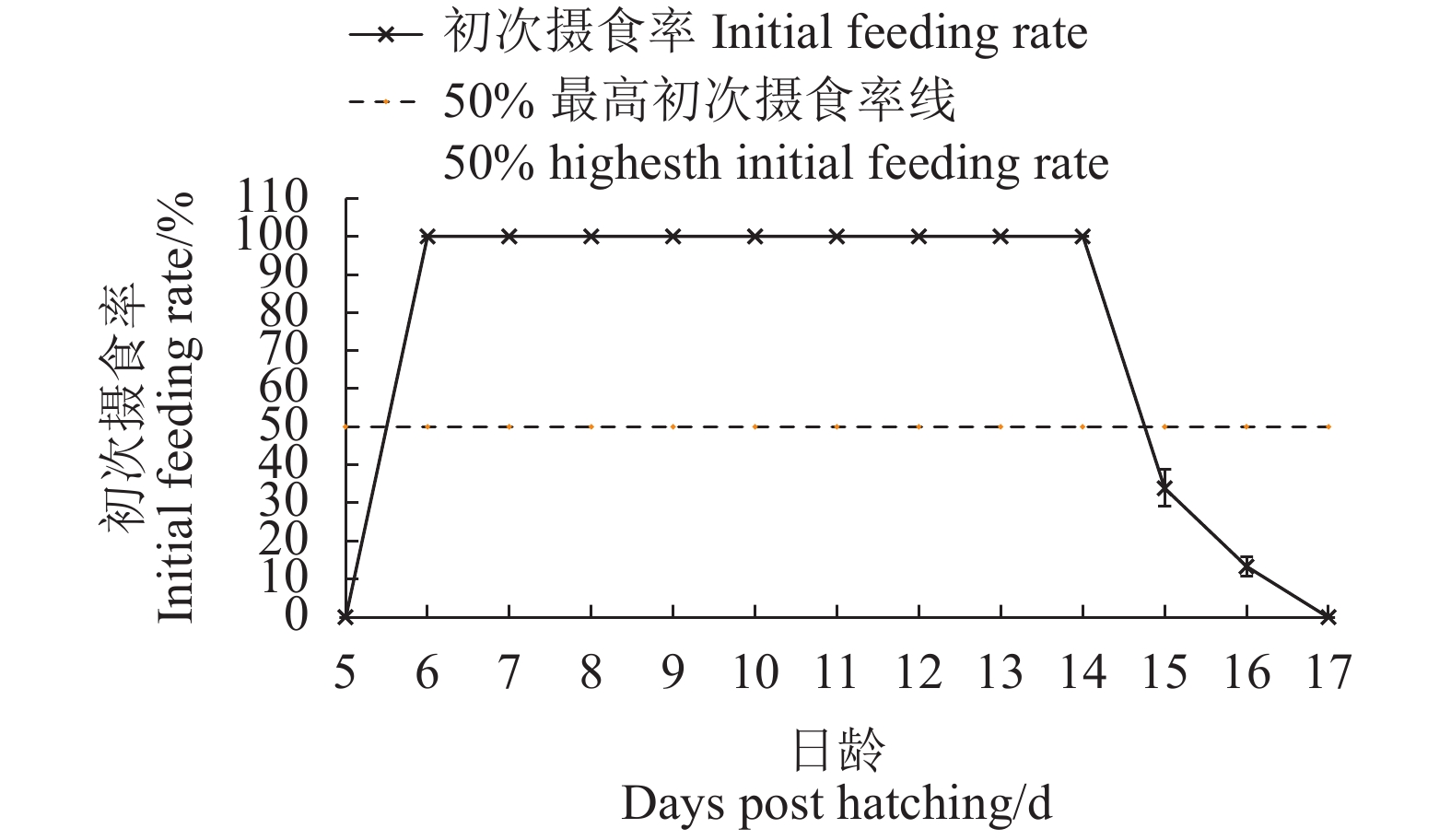
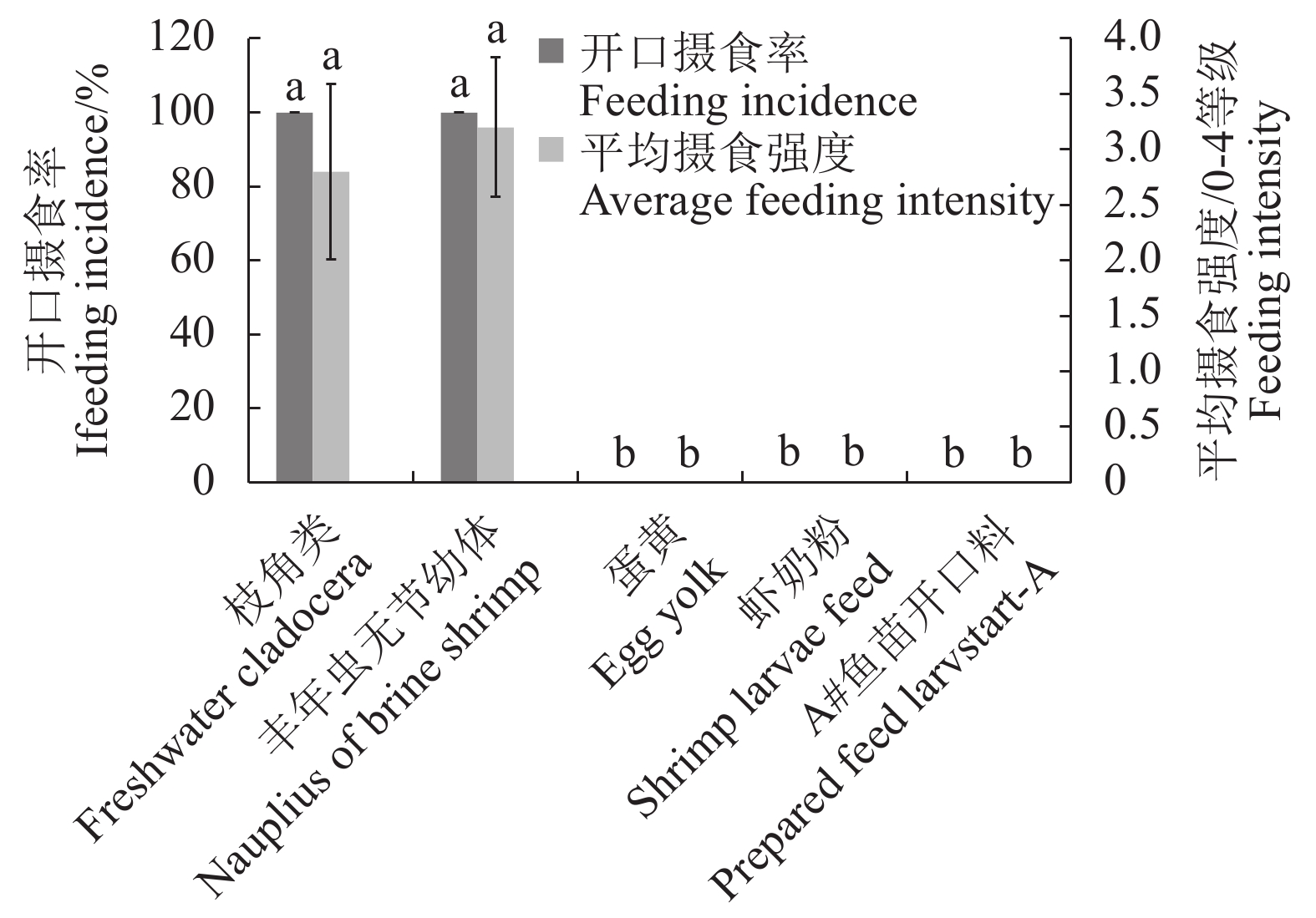
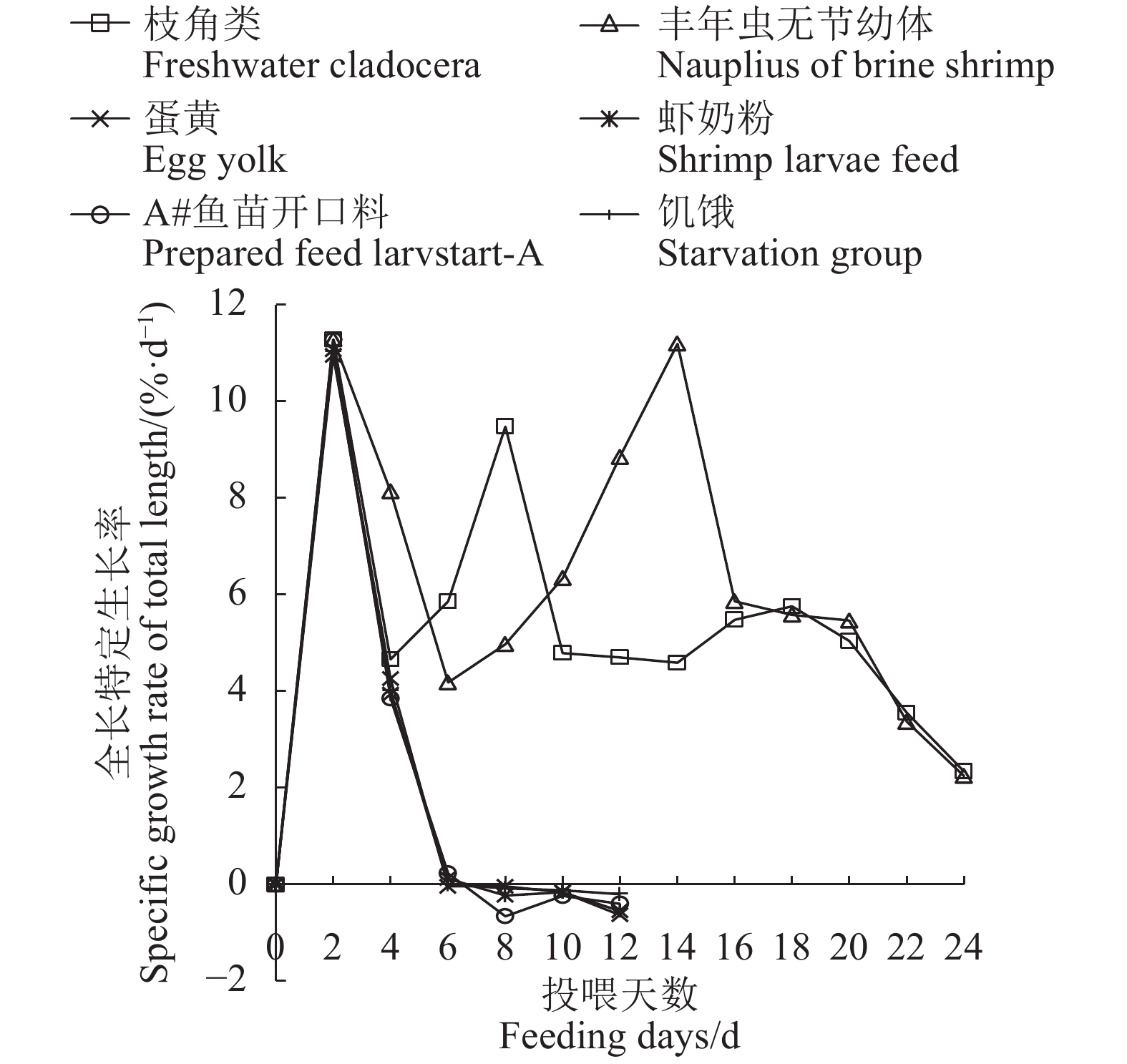
摘要:目的 研究饥饿胁迫和不同开口饵料对大刺鳅仔鱼摄食、生长和成活率的影响,为大刺鳅早期苗种培育技术的改进提供参考依据。方法 采用实验生态学方法,测定饥饿对初孵仔鱼卵黄囊、油球的吸收和死亡不可逆点(PNR);选用枝角类、丰年虫无节幼体、蛋黄、虾奶粉和A#鱼苗开口料作为大刺鳅仔鱼开口饵料,投喂24 d,分析不同开口饵料对大刺鳅仔鱼生长的影响。结果 在水温(27.0±1.5)℃的条件下,仔鱼6日龄开口摄食,初次摄食率达100%,PNR发生在14~15日龄,其摄食能力和饥饿耐受性相对较强,饥饿延缓了仔鱼对卵黄囊和油球的吸收;仔鱼能够摄食枝角类和丰年虫无节幼体等活饵,投喂1 d后的开口摄食率达100%,且具有较快的生长速度和较高的成活率;而仔鱼不摄食蛋黄、虾奶粉和A#鱼苗开口料等人工饵料,其生长、成活率与饥饿组无差异(P>0.05)。结论 枝角类和丰年虫无节幼体是大刺鳅仔鱼适宜的开口饵料。Abstract:Objective Effects of starvation stress and different initial starting forages on the feeding, growth and survival rate of Mastacembelue armatus larvae were studied with a reference to the aquaculture.Method Absorptions on yolk sac and fat globules as well as the point of no return (PNR) of starved larvae were observed by methods of experimental ecology. Eel larvae fed with either freshwater cladocera, nauplius of brine shrimp, egg yolk, crustacean powder or prepared Larvstart-A formulation for 24 d were also under continuous observations.Result The feeding started on the eel larvae at 6-day-old in (27.0±1.5)℃water with an initial feeding rate of 100%. The PNR of starved larvae occurred between 14-d and 15-d of age. Starvation delayed the absorptions on yolk sac and fat globules by the larvae. The consumption on live freshwater cladocera and shrimp nauplius began one day after feeding with 100% feeding rate, and followed by rapid growth with a high survival rate. There was no significant difference on the growth and survival rate between the starved larvae and those fed on the artificial forages such as egg yolk, crustacean powder or Larvstart-A (P>0.05), which were could not be consumed.Conclusion It appeared that the ideal starting diet for M. armatus larvae would be the freshwater cladocera and brine shrimp nauplius.
-
Keywords:
- Masracembelue armatu /
- larvae /
- starvation /
- starting forage /
- feeding rate /
- growth /
- survival rate
-
0. 引言
【研究意义】近年来,随着社会经济发展与人们生活水平提升,心血管疾病发病率呈逐年上升趋势,已严重威胁人类健康。动脉粥样硬化是心血管系统疾病中最常见的疾病之一,也是心血管疾病共同的病理基础[1]。积极预防和控制动脉粥样硬化是预防心血管疾病、降低疾病发病率的重要手段。【前人研究进展】病理学研究结果表明,VSMC增殖是早期动脉粥样硬化形成的始动环节之一,成为心血管疾病防治研究的重要靶细胞[2]。同时,有研究发现,活性氧自由基(reactive oxygen species, ROS)与VSMC增殖相关。血管紧张素II、高糖等通过提高VSMC胞内ROS水平促进细胞增殖[3-4]。抗氧化剂调控ROS介导信号通路抑制VSMC增殖[5-6]。因此,以ROS清除剂筛选VSMC增殖抑制剂成为研究方向之一。【本研究切入点】海带是我国东南沿海常见的经济型养殖海藻,具有药食同源性,在我国多部古代医学典籍中均有记载其药学功效。多糖是海带主要的药效学活性成分,动物学试验研究结果表明,海带多糖可有效降低试验性大鼠血管脂质沉积,降低动脉粥样硬化风险[7]。本课题组前期研究发现海带多糖具有清除超氧阴离子(O2·−)活性,且抑制碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)诱导VSMC增殖[8-9]。已有研究发现H2O2通过调控O2·−介导信号通路促进VSMC增殖[10-11]。但是海带多糖对VSMC增殖抑制活性与其抗氧化活性相关性研究未见相关报道。【拟解决的关键问题】因此,本课题以氧化剂H2O2为诱导剂建立VSMC体外增殖模型,研究海带多糖对氧化剂诱导VSMC增殖及胞内过氧化物生成影响,为阐明海带多糖对VSMC的作用机制奠定基础。
1. 材料与方法
1.1 原料
海带多糖由本实验室制备,多糖含量为87.2%[8];DMEM培养基购自Gibco公司;胎牛血清(FBS)购自杭州四季青;丙二醛(MDA)检测试剂盒购自碧云天公司;二甲基亚砜(DMSO)、H2O2购自Sigma公司;动物细胞裂解液购自上海生工;MTT购自Biosharp公司;其他试剂均为国产分析纯。
1.2 主要仪器设备
BCM-1000超净工作台,苏州净化设备有限公司;HERAcell 150i CO2恒温培养箱,美国Thermo公司;TGL-16M 冷冻离心机,湖南湘仪;P10-Y超纯水系统,科尔顿有限公司;M3 酶标分析仪,美国MD公司;TS-100F 倒置显微镜,日本尼康公司;UV-2600紫外-可见光分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 细胞培养
VSMC由本实验室制备。细胞培养及传代:VSMC采用含10% FBS的DMEM培养液,于37℃、5% CO2培养箱内静置培养。待细胞生长汇合后,吸弃培养瓶内培养液,PBS缓冲液清洗细胞瓶,加入适量0.25%胰酶,37℃放置3 min,倒置显微镜下观察,待细胞呈悬浮,即加入完全培养液终止酶解反应。吸管反复轻轻吹打培养液以分散细胞团,取0.5 mL细胞悬液接种于新的培养瓶内,补加新鲜的完全培养液至3 mL。置于37℃、5% CO2培养箱静置培养。
1.3.2 H2O2诱导VSMC增殖模型构建
取浓度为1×105 个·mL−1 VSMC悬液接种96孔板,37℃、5% CO2培养箱静置培养24 h,待细胞完全贴壁后,用无血清的DMEM培养液37℃孵育8 h。加入H2O2溶液于96孔板至终浓度为设定浓度,对照组用无血清DMEM代替H2O2。孵育至12 h、24 h、36 h后加入MTT溶液(100 μg ·孔−1),孵育4 h后,弃上清液,加入DMSO(200 µL·孔−1)。振荡混匀,于578 nm下检测吸光值。每个试验组设定6孔平行孔。细胞增殖率计算公式:
增值率/%=AiAo×100 (1) 式中:Ai为H2O2模型组吸光值;Ao为对照组吸光值。
1.3.3 MTT法测定VSMC增殖
取对数生长期细胞悬液(1×105 个·mL−1)接种于96孔培养板中,200 μL·孔−1,待细胞贴壁后更换无血清培养液,37℃、5% CO2培养箱内静置过夜培养。吸弃培养液,向96孔板内分别加入0.1、0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置6个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间,加入MTT溶液(100 μg·孔−1),孵育4 h后,弃上清液,加入DMSO(200 µL·孔−1)。振荡混匀,于578 nm下检测吸光值。细胞增殖抑制率计算公式:
抑制率/%=Ao−AiAo×100 (2) 式中:A0 为H2O2模型组的吸光值;Ai为海带多糖试验组吸光值。
1.3.4 VSMC形态观察
取对数生长期细胞悬液(1×105 cells·mL−1)接种于6孔培养板中,1 mL·孔−1,待细胞贴壁后更换无血清培养液,37℃、5% CO2培养箱内静置过夜培养。吸弃培养液,向6孔板内分别加入0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置3个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间后于倒置显微镜下观察细胞形态。
1.3.5 MDA含量测定
按1.3.4方法处理细胞,待细胞经无血清培养液过夜饥饿处理后吸弃培养液,向6孔板内分别加入0.1、0.5、1.0 mg·mL−1海带多糖样品,每个浓度样品设置3个平行孔,H2O2模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入H2O2,继续孵育至设定时间后收集细胞,按碧云天MDA检测试剂盒说明操作,于532 nm下测定吸光值,并计算MDA含量。
1.3.6 数据分析
数据均采用SPSS 17.0软件进行统计学处理,均数±标准差表示,并对结果进行LSD-t检验。
2. 结果与分析
2.1 H2O2 诱导VSMC体外增殖模型的建立
本课题以H2O2为诱导剂建立VSMC体外增殖模型,结果如表1所示。在相同的H2O2浓度下,24 h试验组VSMC增殖率均高于12 h和48 h试验组。而在H2O2相同作用时间下,VSMC增殖率均随着H2O2浓度的增加呈先上升而后下降的趋势。在H2O2浓度为10~100 µmol·L−1时,VSMC增殖率随着H2O2浓度增高而增大。当时间为24 h,H2O2浓度为50 µmol·L−1时,VSMC增殖率达到142.54%,再增加H2O2浓度至100 µmol·L−1,其VSMC增殖率略有增加,但与50 µmol·L−1试验组相比,差异并不显著。而当H2O2浓度增加至150 µmol·L−1,其VSMC增殖率则有所下降。可见当H2O2浓度增大至150 µmol·L−1对VSMC具有细胞毒性,这与文献[12]报道一致。因此,本课题选择H2O2诱导VSMC增殖处理浓度为50 µmol·L−1,作用时间为24 h。
表 1 MTT测定VSMC增殖率Table 1. Viability of VSMCs determined by MTT assayH2O2浓度
H2O2Concentration/
(µmol·L−1)12 h 24 h 36 h 10 102.11±5.22 112.23±3.15 108.74±4.42 20 112.08±2.15 127.65±1.55 117.24±5.68 50 129.56±2.43 a 142.54±2.91 a 133.25±3.48 a 100 132.87±3.56 a 144.29±3.68 a 138.62±2.84 a 150 107.23±5.27 114.87±4.35 96.48±2.57 注:a: 与相同作用时间下H2O2浓度为10 µmol·L−1试验组比,P<0.05。
Note: a: during the same pretreatment time, indicated significant differences compared with the group of 10 µmol·L−1 H2O2, P<0.05. 2.2 海带多糖对VSMC增殖作用的影响
采用MTT法测定海带多糖对VSMC增殖影响,结果见图1所示。从图1可以看出,海带多糖预处理时间相同时,随着海带多糖预处理质量浓度的增加VSMC增殖抑制率增大,呈量效相关性。在相同海带多糖预处理时间下,与海带多糖预处理质量浓度为0.1 mg·mL−1试验组相比,海带多糖预处理质量浓度为0.5 mg·mL−1和1.0 mg·mL−1试验组VSMC增殖抑制率均显著增高(P<0.05)。当海带多糖预处理时间为12 h时,质量浓度为1.0 mg·mL−1海带多糖预处理试验组VSMC增殖抑制率为53.11%,是相同多糖预处理时间下0.1 mg·mL−1海带多糖预处理试验组的5.72倍。由此可见,海带多糖可抑制氧化剂H2O2诱导VSMC增殖。
![]() 图 1 海带多糖对H2O2诱导VSMC增殖抑制率注:a: 相同海带多糖预处理时间下,与0.1 mg·mL−1海带多糖试验组相比,P<0.05;b:相同海带多糖预处理浓度下,与预处理时间12 h海带多糖试验组相比,P<0.05。Figure 1. Effects of L. japonica polysaccharides on H2O2-induced VSMC proliferationNote: a: during the same pretreatment time of polysaccharide, indicated significant differences compared with the group of 0.1 mg·mL−1 polysaccharide, P<0.05; b: under the same concentration of polysaccharide pretreatment, indicated significant differences compared with the group of 12 h treatment with polysaccharide, P<0.05.
图 1 海带多糖对H2O2诱导VSMC增殖抑制率注:a: 相同海带多糖预处理时间下,与0.1 mg·mL−1海带多糖试验组相比,P<0.05;b:相同海带多糖预处理浓度下,与预处理时间12 h海带多糖试验组相比,P<0.05。Figure 1. Effects of L. japonica polysaccharides on H2O2-induced VSMC proliferationNote: a: during the same pretreatment time of polysaccharide, indicated significant differences compared with the group of 0.1 mg·mL−1 polysaccharide, P<0.05; b: under the same concentration of polysaccharide pretreatment, indicated significant differences compared with the group of 12 h treatment with polysaccharide, P<0.05.同时,由图1可以看出,当海带多糖预处理质量浓度高于0.5 mg·mL−1时,与多糖预处理时间12 h试验组相比,多糖预处理时间为24 h和48 h试验组VSMC增殖抑制率均显著增高(P<0.05),增殖抑制率均达到60%。其中,当海带多糖预处理质量浓度为1.0 mg·mL−1时,多糖预处理时间为24 h试验组VSMC增殖抑制率最大,达73.56%。因此,后续试验选择海带多糖预处理时间为24 h。
2.3 海带多糖对VSMC形态影响
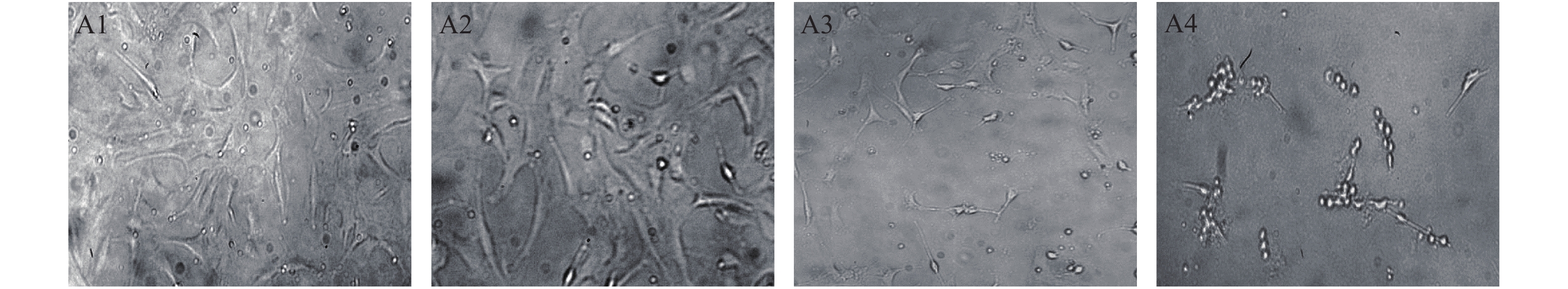
由图2可知,H2O2模型组细胞透光性强,细胞边缘模糊,细胞呈伸展的梭状,且细胞密度大。海带多糖预处理试验组VSMC形态则出现显著变化,0.5 mg·mL−1海带多糖预处理试验组VSMC数目减少,且细胞胞质回缩,部分细胞呈圆形。1 mg·mL−1海带多糖预处理试验组VSMC密度显著降低,细胞边缘清晰,细胞胞质回缩,镜下可见大部分细胞呈圆形。由此可见,海带多糖可引起VSMC生长形态改变,随着海带多糖预处理浓度的增高,VSMC数量显著减少,且呈圆形的VSMC数量增多,表明海带多糖预处理后VSMC形态发生显著变化,使其增殖速度减慢。
![]() 图 2 VSMC形态(×100)注:A1:对照组,A2 :H2O2模型组,A3 :0.5 mg·mL−1 海带多糖+H2O2处理组,A4:1 mg ·mL−1海带多糖+H2O2处理组。Figure 2. Morphology of VSMC (×100)Note: A1: Control group; A2: H2O2 model group; A3: the group treatment with 0.5 mg·mL−1 polysaccharide and H2O2; A4: the group treatment with 1 mg·mL−1 polysaccharide and H2O2.
图 2 VSMC形态(×100)注:A1:对照组,A2 :H2O2模型组,A3 :0.5 mg·mL−1 海带多糖+H2O2处理组,A4:1 mg ·mL−1海带多糖+H2O2处理组。Figure 2. Morphology of VSMC (×100)Note: A1: Control group; A2: H2O2 model group; A3: the group treatment with 0.5 mg·mL−1 polysaccharide and H2O2; A4: the group treatment with 1 mg·mL−1 polysaccharide and H2O2.2.4 海带多糖对H2O2诱导VSMC胞 内MDA生成的影响
研究发现,H2O2诱导VSMC胞内大量累积ROS可促进VSMC胞内一系列脂质过氧化产物的生成[13-14],进而诱导细胞释放生长因子促使VSMC增殖[15-16],因此脂质过氧化物是评估VSMC胞内ROS水平的重要参数。本课题以MDA表征胞内脂质过氧化物生成量,结果如表2所示。
表 2 VSMC胞内MDA生成量Table 2. MDA concentration in VSMC样品Samples 丙二醛MDA/(µmol·L−1) 对照组 Control 1.94±0.05 H2O2模型组
H2O2 Model Group3.21±0.09 a 0.1 mg·mL−1海带多糖+H2O2
0.1 mg·mL−1Laminaria japonica polysaccharide+H2O22.91±0.04 0.5 mg·mL−1海带多糖+H2O2
0.5mg·mL−1Laminaria japonica polysaccharide+H2O21.75±0.08 b 1.0 mg·mL−1 海带多糖+H2O2
1.0 mg·mL−1Laminaria japonica polysaccharide+H2O21.27±0.05 b 注:a:与对照组相比,P<0.01;b:与H2O2模型组相比,P< 0.01。
Note: a: indicated significant differences compared with the control group, P<0.01; b: indicated significant differences compared with the H2O2 model group, P<0.01.从表2中可以看出,与对照组相比,H2O2模型组MDA含量显著提高,达到3.21 µmol·L−1,表明H2O2诱导VSMC胞内生成大量脂质过氧化物,ROS水平显著提高,这是其诱导VSMC增殖的重要因素。而采用不同质量浓度海带多糖进行预处理后,其VSMC胞内MDA生成量均有下降。当海带多糖质量浓度达到1.0 mg·mL−1时,VSMC胞内MDA生成量最低,仅为1.27 µmol·L−1,与H2O2模型组相比下降了60.44%。由此可见,VSMC胞内脂质过氧化物生成量随着海带多糖预处理浓度的增加而降低,呈量效相关性,表明海带多糖预处理后有效抑制VSMC胞内因H2O2诱导引起的ROS升高,提示海带多糖对H2O2诱导VSMC增殖的抑制机制与调控VSMC胞内ROS水平相关。因此,后续试验可进一步从分子水平探讨海带多糖对VSMC胞内ROS的调控机制,阐明海带多糖对H2O2诱导VSMC增殖抑制机制。
3. 讨论与结论
病理学研究发现,血管平滑肌细胞异常增殖是动脉粥样硬化形成的始动环节,也是动脉粥样硬化心血管疾病共同的病理基础。研究发现抗动脉粥样硬化活性物质西洛他唑通过阻断VSMC胞内ERK1/2信号通路,抑制VSMC增殖[17]。Bin等对动脉粥样硬化形成分子机制研究发现,动脉粥样硬化重要诱因氧化低密度脂蛋白(ox-LDL)诱导VSMC胞内转录因子KLF5表达,进而上调胞内微小RNA-29a表达水平,最终促进VSMC增殖而形成动脉粥样硬化斑块[18]。细胞学研究发现,ROS水平增高激活VSMC胞内MAPK信号通路并促进VSMC增殖[19]。Yang等研究结果表明高糖处理引起细胞ROS水平增高是其诱导VSMC增殖的主要因素[4]。因此,胞内ROS水平增高是VSMC增殖的促进因子。
天然产物活性研究结果表明,海藻多糖具有显著抗氧化活性,可有效降低胞内ROS水平。马军等研究发现海藻多糖具有自由基清除和抗脂质过氧化活性[20]。杨运高等用大鼠红细胞免疫功能缺陷模型研究海藻多糖对红细胞免疫功能及自由基损伤的影响。试验结果显示,海藻多糖增强超氧化物歧化酶、谷胱甘肽等还原性物质活性,并降低MDA含量,表明海藻多糖可降低大鼠体内ROS水平,是抗氧化剂的重要备选资源[21]。海带多糖是一种抗氧化活性显著的海藻多糖,其对DPPH、羟自由基、超氧阴离子等自由基的清除活性显著[22]。张晴岚等研究发现海带多糖可改善大鼠血脂水平,提高一氧化氮浓度和一氧化氮合酶活性,抑制动脉粥样硬化斑块发生和发展[23]。本课题以H2O2为诱导剂建立VSMC增殖模型,评估海带多糖作用下动脉粥样硬化始动因子VSMC生长与脂质过氧化水平的相关性。结果表明,海带多糖可抑制H2O2诱导VSMC增殖且呈量效相关性。而海带多糖浓度与VSMC胞内MDA含量呈负相关性,可见海带多糖缓解了VSMC胞内因H2O2诱导引起的ROS水平增高,表明海带多糖抑制VSMC增殖与其抗氧化活性相关。因此,后续研究需进一步从ROS调控细胞增殖的MAPK通路上进一步探讨海带多糖对VSMC增殖的抑制机制,为深度开发海带药用价值奠定基础。
-
表 1 大刺鳅仔鱼卵黄囊和油球的吸收
Table 1 Absorptions on yolk sac and fat-globules by M. armatu larvae
日龄
Day post hatching/d饥饿组 Starvation group 对照组 Control group 仔鱼全长
Total length/mm卵黄囊体积
Volume of yolk sac/mm3油球体积
Volume of oil globule/mm3仔鱼全长
Total length/mm卵黄囊体积
Volume of yolk sac/mm3油球体积
Volume of oil globule/mm30 5.85±0.11 9.47±0.70 a 0.74±0.09 a 5.85±0.15 9.49±0.69 a 0.79±0.02 a 1 6.65±0.10 7.34±0.14 a 0.64±0.09 a 6.66±0.06 7.38±0.16 a 0.65±0.10 a 2 7.72±0.23 4.20±0.19 a 0.51±0.05 a 7.74±0.13 4.13±0.79 a 0.49±0.07 a 3 8.78±0.16 3.94±0.11 a 0.47±0.10 a 8.79±0.29 4.01±0.21 a 0.50±0.09 a 4 9.18±0.12 3.75±0.24 a 0.30±0.05 a 9.16±0.31 3.69±0.29 a 0.31±0.03 a 5 9.50±0.44 2.55±0.69 a 0.30±0.07 a 9.51±0.19 2.60±0.63 a 0.30±0.06 a 6 10.60±0.26 2.16±0.33 a 0.29±0.06 a 10.69±0.31 2.47±0.32 b 0.29±0.06 a 7 11.78±0.36 1.81±0.23 a 0.27±0.05 a 11.84±0.23 1.31±0.38 b 0.27±0.01 a 8 12.01±0.84 1.45±0.42 a 0.18±0.03 a 12.34±0.32 0.87±0.29 b 0.16±0.03 a 9 12.47±0.62 0.55±0.21 a 0.16±0.05 a 12.98±0.84 0.29±0.08 b 0.11±0.01 b 10 12.49±0.80 0.32±0.01 a 0.09±0.02 a 13.83±0.10 0 b 0.01±0.00 b 11 12.51±0.65 0 0.01±0.00 14.80±0.98 0 0 12 12.48±0.76 0 0 16.91±0.58 0 0 13 12.41±0.73 0 0 18.29±0.86 0 0 注:同行同一项目数据后不同小写字母表示试验组与对照组间差异显著(P<0.05)。
Note: Different lowercase letters after the same project data indicate significant differences between the test groups (P<0.05).表 2 饥饿和不同开口饵料对大刺鳅仔鱼全长的影响
Table 2 Growth by body length of M. armatu larvae under feeding with various forages or starvation
投喂天数
Feeding days/d全长 Total length/mm 枝角类
Freshwater cladocera丰年虫无节幼体Nauplius of brine shrimp 蛋黄
Egg yolk虾奶粉
Shrimp larvae feedA#鱼苗开口料
Prepared feed larvstart-A饥饿组
Starvation group0 9.48±0.75 a 9.48±0.75 a 9.48±0.75 a 9.48±0.75 a 9.48±0.75 a 9.48±0.75 a 2 11.88±0.75 a 11.88±0.75 a 11.80±0.94 a 11.83±0.91 a 11.88±0.87 a 11.82±0.89 a 4 13.04±0.82ab 13.98±1.01 a 12.85±0.44 b 12.80±0.75 b 12.83±0.58 b 12.81±0.75 b 6 14.66±0.62 a 15.20±0.77 a 12.84±0.69 b 12.83±0.76 b 12.89±0.67 b 12.81±0.89 b 8 17.72±1.17 a 16.79±0.98 a 12.83±0.21 b 12.77±0.54 b 12.72±0.70 b 12.79±0.91 b 10 19.50±1.46 a 19.06±1.11 a 12.79±0.17 b 12.73±0.54 b 12.66±0.43 b 12.76±0.46 b 12 21.42±1.36 a 22.75±1.32 a 12.63±0.48 b 12.59±0.55 b 12.56±0.50 b 12.71±0.42 b 14 23.48±1.67 b 28.46±2.57 a 16 26.20±0.76 b 32.00±1.06 a 18 29.42±1.42 b 35.78±2.00 a 20 32.52±3.06 b 39.91±2.07 a 22 34.91±2.62 b 42.69±3.55 a 24 36.58±1.77 b 44.65±2.53 a 日均增长 Daily length gain/(mm·d−1) 1.13±0.09 b 1.47±0.11 a 0.26±0.07 c 0.26±0.06 c 0.26±0.09 c 0.27±0.08 c 增长率 Growth rate/% 288.19±41.86 b 373.28±44.56 a 33.89±11.84 c 33.35±10.30 c 33.35±14.80 c 34.83±13.30 c 全长特定生长率
Specific growth rate of total length/(%·d−1)5.63±0.44 a 6.46±0.40 a 2.41±0.73 b 2.38±0.64 b 2.36±0.88 b 2.46±0.83 b 注:同行数据后不同小写字母代表各饵料组之间差异显著(P<0.05)。表3、4同。
Note: Different letters of the same feeding days indicates significant differences among the bait groups (P<0.05). The same as Table 3, 4.表 3 饥饿和不同开口饵料对大刺鳅仔鱼体质量的影响
Table 3 Growth by body weight of M. armatu larvae under feeding with various forages or starvation
投喂天数
Feeding days/d体质量 Body mass/mg 枝角类
Freshwater cladocera丰年虫无节幼体
Nauplius of brine shrimp蛋黄
Egg yolk虾奶粉
Shrimp larvae feedA#鱼苗开口料
prepared feed larvstart-A饥饿组
Starvation group0 9.24±0.80 a 9.24±0.80 a 9.24±0.80 a 9.24±0.80 a 9.24±0.80 a 9.24±0.80 a 2 9.92±0.75 a 11.18±1.22 b 9.60±0.77 a 9.80±1.010 a 9.64±0.69 a 9.92±0.91 a 4 10.70±2.17 a 14.20±2.66 b 9.60±1.19 a 9.50±0.71 a 10.23±1.11 a 9.54±1.42 a 6 16.36±1.21 a 20.66±3.05 b 9.40±1.07 c 9.20±0.77 c 9.84±0.73 d 9.32±1.13 cd 8 20.38±1.93 a 24.90±3.75 b 8.70±0.75 c 8.50±0.60 c 8.93±0.91 c 8.33±1.12 c 10 26.94±3.16 a 33.92±4.85 b 7.50±0.38 c 7.40±0.39 c 8.14±0.47 c 7.82±0.68 c 12 38.60±7.08 a 50.08±9.50 b 6.92±0.42 c 7.07±0.58 c 7.64±0.53 c 7.19±0.47 c 14 50.10±8.42 a 79.24±15.52 b 16 68.64±2.33 a 106.48±10.66 b 18 87.38±8.87 a 138.13±17.88 b 20 101.06±27.85 a 172.04±15.09 b 22 113.08±20.14 a 210.64±56.62 b 24 118.58±13.44 a 251.26±68.33 b 日均增重
Daily average weight increasement/(mg·d−1)4.56±0.58 b 10.08±2.82 a −0.19±0.09 c −0.18±0.08 c −0.13±0.08 d −0.17±0.09 c 增重率 Weight gain rate/% 1183.33±239.13 b 2619.26±754.73 a −25.11±4.34 c −23.49±8.72 c −17.32±6.92 d −22.19±8.44 c 体质量特定生长
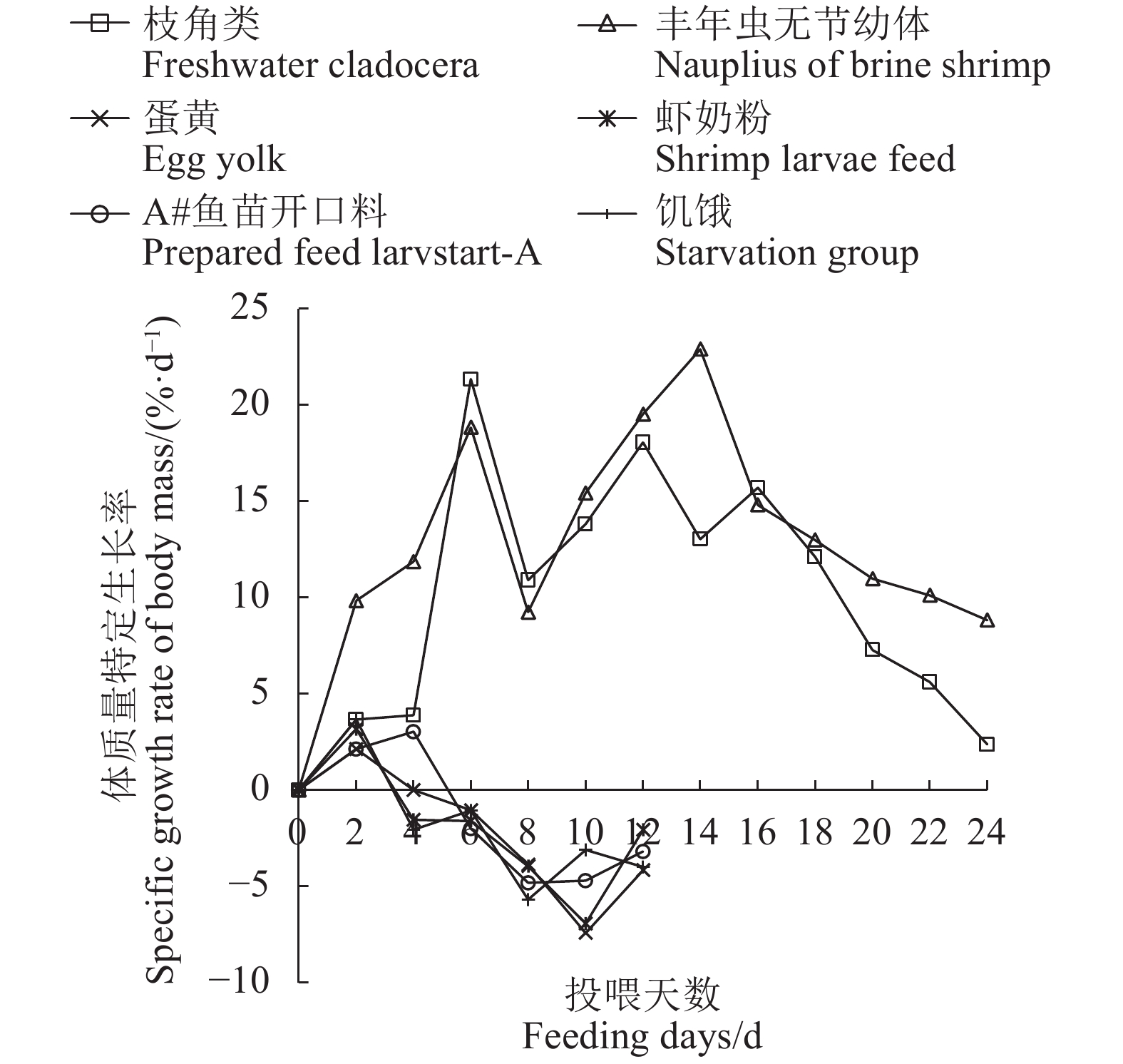
Specific growth rate of body mass/(%·d−1)10.63±0.79 b 13.76±1.18 a −2.41±0.50 c −2.23±0.95 c −1.58±0.74 d −2.09±0.91 c 表 4 饥饿和不同开口饵料对大刺鳅仔鱼成活率的影响
Table 4 Survival rates of M. armatu larvae under feeding with various forages or starvation
(单位:%) 投喂天数
Feeding days/d饵料组 Diet groups 饥饿组
Starvation group枝角类
Freshwater cladocera丰年虫无节幼体
Nauplius of brine shrimp蛋黄
Egg yolk虾奶粉
Shrimp larvae feedA#鱼苗开口料
Prepared feed larvstart-A0 100.00±0.00 a 100.00±0.00 a 100.00±0.00 a 100.00±0.00 a 100.00±0.00 a 100.00±0.00 a 2 96.79±1.13 a 95.08±1.54 ab 93.33±0.95 b 95.56±2.40 ab 93.65±1.10 b 93.33±0.95 b 4 92.00±0.83 a 91.51±1.56 a 89.05±2.96 a 90.88±3.68 a 87.63±0.55 a 87.98±2.85 a 6 85.88±5.09 a 85.51±4.81 a 78.68±2.82 b 65.78±0.90 c 67.76±5.19 c 76.63±2.63 b 8 80.30±6.41 a 79.23±6.09 a 47.82±7.06 bc 39.08±5.90 c 42.73±4.72 bc 50.82±3.05 b 10 75.28±8.43 a 74.64±6.97 a 36.06±3.81 b 23.32±7.64 c 29.51±4.82 bc 39.16±3.70 b 12 69.66±9.47 a 68.91±8.02 a 21.66±3.98 b 13.41±3.49 c 15.95±1.04 bc 25.76±2.66 b 14 67.96±10.10 a 65.47±8.56 a 0.00 b 0.00 b 0.00 b 0.00 b 16 65.34±10.38 a 61.85±8.04 a 18 63.26±11.24 a 60.31±8.24 a 20 58.86±11.03 a 56.58±6.18 a 22 57.44±11.58 a 52.54±7.43 a 24 56.18±13.29 a 50.26±6.84 a -
[1] 黄永春. 汀江大刺鳅食性和繁殖生物学 [J]. 水产学报, 1999, 23(S1):1−6. HUANG Y C. Feeding habit and reproductive biology of Mastacembelus armatus in Tingjiang river [J]. Journal of Fisheries of China, 1999, 23(S1): 1−6.(in Chinese)
[2] 曾庆祥, 方园, 曾学平, 等. 大刺鳅的生物学特性与人工繁养殖技术 [J]. 中国水产, 2016(3):70−73. DOI: 10.3969/j.issn.1002-6681.2016.03.030 ZENG Q X, FANG Y, ZENG X P, et al. Biological Characteristics and Artificial Breeding Techniques of Masracembeluearmatu [J]. China Fisheries, 2016(3): 70−73.(in Chinese) DOI: 10.3969/j.issn.1002-6681.2016.03.030
[3] 薛凌展, 樊海平, 秦志清. 池塘网箱培育大刺鳅种苗试验 [J]. 科学养鱼, 2016(5):6−7. XUE L Z, FAN H P, QIN Z Q. Fry Rearing were conducted innet cage of Masracembelue armatuin pond [J]. Scientific Fish Farming, 2016(5): 6−7.(in Chinese)
[4] 宋聃, 张颖, 麦丽坎, 等. 饥饿和不同饵料对杂交鲟(达氏鳇(♀)×施氏鲟(♂))仔稚鱼生长和消化酶活性的影响 [J]. 淡水渔业, 2015, 45(4):76−81. DOI: 10.3969/j.issn.1000-6907.2015.04.013 SONG D, ZHANG Y, MAI L K, et al. Effects of starvation and feeding different diets on growth and digestive enzyme activity of Huso dauricus (♀) × Acipenser schrenckii (♂) [J]. Freshwater Fisheries, 2015, 45(4): 76−81.(in Chinese) DOI: 10.3969/j.issn.1000-6907.2015.04.013
[5] 林贞贤, 杨广成. 不同开口饵料对泰山螭霖鱼仔鱼摄食力、存活和生长的影响 [J]. 泰山学院学报, 2015, 37(3):84−88. DOI: 10.3969/j.issn.1672-2590.2015.03.015 LIN Z X, YANG G C. Effects of initial feeds on food intake, survival rates and growth of scaphesthes macrolepis larvae [J]. Journal of Taishan University, 2015, 37(3): 84−88.(in Chinese) DOI: 10.3969/j.issn.1672-2590.2015.03.015
[6] 吴兴兵, 杨德国, 朱永久, 等. 不同开口饵料对四川裂腹鱼仔鱼生长和成活率的影响 [J]. 淡水渔业, 2014, 44(6):9−12, 23. DOI: 10.3969/j.issn.1000-6907.2014.06.002 WU X B, YANG D G, ZHU Y J, et al. Effects of initial feeding on the growth and survival of Schizothorax kozlovi Nikolsky larvae [J]. Freshwater Fisheries, 2014, 44(6): 9−12, 23.(in Chinese) DOI: 10.3969/j.issn.1000-6907.2014.06.002
[7] 宋兵, 陈立侨, 高露姣, 等. 饥饿对杂交鲟仔鱼摄食、生长和体成分的影响 [J]. 水生生物学报, 2004, 28(3):333−336. DOI: 10.3321/j.issn:1000-3207.2004.03.020 SONG B, CHEN L Q, GAO L J, et al. The effects of starvation on feeding, growth and biochemical composition of hybrid sturgeon larvae [J]. Acta Hydrobiologica Sinica, 2004, 28(3): 333−336.(in Chinese) DOI: 10.3321/j.issn:1000-3207.2004.03.020
[8] 秦志清. 饥饿对半刺厚唇鱼(Acrossocheilius hemispinus)仔鱼早期发育的主要影响 [J]. 集美大学学报(自然科学版), 2015, 20(4):241−248. QIN Z Q. Effects of starvation on feeding, growth, survival and development of acrossocheilius hemispinus larvae [J]. Journal of Jimei University(Natural Science Edition), 2015, 20(4): 241−248.(in Chinese)
[9] 殷名称. 鱼类早期生活史研究与其进展 [J]. 水产学报, 1991, 15(4):348−358. YIN M C. Advances and studies on early life history of fish [J]. Journal of Fisheries of China, 1991, 15(4): 348−358.(in Chinese)
[10] 王茂元. 斑鳜仔鱼饥饿试验及不可逆点的确定 [J]. 广东海洋大学学报, 2015, 35(4):99−103. DOI: 10.3969/j.issn.1673-9159.2015.04.016 WANG M Y. Starvation test on Siniperca scherzeri larvae and acertaining the point of No return [J]. Journal of Guangdong Ocean University, 2015, 35(4): 99−103.(in Chinese) DOI: 10.3969/j.issn.1673-9159.2015.04.016
[11] 殷名称. 北海鲱卵黄囊期仔鱼的摄食能力和生长 [J]. 海洋与湖沼, 1991, 22(6):554−560. YIN M C. Feeding ability and growth of the yolk-sac larvae of north Sea herring [J]. Oceanologia et Limnologia Sinica, 1991, 22(6): 554−560.(in Chinese)
[12] 贾瑞锦, 陈超, 孔祥迪, 等. 饥饿对条纹锯仔鱼的存活、摄食及生长的影响 [J]. 海洋科学, 2014, 38(4):44−49. DOI: 10.11759/hykx20130125001 JIA R J, CHEN C, KONG X D, et al. Effects of starvation on suriving, feeding and growth of the Yolk-sac larval of Centropristis striata [J]. Marine Sciences, 2014, 38(4): 44−49.(in Chinese) DOI: 10.11759/hykx20130125001
[13] 于欢欢, 陈超, 张廷廷, 等. 饥饿对云纹石斑鱼(Epinephelus moara)卵黄囊期仔鱼摄食和生长的影响 [J]. 渔业科学进展, 2015, 36(6):37−42. DOI: 10.11758/yykxjz.20150606 YU H H, CHEN C, ZHANG T T, et al. Feeding and growth of Epinephelus moara larvae in the process of nourishing transformation [J]. Progress in Fishery Sciences, 2015, 36(6): 37−42.(in Chinese) DOI: 10.11758/yykxjz.20150606
[14] 秦志清. 黑莓鲈(Pomoxis nigromacufatus)仔鱼饥饿试验及PNR的确定 [J]. 福建农业学报, 2014, 29(12):1167−1173. DOI: 10.3969/j.issn.1008-0384.2014.12.004 QIN Z Q. Experimental starvation on Pomoxis nigromacufatus larvae and definition of the point of no return [J]. Fujian Journal of Agricultural Sciences, 2014, 29(12): 1167−1173.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2014.12.004
[15] 乔志刚, 常国亮, 石灵, 等. 不同温度下鲇仔鱼的耐饥饿特性 [J]. 水利渔业, 2007, 28(2):12−13, 33. DOI: 10.3969/j.issn.1003-1278.2007.02.005 QIAO Z G, CHANG G L, SHI L, et al. Starvation tolerance of silurusasotus larvae at different temperatures [J]. Reservoir Fisheries, 2007, 28(2): 12−13, 33.(in Chinese) DOI: 10.3969/j.issn.1003-1278.2007.02.005
[16] 殷名称. 鲢、鳙、草鱼、银鲫卵黄囊期仔鱼的摄食、生长和耐饥饿能力[C]//鱼类学论文集(第六辑). 北京: 科学出版社, 1987: 69-79. YIN M C. Feeding, growth and starvation tolerance of larvae of silver carp, bighead carp, grass carp and silver crucian carp in yolk sac stage [C]//Collection of Fisheries Thesis (Part 6). Beijing: Science Press, 1997: 69-79.
[17] 易建华. 不同开口饵料对胭脂鱼仔稚鱼成活率的影响[D]. 重庆: 西南大学, 2014. YI J H. Effects of initial feeding on rate of survival of larval and juvenile Chinese sucker, Myxocyprinus asiaticus[D]. Chongqing: Southwest University, 2014. (in Chinese)
[18] 殷名称. 鱼类仔鱼期的摄食和生长 [J]. 水产学报, 1995, 19(4):335−342. YIN M C. Feeding and growth of the larva stage. of fish [J]. Journal of Fisheries of China, 1995, 19(4): 335−342.(in Chinese)
[19] 海萨, 杜劲松, 刘昆仑, 等. 白斑狗鱼仔、稚鱼的摄食与生长 [J]. 水利渔业, 2006, 26(6):40−41, 43. DOI: 10.3969/j.issn.1003-1278.2006.06.015 HAI S, DU J S, LIU K L, et al. Studies on the feeding and growth of larval Esoxlucius [J]. Reservoir Fisheries, 2006, 26(6): 40−41, 43.(in Chinese) DOI: 10.3969/j.issn.1003-1278.2006.06.015
[20] 黄峰, 严安生, 张桂蓉, 等. 大口鲇仔鱼消化道的组织学观察 [J]. 华中农业大学学报, 2000, 19(1):59−63. DOI: 10.3321/j.issn:1000-2421.2000.01.017 HUANG F, YAN A S, ZHANG G R, et al. Observation of the histology of the digestive tract of Silurus meridionalis larvae [J]. Journal of Huazhong Agricultural, 2000, 19(1): 59−63.(in Chinese) DOI: 10.3321/j.issn:1000-2421.2000.01.017
[21] 朱成德. 仔鱼的开口摄食期及其饵料综述 [J]. 水生生物学报, 1986, 10(1):86−95. ZHU C D. Aspects on the first-feeding stage and foods of fish larvae [J]. Acta Hydrobiologica Sinica, 1986, 10(1): 86−95.(in Chinese)
-
期刊类型引用(0)
其他类型引用(2)




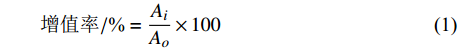
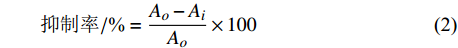
 下载:
下载: