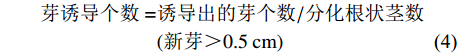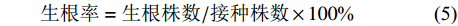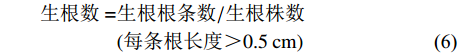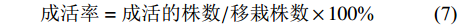Tissue Culture for Rapid Propagation of A Cymbidium goeringii Hybrid
-
摘要:目的 筛选春兰组培各阶段的最佳培养条件,建立优良的春兰快繁体系,为春兰大规模生产开发提供科学依据。方法 以春兰‘黄梅’ב黄荷’F1无菌播种形成的根状茎为试验材料,通过基本培养基(1/2MS、改良1/2MS、HyponexⅡ)和植物生长调节剂(6-BA、NAA、TDZ、IBA)等因子不同组合,围绕增殖、分化、生根等阶段建立其再生体系,并对培育出的组培苗进行移栽练苗。结果 增殖最适培养基为3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA+3.0 mg·L−1 NAA+1.0 g·L−1 活性炭(AC)+30.0 g·L−1 白砂糖(Su)+7.0 g·L−1 琼脂(Ag),生长速度和增殖系数分别为7.31和6.02;分化最适培养基为2.0 mg·L−1 6-BA+0.3 mg·L−1 NAA+30.0 g·L−1 Su+7.0 g·L−1 Ag,分化率、芽诱导个数和株高分别为90.00%、5.44个和2.53 cm;生根最适培养基为1.5 mg·L−1 IBA+2.0 g·L−1蛋白胨+1.0 g·L−1 AC+25.0 g·L−1 Su+7.0 g·L−1 Ag,生根率、生根数和平均根长分别为100.00%、8.03条和3.00 cm;春兰组培苗练苗移栽60 d后存活率达96.53%。结论 新型基本培养基HyponexⅡ(3.0 g·L−1)对春兰增殖培养有高效促进作用,高水平的IBA(1.5 mg·L−1)有利于春兰组培苗生根壮苗。Abstract:Objective Optimum conditions for an efficient, rapid propagation from rhizomes of a Cymbidium goeringii hybrid were investigated.Method Rhizomes of the aseptically seeded F1 hybrid between two C. goeringii cultivars, Huang-mei and Huang-he, were cultivated on various media (i.e., 1/2MS、modified 1/2MS, and HyponexⅡ) with added plant growth regulators (i.e., 6-BA, NAA, TDZ, and/or IBA) to monitor the plant growth throughout propagation, differentiation, and rooting of the regeneration process. The seedlings were subsequently transplanted outdoor to determine their survival rate.Result In the propagation stage, the optimal medium was 3.0 g HyponexⅡ·L−1 + 0.5 mg 6-BA·L−1 + 3.0 mg NAA·L−1 + 1.0 g activated carbon (AC)·L−1 + 30.0 g sugar (Su)·L−1 + 7.0 g agar (Ag)·L−1 to achieve a growing rate of 7.31 and a multiplication coefficient of 6.02. The optimal medium for differentiation was 2.0 mg 6-BA·L−1 + 0.3 mg NAA·L−1 + 30.0 g Su·L−1 + 7.0 g Ag·L−1 to deliver an averaged 90.00% differentiation, 5.44 buds per rhizome segment, and 2.53 cm height of seedling. For optimum rooting, the medium was 1.5 mg IBA·L−1 + 2.0 g peptone·L−1 + 1.0 g AC·L−1 + 25.0 g Su·L−1 + 7.0 g Ag·L−1 to result in 100.00% root-generation with an averaged 8.03 roots at 3.00 cm long per plant. The survival rate of plantlets 60 d after transplantation was up to 96.53%.Conclusion HyponexⅡ applied at 3.0 g·L−1 was found highly efficient for the C. goeringii rhizome regeneration; and, the addition of 1.5 mg·L−1 of IBA in the medium significantly enhanced the rooting for the seedlings.
-
Keywords:
- Cymbidium goeringii /
- propagation culture /
- differentiation culture /
- rooting culture
-
0. 引言
【研究意义】春兰Cymbidium goeringii为兰科Orchidaceae兰属Cymbidium的多年生草本植物,是我国兰科植物(国兰)中资源最丰富、分布最广的种类之一[1],一般于早春开花,花姿优美,气质优雅,备受国人喜爱,有“天下第一香”和“花中君子”的称号[2];然而,高昂的售价与新品种培育周期漫长等问题一直制约着春兰的规模化发展,长期以来国内春兰的商品市场主要依赖日本、台湾等地的返销苗,该类苗与原生苗相比存在着成活率差、倒苗等问题[3]。目前兰花快速繁殖的主要途径是通过组织培养技术[4],因此如何借用组织培养技术培育开品好、生长周期快的本土优良新品种提升产品自信、丰富春兰市场是解决这一问题最有效的方法。【前人研究进展】近年来关于国兰杂交种的组培技术已有不少报道,常见于‘宋梅’ב集圆’[5]、‘宋梅’ב韩国桃花’[6]和‘春绿兰’ב虎雪兰’[7]等;前人对国兰组培研究的基本培养基多使用MS培养基[5-7],后期兴起的Hyponex培养基为兰花组培提供了更为简便的配制方法,多见于蝴蝶兰[8-9]、墨兰[10]等研究中。【本研究切入点】目前关于春兰‘黄梅’ב黄荷’F1的研究尚未见报道,同时Hyponex对国兰生长影响的报道较少,尤其针对春兰组培的研究仅在简报中出现[11];此外,本课题组的前期研究发现,不同品种的春兰对组培条件的需求仍然存在差异,缺少科学完整且适用于工厂规模化生产的技术理论,为此,本试验对春兰‘黄梅’ב黄荷’F1根状茎及其组培苗的增殖、分化、生根培养和炼苗移栽的关键影响因子进行了相关研究。【拟解决的关键问题】本试验选取了稳定性强及市场上易获取的基本培养基(MS和HyponexⅡ)、细胞分裂素(6-BA和TDZ)、生长素(NAA和IBA)和有机添加剂(蛋白胨)为春兰‘黄梅’ב黄荷’F1组培各阶段寻找最佳培养条件,旨在建立优良、高效的春兰快繁体系,形成规模化种植,从而提高春兰在我国花卉市场的竞争力。
1. 材料与方法
1.1 试验材料
以2015年9月取自福建连城兰花股份有限公司的春兰‘黄梅’ב黄荷’F1无菌播种形成的根状茎为试验材料。试验于福建农林大学下安园林植物实验室进行。
1.2 试验方法
1.2.1 增殖培养
采用L9(34)正交试验[12]研究不同基本培养基、6-BA和NAA对春兰根状茎增殖培养的影响(表1),所有处理附加1.0 g·L−1 活性炭(AC)+30.0 g·L−1 白砂糖(Su)+7.0 g·L−1 琼脂(Ag),pH 5.6~5.8。选取长1.5~2.0 cm的健壮根状茎(无分支)接入上述增殖培养基中。试验每组接种10瓶,每瓶接种5个材料,2次重复。光照时间12 h·d−1,培养温度(26±2)℃,散射光培养,120 d后统计根状茎的生长速度和增殖系数。
表 1 根状茎增殖培养配方正交设计L9(34)Table 1. Orthogonal design L9 (34) on culture media for rhizome propagation水平
Level因素 Factor 基本培养基 Basic medium 6-BA/(mg·L−1) NAA/(mg·L−1) 1 1/2MS 0.1 2.0 2 Revised 1/2MS 0.3 3.0 3 Hyponex Ⅱ3.0 g·L−1 0.5 5.0 注:改良1/2MS为不含有微量元素的1/2MS培养基。
Note: Modified ½ MS was regular ½ MS without added microelements.生长速度=(增殖后根状茎质量−接种时根状茎质量)/接种时根状茎质量 (1) 增殖系数=接种根状茎上新增侧枝数/接种根状茎数(新增根状茎长度>0.5cm) (2) 1.2.2 分化培养
以1/2MS培养基(30.0 g·L−1 Su,7.0 g·L−1 Ag,pH 5.6~5.8)为基本培养基,针对NAA(0.3和0.5 mg·L−1)、6-BA(0.0,1.0,2.0和3.0 mg·L−1)和TDZ(0.0,0.5,1.0和1.5 mg·L−1)配置培养基探索其对春兰根状茎分化的影响(表2)。材料选取、接种方式同1.2.1。光照时间12 h·d−1,培养温度26±2℃,前30 d散射光培养,之后转入500~1 500 lx光强下培养,120 d后统计根状茎的分化率和芽诱导个数。
表 2 根状茎分化培养试验设计Table 2. Experimental design on culture media for rhizome differentiation处理号 Number NAA/(mg·L−1) 6-BA/(mg·L−1) TDZ/(mg·L−1) 1 0.3 1.0 0.0 2 0.3 2.0 0.0 3 0.3 3.0 0.0 4 0.3 0.0 0.5 5 0.3 0.0 1.0 6 0.3 0.0 1.5 7 0.5 1.0 0.0 8 0.5 2.0 0.0 9 0.5 3.0 0.0 10 0.5 0.0 0.5 11 0.5 0.0 1.0 12 0.5 0.0 1.5 分化率=分化根状茎个数/接种根状茎数×100% (3) 芽诱导个数=诱导出的芽个数/分化根状茎数(新芽>0.5cm) (4) 1.2.3 IBA和蛋白胨对组培苗生根的培养
以1/2MS为基本培养基,对IBA(0.5、1.0和1.5 mg·L−1)和蛋白胨(1.0、2.0和3.0 g·L−1)进行全因素试验设计(表3),所有处理附加1.0 g·L−1 AC+25.0 g·L−1 Su+7.0 g·L−1 Ag(pH 5.6~5.8),研究其对株高(6±2) cm组培苗(无根)生根的影响。每组接种10瓶,每瓶接种3株,重复2次。光照时间12 h·d−1,培养温度(26±2)℃,光强500~1 000 lx,120 d后统计根状茎的生根率和生根数。
表 3 组培苗生根培养全因素设计Table 3. All factor design on culture media for plantlet rooting处理号 Number IBA/(mg·L−1) 蛋白胨 Peptone/(g·L−1) 1 0.5 1.0 2 0.5 2.0 3 0.5 3.0 4 1.0 1.0 5 1.0 2.0 6 1.0 3.0 7 1.5 1.0 8 1.5 2.0 9 1.5 3.0 生根率=生根株数/接种株数×100% (5) 生根数=生根根条数/生根株数(每条根长度>0.5cm) (6) 1.2.4 炼苗移栽
选取生长健壮、叶色正常,株高(10±2) cm,根皮色白中带绿、无黑色、畸形、变异的组培苗为试验材料,清净根部培养基,在阴凉处晾干2 d,移栽至树皮(2~3 cm)和火烧石等体积混合的基质中,60 d后观察生长状态并统计成活率。
成活率=成活的株数/移栽株数×100% (7) 1.2.5 数据统计分析
使用Excel 2010计算平均值和标准差,SPSS 19.0统计分析软件对数据进行方差分析和Least-Significant Difference(LSD)多重比较,水平0.01<P≤0.05差异显著;水平0<P≤0.01差异极显著。
2. 结果与分析
2.1 基本培养基、6-BA和NAA对根状茎增殖的影响
接种时根状茎上无明显凸起(图1-A),培养15 d后有明显萌动,新萌动的根状茎向下扎入培养基中(图1-B),培养120 d时根状茎数量明显增多,且新生根状茎亦会出现分支现象(图1-C)。
![]() 图 1 离体培养各个阶段注:A为增殖培养第1 d;B为增殖培养第15 d;C为增殖培养120 d;D为分化培养第1 d;E为分化培养第15 d;F为分化培养120 d;G为生根培养120 d;H为组培苗练苗移栽60 d。Figure 1. Tissue cultures at various development stagesNote: A is multiplication culture on 1st day; B, 15th day; and, C, 120th day. D is differentiation culture on 1st day; E, 15th day; and, F, 120th day. G is rooting culture on 120th day. H indicates plantlets on 60th day after transplantation.
图 1 离体培养各个阶段注:A为增殖培养第1 d;B为增殖培养第15 d;C为增殖培养120 d;D为分化培养第1 d;E为分化培养第15 d;F为分化培养120 d;G为生根培养120 d;H为组培苗练苗移栽60 d。Figure 1. Tissue cultures at various development stagesNote: A is multiplication culture on 1st day; B, 15th day; and, C, 120th day. D is differentiation culture on 1st day; E, 15th day; and, F, 120th day. G is rooting culture on 120th day. H indicates plantlets on 60th day after transplantation.由表4可知:比较生长速度和增殖系数指标中各因素R值,均表明基本培养基的影响高于6-BA和NAA,6-BA对生长速度的影响大于NAA,NAA对增殖系数的影响大于6-BA。
表 4 不同处理对根状茎增殖培养的影响Table 4. Effects of medium composition on rhizome propagation处理号
NumberA:基本培养基
Basic mediumB:6-BA/(mg·L−1) C:NAA/(mg·L−1) 生长速度
Speed of growth增殖系数
Proliferation coefficient1 1 1 1 2.53±0.35 Bd 7.40±0.42 Aa 2 1 2 2 4.19±0.14 Bbcdd 6.69±0.0 5 Aab 3 1 3 3 4.76±0.31 ABbc 7.46±0.66 Aa 4 2 1 2 2.91±0.18 Bcd 6.27±0.31 Aab 5 2 2 3 3.46±0.15 Bbcd 7.20±0.30 Aa 6 2 3 1 4.19±0.47 Bbcd 5.85±0.07 Aab 7 3 1 3 5.21±0.41 ABb 5.41±0.54 Ab 8 3 2 1 5.10±0.53 ABbc 5.93±0.10 Aab 9 3 3 2 7.31±0.27 Aa 6.02±0.82 Aab ka1 3.83 3.55 3.94 Ra值排序:A>B>C
最优水平:A3B3C2
Rb值排序:A>C>B
最优水平:A1B2C3ka2 3.52 4.25 4.80 ka3 5.87 5.42 4.48 Ra 2.35 1.87 0.87 kb1 7.18 6.36 6.39 kb2 6.44 6.61 6.33 kb3 5.79 6.45 6.69 Rb 1.39 0.25 0.37 注:ka表示生长速度;Ra表示生长速度的极差;kb表示增殖系数;Rb表示增殖系数的极差。大写字母表示在0.01水平下的差异,小写字母表示0.05水平下的差异,下同。
Note: ka stands for speed of growth; Ra, variance of ka; kb, multiplication coefficient; and, Rb, variance of kb. Capital letters indicate significantly different at P<0.01, lowercase significantly different at P<0.05. Same for Table 5&6.通过极差分析得出:最有利于根状茎生长的培养基为3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA+3.0 mg·L−1 NAA(即处理9);有利于提高根状茎增殖系数的培养基为:1/2MS+0.3 mg·L−1 6-BA+5.0 mg·L−1 NAA。方差分析表明:基本培养基(P=0.000<0.01)和6-BA(P=0.005<0.01)对春兰根状茎生长速度的影响极显著,NAA的影响不显著;基本培养基(P=0.009<0.01)对春兰增殖系数的影响极显著,6-BA和NAA的影响不显著。
进一步用LSD多重比较不同水平的基本培养基和6-BA对根状茎生长速度的影响:3.0 g·L−1 HyponexⅡ与1/2MS(P=0.000<0.01)、改良1/2MS(P=0.000<0.01)之间差异极显著,后两者之间差异不显著;0.1 mg·L−1 6-BA与0.5 mg·L−1 6-BA差异极显著(P=0.005<0.01),0.3 mg·L−1 6-BA与其他2个浓度之间差异不显著。进一步用LSD多重比较不同水平的基本培养基对根状茎增殖系数的影响:1/2MS和3.0 g·L−1 HyponexⅡ对增殖系数差异极显著(P=0.002<0.01),改良1/2MS与前两者之间差异不显著。由此可见:缺少微量元素的1/2MS对根状茎增殖培养无明显促进作用;HyponexⅡ对比1/2MS更有利于春兰根状茎的增殖培养;1/2MS更有利于促进春兰根状茎的分支生长;6-BA浓度的升高有利于春兰根状茎的诱导。
2.2 NAA、6-BA和TDZ对根状茎芽分化的影响
接种时1.5~2.0 cm的根状茎上无明显的芽点凸起(图1-D),培养30 d后诱导出肉眼可见的向上生长的芽(图1-E),培养120 d时根状茎上形成了叶片2片以上的春兰小苗(图1-F)。
由表5可知:有6-BA参与的处理中,0.3 mg·L−1水平的NAA比0.5 mg·L−1水平分化率更高;有TDZ参与的处理中,1.0 mg·L−1 TDZ更有利于提高分化率。芽诱导个数最多的是处理2(5.44个),其次为处理3(4.90个),处理9的芽诱导个数最少(3.09个),12个处理中0.3 mg·L−1 NAA的芽诱导个数普遍比0.5 mg·L−1 NAA更多,有TDZ参与的处理中,1.0 mg·L−1 TDZ更有利于提高芽诱导个数。1.0 mg·L−1 6-BA时株高保持了较高高度,处理7达2.77 cm,处理1达2.70 cm,处理6的株高最低(1.06 cm),随着6-BA或者TDZ的浓度升高,株高随之降低。
表 5 NAA、6-BA和TDZ对根状茎芽分化的影响Table 5. Effects of varied concentrations of NAA, 6-BA, and TDZ on rhizome differentiation处理号 Number 分化率 Differentiation rate /% 芽诱导个数 Number of Induced bud /个 株高 Plant height/cm 1 98.00±6.32 Aa 4.07±0.53 BCDEbcde 2.70±0.81 Aa 2 90.00±10.44 ABabcd 5.44±0.78 Aa 2.53±0.75 Aa 3 94.55±12.93 ABab 4.90±0.52 ABab 1.51±0.42 DEFcd 4 78.08±19.10 Bcd 4.48±0.71 ABCDbc 1.70±0.36 CDEc 5 91.67±13.37 ABabc 4.78±0.63 ABCab 1.26±0.27 EFde 6 77.14±15.41 Bd 4.07±0.50 BCDEbcde 1.06±0.16 Fe 7 94.00±13.50 ABab 3.55±0.36 CDEcde 2.77±0.90 Aa 8 87.27±13.48 ABabcd 3.31±0.33 DEde 2.49±0.79 ABa 9 80.00±16.33 ABcd 3.09±0.33 Ee 2.07±0.55 BCb 10 46.00±9.66 Ce 3.15±0.48 Ee 1.77±0.47 CDbc 11 88.33±10.30 ABabcd 4.18±0.47 BCDEbcd 1.51±0.30 DEFcd 12 81.43±11.43 ABbcd 3.80±0.45 BCDEcde 1.47±0.33 DEFcd 方差分析表明:NAA对春兰根状茎的分化率(P=0.000<0.01)、芽诱导个数(P=0.000<0.01)和株高(P=0.001<0.01)的影响极显著;6-BA(P=0.000<0.01)对株高的影响极显著,对分化率和芽诱导个数的影响不显著;TDZ对根状茎的分化率(P=0.000<0.01)和株高(P=0.000<0.01)的影响极显著,对芽诱导个数不显著。
处理1、2和3的芽分化效果都较好,但高浓度的6-BA(3.0 mg·L−1)不利于组培苗株高的伸长;处理2的分化率较处理1低8%,芽诱导个数平均多出1.37个芽,株高上无明显差异;考虑需高效的分化培养基诱导组培苗转接至生根壮苗培养,分析可知12组处理中处理2培养基最适合诱导芽的分化。
2.3 IBA和蛋白胨对组培苗生根的影响
接种时组培苗底部竖向插入培养基适当深度,培养120 d 时组培苗底部的假鳞茎周边新生出若干的肉质根,同时叶片适当的伸长变壮(图1-G)。
由表6可知:随着IBA浓度升高,生根率呈逐渐升高的趋势,处理8的生根率(100.00%)和生根数(8.03条)都表现最好。方差分析表明:IBA对生根率(P=0.031<0.05)和生根数(P=0.036<0.05)影响显著,对平均根长(P=0.006<0.01)影响极显著;蛋白胨对生根率、生根数和平均根长影响不显著;IBA和蛋白胨对平均根长(P=0.000<0.01)影响极显著,对生根率和生根数影响不显著。
表 6 不同IBA和蛋白胨对组培苗生根的影响Table 6. Effects of varied concentrations of IBA and peptone on rooting of seedlings处理号 Number 生根率 Rooting rate/% 生根数 Number of roots/条 平均根长 Average root length /cm 1 72.73±16.61 Aa 5.25±0.76 ABb 2.65±1.19 Bc 2 82.86±12.87 Aa 5.89±1.16 ABab 2.80±1.20 ABbc 3 83.33±18.25 Aa 4.53±0.61 Bb 2.77±1.13 Bbc 4 89.47±15.29 Aa 5.25±1.00 ABb 2.75±1.30 Bbc 5 88.24±15.94 Aa 5.29±1.79 ABb 2.91±1.27 ABabc 6 77.42±12.62 Aa 6.87±1.09 ABab 3.18±1.12 Aa 7 97.14±9.24 Aa 6.46±1.17 ABab 3.19±1.20 Aa 8 100.00±0 Aa 8.03±1.38 Aa 3.00±1.16 ABab 9 96.43±7.91 Aa 6.31±1.37 ABab 2.75±1.08 Bbc 进一步用LSD多重比较IBA的3个不同水平对生根率的影响:0.5 mg·L−1和1.5 mg·L−1之间差异显著(P=0.006<0.01),1.0 mg·L−1和前两者之间差异不显著。进一步用LSD多重比较IBA的3个不同水平对生根数的影响:0.5 mg·L−1和1.5 mg·L−1之间差异显著(P=0.027<0.05),1.0 mg·L−1和前两者之间差异不显著。进一步用LSD多重比较IBA的3个不同水平对平均根长的影响:0.5 mg·L−1和1.0 mg·L−1(P=0.004<0.01)、1.5 mg·L−1(P=0.001<0.01)之间差异极显著,后两者之间差异不显著。表明在一定范围内,IBA浓度的升高有利于提高春兰组培苗的生根率、生根数和根长的生长。
2.4 炼苗移栽
春兰组培苗在树皮(2~3 cm)和火烧石等体积混合的基质中移栽60 d后,存活率达96.53%(图1-H)。
3. 讨论与结论
3.1 讨论
3.1.1 增殖的影响
增殖培养在兰花组培中是至关重要的一环,有研究表明春兰对培养基中无机盐浓度要求较低,若长时间继代培养1/2MS较合适,近年来对春兰组织培养广泛使用的基本培养基多为MS[13];有研究指出春兰[14]、蕙兰[15]、建兰[16]适合培养在低水平的无机盐和氨态氮培养基中,若长期继代培养以1/2MS为宜,寒兰[17]、墨兰[18]则适合培养在高水平的无机盐培养基中。在前人的研究基础上,本试验采用正交设计了多因素共同作用对根状茎增殖的影响,对低水平的无机盐(1/2MS)进行了改良,结果表明缺少微量元素对春兰根状茎的增殖未起到促进作用;目前关于Hyponex对春兰根状茎增殖影响的研究报道较少,在郑艳艳[10]对墨兰‘奇花’的研究中表明,当MS和Hyponex同时添加2.0 mg·L−1 BA + 0.1 mg·L−1 NAA+1.0 g·L−1蛋白胨时,HyponexⅠ和HyponexⅡ混合使用时的增殖效果优于MS培养基;本试验结果显示HyponexⅡ的参与对比MS、6-BA和NAA起到了明显的促进作用,甚至大过植物生长调节剂在增殖阶段的优势,但若缺少合适的生长调节剂配合,根状茎多短小似桑葚状聚集在一起。由此可知,春兰根状茎对无机盐、植物生长调节剂的选择与浓度之间具有紧密联系,Hyponex作为基本培养基时需要配合适当的植物生长调节剂引导根状茎伸长。
一般在增殖继代培养阶段,生长素(NAA、IBA等)与细胞分裂素(BA、TDZ等)的所需量成反比,即生长素相对较多,细胞分裂素相对需求较少,同时也要注意生长素和细胞分裂素之间的平衡关系[19]。孙芳[20]对‘如意素’ב集园’的研究表明当0.5 mg·L−1 6-BA + 2.0 mg·L−1 NAA时为最佳增殖培养基,增殖系数为5.25,当IBA替代NAA即0.1 mg·L−1 6-BA + 2.0 mg·L−1 IBA时增殖系数为4.38;刘幸佳[21]对‘宋梅’的研究表明当0.1 mg·L−1 6-BA与1.0 mg·L−1 IBA或5.0 mg·L−1 NAA搭配时为最佳增殖培养基,增殖系数均为5.8;牛田[19]对‘金荷鼎’与‘赤蕙’的研究表明当0.5 mg·L−1 6-BA + 1.0 mg·L−1 NAA时为最佳增殖培养基,增殖系数为5.67。在前人的研究基础上,本试验根据规律选取了低浓度6-BA搭配高浓度NAA对春兰进行增殖培养研究,最高增殖系数可达7.40;在实际生产中兰花根状茎的生长速度与增殖系数是同样重要的一项评判标准,因此对比前人研究,本试验增加了生长速度的评判因子,本研究结果显示,春兰根状茎在3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA + 3.0 mg·L−1 NAA(处理9)中生长速度远远快于其他处理,增殖系数处于中间值,在保障一定增殖系数的条件下,生长速度快的处理可解决春兰在组培快繁期间培养周期长的问题,即可实现一年内2次转接增至3次,此配方不仅提高了增殖系数,同时缩短了增殖培育时间。此外,结合本试验多重比较的结果针对该杂交春兰增殖阶段可继续尝试6-BA浓度高于0.5 mg·L−1的研究。
3.1.2 芽分化的影响
影响根状茎芽分化的因素是比较复杂的,除去生长调节剂的作用,还与活性炭[21]和外援添加物[22]有着密不可分的关系。王永清等[23]研究表明高水平6-BA(2.0 mg·L−1)与低水平NAA(0.5 mg·L−1)有利于春兰芽的分化,高水平NAA(2.0 mg·L−1)有利于根的诱导;在前人的研究基础上,本试验仅针对生长调节剂(NAA、6-BA、TDZ)进行了探讨:0.3 mg·L−1 NAA的分化效果整体优于0.5 mg·L−1,研究中最低水平的6-BA(1.0 mg·L−1)和NAA(0.3 mg·L−1)分化率最高(98%),但在规模化生产中分化阶段考虑的不仅仅是分化率,需同时考虑芽诱导个数和株高等评判因子,综合考虑较优组合为2.0 mg·L−1 6-BA+0.3 mg·L−1 NAA。本试验还对TDZ进行了探讨,目前关于TDZ对春兰根状茎分化培养阶段的影响未见报道,多集中在国兰的增殖培养阶段[24-25],刘昳雯[26]对莲瓣兰的研究结果表明TDZ高效的细胞分裂活性在其芽分化阶段优于6-BA,在本研究中在同为细胞分裂素的TDZ替代6-BA的情况下,高浓度的TDZ(0.5~1.5 mg·L−1)不利于春兰的分化,这可能是不同兰属在芽分化阶段对生长调节剂的需求有着一定的差异,在实际应用过程中应根据不同品种不同阶段进行适当的调整,同时在后期的研究中可适当降低TDZ浓度对春兰分化继续进行探讨。
3.1.3 生根的影响
IBA是组培植物生根壮苗的关键[27]。李玉萍[6]利用正交试验对比了IBA、NAA和BA对‘宋梅’ב韩国桃花’生根的影响,其研究结果表明对平均根数的影响大小为IBA>NAA>BA,同时表明不添加或低浓度的有机质对杂交兰幼根生长更有利;卜朝阳[28]的研究也表明了在0.1 mg·L−1 6-BA+0.5 mg·L−1 NAA的基础上,添加0.2 mg·L−1 IBA更有利于蝴蝶兰生根。本试验经过120 d的培养,结果表明IBA有利于春兰生根培养,且高水平IBA(1.5 mg·L−1)对春兰根部生长更有利;该研究结果与魏韩英[29]对春兰‘宋梅’生根的研究结果相反,其认为在添加0.1 mg·L−1 6-BA+0.5 / 1.0 / 2.0 mg·L−1 IBA的全因素处理中,低浓度IBA(0.5 mg·L−1)生根效果最好,这可能是因为降低无机盐浓度改变了植物体内的渗透压,从而影响了植物体的代谢[30]。本研究结果显示蛋白胨浓度对春兰组培苗生根的影响很小,这可能由于培养基中氮源已经充足,1.0~3.0 g·L−1水平的蛋白胨不是春兰生根的关键。
3.2 结论
本试验从不同基本培养基(MS和Hyponex)、细胞分裂素(6-BA和TDZ)、生长素(NAA和IBA)和有机添加剂(蛋白胨)对春兰‘黄梅’ב黄荷’杂交根状茎组培快繁各阶段进行了研究。结果表明:增殖最适培养基为3.0 g·L−1 HyponexⅡ+0.5 mg·L−1 6-BA+3.0 mg·L−1 NAA+1.0 g·L−1 AC+30.0 g·L−1 Su+7.0 g·L−1 Ag,生长速度和增殖系数分别为7.31和6.02;分化最适培养基为2.0 mg·L−1 6-BA+0.3 mg·L−1 NAA+30.0 g·L−1 Su+7.0 g·L−1 Ag,分化率、芽诱导个数和株高分别为90.00%、5.44个和2.53 cm;生根最适培养基为1.5 mg·L−1 IBA+2.0 g·L−1蛋白胨+1.0 g·L−1 AC+25.0 g·L−1 Su+7.0 g·L−1 Ag,生根率、生根数和根长分别为100.00%、8.03条和3.00 cm;练苗移栽60 d后存活率达96.53%。
-
图 1 离体培养各个阶段
注:A为增殖培养第1 d;B为增殖培养第15 d;C为增殖培养120 d;D为分化培养第1 d;E为分化培养第15 d;F为分化培养120 d;G为生根培养120 d;H为组培苗练苗移栽60 d。
Figure 1. Tissue cultures at various development stages
Note: A is multiplication culture on 1st day; B, 15th day; and, C, 120th day. D is differentiation culture on 1st day; E, 15th day; and, F, 120th day. G is rooting culture on 120th day. H indicates plantlets on 60th day after transplantation.
表 1 根状茎增殖培养配方正交设计L9(34)
Table 1 Orthogonal design L9 (34) on culture media for rhizome propagation
水平
Level因素 Factor 基本培养基 Basic medium 6-BA/(mg·L−1) NAA/(mg·L−1) 1 1/2MS 0.1 2.0 2 Revised 1/2MS 0.3 3.0 3 Hyponex Ⅱ3.0 g·L−1 0.5 5.0 注:改良1/2MS为不含有微量元素的1/2MS培养基。
Note: Modified ½ MS was regular ½ MS without added microelements.表 2 根状茎分化培养试验设计
Table 2 Experimental design on culture media for rhizome differentiation
处理号 Number NAA/(mg·L−1) 6-BA/(mg·L−1) TDZ/(mg·L−1) 1 0.3 1.0 0.0 2 0.3 2.0 0.0 3 0.3 3.0 0.0 4 0.3 0.0 0.5 5 0.3 0.0 1.0 6 0.3 0.0 1.5 7 0.5 1.0 0.0 8 0.5 2.0 0.0 9 0.5 3.0 0.0 10 0.5 0.0 0.5 11 0.5 0.0 1.0 12 0.5 0.0 1.5 表 3 组培苗生根培养全因素设计
Table 3 All factor design on culture media for plantlet rooting
处理号 Number IBA/(mg·L−1) 蛋白胨 Peptone/(g·L−1) 1 0.5 1.0 2 0.5 2.0 3 0.5 3.0 4 1.0 1.0 5 1.0 2.0 6 1.0 3.0 7 1.5 1.0 8 1.5 2.0 9 1.5 3.0 表 4 不同处理对根状茎增殖培养的影响
Table 4 Effects of medium composition on rhizome propagation
处理号
NumberA:基本培养基
Basic mediumB:6-BA/(mg·L−1) C:NAA/(mg·L−1) 生长速度
Speed of growth增殖系数
Proliferation coefficient1 1 1 1 2.53±0.35 Bd 7.40±0.42 Aa 2 1 2 2 4.19±0.14 Bbcdd 6.69±0.0 5 Aab 3 1 3 3 4.76±0.31 ABbc 7.46±0.66 Aa 4 2 1 2 2.91±0.18 Bcd 6.27±0.31 Aab 5 2 2 3 3.46±0.15 Bbcd 7.20±0.30 Aa 6 2 3 1 4.19±0.47 Bbcd 5.85±0.07 Aab 7 3 1 3 5.21±0.41 ABb 5.41±0.54 Ab 8 3 2 1 5.10±0.53 ABbc 5.93±0.10 Aab 9 3 3 2 7.31±0.27 Aa 6.02±0.82 Aab ka1 3.83 3.55 3.94 Ra值排序:A>B>C
最优水平:A3B3C2
Rb值排序:A>C>B
最优水平:A1B2C3ka2 3.52 4.25 4.80 ka3 5.87 5.42 4.48 Ra 2.35 1.87 0.87 kb1 7.18 6.36 6.39 kb2 6.44 6.61 6.33 kb3 5.79 6.45 6.69 Rb 1.39 0.25 0.37 注:ka表示生长速度;Ra表示生长速度的极差;kb表示增殖系数;Rb表示增殖系数的极差。大写字母表示在0.01水平下的差异,小写字母表示0.05水平下的差异,下同。
Note: ka stands for speed of growth; Ra, variance of ka; kb, multiplication coefficient; and, Rb, variance of kb. Capital letters indicate significantly different at P<0.01, lowercase significantly different at P<0.05. Same for Table 5&6.表 5 NAA、6-BA和TDZ对根状茎芽分化的影响
Table 5 Effects of varied concentrations of NAA, 6-BA, and TDZ on rhizome differentiation
处理号 Number 分化率 Differentiation rate /% 芽诱导个数 Number of Induced bud /个 株高 Plant height/cm 1 98.00±6.32 Aa 4.07±0.53 BCDEbcde 2.70±0.81 Aa 2 90.00±10.44 ABabcd 5.44±0.78 Aa 2.53±0.75 Aa 3 94.55±12.93 ABab 4.90±0.52 ABab 1.51±0.42 DEFcd 4 78.08±19.10 Bcd 4.48±0.71 ABCDbc 1.70±0.36 CDEc 5 91.67±13.37 ABabc 4.78±0.63 ABCab 1.26±0.27 EFde 6 77.14±15.41 Bd 4.07±0.50 BCDEbcde 1.06±0.16 Fe 7 94.00±13.50 ABab 3.55±0.36 CDEcde 2.77±0.90 Aa 8 87.27±13.48 ABabcd 3.31±0.33 DEde 2.49±0.79 ABa 9 80.00±16.33 ABcd 3.09±0.33 Ee 2.07±0.55 BCb 10 46.00±9.66 Ce 3.15±0.48 Ee 1.77±0.47 CDbc 11 88.33±10.30 ABabcd 4.18±0.47 BCDEbcd 1.51±0.30 DEFcd 12 81.43±11.43 ABbcd 3.80±0.45 BCDEcde 1.47±0.33 DEFcd 表 6 不同IBA和蛋白胨对组培苗生根的影响
Table 6 Effects of varied concentrations of IBA and peptone on rooting of seedlings
处理号 Number 生根率 Rooting rate/% 生根数 Number of roots/条 平均根长 Average root length /cm 1 72.73±16.61 Aa 5.25±0.76 ABb 2.65±1.19 Bc 2 82.86±12.87 Aa 5.89±1.16 ABab 2.80±1.20 ABbc 3 83.33±18.25 Aa 4.53±0.61 Bb 2.77±1.13 Bbc 4 89.47±15.29 Aa 5.25±1.00 ABb 2.75±1.30 Bbc 5 88.24±15.94 Aa 5.29±1.79 ABb 2.91±1.27 ABabc 6 77.42±12.62 Aa 6.87±1.09 ABab 3.18±1.12 Aa 7 97.14±9.24 Aa 6.46±1.17 ABab 3.19±1.20 Aa 8 100.00±0 Aa 8.03±1.38 Aa 3.00±1.16 ABab 9 96.43±7.91 Aa 6.31±1.37 ABab 2.75±1.08 Bbc -
[1] 陈心启. 国兰及其品种全书[M]. 北京: 中国林业出版社, 2011: 1−10. [2] 陈宇勒. 兰花繁育技术图解[M]. 广州: 广东科技出版社, 2009: 26−45. [3] 李子红. 珍品兰花快速繁殖与养护[M]. 上海: 上海科学技术出版社, 2006: 5−10. [4] 凌晓祺. 国兰花期调控与组培快繁技术优化的研究[D]. 杭州: 浙江大学, 2016. LIN X Q. Study On Flowering Regulation and Technique Optimization of Tissue Culture of Chinese Orchid[D]. Hangzhou: Zhejiang University, 2013. (in Chinese)
[5] 于永畅, 张林, 王厚新, 等. 影响春兰杂交兰‘宋梅’ב集圆’组培苗生根的因素 [J]. 北方园艺, 2013(7):66−68. YU Y C, ZHANG L, WANG H X, et al. Some Influencing Factors of Root Differentiation of Seedlings in Hybridization of Cymbidium goeringii ‘Songmei’בJiyuan’ [J]. Northern Horticulture, 2013(7): 66−68.(in Chinese)
[6] 李玉萍, 李沁晔, 罗凤霞. 宋梅×韩国桃花杂交兰组培苗壮苗和生根培养基研究 [J]. 江苏农业科学, 2018, 46(14):35−37, 44. LI Y P, LI Q Y, LUO F X. Study on tissue Culture and rooting medium of Hybrid Orchid of ‘Song Mei’×’Korea Peach Flower’ [J]. Jiangsu agricultural science, 2018, 46(14): 35−37, 44.(in Chinese)
[7] 王玉英, 李灵丽, 刘丹, 等. ‘春绿兰×虎雪兰’F1代组培苗快繁技术 [J]. 北方园艺, 2018(3):87−91. WANG Y Y, LI L L, LIU D, et al. Rapid Propagation of Cymbidium faberi Rolfe var. Szechuanicum×(C. tracyanum var. Huanghua×C. mastersii) F1 hybrids [J]. Northern Horticulture, 2018(3): 87−91.(in Chinese)
[8] 卜朝阳, 董伟清, 闭志强, 等. 蝴蝶兰克隆苗根系生长影响因素研究 [J]. 西南农业学报, 2009, 22(6):1737−1740. DOI: 10.3969/j.issn.1001-4829.2009.06.052 PU C Y, DONG W Q, BI Z Q, et al. Affecting Factors on Root System Growth of Phalaenopsis Clone Seedlings [J]. Southwest China Journal of Agricultural Sciences, 2009, 22(6): 1737−1740.(in Chinese) DOI: 10.3969/j.issn.1001-4829.2009.06.052
[9] 曾碧玉, 许传俊, 张文惠, 等. 蝴蝶兰花梗初代培养研究 [J]. 福建农业学报, 2013, 28(2):124−128. DOI: 10.3969/j.issn.1008-0384.2013.02.006 ZENG B Y, XU C J, ZHANG W H, et al. Culturing Flower-stalks of Phalaenopsis [J]. Fujian Journal of Agricultural Sciences, 2013, 28(2): 124−128.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2013.02.006
[10] 郑艳艳. 墨兰组培体系的优化及根状茎在生物反应器培养的研究[D]. 延吉: 延边大学, 2011. ZHENG Y Y. Optimization of Tissue Culture System and Proliferation of Rhizome in Bioreactor Culture of Cymbidium sinense Willd[D]. Yanji: Yanbian University, 2011. (in Chinese)
[11] 李洪林, 杨波. 春兰根状茎离体培养与快速繁殖(简报) [J]. 亚热带植物科学, 2012, 41(4):67−68. LI H L, YANG B. In vitro Culture and Rapid Propagation of Cymbidium goeringii [J]. Subtropical Plant Science, 2012, 41(4): 67−68.(in Chinese)
[12] 洪伟, 吴承祯. 试验设计与分析——原理·操作·案例[M]. 北京: 中国林业出版社, 2004: 95−115. [13] 唐凤鸾, 黄雪梅, 冼康华, 等. 春兰种苗繁育及开花调控研究进展 [J]. 南方农业学报, 2015, 46(6):1067−1073. DOI: 10.3969/j.issn.2095-1191.2015.6.1067 TANG F L, HUANG X M, XI K H, et al. Progress on seedling propagation and flowering regulation of Cymbidium goeringii [J]. Journal of Southern Agriculture, 2015, 46(6): 1067−1073.(in Chinese) DOI: 10.3969/j.issn.2095-1191.2015.6.1067
[14] 潘银萍, 李承秀, 王长宪, 等. 春荷鼎杂交根状茎的组培快繁的研究 [J]. 中国农学通报, 2010, 26(5):209−212. PAN Y P, LI C X, WANG C X, et al. Study of the Rootstocks about Cymbidium faberi ‘chun he ding’ in Rapid Multiplication Techniques [J]. Chinese Agricultural Science Bulletin, 2010, 26(5): 209−212.(in Chinese)
[15] 于永畅. 蕙兰‘大一品’组织培养技术及部分国兰品种抗寒性研究[D]. 泰安: 山东农业大学, 2014. YU Y C. Study on Tissue Culture of Cymbidium faberi ‘Da Yipin’ and Cold Resistance of Chinese Cymbidium[D]. Taian: Shandong Agricultural University, 2014. (in Chinese)
[16] 陈丹丹. 建兰离体培养与形态发生特征研究[D]. 南京: 南京农业大学, 2015. CHEN D D. In Vitro Culture of Cymbidium Ensifolium and the Study of Morphogenesis Characteristics[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[17] 苏妍. 寒兰杂交后代快速繁殖体系及生理生化研究[D]. 福州: 福建农林大学, 2016. SU Y. Studies on Rapid Propagation of Hybrid Offspring of Cymbidium Kanran and Changes of Physiology and Biochemistry[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016. (in Chinese)
[18] 许申平, 袁秀云, 王默霏, 等. 墨兰(Cymbiduim sinense)组培快繁技术体系研究 [J]. 热带作物学报, 2018, 39(5):926−930. DOI: 10.3969/j.issn.1000-2561.2018.05.015 XU S P, YUAN X Y, WANG M F, et al. Micropropagation in vitro of Cymbidium sinensis [J]. Chinese Journal of Tropical Crops, 2018, 39(5): 926−930.(in Chinese) DOI: 10.3969/j.issn.1000-2561.2018.05.015
[19] 牛田. 春兰种质资源的SRAP分子评价及组织培养[D]. 泰安: 山东农业大学, 2014. NIU T. Molecular Evaluation of the Germplasm Resouces by SRAP and Tissue Culture[D]. Taian: Shandong Agricultural University, 2014. (in Chinese)
[20] 孙芳. 春兰蕙兰杂交育种技术研究[D]. 泰安: 山东农业大学, 2013. SUN F. Studies on the Crossbreeding between Cymbidium Goeringii and Cymbidium Faberi[D]. Taian: Shandong Agricultural University, 2013. (in Chinese)
[21] 刘幸佳. 几种国兰组织培养及春兰菌根真菌研究[D]. 杭州: 浙江农林大学, 2013. LIU X J. Study on Several Cymbidium Plants Tissue Culture and Cymbidium goeringii Mycorrhizal Fungi[D]. Hangzhou: Zhejiang A & F University, 2013. (in Chinese)
[22] 施满容. 金线莲组织培养条件优化对其有效成分含量的影响 [J]. 福建农业学报, 2018, 33(5):495−501. SHI M R. Optimizing Tissue Culture of Anoectochilus roxburghii for a Maximized Content on Effe [J]. Fujian Journal of Agricultural Sciences, 2018, 33(5): 495−501.(in Chinese)
[23] 王永清, 余道平. 春兰根状茎离体培养 [J]. 园艺学报, 2005, 32(4):706. DOI: 10.3321/j.issn:0513-353X.2005.04.046 WANG Y Q, YU D P. In Vitro Culture of Cymbidium goeringii Rhizomes [J]. Acta Horticulturae Sinica, 2005, 32(4): 706.(in Chinese) DOI: 10.3321/j.issn:0513-353X.2005.04.046
[24] 邢海, 孙叶芳, 郑琪, 等. 中透艺春兰根状茎的组培快繁及艺向培养研究 [J]. 现代农业科技, 2016(8):139−140, 145. DOI: 10.3969/j.issn.1007-5739.2016.08.087 XING H, SUN Y F, ZHENG Q, et al. Study om Rapid Propagation and Directional Art Culture of Rhizome of Cymbidium goeringii ‘Zhongtou yi’ [J]. Modern Agricultural Sciences and Technology, 2016(8): 139−140, 145.(in Chinese) DOI: 10.3969/j.issn.1007-5739.2016.08.087
[25] 叶秀仙, 黄敏玲, 林榕燕, 等. 素心建兰无菌播种快繁技术研究 [J]. 福建农业学报, 2015, 30(10):939−943. DOI: 10.3969/j.issn.1008-0384.2015.10.003 YE X X, HUANG M L, LIN R Y, et al. Aseptic Sowing and Rapid Propagation of Cymbidium ensifolium var.susin [J]. Fujian Journal of Agricultural Sciences, 2015, 30(10): 939−943.(in Chinese) DOI: 10.3969/j.issn.1008-0384.2015.10.003
[26] 刘昳雯, 许春梅, 王丹, 等. 莲瓣兰" 滇梅”根状茎的增殖与分化技术研究 [J]. 安徽农业科学, 2014, 42(10):2890−2892. DOI: 10.3969/j.issn.0517-6611.2014.10.021 LIU Y W, XU C M, WANG D, et al. Research of Proliferation and Differentiation of Cymbidium tortisepalum ‘Dian Mei’ Rhizome [J]. Journal of Anhui Agricultural Sciences, 2014, 42(10): 2890−2892.(in Chinese) DOI: 10.3969/j.issn.0517-6611.2014.10.021
[27] 刘帆, 朱文丽, 黄明忠, 等. 紫花苞舌兰类原球茎诱导及植株再生 [J]. 基因组学与应用生物学, 2017, 36(5):2082−2087. LIU F, ZHU W L, HUANG M Z, et al. Inducement of Philippine Ground Orchid (Spathoglottis plicata) Protocorm-Like Bodies and Plant Regeneration [J]. Genomics and Applied Biology, 2017, 36(5): 2082−2087.(in Chinese)
[28] 卜朝阳. 蝴蝶兰高效离体繁殖途径的研究 [J]. 西北农林科技大学学报(自然科学版), 2005, 33(12):69−72, 77. DOI: 10.3321/j.issn:1671-9387.2005.12.014 PU Z Y. Study on efficient Propagation Pathway of Phalaenopsis spp [J]. Journal of Northwest A&F University (Natural Science Edition), 2005, 33(12): 69−72, 77.(in Chinese) DOI: 10.3321/j.issn:1671-9387.2005.12.014
[29] 魏韩英. 春兰‘宋梅’组织培养及兰花菌根真菌的研究[D]. 杭州: 浙江农林大学, 2010. WEI H Y. Study on Tissue Culture and Mycorrhizal Fungi of Cymbidium goeringii ‘Songmae’[D]. Hangzhou: Zhejiang A & F University, 2010. (in Chinese)
[30] Predieri S, Brizzi G, Gatti E. Effect of nitrogen supply on rooting of pear (Pyrus communis L.) cv. Conference microcuttings [J]. Advances in horticultural science, 1999, 13(2): 68−70.
-
期刊类型引用(3)
1. 陈兰芬,陈卿然,汤久杨,王颖,宋彩凤. 国兰新品种‘森彩菊韵’组培快繁技术研究. 现代园艺. 2024(04): 10-12 .  百度学术
百度学术
2. 杨松敏,唐若楠,程梦雅,牛沐奇,陈和明,彭东辉. 杂交兰‘红美人’×寒兰‘杨贵妃’杂交后代增殖与分化研究. 北方园艺. 2023(14): 63-70 .  百度学术
百度学术
3. 卢雪兰,罗雯,黄琼英,冠巍,徐俊强. 无性繁殖技术在植物中药材繁殖和生产中的应用研究进展. 现代园艺. 2021(07): 31-35 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: